-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Překryv projevů trombotické trombocytopenické purpury a antifosfolipidového syndromu u pacientky s juvenilním systémovým lupus erythematodes
Overlap of the symptoms of thrombotic thrombocytopenic purpura and antiphospholipid syndrome in a patient with juvenile systemic lupus erythematosus – case report
Thrombocytopenia accompanied by thrombosis is often observed in patients with systemic lupus erythematosus. The underlying process may be associated with more frequent secondary antiphospholipid syndrome characterized by the presence of antiphospholipid antibodies and thromboses, or with associated thrombotic thrombocytopenic purpura linked with insufficient ADAMTS13 protease activity (A Disintegrin-like And Metalloproteinase with Thrombospondin Type 1 motif 13). In our article we demonstrate a case of a fourteen-year-old girl without a serious pre-existing medical history, who was hospitalized for a stroke accompanied by severe thrombocytopenia and microangiopathic haemolytic anemia. The condition was evaluated as a thrombotic thrombocytopenic purpura, and the patient was treated with plasma exchange therapy (plasmapheresis), glucocorticoids, and then anticoagulation and antiaggregation therapy. Within 6 weeks of onset of the disease, thrombocytopenia has relapsed after tapering of the glucocorticoid dose. Additional plasmaphereses were initiated and rituximab was successfully administered at the same time. Based on further developments in the disease, imaging and laboratory tests, it is possible to admit that it was most likely a coincidence of thrombotic thrombocytopenic purpura and antiphospholipid syndrome. The clinical picture was later completed by a manifestation of systemic lupus erythematosus. The pathogenesis and the current prevalence of these three diseases are discussed.
Key words:
Systemic lupus erythematosus, thrombotic microangiopathy, thrombotic thrombocytopenic purpura, antiphospholipid syndrome
Autori: M. Bělobrádková 1; M. Cermanová 2; L. Minxová 3; Z. Bělobrádek 4; Z. Vavera 5; M. Tošovský 1; T. Soukup 1
Pôsobisko autorov: Lékařská fakulta Univerzity Karlovy a Fakultní nemocnice v Hradci Králové, Česká republika ; II. interní gastroenterologická klinika 1; IV. interní hematologická klinika 2; Dětská klinika 3; Radiologická klinika 4; I. kardioangiologická klinika 5
Vyšlo v časopise: Čes. Revmatol., 25, 2017, No. 4, p. 190-198.
Kategória: Kazuistika
Súhrn
Trombocytopenie doprovázená trombózami je u pacientů se systémovým lupus erythematodes často pozorovaným jevem. Podstata může spočívat v asociaci s častějším sekundárním antifosfolipidovým syndromem charakterizovaným přítomností antifosfolipidových protilátek a trombóz, nebo v přidružené trombotické trombocytopenické purpuře spojené s nedostatečnou aktivitou proteázy ADAMTS13 (A Disintegrin-like And Metalloproteinase with Thrombospondin type 1 motif 13). V našem článku demonstrujeme případ čtrnáctileté dívky, bez závažnějšího předchorobí, která byla hospitalizována pro cévní mozkovou příhodu provázenou těžkou trombocytopenií a mikroangiopatickou hemolytickou anémií. Stav byl vyhodnocen jako trombotická trombocytopenická purpura a pacientka byla léčena výměnnými plazmaferézami, glukokortikoidy, posléze antikoagulační a antiagregační léčbou. Za 6 týdnů od počátku onemocnění, po deeskalaci dávky glukokortikoidů, došlo k relapsu trombocytopenie. Byly zahájeny další plazmaferézy a současně byl úspěšně podán rituximab. Na základě dalšího vývoje onemocnění, zobrazovacích a laboratorních vyšetření lze připustit, že se nejspíše jednalo o souběh trombotické trombocytopenické purpury a antifosfolipidového syndromu. Klinický obraz byl později doplněn o manifestaci systémového lupus erythematodes. Jsou diskutovány patogeneze a současný výskyt těchto tří chorob.
Klíčová slova:
Systémový lupus erythematodes, trombotická mikroangiopatie, trombotická trombocytopenická purpura, antifosfolipidový syndromÚvod
Systémový lupus erythematodes (SLE) je autoimunitní onemocnění provázené nadprodukcí orgánově nespecifických protilátek, z nichž některé se podílejí na patogenezi tkáňového poškození. Onemocnění se může manifestovat širokou škálou projevů. Mezi časté známky, zvláště u dětí, patří hematologické abnormality [1, 2]. Trombocytopenie, většinou mírná, je běžnou manifestací SLE.
Její nejčastější příčinou u SLE je imunitní trombocytopenie, která je způsobena destrukcí destiček v periferním krevním oběhu vlivem protilátek proti trombocytům. Tyto protilátky zjišťujeme až u 60 % pacientů se SLE. Jejich přítomnost nemusí automaticky vyústit v rozvoj trombocytopenie [3].
Ve většině případů imunitní trombocytopenie u SLE nevede k přímému ohrožení života, na rozdíl od dalších dvou jednotek, u kterých bývají přítomny trombotické projevy, tedy antifosfolipidový syndrom (APS) a trombotická trombocytopenická purpura (TTP).
APS je definován jednou či více klinickými manifestacemi arteriální či venózní trombózy postihující kterýkoliv orgán či tkáň, nebo samovolnými ztrátami plodu a současnou přítomností antifosfolipidových protilátek [4]. Klasifikační kritéria APS předkládá tabulka 1.
Tab. 1. Revidovaná klasifikační kritéria pro antifosfolipidový syndrom – Sydney 2004 (upraveno podle Miyakis et al. [4]. ![Revidovaná klasifikační kritéria pro antifosfolipidový syndrom – Sydney 2004 (upraveno podle Miyakis et al. [4].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/8338545b10a0e541c7bfc1c5a6b6c0fe.png)
Antifosfolipidové protilátky vídáme u 50 % pacientů se SLE, nicméně trombóza komplikuje onemocnění pouze u 1/3 z nich [5]. U méně jak 1 % pacientů s APS se rozvine katastrofický antifosfolipidový syndrom, kdy trombóza poškodí 3 a více orgánů během 1 týdne [6,7].
U 1-4 % pacientů se SLE vyvolá závažnou trombocytopenii TTP [8]. TTP patří do kategorie tzv. trombotických mikroangiopatií (TMA), kdy poškození cévní stěny z různých příčin vede k lokalizované či difuzní mikrovaskulární trombóze. Pro TMA je typická konsumpční trombocytopenie v kombinaci s mikroangiopatickou hemolytickou anémií. Mikroangiopatická hemolytická anémie je neimunní hemolýza (přímý Coombsův test je negativní) s vysokým počtem schistocytů v krvi, které vznikají intravaskulární fragmentací erytrocytů. Je doprovázena zvýšením hladiny sérové laktát dehydrogenázy, nekonjugovaným bilirubinem a nízkým haptoglobinem [9]. Příčiny TMA mohou být různé. V tabulce 2 jsou uvedeny stavy, které musíme zvažovat, máme-li před sebou pacienta s trombocytopenií, mikroangiopatickou hemolytickou anémií a s poškozením tkání, které je způsobené mikrovaskulární trombózou (TMA je patologická diagnóza potvrzená biopticky). Chybná diagnóza a následně nevhodně zvolená léčba může mít pro pacienta závažné následky.
Tab. 2. Stavy provázené mikroangiopatickou hemolytickou anémií a trombocytopenií. 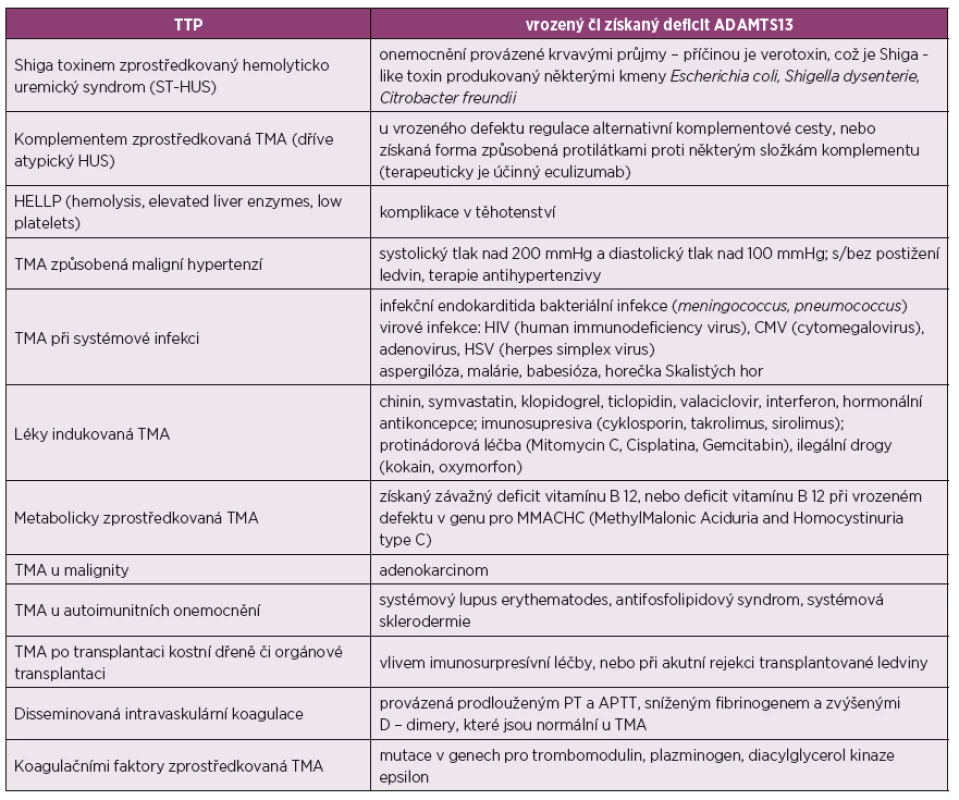
Stavy provázené mikroangiopatickou hemolytickou anémií a trombocytopenií, upraveno podle Scully M. a kol., Rodríguez-Pinto I. a kol., Campistol J. a kol., Bu F. a kol. [9, 28, 29, 30]. TTP je klinický syndrom, charakterizovaný těžkou trombocytopenií v důsledku eskalované tvorby trombů v mikrocirkulaci s následným ischemickým poškozením orgánů (mozek, ledviny, srdce, gastrointestinální trakt ...). V patofyziologii TTP hraje klíčovou roli von Willebrandův faktor, což je multimerní glykoprotein, který se při porušené cévní stěně uvolňuje z endotelií. V podobě dlouhých vláknitých struktur se váže na odhalený kolagen cév a zprostředkovává adhezi destiček. Tento děj je fyziologicky regulován enzymem ADAMTS13, syntetizovaným v endoteliích a játrech, který řetězce von Willebrandova faktoru štěpí. Pokud je snížena jeho aktivita, vlákna von Willebrandova faktoru perzistují v krevním řečišti. Dochází jak k tvorbě trombů s konzumpcí trombocytů, tak k mechanické destrukci erytrocytů a k hemolýze. Aktivita ADAMTS13 pod 10 % je považována za příčinu TTP [10, 11]. Vedle genetického defektu tohoto enzymu u vrozené TTP, bývají za jeho sníženou aktivitu zodpovědné inaktivující protilátky proti ADAMTS13.
V našem článku demonstrujeme případ čtrnáctileté dívky, u níž se SLE v úvodu manifestoval cévní mozkovou příhodou provázenou těžkou trombocytopenií a hemolytickou anémií. Cílem předložené kazuistiky je nastínit složitost diferenciální diagnostiky u takto akutních stavů s nutností okamžité léčby.
Popis případu
Prezentujeme kazuistiku dívky, která byla v předchorobí léčena pro recidivující respirační infekty a otitidy s opakovanými paracentézami.
Ve věku 14 let byla přijata na jednotku intenzivní péče Infekční kliniky pro podezření na meningoencefalitidu. V klinickém obrazu dominovala kvantitativní porucha vědomí s motorickým neklidem a krvácivé projevy na kůži (petechie na hrudníku, starší hematomy na trupu a dolních končetinách). Dva dny před přijetím jí byl praktickým lékařem nasazen penicilin pro akutní tonzilitidu.
Laboratorní testy prokázaly těžkou trombocytopenii 3x 10^9/l, leukocytózu 22 x10^9/l, vysoké reaktanty akutní fáze: sedimentace erytrocytů 133/146 mm za první/druhou hodinu, CRP 60 mg/l. Dále byla zjištěna hemolytická anémie s počtem erytrocytů 2,4x10^12/l, hemoglobinem 66 g/l, nekonjugovaným bilirubinem 55 μmol/l, laktát dehydrogenázou 17,7 μkat/l (norma: 2,2–3,6 μkat/l), schistocyty 0,042, retikulocytózou 0,0617 a pozitivitou přímého Coombsova testu. Vyšetření koagulačních parametrů zjistilo normální protrombinový test (PT) a prodloužený aktivovaný parciální tromboplastinový čas (APTT) 78,3 s. Plazmatická koncentrace fibrinogenu a antitrombinu byla v normě.
Na postižení ledvin upozornila semikvantitativně mírná proteinurie, mikroskopická erytrocyturie, sérová koncentrace kreatininu 123 μmol/l a urey 13,9 mmol/l. Jaterní enzymy byly, krom lehce zvýšeného AST (1,02 μkat/l), v normě. Vyloučeny byly infekční příčiny, Neisseria meningitidis nebyla v krvi prokázána (metodou polymerázové řetězové reakce).
Během prvního dne hospitalizace došlo k rozvoji iktu s levostrannou hemiparézou, deviací bulbů doprava, horizontálním nystagmem a centrální parézou nervus facialis. Na výpočetní tomografii mozku byl prokázán uzávěr arteria cerebri media dextra s hypodenzitou v jejím povodí. O den později byla na magnetické rezonanci mozku zjištěna ischemie ve stejné lokalitě s nově patrným středočárovým přesunem doleva na podkladě expanzívních změn při dokonané ischemii (obr. 1). Na základě trombózy v centrálním nervovém systému, trombocytopenie, mikroangiopatické hemolytické anémie s přítomností schistocytů a horečky byl stav uzavřen jako TTP. K potvrzení diagnózy byl indikován odběr séra k vyšetření aktivity ADAMTS13 a protilátek proti ADAMTS13, který dodatečně odhalil aktivitu ADAMTS13 <2 % s vysoce pozitivními protilátkami proti ADAMTS13. Neodkladně, ještě před obdržením těchto výsledků, byly zahájeny velkoobjemové výměnné plazmaferézy – celkem 11krát. Jako prevence alergické reakce na podávanou plazmu a s cílem potlačit produkci autoprotilátek byly aplikovány vyskokodávkové kortikoidy s postupnou detrakcí do konečné dávky prednisonu 10 mg/den během šesti týdnů. Vzestup trombocytů byl pozorován již za 48 hodin po první plazmaferéze. Došlo také k úpravě vědomí, centrální levostranný hemisyndrom však perzistoval. Po vzestupu trombocytů nad 50 x 10^9/l, byla do terapie přidána antikoagulační a antiagregační medikace. Za čtyři dny od zahájení léčby se počet trombocytů normalizoval, postupně došlo také k úpravě renálních funkcí.
Obr. 1. T2 vážené obrazy z magnetické rezonance mozku. Je patrná T2 hyperintenzní oblast prakticky v celé pravé hemisféře a přesun středočárových struktur doleva. Nález odpovídá prodělané čerstvé ischemii. 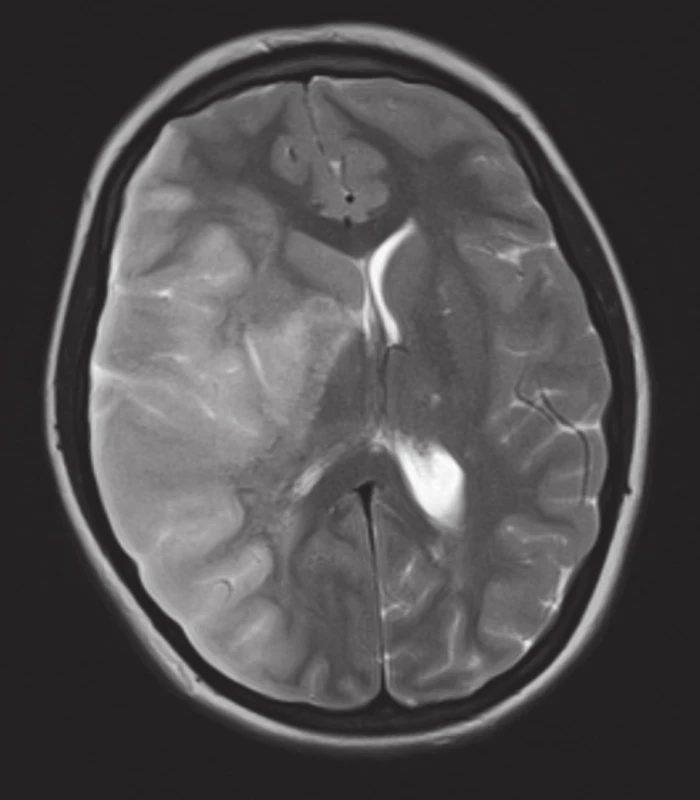
Obr. 2. Jícnová echokardiografie. Regurgitační jet v místě perforace zadního cípu mitrální chlopně (šipka). 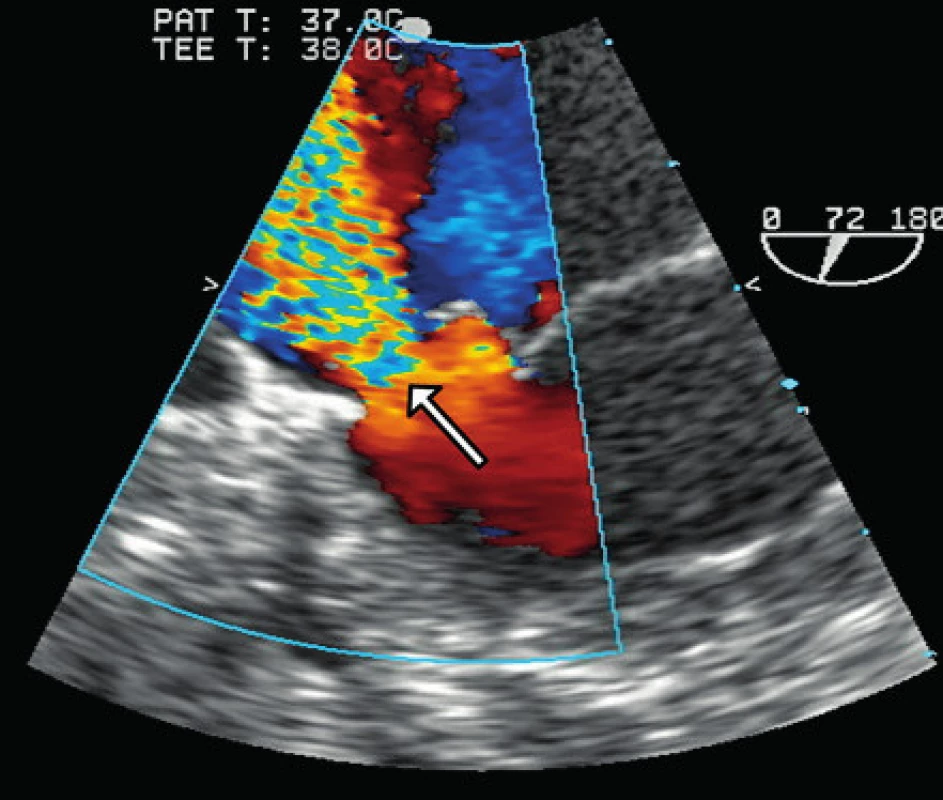
Screening autoprotilátek (ANA/ELISA – Enzyme – Linked Immuno Sorbent Assay, ANCA/IF – imunofluorescenční vyšetření, anti ds DNA/IF, ENA/ELISA) k vyloučení systémového onemocnění pojiva byl negativní, včetně antifosfolipidových protilátek proti kardiolipinu (ACLA) a beta-2-glykoproteinu. Je třeba uvést, že tento odběr byl proveden až po první plazmaferéze. Výsledek vstupního lupus antikoagulans (LA) a ANA/IF není znám, úvodní prodloužení APTT však pro přítomnost LA spíše svědčí.
Na kontrolní magnetické rezonanci mozku za měsíc od zahájení léčby se objevila dvě nová drobná ložiska subakutní ischemie v pravé hemisféře. Bylo vysloveno podezření na kardioembolickou příčinu a proveden jícnový ultrazvuk srdce, kde byla zjištěna významná mitrální regurgitace 4. st./4 při perforaci zadního cípu mitrální chlopně a vegetace na mitrální chlopni (obr. 3). V rámci diferenciální diagnostiky se proto uvažovalo o sekundární TTP u možné infekční endokarditidy. Vzhledem k negativním hemokulturám, CRP 1,2 mg/l, laboratornímu nálezu prodlouženého APPT a pozitivitě přímého Coombsova testu již v úvodu onemocnění, bylo nutno pomýšlet i na APS, případně na SLE. Nález na chlopních bylo možno považovat za sterilní Libman - Sachsovu endokarditidu, typickou pro SLE a APS. Nicméně LA tehdy vyšetřený nebyl, tudíž o naplnění kritérií pro APS (viz tabulka 1) lze jen zpětně přemýšlet.
Obr. 3. Jícnová echokardiografie. Vegetace na síňové straně předního cípu mitrální chlopně (šipka). 
Za 6 týdnů od počátku onemocnění, po deeskalaci dávky prednisonu na 10 mg/den, došlo k relapsu trombocytopenie na 40× 10^9/l, dusíkaté katabolity zůstaly v normě. Byly zahájeny další výměnné plazmaferézy – celkem 43×. Současně byl podán rituximab (RTX) 610 mg – 5krát po 3 týdnech. Následkem imunokompromitace došlo k rozvoji sepse. Při hemokultivaci a mikrobiologickém vyšetření dialyzačního katetru byl zachycen Enterococcus faecalis. Pro podezření na sekundární infekci vegetací na mitrální chlopni byla zahájena kombinovaná antibiotická terapie. Na kontrolním vyšetření jícnovou echokardiografií došlo k vymizení vegetací.
Za 6 měsíců od prvních projevů nemoci byla již prokázána pozitivita LA 2,46 opakovaně v odstupu dvanácti týdnů. Současně byla provedena i komplexní laboratorní diagnostika protilátek typu LA podle doporučení Mezinárodní společnosti pro trombózu a hemostázu. ACLA a anti beta-2-glykoprotein (ELISA test) zůstaly negativní.
Za 12 měsíců od prvních projevů nemoci se poprvé objevila silná pozitivita ANA/IF a anti-dsDNA 339,05 U/ml (ELISA test). Pacientka byla předána do péče revmatologa, který na základě pozitivity autoprotilátek proti ANA, dvouvláknové DNA, LA, intermitentně zjišťované Coombs pozitivní hemolytické anémii a leukopenii (3,49; 3,56×10^9/l), stanovil diagnózu juvenilní systémový lupus erythematodes. Vzhledem k přetrvávající proteinurii, při normálních renálních funkcích, byla k vyloučení lupusové nefritidy indikována biopsie ledviny. Po roce antiagregační a antikoagulační léčby nízkomolekulárním heparinem v dávce 0,6 mg 2× denně byl zjištěn obraz TMA (kompatibilní jak s diagnózou TTP, tak s APS), bez známek lupusové nefritidy (obr. 4).Proto bylo rozhodnuto o trvalé antiagregační a antikoagulační terapii, přestože takto kombinovaná léčba je velmi zrádná kvůli možným krvácivým komplikacím.
Obr. 4. Histologický preparát renálního glomerulu v barvení hematoxilin-eosin. Modré šipky ukazují na místa trombotické mikroangiopatie. 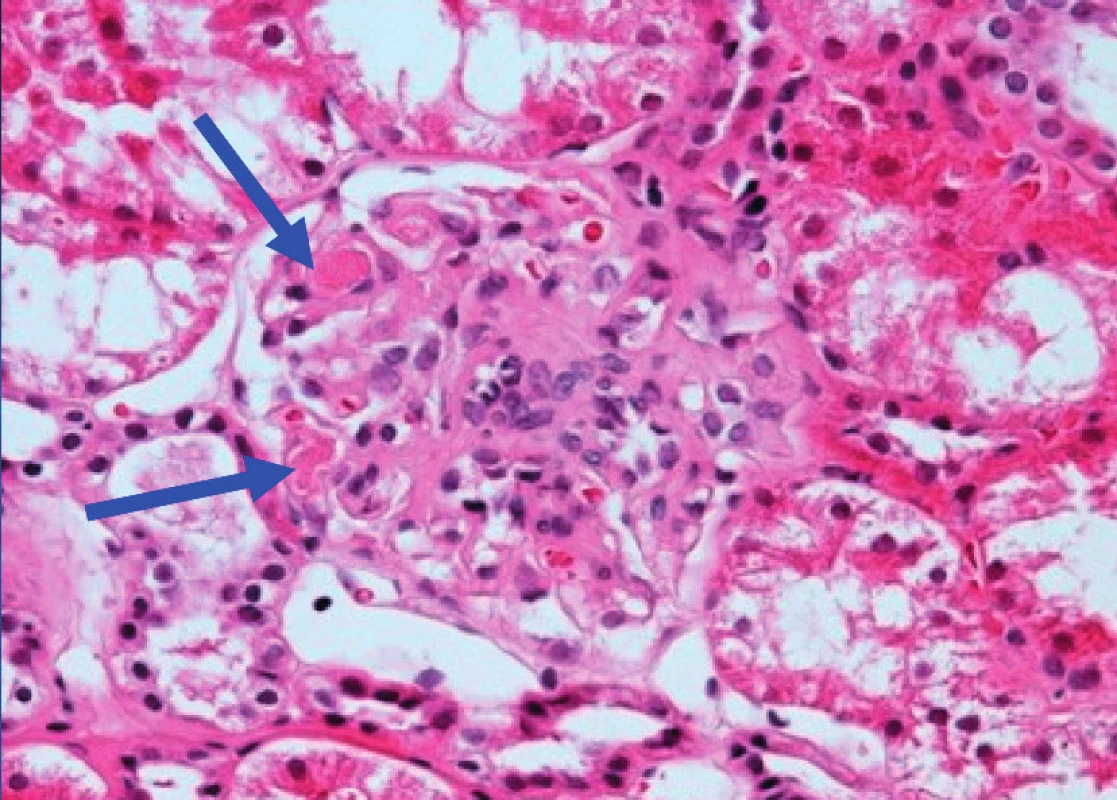
Díky účinné léčbě (výměnné plazmaferézy, kortikoterapie s postupnou detrakcí, rituximab, antikoagulační, antiagregační a antibiotická terapie) a intenzívní rehabilitaci se stav pacientky zlepšil, byla dosažena remise onemocnění. Dívka se vrátila do školy, nyní studuje obchodní akademii. V neurostatu přetrvává levostranná hemiparéza, flekční spasticita akra levé horní končetiny, semiflexe v lokti, paréza levé dolní končetiny, chůze je hemiparetická s cirkumdukcí levé dolní končetiny. Jako udržovací terapie je indikován methylprednisolon 4 mg, hydroxychlorochin 400 mg/den, warfarin, nízká dávka kyseliny acetylsalicylové a ramipril.
Diskuse
U pacientů bez iniciální diagnózy SLE může být velmi obtížné až nemožné rozlišit podstatu trombotické příhody. Pacientka v úvodu naplnila diagnostická kritéria pro TTP (trombóza v centrálním nervovém systému, horečka, trombocytopenie, mikroangiopatická hemolytická anémie, nízká aktivita ADAMTS13, protilátky proti ADAMTS13, později byl doložen i histologický průkaz TMA v ledvinách) [9, 12].
Za měsíc od začátku nemoci, v období remise TTP dokumentované normalizací počtu trombocytů, se objevila čerstvá ischemická ložiska v mozku v důsledku embolizace ze sterilních chlopenních vegetací. Normální sérová koncentrace CRP a negativní hemokultury nepodporovaly diagnózu infekční endokarditidy. Přestože máme důkazní nouzi týkající se LA z tohoto období, lze zpětně přemýšlet o tom, že tehdy naplnila i klasifikační kritéria pro APS (sterilní vegetace na chlopních, histologický průkaz TMA v ledvinách, opožděně vyšetřený, ale od té doby trvale pozitivní LA, konfirmovaný předepsanými testy – viz níže) [6, 13]. Otázkou do diskuse je, zda se hned v úvodu nejednalo o souběh TTP a antifosfolipidového syndromu. Jev prodlouženého APTT a normálního INR dává tušit přítomnost LA. LA jsou imunoglobuliny třídy IgG, IgM a IgA či jejich směs, které reagují s fosfolipidy v koagulačních testech. Průkazem jejich přítomnosti je prodloužení koagulačních testů závislých na fosfolipidech (APTT citlivé na LA, diluční test s jedem Russelovy zmije, konfirmační neutralizační test,...). Tyto testy by měl být prováděny v souladu s doporučením Mezinárodní společnosti pro trombózu a hemostázu, po krátkodobém vyloučení antikoagulační léčby [5].
Postižení chlopní v podobě Libman Sachsovy endokarditidy nacházíme u jedné třetiny pacientů s APS a je jednou z nejčastějších kardiálních manifestací SLE [5]. Perforace mitrální chlopně je její popsanou komplikací [14]. Libman Sachsovy aseptické valvulární léze nacházíme až u 10 % pacientů se SLE (pokud použijeme transthorakální echokardiografii) a u 30 % pacientů se SLE (pokud použijeme jícnovou echokardiografii) [15]. Zároveň riziko rozvoje sterilních vegetací na chlopních u SLE zvyšuje přítomnost antifosfolipidových protilátek [16]. Takto postižené chlopně jsou pak vhodným substrátem pro mikrobiální kolonizaci [17]. Je otázkou, zda příčnou enterococcové sepse byl zavedený dialyzační katetr. V té chvíli nebylo možné vyloučit, že vegetace na chlopních jsou infikované, a proto byla zahájena dlouhodobá antibiotická terapie na infekční endokarditidu. Kombinace antimikrobiální léčby, antitrombotické a antikoagulační léčby vedla k následnému vymizení vegetací na chlopních.
Za rok od začátku onemocnění pacientka naplnila diagnózu podle kritérií SLICC (Systemic Lupus International Collaborating Clinics) pro SLE (ANA, anti-dsDNA, pozitivní LA, pozitivní přímý Coombsův test, intermitentně byla zjišťována leukopenie a hemolytická anémie) [18, 19].
Lze spekulovat i o tom, že pozitivita přímého Coombsova testu již na počátku onemocnění předznamenala rozvoj SLE. Úvodní negativita ANA a anti-dsDNA by se pak dala vysvětlit vyšetřením těchto autoprotilátek až po první plazmaferéze.
TTP, APS jsou závažná autoimunitní onemocnění s tendencí k trombózám v důsledku specifických autoprotilátek (antiADAMTS13, antifosfolipidové protilátky). Obě tato onemocnění se mohou vzájemně překrývat, mohou předcházet, či koincidovat se SLE a komplikovat tak jeho průběh [8, 20, 21, 22].
V literatuře je popisováno, že u autoimunitních onemocnění (SLE, systémová sklerodermie) mohou být přítomny nejen antifosfolipidové protilátky, ale i protilátky proti ADAMTS13, aniž by byla přítomna patologická trombóza [23]. Zároveň je pozorována snížená aktivita ADAMTS13, aniž by korelovala s hladinou protilátek proti ní, jak dokazují následující studie.
Lee a kolektiv v práci z r. 2016 studovali aktivitu ADAMTS13 a anti ADAMTS13 u 216 pacientů s LA a/nebo s ACLA. Potvrdili, že u 40 % z nich byla také redukována aktivita ADAMTS13. Téměř 50 % pacientů mělo jiné souběžné autoimunitní onemocnění, SLE byl popsán u 18 % pacientů. Tato práce prokázala, že protilátky proti ADAMTS13 se zvýšeně vyskytují u autoimunitních onemocnění, ale jejich výskyt nebyl vždy spojen s redukcí aktivity ADAMTS13 [24].
K podobnému závěru dospěla i práce autorů Martin-Rodrigueze a kol. z roku 2015, která porovnávala aktivitu ADAMTS13 u padesáti pacientů se SLE a padesáti zdravých dobrovolníků. Zjistili, že aktivita ADAMTS13 byla sice snížena, ale nikdy ne závažně (<10 %), jako u TTP. Navíc protilátky proti ADAMTS13 se v této studii vyskytovaly vzácně a příliš nekorelovaly s aktivitou SLE [25].
V souladu s dostupnou literaturou se domníváme, že za redukovanou aktivitou enzymu ADAMTS13 u SLE nestojí jen protilátky proti ADAMTS13, ale i další, možná významnější patologický proces.
Co je tedy hlavní příčinou redukce aktivity ADAMTS13 u některých pacientů se SLE? Autoři článků nabízejí následující hypotézu. Při autoimunitním onemocnění dochází k poškození endotelu, k čemuž významnou měrou mohou přispět i antifosfolipidové protilátky vážící se na jeho povrch [26]. Tangovaný endotel zvýšeně uvolňuje von Willebrandův faktor a menší množství enzymu ADAMTS13, uplatňuje se i konsumpce ADAMTS13 na vláknech von Willebrandova faktoru. Výsledkem je protrombogenní stav se zvýšeným rizikem trombóz u pacientů se SLE [25, 27].
Zajímavé je, že redukce aktivity ADAMTS13, aniž by korelovala s přítomností protilátek proti ADMTS13, bývá pozorována také u sepse, cirhózy, malignit, diabetu a v souvislosti s podáváním některých léků a může přispět k zvýšenému riziku trombóz u těchto onemocnění [10, 24, 25].
TTP je život ohrožující stav vyžadující urgentní terapeutický zásah. Pilířem léčby jsou opakované výměnné plazmaferézy. Plazmaferézy odstraní protilátky proti ADAMTS13, multimery von Willebrandova faktoru a zároveň je substituována metaloproteináza ADAMTS13 obsažená ve vyměněném objemu plazmy. V případě souběžného APS odstraní antifosfolipidové protilátky. U pacientů s cévní mozkovou příhodou, masívní plicní embolií, rozsáhlou hlubokou žilní trombózou či periferní arteriální obstrukcí lze uvažovat o trombolytické terapii. Podle vývoje stavu je pokračováno ve výměnných plazmaferézách, kortikoterapii, imunomodulační terapii intravenózními imunoglobuliny a imunosupresívní terapii cyklofosfamidem, azathioprinem či rituximabem. Plná antikoagulační léčba nebo kombinovaná antikoagulační a antiagregační terapie je indikována u pacientů s TTP při vzestupu trombocytů nad 50 tisíc a u pacientů s APS, kteří prodělali arteriální trombózu s persistujícími antifosfolipidovými protilátkami [5, 9].
U pacientů s APS – asociovanou nefropatií je doporučována striktní regulace arteriální hypertenze a proteinurie inhibitory angiotensin konvertujícího enzymu, či blokátory receptoru pro angiotensin [5, 31].
Diferenciální diagnostika TMA, jak napovídá tabulka 2, je široká. Předkládáme soubor diagnostických testů, viz tabulka 3, které navrhujeme vyšetřit ještě před zahájením výměnných plazmaferéz a imunosupresivní léčby, pokud čelíme život ohrožujícímu stavu, jaký jsme demonstrovali naší kazuistikou.
Tab. 3. Diagnostické testy u pacientů s podezřením na TMA, upraveno dle Rodriguez-Pintó et al. [28]. ![Diagnostické testy u pacientů s podezřením na TMA, upraveno dle Rodriguez-Pintó et al. [28].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/135d60e6cd24e850a9f6b8fbfef0f25c.png)
TMA – trombotická mikroangiopatie, PT – protrombinový test, APTT – aktivovaný parciální tromboplastinový čas, LDH – laktát dehydrogenáza, ADAMTS13 – A Disintegrin-like And Metalloproteinase with Thrombospondin type 1 motif 13, ELISA – Enzyme-Linked Immuno Sorbent Assay, IF – imunofluorescenční vyšetření, RTG – rentgenové vyšetření, CT – computer tomography, PET/CT – positron emission tomography/computer tomography. Závěr
Život ohrožující stavy podobné demonstrovanému případu se vyskytují vzácně. Vzhledem k tomu, že vyžadují aktivní léčebný přístup, je vhodné si připomenout složitost jejich diferenciální diagnostiky. Na péči o pacienta se závažným trombotickým stavem by měli spolupracovat specialisté řady oborů, společně sledovat vývoj stavu, odpověď na terapii a řešit případné komplikace.
Tato práce byla podpořena výzkumným projektovým grantem PROGRES Q40-15 (Karlova univerzita)
adresa pro korespondenci:
MUDr. Tomáš Soukup, PhD.
II. interní gastroenterologická klinika Fakultní nemocnice v Hradci Králové, Sokolská 581, 500 05 Hradec Králové,
e-mail: tomas.soukup@fnhk.cz
Zdroje
1. Thakral A, Klein-Gitelman MS. An Update on Treatment and Management of Pediatric Systemic Lupus Erythematosus. Rheumatology and Therapy 2016; 3(2): 209–219.
2. Fonseca R, Aguiar F, Rodrigues M, Brito I. Clinical phenotype and outcome in lupus according to age: a comparison between juvenile and adult onset. Reumatologia clinica, 2016.
3. Velo-Garcia A, Castro SG, Isenberg DA. The diagnosis and management of the haematologic manifestations of lupus. Journal of Autoimmunity 2016; 74 : 139–160.
4. Miyakis S, Lockshin MD, Atsumi T, Branch DW, Brey RL, Cervera R, Reber G. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS). Journal of Thrombosis and Haemostasis 2006; 4(2), 295–306.
5. Negrini S, Pappalardo F, Murdaca G, Indiveri F, Puppo F. The antiphospholipid syndrome: from pathophysiology to treatment. Clinical and Experimental Medicine 2016; 1-11.
6. Asherson RA, Cervera R, De Groot PG, Erkan D, Boffa MC, Piette JC. Catastrophic antiphospholipid syndrome: international consensus statement on classification criteria and treatment guidelines. Lupus 2003; 12(7): 530–534.
7. Nayer A, Ortega LM. Journal of Nephropathology. Journal of nephropathology 2014; 3(1): 9.
8. Fayyaz A, Igoe A, Kurien BT, Danda D, James JA, Stafford HA, Scofield RH. Haematological manifestations of lupus. Lupus science & medicine 2015; 2(1): e000078.
9. Scully M, Hunt BJ, Benjamin S, Liesner R, Rose P, Peyvandi F, Machin SJ. Guidelines on the diagnosis and management of thrombotic thrombocytopenic purpura and other thrombotic microangiopathies. British journal of haematology 2012; 158(3): 323–335.
10. Moore JC, Hayward CP, Warkentin TE, Kelton JG. Decreased von Willebrand factor protease activity associated with thrombocytopenic disorders. Blood 2001; 98(6): 1842–1846.
11. Bianchi V, Robles R, Alberio L, Furlan M, Lämmle B. Von Willebrand factor–cleaving protease (ADAMTS13) in thrombocytopenic disorders: a severely deficient activity is specific for thrombotic thrombocytopenic purpura. Blood 2002; 100(2): 710-713.
12. Noris M, Remuzzi G. Thrombotic thrombocytopenic purpura-then and now. In: Seminars in thrombosis and hemostasis. Copyright© 2006 by Thieme Medical Publishers, Inc., 333 Seventh Avenue, New York, NY 10001, USA; 2006. p. 081–089.
13. Asherson RA, Espinosa G, Cervera R, Font J, Reverter JC. Catastrophic antiphospholipid syndrome: proposed guidelines for diagnosis and treatment. JCR: Journal of Clinical Rheumatology 2002; 8(3): 157–165.
14. Aby ES, Rosolo Z, Simegn MA. Mitral valve perforation in Libman–Sacks endocarditis: a heart-wrenching case of lupus. Journal of general internal medicine 2016; 31(8): 964–969.
15. Khan RM, Namas R, Parikh S, Rubin B. Embolic stroke as the initial manifestation of systemic lupus erythematosus. Case reports in rheumatology 2015.
16. Paran D, Caspi D, Levartovsky D, Elkayam O, Kaufman I, Litinsky I, Koifman B. Cardiac dysfunction in patients with systemic lupus erythematosus and antiphospholipid syndrome. Annals of the rheumatic diseases 2007; 66(4): 506–510.
17. Hojnik M, George J, Ziporen L, Shoenfeld Y. Heart valve involvement (Libman-Sacks endocarditis) in the antiphospholipid syndrome. Circulation 1996; 93(8): 1579–1587.
18. Tan EM, Cohen AS, Fries JF, Masi AT, Mcshane DJ, Rothfield NF, Winchester RJ. The 1982 revised criteria for the classification of systemic lupus erythematosus. Arthritis & Rheumatology 1982; 25(11): 1271–1277.
19. Petri M, Orbai AM, Alarcon GS, Gordon C, Merrill JT, Fortin PR, Sturfelt G. Derivation and validation of the Systemic Lupus International Collaborating Clinics classification criteria for systemic lupus erythematosus. Arthritis & Rheumatology 2012; 64(8): 2677–2686.
20. Muscal E, Edwards RM, Kearney DL, Hicks JM, Myones BL, Teruya J. Thrombotic microangiopathic hemolytic anemia with reduction of ADAMTS13 activity. American journal of clinical pathology 2011; 135(3): 406-416.
21. Amoura Z, Costedoat–Chalumeau N, Veyradier A, Wolf M, Ghillani–Dalbin P, Cacoub P, Piette JC. Thrombotic thrombocytopenic purpura with severe ADAMTS13 deficiency in two patients with primary antiphospholipid syndrome. Arthritis & Rheumatism 2004; 50(10): 3260–3264.
22. Brunner HI, Freedman M, Silverman ED. Close relationship between systemic lupus erythematosus and thrombotic thrombocytopenic purpura in childhood. Arthritis & Rheumatism 1999; 42(11): 2346–2355.
23. Mannucci PM, Vanoli M, Forza I, Canciani MT, Scorza R. Von Willebrand factor cleaving protease (ADAMTS13) in 123 patients with connective tissue diseases (systemic lupus erythematosus and systemic sclerosis). Haematologica 2003; 88(8): 914–918.
24. Lee SJ, Kim JE. Han KS, Kim HK. Thrombotic risk of reduced ADAMTS13 activity in patients with antiphospholipid antibodies. Blood Coagulation & Fibrinolysis 2016; 27(8): 907–912.
25. Martin-Rodriguez S, Reverter JC, Tàssies D, Espinosa G, Heras M, Pino M, Diaz-Ricart M. Reduced ADAMTS13 activity is associated with thrombotic risk in systemic lupus erythematosus. Lupus 2015; 24(11): 1143–1149.
26. Yamazaki S, Taki M, Yasumuro Y, Takayama S, Miyake F, Fujimura Y, Suzuki Y. Von Willebrand factor-cleaving protease activity in patients of collagen disease with antiphospholipid antibodies. Rinsho byori. The Japanese journal of clinical pathology 2002; 50(3): 301–307.
27. Espinosa G, Bucciarelli S, Cervera R, Lozano M, Reverter JC, De la Red G, Asherson RA. Thrombotic microangiopathic haemolytic anaemia and antiphospholipid antibodies. Annals of the rheumatic diseases 2004; 63(6): 730–736.
28. Rodriguez-Pinto I, Espinosa G, Cervera R. Catastrophic APS in the context of other thrombotic microangiopathies. Current rheumatology reports 2015; 17(1): 1–10.
29. Campistol JM, Arias M, Ariceta G, Blasco M, Espinosa M, Grinyó JM, Rodriguez de Cordoba S. An update for atypical haemolytic uraemic syndrome: diagnosis and treatment. A consensus document. Nefrologia 2013; 33(1): 27–45.
30. Bu F, Maga T, Meyer NC, Wang K, Thomas CP, Nester CM, Smith RJ. Comprehensive genetic analysis of complement and coagulation genes in atypical hemolytic uremic syndrome. Journal of the American Society of Nephrology 2014; 25(1): 55–64.
31. Groot N, de Graeff N, Aviin T, et al. European evidence-based recommendations for diagnosis and treatment of pediatric antiphospholipid syndrome: the SHARE initiative. Ann Rheum Dis Published Online 4.5.2016.
Štítky
Dermatológia Detská reumatológia Fyzioterapia Interné lekárstvo Kardiológia Ortopédia Reumatológia
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2017 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Revmatologický ústav oslavil 65 let od svého založení
- Kloubní zánět a mikrobi na škále od mikrobiomu po septickou artritidu
- Ateroskleróza a kardiovaskulární riziko u pacientů se systémovou sklerodermií
- Riziko jaterního poškození při léčbě antagonisty tumor nekrotizujícího faktoru
- Překryv projevů trombotické trombocytopenické purpury a antifosfolipidového syndromu u pacientky s juvenilním systémovým lupus erythematodes
- Zpráva z kongresu American College of Rheumatology 2017
- Přehled akcí, které pořádá Česká revmatologická společnost v roce 2018 nebo na kterých se spolupodílí
- Obsah ročníku časopisu Česká revmatologie 25/2017
- Česká revmatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Kloubní zánět a mikrobi na škále od mikrobiomu po septickou artritidu
- Ateroskleróza a kardiovaskulární riziko u pacientů se systémovou sklerodermií
- Revmatologický ústav oslavil 65 let od svého založení
- Riziko jaterního poškození při léčbě antagonisty tumor nekrotizujícího faktoru
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



