-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Riziko jaterního poškození při léčbě antagonisty tumor nekrotizujícího faktoru
Risk of liver damage during the treatment with tumor necrosis factor antagonists
Treatment with tumor necrosis factor antagonists can cause drug-induced liver damage. However, after a thorough analysis of detected cases and prospective studies aimed at monitoring liver damage, it can be concluded that the risk of severe hepatic damage is relatively low and treatment can therefore be considered as safe. Most authors emphasize the need for consistent monitoring of patients with early detection of potential hepatotoxicity. A multidisciplinary approach is recommended in further decision making. Some authors consider liver biopsy a key examination. However, standard recommendations for hepatic damage during treatment with tumor necrosis factor antagonists, including treatment recommendations, are lacking.
Key words:
Treatment with tumor necrosis factor alpha antagonists, liver toxicity, autoimmune rheumatic diseases
Autoři: O. Šléglová
Působiště autorů: Revmatologický ústav, Praha
Vyšlo v časopise: Čes. Revmatol., 25, 2017, No. 4, p. 184-189.
Kategorie: Přehledový článek
Souhrn
Léčba antagonisty tumor nekrotizujícího faktoru může způsobit poškození jater vyvolané lékem. Nicméně po důkladné analýze zjištěných případů a provedení prospektivních studií zaměřených na sledování jaterního poškození lze konstatovat, že riziko vzniku těžkých jaterních poškození je poměrně nízké a léčbu lze tudíž nadále považovat za bezpečnou. Většina autorů zdůrazňuje nutnost důsledné monitorace pacientů s časným záchytem potencionální hepatotoxicity. Při dalším rozhodování je doporučován multidisciplinární přístup. Někteří autoři považují za klíčové provedení jaterní biopsie. Standardní doporučení pro postup při jaterním poškození při léčbě antagonisty tumor nekrotizujícího faktoru včetně doporučení pro léčbu však chybí.
Klíčová slova:
Léčba antagonisty tumor nekrotizujícího faktoru alfa, hepatotoxicita, autoimunitní revmatická onemocněníÚvod
Léčba antagonisty tumor nekrotizujícího faktoru alfa (anti-TNF) znamenala revoluční léčbu zánětlivých onemocnění, jako jsou revmatoidní artritida (RA), psoriáza včetně psoriatické artritidy (PsA), ankylozující spondylitida (AS) či zánětlivá onemocnění střev. Přestože tyto léky mají relativně málo závažných nežádoucích účinků, jsou spojovány s možným poškozením jater vyvolaným lékem (DILI – Drug Induced Liver Injury). Literární údaje o možném jaterním poškození pocházely převážně z jednotlivých kasuistik [1, 2, 3, 4]. Teprve v poslední době bylo publikováno několik studií, které se snaží analyzovat zdokumentované případy jaterního poškození a poskytnout klinickou charakteristiku pacientů, u kterých došlo k poškození jater [5, 6]. Dosud neexistují doporučení, jak postupovat při záchytu abnormality jaterních testů, které jsou často přechodně zvýšené v průběhu léčbě anti-TNF. Rovněž chybí doporučení, jak postupovat v léčbě jaterního poškození. Tento článek se pokusí shrnout současné znalosti o jaterním postižení v rámci léčby anti-TNF a seznámit s postupy, které jsou navrhovány [7].
Polékové poškození jater
Játra jsou hlavním místem metabolismu léčivých přípravků a jiných exogenních sloučenin. Léčivé přípravky přijímané per os jsou absorbovány z gastrointestinálního traktu a portální žilou se dostávají do jater. Z jater se pak v různé míře metabolizované sloučeniny dostávají do systémového oběhu. Játra jsou tedy vystavena jak mateřské nemetabolizované látce, tak jejím metabolitům. Jaterní lézi může způsobit užívání mnoha léků, ať na předpis, volně prodejných v lékárně, bylinných přípravků, či tzv. doplňků stravy. Bylo popsáno více než 1000 léků a bylinných preparátů, které způsobují jaterní poškození. U disponovaného nemocného může elevaci jaterních enzymů nebo bilirubinu způsobit jakýkoliv podávaný lék. Hepatotoxicita tvoří asi 10 % nežádoucích účinků léků. U nemocných starších 50 let představují polékové jaterní léze až 40 % případů zvýšení jaterních testů a jsou příčinou 1 % hospitalizací. Jsou také jednou z nejčastějších příčin stažení léku z trhu [8, 9, 10].
Druhy jaterních poškození zjednodušeně rozdělujeme na jaterní léze hepatocelární (parenchymové) se zvýšením alaninaminotransferázy (ALT) a aspartátaminotransferázy (AST), cholestatické se zvýšenou glutamyltransferázou (GGT) a alkalickou fosfatázou (ALP) a smíšené (tab. 1). Podle průběhu pak na akutní a chronické. Podle závažnosti můžeme rozdělovat postižení na lehké (ALT nepřekročí 3x normy), střední a těžké poškození (ALT 8x normy, nebo elevace celkového bilirubinu nad 2x normy).
Tab. 1. Rozdělení léčivých přípravků podle nejčastějších mechanismů poškození jater. 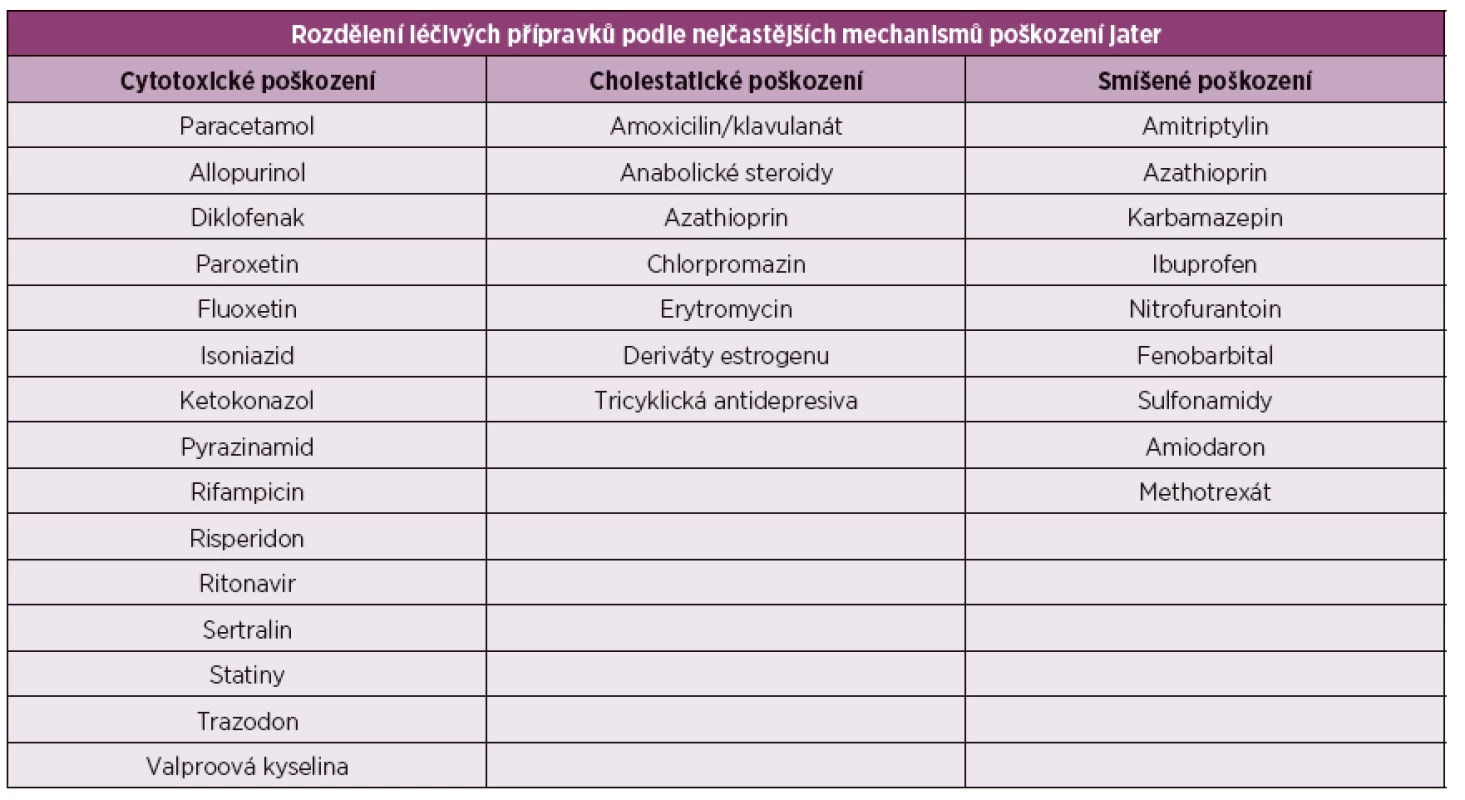
ALT je cytoplazmatický enzym vysoce specifický pro jaterní buňku. V mnohem menší míře se nachází v jiných tkáních, např. v myokardu nebo kosterním svalu. Zvýšení jeho hodnot v séru je známkou zvýšení permeability membrán hepatocytů. Je markerem i mírného poškození hepatocytů a je pro hepatocelulární poškození charakteristický. AST má složku cytosolovou a mitochondriální a nachází se ve stejné míře i v řadě dalších tkáních (srdce, ledviny, příčně pruhované svalstvo). Mitochondriální izoenzym AST se uvolňuje do krve až při rozpadu jaterních buněk. Signalizuje závažnější jaterní lézi. Jeho hladina ale může být ovlivněna i nemocemi krve, ledvin, srdce, kosterních svalů či slinivky břišní. U většiny jaterních lézí je ALT vyšší než AST. Klinický obraz bývá různý – od asymptomatických případů, kdy je nález zcela náhodný při biochemickém vyšetření, až po fulminantní jaterní selhání. Mohou být přítomny příznaky jako únava, nechutenství, gastrointestinální obtíže, bolesti kloubů, ikterus a hepatomegalie s palpační bolestivostí v pravém podžebří.
Diagnostika polékových jaterních lézí může být obtížná. Klíčovou úlohu hraje podrobná farmakologická anamnéza, ta však nemusí být vždycky spolehlivá. Vztah mezi jaterní lézí a užíváním léku není vždy jasný. Pacienti mohou brát více léků, a to výrazně ztěžuje identifikaci dané noxy [11]. Dále může dojít k souběhu s další jaterní chorobou (např. nealkoholickou steatohepatitidou nebo alkoholovým jaterním poškozením). Znaky, které svědčí pro lékovou toxicitu, zahrnují nepřítomnost poškození před užitím léku, přítomnost klinických příznaků nebo laboratorních abnormalit při užívání léku a jejich zlepšení poté, co byl lék vysazen [12].
Analýza publikovaných případů jaterního poškození při anti-TNF léčbě
Ghabril Marwan a kolektiv [5] publikovali retrospektivní analýzu jaterního poškození u 34 pacientů, která byla spojována s užíváním anti-TNF léčby. Případy DILI (Drug Induced Liver Injury – poškození jater vyvolaného léky) byly vyhledány na základě prohledání databáze U. S. DILIN (Drug Induced Liver Injury Network) z let 2003–2011. K hodnocení kausality byla použita Rousel-Uclaf Causality Assessment Method (RUCAM, Rousel-Ucklaf metoda hodnocení kausality) [13]. V této databázi bylo identifikováno 6 případů, u nichž je pravděpodobné, že mají DILI spojenou s použitím anti-TNF léčby. Dále byla prohledána databáze PubMed, kde bylo identifikováno dalších 28 případů vhodných pro analýzu.
Bylo zjištěno DILI při léčbě infliximabem u 26 pacientů, adalimumabem u 4 pacientů a etanerceptem u 4 pacientů. Průměrná doba vzniku DILI byla 13 týdnů (2–104 týdnů). Dvaadvacet z 33 subjektů, kteří podstoupili sérologickou analýzu (67 %), bylo pozitivně testovaných na antinukleární protilátky nebo na protilátky proti hladkému svalstvu. Z těchto 22 pacientů 17 podstoupilo jaterní biopsii; 15 subjektů mělo jasné rysy autoimunity. Dvaadvacet pacientů s autoimunitními změnami mělo delší medián latence (16 vs. 10 týdnů) a vyšší vrcholové hladiny ALT než 12 pacientů bez autoimunitních změn. Byl zaznamenán 1 případ závažné cholestázy. Všichni, kromě jediného subjektu, se zlepšili po přerušení léčby. Dvanáct pacientů bylo léčeno kortikosteroidy. Nebylo zjištěno žádné úmrtí v důsledku jaterního poškození, jeden pa-cient s preexistující jaterní cirhózou byl indikován k transplantaci jater.
Autoři konstatují, že akutní poškození jater způsobené antagonisty TNF α může být „class“ efektem (účinkem celé skupiny), protože se vyskytlo u několika přípravků této kategorie. Nejběžnějším typem prezentace je autoimunitní fenotyp s výrazným hepatobuněčným poškozením, ale vyskytuje se i smíšený neautoimunitní mechanismus nebo převládající cholestatické postižení jater. Prognóza po přerušení léčby je obvykle dobrá, někteří pacienti mohou mít prospěch z přechodné léčby kortikoidy. Změna na jiný anti-TNF po zhojení jaterního poškození je možná. Byla dobře tolerovaná, bez recidivy jaterního poškození.
Prospektivní studie zaměřené na riziko jaterního poškození při anti-TNF léčbě
V prospektivní studii provedené Bjorssonem a kolektivem [6] v Národní univerzitní nemocnici na Islandu byli sledováni pacienti léčení anti-TNF léčbou v letech 2009–2013. Celkem bylo zařazeno 1076 pacientů léčených infliximabem, 270 adalimumabem a 430 etanerceptem. DILI bylo zjištěno u 11 pacientů (8 žen, průměrný věk 46 let). Kauzalita byla hodnocena pomocí RUCAM (Rousel-Uclaf Causality Assessment Metod) – 73 % případů hodnoceno jako vysoce pravděpodobné. V 9 případech zjištěné DILI se jednalo o pacienty léčené infliximabem. DILI se tedy vyvinula u 1 ze 120 pacientů, kteří dostávali infliximab, u 1 z 270 pacientů na adalimumabu a 1 ze 430 pacientů léčených etanerceptem. U většiny pacientů léčených infliximabem (6) se DILI vyvinula po 4 infuzích léku. Všichni pacienti měli zvýšené jaterní testy (3x elevace ALT nebo AST, nebo 2x ALP, bilirubinu), pouze čtyři pacienti měli žloutenku. Pacienti byli standardně testováni před zahájením léčby anti-TNF preparátem (vyloučení hepatitid, CMV, EB, alkoholu, JT onemocnění).
U 8 pacientů bylo zjištěno hepatocelulární poškození jater, 2 pacienti byli hodnoceni jako cholestatické postižení a u 1 pacienta se vyskytlo postižení smíšené. Sedm pacientů, kteří vyvinuli DILI, bylo testováno na antinukleární protilátky (ANA) před léčbou anti-TNF, tři měli pozitivní výsledky testu. V kontrolní skupině bez vývoje DILI byly ANA pozitivní u 5 ze 14 testovaných. Po vzniku DILI bylo 8 z 11 pacientů testováno pozitivně na ANA. Ve vzorcích jaterních biopsií odebraných u 5 pacientů s DILI byly 3 bioptické vzorky s nálezem těžké akutní hepatitidy. Zajímavé bylo zjištění, že pouze 9 % pacientů, kteří vyvinuli DILI, dostalo methotrexát během léčby anti-TNF, ve srovnání s 59 % u kontrolní skupiny bez DILI.
Steroidy byla léčena DILI u 5 pacientů a ve 4 případech byla léčba krátkodobá, bez recidivy po přerušení léčby. Osm pacientů s proběhlým DILI pokračovalo v léčbě jinými antagonisty TNF bez recidivy DILI. Závěrem autoři konstatují, že z anti-TNF agens je infliximab nejčastěji spojován s DILI, která se vyvinula u 1 ze 120 pacientů, kteří dostávali tento lék. Padesát procent pacientů s DILI spojeným s anti-TNF vyžadovalo steroidní terapii, většinou krátkodobou. Z uvedené sledování se zdá, že přidání methotrexátu k terapii anti-TNF může snížit riziko vzniku DILI.
Co způsobuje jaterní poškození při anti-TNF léčbě?
Přesné mechanismy poškození jater spojené s antagonisty TNF α nejsou jasné. Uvažuje se o imunoreaktivním mechanismu, přímém poškození jater či změnách profilu lipidů vedoucím k jaterní steatóze [6, 7, 14]. U jednotlivých pacientů se mohou spolupodílet i geneticky podmíněné variace metabolismu, polymorfismy a mutace.
Patologický mechanismus při klasické autoimunitní hepatitidě (AIH) je ztráta tolerance nemocného vůči vlastním hepatocytům [15, 16, 17]. Předpokládá se, že děje jsou iniciované CD4 T buňkami, které rozpoznávají vlastní antigeny. Zda léky ze skupiny antagonistů TNF α mohou indukovat AIH stejným mechanismem, vyžaduje další studium. Jako další mechanismus nelze vyloučit přímé poškození jater. Je však i známo, že léčba anti-TNF indukuje změny lipidového profilu, které se mohou odrazit ve zvýšeném riziku steatózy jater. Často se zřejmě uplatňuje i kombinace jednotlivých mechanismů.
Současné použití DMARD (chorobu modifikujících léků), zejména methotrexátu, bylo významně častější u kontrol, které nevyvinuly jaterní poškození [5, 6].
V provedených studiích nebylo pozorováno, že by některý z pacientů, kteří byli léčeni druhým antagonistou anti-TNF α (po zhojení jaterního poškození), vyvinul opětovné poškození jater [18, 19]. Zkřížená reaktivita mezi různými anti-TNFα je tedy velmi nepravděpodobná Nicméně nelze vyloučit, že poškození jater pozorované ve spojení s anti-TNF léky je „class“ efekt celé této skupiny, zprostředkovaný autoimunitou.
Co má vliv na vznik jaterního poškození při anti-TNF léčbě?
Za rizikové faktory vzniku jaterního poškození se považuje preexistující jaterní onemocnění a potenciálně hepatotoxické léky [10, 20, 21]. Na druhou stranu u současného použití DMARD, včetně methotrexátu, nebylo potvrzeno větší riziko vzniku DILI (tab. 2).
Tab. 2. Faktory ovlivňující hepatotoxicitu. 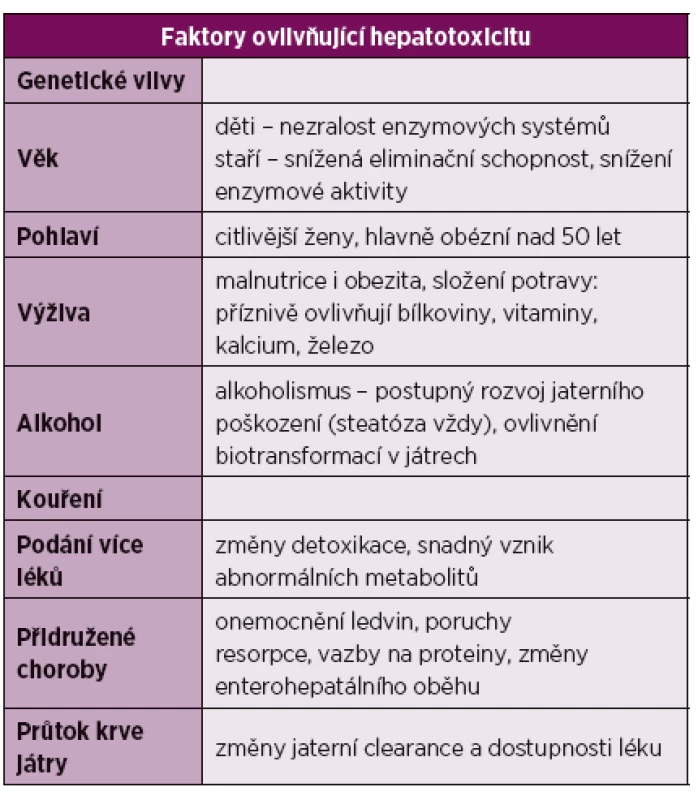
Je zajímavé, že ani ANA pozitivita, ani aktivita nemoci nebo dávka antagonistů TNF α nevykazovala rozdíly mezi pacienty s DILI a pacienty z kontrolní skupiny, u kterých k poškození jater nedošlo (16). Současné použití DMARD, zejména methotrexátu, bylo významně častější u kontrol, které nevyvinuly jaterní poškození. Důvod, proč tomu tak je, ale není jasný. Dříve bylo prokázáno, že methotrexát vede k poklesu hladiny cirkulujících autoprotilátek při kožním lupus erythematodes, bohužel vliv methotrexátu na hladiny protilátek během anti-TNF α léčby nebyl zkoumán [5, 6, 7].
Jaká vyšetření by měla být provedena před zahájením léčby anti-TNF?
Před zahájením léčby anti-TNF by měli všichni pacienti být vyšetřen na předchozí onemocnění jater včetně chronické virové hepatitidy, autoimunitní poruchy a nealkoholické steatózy jater [6, 7, 20, 21]. Měla by být provedena podrobná anamnéza konzumace alkoholu či užívání drog. Krevní testy by měly zahrnovat vyšetření jaterních funkcí a screening hepatitid B, C a HIV infekce.
Jaké kontroly jsou vhodné po zahájení léčby anti-TNF?
Jaterní testy (transaminázy?) by měly být pravidelně prováděny po zahájení anti-TNF léčby. Mezi jednotlivými autory nepanuje úplná shoda ve frekvenci kontrol, nejčastěji je udáváno častější sledování po zahájení anti-TNF léčby (prvních 8 týdnů každé 2 až 3 týdny) a poté každých 8 týdnů po celou dobu léčby [6, 7, 20, 21].
Při zjištění abnormální hladiny transamináz je prvním krokem opětovné vyloučení ostatních možných příčin zvýšených jaterních testů včetně virové hepatitidy, alkoholu, celiakie či autoimunitní poruchy. Je třeba si uvědomit, že mírná elevace ALT/AST do 2x normálních hodnot není neobvyklá u pacientů s autoimunitními revmatickými chorobami, kteří kromě anti-TNF léčby jsou léčeni i jinými, chorobu modifikujícími léky či nesteroidními antirevmatiky. Pokud tedy je zvýšení ALT <3x hodnot, je třeba především opakované sledování a úprava léčby s vyloučením případných dalších rizikových léků a důslednou abstinencí alkoholu. Naopak, v případě, že je zvýšení hladiny ALT >3x normálních hodnot nebo při objevení se žloutenky, je vhodné přerušení léčby a konzultace hepatologa.
Jak postupovat při podezření na DILI při léčbĚ anti-TNF?
Při potvrzení zvýšení hladiny ALT >3x normálních hodnot nebo se objevení se žloutenky přerušujeme léčbu [6, 7, 20, 22, 23]. Vhodná je konzultace hepatologa. Mělo by být provedeno ultrazvukové vyšetření jater a v případě trvalého zvýšení hodnot jaterních testů zvážena jaterní biopsie. Část autorů považuje jaterní biopsii za klíčovou a doporučuje její provedení u všech pacientů s podezřením na DILI, pokud není kontraindikována z jiných zdravotních důvodů. Biopsie může vyloučit jinou potenciální etiologii a případně zahájit vhodnou specifickou léčbu nebo potvrdit diagnózu DILI (graf 1). Protože DILI představuje významnou příčinu poškození jater, je časná diagnostika důležitá. Potvrzená diagnóza vede k rychlému ukončení působení vyvolávajícího agens a časnému zahájení regenerace jaterního parenchymu.
Graf 1. Jak postupovat při podezření na DILI při anti-TNF léčbě. Upraveno podle Rossi RE, et al. Tumour-necrosis-factor inhibitors and liver. World J Gastroenterol 2014. 
Většina jaterních postižení při anti-TNF léčbě je mírná s dobrou prognózou po vysazení léčby. U nemocných dochází k postupné spontánní normalizaci jaterních testů. U pacientů, kde nedochází k spontánnímu poklesu hodnot jaterních testů nebo postižení jater bylo závažnější, zahajujeme léčbu kortikoidy. Kortikoidy většinou vedou k rychlejšímu poklesu zvýšených hodnot zvláště tam, kde byla prokázána autoimunitní etiologie. Podání kortikoidů vyžaduje zhruba třetina až polovina pacientů s DILI. Kortikoterapie nemusí být dlouhodobá. Vysadit kortikoidy se u většiny pacientů povede zhruba do šesti měsíců.
Změna na jiný anti-TNF po úplném zhojení jaterního poškození je možná. Je dobře tolerovaná, bez recidivy jaterního poškození.
Jak by měl být informován pacient?
Pacient by měl být upozorněn na potenciální problém hepatotoxicity při anti-TNF léčbě [6, 7, 20, 21]. Musí být instruován, že pokud by byly zjištěny zvýšené jaterní testy (i při vyšetření prováděném u jiných lékařů), necítil se dobře nebo se objevila žloutenka, měl by vyhledat lékařskou pomoc. Rovněž mu je vhodné doporučit omezení konzumace alkoholu.
Závěr
V souhrnu lze konstatovat, že přechodné mírné zvýšení ALT a AST u pacientů s autoimunitním revmatickým onemocněním, kteří jsou na anti-TNF léčbě, je častým nálezem. Ve většině případů dojde ke spontánní úpravě. Na druhou stranu si je třeba uvědomit, že jaterní poškození může být komplikací anti-TNF léčby. Ačkoliv jednotná doporučení pro postup a léčbu v těchto případech neexistují, zdá se, že základem je důsledná monitorace, multidisciplinární přístup s doplněním ultrazvuku jater a případnou včasnou jaterní biopsií, která může pomoci diferencovat DILI od jiných příčin jaterního onemocnění. Většina jaterních postižení při anti-TNF léčbě je mírná s dobrou prognózou po vysazení léčby, ale byly popsány i případy těžkého poškození jater. Léčbu kortikoidy vyžaduje 30–50 % pacientů. Léčba jiným anti-TNF (po zhojení jaterního poškození) je možná a dobře tolerovaná.
adresa pro korespondenci:
MUDr. O. Šléglová
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
e-mail: sleglova@revma.cz
Zdroje
1. Germano V, Picchianti Diamanti A, Baccano G, et al. Autoimmune hepatitis associated with infliximab in a patient with rheumatoid arthritis. Ann Rheum Dis 2005; 64 : 1519–1520.
2. Harada K, Akai Y, Koyama S, et al. A case of autoimmune hepatitis exacerbated by the administration of etanercept in the patient with rheumatoid arthritis. Clin Rheumatol 2008; 27 : 1063–1066.
3. Ozorio G, McGarity B, Bak H, et al. Autoimmune hepatitis following infliximab therapy for ankylosing spondylitis. Med J Aust. 2007; 187 : 524–526.
4. Tobon GJ, Cañas C, Jaller JJ, et al. Serious liver disease induced by infliximab. Clin Rheumatol 2007; 26 : 578–581.
5. Ghabril M, Bonkovsky HL, Kum C, Davern T, Hayashi PH, et al. Liver injury from tumor necrosis factor-α antagonists: analysis of thirty-four cases. Clin Gastroenterol Hepatol 2013; 11 : 558–564.
6. Bjornsson ES, Gunnarsson BI, Grondal G, et al. Risk of drug-induced liver injury from tumor necrosis facror antagonists. Clin Gastroenterol Hepatol 2015; 13 : 602–608.
7. Rossi RE, Parisi I, Despott EJ, et al. Anti-tumour necrosis factor agent and liver injury: Literatury review, recommendations and management. World J Gastroenterol 2014; 20(46): 17352–17359.
8. Brodanova M. Toxické poškození jater – I. díl. Interní Med. 2002; 12 : 590–594.
9. Brodanova M. Toxické poškození jater – II. díl. Interní Med. 2003; 1 : 19–23.
10. Červený P. Polékové poškození jater. Prakt. lékáren. 2013; 9(3): 123–126.
11. Grant LM, Rockey DC. Drug - induced hepatotoxicity. N Eng J Med 2003; 349(5): 474–485.
12. Bjornsson ES, Talwalkar J, Treeprasertsuk S, et al. Drug-induced autoimmune hepatis: clinical characteristics and prognosis. Hepatology 2010; 51 : 2040–2048.
13. Danan G, Benichou C. Causality assessment of adverse reactions to drugs – I. A novel method based on the conclusions of international consensus meetings: application to drug-induced liver injuries. J Clin Epidemiol 1993; 46 : 1323–1330.
14. Kleiner DE, Chalasani NP, Lee WM, et al. Hepatic histological findings in suspected drug-induced liver injury: systemic evaluation and clinical associations. Hepatology 2014; 59 : 661–670.
15. Hennes EM, Zeniya M, Czaja AJ, et al. Simplified criteria for the diagnosis of autoimmune hepatitis. Hepatology 2008; 48 : 169–176.
16. Vergani D, Mieli-Vergani G. Autoimmune hepatitis. Autoimmun Rev 2003; 2 : 241-247.
17. Lammert C, Einarsson S, Niklasson A, et al. Relationship between daily dose of oral medications and idiosyncratic druginduced liver injury(DILI). Search for signals. Hepatology 2008; 47 : 2003–2009.
18. Thiefin G, Morelet A, Heurgue A, et al. Infliximab-induced hepatitis: absence of cross-toxicity with etanercept. Joint Bone Spine 2008; 75 : 737–739.
19. Carlsen KM, Riis L, Madsen OR. Toxic hepatitis induced by infliximab an a patient with rheumatoid arthritis with no relapse after switching to eranercept. Clin Rheumatol 2009; 28 : 1001–1003.
20. Miehsler W, Dejaco C, Petritsch W, et al. A decade of infliximab: The Austrian evidence based consensus on the safe of use of infliximab in inflammatory bowel disease. J Crohn Colitis 2010; 4 : 221–256.
21. Mancini S, Amorotti E, Vecchio S, et al. Infliximab-related hepatis: discussion of a case and review of the literature. Intern Emerg Med 2010; 5 : 193–200.
22. Fontana RJ, Seeff LB, Andrade RJ, et al. Standardization of nomenclature and causalita assessment in drug-induced liver injury: summary of a clinical research workshop. Hepatology 2010; 52 : 730–742.
23. Chalasani N, Fontana RJ, Bonkovsky HL, et al. Causes, clinical features, and outcomes from a prospective study of drug-induced liver injury in the United States. Gastroenterology 2008; 135 : 1924–1934.
Štítky
Dermatológia Detská reumatológia Fyzioterapia Interné lekárstvo Kardiológia Ortopédia Reumatológia
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2017 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Revmatologický ústav oslavil 65 let od svého založení
- Kloubní zánět a mikrobi na škále od mikrobiomu po septickou artritidu
- Ateroskleróza a kardiovaskulární riziko u pacientů se systémovou sklerodermií
- Riziko jaterního poškození při léčbě antagonisty tumor nekrotizujícího faktoru
- Překryv projevů trombotické trombocytopenické purpury a antifosfolipidového syndromu u pacientky s juvenilním systémovým lupus erythematodes
- Zpráva z kongresu American College of Rheumatology 2017
- Přehled akcí, které pořádá Česká revmatologická společnost v roce 2018 nebo na kterých se spolupodílí
- Obsah ročníku časopisu Česká revmatologie 25/2017
- Česká revmatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Ateroskleróza a kardiovaskulární riziko u pacientů se systémovou sklerodermií
- Kloubní zánět a mikrobi na škále od mikrobiomu po septickou artritidu
- Revmatologický ústav oslavil 65 let od svého založení
- Riziko jaterního poškození při léčbě antagonisty tumor nekrotizujícího faktoru
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



