-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Technológia tabliet s riadeným uvoľňovaním s obsahom veľmi dobre rozpustných liečiv
Technology of controlled-release tablets containing highly soluble active ingredients
The aim of this experimental study was the preparation of once-daily-dosed matrix tablets containing the highly soluble drugs metoprolole succinate and metformine hydrochloride using Eudragit® NE 30 D as the matrix forming polymer. Matrix tablets were prepared by compression of coated granules. The formation of the secondary structure from the coating polymer was evaluated. In the case of metoprolole succinate, the drug release was prolonged, 53% of the drug being released within 20 hours. Dissolution profile was modified by addition of a filler, then the drug was completely released within 24 hours what is not acceptable for experimental purpose. The described technology of the preparation of the once-daily-dosed matrix was used also for the highly dosed drug metformine hydrochloride. The release rate of metformine hydrochloride was evaluated in dependence on the polymer content. The prepared formulation showed similar dissolution characteristics as the marketed product used in therapy. A positive effect of curing on the stability of the dissolution profile was demonstrated. The results demonstrate that the reported technology of compression of Eudragit® NE 30 D coated granules is usable for the preparation of prolonged-release dosage forms containing highly soluble drugs.
Key words:
Eudragit® NE 30 D – prolonged release – secondary structure – metoprolole succinate – metformine hydrochloride
Autoři: B. Vladovičová 1; V. Kormanová 1; M. Vítková 2; V. Hubinová 1; M. Žabka 2; K. Gardavská 2
Působiště autorů: Zentiva a. s., Hlohovec, Slovenská republika, 2Univerzita Komenského v Bratislave, Farmaceutická fakulta, Katedra galenickej farmácie, Slovenská republika 1
Vyšlo v časopise: Čes. slov. Farm., 2010; 59, 179-185
Souhrn
Cieľom tejto experimentálnej práce bolo pripraviť jeden krát denne dávkovanú („once daily“ – OD) matricovú retardetu s obsahom veľmi dobre rozpustných liečiv metoprololiumsukcinátu a metformíniumchloridu s využitím retardačných vlastností Eudragitu NE 30 D. Matricové retardety sa pripravili zlisovaním obaleného granulátu do výliskov. Sledoval sa vznik sekundárnej štruktúry z polyméru tvoriaceho obal granulátových zrń oboch študovaných liečiv. V prípade metoprololiumsukcinátu v 20. hodine sa uvoľnilo len 53 % z celkového množstva liečiva, čo je pre experimentálny zámer nereálne, a predĺžilo uvoľňovanie liečiva. Prídavkom plniva sa modifikoval liberačný proces a pripravila sa lieková forma uvoľňujúca celú dávku liečiva postupne počas 24 hodín. Uvedený spôsob prípravy matricovej retardety s dávkovaním jeden krát denne sa aplikoval aj pre vysoko dávkované liečivo metformíniumchlorid. Rýchlosť uvoľňovania metformíniumchloridu z matrice sa sledovala v závislosti od množstva polyméru. Pripravenou formuláciou sa dosiahol liberačný profil odpovedajúci prípravku používanému v terapeutickej praxi. Potvrdil sa pozitívny vplyv dodatočného sušenia „curingu“ na stabilitu liberačného procesu počas skladovania. Z výsledkov vyplýva, že zlisovaním granulátu obaleného vodnou disperziou Eudragitu NE 30 D do matricového typu retardety je možné pripraviť liekové formy s riadeným uvoľňovaním s obsahom veľmi dobre rozpustných liečiv.
Kľúčové slová:
Eudragit® NE 30 D – predĺžené uvoľňovanie – sekundárna štruktúra – metoprololiumsukcinát – metformíniumchloridÚvod
Farmaceutický výskum procesov transformácie liečiv na lieky je neodmysliteľnou súčasťou procesu, v ktorom sa od biologicky aktívnej látky dospieva k jej terapeutickému využitiu. Ak sa nesformuje a nevyrobí liek umožňujúci podanie liečiva a jeho prijatie organizmom, žiadna biologicky aktívna látka sa nestane liečivom. Perorálne lieky s riadeným uvoľňovaním liečiva (CR lieky) sú prvým významným výsledkom aktívneho využitia farmakokinetických poznatkov o závislosti biologickej dostupnosti liečiva od lieku a jeho formy. Sú to lieky s polymérnymi bariérami a membránami schopnými kvantifikovať účinok liečiva a privádzať ho na miesto predpokladaného účinku. Polymérna membrána je prvkom riadiacim liberáciu liečiva, riadi nástup účinku liečiva a dĺžku jeho trvania v programovanom čase.
Formuláciou liekovej formy s riadeným uvoľňovaním sa optimalizuje farmakokinetický profil liečiva, prostredníctvom zjednodušeného dávkovacieho režimu sa zjednodušuje „patient compliance“, zefektívňuje liečba a zvyšuje účinnosť liečiva. V prípade dobre rozpustných liečiv môže byť formulácia týchto liekových foriem problematická, pretože dochádza k počiatočnému rýchlemu uvoľneniu liečiva, ktoré treba modifikovať a následne zabezpečiť ustálenie liberačného procesu a udržanie hladiny liečiva v oblasti terapeutickej koncentrácie v žiadanom časovom intervale.
Problematika riadeného uvoľňovania je vo farmaceutickej technológii živá a aktuálna a je aj dnes predmetom záujmu farmaceutických technológov, o čom svedčia experimentálne štúdie mnohých autorov 1–5).
Cieľom tejto experimentálnej práce bolo pripraviť jeden krát denne dávkovanú („once daily“ OD) liekovú formu s riadeným uvoľňovaním matricového typu s obsahom veľmi dobre rozpustných liečiv metoprololiumsukcinátu a metformíniumchloridu s využitím retardačných vlastností Eudragitu NE 30D 6–10). Metoprololiumsukcinát je kardioselektívny betablokátor, ktorý sa používa k liečbe hypertenzie, angíny pectoris a porúch srdcového rytmu, antihyperglykemikum metformíniumchlorid sa indikuje pri liečbe diabetes melitus 2. typu.
Metoprololiumsukcinát je veľmi dobre rozpustný vo vode (248 mg/ml pri 25 °C), so zvyšovaním teploty rozpustnosť významne narastá (925 mg/ml pri 60 °C).
Metformíniumchlorid má tiež veľmi dobrú rozpustnosť vo vode (> 300 mg/ml pri 25 °C), čo prináša problémy s počiatočným rýchlym uvoľnením liečiva. Naviac je problémom relatívne vysoká dávka liečiva.
Experimentálne výlisky sa pripravili zlisovaním obalených granulátových zŕn. Lisovaním obalených častíc sa značný podiel polymérnych obalov poškodí, následne sa ale tvorí sekundárna matricová štruktúra polyméru modifikujúca liberačný proces. Vznik sekundárnej štruktúry skeletových výliskou sa potvrdil pri štúdiu formulácie násobnej liekovej formy kyseliny acetylosalicylovej pre jej aplikáciu ako tromboprofylaktika. Ukázalo sa, že rýchlosť uvoľňovania zo želatínových kapsúl s obsahom obalených peliet je iná ako z výliskov, ktoré sa z nich pripravili 11). Vysvetlenie autori predpokladali vo vzniku sekundárnej štruktúry vrstvy polyméru tvoriaceho primárny obal peliet. Pelety, ktoré pripravili extrúziou a sferonizáciou obalili fluidnou technikou terpolymérom 2-hydroxyetylmetakrylát:metylmetakrylát:butylakrylát vodná disperzia 3 : 3,5 : 3,5. Obalené pelety naplnili do želatínových kapsúl, výlisky z peliet pripravili bez pomocných látok. Existenciu sekundárnych štruktúr, ktorá sa prejavuje v zmene množstva uvoľneného liečiva potvrdili disolučné profily. Zo želatínových kapsúl s obsahom obalených peliet sa celá dávka liečiva uvoľnila do 3 hodín. Dôkazom vplyvu koherentnej sekundárnej štruktúry je priebeh liberácie liečiva z výliskov, kedy sa v čase 3 hodín uvoľnilo 50 % liečiva. Vytvorená skeletová štruktúra dominantne modifikuje liberačný proces. Existenciu sekundárnej štruktúry vo výliskoch potvrdili aj mikrosnímky.
Súčasťou experimentálnej práce bolo testovanie vplyvu „curingu“ na stabilitu liberačného profilu matricových tabliet s obsahom Eudragitu NE 30 D 12-15).
POKUSNÁ ČASŤ
Materiál
Metoprololiumsukcinát a metformíniumchlorid sa použili ako liečivo, mikrokryštalická celulóza, typ Avicel® PH 101 (FMC BioPolymer) a bezvodá laktóza DCL 21 ako plnivá, povidone 30 (BASF Chemtrade GmbH) ako spojivo, koloidný oxid kremičitý (GRACE GmbH) ako klzná látka a stearan horečnatý (Wera Chemie) ako antiadhezívum. Eudragit® NE 30 D-55 (Evonik Industries) plnil funkciu retardačného polyméru. Glucophage® XR 500 (Merck Santé s.a.s., Francúzsko) obsahujúci 500 mg metformíniumchloridu, hydroxypropylmetylcelulózu, mikrokryštalickú celulózu, stearan horečnatý a karboxymetylcelulózu sodnú sa použil ako referenčný prípravok metformíniumchloridu s predĺženým uvoľňovaním používaný v terapeutickej praxi.
Príprava matricových tabliet
Matricové tablety sa pripravili zlisovaním granulátových zŕn obalených vodnou latexovou disperziou Eudragitu NE 30 D. Zloženie granulátu a matricových tabliet s obsahom metoprololiumsukcinátu uvádza tabuľka 1 a zloženie granulátu a matricových tabliet s obsahom metformíniumchloridu tabuľka 2.
Tab. 1. Zloženie matricových tabliet s obsahom metoprololiumsukcinátu 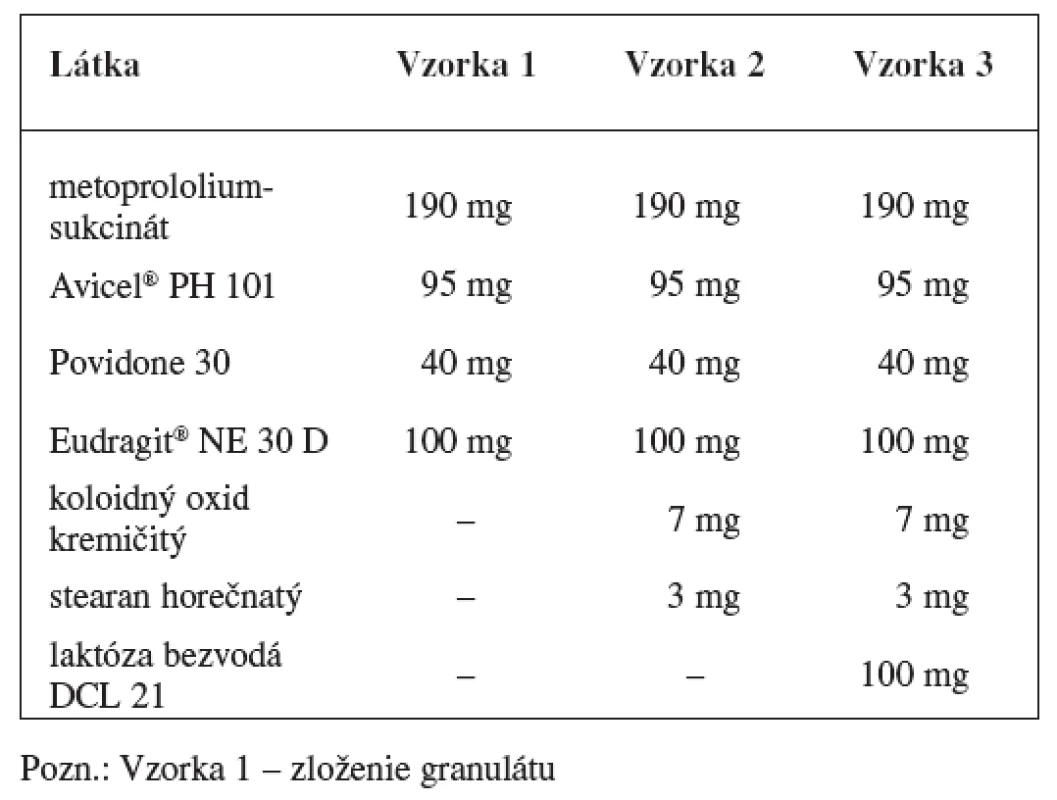
Tab. 2. Zloženie matricových tabliet s obsahom metformíniumchloridu 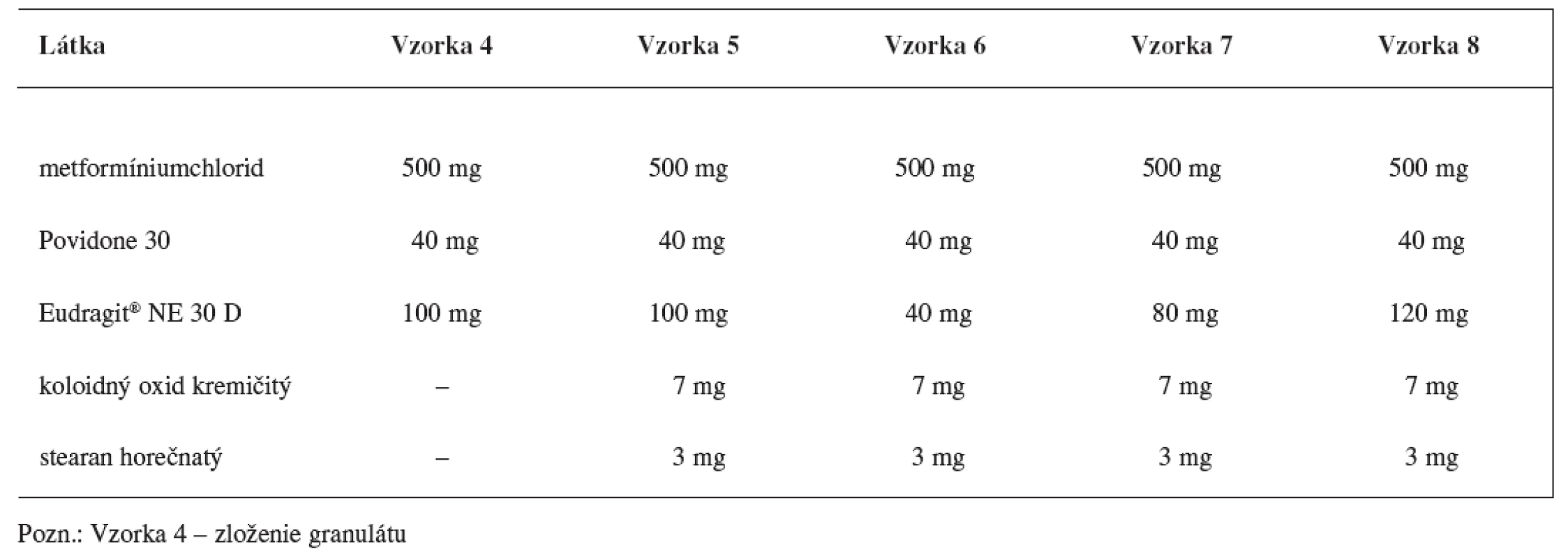
Príprava granulátu
Metformíniumchlorid sa granuloval v rýchlootáčkovom miešadle (Diosna P25) roztokom polyvinylpyrolidonu.
V prípade metoprololiumsukcinátu sa liečivo najskôr homogenizovalo s mikrokryštalickou celulózou, Avicel® typ PH 101 a vzniknutá homogénna zmes sa následne granulovala v rýchlootáčkovom miešadle (Diosna P25) roztokom polyvinylpyrolidonu.
Granulát oboch liečiv sa sušil pri teplote 50 oC vo fluidnej sušiarni (Glatt WSG CD 15) do dosiahnutia vlhkosti maximálne 1,5 %. Vysušený granulát sa presitoval cez sito s priemerom 0,8 mm.
Obaľovanie granulátu v pseudofluidnej vrstve
Granuláty obidvoch študovaných liečiv sa obaľovali vodnou disperziou Eudragitu NE 30 D vo fluidnom zariadení s vrchným nástrekom (Glatt WSG CD 15). Procesné parametre obaľovania sú uvedené v tabuľke 3.
Tab. 3. Procesné parametre obaľovania 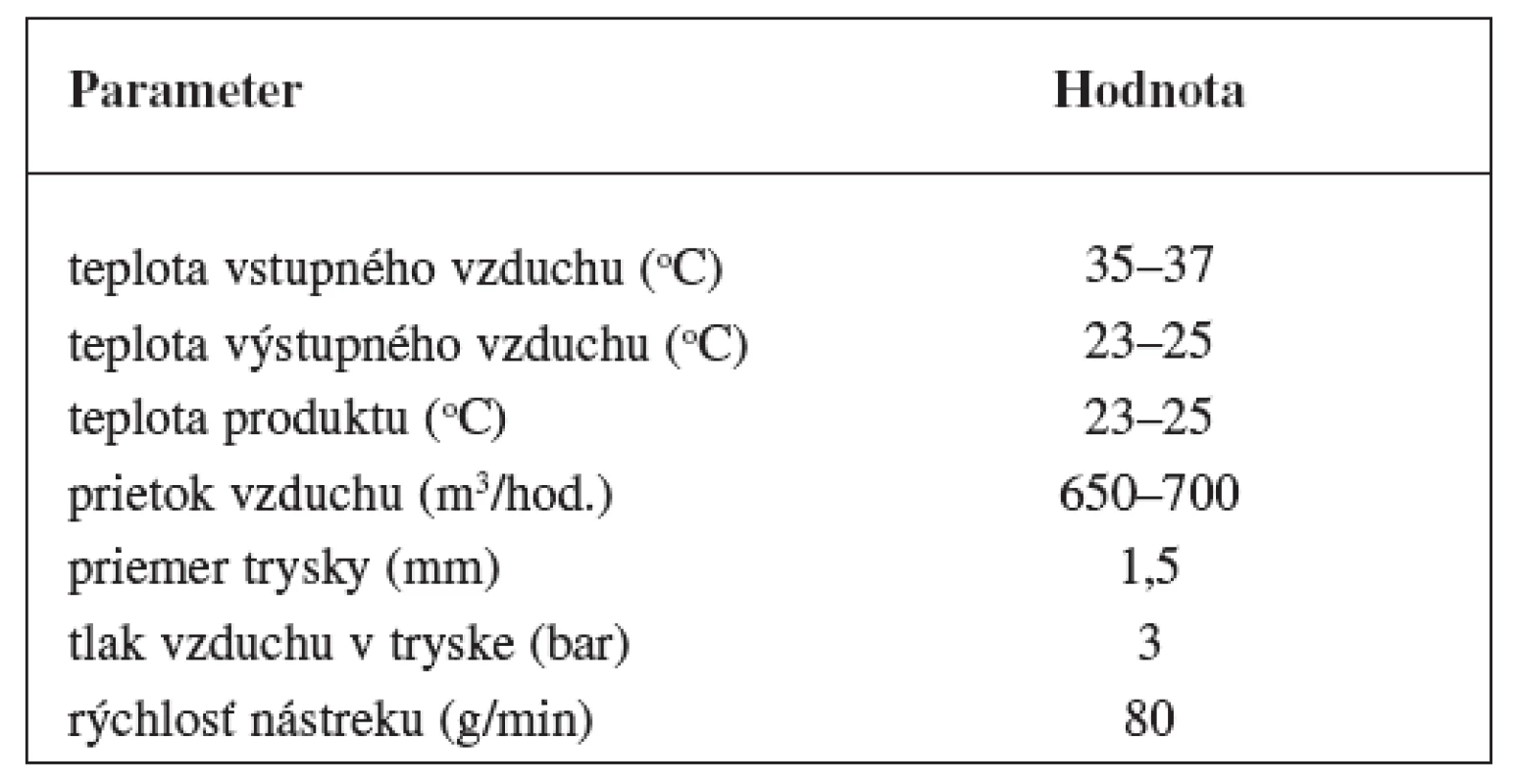
Príprava matricových tabliet
V prípade metoprololiumsukcinátu sa pripravili dve vzorky výliskov. Obalený granulát sa homogenizoval s klznou látkou koloidným oxidom kremičitým a antiadhezívom stearanom horečnatým v homogenizátore (HF 30) po dobu 5 minút. Druhá vzorka obsahovala plnivo – bezvodú laktózu DCL 21. Obidve vzorky tabletoviny sa lisovali na rotačnom tabletovacom lise (Killian). Pripravili sa výlisky s priemerom 12 mm.
V prípade matricových tabliet s obsahom metformíniumrochloridu (4 vzorky) sa obalený granulát homogenizoval s klznou látkou koloidným oxidom kremičitým a antiadhezívom stearanom horečnatým v homogenizátore (HF 30) po dobu 5 minút. Tabletovina sa lisovala na rotačnom tabletovacom lise (Killian) na tablety s dĺžkou 16 mm, šírkou 8 mm.
Pripravené výlisky spĺňali kritériá skúšky hmotnostnej a obsahovej rovnorodosti (SL1), odolnosť proti lomu sa pri obidvoch vzorkách výliskov pohybovala v rozpätí 120–150 N.
Disolučný test
Disolučný test matricových tabliet s obsahom metoprololiumsukcinátu sa realizoval miešadlovou aparatúrou pri 37 °C ± 0,5 °C, 50 rpm, disolučné médium 500 ml fosforečnanového tlmivého roztoku pH 6,8. Metoprololiumsukcinát sa stanovil spektrofotometricky, λ 274 nm.
V prípade výliskov s obsahom metformíniumchloridu sa použila košíková aparatúra, podmienky disolúcie: teplota 37 °C ± 0,5 °C, rýchlosť otáčok 100 rpm, disolučné prostredie 900 ml fosforečnanového tlmivého roztoku pH 6,8, metformíniumchlorid sa stanovil spektrofotometricky, λ 232 nm.
VÝSLEDKY A DISKUSIA
Profil uvoľňovania metoprololiumsukcinátu z matricových tabliet
Grafické znázornenie porovnania rýchlosti uvoľňovania liečiva z obaleného granulátu a z výliskov je znázornené na obrázku 1. V prípade obaleného granulátu sa prakticky celá dávka obsiahnutého liečiva uvoľnila do 8 hodín. Zlisovaním obaleného granulátu sa proces uvoľňovania modifikuje, liberácia liečiva sa signifikantne spomalila. Na časovej hladine 8. hodín sa uvoľnilo v priemere 30,5 % liečiva a v 20. hodine sa uvoľnilo 53 % z celkového množstva liečiva. Túto skutočnosť je možné vysvetliť vytvorením sekundárnej matricovej štruktúry polyméru vo výlisku, ktorá sa stáva prvkom riadiacim uvoľňovanie a modifikuje výsledný liberačný proces.
Obr. 1. Liberačné profily metoprololiumsukcinátu z obaleného granulátu a z matricových tabliet. 100 mg Eudragit® NE 30 D 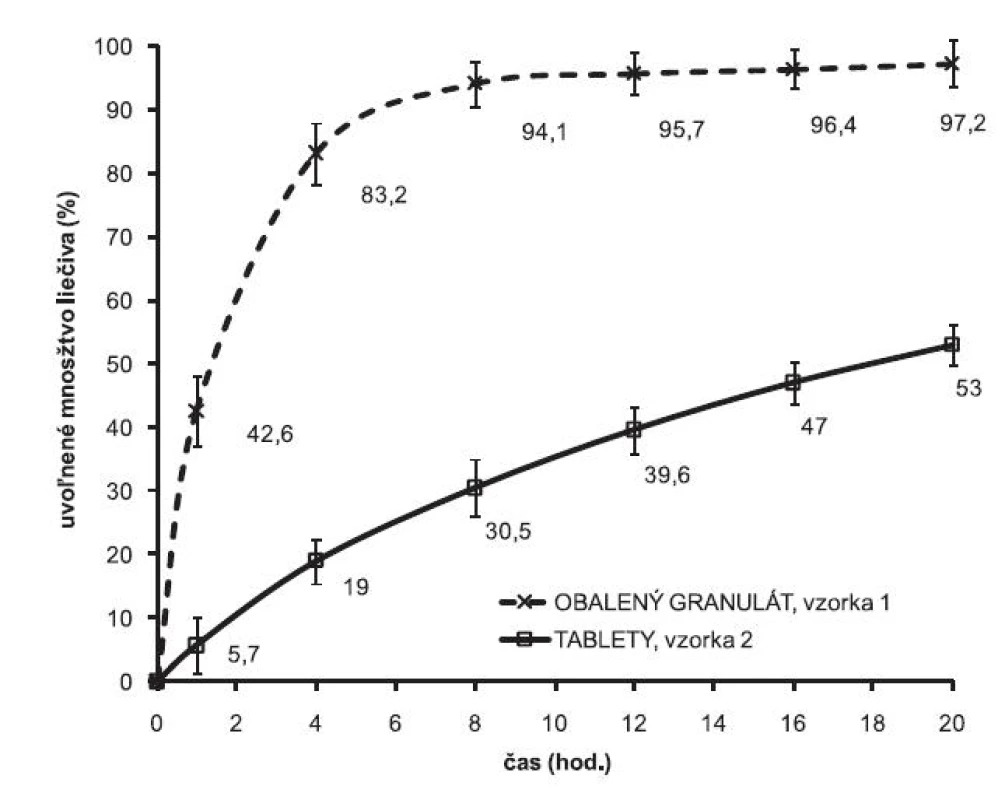
Keďže z matricovej tablety pripravenej zlisovaním obaleného granulátu sa uvoľnilo len 53 % liečiva testovala sa možnosť modifikácie liberačného procesu prídavkom rozpustného plniva laktózy DCL 21 v množstve 100 mg na 1 dávku (vzorka 3). Vplyv prítomnosti plniva na disolučný profil je znázornený na obrázku 2. Prítomnosť plniva sa prejavila zrýchlením liberačného procesu, kompletná dávka liečiva sa uvoľnila do 20. hodiny. Prídavkom plniva sa optimalizoval liberačný proces a pripravila sa lieková forma umožňujúca dávkovanie jeden krát denne. Zmenou formulácie sa ovplyvnila pórovitosť výlisku, čo sa premietlo v rýchlosti uvoľňovania, prakticky celá dávka liečiva sa uvoľnila do 20 hodín.
Obr. 2. Vplyv plniva na liberačné profily metoprololiumsukcinátu z matricových tabliet 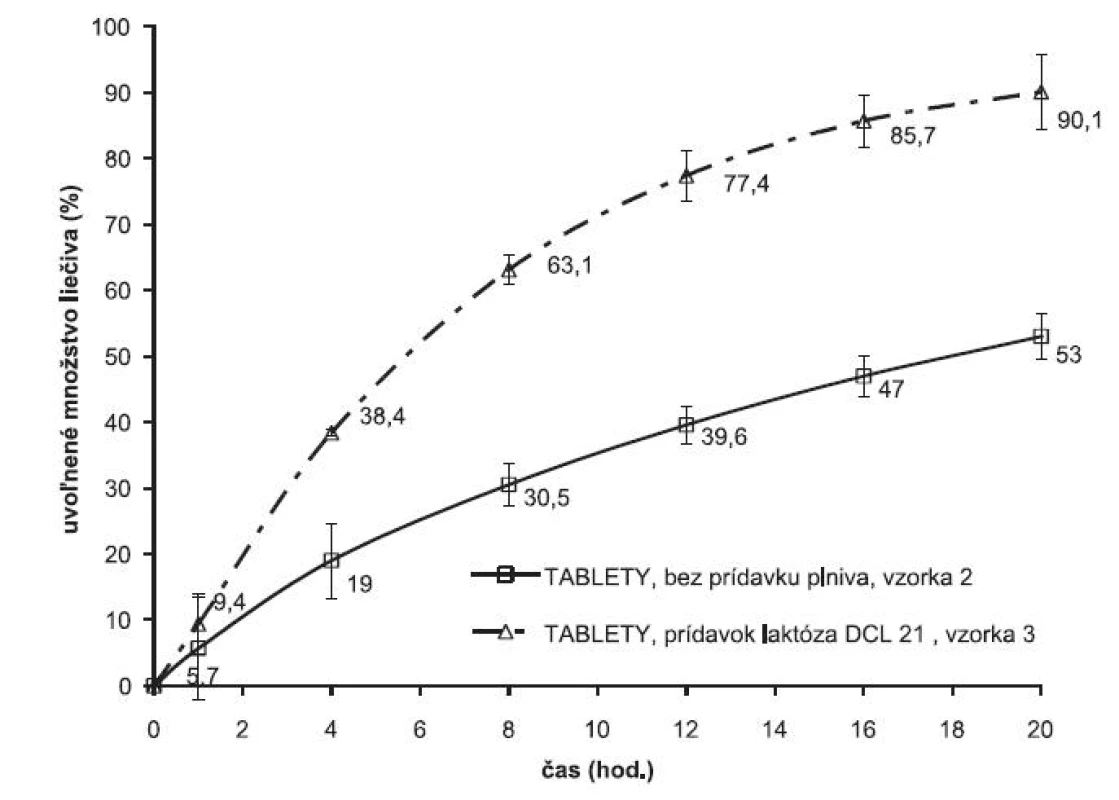
Profil uvoľňovania metformíniumchloridu z matricových tabliet
Druhým testovaným liečivom bol metformíniumchlorid. Pri príprave vzoriek sa použila rovnaká technológia ako v prípade metoprololiumsukcinátu s výnimkou prípravy granulátu, kedy sa granulovalo samotné liečivo. Porovnanie liberačného procesu z obaleného granulátu a z výliskov je na obrázku 3. Je tu analogická situácia, podobne ako v prípade metoprolóliumsukcinátu sa zaznamenal posun v rýchlosti liberácie liečiva z obalených zŕn a z experimentálnych výliskov. Zlisovaním granulátových zŕn metformíniumchloridu obalených primárnou membránou Eudragitu NE 30 D sa vytvorila sekundárna štruktúra, čo sa prejavilo spomalením rýchlosti uvoľňovania liečiva z výliskov, liberačný proces kontinuálne prebieha 20 hodín.
Obr. 3. Liberačné profily metformíniumchloridu z obaleného granulátu a z matricových tabliet. 100 mg Eudragit® NE 30 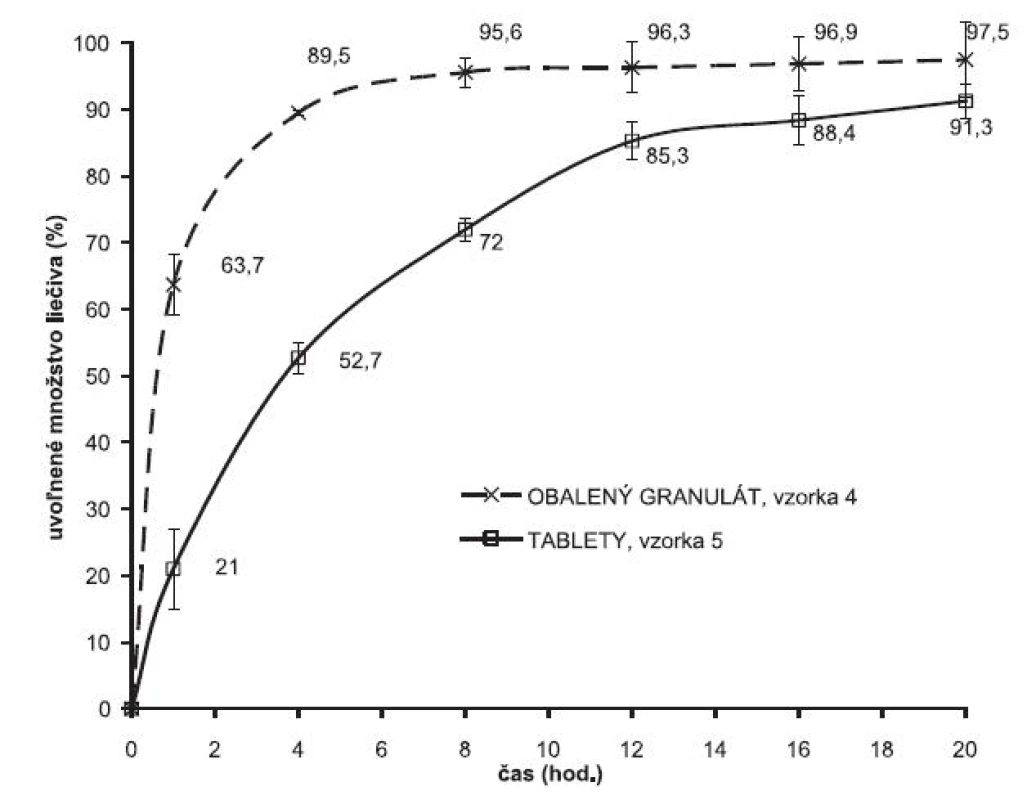
Závislosť rýchlosti uvoľňovania liečiva od množstva polyméru je v technológii známa. V experimente sa táto závislosť sledovala v súvislosti s optimalizáciou disolučného profilu liekovej formy metformíniumchloridu s dávkovacím režimom jeden krát denne. Obrázok 4 ilustruje vplyv množstva polyméru na liberáciu liečiva z matricovej tablety. Zvýšením množstva obalového polyméru sa rýchlosť uvoľňovania metformíniumchloridu z pripravenej matrice spomaľuje. Kým v prípade 40 mg polyméru sa liečivo z matricovej tablety kompletne uvoľnilo do 4 hodiny, pri dvojnásobnom množstve polyméru (80 mg Eudragitu NE) sa liberačný proces predĺžil na 12 hodín a zvýšením množstva polymérov na 120 mg sa v 20. hodine uvoľnilo len 78 % z celkového množstva liečiva. Zistilo sa, že optimálne množstvo polyméru je 100 mg.
Obr. 4. Liberačné profily metformíniumchloridu z matricových tabliet v závislosti od množstva polyméru 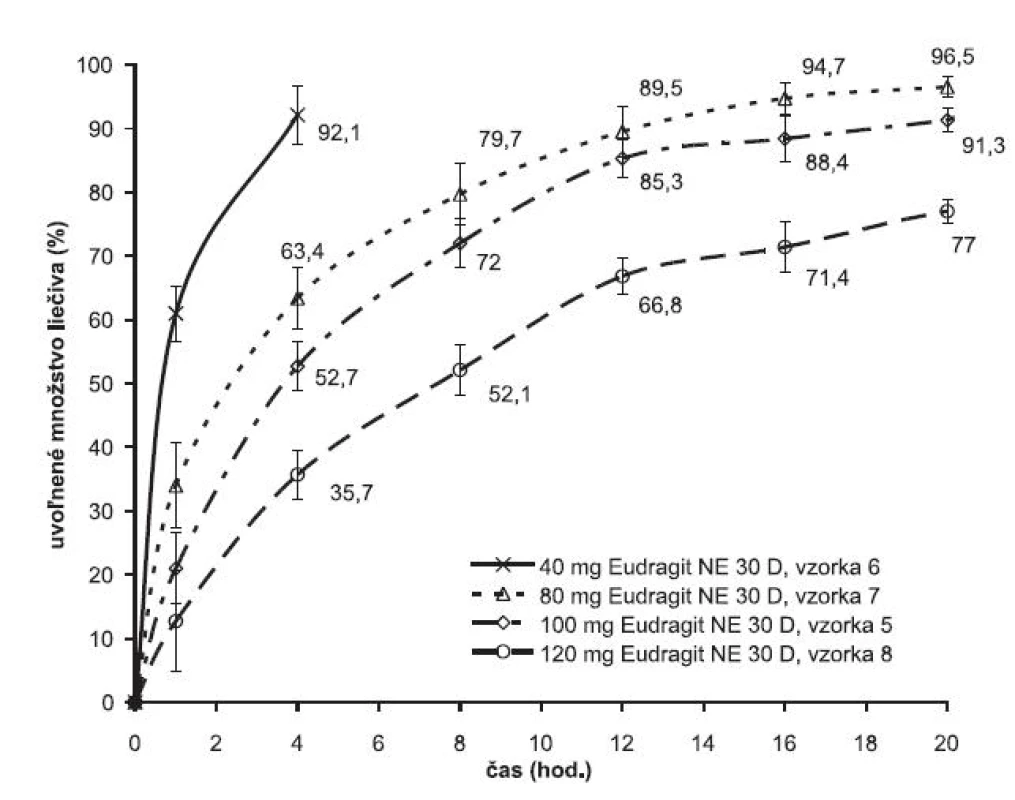
Formovanie filmu z vodných polymérnych disperzií je citlivé na procesné podmienky a úplná koalescencia filmu závisí od podmienok vyparovania rozpúšťadla počas nanášania obalu. Sušením po príprave je možné koalescenciu „dotvoriť“ – film sformovať. V prípade matricových tabliet s obsahom metformíniumchloridu a 100 mg Eudragitu NE 30 D (vzorka 5) sa sledoval vplyv dodatočného sušenia, tzv. „curingu“ na liberačný proces počas skladovania. Podobnosť disolučných profilov stabilitne sledovaných vzoriek vo zvolených odberových intervaloch po troch a šiestich mesiacoch v porovnaní s nezaťaženou vzorkou sa vyjadrila štatisticky faktorom zhody f2 vypočítaným podľa vzorca:
f2 = 50 × log{[1+(1/n)Σnt=1(Rt – Tt)2 ]-0,5 × 100},
kde n je počet testovaných časových bodov, Rt je priemerné percentuálne množstvo porovnávacej vzorky uvoľnené v čase t, Tt je priemerné percentuálne množstvo testovanej vzorky uvoľnené v čase t. Za podobné sa považujú dva disolučné profily, ak je hodnota f2 medzi 50 a 100 10).
Výsledky uvádza tabuľka 4, z ktorej vidno, že dodatočné sušenie obaleného granulátu pri 40 °C počas 24 hodín pozitívne ovplyvnilo stabilitu disolučného profilu počas skladovania. V prípade výliskov pripravených z obaleného granulátu bez dodatočného sušenia sa pozoroval pokles disolučného profilu už za bežných skladovacích podmienok (25 °C ± 2 °C, RV 60 % ± 5 %), faktor zhody po šiestich mesiacoch za bežných skladovacích podmienok f2 = 56,9 a za stresových skladovacích podmienok f2 = 47,8. V prípade výliskov obsahujúcich obalený granulát sušený 24 hodín pri 40 °C je disolučný profil stabilný aj za stresových skladovacích podmienkach (40 °C ± 2 °C, RV 75 % ± 5 %) počas sledovanej doby šesť mesiacov (f2 = 73,9).
Tab. 4. Vplyv „curingu“ na stabilitu liberačného profilu matricových tabliet s obsahom metformíniumchloridu 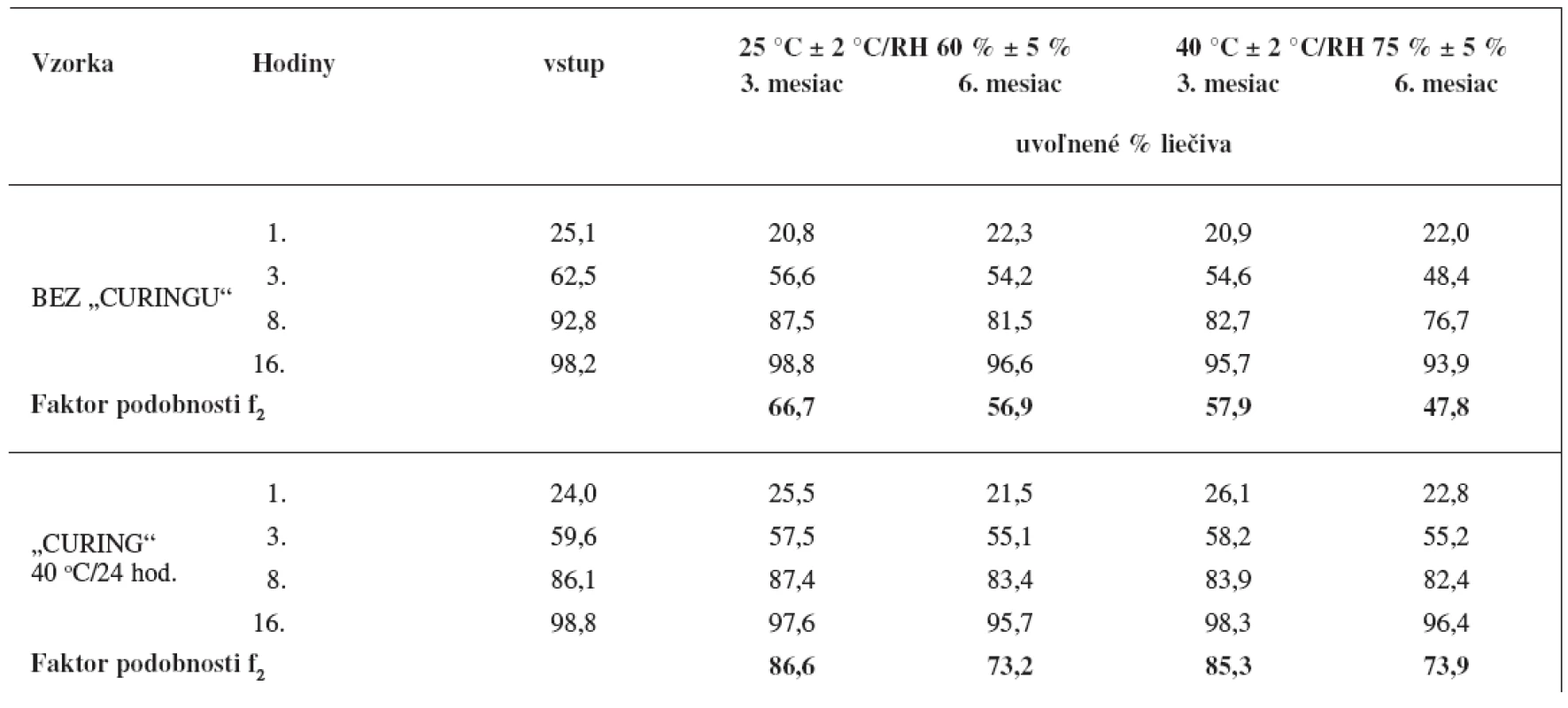
Z porovnania liberácie metformíniumchloridu z matricovej tablety pripravenej zlisovaním granulátu obaleného vodnou disperziou Eudragitu NE 30 D a prípravku používaného v terapeutickej praxi je vidno, že využitím uvedeného princípu modifikácie liberácie liečiva je možné pripraviť liekovú formu s charakteristikami liberácie podobnými prípravku dostupnému v terapeutickej praxi (obr. 5) (vzorka 5). Profil ovoľňovania metformíniumrochloridu zxperimentálnych výliskov odpovedá profilu referenčného prípravku Glucophage® XR 500.
Obr. 5. Porovnanie liberácie metformíniumchloridu z pripravenej formulácie a prípravku dostupnému v terapeutickej praxi 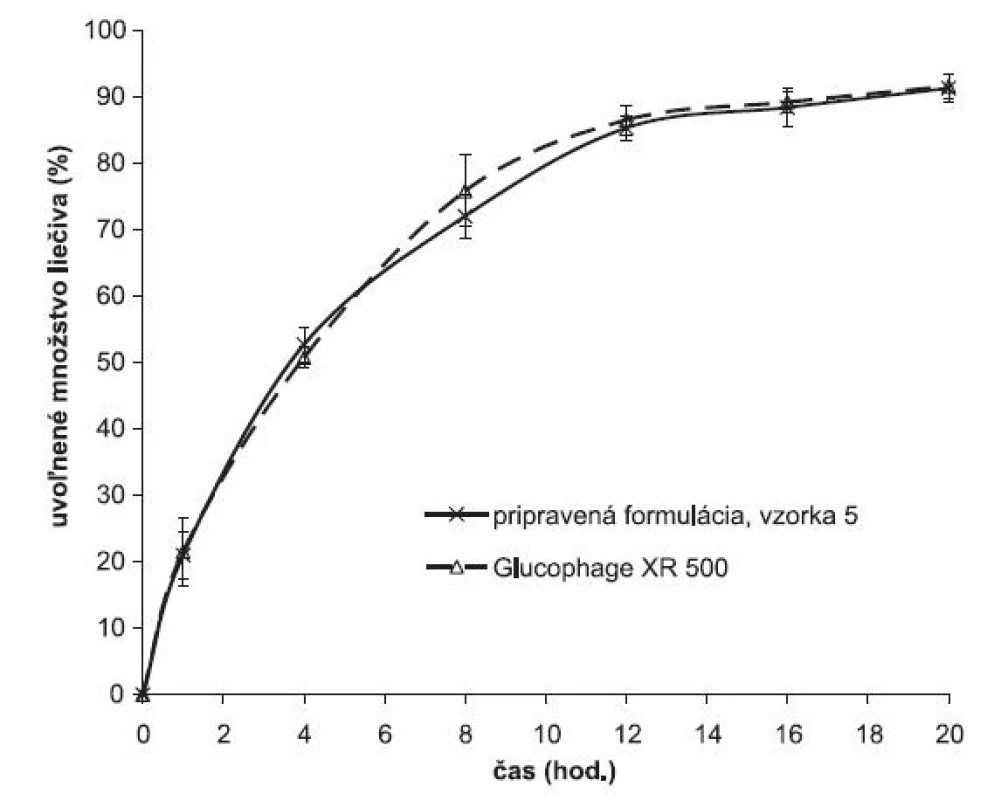
ZÁVER
Eudragit® NE 30 D je vhodný na prípravu matricových tabliet obsahujúcich veľmi dobre rozpustné liečivá metoprolóliumsukcinát a metformíniumchlorid. Zlisovaním granulátu obaleného polymérnym filmom sa formuje sekundárna štruktúra, ktorá modifikuje výsledný liberačný proces. Uvoľňovanie je v prípade obidvoch testovaných liečiv predĺžené na 20 hodín. Liberačný proces je možné modifikovať prídavkom plniva. Dodatočným sušením pri 40 oC počas 24 hodín sa zabezpečilo stabilné uvoľňovanie liečiva počas skladovania aj pri zvýšenej teplote a relatívnej vlhkosti.
Adresa pro korespondenci:
PharmDr. Beáta Vladovičová
Zentiva a.s.,
Nitrianska 100, 920 27 Hlohovec, SR
e-mail: beata.vladovicova@zentiva.sk
Zdroje
1. Rathbone, J. M., Hadgraft, J., Roberts, M. S.: Modified-Release Drug Delivery Technology. New York, Basel: Marcel Dekker, Inc. 2003; 1–962.
2. Martini, L., Close, M., Gravell, K.: Use of a hydrophobic matrix for the sustained release of a highly water soluble drug. Drug. Dev. Ind. Pharm., 2000; 26, 79–83.
3. Gryczová, E. et al.: Pellet starters in layering technique using concentrated drug solution. Drug Dev. Ind. Pharm. 2008; 34, 1381–1387.
4. Vetchý, D. , Rabišková, M.: Some variables influencing rotoagglomeration in miltiprocessor MP–1. Int. J. Pharm., 2002; 242, 353–356.
5. Bagchi, S., Squillante, E.: Effect of different formulation and processing factors on the permeability of Eudragit free films. AAPS Journal, 2002; 3108.
6. Ye, Z. W. et al.: Correlation between the permeability of metoprolol tartrate though plasticized isolated ethylcellulose / hydroxypropyl methylcellulose films and drug repase from reservoir pellets. European Journal of Pharmaceutics and Biopharmaceutics, 2007; 67, 485–490.
7. Levina, M., Palmer, F., Rajabi-Siahboomi, A.: Investigation of directly compressible metformine HCl 500 mg extended release formulation based on hypromellose. Controlled Release Society Annual Meeting, 2005; 1–3.
8. Felton, L. A.: Aqueous polymeric coatings for pharmaceutical dosage forms, vol. 176. New York: Informa Healthcare USA 2008; 237–277.
9. Ojoe, E. et al.: Formulation and in vitro evaluation of theophylline-Eudragit® sustained-release tablets. Rev. Bras. Cienc. Farm. Brazilian Journal of Pharmaceutical Science, 2005; 41, 377–384.
10. Dressman, J., Krämer, J.: Pharmaceutical dissolution testing. Boca Raton: Taylor and Francis group, 2005; 429.
11. Vitková, M., Chalabala, M.: Štúdie o iekových mikroformách. XXIII. uvoľňovanie liečiv z ásobných liekových foriem. Českoslov. Farm., 1991; 40, 156–158.
12. Krejčová, K. et al.: Vliv typu polymerové disperze na uvolňování diklofenaku sodné soli z obalených pelet. Čes. slov. Farm., 2007; 56, 190–199.
13. Amighi, K., Moes, A.: Influence of plasticizer concentration and storage conditions on the drug release rate from Eudragit RS 30 D film-coated sustained-release theophylline pellets. Eur. J. Pharm. Biopharm., 1996; 42, 29–35.
14. Wurster, D. E., Bhattacharjya, S., Flanagan, D. R.: Effect of curing on water diffusivities in acralyte free films as measured via a orption technique. AAPS Pharm. Sci. Tech., 2007; 8, Article 71.
15. Lin, A. Z. et al.: Study of the effect of curing and storage conditions on controlled repase diphenhydramine HCl pellets coated with Eudragit NE 30 D. Pharm. Dev. Technol., 2003; 8, 277–287.
Štítky
Farmácia Farmakológia
Článek NOVÉ KNIHY
Článok vyšiel v časopiseČeská a slovenská farmacie

2010 Číslo 4-
Všetky články tohto čísla
- Antimikróbne pôsobiace látky produkované baktériami mliečneho kvasenia
-
Standardní receptura pro přípravu léčivých přípravků v lékárnách IV
Čím může být užitečná sbírka Formularium hospitale
- Řízené uvolňování léčiv z lékových forem obalených vodnými celulosovými a akrylátovými polymerními disperzemi
- Development of a treatment of pregnant women suffering from epilepsy in the region of Ostrava between the years 1991 and 2006
- Technológia tabliet s riadeným uvoľňovaním s obsahom veľmi dobre rozpustných liečiv
-
Pracovní den Sekce přírodních léčiv České farmaceutické společnosti ČLS JEP
Hradecký den léčivých rostlin
Hradec Králové, 11. červen 2010
- Farmaceuti rokovali v Ružomberku
- NOVÉ KNIHY
- Doc. RNDr. Marián Bukovský, PhD. jubiluje
- Jaroslav Květina – osmdesátiletý
- Česká a slovenská farmacie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle-
Standardní receptura pro přípravu léčivých přípravků v lékárnách IV
Čím může být užitečná sbírka Formularium hospitale
- Technológia tabliet s riadeným uvoľňovaním s obsahom veľmi dobre rozpustných liečiv
- Řízené uvolňování léčiv z lékových forem obalených vodnými celulosovými a akrylátovými polymerními disperzemi
- Antimikróbne pôsobiace látky produkované baktériami mliečneho kvasenia
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



