-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Farmaceutické aspekty živočíšnej lipoxygenázy
Farmaceutické aspekty živočíšnej lipoxygenázy
Lipoxygenases (LOX, plant LOX [EC 1.13.11.12], linoleate: oxygen oxidoreductase, animal LOXs [5-LOX, EC 1.13.11.34; 8-LOX, EC 1.13.11.40; 12-LOX, EC 1.13.11.31; 15-LOX, EC 1.13.11.33], arachidonate: oxygen oxidoreductase) belong to the family of structurally related dioxygenases containing non-heme and non-sulfide iron in the active site. LOX catalyzes the regiospecific and stereospecific insertion of molecular oxygen into the molecule of unsaturated fatty acid with the (1Z,4Z)-penta-1,4-diene structural unit in its aliphatic chain. The result of this reaction is the production of conjugated optically active (S) - or (R)-hydroperoxides of polyunsaturated fatty acids. The occurrence of LOX was determined in plants, in animals, and also in lower organisms such as mushrooms, corals and bacteria. The dominant substrate of animal LOX is arachidonic acid which is released from membrane phospholipids by phospholipase A2 or enters the cell from the extracellular space. Products of the arachidonic acid cascade can play an important role in the pathogenesis of different diseases such as asthma bronchiale, psoriasis and inflammatory diseases, cancer diseases, atherosclerosis, diabetes mellitus and renal diseases.
Key words:
lipoxygenase – isoenzyme – inhibition – pathogenesis of different diseases
Autoři: Marek Obložinský; Lýdia Bezáková; Renáta Kollárová
Působiště autorů: Farmaceutická fakulta Univerzity Komenského v Bratislave, Katedra bunkovej a molekulárnej biológie liečiv
Vyšlo v časopise: Čes. slov. Farm., 2011; 60, 116-124
Kategorie: Přehledy a odborná sdělení
Souhrn
Lipoxygenázy (LOX, rastlinná LOX [EC 1.13.11.12], linoleate: oxygen oxidoreductase, živočíšne LOX [5-LOX, EC 1.13.11.34; 8-LOX, EC 1.13.11.40; 12-LOX, EC 1.13.11.31; 15-LOX, EC 1.13.11.33], arachidonate: oxygen oxidoreductase) sa zaraďujú do rodiny štrukturálne príbuzných dioxygenáz, ktoré obsahujú v aktívnom centre nehémové a nesulfidové železo. LOX katalyzuje polohovošpecifickú a stereošpecifickú inzerciu molekulového kyslíka do molekuly nenasýtenej mastnej kyseliny s (1Z,4Z)-penta-1,4-diénovou štrukturálnou jednotkou v alifatickom reťazci. Výsledkom tejto reakcie je tvorba konjugovaných, opticky aktívnych (S) - alebo (R)-hydroperoxidov polynenasýtených mastných kyselín. Prítomnosť LOX bola dokázaná v rastlinnej ríši, u živočíchov, ale aj u nižších organizmov, ako sú napr. huby, koraly a baktérie. Dominantným substrátom živočíšnej LOX je kyselina arachidónová, ktorá je uvoľňovaná z membránových fosfolipidov prostredníctvom fosfolipázy A2, alebo sa do bunky dostane z extracelulárneho prostredia. Produkty kaskády kyseliny arachidónovej môžu zohrávať významnú úlohu v patogenéze rozličných ochorení, ako je napr. asthma bronchiale, psoriáza a zápalové ochorenia, nádorové ochorenia, ateroskleróza, diabetes mellitus a renálne ochorenia.
Kľúčové slová:
lipoxygenáza – izoenzýmy – inhibícia – patogenéza rôznych ochoreníÚvod
Lipoxygenáza (LOX, rastlinná LOX [EC 1.13.11.12], linoleate: oxygen oxidoreductase, živočíšne LOX [5-LOX, EC 1.13.11.34; 8-LOX, EC 1.13.11.40; 12-LOX, EC 1.13.11.31; 15-LOX, EC 1.13.11.33], arachidonate: oxygen oxidoreductase) patrí do rodiny štrukturálne príbuzných dioxygenáz obsahujúcich v aktívnom centre nehémové a nesulfidové železo. LOX katalyzuje polohovošpecifickú a stereošpecifickú inzerciu molekulového kyslíka do molekuly nenasýtenej mastnej kyseliny (MK) s (1Z,4Z)-penta-1,4-diénovou štrukturálnou jednotkou v alifatickom reťazci MK, a to za tvorby konjugovaných, opticky aktívnych (S) - alebo (R)-hydroperoxidov polynenasýtených MK 1, 2) (obr. 1). Podľa novších poznatkov môžu byť substrátmi LOX nielen voľné MK, ale aj MK prítomné vo viazanej forme vo fosfolipidoch membrán alebo lipoproteínoch 3).
Obr. 1. Hydroperoxidácia (1Z,4Z)-penta-1,4-diénovej štrukturálnej jednotky v alifatickom reťazci MK (R,R’: alifatický zvyšok, S,R: stereošpecifické označenie) 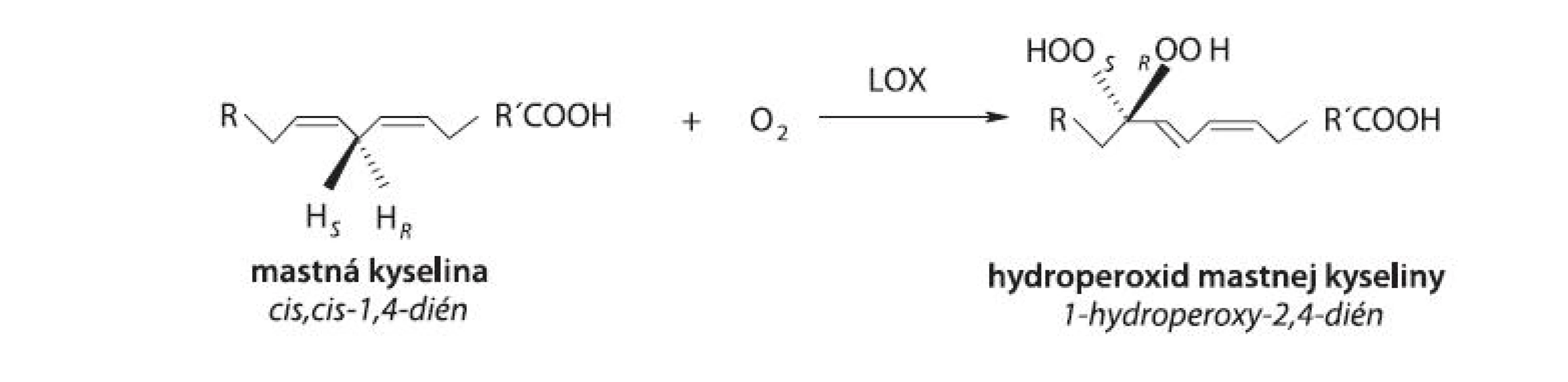
LOX sú rozšírené v ríši rastlín 4) i živočíchov 5), a boli popísané aj u nižších organizmov ako sú napr. huby 6), koraly 7) a baktérie 8).
K hlavným polynenasýteným MK s viacerými dvojitými väzbami (PUFA, polyunsaturated fatty acids) u cicavcov patrí kyselina arachidónová (AA). V rámci kaskády AA sa rozlišujú tri základné vetvy zahŕňajúce enzýmami kontrolovanú tvorbu eikozanoidov. Jedná sa o LOX (tzv. linearizujúca cesta), cyklooxygenázu (COX) (tzv. cyklizujúca cesta) a cytochróm P450 (CYP) (tzv. CYP-cesta) (obr. 2).
Obr. 2. Schematická kaskáda AA pri tvorbe eikozanoidov 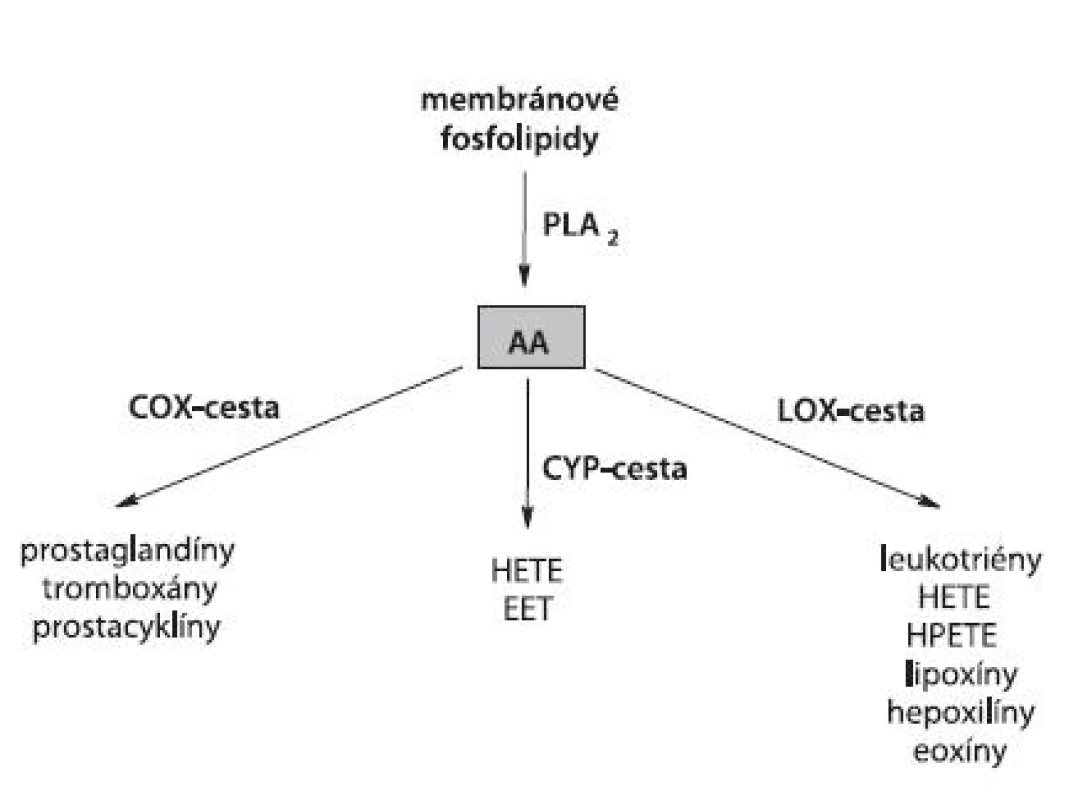
Úlohy a funkcie LOX v patogenéze rôznych ochorení
Produkty kaskády AA, ktorá je dominantným substrátom živočíšnej LOX, môžu zohrávať významnú úlohu v patogenéze rozličných ochorení, ako je napríklad asthma bronchiale, psoriáza a zápalové ochorenia, nádorové ochorenia, ateroskleróza, diabetes mellitus a renálne ochorenia 9).
Bunková diferenciácia: 15-LOX z králičích retikulocytov bola identifikovaná ako agens, ktorý je zodpovedný za deštrukciu mitochondrií počas ich zrenia na erytrocyty. Mechanizmus uvedeného procesu sa vysvetľuje ako dôsledok oligomerizácie a integrácie LOX do fosfolipidovej dvojvrstvy membrán mitochondrií, následkom čoho v nich vznikajú hydrofilné póry a dochádza k deštrukcii membrán. K podobnému procesu deštrukcie organel môže dochádzať v očných šošovkách počas ich zrenia 10). Niektoré štúdie naznačujú, že 15-LOX zasahuje podobným mechanizmom aj do diferenciácie keratinocytov a ľudských tracheobronchiálnych buniek 11).
Bronchiálne ochorenia: Hlavné produkty kaskády AA zohrávajú dôležitú úlohu v rozvoji zápalu dýchacích ciest pri astme 12). Od identifikácie pomaly reagujúcej substancie anafylaxie (SRS-A) ako zmesi leukotriénov C4, D4, E4 (LTC4/LTD4/LTE4) (ktoré sú výsledkom aktivity 5-LOX), sa výskum v rámci štúdia astmy sústreďuje práve na tento kľúčový enzým. Je známe, že bronchiálna hyperaktivita nie je spôsobená len zvýšeným uvoľňovaním mediátorov bronchokonstrikcie a zápalu, ale aj zvýšenou senzitivitou bronchiálnych receptorov voči týmto mediátorom. V pľúcnych epiteliálnych bunkách dochádza k expresii 5-LOX a 15-LOX, ktorých metabolitmi sú napríklad kyselina 5-hydroxyeikozatetraénová (5 HETE), 15-HETE a leukotriény 13, 14). Expresia týchto enzýmov je pritom v rozličných typoch buniek prísne regulovaná 15, 16). Expresia 15-LOX je signifikantne zvýšená v bronchiálnych epiteliálnych bunkách a v eozinofiloch u pacientov s astmou a emfyzémom. V porovnaní so zdravými jedincami bola následne u týchto pacientov pozorovaná vysoká koncentrácia 15-HETE 17, 18). Niektoré štúdie ukazujú, že 15-LOX sa zapája do rôznych patologických procesov aj pri ďalších bronchiálnych ochoreniach – ako napr. bronchitída a chronická obštrukčná choroba pľúc 19, 20).
Psoriáza a zápalové ochorenia: Pri psoriáze a iných proliferatívnych dermatózach je kaskáda AA charakterizovaná zvýšenou tvorbou nezvyčajného produktu 12(R)--HETE 21). Uvoľňovanie 12(R)-HETE do postihnutého tkaniva je výsledkom aktivity 12R-LOX v psoriatických léziách 22). V zdravom ľudskom tkanive je aktivita 12R LOX takmer nedetegovateľná. U pacientov s kongenitálnou ichtysioformnou erytrodermatitídou a s vrodenou kožnou chorobou s poruchou keratinizácie boli v niektorých štúdiách identifikované mutácie v regióne génu pre 12R-LOX (ALOX12B) 23). Zvýšené hladiny 15 HETE sú zase spájané so zápalovými procesmi pri ľudskej proktokolitíde 24, 25). K expresii 15S-LOX a tvorbe 15(S)-HETE dochádza aj v synoviocytoch u jedincov s reumatoidnou artritídou B 26).
Nádorové ochorenia: Zvýšená expresia 12S-LOX (doštičkový typ) je často pozorovaná pri rakovine prostaty, pričom miera expresie enzýmu je vo vzájomnom vzťahu so stupňom štádia ochorenia 27). Zvýšená tvorba biologicky aktívneho metabolitu 12(S)-HETE, ktorá je odpoveďou na zvýšenú aktivitu 12S-LOX, zodpovedá za progresiu rakoviny prostaty prostredníctvom modulácie bunkovej proliferácie, ktorá indukuje angiogenézu a spôsobuje následné metastázy do iných tkanív 28, 29). Inhibícia enzýmu 12S-LOX môže pritom zredukovať spomínané dva procesy 27). Zvýšená expresia 12S-/15S--LOX bola pozorovaná v tkanive karcinómu hrubého čreva 30–32). Výsledky ďalších štúdií poukázali na to, že 5 LOX zase zohráva dôležitú úlohu v orálnej karcinogenéze 33).
Ateroskleróza: LOX môže významne prispievať k patofyziologickému progresu aterosklerózy, a to oxidáciou lipoproteínov s nízkou hustotou (LDL) a produkciou prozápalových leukotriénov 34). Známym faktom je, že 15S-LOX oxiduje v in vitro podmienkach LDL na aterogénnu formu. Ľudské aterosklerotické lézie pritom preukázali prítomnosť aktivity 12S/15S-LOX. Prítomnosť mRNA pre 12S/15S-LOX bola navyše zistená aj pri použití rôznych zvieracích modelov 35). Štúdium kaskády AA pri izoenzýme 5-LOX zase ukázalo, že tento enzým je aktívny v rozličných štádiách aterosklerózy, počínajúc iniciáciou vaskulárnej lézie, ďalej v štádiu rastu a bunkovej proliferácie vo vnútri lézie, a aj počas destabilizácie plakov, ktorá vedie k ich ruptúre 36). Signifikantnú úlohu génu pre 5-LOX v patogenéze aterosklerózy potvrdili aj štúdie na experimentálnych hyperlipidemických myšacích modeloch, kde absencia iba jednej alely pre 5-LOX zabezpečila silnú ochranu pred vývojom aterosklerózy u väčšiny zvierat 37).
Diabetes mellitus: In vitro štúdie ukázali, že glukóza zvyšuje aktivitu 12/15-LOX 38). U pacientov s diabetom bol zaznamenaný nárast hladín 12-HETE, ktorá zvyšuje interakciu monocytov s cievnym endotelom, čo vedie k rozvoju aterosklerózy, hlavnej komplikácie diabetes mellitus 35). Modulácia aktivity 12/15-LOX v cievnej stene by tak mohla viesť k predchádzaniu skorých vaskulárnych zápalových komplikácií u diabetu. Pri inzulín-dependentnom diabete (diabetes mellitus I. typu) sú inzulín-produkujúce ß-bunky Langerhansových ostrovčekov v pankrease zničené cytokínmi závislými na autoimunitných procesoch. Cytokíny, ktoré sa na tom podieľajú, sú interleukín 1ß (IL-1ß), interferón γ (IFN-γ) a faktor nekrotizujúci tumor α (TNF-α). Mechanizmus uvedeného procesu sa vysvetľuje ako dôsledok aktivácie oxidu dusnatého 39). IL-1ß zvyšuje expresiu 12/15-LOX v potkaních bunkových líniách a v čerstvo izolovaných ß bunkách Langerhansových ostrovčekov 40). Zvýšenie expresie mRNA pre 12/15-LOX ako aj produktov jej katalytického účinku (predovšetkým 12-HETE) bol pozorovaný po liečbe IL-1ß. Avšak niektorí autori nesúhlasia s touto teóriou a tvrdia, že zvýšená produkcia 12-HETE je dôsledok zvýšenej dostupnosti substrátu NO-sprostredkovanej cesty, a nie následok zvýšenia enzýmovej aktivity 12-LOX 41). U myší s deficitom 12/15-LOX bola pozorovaná vysoká odolnosť voči streptozotocínom indukovanej cukrovke 42), pričom u pacientov trpiacich týmto ochorením bola pozorovaná zvýšená hladina 12 HETE 43). Iná situácia týkajúca sa 12/15-LOX je pri non-inzulín dependentnom diabete (diabetes mellitus II. typu). Hepoxilín totiž indukuje produkciu inzulínu 44) a 12-HETE indukuje produkciu glukagónu v α bunkách Langerhansových ostrovčekov pankreasu 45).
Renálne ochorenia: Niektoré ochorenia obličiek sa spájajú so zvýšenou aktivitou 5-LOX, nakoľko kľúčovým mediátorom v patofyziológii renálnej dysfunkcie spôsobenej ischémiou obličiek je práve LTB4. Tento leukotrién je zodpovedný za infiltráciu obličiek polymorfonukleárnymi bunkami (PMN) 46). LTB4 totiž indukuje expresiu adhezívnych molekúl, a tým aktivuje PMN-bunky, ktoré následne menia svoj tvar a viažu sa na endotel. Po transmigrácii týchto buniek do ischemického renálneho tkaniva začnú PMN-bunky uvoľňovať reaktívne kyslíkové radikály, proteázy, elastázy, myeloperoxidázy, cytokíny a iné mediátory, ktoré vyvolávajú zápal a prispievajú k poškodeniu tkaniva 47). Niektoré štúdie preukázali, že 40 % pacientov s glomerulonefritídou má signifikantne zvýšenú aktivitu 5-LOX a 5-LOX aktivujúci proteín (FLAP). Porovnanie s klinickými údajmi ukázalo, že pacienti so zvýšenou expresiou 5-LOX a FLAP mali zníženú glomerulárnu filtráciu, zvýšené hladiny močoviny v krvi, kreatinínu v sére a trpeli proteínúriou 48).
Inhibícia LOX
Ako vyplýva z vyššie uvedených informácií, LOX a produkty jej katalytického účinku majú celý rad nežiadúcich efektov. Veľká pozornosť je preto venovaná výskumu a vývoju jej inhibítorov, ktorých pozornosť sa vo veľkej miere sústreďuje najmä na 5-LOX.
Selektívna inhibícia LOX
Mechanizmus účinku nesteroidných protizápalových látok (NSAID) spočíva v inhibícii katalytickej aktivity COX, ktorá je kľúčovým enzýmom biosyntézy prostanoidov z AA. AA je uvoľňovaná z fosfolipidov bunkovej membrány prostredníctvom fosfolipázy A2 (PLA2), avšak nie je len substrátom pre tvorbu prostanoidov COX-cesty, ale aj iných eikozanoidov LOX-cesty (kyselina hydroperoxyeikozatetraénová HPETE, HETE, leukotriény, lipoxíny, epi-lipoxíny, hepoxilíny, eoxíny). Jednotlivé účinky týchto biologicky aktívnych zlúčenín sú úzko prepojené so zápalovým procesom. Ich zvýšená tvorba je pritom nežiadúcim faktorom v rámci terapie rôznych zápalových ochorení. Mnohé z LOX-inhibítorov vykazujú zlepšenie funkcií dýchacích ciest, zmierňujú symptómy astmy a znižujú potrebu liečby u pacientov s ľahkou až strednou astmou. Avšak v prípade chronických zápalových procesov tieto látky zlyhávajú, a to aj pri vysokých dávkach pri silnej inhibícii syntézy leukotriénov. LOX-inhibítory možno rozdeliť do nasledovných kategórií:
- vychytávače voľných kyslíkových radikálov (redoxné inhibítory),
- zlúčeniny viažúce sa na centrálny atóm železa v aktívnom centre enzýmu (železo viažúce inhibítory),
- štrukturálne analógy substrátu a produktov (substrátové a produktové analógy),
- tzv. FLAP-inhibítory,
- duálne inhibítory.
Inhibítory LOX
Vychytávače voľných kyslíkových radikálov
Tieto zlúčeniny pôsobia väčšinou tak, že tvoria radikály s nízkou energiou, a takto interferujú s kaskádou AA v rámci linearizujúcej vetvy LOX-cesty. Mnohé inhibítory pôsobia ako zhášače reťazovo vznikajúcich peroxidových radikálov (lipid O-O). Ide o látky s nízkym redoxným potenciálom (napr. organické zlúčeniny typu fenolov, chinónov, hydrochinónov a pod.). Uvedené redoxné inhibítory vykazujú len slabú selektivitu pre 5 LOX vzhľadom na COX. Navyše napriek vysokej in vitro aktivite sú v in vivo podmienkach (pri p.o. podávaní) často slabé alebo neaktívne.
Rozsiahlou skupinou rastlinných inhibítorov LOX sú flavonoidy (obr. 3). V tabuľke 1 sú uvedené niektoré vybrané flavonoidné inhibítory. Reťazová radikálová reakcia je kontrolovaná najmä vychytávaním voľných radikálov fenolickými hydroxylmi antioxidantov 49, 50). Z jednoduchých analýz vyplýva, že sila väzby O-H v hydroxylovej skupine reprezentuje schopnosť hydroxylovej skupiny zachytávať voľné radikály 51). Čím je slabšia, tým je antioxidant aktívnejší.
Obr. 3. Všeobecná štruktúra flavonoidov 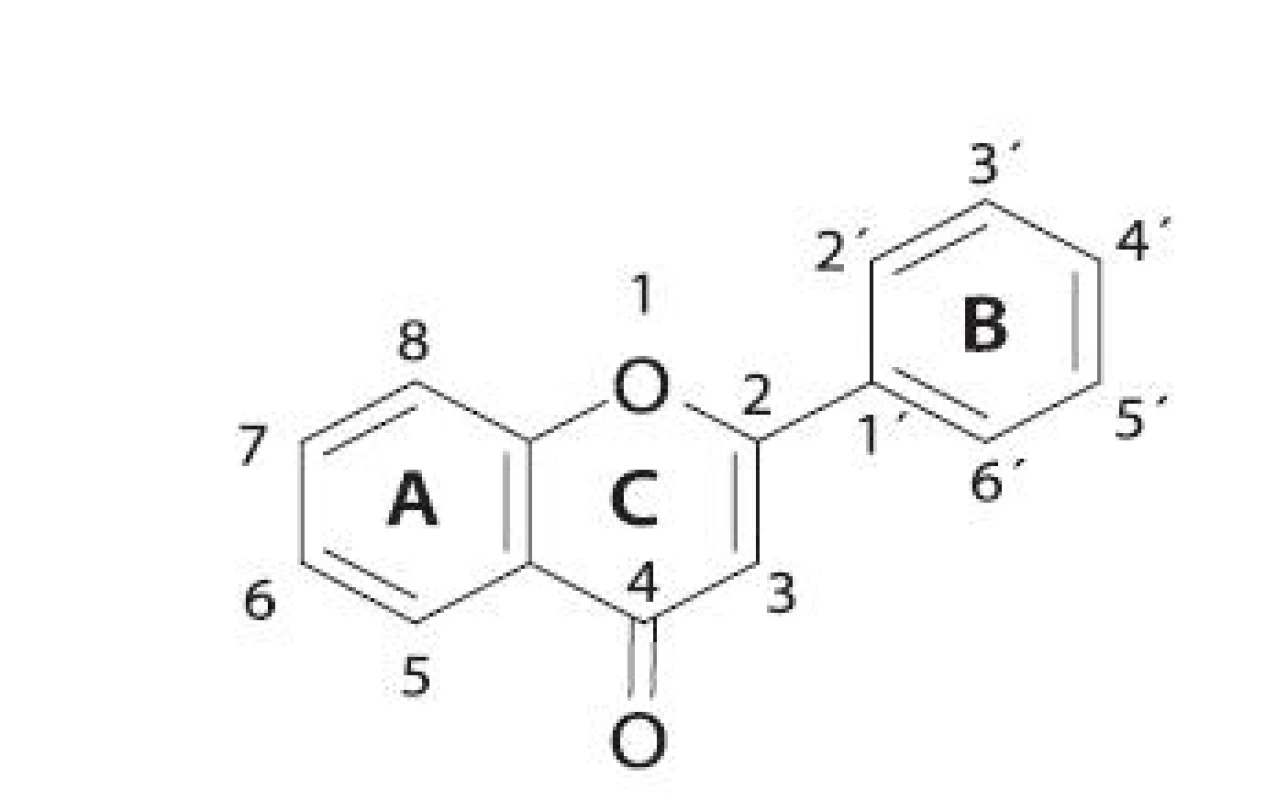
Tab. 1. Flavonoidné inhibítory LOX 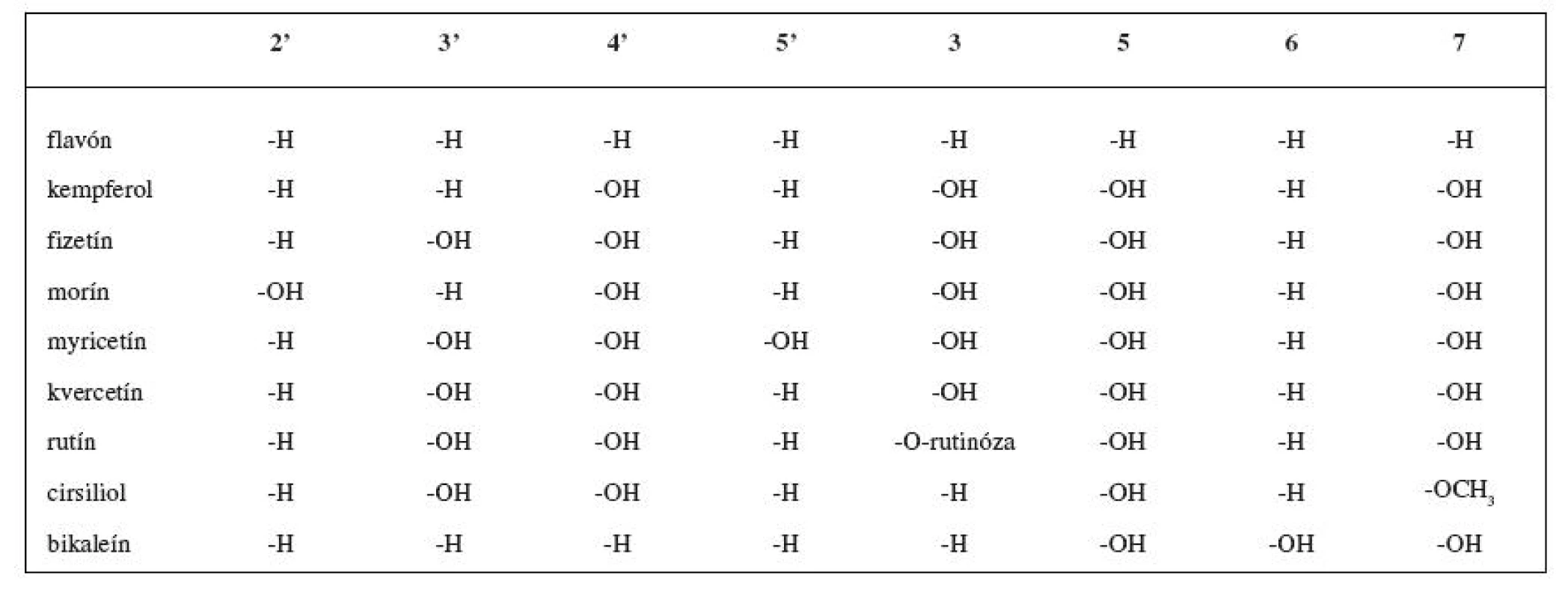
Indexy charakterizujúce silu väzby O-H (poriadok väzby, dĺžka väzby) môžu byť použité ako parametre na vyhľadávanie nových antioxidantov 52). Polyfenolické zlúčeniny, ku ktorým patrí aj veľká skupina flavonoidov, sú zastúpené v zelenine, ovocí, víne a v čaji. Tieto zlúčeniny sú všeobecne známe svojimi antioxidačnými vlastnosťami. Aj napriek príjmu vysokokalorickej stravy je výskyt kardiovaskulárnych ochorení vo Francúzsku v porovnaní s inými západnými krajinami až zarážajúco nízky 53). Tento jav (tzv. „francúzsky paradox“) sa pripisuje konzumácii červeného vína, ktoré obsahuje oveľa väčšie množstvo polyfenolov ako biele víno 54). Zlúčeniny ako resveratrol, kvercetín, katechín a proantokyanidíny, ktoré sú obsiahnuté v hroznových šupkách a semienkach, majú schopnosť inhibovať agregáciu trombocytov a zabraňujú oxidácii LDL 55). Medzi inhibítory štruktúrne podobné flavonoidom (ktoré pôsobia rovnakým mechanizmom účinku) patrí aj kyselina kávová, kyselina nordihydroguajaretová (NDGA) a eskuletín.
Popri vyššie uvedených prírodných zlúčeninách sú však prototypom tejto skupiny fenidón a indazolínové deriváty 56). Veľkým problémom týchto redoxných inhibítorov je však to, že reagujú s ostatnými biologickými redoxnými systémami, čoho dôsledkom je aj tvorba methemoglobínu. Zmena redoxného potenciálu pomocou substitúcie funkčných skupín viedla k odstráneniu tvorby methemoglobínu, avšak zlúčeniny boli zle rozpustné a slabo sa absorbovali. Preto nenašli uplatnenie na trhu, i keď sa ponúka možnosť ich využitia pri liečbe psoriázy 57).
Zlúčeniny viažúce sa na centrálny atóm železa v aktívnom centre enzýmu
Pri hľadaní látok schopných inhibovať LOX sa vychádzalo aj z predpokladu, že vytvorenie stabilného komplexu medzi iónom železa v aktívnom centre LOX a chelátotvornou funkčnou skupinou ligandu znemožní väzbu prirodzeného substrátu na enzým. Ebselén (2-fenyl-1,2-benzizoselenazol-3(2H)-ón) je selénová organická zlúčenina (obr. 4) nízkej toxicity, ktorá má zaujímavý farmakologický profil 58). Ebselén bol pôvodne vyvinutý ako protizápalové liečivo 59), ale boli zaznamenané aj iné zaujímavé farmakologické aktivity, ako je napríklad neuroprotektívny efekt 60). Ebselén je schopný inhibovať niekoľko enzýmov participujúcich na zápalovej reakcii, ako sú napr. NADPH-oxidáza, NO-syntáza, 5-LOX a 15-LOX 58). Ukázalo sa, že mechanizmus inhibície aktivity 5-LOX a 15-LOX je dvojaký 61):
- v prítomnosti glutatiónu prevláda nepriama inhibícia založená na tom, že ebselén redukuje bunkové hydroperoxidy na príslušné alkoholy, a tým je odstránená ich potenciálna schopnosť oxidovať LOX z neaktívnej formy Fe2+ na aktívnu formu Fe3+;
- priama inhibícia prostredníctvom tvorby stabilného komplexu medzi iónom železa v aktívnom centre LOX a ebselénom, čím vznikne katalyticky inaktívny komplex.
Obr. 4. Chemická štruktúra ebselénu 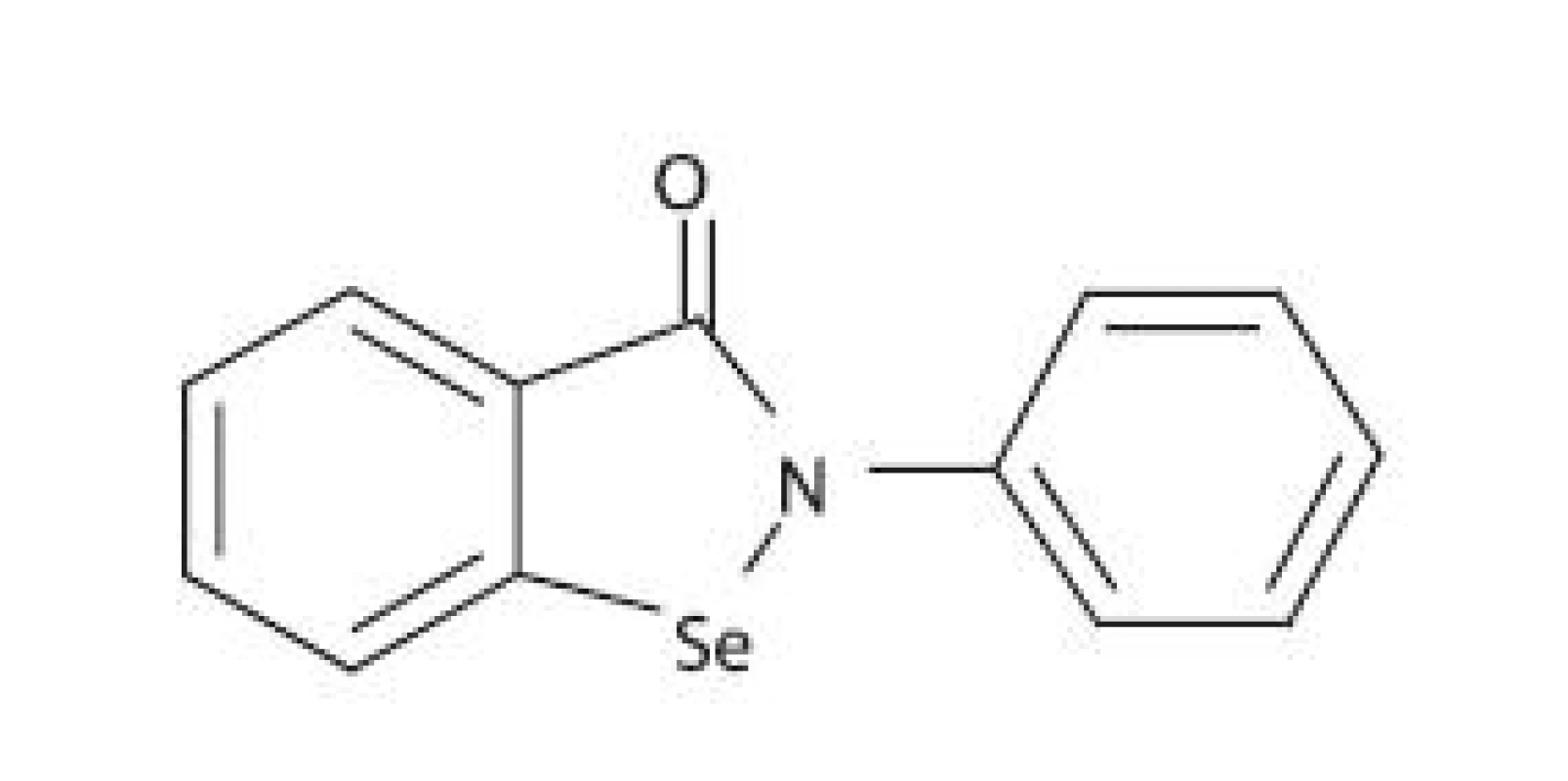
K ďalším zlúčeninám so schopnosťou vytvárať s LOX katalyticky inaktívny komplex patrí N-hydroxymočovina, kyselina arachidónohydroxámová a množstvo jej N-alkyl derivátov. Jednými z najsilnejších chelátorov sú práve kyseliny hydroxámové a deriváty N-hydroxymočoviny (napr. zileuton). Vykazujú strednú selektivitu pre inhibíciu 5-LOX. Ich problémom však je, že sú rýchlo metabolizované a oxidované prostredníctvom 5-LOX na nitroxidové radikály, a rizikom je i indukcia pečeňových enzýmov 57).
Štrukturálne analógy substrátu a produktov
Do tejto skupiny inhibítorov patria dva typy zlúčenín, avšak ich použitie ako liečiv je obmedzené, pretože majú nízku in vitro aktivitu.
Do prvej skupiny patria látky podobné substrátu AA, ktoré buď súťažia o aktívne centrum enzýmu, ale nie sú enzýmom premieňané, alebo podliehajú katalýze daným enzýmom za vzniku reaktívnych produktov, ktoré spôsobia samovražednú inhibíciu. Medzi substrátové analógy patrí kyselina all-cis-5,8,11,14-eikozatetraínová (ETYA), ktorá ireverzibilne inaktivuje LOX, a kyselina all-cis-5,8,11-eikozatriínová (ETIA) 62). Ďalším zo substrátových analógov je kurkumín, ktorý je prirodzene sa vyskytujúci fenol izolovaný z koreňa rastliny Curcuma longa L. Vykazuje protizápalové vlastnosti a u myší potláča vznik procesu rakoviny 51).
Druhým typom sú zlúčeniny, ktoré sa podobajú na produkty LOX-katalyzovaných reakcií (LTA4, 5-HETE, 15-HETE), a ktoré sú schopné inhibovať enzým tvorbou enantiošpecifických interakcií. Ide vlastne o spätnú inhibíciu enzýmu vlastnými produktami. Medzi analógy produktov patrí 5,6-metano-LTA4, 5-HETE-laktón a 15(S)-HETE (obr. 5) 62). Ďalej sem možno zaradiť napr. metoxyalkyltiazol, ktorý je silným inhibítorom 5-LOX, a pritom neinhibuje COX ani pri koncentráciách výrazne prevyšujúcich tie, pri ktorých je inhibovaná 5-LOX 56). Veľké nádeje sa kladú aj na triedu lignánov odvodených z prírodného zdroja (justicidínu E). Ich pozitívom je možnosť dávkovania ako prodrug formy s veľmi dobrou biologickou dostupnosťou pri p.o. podávaní. Problémom však je extenzívny metabolizmus pyránového kruhu 63).
Obr. 5. Substrátové a produktové analógy LOX 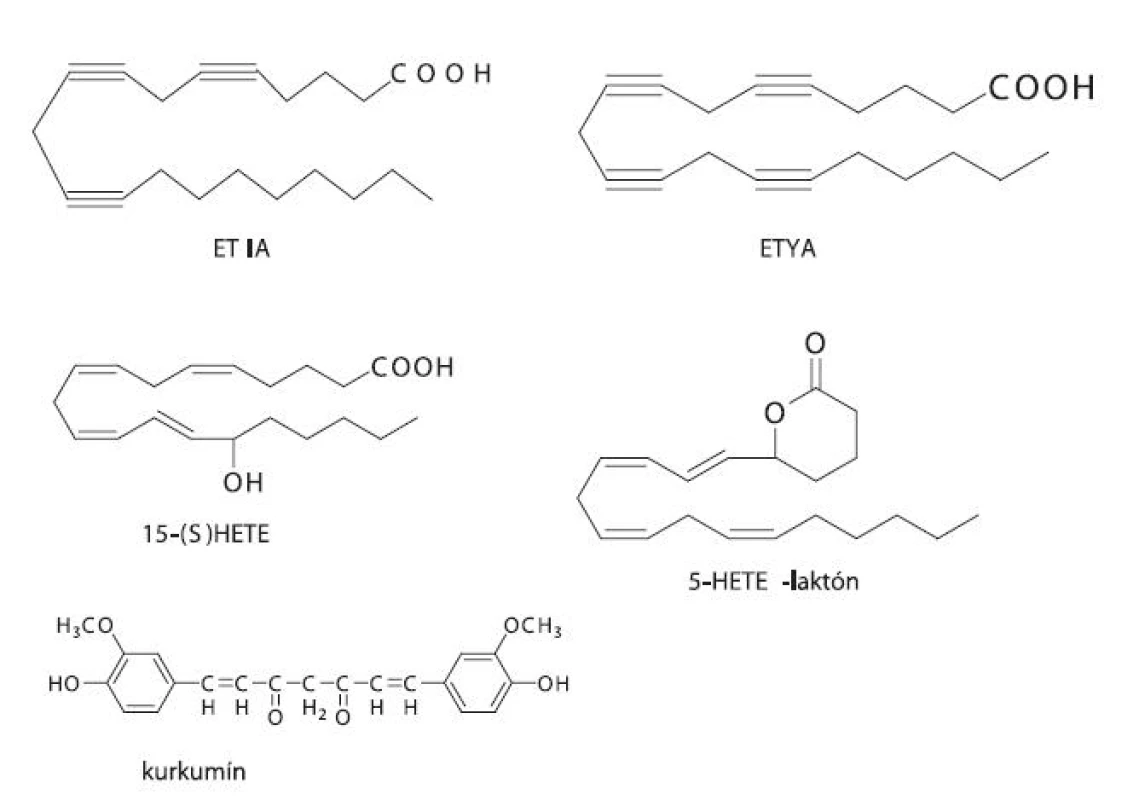
FLAP-inhibítory
FLAP (5-LOX aktivujúci proteín) je integrálnym membránovým proteínom s Mr 18 kDa, ktorý sprostredkuje transport a vhodnú orientáciu AA vzhľadom k 5-LOX 64, 65). Aktivita FLAP môže byť blokovaná tzv. FLAP-inhibítormi, ktoré predstavujú novú skupinu látok schopných ovplyvňovať aktivitu LOX. Prvou zlúčeninou tejto skupiny bol indolový derivát MK886 (obr. 6), ktorý je zároveň aj antagonistom tromboxánu A2 (TXA2) 66). MK886 nemá žiaden efekt na COX ani na jednotlivé izoformy LOX, ale kompetetívne blokuje väzbu AA na FLAP. Niekoľko štúdií preukázalo, že MK886 indukuje masívnu apoptózu v hormonálne závislých aj nezávislých ľudských rakovinových bunkách prostaty 67, 68). Apotóza indukovaná prostredníctvom MK886 však nemusí súvisieť s inhibíciou FLAP, pretože k apoptóze dochádza aj v bunkách, v ktorých nie je prítomná LOX 69), alebo v ktorých sú hladiny FLAP znížené 66). MK591 je štrukturálny analóg MK886, od ktorého sa líši povahou 5-indoyl - substituenta (chinolín). Obidva inhibítory zdieľajú rovnaký mechanizmus účinku, avšak MK591 preukazuje silnejší inhibičný účinok 70). Ďalšími FLAP-inhibítormi sú chinolínové deriváty a kombinované indolínové/chinolínové deriváty, napr. BAY-X-1015 71).
Obr. 6. Štruktúrny vzorec MK886 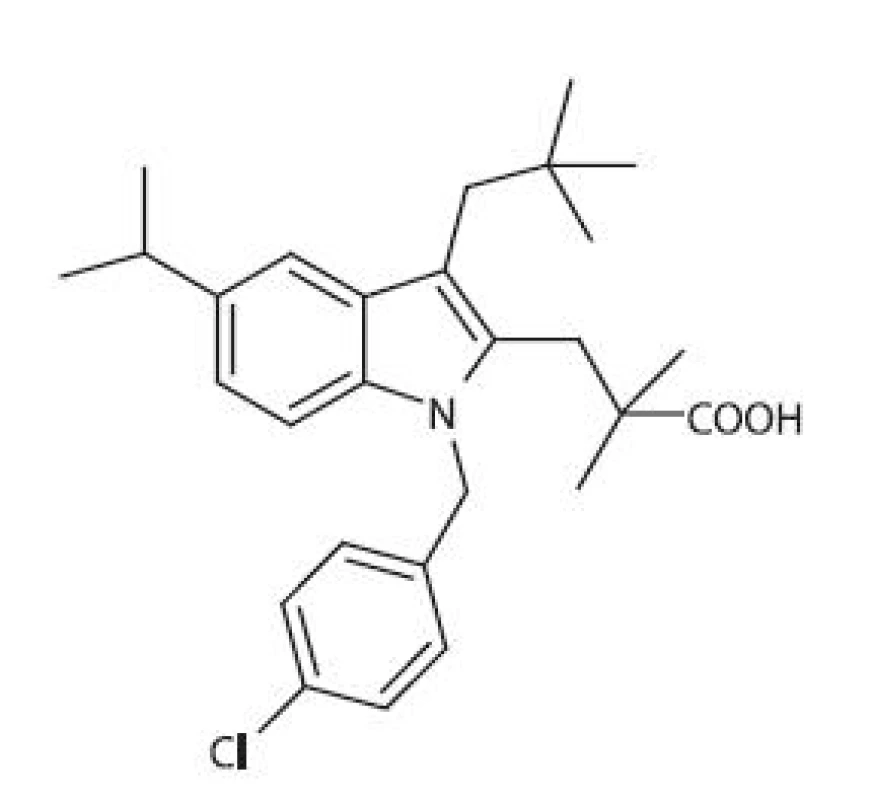
Duálne inhibítory
COX a LOX predstavujú dva hlavné enzýmy kaskády AA. Mnoho farmaceutických spoločností vyvíjalo za posledné desaťročia zlúčeniny, ktoré inhibujú 5-LOX a iné enzýmy zúčastňujúce sa na progresii zápalového procesu. Najviac úsilia sa kladie práve na duálne COX/LOX-inhibítory. Výsledky štúdií naznačujú, že obidve vetvy sú vnútorne prepojené, keďže inhibovaním cyklizujúcej COX-cesty dochádza k zvýšenej preferencii linearizujúcej vetvy LOX-cesty 72). I keď leukotriény vznikajúce cez 5-LOX hrajú určitú úlohu pri zápalových ochoreniach 73), všetky súvisiace štúdie indikujú, že samotná inhibícia 5-LOX predstavuje nedostatočný terapeutický model zápalových ochorení. V posledných rokoch teda stojí v popredí záujmu najmä duálna inhibícia COX - a LOX-cesty. Na základe získaných výsledkov sa dá predpokladať, že súčasná inhíbicia tvorby prostanoidov a leukotriénov má synergický efekt a dosahuje optimálnu protizápalovú aktivitu 74). Navyše, duálna inhibícia COX/5-LOX neblokuje 12-LOX a 15-LOX, ktoré prispievajú k syntéze biologicky aktívnych lipoxínov s protizápalovým účinkom 75). Liečivá schopné inhibovať obe COX (COX-1 aj COX-2) a 5-LOX boli pripravené za účelom ponechať si aktivitu NSAID, ale zároveň vynechať ich hlavné nežiadúce účinky. Klasické NSAID pôsobia protizápalovo hlavne cez inhibíciu COX, a jeden z ich hlavných vedľajších účinkov je zníženie produkcie gastroprotektívnych prostaglandínov za súčasného zvýšenia gastropoškodzujúcich a bronchokonstrikčných leukotriénov. Je preto výhodné mať zlúčeninu s oboma aktivitami, pretože prostaglandíny zvyšujú leukotriénmi sprostredkovaný zápal. Avšak pozornosť by sa mala venovať aj možnosti, že predĺžená inhibícia oboch ciest môže spôsobiť niekoľko vedľajších účinkov, hlavne ak sú užívané chronicky. V súčasnosti sú v odbornej literatúre uvádzané rôzne triedy duálnych COX/5-LOX inhibítorov:
- modifikované NSAID (indometacínové deriváty, fenamátové deriváty, tepoxalín, celekoxibové dereriváty ...),
- di-terc-butylfenoly (tebufelón, darbufelón ...),
- tiofénové deriváty (RWJ-63556),
- pyrazolínové deriváty (fenidón),
- pyrolizínové deriváty (likofelón).
Jedným z prvých duálnych COX/LOX-inhibítorov bol tepoxalín (obr. 7A). Pri p.o. podávaní u psov inhiboval syntézu prostaglandínu E2 (PGE2)a LTB4 v synoviálnej tekutine z kolenných kĺbov. Zlúčenina bola dobre tolerovaná, pričom sa nepreukázal žiaden významný ulcerogénny efekt po gastroskopickom vyšetrení 76). Likofelón (obr. 7B) je pyrolizínový derivát a substrátový analóg AA. Táto zlúčenina preukazuje duálnu a vyrovnanú inhibičnú aktivitu voči COX a LOX, a zároveň má protizápalové, analgetické, antipyretické, antiastmatické a antiagregačné vlastnosti 77).
Obr. 7. Štruktúrny vzorec tepoxalínu a likofelónu (A: tepoxalín, B: likofenón) 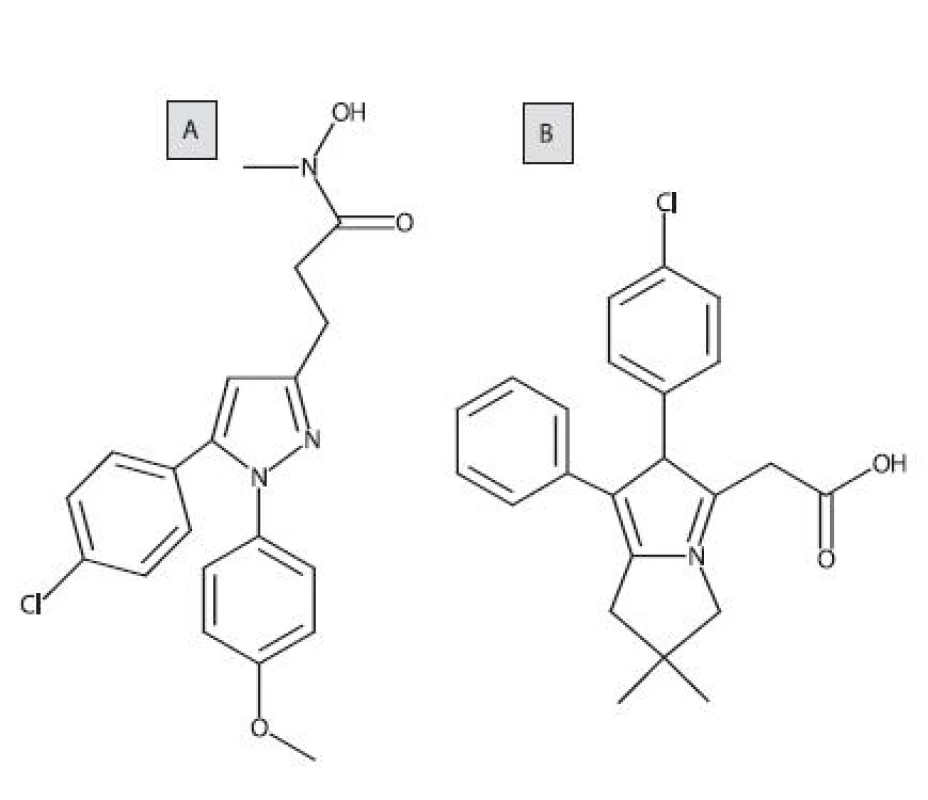
Duálne COX/LOX-inhibítory budú pravdepodobne v budúcnosti predstavovať perspektívnu skupinu liečiv, nakoľko ich možno potenciálne využiť v rámci týchto oblastí:
- V ostatnom čase sa preukázalo úzke prepojenie medzi polynenasýtenými MK a karcinogenézou, čo viedlo k identifikácii rôznych molekulárnych cieľov kaskády AA pri nádorových ochoreniach. COX a LOX preukázali „svoj podiel“ viny pri niekoľkých typoch karcinómov, vrátane rakoviny hrubého čreva, pankreasu, prsníka, pľúc, kože, močového mechúra a pečene 62).
- Duálne COX-2/LOX-inhibítory sú výhodné pre blokovanie LOX-cesty, ktorá býva u klasických NSAID hlavným dôvodom vzniku nežiadúcich účinkov.
- Ďalšou sľubnou terapeutickou indikáciou môžu byť s vekom spojené degeneratívne ochorenia – ako napr. zápal nervov a oxidatívny stres, ktoré k nim prispievajú. Reaktívne mikroglie sa vo zvýšenej miere našli v starnúcom mozgu a obzvlášť u degeneratívnych ochorení (Alzheimerova a Parkinsonova choroba, amyotrofická laterálna skleróza, skleróza multiplex). Stimulované mikroglie vylučujú neurotoxické produkty a bezkyslíkové radikály. Duálne COX/LOX-inhibítory potláčajú v in vitro podmienkach neurotoxicitu mikroglií v závislosti na dávke a zároveň významne potencujú efekt COX inhibítorov. Potláčanie 5-LOX aktivity môže mať tiež kladný vplyv na neurodegeneratívne ochorenia prostredníctvom ďalšieho mechanizmu, ktorým je inhibícia aktivácie transkripčného faktora κB (NF κB) a tým prevencia degradácie inhibítor transkripčného faktora κB-α (IkB-α) 78). Inhibíciou LOX v centrálnej nervovej sústave sa predišlo smrti neurónov spôsobenou vyčerpaním zdrojov glutatiónu 79). Ten kontroluje redoxný stav buniek a chráni neuróny pred toxicitou kyslíkových radikálov. Takéto vyčerpanie zdrojov sa objavuje už v skorých štádiách Parkinsonovej choroby.
- Duálne COX/LOX-inhibítory môžu tiež pomôcť lepšie zvládnuť hlavné nedostatky neselektívnych COX-inhibítorov (napr. dlhodobé podávanie kyseliny acetylsalicylovej v nízkych dávkach), a to renálne a žalúdočné potiaže spojené s blokovaním tvorby TXA2 v krvných doštičkách a neovplyvňovaním formovania prostacyklínu (PGI2). Blokovaním 5-LOX sa redukuje leukocytmi spôsobený zápal a trombogénny potenciál, čím sa pôsobí proti poškodzovaniu sliznice žalúdka spojeného s inhibíciou COX-1 80). Význam tohto poznatku je aj v tom, že 5-LOX je vysoko exprimovaná v arteriálnych stenách pacientov postihnutých aterosklerózou, pričom leukotriény a cysteínové leukotriény (LTC4, LTD4, LTE4) spúšťajú kruh zápalu arteriálnej steny a remodelingu počas aterogenézy (tzv. hypotéza 5-LOX aterosklerózy) 76).
Adresa pro korespondenci:
Mgr. Renáta Kollárová
Katedra bunkovej a molekulárnej biológie liečiv FaF UK
Kalinčiakova 8, 832 32 Bratislava, Slovenská republika
e-mail: kollarova@fpharm.uniba.sk
Zdroje
1. Shibata, D., Axelrod, B.: Plant lipoxygenases. J. Lipid Mediat. Cell Signal. 1995; 12, 213–228.
2. Brash, A. R.: Lipoxygenases: occurence, functions, catalysis, and acquisition of of substrate. J. Biol. Chem. 1999; 274, 23479–23682.
3. Andreou, A., Feussner, I.: Lipoxygenases – structure and reaction mechanism. Phytochemistry 2009; 70, 1504–1510.
4. Veldink, G. A., Hilbers, M. P., Nieuwenhuizen, W. F.: Plant lipoxygenase: structure and mechanism. In: Rowley, A.F., Kühn, H., Schewe, T. eds. Eicosanoid and related compounds in plants and animals, London, Portland Press, 1998.
5. Ueda, N., Suzuki, H., Yamamoto, S.: Mammalian lipoxygenases. Structure, functions and evolutionary aspects. In: Rowley, A. F., Kühn, H., Schewe, T. eds. Eicosanoid and related compounds in plants and animals. London: Portland Press, 1998, 47–48.
6. Bisakowski, B., Perraud, X., Kermasha, S.: Characterization of hydroperoxides and carbonyl compounds obtained by lipoxygenase extracts of selected microorganisms. Biosci. Biotechnol. Biochem. 1997; 61, 1262–1269.
7. Brash, A. R., Boeglin, W. E., Chang, M. S., Shieh, B. H.: Purification and molecular cloning of an 8R-lipoxygenase from the coral Plexaura homomalla reveal the related primary structures of R - and S-lipoxygenases. J. Biol. Chem. 1996; 271, 20949–20957.
8. Porta, H., Rocha-Sosa, M.: Lipoxygenase in bacteria: a horizontal transfer event? Microbiology 2001; 147, 3199–3200.
9. Tapiero, H., Ba, G. N., Couvreur, P., Tew, K. D.: Polyunsaturated fatty acids (PUFA) and eicosanoids in human health and pathologies. Biomed. Pharmacother. 2002; 56, 215–222.
10. van Leyen, K., Duvoisin, R. M., Engelhardt, H., Wiedmann, M.: A function for lipoxygenase in programmed organelle degradation. Nature 1998; 395, 392–395.
11. Hill, E. M., Eling, T. E., Nettesheim, P.: Changes in expression of 15-lipoxygenases and prostaglandin H-synthase during differentiation of human tracheobronchial epithelial cells. Am. J. Respir. Cell Mol. Biol. 1998; 18, 662–669.
12. Chavis, C., Vachier, I., Bousquet, J., Godard, P., Chanez, P.: Generation of eicosanoid from 15(S)-hydroxyeicosatetraenoic acid in blood monocytes from steroid-dependent asthmatic patients. Biochem. Pharmacol. 1998; 56, 535–541.
13. Salari, H., Chan-Yeung, M.: Release of 15 - hydroxyeicosatetraenoic acid (15-HETE) and prostaglandin E2 (PGE2) by cultured human bronchial epithelial cells. Am. J. Respir. Cell Mol. Biol. 1989; 1, 245–250.
14. Hill, E. M., Eling, T. E., Nettesheim, P.: Differentiation dependency of eicosanoid enzyme expression in human tracheobronchial cells. Toxicol. Lett. 1998; 96, 239–244.
15. Conrad, D. J., Lu, M.: Regulation of human 12/15-lipoxygenase by Stat6-dependent transcription. Am. J. Respir. Cell Mol. Biol. 2000; 22, 226–234.
16. Moore, P. E., Lahiri, P., Laporte, J. D., Church, T., Panettieri Jr., R. A., Shore, S. A.: Selected contribution: synergism between TNF-alpha and IL-1b in airway smooth muscle cells: implications for b-adrenergic responsiveness. J. Appl. Physiol. 2001; 91, 1467–1474.
17. Campbell, A. M., Chanez, P., Vignola, A. M., Bousquet, J.: Functional characteristics of bronchial epithelium obtained by brushing from asthmatic and normal subjects. Am. Rev. Respir. Dis. 1993; 147, 529–534.
18. Levy, B. D., Romano, M., Chapman, M. A., Reilly, J. J.: Human alveolar macrophages have 15-lipoxygenase and generate 15(S)-hydroxy-5,8,11-cis-13-trans-eicosatetraenoic acid and lipoxins. J. Clin. Invest. 1993; 92, 523–531.
19. Kasahara, Y., Tuder, R. M., Cool, C. D., Voelkel, N. F.: Expression of 15-lipoxygenase and evidence for apoptosis in the lungs from patients with COPD. Chest 2000; 117, 260.
20. Zhu, J., Kilty, I., Granger, H., Gamble, E., Qiu, Y.S., Hattotuwa, K., Elston, W., Liu, W.L., Oliva, A., Pauwels, R.A., Kips, J.C., De Rose, V., Barnes, N., Yeadon, M., Jenkinson, S., Jeffery, P.K.: Gene expression and immunolocalisation of 15-lipoxygenase isozymes in the airway mucosa of smokers with chronic bronchitis. Am. J. Respir. Cell Mol. Biol. 2002; 27, 666–667.
21. Baer, A. N., Costello, P. B., Green, F. A.: Stereospecifity of the products of the fatty acids oxygenases derived from psoriatic scales. J. Lipid Res. 1991; 32, 341–347.
22. Boeglin, W. E., Kim, R. B., Brash, A. R.: A 12R-lipoxygenase in human skin: Mechanistic evidence, molecular cloning, and expression. Biochemistry 1998; 95, 6744–6749.
23. Jobard, F., Lefevre, C., Karaduman, A., Blanchet-Bardon, C., Emre, S., Weissenbach, J., Ozgüc, M., Lathrop, M., PrudęHomme, J. F., Fischer, J.: Lipoxygenase-3 (ALOXE3) and 12(R)-lipoxygenase (ALOX12B) are mutated in non-bullous congenital ichthyosiform erythroderma (NCIE) linked to chromosome 17p13.1. Hum. Mol. Genet. 2002; 11, 107–113.
24. Donoiwitz, M.: Arachidonic acid metabolites and their role in inflammatory bowel disease. Gastroenterology 1985; 88, 580–587.
25. Zijlstra, F. J., van Dijk, A. P., Garrelds, I. M., Ouwendijk, R. J. T., Wilson, J. H. P.: Species differences in the pattern of eicosanoids produced by inflamed and non-inflamed tissue. Inflamm. Res. 1991; 36, 73–75.
26. Liagre, B., Vergne, P., Rigaud, M., Beneytout, J. L.: Arachidonate 15-lipoxygenase of reticulocyte-type in human rheumatoid arthritis type B synoviocytes and modulation of its activity by proinflammatory cytokines. J. Rheumatol. 1999; 26, 1044–1051.
27. Jankum, J., Aleem, A.M., Malgorzewicz, S., Szkunlarek, M.: Synthetic curcuminoids modulate the arachidonic acid metabolism of human platelet 12‑lipoxygenase and reduce sprout formation of human endothelial cells. Mol. Cancer Ther. 2006; 5, 1371–1382.
28. Honn, K. V., Tang, D. G., Gao, X., Butovich, I. A., Liu, B., Timar, J., Hagmann, W.: 12-lipoxygenases and 12(S)-HETE: role in cancer metastasis. Cancer Metastasis Rev. 1994; 13, 365–369.
29. Nie, D., Che, M., Grignon, D., Tang, K., Honn, K. V.: Role of eicosanoids in prostate cancer progression. Cancer Metastasis Rev. 2001; 20, 195–206.
30. Ikawa, H., Kamitani, H., Calvo, B. F., Foley, J. F., Eling, T. E.: Expression of 15-lipoxygenase in human colorectal cancer. Cancer Res. 1999; 59, 360–366.
31. Kamitani, H., Geller, M., Eling, T. E.: Expression of 15-lipoxygenase by human colorectal carcinoma Caco-2 cells during apoptosis and cell differentiation. J. Biol. Chem. 1998; 273, 21569–21577.
32. Kamitani, H., Eling, T. E., Kameda, H., Kelavkar, U. K.: A GATA binding site is involved in the regulation of 15-lipoxygenase expression in human colorectal carcinoma cell line, caco-2. FEBS Lett. 2000; 467, 341–347.
33. Li, N., Sood, S., Wang, S., Fang, M.: Overexpression of 5-lipoxygenase and cyclooxygenase 2 in hamster and human oral cancer and chemopreventive effects of zileuton and celecoxib. Clin. Cancer Res. 2005; 11, 2089–2096.
34. RĆdmark, O.: 5-lipoxygenase-derived leukotrienes, mediators also of atherosclerotic inflammation. Arterioscler. Thromb. Vasc. Biol. 2003; 23, 1140–1142.
35. Melissa, E., Hatley, S.S., Kelly, B., Reilly, D.T., Hedrick, C.C.: Increased production of 12/15 lipoxygenase eicosanoids accelerates monocyte/endothelial interactions in diabetic db/db mice. J. Biol. Chem. 2003; 28, 25369–25375.
36. Mehrabian, M., Allayee, H., Wong, J., Shi, W., Wang, X. P., Shaposhnik, Z., Funk, C. D., Lusis, A. J.: Identification of 5-lipoxygenase as a major gene contributing to atherosclerosis. Circ. Res. 2002; 91, 120–126.
37. Spanbroek, R., Gräbner, R., Lötzer, K., Hildner, M., Urbach, A., Rühling, K., Moos, M. P. W., Kaiser, B., Cohnert, T. U., Wahlers, T., Zieske, A., Plenz, G., Robenek, H., Salbach, P., Kühn, H., RĆdmark, O., Samuelsson, B., Habenicht, A. J. R.: Expanding expression of the 5-lipoxygenase pathway within the arterial wall during human atherogenesis. Proc. Natl. Acad. Sci. USA 2002; 100, 1238–1243.
38. Patricia, M. K., Kim, J. A., Harper, C. M., Shih, P. T.: Lipoxygenase products increase monocyte adhesion to human aortic endothelial cells. Arterioscler. Thromb. Vasc. Biol. 1999; 19, 2615–2622.
39. Eizirik, D. L., Mandrup-Poulsen, T.: A choice of death – the signal-transduction of immune-mediated beta-cell apoptosis. Diabetologia 2001; 44, 2115–2133.
40. Bleich, D., Chen, S., Gu, J. L., Thomas, L., Scott, S., Gonzales, N., Natarajan, R., Nadler, J. L.: Interleukin-1 beta regulates the expression of a leukocyte type of 12-lipoxygenase in rat islets and RIN m5F cells. Endocrinology 1995; 136, 5736–5744.
41. Ma, Z., Ramanadham, S., Corbett, J. A., Bohrer, A., Gross, R. W., McDaniel, M. L., Turk, J.: Interleukin-1 enhances pancreatic islet arachidonic acid 12-lipoxygenase product generation by increasing substrate availability through a nitric oxide-dependent mechanism. J. Biol. Chem. 1996, 271, 1029–1042.
42. Bleich, D., Chen, S. Y., Zipser, B., Sun, D. X., Funk, C. D., Nadler, J.: Resistance to type 1 diabetes induction in 12-lipoxygenase knockout mice. J. Clin. Invest. 1999; 103, 1431–1436.
43. Antonipillai, I., Nadler, J., Vu, E. J., Bughi, S., Natarajan, R., Horton, R.: A 12-lipoxygenase product, 12-hydroxyeicosatetraenoic acid, is increased in diabetics with incipient and early renal disease. J. Clin. Endocrinol. Metab. 1996; 81, 1940–1945.
44. Pace-Asciak, C. R., Demin, P. M., Estrada, M., Liu, G.: Hepoxilins raise circulating insulin levels in vivo. FEBS Lett. 1999; 461, 165–168.
45. Falck, J. R., Manna, S., Moltz, J., Chacos, N., Capdevila, J.: Epoxyeicosatrienoic acids stimulate glucagon and insulin release from isolated rat pancreatic islets. Biochem. Biophys. Res. Commun. 1983; 114, 743–749.
46. Noiri, E., Yokomizo, T., Nakao, A., Izumi, T., Fujita, T., Kimura, S., Shimizu, T.: An in vivo approach showing the chemotactic activity of leukotriene B4 in acute renal ischemic-reperfusion injury. Proc. Natl. Acad. Sci. USA 2000; 97, 823–828.
47. Rabb, H., OęMeara, Y. M., Maderna, P., Coleman, P., Brady, H. R.: Leukocytes, cell adhesion molecules and ischemic acute renal failure. Kidney Int. 1997; 51, 1463–1468.
48. Rifai, A., Sakai, H., Yagame, M.: Expression of 5‑lipoxygenase and 5-lipoxygenase activation protein in glomerulonephritis. Kidney Int. 1993; 43, 95–99.
49. Henderson, W. R.: Products of 12 - and 15-lipoxygenase. In: Henson, P.M., Murphy, R.C. eds. Mediators of the inflammatory process, Handbook of inflammation, Elsevier, Amsterdam, 1989.
50. Liaw, Y. W., Liu, Y. W., Chen, B. K., Chang, W. Ch.: Introduction of 12-LOX exspression by phorbol 12-myristate 13-acetate in human epidermoid carcinoma A431 cell. Bioch. Biophys. Acta 1998; 1389, 23–33.
51. Bors, W., Heller, W., Michel, C., Saran, M.: Flavonoids as antioxidants: Determination of radical-scavenging efficiencies. Metods Enzymol. 1990; 186, 343–345.
52. van Acker, S. A., Koymans, L. M., Bast, A.: Molecular pharmacology of vitamin E: Structural aspects of antioxidant activity. Free Radic. Biol. Med. 1993; 15, 311–328.
53. Sun, A. Y., Simonyi, A., Sun, G. Y.: The „French paradox“ and beyond: neuroprotective effects of polyphenols. Free Radic. Biol. Med. 2002; 32, 314–318.
54. Renaud, S., de Lorgeril, M.: Wine, alcohol, platelets and the french paradox for coronary heart disease. Lancet 1992; 339, 1523–1526.
55. Soleas, G. J., Diamandis, E. P., Goldberg, D. M.: Wine as a biological fluid: history, production, and role in disease prevention. J. Clin. Lab. Anal. 1997; 11, 287–313.
56. Bertolini, A., Leone, S., Ottani, A.: Dual acting anti-inflammatory drugs. Curr. Top. Med. Chem. 2007; 7, 265–275.
57. Young, R. N.: Inhibitors of 5-lipoxygenase: a therapeutic potential yet to be fully realized? Eur. J. Med. Chem. 1999; 34, 671–685.
58. Schewe, T.: Molecular actions of ebselen – an antiinflammatory antioxidant. Gen. Pharmacol. 1995; 26, 1153–1169.
59. Gao, J. X., Issekutz, A. C.: The effect of ebselen on polymorphonuclear leukocyte and lymphocyte migration to inflammatory reactions in rats. J. Immunopharmacol. 1993; 25, 239–251.
60. Takasago, T., Peters, E. E., Graham, D. I., Masayasu, H., Macrae, I. M.: Neuroprotective efficacy of ebselen, an antioxidant with anti-inflammatory actions, in rodent model of permanent middle cerebral artery occlusion. Br. J. Pharmacol. 1997; 122, 1251–1256.
61. Schewe, C., Schewe, T., Wendel, A.: Strong inhibition of mammalian lipoxygenases by the antiinflammatory seleno-organic compound ebselen in the absence of glutathione. Biochem. Pharmacol. 1994; 48, 65–74.
62. Fischer, S. M., Klein, R. D.: Lipoxygenases as targets for cancer prevention. In: Kelloff, G. J., Hawk, E. T., Sigman, C. C. eds. Cancer chemoprevention: Promising cancer chemopreventive agents, Humana Press, New Jersey, 2004.
63. Chauret, N., Li, C., Ducharme, Y., Trimble, L. A., Yergey, J. A., Ramachandran, C., Nicoll-Griffith, D. A.: In vitro and in vivo biotransformations of the naphthalenic lignan lactone 5-lipoxygenase inhibitor, L‑702,539. Drug Metabol. Dispos. 1995; 23, 65–71.
64. Funk, C. D.: Prostaglandins and leukotrienes: advances in eicosanoid biology. Science 2001; 294, 1871–1875.
65. Cao, Y., Prescott, S. M.: Many actions of cyclooxygenase-2 in cellular dynamics and in cancer. J. Cell Physiol. 2002; 190, 279–286.
66. Datta, K., Biswal, S. S., Kehrer, J. P.: The 5-lipoxygenase-activating protein (FLAP) inhibitor, MK886, induces apoptosis independently of FLAP. Biochem. J. 1999; 340, 371–375.
67. Avis, I., Hong, S. H., Martinez, A., Moody, T., Choi, Y. H., Trepel, J., Das, R., Jett, M., Mulshine, J. L.: Five-lipoxygenase inhibitors can mediate apoptosis in human breast cancer cell lines through complex eicosanoid interactions. Faseb J. 2001; 15, 2007–2009.
68. Tang, D. G., La, E., Kern, J., Kehrer, J. P.: Fatty acid oxidation and signaling in apoptosis. Biol. Chem. 2002; 383, 425–442.
69. Datta, K., Biswal, S. S., Xu, J., Towndrow, K. M., Feng, X., Kehrer, J. P.: The 5-lipoxygenase-activating protein (FLAP) inhibitor, MK886, induces apoptosis independently of FLAP. J. Biol. Chem. 1998; 273, 28163–28169.
70. Tong, Z., Wu, X., Kehrer, J. P.: Increased expression of the lipocalin 24p3 as an apoptotic mechanism for MK886. Biochem. J. 2003; 372, 203–210.
71. Hamilton, A. L., Watson, R. M., Wyile, G., OęByrne, P. M.: Attenuation of early and late phase allergen-induced bronchoconstriction in asthmatic subjects by a 5-lipoxygenase activating protein antagonist, BAYx 1005. Thorax 1997; 52, 348–354.
72. Gambaro, G.: Strategies to safely interfere with prostanoid activity while avoiding adverse renal effects: could COX-2 and COX-LOX dual inhibition be the answer? Nephrol. Dial. Transplant. 2002; 19, 1159–1116.
73. Sala, A., Zarini, S., Bolla, M.: Leukotrienes: lipid bioeffectors of inflammatory reactions. Biochemistry (Mosc.) 1998; 63, 84–92.
74. Martel-Pelletier, J., Lajeunesse, D., Reboul, P., Pelletier, J. P.: Therapeutic role of dual inhibitors of 5-LOX and COX, selective and non-selective nonsteroidal anti-inflammatory drugs. Ann. Rheum. Dis. 2003; 62, 501–509.
75. Serhan, C. N., Levy, B. D., Clish, C. B., Gronert, K., Chiang, N.: Lipoxins, aspirin-triggered 15-epi-lipoxin stable analogs and their receptors in antiinflammation: a window for therapeutic opportunity. Ernst Schering Res. Found. Workshop 2000; 31, 143–185.
76. Leone, S., Ottani, A., Bertolini, A.: Dual acting anti-inflammatory drugs. Curr. Top. Med. Chem. 2007; 7, 265–275.
77. Laufer, S.: Discovery and development of ML3000. Inflammopharmacology 2001; 9, 101–112.
78. Fiebich, B. L., Hofer, T. J., Lieb, K., Huell, M., Butcher, R. D., Schumann, G., Schulze-Osthoff, K., Bauer, J.: The non-steroidal antiinflamatory drug tepoxalin inhibits interleukin-6 and alpha1-anti-chymotrypsin synthesis in astrocytes by preventing degradation of IkB-alpha. Neuropharmacol. 1999; 38, 1325–1333.
79. Kramer, B. C., Yabut, J. A., Cheong, J., Jnobaptiste, R., Robakis, T., Olanow, C. W., Mytilineou, C.: Toxicity of glutathione depletion in mesencephalic cultures: a role for arachidonic acid and its lipoxygenase metabolites. Eur. J. Neurosci. 2004; 19, 280–286.
80. de Gatetano, G., Donati, M. B., Cerletti, C.: Prevention of thrombosis and vascular inflamation: benefits and limitations of selective or combined COX-1, COX-2 and 5-LOX inhibitors. Trends Pharmacol. Sci. 2003; 24, 245–252.
Štítky
Farmácia Farmakológia
Článok vyšiel v časopiseČeská a slovenská farmacie

2011 Číslo 3-
Všetky články tohto čísla
-
Dopad zdravotnické reformy v oblasti léčiv
II. Analýza z pohledu finanční spoluúčasti pacienta na farmakoterapii - Význam genetického polymorfizmu enzýmov cytochrómu P450 – časť I.Enzýmový systém cytochrómu P450 a cytochróm P450 1A2
- Farmaceutické aspekty živočíšnej lipoxygenázy
- Inhibiční aktivita vybraných ß-karbolínových alkaloidů na enzymy acetylcholinesterasu a butyrylcholinesterasu
- Index Nominum. International Drug Directory Vol. 1 a Vol 2. 20th edition.
- Vplyv membrán na permeáciu alaptidu z hydrogélov
- Lacinová, Ľ., Uhríková, D.: Biofyzika napäťovo závislých iónových kanálov.
- Syntéza a základné fyzikálno-chemické vlastnosti 1-[3-(Y-alkoxyfenylkarbamoyl-oxy)-2-hydroxypropyl]-4-(2-metylfenyl)-piperazíniumchloridov
-
XXXIII. pracovní dny sekce radiofarmacie České společnosti nukleární medicíny ČLS JEP
Rožnov pod Radhoštěm, 1.–3. června 2011 - doc. RNDr. Eva Račanská, CSc. – laureátka Weberovej ceny SFS
-
Dopad zdravotnické reformy v oblasti léčiv
I. Analýza z pohledu lékárny
-
Dopad zdravotnické reformy v oblasti léčiv
- Česká a slovenská farmacie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Význam genetického polymorfizmu enzýmov cytochrómu P450 – časť I.Enzýmový systém cytochrómu P450 a cytochróm P450 1A2
- doc. RNDr. Eva Račanská, CSc. – laureátka Weberovej ceny SFS
- Vplyv membrán na permeáciu alaptidu z hydrogélov
- Farmaceutické aspekty živočíšnej lipoxygenázy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



