-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Štúdium lokálnych anestetík – časť 200*
Výber optimálneho typu chitosanu pre formuláciu lokálnych anestetík karbamátového typu do hydrogélov
Study of local anaesthetics – Part 200
Choice of the optimal type of chitosan for the formulation of local anaesthetics of the carbamate type into hydrogelsThe aim of this examination was a study of hydrogels on the base of various types of the natural polymer chitosan with an assay of local anaesthetics of the carbamate type. The concentration of the gel-creating compound in hydrogels was 2.5%. The study included heptacainiumchloride (HEP), pentacainiumchloride (PEN) and carbisocainiumchloride (CAR). Evaluation was focused on the flow properties of prepared gels and the liberation of drugs from them. Based on the achieved results, the optimal type of biopolymer was determined: PEN – CHIT B, for CAR – CHIT C, while in the case of HEP it was found that chitosan is not suitable as a gel-creating base.
Keywords:
heptacaine • pentacaine • carbisocaine • biopolymer • liberation
Received 18 Octobec 2012 / Accepted 26 November 2012
Autoři: Jozef Čižmárik 1; Zuzana Vitková 2; Petra Herdová 2
Působiště autorů: Katedra farmaceutickej chémie, Farmaceutická fakulta, Univerzita Komenského, Bratislava 1; Katedra galenickej farmácie, Farmaceutická fakulta UK, Bratislava 2
Vyšlo v časopise: Čes. slov. Farm., 2012; 61, 285-287
Kategorie: Krátká sdělení
*Venované 60. výročiu založenia Farmaceutickej fakulty Univerzity Komenského v Bratislave.
Souhrn
Cieľom tohto výskumu bolo štúdium hydrogélov na báze rôznych typov prírodného polyméru chitosanu s obsahom lokálnych anestetík karbamátového typu. Koncentrácia gélotvornej látky v hydrogéloch bola 2,5 %. Študovanými liečivami bol heptakaíniumchlorid (HEP), pentakaíniumchlorid (PEN) a karbizokaíniumchlorid (KAR). Hodnotili sa tokové vlastnosti pripravených gélov a liberácia liečiv z nich. Na základe dosiahnutých výsledkov sa stanovil optimálny typ biopolyméru pre PEN – CHIT B a KAR – CHIT C, v prípade HEP sa zistilo, že chitosan nie je vhodný ako gélotvorný základ.
Kľúčové slová:
heptakaín • pentakaín • karbizokaín • biopolymér • liberáciaÚvod
Vstrebávanie liečiv z hydrogélov ovplyvňuje okrem teploty, pH, koncentrácie liečiva aj typ použitého polyméru. Prostredníctvom použitej gélotvornej látky možno ovplyvňovať rýchlosť a rozsah absorpcie liečiva. Optimálny gélotvorný základ by mal byť fyzikálne, chemicky a mikrobiologicky stabilný, biokompatibilný a schopný rýchlo uvoľniť liečivo do stratum corneum.
Väčšina súčasne používaných polymérov je syntetického pôvodu, ich biokompatibilita a biologická odbúrateľnosť je oveľa obmedzenejšia ako u prírodných polymérov, ku ktorým patrí aj chitín, chitosan a ich deriváty. Vo farmácii majú preto v posledných rokoch významné postavenie biodegradovateľné polyméry vďaka ich biokompatibilite, biodegradabilite, adsobčnej schopnosti a netoxickým vlastnostiam1).
Jeden z týchto biodegradovateľných polymérov je aj predmetom formulácie lokálnych anestetík do hodnotených hydrogélov. Jedná sa o chitosan, ktorý sa získava z chitínu kôrovcov. Patrí medzi perspektívne polysacharidy so širokou škálou využitia v rôznych aplikáciách. Uplatňuje sa ako základ pri príprave hydrogélov. Náplasti a gély s obsahom chitosanu udržujú vlhkosť a súčasne z rany absorbujú nadbytočnú vlhkosť. Pôsobia chladivo a majú upokojujúci efekt. Používa sa v terapii dekubitov a popálenín, znižuje tvorbu jaziev, podporuje hojenie rán, má antimikrobiálny efekt a patrí medzi liečivá podporujúce granuláciu. Chitosan disponuje tiež výbornými biodegradačnými, biokompatibilnými, bioadhezívnými a antioxidačnými vlastnosťami. Pri nanesení na ranu má dezinfekčný, hemostatický a analgetický účinok2), čo vytvára predpoklad jeho možného uplatnenia pri formulácii lokálnych anestetík. Používa sa v oftalmológii – disponuje výhodnými vlastnosťami (optická jasnosť, imunologická kompatibilita, mechanická stabilita, dostatočné optické korekcie, priepustnosť plynov, zmáčanlivosť), čo sa uplatňuje pri výrobe kontaktných šošoviek. Chitosan má antacídne a antiulcerózne vlastnosti, používa sa vo funkcii nosiča rôznych liečiv s riadeným uvoľňovaním. Uplatňuje sa pri transdermálnej absobcii, pri nosovej a orálnej aplikácii a pri formulácii vakcín1).
Chitosan sa ľahko rozpúšťa v kyslom prostredí, kedy dochádza k protonizácii aminoskupiny, vlákna polyméru získavajú súhlasný kladný náboj a odpudzujú sa, v dôsledku čoho polymér napučiava. Zmenou jeho fyzikálno-chemických vlastností sa zabezpečí uvoľňovanie liečiva. Na základe molekulovej hmotnosti chitosanu možno ovplyvniť jeho biologickú aktivitu. Stúpajúcou molekulovou hmotnosťou sa spomaľuje liberácia liečiva z hydrogélu3).
Vzhľadom na to, že v terapeutickej praxi používané lokálne anestetiká sa vyrábajú vo forme gélov hlavne na báze derivátov celulóz, cieľom tejto štúdie bola formulácia vybraných lokálnych anestetík do hydrogélov na báze chitosanu. V štúdii sa sledoval vplyv rôznych typov chitosanu na tokové vlastnosti a liberáciu vybraných lokálnych anestetík z hydrogélov.
Pokusná časť
Použité chemikálie
Heptakaíniumchlorid (HEP) – heptacaine-N-[(2-heptyloxyfenylkarbamoyloxy)-ethyl]-piperidíniumchlorid; Karbizokaíniumchlorid (KAR) – 1-[2-(2-heptyloxyfenylkarbamoyloxy) - 2-metyletyl]-dietylamóniumchlorid; Pentakaíniumchlorid (PEN) – (+/-)-trans-[(3-pentyloxyfenylkarbamoyloxy)-2-cyklohexyl]-pyrolidíniumchlorid – pripravila Katedra farmaceutickej chémie, Farmaceutická fakulta, UK, Bratislava; chitosan – 3 typy: A – chitosan získaný z kreviet – molekulová hmotnosť 190 000 až 375 000 – (Sigma – Aldrich, USA); B – chitosan – molekulová hmotnosť 190 000–310 000 – (Sigma – Aldrich, USA); C – chitosan sukcinát získaný z kôrovcov – Liposan UltraTM (Vanson Europe LTD, Cheshire, England); kyselina mliečna (Interpharm, SR); chlorid sodný (Natrii chloridum SL1) Spolchim spol. s.r.o., Bratislava, SR) na prípravu izotonického roztoku.
Použité prístroje a materiál
Permeačná aparatúra vyrobená na KGF, FaF, UK, Bratislava, SR; Permeačná membrána (celofán) – EKOZ s. r. o, SR; Spektrofotometer – Philips Pyll Unicam 8625 Ltd., Cambridge, GB; Termostat U 10-Prüfgeräte – Werk Medingen, D; Viskotester VT 500 Haake Mess-Technik GmbH, Karlsruhe, D.
Zloženie a príprava hydrogélov:
Navážené množstvo liečiva sa rozpustilo v 1% roztoku kyseliny mliečnej, potom sa dispergoval chitosan a dovážil sa roztok kyseliny mliečnej do predpísanej hmotnosti hydrogélu. Liečivá (HEP, KAR, PEN) boli použité v 0,1% (m/m) koncentrácii. Vo funkcii gélotvornej látky sa použili 3 typy chitosanu (CHIT A, CHIT B, CHIT C). Pre porovnanie výsledkov tokových vlastností hydrogélov boli pripravené gély bez a s obsahom liečiv.
Stanovenie reologických parametrov
Reologické vlastnosti hydrogélov sa hodnotili 48 h po príprave hydrogélov pomocou rotačného viskozimetra VISCOTESTER VT 500 pri teplote 20° C ± 0,2° C.
Liberácia liečiv z hydrogélov a stanovenie obsahu liečiv
Liberácia liečiv sa sledovala použitím permeačnej aparatúry v 6 komôrkach, kde do donorovej časti sa dali 3 g gélu a do akceptorovej časti 20 ml fyziologického roztoku (0,9% NaCl). Aparatúra sa temperovala na 37 °C ± 0,2 °C. Odbery sa robili v časovom rozsahu 3 hodín, t.j. po 15., 30., 45., 60., 90., 120. a 180. minúte. Ako semipermeabilná membrána bol použitý celofán. Vykonalo sa 6 paralelných stanovení. Uvoľnené množstvo liečiv sa stanovilo spektrofotometricky pri príslušnej vlnovej dĺžke: λPEN = 238 nm, λKAR = 279 nm, λHEP = 233 nm.
Výsledky
V prvej časti štúdie sa hodnotila liberácia liečiva HEP z chitosanových hydrogélov. Zistilo sa, že liečivo sa veľmi pomaly uvoľňovalo, z pomedzi použitých CHIT A, B a C sa najviac liečiva uvoľnilo z CHIT B (0,055 mg/20 ml) (graf 1), potom z CHIT C (0,033 mg/20 ml) a najmenej z CHIT A (0,031 mg/20 ml). Tieto rozdiely neboli štatisticky významné. Rýchlostná konštanta uvoľňovania HEP bola najvyššia v prípade CHIT B v 180. min (k180 = 0,006 h-1).
Graf 1. Uvoľnené množstvo liečiv po 180. min z hydrogélov na báze troch typov CHIT 
PEN sa najpomalšie uvoľňoval z gélu CHIT A (graf 1) – uvoľnené množstvo po 180. min tvorilo 1,091 mg/20 ml (štatistický významný rozdiel (P < 0,05) oproti CHIT B a CHIT C). Z ostatných dvoch typov chitosanových gélov bolo uvoľňovanie rýchlejšie, avšak vzájomne veľmi podobné (rozdiel nebol štatisticky významný). Po 180. min sa uvoľnilo z hydrogélu na báze CHIT C 1,620 mg/20 ml, takmer rovnaké ako z hydrogélu na báze CHIT B 1,580 mg/20 ml. Vzhľadom na priebeh liberácie liečiva v jednotlivých časových intervaloch bol vyhodnotený ako optimálny gélotvorný základ CHIT B. Pri tomto type bola vypočítaná tiež najvyššia hodnota rýchlostnej konštanty uvoľňovania (k180 = 0,250 h-1).
V prípade lokálneho anestetika KAR sa v priebehu celej liberácie najlepšie uvoľňovalo liečivo z hydrogélu na báze CHIT C (graf 1) – rozdiel oproti ostatným typom bol štatisticky významný. Po 180. min sa najvyššie uvoľnené množstvo liečiva dosiahlo 1,365 mg/20 ml s najvyššou hodnotou rýchlostnej konštanty (k180 = 0,202 h-1). Pri ostatných dvoch typov základov to bolo: (CHIT A) 1,0203 mg/20 ml a (CHIT B) 0,9504 mg/20 ml.
Na základe reologického merania sa vypočítali maximálne hodnoty štruktúrnej viskozity gélov (tab. 1) s liečivom a bez liečiva. V prípade gélov bez liečiv najvyššiu hodnotu štruktúrnej viskozity mal gél na báze CHIT typ B. Na pridanie liečiva reagovali hydrogély rôznym spôsobom. V prípade CHIT A nastalo pomerne výrazné zvýšeniu štruktúrnej viskozity pri všetkých liečivách, pričom pri CHIT C tieto hodnoty poklesli. V prípade CHIT B liečivá PEN a KAR hodnoty štruktúrnej viskozity znížili a HEP zvýšilo.
Tab. 1. Maximálna hodnota štruktúrnej viskozity chitosanových gélov bez liečiva a s lokálnym anestetikom 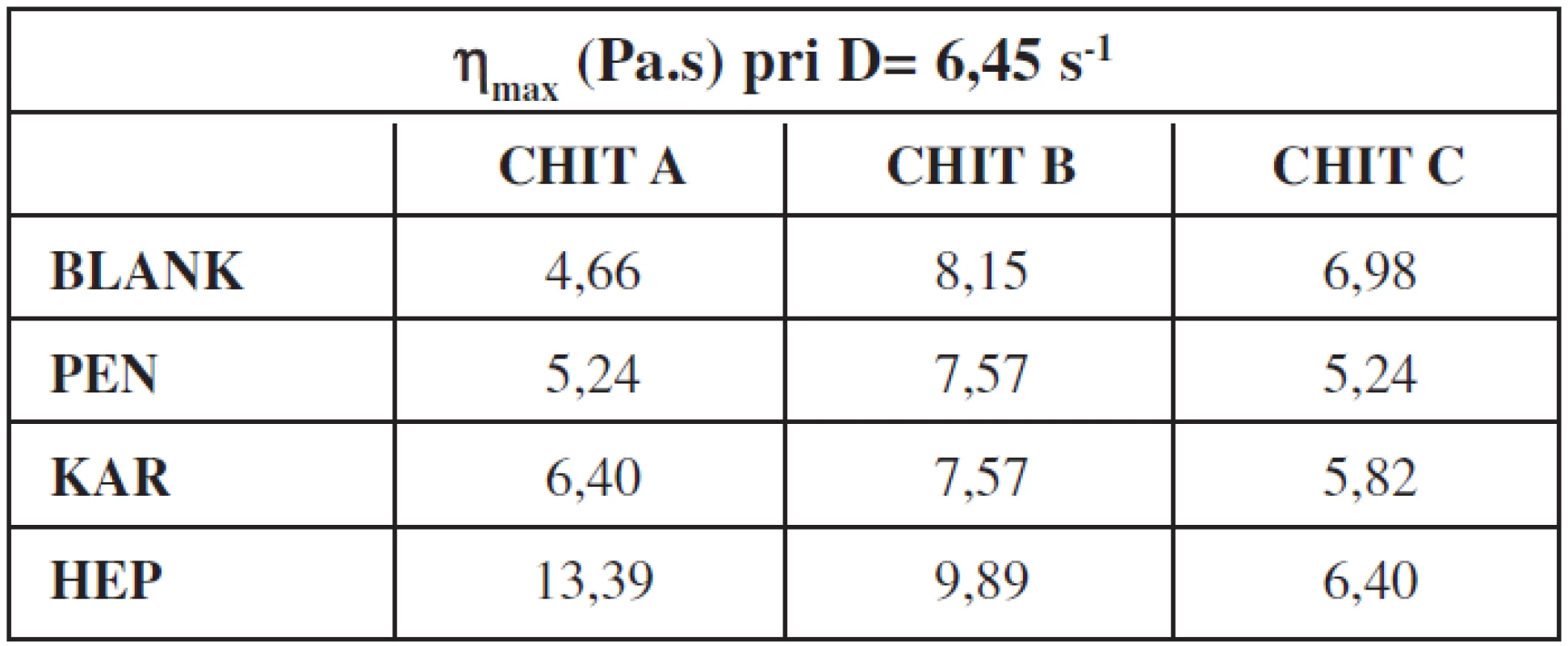
Z výsledkov reologického merania sa zostrojili tokové krivky hydrogélov na báze optimálnych gélotvorných základov. Z grafu 2 je vidieť, že gély mali nenewtonovské, časovo nezávislé plastické vlastnosti.
Graf 2. Tokové krivky hydrogélov 
Na základe vyhodnotenia všetkých dosiahnutých výsledkov sa stanovil optimálny typ chitosanu k príprave gélotvorných základov pre študované lokálne anestetiká. V prípade liečiva PEN – CHIT B; pre liečivo KAR – CHIT C. V prípade liečiva HEP sa zistilo, že chitosan nie je vhodný ako gélotvorný základ pre formuláciu tohto lokálneho anestetika, nakoľko liečivo sa z neho uvoľňuje len v malom množstve.
Stret záujmov: žiadny.
Došlo 18. októbra 2012 / Přijato 26. novembra 2012
Jozef Čižmárik1, Zuzana Vitková2, Petra Herdová2
1Katedra farmaceutickej chémie, Farmaceutická fakulta, Univerzita Komenského, Bratislava
Adresa pro korespondenci:
Zuzana Vitková
PharmDr. Petra Herdová, PhD.
2Katedra galenickej farmácie, Farmaceutická fakulta UK
Odbojárov 10, 832 32 Bratislava, Slovenská republika
e-mail: herdova@fpharm.uniba.sk
Zdroje
1. Majeti N.V., Kumar R. A review of chitin and chitosan applications. React. Polym. 2000; 46, 1–27.
2. Dasha M., Chiellini F., Ottenbriteb R. M., Chiellini E. Chitosan – a versatile semi-synthetic polymer in biomedical applications. Prog. Polym. Sci. 2011; 36, 981–1014.
3. Rinaudo M. Chitin and chitosan: Properties and applications. Prog. Polym. Sci., 2006; 31, 603–632.
Štítky
Farmácia Farmakológia
Článok vyšiel v časopiseČeská a slovenská farmacie

2012 Číslo 6-
Všetky články tohto čísla
- Halloysit – zajímavý nanotubulární nosič pro léčiva
- Vliv zinečnatých a kademnatých iontů na růst a produkci kumarinů v suspenzní kultuře Angelica archangelica L.
- Porovnanie produkcie sanguinarínu suspenznými kultúrami rastlín čeľade Papaveraceae
- Hodnocení obsahové stejnoměrnosti tablet s nízkým obsahem léčivé látky s úzkým terapeutickým indexem
- Analýza farmaceutické péče při dispenzaci léčiva orlistat v režimu OTC
- Fenylsalicyláty – nová skupina potenciálních antituberkulotik
-
Štúdium lokálnych anestetík – časť 200*
Výber optimálneho typu chitosanu pre formuláciu lokálnych anestetík karbamátového typu do hydrogélov - FIP oslavila 100. výročí
-
TEACHING COMMUNICATION SKILLS IN PHARMACY PRACTISE
TO KNOW AND TO DO ARE TWO DIFFERENT THINGS -
PATIENT COUNSELING IN PHARMACY PRACTICE
OPTIMIZATION OF DRUG THERAPY - The Czech Pharmaceutical Society 1871 - 2012
- Za doc. DrPh. PhMr. Jozefom Hegerom
- Príručka vybratých pojmov v analytickej chémii
- POKYNY PRO AUTORY ČASOPISU ČESKÁ A SLOVENSKÁ FARMACIE
- AUTORSKÝ REJSTŘÍK
- Věcný rejstřík
- Česká a slovenská farmacie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Hodnocení obsahové stejnoměrnosti tablet s nízkým obsahem léčivé látky s úzkým terapeutickým indexem
- Analýza farmaceutické péče při dispenzaci léčiva orlistat v režimu OTC
- Za doc. DrPh. PhMr. Jozefom Hegerom
- Halloysit – zajímavý nanotubulární nosič pro léčiva
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



