-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Možnosti neinvazivní diagnostiky u NAFLD
Noninvasive diagnostics in NAFLD
Non-alcoholic fatty liver disease (NAFLD) represents one of the most common chronic liver diseases affecting more than 25% of the population. The majority of patients have simple steatosis, but some develop liver cirrhosis with its complications. In such a prevalent condition there is a need for non-invasive diagnostic methods allowing stratification of patients without liver biopsy. This summary lists the current options of non-invasive diagnostics of NAFLD.
Key words:
non‑alcoholic fatty liver disease – fibrosis – elastography – non‑invasive diagnosis
The author declares he has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
28. 2. 2015Accepted:
16. 3. 2015
Autori: K. Dvořák
Pôsobisko autorov: IV. interní klinika 1. LF UK a VFN v Praze
Vyšlo v časopise: Gastroent Hepatol 2015; 69(2): 110-115
Kategória: Hepatologie: přehledová práce
doi: https://doi.org/10.14735/amgh2015110Súhrn
NAFLD (non‑alcoholic fatty liver disease) postihuje min. 25 % populace, a patří tak mezi nejčastější charonické jaterní choroby. Většina pacientů má prostou steatózu, avšak část pacientů dospěje do stadia jaterní cirhózy s jejími komplikacemi. Vzhledem k vysoké prevalenci tohoto onemocnění jsou hledány diagnostické metody, které by stratifikovaly pacienty bez nutnosti jaterní biopsie. Tento souhrn uvádí současné možnosti neinvazivní diagnostiky u pacientů s NAFLD.
Klíčová slova:
nealkoholové postižení jater – fibróza – elastografie – neinvazivní diagnostika
Nealkoholové postižení jater se steatózou (non‑alcholic fatty liver disease – NAFLD) je jednou z nejčastějších chronických jaterních chorob. Zahrnuje spektrum patologických stavů od prosté steatózy přes nealkoholovou steatohepatitidu (NASH) po jaterní cirhózu. Většina pacientů má prostou steatózu, ale část pacientů dospěje do stadia jaterní cirhózy s jejími komplikacemi včetně portální hypertenze a hepatocelulárního karcinomu. Najít tyto rizikové pacienty představuje zásadní, avšak značně obtížný úkol. U patologie, která postihuje minimálně čtvrtinu populace, je jistě nemyslitelné všem provádět jaterní biopsii, a proto bylo v posledním desetiletí studováno mnoho způsobů, jak v diagnostice NAFLD postupovat neinvazivně.
NAFLD je diagnóza per exclusionem vyžadující vyloučení ostatních možných příčin akumulace tuku v játrech či zvýšených jaterních testů.
Jaterní biopsie
Jaterní biopsie představuje tradiční standard v diagnostice NAFLD. Umožňuje nejen diagnostikovat jaterní steatózu, která je charakteristickým znakem a základním předpokladem NAFLD, ale umožňuje také vyloučit jiné jaterní choroby, jako jsou autoimunitní hepatitida, Wilsonova choroba a hemochromatóza. Dále umožňuje hodnotit nekroinflamatorní změny v jaterní tkáni, které jsou typickou známkou NASH (obr. 1). Dalším přínosem jaterní biopsie je možnost hodnocení pokročilosti jaterní fibrózy, jejíž tíže má pro konkrétního pacienta největší prognostický význam.
Obr. 1. Typický histologický obraz NASH (hemoatoxylin-eozin). Je patrná steatóza, balooning hepatocytů a fibróza. (Laskavě zapůjčeno as. MUDr. J. Stříteským, CSc. – Patologicko-anatomický ústav, 1. LF UK v Praze). Fig. 1. The typical histological picture of NASH (hematoxylin-eosin). Mixed steatosis, ballooning hepatocytes and fibrosis are evident. (Courtesy of J. Stříteský, MD, PhD. – Department of Pathology and Anatomy, 1<sup>st</sup> Faculty of Medicine, Charles University in Prague). 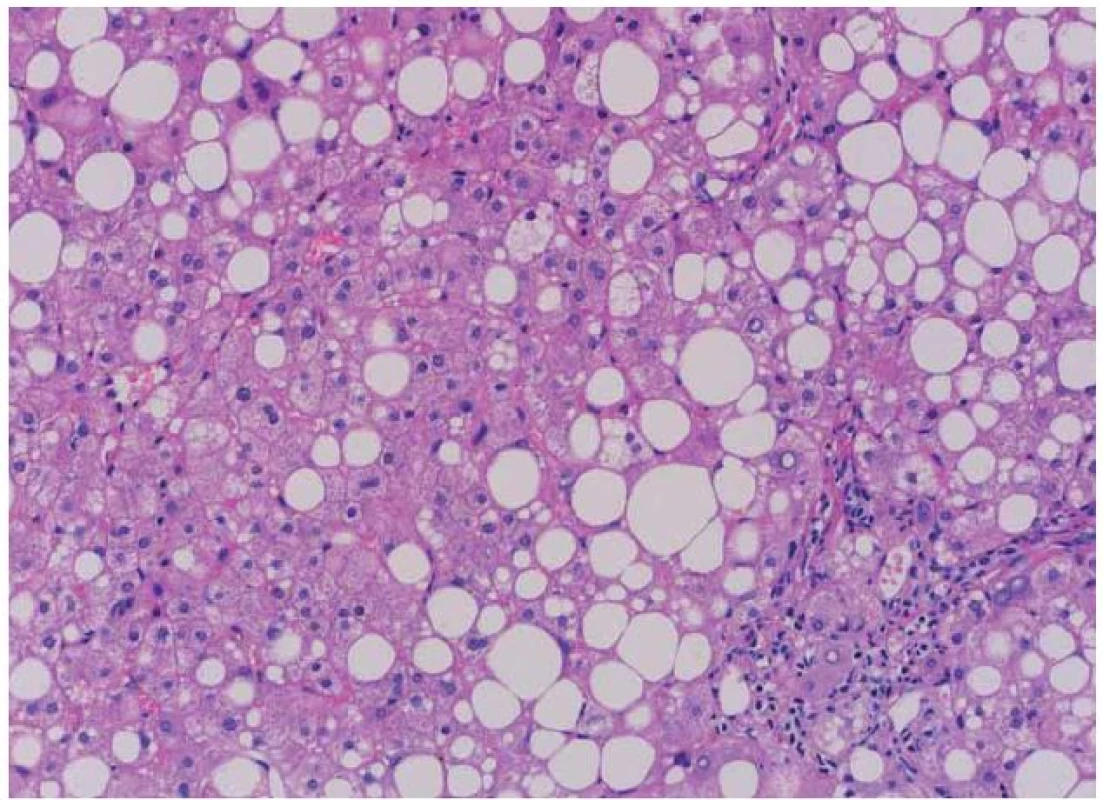
Základní nevýhodou jaterní biopsie je její invazivní charakter. Přestože je tato metoda obecně bezpečná, existuje zde tak jako u každé invazivní metody riziko komplikací – krvácení, pneumothorax, biliární peritonitida (vyskytují se u cca tří případů z 1 000). Perkutánní biopsie je kontraindikována při poruchách koagulace, ascitu, dilatovaných intrahepatálních žlučovodech nebo při polycystóze jater. Výkon vyžaduje souhlas paienta, který bývá k výkonu zpravidla hospitalizován. U výrazně obézních pacientů může být biopsie provedena transjugulární cestou.
Jaterní biopsie však i přes dlouhou historii užívání není zdaleka optimálním referenčním standardem. Získaný vzorek jaterní tkáně (ideálně váleček dlouhý 20 – 25 mm, alespoň 11 kompletních portálních polí) představuje pouze 1/ 50 000 objemu jaterní tkáně. Z analýzy jaterních biopsií u více než 8 700 pacientů vyplynulo, že tato kritéria nesplňuje ani polovina z nich [1]. Patologické změny v játrech navíc nejsou rozloženy zcela homogenně, čímž může docházet k dalšímu zkreslení [2]. To je navíc ještě zesíleno výraznou subjektivitou a variabilitou hodnocení patologem. Jaterní biopsie u NAFLD představuje specifickou problematiku, neboť skóre užívaná k hodnocení pokročilosti jaterní fibrózy u pacientů s chronickými virovými hepatitidami se pro NAFLD nehodí. Toto jsou tedy základní důvody potřeby najít neinvazivní metody diagnostiky NAFLD. Tato vyšetření by měla umožnit diagnostikovat jaterní steatózu s dostatečnou přesností, identifikovat pacienty s nealkoholovou steatohepatitidou a neinvazivně kvantifikovat jaterní fibrózu.
Hodnocení jaterní steatózy
Zobrazovací metody
Ultrazvukové vyšetření jater je nejběžnějším vyšetřením užívaným k diagnostice jaterní steatózy. Je běžně dostupné a nezatěžuje pacienta radiací. Senzitivita a specificita ultrasonografie pro steatózu jater je přes 90 %, pokud je mikrovezikulární steatózou postiženo přes 30 % hepatocytů [3]. Naproti tomu je steatóza jater histologicky definována jako akumulace tukových vezikul ve více než 5 % hepatocytů. Toto je třeba si uvědomit, když vyšetřujeme pacienta se suspekcí na NAFLD a na ultrazvuku nejsou patrné výraznější změny echogenity jaterního parenchymu. Typický ultrasonografický nález jaterní steatózy zahrnuje „světlejší“ (hyperechogenní) echotexturu jaterního parenchymu ve srovnání s parenchymem sousední pravé ledviny. Dále je to rozmazání okrajů větších jaterních cév (tzv. vessel blurring) a dorzální oslabení akustického signálu. Běžné ultrazvukové vyšetření jater není ani při kombinaci různých kritérií schopno predikovat přítomnost NASH nebo fibrózy s dostatečnou přesností. Dalším podstatným faktem je možná regrese steatózy při progresi základní choroby do stadia jaterní cirhózy způsobená navozeným katabolizmem.
Ostatní zobrazovací metody, jako jsou CT nebo MR, nepřinášejí žádný diagnostický benefit. Tyto metody jsou méně dostupné než ultrazvuk, CT je navíc zatíženo radiací a nemělo by být k diagnostice steatózy primárně užíváno. Dále existují moderní zobrazovací metody založené na MR, jako je dual gradient echo MRI a protonová MR spektroskopie, které mají senzitivitu a specificitu kolem 80 % pro detekci steatózy již při postižení pěti a více procent hepatocytů [4]. Tyto metody však u nás nejsou běžně dostupné. Navíc klinická hodnota přesné kvantifikace steatózy není jasná, protože klinické dopady vyplývají zejména z přítomnosti nekroinflamatorních změn a fibrózy, nikoli ze stupně jaterní steatózy [5].
Klinické parametry
Pacienti s NAFLD mívají ve srovnání se zdravou populací vyšší jaterní testy (ALT, AST a často zejména GGT). Elevace transamináz je mimo jiné asociována také s vyšší celkovou a kardiovaskulární mortalitou [6]. Nicméně přibližně polovina pacientů s NAFLD má normální jaterní testy [7], a transaminázy tak zůstávají nespolehlivým indikátorem zvýšené akumulace tuku v játrech. Fatty Liver Index [8] byl vyvinut ve snaze o spolehlivější ukazatel ztukovatění jater. Zahrnuje jednoduché parametry (obvod pasu, BMI, GGT a hladinu triglyceridů) a má více než 80% přesnost při detekci steatózy. Byl však validován pouze proti ultrasonografii. Více než pro běžnou klinickou praxi se hodí pro epidemiologické studie.
Neinvazivní diagnostika NASH
NASH přestavuje aktivní formu NAFLD, která progreduje do jaterní cirhózy až u 20 % případů [9]. Diagnostikovat NASH je však celkem obtížné. Tyto potíže souvisí jak s variabilitou vzorků jaterní tkáně, tak se subjektivitou jejich hodnocení. Právě tato fakta také významně komplikují vývoj, porovnání a validaci neinvazivních metod(obr. 1).
Klinické a základní biochemické parametry
Ačkoli jsou pacienti s NASH častěji obézní (zejména centrální typ obezity), mají častěji diabetes, hypertenzi a dyslipidemii, tak vzhledem k četnosti těchto stavů u pacientů s prostou steatózou neumožňuje přítomnost komorbidit činit relevantní závěry stran suspekce na NASH.
Aktivita aminotransferáz u NAFLD není indikátorem aktivity onemocnění. I pacienti s dlouhodobě normálním ALT mohou mít histologické známky aktivity zánětu. Pacienti s vyššími jaterními testy jsou ve větším riziku mít NASH, ale i při normální aktivitě aminotrasferáz může být přítomno celé spektrum histologických nálezů [10]. Navíc může být přechod do stadia jaterní cirhózy provázen poklesem ALT, což celou situaci dále komplikuje [11]. Určitou prediktivní hodnotu může mít elevace GGT, která je pro pacienty s NAFLD typická. Přestože asociace GGT s NASH není zcela jasná, je vyšší GGT spojeno se zvýšenou mortalitou. Ve velké populační sedmileté studii na pacientech s NAFLD bylo vyšší GGT spojeno s dvojnásobným vzestupem mortality [12]. Tito pacienti tak mohli mít spíše NASH než prostou steatózu.
Speciální laboratorní parametry a biomarkery
Adipokiny a cytokiny
Adipokiny jsou proteiny secernované adipocyty, které hrají významnou roli ve vývoji zánětu, inzulinové rezistence a lipidovém metabolizmu obecně. Adiponektin je adipokin s antiinflamatorním efektem, který zlepšuje inzulinovou senzitivitu. Plazmatické hladiny adiponektinu bývají u pacientů s NAFLD sníženy a korelují s tíží steatózy a v některých studiích s přítomností NASH. Adiponektin bývá snížen i při obezitě, metabolickém syndromu a diabetes mellitus 2. typu. Hladina adiponektinu v séru vykazuje průměrnou přesnost v rozlišení NASH a prosté steatózy (AUROC 0,76 – 0,79) [13]. U pacientů s NASH bývají také zvýšeny sérové hladiny prozánětlivých cytokinů jako TNFα a IL‑6 [14], ale tyto výsledky nebyly konzistentně potvrzeny všemi autory.
NASH je také stav charakteristický přítomností zvýšeného oxidačního stresu v játrech. Byly proto studovány různé markery oxidativního stresu (sérová hladina thioredoxinu, FGF ‑ 21, vitaminu E, glutathion peroxidáza a dalších), závěry těchto prací jsou však také rozporuplné.
Biomarkery apoptózy
Základním znakem NASH je poškození a apoptóza hepatocytů. Při apoptóze vede aktivace kaspáz v buňce ke štěpení jednotlivých substrátů, mezi které patří i cytokeratin 18. Cytokeratin 18 je specifická komponenta cytoskeletu hepatocytů. Bylo prokázáno, že množství fragmentů cytokeratinu 18 je zvýšeno nejen v játrech, ale i v séru u pacientů s NASH. Existují kity na stanovení jak fragmentů cytokeratinu (M30 - Apoptosense), tak ke stanovaní štěpeného i neštěpeného cytokeratinu 18 (M65 - Apoptosense). M30 reflektuje spíše apoptotickou aktivitu, M65 nekrózu. K rozlišení NASH nehraje výraznější roli, který z kitů se použije. Jako jediný biomarker byl validován více než 10 studiemi na více než 1 000 pacientech s NAFLD. Podle metaanalýzy z roku 2011 vykazuje AUROC 0,82 s 78% senzitivitou a 86% specificitou v rozlišení NASH a prosté steatózy [15]. Výsledky naší vlastní práce tyto závěry potvrzují. U 56 bioptovaných pacientů s NAFLD predikovalo stanovení cytokeratinu 18 M30/ M65 NASH s AUROC 0,85/ 0,89 [16].
Skórovací systémy
Byla navržena řada komplexních modelů a skórovacích systémů k predikci přítomnosti NASH. Většina z nich byla odvozena u specifických populací pacientů (zejména morbidně obézní). Jejich výsledky nejsou jednoznačně přesvědčivé a vyžadují externí validaci. Některé takovéto testy jsou k dispozici pouze komerčně a jejich využití v běžné klinické praxi v našich podmínkách není reálné.
Neinvazivní diagnostika jaterní fibrózy
Pokročilost jaterní fibrózy je pravděpodobně nejpodstatnější informací týkající se prognózy konkrétního pacienta. Navíc rozpoznání jaterní cirhózy umožňuje zařadit pacienta do ultrazvukového screeningu hepatocelulárního karcinomu a screeningu jícnových varixů. Běžné zobrazovací metody jako ultrazvuk, CT a MR dokáží rozpoznat jaterní cirhózu, pouze pokud jsou patrná játra s nerovným povrchem nebo jsou přítomny známky portální hypertenze, jako je ascites, dilatace portální žíly, splenomegalie nebo portosystémové kolaterály.
Sérové testy
Jak už bylo zmíněno výše, samotná aktivita aminotransferáz nevypovídá o pokročilosti jaterní fibrózy a pacient s normálními jaterními testy může mít i jaterní cirhózu. Větší hodnotu může mít poměr AST/ ALT. Jak ukázalo několik studií, poměr AST/ ALT > 1 může předpovídat pokročilou fibrózu [17].
Jaterní fibróza je výsledkem dynamického děje produkce a odbourávání extracelulární matrix. Z jejích komponent, které byly zkoumány ve smyslu možností neinvazivního hodnocení jaterní fibrózy, jsou to např. pentraxin‑3, 7S-doména kolagenu IV, N‑terminální peptid prokolagenu III (PIIINP), tkáňový inhibitor metaloproteinázy 1 (TIMP - 1) a zejména kyselina hyaluronová (HA). Publikované studie, mezi které patří i naše vlastní práce [16], ukazují predikci pokročilé fibrózy s AUROC 0,75 – 0,97 [18].
Skórovací systémy
Prediktivních modelů a skórovacích systémů byla k neinvazivní diagnostice jaterní cirhózy u pacientů s NAFLD vyvinuta celá řada. Obvykle mají dobrou přesnost pro pokročilou fibrózu, méně přesné jsou pro fibrózu mírnou a středně pokročilou. Zahrnují od několika běžně dostupných parametrů po komplikovanější formule s běžně nestanovovanými parametry. Některé testy, jako je např. FibroTest (obsahuje bilirubin, GGT, α2 - makroglobulin a apolipoprotein A1), jsou dostupné pouze komerčně.
Jedním z jednodušších skóre je BAAT skóre (BMI, věk, ALT, triglyceridy), které vykazovalo 100% negativní prediktivní hodnotu k vyloučení septální fibrózy (100% senzitivitu, ale pouze 47% specificitu) [19]. Dalším podobným skóre je BARD skóre (BMI, AST/ ALT, diabetes) vzniklé na podkladě analýzy více než 800 bioptovaných obézních NAFLD pacientů [20]. Přítomnost alespoň dvou faktorů zvyšovala 17krát riziko pokročilé fibrózy s vysokou negativní prediktivní hodnotou.
European Liver Fibrosis Study Group vytvořila na základě analýzy více než tisíce pacientů (61 s NAFLD) ELF skóre [21]. Kombinuje věk, hladinu hyaluronové kyseliny v séru, PIIINP, TIMP ‑ 1. Pro pokročilou fibrózu u NASH vykazuje AUROC 0,87, u mírných a středně pokročilých stadií vykazuje podstatně horší výsledky. Užitečnost skóre byla prokázána na velké kohortě pacientů s chronickými virovými hepatitidami, ale jeho užití u pacientů s NAFLD je vzhledem k nízkému počtu NAFLD pacientů zahrnutých do analýzy otazné.
Nejvíce dat existuje k NAFLD Fibrosis Score [22]. Bylo externě validováno 13 studiemi na více než 3 000 pacientů [15]. Obsahuje věk, BMI, glykemii, počet trombocytů, albumin a poměr AST/ ALT (tab. 1). Vykazuje výbornou přesnost v diagnostice pokročilé fibrózy a je považováno za neinvazivní parametr, který může být používán v běžné klinické praxi. Přibližně čtvrtina pacientů spadne do šedé zóny mezi mírnou a pokročilou fibrózou.
Tab. 1. NAFLD Fibrosis Score, podle [22]. Tab. 1. NAFLD Fibrosis Score, according to [22]. ![NAFLD Fibrosis Score, podle [22].
Tab. 1. NAFLD Fibrosis Score, according to [22].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/b5f74050c3e490f2082ae56f68d4503e.jpg)
FIB ‑ 4 test (věk, ALT, AST, počet trombocytů) byl vyvinut k hodnocení pokročilé fibrózy u chronických jaterních chorob obecně. Při srovnání s ostatními skóre vykazuje velmi dobré výsledky s AUROC nad 0,8. Jedná se o slibný test, který vzhledem ke své jednoduchosti může být použit spolu s dalšími skóre.
Měření tuhosti jaterní tkáně – elastografie
Tranzientní elastografie hodnotí tuhost jaterní tkáně pomocí ultrazvukového hodnocení pulzních ech. Existují dva základní typy přístrojů. Jednoúčelový FibroScan®, který slouží pouze k měření elasticity jaterní tkáně, a dále systémy, které mají toto měření integrované do ultrazvukového přístroje – např. systém ARFI – Accustic Radiation Force Impulse) od firmy Siemens, Real Time Elastography od firmy Hitachi, Shear Wave Elastography firmy Aixplorer.
Sonda přístroje je přiložena do pravého mezižebří v místě obdobném pro provádění jaterní biopsie. Přístroj vyšle při měření mechanický nebo akustický impulz, který vede k vytvoření střihových vln (shear waves) v játrech. Poté sonda vyšle jiné ultrazvukové vlny sloužící k měření rychlosti šíření těchto střihových vln na základě Dopplerova principu. Podle pravidla, že vlny se šíří tím rychleji, v čím hustším prostředí procházejí, pak může být hodnocena tuhost jater, a tím jaterní fibróza. Tento postup byl validován u mnoha jaterních chorob, nejvíce dat je u pacientů s chronickou hepatitidou C. U pacientů s NAFLD vykazuje dobrou přesnost s AUROC 0,84 – 0,99 pro fibrózu F2 – 4 a 0,93 – 1 pro F3 – 4 [23].
Zvýšení tuhosti jaterní tkáně však není vždy způsobeno pouze přítomností jaterní fibrózy. Měření je ovlivněno dalšími stavy, jako jsou přítomnost akutní hepatitidy (obecně elevace transamináz nad trojnásobek horního limitu normy), městnavé srdeční selhání nebo biliární obstrukce. Vzhledem k vyššímu prokrvení jater postprandiálně je i toto vyšetření nutno provádět na lačno. Průchod vln je dále ovlivňován tloušťkou podkožního tuku, což může vést ke zkreslení výsledků měření. Proto výrobce FibroScanu vyvinul XL sondu, která užívá nižší frekvenci ultrazvuku a hodnotí hlubší část jaterního parenchymu, čímž lze zvýšit úspěšnost a přesnost měření. Systémů integrovaných do ultrazvukových přístrojů se toto omezení netýká, protože tam je oblast měření volitelná a je vizualizována běžným ultrazvukovým B ‑ módem (obr. 2). Výsledky měření se však mezi jednotlivými výrobci mohou lišit. Nespornou výhodou těchto přístrojů je možnost elastografického měření během běžného ultrazvukového vyšetření jater.
Obr. 2. Elastografie jater pomocí ARFI (přístroj Siemens Acuson S2000). Obdélník představuje oblast měření. Pro měření v játrech je nejvhodnější vzdálenost 3 cm pod jaterním pouzdrem. Měření prováděná povrchověji jsou zkreslena přítomností vaziva v jaterním pouzdře a vykazují falešně vyšší hodnoty. Fig. 2. Elastography of the liver using ARFI (Siemens Acuson S2000 device). The rectangle represents the area of measurement. For measurement in the liver the most appropriate distance is 3 cm below the liver capsule. Measurements made closer to the surface are distorted by the presence of connective tissue in the liver capsule and show falsely higher values. 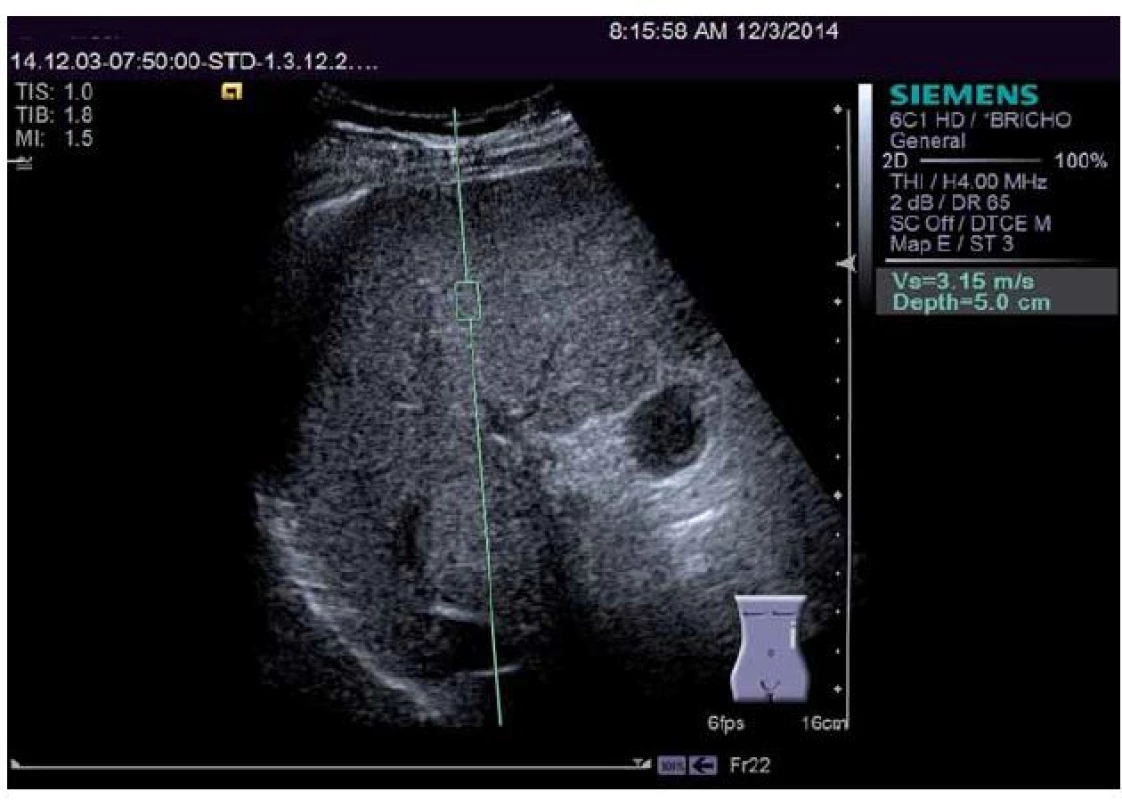
Další metodou schopnou posoudit propagaci střihových vln v jaterním parenchymu je MR elastografie. Obdobně jako při použití FibroScanu® je na pacienta přiložen generátor střihových vln, jejichž propagace je poté hodnocena pomocí metod MR. Výhodou metody je analýza celého jaterního parenchymu, solidní přesnost (AUROC 0,96 – 0,99) [24], nevýhodou jsou vysoké náklady, malá dostupnost a nízké počty pacientů v publikovaných pracích [15].
Obrovské množství různých diagnostických skóre vede k nejistotě, co tedy použít v klinické praxi. V současné době je za nejvíce validované považováno NAFLD Fibrosis Score. Skládá se navíc z jednoduchých klinických parametrů, a je tak dobrým nástrojem pro běžnou klinickou praxi. Elastografické metody rovněž poskytují dostatečnou přesnost k rozlišení pacientů s pokročilou fibrózou. V západním světě již běžně fungují jako alternativa k jaterní biopsii u pacientů s chronickou hepatitidou C, to samé lze očekávat i u pacientů s ostatními jaterními chorobami včetně NAFLD.
Závěr
V neinvazivní diagnostice jaterní steatózy vede díky své dostupnosti běžná sonografie jater, která pravděpodobně nebude v nejbližší době překonána. Je třeba mít na mysli, že nepřítomnost typických ultrazvukových změn (jako je vyšší echogenita jaterního parenchymu) nemusí znamenat nepřítomnost vyšší akumulace tuku v játrech. Laboratorní metody a skóre nemají pro diagnostiku steatózy v současné době dostatečnou přesnost.
Z parametrů týkajících se predikce přítomnosti nealkoholové steatohepatitidy je nejvíce validovaným markerem stanovení cytokeratinu 18 v séru. Vzhledem k omezené dostupnosti však zatím tento marker nebyl zaveden do běžné klinické praxe.
Jediným adekvátně validovaným diagnostickým nástrojem k neinvazivní diagnostice jaterní fibrózy u NAFLD je NAFLD Fibrosis Score a dále tu jsou elastografické metody (FibroScan®, ARFI apod.), které dokáží spolehlivě prokázat pokročilou fibrózu a napomoci v rozhodnutí, zda provádět jaterní biopsii. FibroScan® má více dat a lepší standardizaci, ostatní metody však mají výhodu, že jsou integrovány do ultrazvukového přístroje.
I přes nesmírný pokrok v neinvazivní diagnostice NAFLD/ NASH a jaterních chorob obecně nejsou tyto metody zdaleka perfektní. Nenahrazují jaterní biopsii, ale v mnoha případech mohou výrazně napomoci stagingu onemocnění zejména u pacientů, kteří jaterní biopsii odmítají. V neposlední řadě také nabízí možnost snadného sledování vývoje nemoci v průběhu času.
Podpořeno SVV 260156/ 2015 a IGA NT 12290/4.
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 28. 2. 2015
Přijato: 16. 3. 2015
MU Dr. Karel Dvořák
IV. interní klinika
1. LF UK a VFN v Praze
U Nemocnice 499/ 2, 128 08 Praha 2
k2dvorak@gmail.com
Zdroje
1. Cholongitas E, Senzolo M, Standish R et al. A systematic review of the quality of liver biopsy specimens. Am J Clin Pathol 2006; 125(5): 710 – 721.
2. Ratziu V, Charlotte F, Heurtier A et al. Sampling variability of liver biopsy in nonalcoholic fatty liver disease. Gastroenterology 2005; 128(7): 1898 – 1906.
3. Hernaez R, Lazo M, Bonekamp S et al. Diagnostic accuracy and reliability of ultrasonography for the detection of fatty liver: a meta‑analysis. Hepatology 2011; 54(3): 1082 – 1090. doi: 10.1002/ hep.24452.
4. Lee SS, Park SH, Kim HJ et al. Non ‑ invasive assessment of hepatic steatosis: prospective comparison of the accuracy of imaging examinations. J Hepatol 2010; 52(4): 579 – 585. doi: 10.1016/ j.jhep.2010.01.008.
5. Wong VW, Wong GL, Choi PC et al. Disease progression of non‑alcoholic fatty liver disease: a prospective study with paired liver biopsies at 3 years. Gut 2010; 59(7): 969 – 974. doi: 10.1136/ gut.2009.205088.
6. Ekstedt M, Franzén LE, Mathiesen UL et al. Long‑term follow‑up of patients with NAFLD and elevated liver enzymes. Hepatology 2006; 44(4): 865 – 873.
7. Neuschwander ‑ Tetri BA, Clark JM, Bass NM et al. Clinical, laboratory and histological associations in adults with nonalcoholic fatty liver disease. Hepatology 2010; 52(3): 913 – 924. doi: 10.1002/ hep.23784.
8. Bedogni G, Bellentani S, Miglioli L et al. The Fatty Liver Index: a simple and accurate predictor of hepatic steatosis in the general population. BMC Gastroenterol 2006; 6 : 33.
9. McCullough AJ. The clinical features, diagnosis and natural history of nonalcoholic fatty liver disease. Clin Liver Dis 2004; 8(3): 521 – 533.
10. Mofrad P, Contos MJ, Haque M et al. Clinical and histologic spectrum of nonalcoholic fatty liver disease associated with normal ALT values. Hepatology 2003; 37(6): 1286 – 1292.
11. Hui AY, Wong VW, Chan HL et al. Histological progression of non‑alcoholic fatty liver disease in Chinese patients. Aliment Pharmacol Ther 2005; 21(4): 407 – 413.
12. Haring R, Wallaschofski H, Nauck M et al. Ultrasonographic hepatic steatosis increases prediction of mortality risk from elevated serum gamma ‑ glutamyl transpeptidase levels. Hepatology 2009; 50(5): 1403 – 1411. doi: 10.1002/ hep.23135.
13. Hui JM, Hodge A, Farrell GC et al. Beyond insulin resistance in NASH: TNF‑alpha or adiponectin? Hepatology 2004; 40(1): 46 – 54.
14. Jarrar MH, Baranova A, Collantes R et al. Adipokines and cytokines in non‑alcoholic fatty liver disease. Aliment Pharmacol Ther 2008; 27(5): 412 – 421.
15. Musso G, Gambino R, Cassader M et al. Meta‑analysis: natural history of non‑alcoholic fatty liver disease (NAFLD) and diagnostic accuracy of non‑invasive tests for liver disease severity. Ann Med 2011; 43(8): 617 – 649. doi: 10.3109/ 07853890.2010.518623.
16. Dvorak K, Stritesky J, Petrtyl J et al. Use of non‑invasive parameters of non‑alcoholic steatohepatitis and liver fibrosis in daily practice – an exploratory case ‑ control study. PLoS One 2014; 9(10): e111551. doi: 10.1371/ journal.pone.0111551.
17. Angulo P, Keach JC, Batts KP et al. Independent predictors of liver fibrosis in patients with nonalcoholic steatohepatitis. Hepatology 1999; 30(6): 1356–1362.
18. Machado MV, Cortez ‑ Pinto H. Non ‑ invasive diagnosis of non‑alcoholic fatty liver disease. A critical appraisal. J Hepatol 2013; 58(5): 1007 – 1019. doi: 10.1016/ j.jhep.2012.11.021.
19. Ratziu V, Giral P, Charlotte F et al. Liver fibrosis in overweight patients. Gastroenterology 2000; 118(6): 1117 – 1123.
20. Harrison SA, Oliver D, Arnold HL et al.Development and validation of a simple NAFLD clinical scoring system for identifying patients without advanced disease. Gut 2008; 57(10): 1441 – 1447. doi: 10.1136/ gut.2007.146019.
21. Guha IN, Parkes J, Roderick P et al. Noninvasive markers of fibrosis in nonalcoholic fatty liver disease: Validating the European Liver Fibrosis Panel and exploring simple markers. Hepatology 2008; 47(2): 455 – 460.
22. Angulo P, Hui JM, Marchesini G et al. The NAFLD fibrosis score: a noninvasive system that identifies liver fibrosis in patients with NAFLD. Hepatology 2007; 45(4): 846 – 854.
23. Wong VW, Vergniol J, Wong GL et al. Diagnosis of fibrosis and cirrhosis using liver stiffness measurement in nonalcoholic fatty liver disease. Hepatology 2010; 51(2): 454 – 462. doi: 10.1002/ hep.23312.
24. Huwart L, Sempoux C, Vicaut E et al. Magnetic resonance elastography for the noninvasive staging of liver fibrosis. Gastroenterology 2008; 135(1): 32 – 40. doi: 10.1053/ j.gastro.2008.03.076.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2015 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Nejen o hepatitidách
- Komplikace perkutánní endoskopické gastrostomie
- Léčba chronické virové hepatitidy C simeprevirem
- Možnosti neinvazivní diagnostiky u NAFLD
- Funkční varianty genů pro metaloproteinázy MMP‑ 1 a MMP‑ 7 nesouvisejí se závažností portální hypertenze u pacientů s cirhózou
- Autochtónny prípad vírusovej hepatitídy E na Slovensku
- Dvacet let urgentního ERCP ve FN v Motole
- Poruchy motility pažeráka – Chicagska klasifikácia, v3.0
- Atypický obraz infiltrace tračníku lymfomem u pacienta s chronickou lymfatickou leukemií
- SOUTĚŽ O NEJLEPŠÍ KAZUISTIKU 2015
- Vedolizumab v léčbě Crohnovy choroby
-
Správná odpověď na kvíz
Syndrom zanořeného disku – buried bumper syndrom (BBS) - Nová perorální antikoagulancia – přednosti a úskalí léčby
- Report of XXth Gastroforum
- ECCO – Inflammatory Bowel Diseases 2015
- IBD pracovní dny 2015, Hořovice
- Nová platforma webu časopisu Gastroenterologie a hepatologie a spolupráce s Národní lékařskou knihovnou
- Zprávy z redakce
- Maltofer®
- Autodidaktický test: hepatologie
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Maltofer®
- Atypický obraz infiltrace tračníku lymfomem u pacienta s chronickou lymfatickou leukemií
- Nová perorální antikoagulancia – přednosti a úskalí léčby
- Poruchy motility pažeráka – Chicagska klasifikácia, v3.0
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



