-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Sartanová enteropatie – kazuistika a přehled literatury
Sartan associated enteropathy – case report and review of the literature
Sartan-associated enteropathy is a sprue-like diarrhoeal disease induced by sartans (especially olmesartan) and is characterised by damage to the small intestine. Villous atrophy with lymphocytic infiltration of lamina propria is usually present and can be associated with intraepithelial lymphocytosis and/or subepithelial collagen deposits. The course of the disease is sometimes severe; however, withdrawal of medication leads to the complete reversal of symptoms and drug re-challenge results in the reappearance of the clinical signs of the disease. This side effect of the drug is relatively rare compared with the number of patients treated with olmesartan. Nevertheless, it represents a frequent and important diagnostic alternative in cohorts of patients with non-coeliac sprue. The disease is presumably caused by an autoimmune mechanism in predisposed individuals. We present a case report of telmisartan-associated enteropathy.
Key words:
olmesartan – sprue – enteropathy – angiotensin II type 1 receptor blockers – celiac disease
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
26. 8. 2015Accepted:
22. 9. 2015
Autori: J. Cyrany 1; T. Vašátko 1; M. Nová 2; E. Hovorková 2; J. Macháč 3; J. Szanyi 3; M. Kopáčová 1
Pôsobisko autorov: II. interní gastroenterologická klinika LF UK a FN Hradec Králové 1; Fingerlandův ústav patologie, LF UK a FN Hradec Králové 2; Klinika infekčních nemocí LF UK a FN Hradec Králové 3
Vyšlo v časopise: Gastroent Hepatol 2016; 70(2): 150-156
Kategória: Klinická a experimentální gastroenterologie: kazuistika
doi: https://doi.org/10.14735/amgh2016csgh.info01Súhrn
Sartanová enteropatie je sprue podobné průjmovité onemocnění asociované s užíváním sartanů (především olmesartanu), při kterém prokazujeme poškození tenkého střeva, nejčastěji v podobě vilózní atrofie s lymfocytární infiltrací lamina propria, v některých případech s intraepiteliální lymfocytózou a/nebo subepiteliálními kolagenními depozity. Současně je nutné vyloučit jiné příčiny enteropatie, především celiakii. Onemocnění může mít i závažný průběh, ale vysazení léku vede k uzdravení, příznaky je možné reprodukovat znovunasazením léku. Vzhledem k množství olmesartanem léčených pacientů se tento nežádoucí účinek objevuje vzácně. V kohortě pacientů s neceliakální sprue se však jedná o častou a důležitou diferenciálně diagnostickou možnost. Onemocnění vzniká pravděpodobně autoimunitním mechanizmem u predisponovaných jedinců. Prezentujeme případ pacientky s enteropatií asociovanou s užíváním telmisartanu.
Klíčová slova:
olmesartan – sprue – enteropatie – blokátory receptoru typu 1 pro angiotensin II – celiakieÚvod
Nejčastější příčinou malasimilačního syndromu v rozvinutých zemích je celiakie. Diferenciální diagnostika enteropatií jiných než celiakie je komplexní a často obtížná. V posledních letech bylo dokumentováno již více než 100 případů enteropatie asociované s užíváním sartanů, především olmesartanu. Případy jsou charakterizované průjmy, úbytkem hmotnosti a různou mírou poškození tenkého střeva.
Blokátory AT1 receptoru pro angiotenzin II (ARB – angiotensin II receptor blockers), sartany, jsou jako antihypertenziva používány od roku 1995. Jejich výhodou je absence nežádoucích účinků souvisejících s kumulací degradačních produktů bradykininu ve tkáních (např. kašel), které komplikují léčbu inhibitory enzymu konvertujícího angiotensin (ACE inhibitory). Olmesartan medoxomil představuje proléčivo olmesartanu a byl uveden na trh léčby arteriální hypertenze v roce 2002, v roce 2012 jím byly v USA léčeny téměř 2 miliony pacientů [1].
Kazuistika
Koncem června 2013 navštívila 71letá pacientka ambulanci infekční kliniky pro vodnaté průjmy. Nemocná byla mnoho let léčena pro arteriální hypertenzi, β-blokátor byl v jejím případě kontraindikován pro syndrom chorého sinusového uzlu se sklonem k bradykardii. Aktuálně byla léčena kombinací nitrendipinu, indapamidu, rilmenidinu a telmisartanu, který nemocná užívala tři měsíce v dávce 80 mg denně (v minulosti se u ní objevil kašel při podávání ACE inhibitorů). Hyperlipidemie byla léčená atorvastatinem. Pacientka v minulosti podstoupila hysterektomii pro descensus uteru, appendektomii, totální endoprotézu obou kolenních kloubů a operaci bederní páteře. Nemocná dále trpěla depresemi (užívala citalopram a trazodon). Průjmy byly vodnaté až 20× denně, bez příměsi krve, nebyly provázeny horečkou, bolestmi břicha ani zvracením.
Nebyla prokázána infekční etiologie průjmu, ambulantně byla nasazena probiotika, podávání loperamidu vedlo jen k redukci počtu stolic přibližně na polovinu, intermitentně byla podávána infuzní terapie. Po měsíci musela být nemocná hospitalizována, při přijetí byl somatický nález normální. Nemocná v průběhu onemocnění zhubla celkem 10 kg (při přijetí hmotnost 86 kg, výška 158 cm; BMI 34 kg/m2). Laboratorně byla prokázána renální insuficience (max. hodnota urey 12,9 mmol/l a kreatininu 228 µmol/l), hypokalemie (min. 3,4 mmol/l), mírná hypoproteinemie (celková bílkovina 63,6 g/l; albumin 38,9 g/l; prealbumin 0,12 g/l), mírné zvýšení C-reaktivního proteinu (CRP) (maximální hodnota CRP 56,2 mg/l), posun doleva při normálním počtu leukocytů (7,57 × 109/l, 21 % tyčí). Hodnota volné frakce hormonu T3 byla normální. Kultivace výtěru z rekta byla opakovaně negativní, antigen i toxin Clostridium difficile byly opakovaně negativní, ve stolici nebyly nalezeny ani antigeny rotavirů, adenovirů či norovirů; standardní parazitologické vyšetření bylo negativní; infekce CMV (cytomegalovirus) metodou PCR (polymerase chain reaction) z krve nebyla prokázána. Během hospitalizace se průjmy zmírnily, po propuštění však trvaly (po přechodném vysazení během hospitalizace nemocná telmisartan užívala po propuštění nadále). Při sonografickém vyšetření břicha nebyla nalezena žádná patologie. Nemocná byla doporučena ke koloskopickému vyšetření, které prokázalo v tračníku jen mírná ložisková zarudnutí, v pravém tračníku s jemnými povlaky hlenu; klky v terminálním ileu se jevily zkrácené (obr. 1 a 2). V esovitém tračníku byly přítomny divertikly bez endoskopických známek kolitidy asociované s divertikly SCAD (segmental colitis associated with diverticulitis). Histologicky byla prokázána ve sliznici terminálního ilea atrofie klků s intraepiteliální lymfocytózou a výraznou zánětlivou infiltrací lamina propria s lymfoidními folikuly s aktivovanými zárodečnými centry (obr. 3) a s pásovitým subepiteliálním materiálem, dobře patrným v barvení modrým trichromem (obr. 4). Při vyšetření technikou polotenkých plastových řezů byla kromě těžké atrofie klků a subepiteliálního pruhu amorfního hyalinního materiálu prokázána také výrazná atrofie až zánik mikroklků (obr. 5). Také histologické vyšetření sliznice tračníku prokázalo pás hyalinního materiálu subepiteliálně v barvení modrými trichromem. Převážně lymfocytární infiltrát lamina propria obsahoval četné CD3 pozitivními lymfocyty, které fokálně pronikaly i do povrchového epitelu, kde byl jejich počet vyšší než 20 na 100 kolonocytů. Ve sliznici nebyly prokázány mikroby při barvení dle Grama ani inkluze CMV. Nálezy tedy odpovídaly kolagenní ileitidě a kolitidě.
Obr. 1. Koloskopie (Olympus CF H180AL). Terminální ileum s obrazem zkrácených klků. Fig. 1. Colonoscopy (Olympus CF H180AL). Terminal ileum with shortened villi. 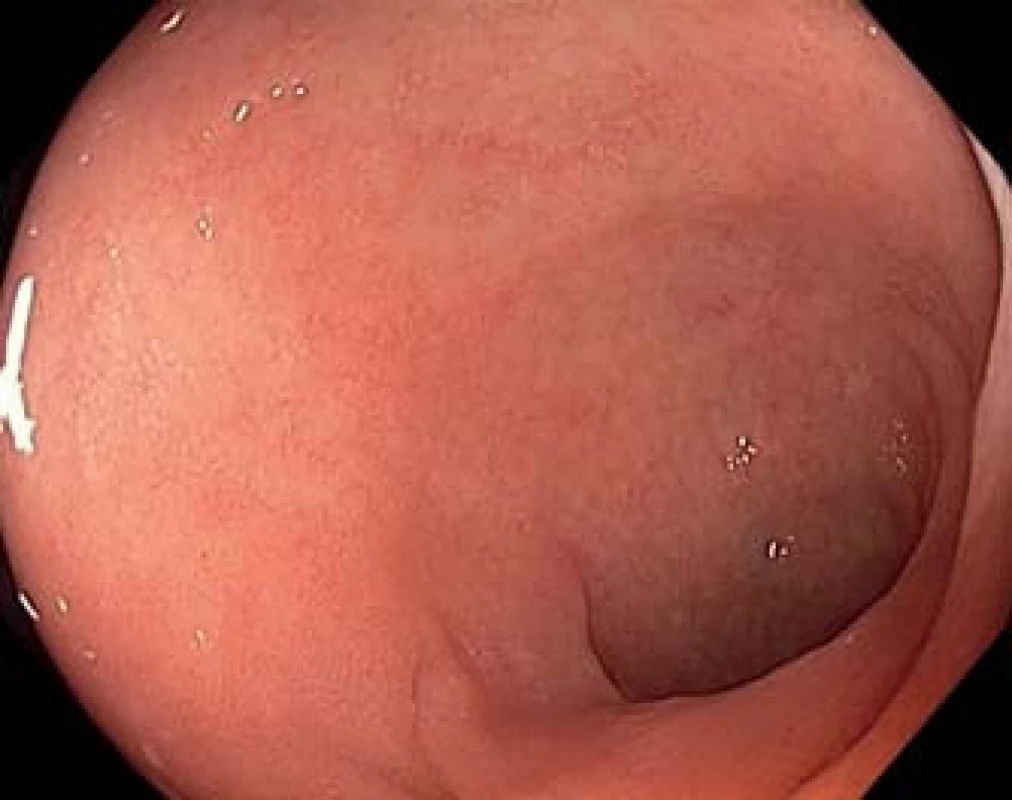
Obr. 2. Koloskopie (Olympus CF H180AL). Terminální ileum s obrazem zkrácených klků v obraze NBI (narrow band imaging) ve vodní imerzi. Fig. 2. Colonoscopy (Olympus CF H180AL). Terminal ileum with shortened villi in NBI (narrow band imaging) and water immersion. 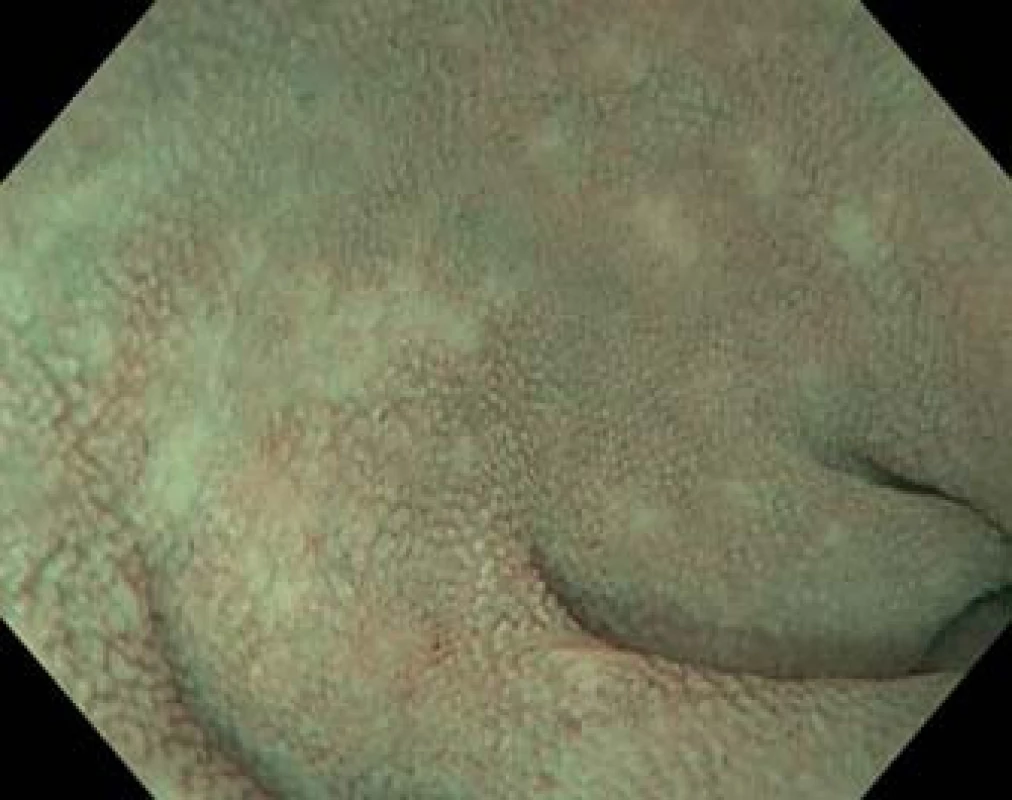
Obr. 3. Histologický obraz sliznice terminálního ilea prokazující atrofii klků, intraepiteliální lymfocytózu, zánětlivou infiltraci lamina propria a pásovitý subepiteliální hyalinní materiál (hematoxylin-eozin, zvětšení 200×). Fig. 3. Histology of terminal ileal mucosa con rming villi atrophy, intraepithelial lymphocytosis, in ammatory infiltration of lamina propria and band-like subepithelial hyalin material (haematoxylin-eosin, magnification 200×). 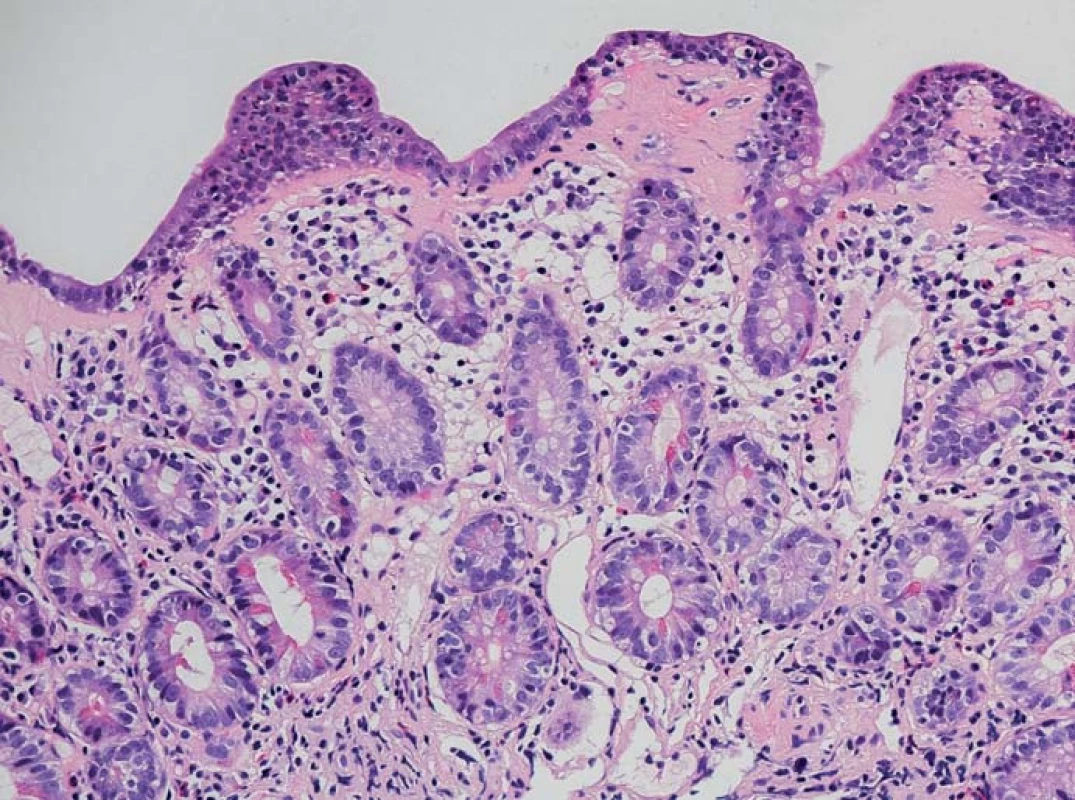
Obr. 4. Histologický obraz sliznice terminálního ilea se sytě modrým pásem subepiteliálního hyalinního materiálu při kolagenní ileitidě (modrý trichrom, zvětšení 200×). Fig. 4. Histology of terminal ileal mucosa with a deep blue band of subepithelial hyalin material: collagen ileitis (blue trichrome, magnification 200×). 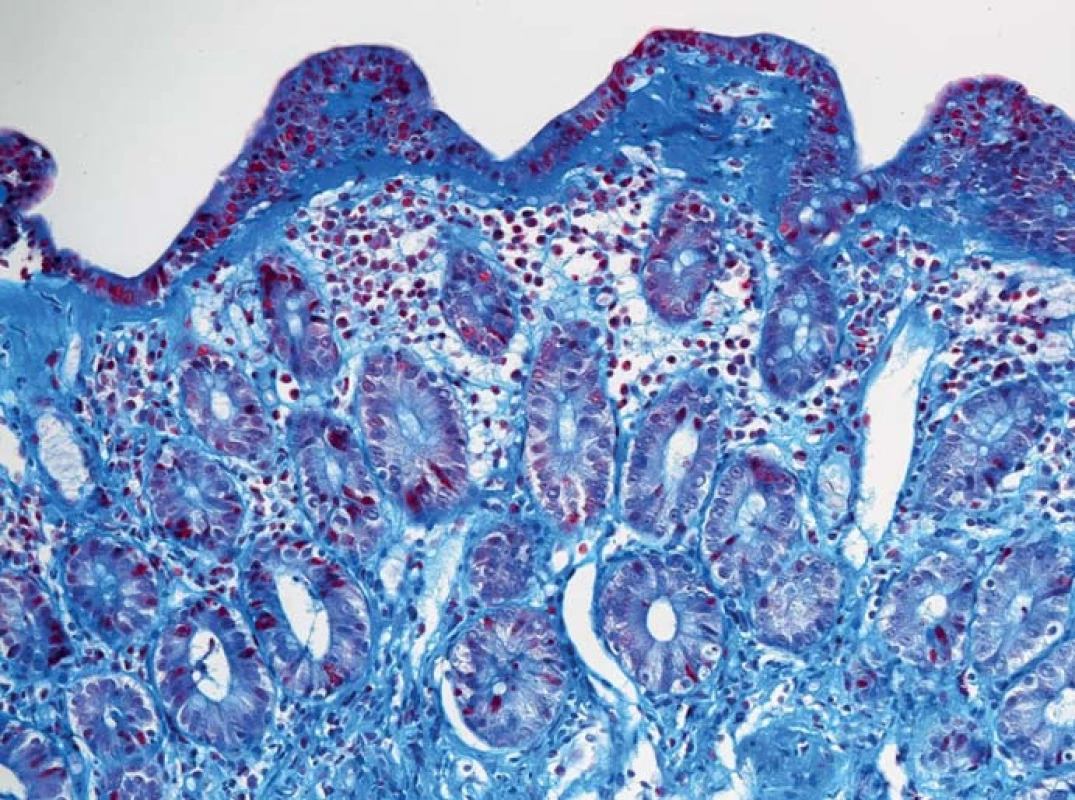
Obr. 5. Histologický obraz sliznice terminálního ilea prokazující kromě těžké atrofie klků a subepiteliálního pruhu amorfního hyalinního materiálu také výraznou atrofii mikroklků (technika polotenkých plastových řezů, zvětšení 400×). Fig. 5. Histology of terminal ileum mucosa revealing severe villous atrophy, subepithelial band of amorphous hyalin material and significant atrophy of microvilli (semi-thin plastic section, magnification 400×). 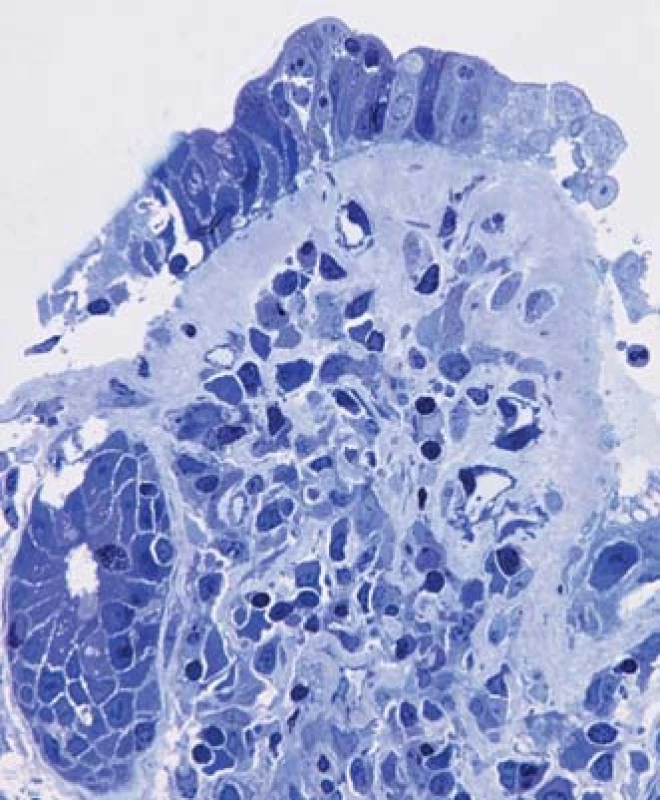
Byla provedena gastroskopie s nálezem budícím podezření na atrofii sliznice těla žaludku (výraznější podslizniční cévní kresba), ale bez endoskopických známek atrofie sliznice duodena (vč. posouzení v NBI a optickém zvětšení NearFocus). Ve sliznici těla žaludku byla histologicky prokázána atrofie žlázové vrstvy s minimální ložiskovou kompletní intestinální metaplazií a subepiteliální hyalinní materiál pozitivní při barvení PAS, v modrém trichromu a dle van Giesona. Nález tedy odpovídal kolagenní gastritidě. Ve sliznici duodena nebyla prokázána atrofie a množství intraepiteliálních lymfocytů (CD3 pozitivních) nebylo vyšší než 20 na 100 enterocytů, normální byl také nález při vyšetření metodou polotenkých plastových řezů.
Byl proveden vodíkový a metanový dechový test s nálezem signifikantního vzestupu výdeje vodíku – inkrement 17 ppm 100 min po podání substrátu (75 g glukózy).
Imunofluorescenčně stanovený antinukleární faktor (ANF IF) i protilátky proti dvouvláknové DNA (anti-dsDNA) v séru byly negativní. Přítomnost autoprotilátek proti parietálním buňkám žaludku, proti vnitřnímu činiteli a proti H+/K+ ATPáze svědčil pro autoimunitní povahu gastritidy. Protilátky asociované s celiakií byly negativní (IgA protilátky proti tkáňové transglutamináze i endomysiu při normální celkové hladině IgA). Pacientka je nositelkou genu HLA DQ2 (human leukocyte antigen) predisponujícího pro celiakii (HLA DQ8 negativní).
Po konzultaci gastroenterologa, provedení koloskopie a se znalostí histologického nálezu bylo vzneseno podezření na sartany indukovanou kolagenní sprue, telmisartan byl počátkem srpna 2013 vysazen. Po vysazení došlo k postupné normalizaci průjmu a k mírnému vzestupu hmotnosti, nebyla tedy indikována terapie systémovými ani topickými steroidy, ani bezlepková dieta. Nežádoucí účinek léku byl řádně hlášen Státnímu ústavu pro kontrolu léčiv. Biopsie odebrané při kontrolní koloskopii sedm měsíců po vysazení telmisartanu prokázaly prakticky kompletní regresi všech původních změn ve sliznici terminálního ilea i tračníku. Ve sliznici žaludku s odstupem 1,5 roku trvá nález chronické aktivní gastritidy s intestinální metaplazií, ale bez hyalinního subepiteliálního materiálu. Znovunasazení léku nebylo z etických důvodů opodstatněné.
Shrneme-li výše uvedené nálezy, u pacientky s onemocněním charakteru sprue byla prokázána kolagenní ileitida, kolitida a gastritida, která byla velmi pravděpodobně asociována s užíváním telmisartanu. Za predisponující faktor u nemocné můžeme považovat pozitivitu HLA DQ2 genu. Byl prokázán syndrom bakteriálního přerůstání v tenkém střevě, který je často s kolagenní enteropatií asociován.
Definice
Sartanovou enteropatii definujeme jako sprue podobné průjmovité onemocnění spojené s užíváním sartanů (především olmesartanu), při kterém prokazujeme poškození tenkého střeva, nejčastěji v podobě vilózní atrofie s lymfocytárním infiltrátem lamina propria, v některých případech s intraepiteliální lymfocytózou a/nebo subepiteliálními kolagenními depozity. Onemocnění může mít i život ohrožující průběh, dobře však reaguje na vysazení vyvolávajícího léku. Zároveň není prokázána jiná příčina enteropatie, především celiakie (absence specifických autoprotilátek a odpovědi na bezlepkovou dietu).
Historie
Asociaci mezi užíváním olmesartanu a enteropatií podobnou sprue poprvé popsali u skupiny 22 pacientů autoři z Mayo kliniky v Rochesteru [2] v roce 2012. První podezření pojali údajně sami pacienti vyšetřovaní pro suspektní refrakterní sprue, u kterých průjmy ustoupily během hospitalizace (kdy si hypotenze vynutila vysazení antihypertenziv) a znovu se objevily časně po propuštění. Ve stejné době byla na tomto pracovišti studována kohorta pacientů s kolagenní sprue a olmesartan užívala třetina z nich.
Epidemiologie
Systematický přehled italských autorů shrnuje 54 dosud popsaných případů enteropatie asociované s olmesartanem [3] – souhrn zahrnuje také již dříve publikované případy nebo jejich série [2,4–13]. Americká FDA (Food and Drugs Administration) registrovala 23 vážných případů této enteropatie do počátku roku 2013. Národní průzkum mezi francouzskými a belgickými gastroenterology odhalil 36 takových případů [14]. Kromě výše uvedeného byly publikovány ještě menší série případů [15] nebo jednotlivé kazuistiky [16–21]. Naše skupina publikovala první případ enteropatie asociované s telmisartanem [22], byly publikovány jednotlivé případy indukované irbesartanem [14,23] a valsartanem [24]. Onemocnění postihuje stejně často obě pohlaví [3] v průměrném věku kolem 70 let [3,14].
Etiopatogeneze
Patogenetický mechanizmus postižení není znám. Nejvíce se spekuluje o buněčném imunitním mechanizmu [14], inhibici transformujícího růstového faktoru β (TGF-β) sartany [2], zvažuje se i proapoptotický efekt angiotenzinu 2 na enterocyty [3]. Za predisponující faktor je považována častější přítomnost haplotypu HLA DQ2 nebo DQ8 typického pro celiakii (72 vs. 40 % v normální populaci) [3]. Sérologie celiakie je však vždy negativní. Pro autoimunitní etiologii svědčí také častý výskyt autoimunitních projevů v osobní nebo rodinné anamnéze nemocných, častá pozitivita antinukleárních protilátek, polyklonální intraepiteliální lymfocytóza a odpověď na imunosupresivní terapii [14]. Histologický obraz je podobný autoimunitní enteropatii [25]. Tři typy sartanů asociovaných s enteropatií (olmesartan, telmisartan a irbesartan) mají z této lékové skupiny nejdelší eliminační poločas (13–24 hod), naopak valsartan pouze 6 hod [10]. Medián podávané dávky olmesartanu u postižených byl 40 mg denně (10–60 mg) [14]. Olmesartan na myším modelu metotrexátem indukované mukozitidy vedl k rozvoji enteropatie s těžkým průjmem a hmotnostním úbytkem, ačkoli vykazoval protizánětlivou aktivitu (histologicky i dle tkáňových koncentrací myeloperoxidázy, malondialdehydu a cytokinů IL-1β, TNF-α) [26].
Klinické projevy
Nejčastějšími projevy jsou průjem (bez enteroragie; 95 % [3], 100 % [14]) a hmotnostní úbytek (89 % [3]). Průjmy jsou významné (v průměru šest stolic denně, 3–42 denně [2]), nezřídka vedoucí k těžké dehydrataci. Také hmotnostní úbytek bývá signifikantní (průměrně 18 kg, 2,5–57 kg [2]). Přibližně u poloviny nemocných se objevuje únava (56 % [3]), nauzea a zvracení (45 % [3], 56 % [14]), bolesti břicha (37 % [3], 75 % [14]); nadýmání je méně časté (29 % [3]). Mohou být přítomny otoky a serózní výpotky jako projev hypoproteinemie. V rodinné nebo osobní anamnéze pacientů se často objevuje autoimunitní onemocnění [14].
Diagnostika
Typickými laboratorními nálezy jsou normocytární anémie (45 % [3], 47 % [14]) a hypoalbuminemie (39 % [3]); častá je retence dusíkatých katabolitů (69 %) a hypokalemie (88 %), metabolická acidóza (56 % [14]). Podmínkou diagnózy jsou normální hodnoty autoprotilátek asociovaných s celiakií, u části pacientů byly nalezeny haplotypy HLA DQ2 nebo DQ8 (61 % [14]; 72 % [3]), antinukleární protilátky byly pozitivní u většiny pacientů, u kterých byly stanoveny [14].
Duodenoskopické nálezy mohou být normální (52 %), někdy je popisován mozaikový či nodulární charakter sliznice, případně známky atrofie klků (pokud autoři použili techniky i-scan (Pentax) a techniky vodní imerze), zřídka (14 %) byly popsány vředy. Nález v jejunu a ileu (při kapslové enteroskopii, ileokoloskopii a dvoubalonové enteroskopii) byl normální v polovině případů, známky atrofie byly v třetině případů, ulcerace byly nalezeny jen ve 12 % [14,27,28]. Bakteriální přerůstání bylo kultivací duodenálního aspirátu prokázáno u poloviny nemocných [2]. Při histologickém vyšetření bylo duodenum postiženo vilózní atrofií v naprosté většině případů (98 % [3], 89 % [14]), intraepiteliální lymfocytóza byla prokázána v 65 % (více než 40 intra-epiteliálních lymfocytů na 100 enterocytů) [3]. U většiny pacientů (97 %) je přítomna lymfocytární infiltrace lamina propria [14], u třetiny pacientů je patrné zesílení subepiteliální kolagenní vrstvy [3]. Současně může být přítomna mikroskopická kolitida [2,16,22,27] a gastritida [2,16,22]. Dosud není jasné, zda olmesartan způsobuje histologické změny ve sliznici duodena i u pacientů bez průjmu [4,29]. Diagnóza byla stanovena v širokém rozsahu měsíců až let od nasazení léku (v největších souborech byl průměr 2,3 a 3,3 roku) [3,14].
Diferenciální diagnostika
V diferenciální diagnostice neceliakální sprue musíme zvažovat polékovou sprue (dosud známá agens jsou např. azathioprin, metotrexát, mykofenolát mofetil, IFN-α, neomycin, kolchicin či nesteroidní antiflogistika), tropickou sprue, infekci Giardia lamblia, HIV enteropatii, hypogamaglobulinemickou sprue, kolagenní sprue, autoimunitní enteropatii, eozinofilní gastroenteritidu, séronegativní celiakii, refrakterní celiakii, T buněčný lymfom, syndrom bakteriálního přerůstání v tenkém střevě a vzácnou enteropatii při systémovém lupus erytematodes [14,30,31].
Terapie a prognóza
Bezlepková dieta u naprosté většiny pacientů (98 %) neměla efekt. Před rozpoznáním polékové etiologie onemocnění byli pacienti léčeni pro autoimunitní enteropatii, vč. podávání systémových steroidů (efekt u 19 z 20 takto léčených pacientů) nebo topických steroidů (enteric-coated budesonide) [32]. Také pokud byly podávány thiopuriny, tacrolimus nebo anti-TNF terapie, účinkovaly u většiny takto léčených nemocných [14]. Naopak antibiotika v monoterapii byla bez efektu [2].
Přerušení podávání sartanu vedlo u všech pacientů k ústupu průjmu. U většiny (93 %) pacientů, kteří podstoupili kontrolní duodenoskopii, došlo ke kompletní normalizaci histologického nálezu. Případy recidivy potíží po opakovaném nasazení olmesartanu (rechallenge) dokládá jak zpráva FDA (10 případů) [1], tak francouzský průzkum (10 případů) [14], v ostatních sériích jsou popsány kazuisticky [5,20]. Přestože byly popsány případy závažných průběhů s komatem, nutností hemodialýzy a intenzivní péče [14] (kazuisticky i případ komplikovaný srdeční zástavou [33]), nebylo dosud popsáno úmrtí v souvislosti s tímto nežádoucím účinkem.
Diskuze
Sprue podobné onemocnění indukované olmesartanem bylo poprvé popsáno v roce 2012 [2], 10 let po uvedení tohoto léku na trh antihypertenziv. Přestože vztah mezi lékem a nežádoucím účinkem musíme v tomto případě i při použití standardizovaných nástrojů (Naranjo adverse drug reaction probability scale [34]) považovat za velmi pravděpodobný až jistý, existují i opačné argumenty. Ve studii ROADMAP (studie fáze III, olmesartanem byla léčena polovina z téměř 4,5 tis. diabetiků) byl výskyt průjmu srovnatelný s placebem [35,36]. Podobně retrospektivní kohortová analýza (více než 45 tis. diabetických pacientů) nenašla u olmesartanu více hospitalizací pro gastrointestinální onemocnění než u jiných sartanů [37]. Tento fakt je vysvětlován jak nízkou frekvencí olmesartanem indukované sprue a relativně krátkým časem sledování, tak i obecně častějšími průjmy v populaci diabetiků vzhledem k přítomnosti viscerální neuropatie. Užívání sartanů u pacientů indikovaných k endoskopickým vyšetřením pro průjem analyzovala americká studie případů a kontrol [38]. Retrospektivně bylo hodnoceno více než 2 tis. gastroskopií a téměř 12,5 tis. koloskopií ve více než šestiletém intervalu; olmesartan však užívalo jen 1 % nemocných. Nebyl shledán rozdíl ve výskytu užívání olmesartanu (ani sartanů obecně) ve skupině pacientů s průjmem v porovnání s kontrolní skupinou (refluxní choroba jícnu a screening kolorektálního karcinomu). Autoři vyvozují, že se jedná pravděpodobně o vzácný jev u rizikových pacientů. Naproti tomu francouzská kohortová studie [39] analyzovala národní pojišťovenskou a nemocniční databázi. V kohortě více než 4,5 mil. pacientů a téměř 9 mil. paciento-roků bylo riziko těžké střevní malabsorpce vyžadující hospitalizaci ve skupině léčené olmesartanem ve srovnání se skupinou léčenou ACE inhibitorem signifikantně vyšší (RR = 2,49; p < 0,0001) a narůstalo s délkou podávání preparátu (RR = 10,65 u nemocných léčených více než dva roky). Autoři neshledali podobné riziko pro jiné sartany.
Není dosud jasné, zda může sartanová enteropatie (podobně jako celiakální sprue) existovat i ve formě oligo-/monosymptomatické či asymptomatické [4,29].
Lékaři předepisující olmesartan i pacienti, kteří jej užívají, by měli být na tento možný nežádoucí účinek upozorněni. Příslušnou změnu v souhrnu údajů o přípravku a v příbalové informaci léků obsahujících olmesartan schválila americká FDA v březnu 2013 [1] a obsahují ji i odpovídající dokumenty léků dostupných v ČR [40].
Ačkoli případy sprue asciované s jinými sartany než olmesartanem jsou dosud raritní, nutí zvažovat skupinový efekt této lékové skupiny na trávicí trubici [14,22–24]. Olmesartan, telmisartan a irbesartan mají mezi sartany nejdelší eliminační poločas (13, 15 a 24 hod), naopak valsartan má eliminační poločas krátký (6 hod) [10]. Jednotlivé sartany se liší afinitou k receptorům AT1 a AT2. Olmesartan jako jediný z výše uvedené skupiny je proléčivem.
Tato nově popsaná etiologie průjmu apeluje na potřebu důkladného endoskopického posouzení známek atrofie sliznice tenkého střeva a nutnost histologické diagnostiky nejen tračníku a duodena, ale i ilea a žaludku i při normálním endoskopickém nálezu [14].
Zde publikovaný případ sprue asociované s užíváním telmisartanu (publikovaný již dříve naší skupinou [22]) nese většinu společných rysů s případy asociovanými s olmesartanem (klinický průběh, laboratorní výsledky vč. pozitivity HLA DQ2). Hlavní odlišností je v našem případě normální histologický nález v duodenu. Vzhledem k tomu, že byly analyzovány čtyři vzorky z různých míst duodena, domníváme se, že tento fakt není vysvětlitelný ložiskovým charakterem změn ani chybou malého množství vzorků. Myslíme si, že jiný typ léku vedl k jinému rozložení patologických změn v tenkém střevě s ušetřením proximálního úseku. Tato distribuce změn je navíc záludnější pro diagnostiku (předpokládáme častější odběr biopsie z duodena než z terminálního ilea u pacientů se sprue), a může být tedy důvodem, proč tento nežádoucí účinek nebyl dosud u telmisartanu popsán.
Závěr
Léčba sartany (především olmesartanem) může být komplikována onemocněním charakteru sprue. Ačkoli se tento nežádoucí účinek jeví v rámci celé populace léčené olmesartanem jako velmi vzácný, tato etiologie je častá v kohortě pacientů prezentujících se jako refrakterní sprue, kolagenní sprue nebo séronegativní vilózní atrofie tenkého střeva [41]. Lékaři pečující o tyto pacienty i lékaři předepisující olmesartan by si měli být tohoto možného nežádoucího účinku vědomi.
Podpořeno programem PRVOUK P37/08 LF UK v Hradci Králové.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 26. 8. 2015
Přijato: 22. 9. 2015
MUDr. Jiří Cyrany, Ph.D.
II. interní gastroenterologická klinika
LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
jiri.cyrany@fnhk.cz
Zdroje
1. U.S. Food and Drug Administration. FDA Drug Safety Communication: FDA approves label changes to include intestinal problems (sprue-like enteropathy) linked to blood pressure medicine olmesartan medoxomil. [online]. Available from: www.fda.gov/downloads/Drugs/DrugSafety/UCM359496.pdf.
2. Rubio-Tapia A, Herman ML, Ludvigsson JFet al. Severe spruelike enteropathy associated with olmesartan. Mayo Clin Proc 2012; 87(8): 732–738. doi: 10.1016/j.mayocp.2012.06.003.
3. Ianiro G, Bibbò S, Montalto M et al. Systematic review: Sprue-like enteropathy associated with olmesartan. Aliment Pharmacol Ther 2014; 40(1): 16–23. doi: 10.1111/apt.12780.
4. Talbot GH. Small bowel histopathologic findings suggestive of celiac disease in an asymptomatic patient receiving olmesartan. Mayo Clin Proc 2012; 87(12): 1231–1232. doi: 10.1016/j.mayocp.2012.09.011.
5. DeGaetani M, Tennyson CA, Lebwohl B et al. Villous atrophy and negative celiac serology: a diagnostic and therapeutic dilemma. Am J Gastroenterol 2013; 108(5): 647–653.
6. Dreifuss SE, Tomizawa Y, Farber NJ et al. Spruelike enteropathy associated with olmesartan: an unusual case of severe diarrhea. Case Rep Gastrointest Med 2013; 2013 : 618071. doi: 10.1155/2013/618071.
7. Nielsen JA, Steephen A, Lewin M. Angiotensin-II inhibitor (olmesartan)-induced collagenous sprue with resolution following discontinuation of drug. World J Gastroenterol 2013; 19(40): 6928–6930. doi: 10.3748/wjg.v19.i40.6928.
8. Nunge D, Eoche M, Fumery M et al. Severe enteropathy with villous atrophy olmesartan medoxomil-associated. Therapie 2013; 68(6): 419–421. doi: 10.2515/therapie/2013057.
9. Stanich PP, Yearsley M, Meyer MM. Olmesartan-associated sprue-like enteropathy. J Clin Gastroenterol 2013; 47(10): 894–895. doi: 10.1097/MCG.0b013e31829a27e6.
10. Tran TH, Li H. Olmesartan and drug-induced enteropathy. P T 2014; 39(1): 47–50.
11. Theophile H, David XR, Miremont-Salame G et al. Five cases of sprue-like enteropathy in patients treated by olmesartan. Dig Liver Dis 2014; 46(5): 465–459. doi: 10.1016/j.dld.2013.12.014.
12. Gaur V, Albeldawi M, Weber L. Chronic diarrhea and weight loss. Gastroenterology 2014; 146(2): 347,591. doi: 10.1053/j.gastro.2013.10.002.
13. de Fonseka A, Tuskey A, Moskaluk C. A case of olmesartan induced enteropathy. Inflamm Bowel Dis 2012; 18: S17.
14. Marthey L, Cadiot G, Seksik P et al. Olmesartan-associated enteropathy: results of a national survey. Aliment Pharmacol Ther 2014; 40(9): 1103–1109. doi: 10.1111/apt.12937.
15. Bhat N, Anupama NK, Yelsangikar A et al. Olmesartan-related sprue-like enteropathy. Indian J Gastroenterol 2014; 33(6): 564–567. doi: 10.1007/s12664-014-0506-7.
16. Fiorucci G, Puxeddu E, Colella R et al. Se-vere spruelike enteropathy due to olmesartan. Rev Esp Enferm Dig 2014; 106(2): 142–144.
17. Gallivan C, Brown I. Olmesartan induced enterocolitis. Pathology 2014; 46(4): 360–361. doi: 10.1097/PAT.0000000000000104.
18. Heerasing N, Hair C, Wallace S. Olmesartan-induced enteropathy. Intern Med J 2015; 45(1): 117–118. doi: 10.1111/imj.12635.
19. Halevy D, Teeuwen U, Kohlhof P. A new spruelike disease as a cause of severe diarrhea. Dtsch Med Wochenschr 2014; 139(45): 2290–2293. doi: 10.1055/s-0034-1387342.
20. Ould Sidi Mohamed M, Colardelle P. Enteropathy due to olmesartan. Ann Cardiol Angeiol (Paris) 2015. doi: 10.1016/j.ancard.2015.04.022.
21. van Beurden YH, Nijeboer P, Janssen J et al. Diarrhoea and malabsorption due to olmesartan use. Ned Tijdschr Geneeskd 2014; 158.
22. Cyrany J, Vasatko T, Machac J et al. Letter: telmisartan-associated enteropathy – is there any class effect? Aliment Pharmacol Ther 2014; 40(5): 569–570. doi: 10.1111/apt.12850.
23. Cammarota G, Ianiro G, Bibbo S et al. Letter: telmisartan associated enteropathy – is there any class effect? Authors’ reply. Aliment Pharmacol Ther 2014; 40(5): 570. doi: 10.1111/apt.12870.
24. Herman ML, Rubio-Tapia A, Wu TT et al. A case of severe sprue-like enteropathy associated with valsartan. ACG Case Rep J 2015; 2(2): 92–94. doi: 10.14309/crj.2015.15.
25. Scialom S, Malamut G, Meresse B et al. Gastrointestinal disorder associated with olmesartan mimics autoimmune enteropathy. PLoS One 2015; 10(6). e0125024. doi: 10.1371/journal.pone.0125024.
26. de Araújo AA, Borba PB, de Souza FH et al. In a methotrexate-induced model of intestinal mucositis, olmesartan reduced inflammation and induced enteropathy characterized by severe diarrhea, weight loss, and reduced sucrose activity. Biol Pharm Bull 2015; 38(5): 746–752. doi: 10.1248/bpb.b14-00847.
27. Khan AS, Peter S, Wilcox CM. Olmesartan-induced enteropathy resembling celiac disease. Endoscopy 2014; 46 (Suppl 1): 97–98. doi: 10.1055/s-0033-1359132.
28. Fukushima M, Kitamoto H, Inokuma T et al. Severe spruelike enteropathy associated with olmesartan observed by double--balloon enteroscopy. Gastrointest Endosc 2016; 83(1): 269–270. doi: 10.1016/j.gie.2015.06.004.
29. Lagana SM, Braunstein ED, Arguelles--Grande C et al. Sprue-like histology in patients with abdominal pain taking olmesartan compared with other angiotensin receptor blockers. J Clin Pathol 2015; 68(1): 29–32. doi: 10.1136/jclinpath-2014-202615.
30. Rubio-Tapia A. Editorial: sprue-like enteropathy associated with Olmesartan – broadening the differential diagnosis of enteropathy. Aliment Pharmacol Ther 2014; 40(11–12): 1362–1363. doi: 10.1111/apt.13000.
31. Marietta EV, Cartee A, Rishi A et al. Drug-induced enteropathy. Dig Dis 2015; 33(2): 215–220. doi: 10.1159/000370205.
32. Hartranft ME, Regal RE. „Triple Phase“ budesonide capsules for the treatment of olmesartan-induced enteropathy. Ann Pharmacother 2014; 48(9): 1234–1237.
33. Abdelghany M, Gonzalez L 3rd, Slater J et al. Olmesartan associated sprue-like enteropathy and colon perforation. Case Rep Gastrointest Med 2014; 2014 : 494098. doi: 10.1155/2014/494098.
34. Naranjo CA, Busto U, Sellers EM et al. A method for estimating the probability of adverse drug reactions. Clin Pharmacol Ther 1981; 30(2): 239–245.
35. Menne J, Haller H. Olmesartan and intestinal adverse effects in the ROADMAP study. Mayo Clin Proc 2012; 87(12): 1230–1231. doi: 10.1016/j.mayocp.2012.10.005.
36. Sanford ML, Nagel AK. A review of current evidence of Olmesartan medoxomil mimicking symptoms of celiac dis-ease. J Pharm Pract 2014. In Press. doi:10.1177/0897190014527320.
37. Padwal R, Lin M, Etminan M et al. Comparative effectiveness of olmesartan and other angiotensin receptor blockers in diabetes mellitus: retrospective cohort study. Hypertension 2014; 63(5): 977–983. doi: 10.1161/HYPERTENSIONAHA.113.02855.
38. Greywoode R, Braunstein ED, Arguelles-Grande C et al. Olmesartan, other antihypertensives, and chronic diarrhea among patients undergoing endoscopic procedures: a case-control study. Mayo Clin Proc 2014; 89(9): 1239–1243. doi: 10.1016/j.mayocp.2014.05.012.
39. Basson M, Mezzarobba M, Weill A et al. Severe intestinal malabsorption associated with olmesartan: a French nationwide observational cohort study. Gut 2015. doi: 10.1136/gutjnl-2015-309690.
40. Souhrn údajů o přípravku Sarten 10 mg. Sp.zn.sukls165021/2014. [online]. Dostupné z: www.sukl.cz/modules/medication/download.php?file=SPC71413.pdf&type=spc&as=sarten-10-spc.
41. Lebwohl B, Ludvigsson JF. Editorial: sprue-like enteropathy due to olmesartan and other angiotensin receptor blockers – the plot thickens. Aliment Pharmacol Ther 2014; 40(10): 1245–1246. doi: 10.1111/apt.12960.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článek HepatologieČlánek Histologický test
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2016 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Hepatologie
- Histologický test
- Chronicky zvýšená aktivita pečeňových enzýmov
- Metody neinvazivního stanovení pokročilosti jaterní fibrózy
- Krvácení z varixů – pohled na terapii po Bavenu VI
- Infekcie pri cirhóze pečene – naše skúsenosti
- SOUTĚŽ O DVĚ NEJLEPŠÍ PŮVODNÍ PRÁCE 2016
- Makro-AST jako příčina izolované chronicky zvýšené aktivity AST – popis dvou případů
- Granulomatózní hepatitida jako vzácná terapeutická komplikace
- Závažné život ohrozujúce parazitárne ochorenie pečene komplikované disemináciou do pľúc
- Sartanová enteropatie – kazuistika a přehled literatury
- Úloha vápnika a vitamínu D při prevencii kolorektálneho karcinómu
- Dopis redakci časopisu Gastroenterologie a hepatologie
- 11th Congress of ECCO, Amsterdam, The Netherlands
-
XX. hradecké gastroenterologické a hepatologické dny
a X. mezinárodní endoskopický workshop - Výběr z mezinárodních časopisů
-
Správná odpověď na kvíz
Ganglioneurom tlustého střeva - Kreditovaný autodidaktický test: hepatologie
- Eziclen® – spolehlivý prostředek k očištění střeva před koloskopickým vyšetřením
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Eziclen® – spolehlivý prostředek k očištění střeva před koloskopickým vyšetřením
- Chronicky zvýšená aktivita pečeňových enzýmov
- Metody neinvazivního stanovení pokročilosti jaterní fibrózy
- Makro-AST jako příčina izolované chronicky zvýšené aktivity AST – popis dvou případů
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



