-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Sérové koncentrace S100P proteinu u pacientů s kolorektálním karcinomem
Serum concentration of S100P protein in patients with colorectal cancer
Background:
Colorectal cancer (CRC) is the third most frequent cancer worldwide and in the Czech Republic. S100P protein plays a significant role in colorectal carcinogenesis and in tumour metastatic progression. The aim of this prospective study was to assess the association between serum concentration of S100P protein and CRC.Methods:
The study included 79 subjects – 36 controls and 43 patients with CRC. The CRC group was divided into subgroups according to tumour side (13 patients with right-sided CRC (CRC-R group) and 30 patients with left-sided CRC (CRC-L group)); stage of the disease (9 patients in clinical stage I, 7 in stage II, 13 in stage III and 13 in stage IV); and tumour grading (5 patients with well-differentiated tumour (G1), 24 patients with moderately-differentiated tumour (G2) and 11 patients with poorly-differentiated tumour (G3)). Serum concentrations of S100P protein were measured in peripheral blood samples using ELISA.Results:
Serum S100P was significantly higher in the CRC group (median: 1251; inter-quartile range (IQR): 731–1749 ng/L) than in the controls (median: 765; IQR: 545–1158 ng/L); p = 0.012. Compared to the control group, serum S100P was significantly higher in patients with left-sided tumours (median: 1426; IQR: 739–1925 ng/L; p = 0.005), in clinical stage IV (median: 1622; IQR: 778–2154 ng/L; p = 0.008) and in patients with moderately-differentiated tumours (median: 1318; IQR: 853–1879 ng/L; p = 0.005). No difference was observed in the CRC-R group when compared with the controls and CRC-L group; p > 0.05.Conclusion:
The study confirms a relationship between serum concentration of S100P protein and CRC. Significantly higher serum levels were observed in patients in clinical stage IV and patients with left-sided carcinoma.Key words:
S100P – biomarker – colorectal cancer
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
7. 6. 2017Accepted:
31. 7. 2017
Autori: Petra Morávková 1
; D. Kohoutová 1; M. Drahošová 2; J. Bureš 1
Pôsobisko autorov: II. interní gastroenterologická klinika LF UK a FN Hradec Králové 1; Ústav klinické imunologie a alergologie, LF UK a FN Hradec Králové 2
Vyšlo v časopise: Gastroent Hepatol 2017; 71(4): 293-298
Kategória: Klinická a experimentální gastroenterologie: původní práce
doi: https://doi.org/10.14735/amgh2017293Súhrn
Úvod:
Kolorektální karcinom (CRC – colorectal cancer) je třetí nejčastější nádorové onemocnění celosvětově a v ČR. S100P protein hraje významnou roli v kancerogenezi CRC a v jeho metastatické progresi. Cílem prospektivní studie bylo posoudit asociaci sérové koncentrace S100P s CRC.Metodika:
Studie zahrnovala 79 jedinců – 36 kontrol (normální pankoloskopický nález; bez anamnézy kolorektální neoplazie) a 43 pacientů s CRC. Skupina s CRC byla rozdělena do jednotlivých podskupin: 1. dle lokalizace nádoru – 13 subjektů s karcinomem pravého tračníku (CRC-R skupina) a 30 osob s karcinomem levého tračníku (CRC-L skupina); 2. dle klinického stadia onemocnění – 9 pacientů ve stadiu I, 7 ve stadiu II, 13 ve stadiu III a 13 ve stadiu IV; 3. dle gradingu nádoru – 5 nemocných s dobře diferencovaným karcinomem (G1), 24 se středně diferencovaným karcinomem (G2) a 11 s nízce diferencovaným karcinomem (G3). Sérové koncentrace S100P proteinu byly hodnoceny ELISA metodou ze vzorků periferní žilní krve.Výsledky:
Sérové koncentrace S100P byly signifikantně vyšší v CRC skupině (medián 1 251, interkvartilové rozpětí – IQR 731–1 749 ng/l) ve srovnání s kontrolní skupinou (medián 765, IQR 545–1 158 ng/l); p = 0,012. Ve srovnání s kontrolní skupinou byly sérové koncentrace S100P významně vyšší v CRC-L skupině (medián 1 426, IQR 739–1 925 ng/l); p = 0,005, u pacientů v klinickém stadiu IV (medián 1 622, IQR 778–2 154 ng/l); p = 0,008, a u pacientů se středně diferencovaným karcinomem (medián 1 318, IQR 853–1 879 ng/l); p = 0,005. Nebyl prokázán signifikantní rozdíl u skupiny CRC-R ve srovnání s kontrolami ani ve srovnání s CRC-L skupinou; p > 0,05.Závěr:
Studie potvrdila asociaci sérové koncentrace S100P proteinu s CRC. Významně vyšší koncentrace S100P byly potvrzeny u pacientů v klinickém stadiu IV a pacientů s levostranným CRC.Klíčová slova:
S100P protein – biomarker – kolorektální karcinomÚvod
Kolorektální karcinom (CRC – colorectal cancer) představuje v celosvětovém měřítku třetí nejčastější nádorové onemocnění u mužů (po karcinomu plic a prostaty) a druhé nejčastější nádorové onemocnění u žen (po karcinomu prsu) [1]. V ČR byla v roce 2014 roční incidence 79 na 100 000 (přibližně 8 000 nově diagnostikovaných pacientů ročně; 95 na 100 000 u mužů, 64 na 100 000 u žen) a mortalita 38 na 100 000 (45 na 100 000 u mužů, 31 na 100 000 u žen) [2]. Dle dostupných statistických dat má incidence CRC trvale vzestupný charakter, zatímco mortalita onemocnění v posledních letech klesá [2,3]. I přes významný pokrok v diagnostice CRC a efektivitě screeningového programu v ČR v populaci s nově diagnostikovaným CRC má téměř 50 % pacientů pokročilé klinické stadium onemocnění (34 na 100 000 v klinickém stadiu III + IV) [4].
S100P protein patří do rodiny S100 proteinů, která je tvořena více než 20 malými bílkovinami s nízkou molekulární hmotností (9–13 kD). Název skupiny je odvozen od rozpustnosti S100 proteinů ve 100% roztoku síranu amonného [5]. S100 proteiny se vyskytují výhradně u obratlovců a jejich struktura je vysoce konzervativní. Jsou schopny vazby s ionty vápníku, hořčíku a zinku, což vede ke strukturálním změnám uvnitř S100 proteinu, a umožní tak jeho interakci s cílovými bílkovinami [6]. S100P protein byl poprvé izolován v roce 1992 z buněk lidské placenty [7,8]. Protein S100P se fyziologicky vyskytuje ve vysoké koncentraci v plicích, srdci, slezině, příčně pruhovaných svalech a v leukocytech. V nižších koncentracích byl také prokázán v jaterní tkáni, thymu, prostatě a ovariu [9]. Parkkila et al ve své práci demonstrovali zvýšenou expresi S100P proteinu v epiteliálních buňkách všech etáží sliznice tlustého střeva, přičemž klesající imunohistochemická pozitivita byla přítomna směrem k bázi Lieberkühnových krypt [10].
Funkce S100P v mediaci buněčné proliferace a migrace je zprostředkována zejména vazbou s ezrinem a RAGE (receptor for advanced glycation endproducts). Ezrin/radixin/moezin je transmembránový protein, který je schopen interakce mezi aktinovými filamenty cytoplazmy a plazmatickou membránou, a tím ovlivňuje migrační schopnost buňky [11,12]. V přítomnosti iontů vápníku vede vazba intracelulárně lokalizovaných homodimérů S100P k aktivaci ezrinu. Na druhé straně vazba s RAGE je zprostředkována extracelulární frakcí S100P a vede k aktivaci ERK1/2 a MAPK signální dráhy a zvýšené expresi onkogenní miRNA-21 [13–15]. V regulaci exprese S100P u CRC se uplatňuje prostaglandin E2 [16] a Trx-1 (thioredoxin-1) [17]. Trx-1 je cytoplazmatický protein s nízkou molekulární hmotností, jehož zvýšená exprese je asociována s inhibicí apoptózy, produkcí volných kyslíkových radikálů uvnitř buňky a proliferací nádorových buněk. Lin et al [17] prokázali, že Trx-1 zvyšuje expresi S100P genu v buňkách CRC. Zvýšená tkáňová exprese S100P u CRC je doložena v mnoha pracích [16,18–24].
Při plánování studie jsme vycházeli z práce Wang et al, kteří jako první prokázali významně vyšší koncentrace S100P proteinu v séru pacientů s CRC [25].
Cílem naší práce bylo posouzení sérové koncentrace S100P proteinu u pacientů s CRC a její asociace s pokročilostí nádorového onemocnění a stupněm diferenciace tumoru.
Metodika
Charakteristika souborů
Studie zahrnovala celkem 79 jedinců, kteří byli do studie zařazeni v letech 2013–2016. Celkem bylo zařazeno 43 pacientů s CRC (CRC skupina; 20 mužů a 23 žen, věk 46–86 let, průměr 67 ± 11) a 36 kontrol – osoby s normálním pankoloskopickým nálezem a negativní osobní anamnézou kolorektální neoplazie (14 mužů, 22 žen, věk 23–80 let, průměr 55 ± 14). CRC skupina zahrnovala 30 % (13 z 43) pacientů s CRC v pravé části tračníku (CRC-R skupina) a 70 % (30 z 43) pacientů s CRC levého tračníku (CRC-L skupina). Za hranici mezi pravým a levým tračníkem byla považovaná lienální flexura. Nemocní CRC skupiny byli klasifikováni dle TNM klasifikace, NCCN guidelines version 2.2017 [26] a stupně diferenciace (gradingu) tumoru. Stupeň diferenciace byl hodnocen u 74 % (32 z 43) pacientů z chirurgického resekátu, 19 % (8 z 43) nemocných nebylo indikováno k radikální chirurgické resekci a stupeň diferenciace byl u těchto pacientů hodnocen z odebraných bioptických vzorků. U 7 % (3 z 43) pacientů nebyl stupeň diferenciace karcinomu z odebraných bioptických vzorků primárně hodnotitelný – u dvou pacientů došlo ke kompletní regresi karcinomu po neoadjuvantní léčbě (v resekčním materiálu karcinom nebyl přítomný), jeden pacient je v době přípravy publikace před plánovaným resekčním výkonem. Tito tři pacienti nebyli do jednotlivých subanalýz CRC skupiny dle gradingu onemocnění zahrnuti. Při rozdělení CRC skupiny dle gradingu přítomného karcinomu jednotlivé podskupiny zahrnovaly 11 % (5 z 43) nemocných s dobře diferencovaným karcinomem (G1), 56 % (24 z 43) se středně diferencovaným karcinomem (G2) a 26 % (11 z 43) s nízce diferencovaným karcinomem (G3). U 7 % (3 z 43) nebyl stupeň diferenciace hodnotitelný (viz výše). Při rozdělní CRC skupiny dle stagingu onemocnění jednotlivé podskupiny zahrnovaly 20 % (9 z 43) nemocných v klinickém stadiu I, 16 % (7 z 43) v klinickém stadiu II, 30 % (13 z 43) v klinickém stadiu III a 30 % (13 z 43) v klinickém stadiu IV. Základní popisná statistika je shrnuta v tab. 1.
Tab. 1. Popisná statistika jednotlivých skupin. Tab. 1. Descriptive statistics of tested groups. 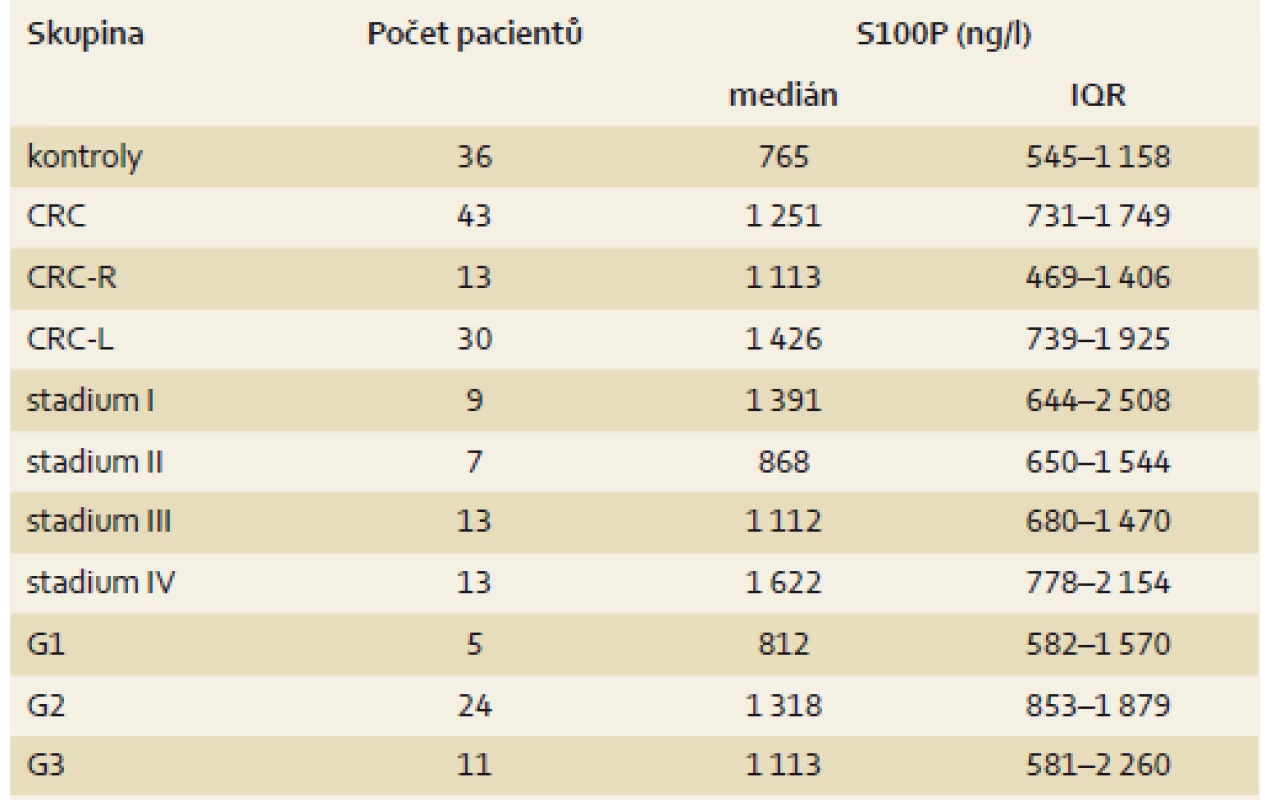
CRC – kolorektální karcinom, CRC-R – CRC v pravém tračníku, CRC-L CRC v levém tračníku, G1 – dobře diferencovaný karcinom, G2 – středně diferencovaný karcinom, G3 – nízce diferencovaný karcinom, IQR – interkvartilové rozpětí Odběr vzorků a měření sérové koncentrace S100P
Ke stanovení sérové koncentrace S100P proteinu bylo u každého jedince odebráno 6 ml srážlivé krve. Vzorky byly odebrány při standardním zavádění periferní žilní kanyly před plánovanou diagnostickou koloskopií na endoskopické jednotce II. interní gastroenterologické kliniky LF UK a FN Hradec Králové a následně transportovány na Ústav klinické imunologie a alergologie LF UK a FN Hradec Králové. Zde byly vzorky centrifugovány a získaná séra byla uchována při –30 °C do doby stanovení S100P proteinu. Měření sérových koncentrací S100P bylo provedeno ELISA metodou za použití souprav CircuLex S100P ELISA Kit CY-8060 (CycLex Co., Nagano, Japonsko).
Všechny osoby zařazené do studie podepsaly informovaný souhlas schválený Etickou komisí Univerzity Karlovy v Praze, Lékařské fakulty v Hradci Králové. Realizace studie a zpracování získaných dat bylo provedeno v souladu s Metodickým návodem Ministerstva zdravotnictví (MZ) ČR (k zabezpečení a ochraně údajů v informačních systémech provozovaných ve zdravotnických zařízeních, uveřejněný ve Věstníku MZ ČR, částka 6/1994 s odvoláním na ustanovení § 55 odstavec 2 písmeno d) zákona 230/1996 Sb., o péči o zdraví lidu v platném znění).
Statistické zpracování
Ke statistickému hodnocení byly použity metody popisné statistiky a neparametrický Mann-Whitneyův test (nebyla potvrzená normalita naměřených dat). Hodnocení proběhlo na statistickém softwaru STATISTICA, ver.13, Tulsa OK, USA.
Výsledky
Sérové koncentrace S100P proteinu byly statisticky významně vyšší v CRC skupině (medián 1 251, interkvartilové rozpětí – IQR 731–1 749 ng/l) ve srovnání s kontrolní skupinou (medián 765, IQR 545–1 158 ng/l); p = 0,012. Ve srovnání s kontrolní skupinou byly sérové koncentrace S100P významně vyšší v CRC-L skupině (medián 1 426, IQR 739–1 925 ng/l); p = 0,005. Sérové koncentrace S100P skupiny CRC-R (medián 1 113, IQR 469–1 406 ng/l) nevykazovaly statisticky významné rozdíly ve srovnání s kontrolní skupinou; p = 0,396. Nebyl prokázán statisticky významný rozdíl při srovnání sérových koncentrací S100P mezi oběma testovanými podskupinami (CRC-L a CRC-R); p = 0,135 (graf 1).
Graf 1. Sérové koncentrace S100P proteinu – kontrolní skupina, skupina s kolorektálním karcinomem (CRC) a skupiny s CRC v pravém (CRC-R) a levém (CRC-L) tračníku. Graph 1. Serum concentrations of S100P protein – control group, colorectal cancer group (CRC) and subgroups with CRC localized in the right (CRC-R) and left (CRC-L) colon. 
Při rozdělení CRC skupiny dle stagingu onemocnění byly sérové koncentrace S100P proteinu signifikantně vyšší u pacientů s CRC v klinickém stadiu IV (medián 1 622, IQR 778–2 154 ng/l) ve srovnání s kontrolní skupinou (medián 765, IQR 545–1 158 ng/l); p = 0,008. Podskupiny s nižším klinickým stadiem nevykazovaly signifikantní rozdíly ve srovnání s kontrolní skupinou: p = 0,086 pro klinické stadium I (medián 1 391, IQR 644–2 508 ng/l); p = 0,565 pro klinické stadium II (medián 868, IQR 650–1 544 ng/l) a p = 0,282 pro klinické stadium III (medián 1 112, IQR 680–1 470 ng/l) (graf 2).
Graf 2. Sérové koncentrace S100P proteinu – kontrolní skupina a jednotlivá klinická stadia pacientů s kolorektálním karcinomem. Graph 2. Serum concentrations of S100P protein – control group and colorectal cancer subgroups divided according to clinical stage. 
V CRC skupině byly sérové koncentrace S100P signifikantně vyšší ve srovnání s kontrolami (medián 765, IQR 545–1 158 ng/l) u pacientů se středně diferencovaným karcinomem (G2, medián 1 318, IQR 853–1 879 ng/l); p = 0,005. Nebyl prokázán statisticky významný rozdíl ve skupině G1 (dobře diferencovaný karcinom, medián 812, IQR 582–1 570 ng/l); p = 0,678, a ve skupině G3 (nízce diferencovaný karcinom, medián 1 113, IQR 581–2 260 ng/l); p = 0,253, ve srovnání se skupinou kontrolní (graf 3). Byl pozorován statisticky významný rozdíl ve skupině G2 + G3 (medián 1 251, IQR 742–1 883 ng/l) ve srovnání s kontrolní skupinou (medián 765, IQR 545–1 158 ng/l); p = 0,007.
Graf 3. Sérové koncentrace S100P proteinu – kontrolní skupina a jednotlivé skupiny kolorektálního karcinomu dle gradingu onemocnění. Graph 3. Serum concentrations of S100P protein – control group and colorectal cancer subgroups divided according to tumour grading. 
Diskuze
Naše studie potvrdila asociaci sérových koncentrací S100P s CRC. Prokázali jsme významně vyšší sérové koncentrace S100P u pacientů v klinickém stadiu TNM IV [26]. Prokázali jsme významně vyšší sérové koncentrace S100P u pacientů se středně diferencovaným karcinomem. I přesto, že jsme u nízce diferencovaných karcinomů signifikantní rozdíly neprokázali, při srovnání skupin G2 + G3 s kontrolní skupinou byl rozdíl ve srovnání s kontrolní skupinou statisticky významný. Důvodem může být malá velikost souboru G3 skupiny. Předpokládáme proto, že při větším počtu měření by rozdíl mohl být prokazatelný.
Nepotvrdili jsme závěry dřívějších prací, které dokumentují vyšší tkáňovou expresi S100P u nádorů v pravém tračníku [18,20]. V našem souboru byly sérové koncentrace S100P vyšší u pacientů v CRC-L skupině. Vysvětlením může být především skutečnost, že CRC-L skupina byla zastoupena ve 37 % (11 z 30) pacienty v TNM stadiu IV. Ve srovnání se skupinou s levostranným CRC obsahovala skupina CRC-P pouze 3 jedince (3 z 13) mající CRC ve IV. stadiu nemoci. Dalším vysvětlením může být nemožnost přesně korelovat sérové koncentrace S100P proteinu s tkáňovou expresí S100P proteinu. Na tuto otázku bude nutné odpovědět studií zabývající se expresí S100P proteinu ve tkáni karcinomu nemocného, u kterého by byla současně stanovena hodnota S100P v séru.
Role S100P proteinu v kancerogenezi a nádorové progresi je nepochybná a v literatuře je dobře dokumentovaná [19,25,27–34]. Vzhledem k tomu, že časná stadia CRC probíhají asymptomaticky, je v současné době snahou kromě optimalizace screeningových metod identifikovat takový biomarker, který by umožnil: 1. časnou detekci nádoru, 2. predikovat chování nádoru, 3. lépe určit prognózu onemocnění, 4. stratifikovat odpověď karcinomu na podanou protinádorovou terapii a 5. pomoci časně detekovat lokální recidivu nebo metastatický proces. Vyšší exprese S100P ve tkáni CRC a v séru pacientů s CRC je asociována s horší prognózou a kratším 5letým přežíváním [23,25]. Výsledky naší studie ukazují, že sérový S100P protein by mohl být vhodným biomarkerem u pacientů s CRC.
Závěr
Studie potvrdila asociaci sérových koncentrací S100P proteinu s CRC. Sérová koncentrace S100P byla významně vyšší u CRC v klinickém stadiu IV a u karcinomů se středním stupněm diferenciace.
Studie vznikla v rámci řešení projektu PROGRES Q40-15 (z Univerzity Karlovy) a s Institucionální podporou výzkumu SVV-2016-260286 Lékařské Fakulty Univerzity Karlovy v Hradci Králové.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 7. 6. 2017
Přijato: 31. 7. 2017
MUDr. Darina Kohoutová, Ph.D.
II. interní gastroenterologická klinika
LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
darina.kohoutova@fnhk.cz
Zdroje
1. Ferlay J, Soerjomataram I, Dikshit R et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer 2015; 136 (5): E359–E386. doi: 10.1002/ijc.29210.
2. Gregor J, Malúšková D, Mužík J et al. Epidemiologie kolorektálního karcinomu v České republice. [online]. Dostupné z: www.kolorektum.cz/index.php?pg=pro-odborniky-epidemiologie-kolorektalniho-karcinomu-epidemiologie-kolorektalniho-karcinomu-v-cr.
3. Mužík J, Dušek L, Šnajdrová L. Epidemiologie kolorektálního karcinomu v krajích České republiky. [online]. Dostupné z: www.kolorektum.cz/index.php?pg=pro-odborniky-epidemiologie-kolorektalniho-karcinomu-epidemiologie-kolorektalniho-karcinomu-v-krajich-ceske-republiky.
4. SVOD. Epidemiologie zhoubných nádorů v České republice. [online]. Dostupné z: www.svod.cz.
5. Moore BW, McGregor D. Chromatographic and electrophoretic fractionation of soluble proteins of brain and liver. J Biol Chem 1965; 240 : 1647–1653.
6. Moravkova P, Kohoutova D, Rejchrt S et al. Role of S100 Proteins in Colorectal Carcinogenesis. Gastroenterology Res Pract 2016; 2016 : 2632703. doi: 10.1155/ 2016/2632703.
7. Becker T, Gerke V, Kube E et al. S100P, a novel Ca (2+) -binding protein from human placenta. cDNA cloning, recombinant protein expression and Ca2+ binding properties. Eur J Biochem 1992; 207 (2): 541–547.
8. Emoto Y, Kobayashi R, Akatsuka H et al. Purification and characterization of a new member of the S-100 protein family from human placenta. Biochem Biophys Res Commun 1992; 182 (3): 1246–1253.
9. Jin G, Wang S, Hu X et al. Characterization of the tissue-specific expression of the s100P gene which encodes an EF-hand Ca2+-binding protein. Mol Biol Rep 2003; 30 (4): 243–248.
10. Parkkila S, Pan P, Ward A et al. The calcium-binding protein S100P in normal and malignant human tissues. BMC Clin Pathol 2008; 8 : 2. doi: 10.1186/1472-6890-8-2.
11. Koltzscher M, Neumann C, König S et al. Ca2+-dependent binding and activation of dormant ezrin by dimeric S100P. Mol Biol Cell 2003; 14 (6): 2372–2384.
12. Austermann J, Nazmi AR, Müller-Tidow C et al. Characterization of the Ca2+-regulated ezrin-S100P interaction and its role in tumor cell migration. J Biol Chem 2008; 283 (43): 29331–29340. doi: 10.1074/jbc.M806145200.
13. Arumugam T, Simeone DM, Schmidt AM et al. S100P stimulates cell proliferation and survival via receptor for activated glycation end products (RAGE). J Biol Chem 2004; 279 (7): 5059–5065.
14. Penumutchu SR, Chou RH, Yu C. Structural insights into calcium-bound S100P and the V domain of the RAGE complex. PLoS One 2014; 9 (8): e103947. doi: 10.1371/journal.pone.0103947.
15. Mercado-Pimentel ME, Onyeagucha BC, Li Q et al. The S100P/RAGE signaling pathway regulates expression of microRNA-21 in colon cancer cells. FEBS letters 2015; 589 (18): 2388–2393. doi: 10.1016/j.febslet. 2015.07.010.
16. Chandramouli A, Mercado-Pimentel ME, Hutchinson A et al. The induction of S100P expression by the Prosta-glandin E2 (PGE2) /EP4 receptor signal-ing pathway in colon cancer cells. Cancer Biol Ther 2010; 10 (10): 1056–1066. doi: 10.4161/cbt.10.10.13373.
17. Lin F, Zhang P, Zuo Z et al. Thioredoxin-1 Promotes Colorectal Cancer Invasion and Metastasis through Crosstalk with S100P. Cancer Lett 2017; 401 : 1–10. doi: 10.1016/j.canlet.2017.04. 036.
18. Birkenkamp-Demtroder K, Olesen SH, Sørensen FB et al. Differential gene expression in colon cancer of the caecum versus the sigmoid and rectosigmoid. Gut 2005; 54 (3): 374–384.
19. Fuentes MK, Nigavekar SS, Arumu-gam T et al. RAGE activation by S100P in colon cancer stimulates growth, migration, and cell signaling pathways. Dis Colon Rectum 2007; 50 (8): 1230–1240.
20. Li JN, Zhao L, Wu J et al. Differences in gene expression profiles and carcinogenesis pathways between colon and rectal cancer. J Dig Dis 2012; 13 (1): 24–32. doi: 10.1111/j.1751-2980.2011.00551.x.
21. Dong L, Wang F, Yin X et al. Overexpression of S100P promotes colorectal cancer metastasis and decreases chemosen-sitivity to 5-FU in vitro. Mol Cell Biochem 2014; 389 (1–2): 257–264. doi: 10.1007/ s11010-013-1947-5.
22. Weidle UH, Birzele F, Krüger A. Molecular targets and pathways involved in liver metastasis of colorectal cancer. Clin Exp Metastasis 2015; 32 (6): 623–635. doi: 10.1007/s10585-015-9732-3.
23. Shen ZY, Fang Y, Zhen L et al. Analysis of the predictive efficiency of S100P on adverse prognosis and the pathogenesis of S100P-mediated invasion and metastasis of colon adenocarcinoma. Cancer Genet 2016; 209 (4): 143–153. doi: 10.1016/j.cancergen.2016.02.002.
24. Royse KE, Chen L, Berger DH et al. Expression of pattern recognition receptor genes and mortality in patients with colorectal adenocarcinoma. Int J Mol Epidemiol Genet 2017; 8 (2): 8–18.
25. Wang Q, Zhang YN, Lin GL et al. S100P, a potential novel prognostic marker in colorectal cancer. Oncol Rep 2012; 28 (1): 303–310. doi: 10.3892/or.2012.1794.
26. Benson AB 3rd, Venook AP, Ceder-quist L et al. Colon Cancer, Version 2.2017, NCCN Clinical Practice Guidelines in Oncology. [online]. Available from: www.nccn.org/professionals/physician_gls/pdf/colon_blocks.pdf.
27. Diederichs S, Bulk E, Steffen B et al. S100 family members and trypsinogens are predictors of distant metastasis and survival in early-stage non-small cell lung cancer. Cancer Res 2004; 64 (16): 5564–5569.
28. Mousses S, Bubendorf L, Wagner U et al. Clinical validation of candidate genes associated with prostate cancer progression in the CWR22 model system using tissue microarrays. Cancer Res 2002; 62 (5): 1256–1260.
29. Schor AP, Carvalho FM, Kemp C et al. S100P calcium-binding protein expression is associated with high-risk proliferative lesions of the breast. Oncol Rep 2006; 15 (1): 3–6.
30. Wang G, Platt-Higgins A, Carroll J et al. Induction of metastasis by S100P in a rat mammary model and its association with poor survival of breast cancer patients. Cancer Res 2006; 66 (2): 1199–1207.
31. Ji J, Zhao L, Wang X et al. Differential expression of S100 gene family in human esophageal squamous cell carcinoma. J Cancer Res Clin Oncol 2004; 130 (8): 480–486.
32. Liang J, Luo G, Ning X et al. Differential expression of calcium-related genes in gastric cancer cells transfected with cellular prion protein. Biochem Cell Biol 2007; 85 (3): 375–383.
33. Logsdon CD, Simeone DM, Binkley C et al. Molecular profiling of pancreatic adenocarcinoma and chronic pancreatitis identifies multiple genes differentially regulated in pancreatic cancer. Cancer Res 2003; 63 (10): 2649–2657.
34. Crnogorac-Jurcevic T, Missiaglia E, Blaveri E et al. Molecular alterations in pancreatic carcinoma: expression profiling shows that dysregulated expression of S100 genes is highly prevalent. J Pathol 2003; 201 (1): 63–74.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článek Recenze knihyČlánek Správná odpověď na kvíz
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2017 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Klinická a experimentální gastroenterologie
- Malé příznaky kontrastující s velkým a progredujícím endoskopickým nálezem
- Vplyv nitroglycerínu na manometrické parametre u pacientov s achaláziou
- Sérové koncentrace S100P proteinu u pacientů s kolorektálním karcinomem
- Samoexpandibilní potahovaný metalický stent Daniš jako bridging k transplantaci jater
- Výsledky terapie infekce Helicobacter pylori na základě mikrobiologického vyšetření po selhání 2. linie eradikační léčby
- Protézoduodenální píštěl – příčina masivního krvácení do gastrointestinálního traktu
- Současné postavení telemedicíny v péči o pacienty s idiopatickými střevními záněty
-
Komentář k článku
Biosimilární infliximab v terapii anti-TNF naivních pacientů s IBD – jednoleté klinické sledování - Možnosti použitia neinvazívnych metód pri nealkoholovej tukovej chorobe pečene
- Adenokarcinom tenkého střeva jako neobvyklý zdroj hypochromní anémie
- Akutní apendicitida – vzácná komplikace koloskopie
- Epidemiologická studie obezity v populaci rozdílného rasového, kulturního, ekonomického a dietního prostředí
- Recenze knihy
- 35th Slovak and Czech Gastroenterological Congress and 39th Slovak and Czech Endoscopic Days
-
Endoscopic achievements in the upper gastrointestinal tract and small bowel
Christian Ell Lecture – Gastro Update Europe 2017, Vienna -
Komentář k lékovému profilu
Rifaximin – terapeutické vlastnosti - Výběr z mezinárodních časopisů
- Správná odpověď na kvíz
- Kreditovaný autodidaktický test: klinická a experimentální gastroenterologie
- Remsima® – první biosimilární infliximab CT-P13
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Výsledky terapie infekce Helicobacter pylori na základě mikrobiologického vyšetření po selhání 2. linie eradikační léčby
- Samoexpandibilní potahovaný metalický stent Daniš jako bridging k transplantaci jater
- Malé příznaky kontrastující s velkým a progredujícím endoskopickým nálezem
- Akutní apendicitida – vzácná komplikace koloskopie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



