-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vzácná příčina mnohočetných vředů tenkého střeva
A rare cause of the small bowel ulcers
Zollinger-Ellison syndrome is a very rare disease characterized by increased production of gastric acid that leads to peptic ulcer disease and diarrhea. It is caused by disproportionate ectopic secretion of gastrin from the cells of the endocrine tumor of digestive system – gastrinoma. It occurs sporadically or as a part of multiple endocrine neoplasia type 1. The tumor is localized mostly in duodenum and pancreas. The treatment combines control of gastric acid secretion, nowadays mainly by proton pump inhibitors and the treatment of gastrinoma itself – surgical or oncological (chemotherapy, biological treatment). In our paper, we present a case of a middle-aged woman examined for abdominal pain and diarrhea. Her initial gastroscopy showed erosive duodenitis; we excluded the infectious etiology of the diarrhea. During the examination process, there were severe complications of peptic ulcer disease for which several surgeries were done. From all the laboratory results and imaging methods, the final diagnosis was made – Zollinger-Ellison syndrome due to gastrinoma of the tail of pancreas and the patient underwent surgery. Unfortunately, there was a progression of the disease in a short time that requested another oncological and surgical treatment.
Keywords:
Zollinger-Ellison syndrome – gastrin – gastrinoma – peptic ulcer – proton pump inhibitors – Somatostatin
Autori: Leksa V.; Kubát J.; Vyhnálek P.
Pôsobisko autorov: Interní oddělení, Nemocnice Pardubického kraje a. s., Pardubická nemocnice
Vyšlo v časopise: Gastroent Hepatol 2021; 75(1): 55-60
Kategória: Klinická a experimentální gastroenterologie: kazuistika
doi: https://doi.org/10.48095/ccgh202155Súhrn
Zollingerův-Ellisonův syndrom (ZES) je velmi vzácné onemocnění charakterizované nadprodukcí žaludeční kyseliny, která vede k projevům vředové choroby a průjmům. Je způsoben nepřiměřenou ektopickou sekrecí gastrinu z buněk neuroendokrinního nádoru zažívacího traktu – gastrinomu. Může se vyskytovat jak sporadicky, tak jako součást mnohočetné endokrinní neoplazie I. typu. Nádor je nejčastěji lokalizován v oblasti duodena a pankreatu. Léčba zahrnuje kontrolu žaludeční sekrece, v současné době zejména pomocí inhibitorů protonové pumpy, a léčbu gastrinomu samotného – chirurgickou a onkologickou (chemoterapie, biologické léčba). V naší kazuistice prezentujeme případ ženy středního věku vyšetřované pro bolesti břicha a průjmy. Na vstupní gastroskopii bylo zjištěno těžké erozivní postižení duodena, byla vyloučena infekční etiologie průjmů. Během vyšetřování příčiny obtíží došlo k rozvoji komplikací vředové choroby s nutností opakovaného operačního řešení. Z provedených vyšetření a laboratorních výsledků byl jako konečná diagnóza stanoven Zollinger-Ellisonův syndrom při gastrinomu kaudy pankreatu, jenž byl posléze řešen operačně. Po krátkém čase však došlo ke generalizaci onemocnění, která si vyžádala další chirurgickou a onkologickou léčbu.
Klíčová slova:
Zollingerův-Ellisonův syndrom – gastrin – gastrinom – peptický vřed – inhibitory protonové pumpy – Somatostatin
Úvod
Zollingerův-Ellisonův syndrom (ZES) je charakterizován nadprodukcí žaludeční kyseliny, která vede k projevům vředové choroby a průjmům. Je způsoben nepřiměřenou ektopickou sekrecí gastrinu z buněk neuroendokrinního nádoru gastroenterologického traktu (GIT) – gastrinomu [1]. Jedná se o velmi vzácné onemocnění, jehož incidence je v literatuře uváděna mezi 0,1 a 3/ 1 000 000 osob. Většina pacientů bývá diagnostikována ve středním věku, častěji se vyskytuje u mužů. Asi 80 % gastrinomů řadíme mezi sporadické, zbývající procento je pak asociováno s mnohočetnou endokrinní neoplazií I. typu (MEN1) – kombinace přítomnosti neuroendokrinního nádoru pankreatu, primární hyperparatyreózy a tumoru hypofýzy [2]. Nejčastějším místem výskytu je pankreas a duodenum, vzácněji pak lymfatické uzliny či žaludek. Nádory lokalizované ve dvanáctníku se nacházejí nejčastěji v jeho prvních dvou částech, bývají častěji menší (≤ 1 cm v průměru) a mnohočetné, méně často pak metastazují do jater [3].
Prezentace případu
Padesátiletá žena byla v naší nemocnici vyšetřována pro bolesti v nadbřišku a vodnaté průjmy v říjnu 2018, nejprve na ambulanci chirurgie a infekčního oddělení. Chronicky se s ničím neléčila, pravidelně neužívala žádné léky. Anamnesticky před lety podstoupila appendektomii, hysterektomii pro myomy, dále byla v mládí provedena fundoplikace jícnu pro refluxní ezofagitidu. Vstupní laboratorní vyšetření v mezích normy, ultrazvuk břicha bez akutních patologických změn, vyloučena infekční etiologie průjmů. Mimo naši nemocnici byla následně provedena gastroskopie, která prokázala mykotické postižení jícnu a těžké erozivní změny duodena. Helicobacter pylori byl negativní z dubna 2018, proto jsme ho nyní znovu neodebírali. Ambulantní gastroenterolog v závěru své zprávy zvažoval infekční či ischemickou etiologii lézí dvanáctníku. Byl nasazen flukonazol, podáván omeprazol v dávce 20 mg 2krát denně. Po několika dnech doplněna CT břišní angiografie s nálezem akutních zánětlivých změn souvislého úseku celého duodena a většiny jejuna, dále byly přítomny malé lemy volné tekutiny mezi postiženými kličkami, porucha cévního zásobení prokázána nebyla – radiologem v diferenciální diagnostice zvažována infekční etiologie či Crohnova choroba. Pacientka byla odeslána k hospitalizaci na naše oddělení k došetření nálezu.
Při přijetí laboratorně elevace CRP (100 mg/ l), leukocytóza (18 × 109/ l), mírná minerálová dysbalance (Na 132 mmol/ l, K 3,0 mmol/ l, Cl 92 mmol/ l). Za hospitalizace jsme provedli gastroskopii, při které jsme v bulbu duodena objevili afty s bílou spodinou, v D1 a D2 duodena pak mnohočetné cirkulární ulcerace s hematinem na spodině (obr. 1) – pro riziko perforace jsme se rozhodli neprovést původně plánovanou push-enteroskopii. Byly odebrány biopsie ze sliznice žaludku a duodena (histologicky pouze známky zánětlivých změn bez průkazu nádorových struktur), z jícnu pak na kultivační vyšetření (prokázána Candida albicans). Zahájili jsme podávání parenterální výživy a pokračovali v léčbě antimykotikem a inhibitory protonové pumpy (IPP) – pantoprazol 40 mg 2krát denně. Po několika dnech bylo doplněno koloskopické vyšetření s normálním nálezem v celém tlustém střevě i v terminálním ileu. Klinický stav pacientky se po pár dnech zlepšil, mineralogram byl upraven, byl obnoven příjem stravy per os, pacientku jsme propustili do domácí péče. Na listopad jsme naplánovali kontrolní gastroskopii.
Obr. 1. Mnohočetné cirkulární ulcerace duodena s hematinem na spodině. Fig. 1. Multiple circular duodenal ulcerations covered with hematin. 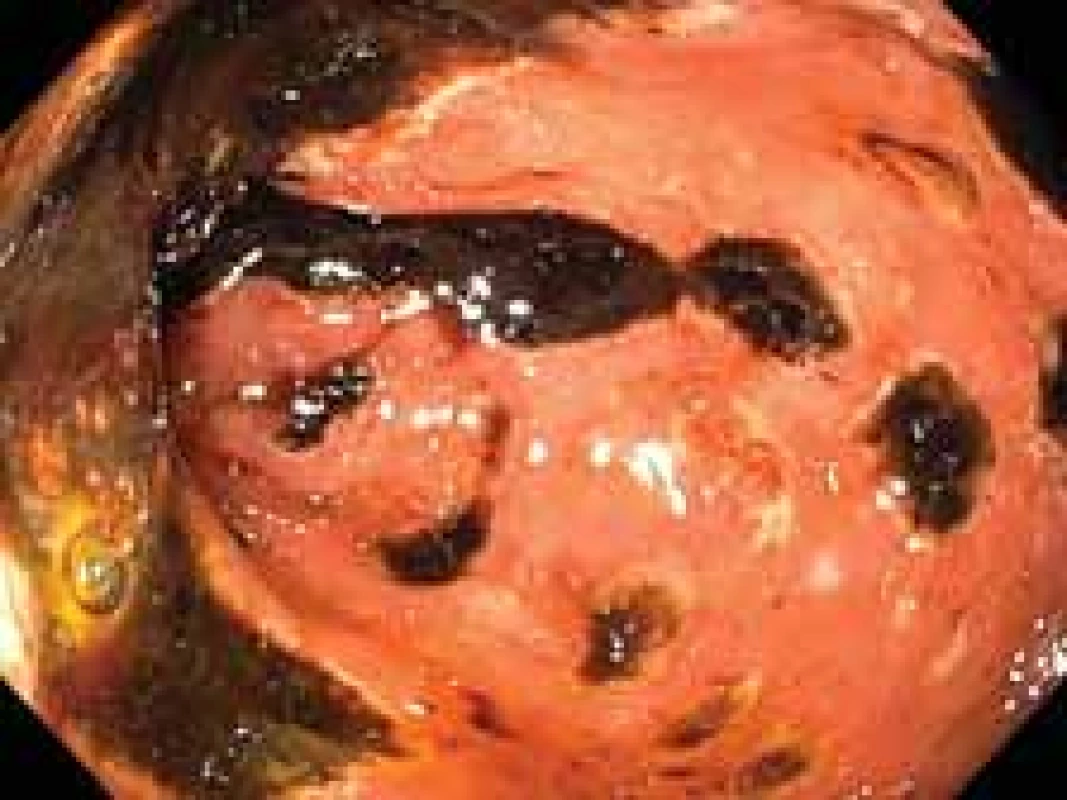
Den před jejím termínem byla pacientka opět přijata na naše oddělení pro bolesti břicha, nauzeu a zvracení. Na kontrolní gastroskopii jsme objevili vícečetné ulcerace v D2 duodenu, s menším množstvím čerstvé krve bez patrného zdroje krvácení – při porovnání s předchozím vyšetřením byl však nález celkově zlepšen. Vzhledem k mírné normocytární anemii jsme zahájili ferosubstituci. Po necelých dvou týdnech jsme opět přijali pacientku na naše oddělení. Tentokrát pro melénu s výrazným poklesem v krevním obraze (hemoglobin 97 g/ l). Na CT vyšetření jsme zjistili patologický obraz orální kličky jejuna (rentgenologem hodnoceno jako suspektní při enteritidě). Endoskopicky vícečetné chronické ulcerace v duodenu (Forrest III) a orálním jejunu (Forrest IIb) – zde provedeno ošetření opichem roztoku adrenalinu, argon-plazmovou koagulací a endoklipem. Za hospitalizace jsme provedli hemosubstituci, podali jsme hemostyptika, IPP. Kultivačně ze stolice PCR prokázána pozitivita pro Astrovirus – pacientka byla bez klinických projevů akutní infekce, po konzultaci s mikrobiologem bez terapie. Po propuštění domluveno na začátek prosince 2018 došetření tenkého střeva pomocí kapslové enteroskopie.
Druhý den po zavedení kapsle se objevují bolesti břicha, zvracení, dle rentgenového snímku a chirurgického vyšetření uzavíráno jako subileózní stav, kapsle na rentgenu nezobrazena. Provedena enteroskopie, při které nebyla kapsle nalezena, ale dle skiaskopie byla přítomna v kličkách tenkého střeva v levém mezogastriu. Endoskopicky byly stále přítomny vícečetné nehojící se ulcerace duodena a orálního jejuna (obr. 2), pacientku jsme přeložili na chirurgii. Při operační revizi byla kapsle nalezena v céku. Peroperačně byly přítomny těžké nekrotické změny jejuna s prosakováním v délce přibližně 20 cm. Bylo přistoupeno k resekčnímu výkonu postiženého úseku, kontinuita střeva obnovena jejunojejunoanastomózou side-to-side. Histologicky byly v resekátu ulcerace, místy transmurální, dále byly přítomny mikrotromby submukózy střeva (zvažována ischemická etiologie), změny typické pro morbus Crohn nenalezeny, vzorek zaslán ještě na vyšší pracoviště k druhému čtení (kde byl případ uzavřen jako peptická etiologie vředu). Pooperační průběh byl bez komplikací, pacientku jsme propustili domů. Na začátku ledna 2019 však bylo nutné provést další operaci pro známky vysokého ilea při stenóze jejunojejunoanastomózy, provedli jsme retrokolickou laterolaterální gastroenteroanastomózu.
Obr. 2. Mnohočetné ulcerace orálního jejuna. Fig. 2. Multiple ulcerations of oral jejunum. 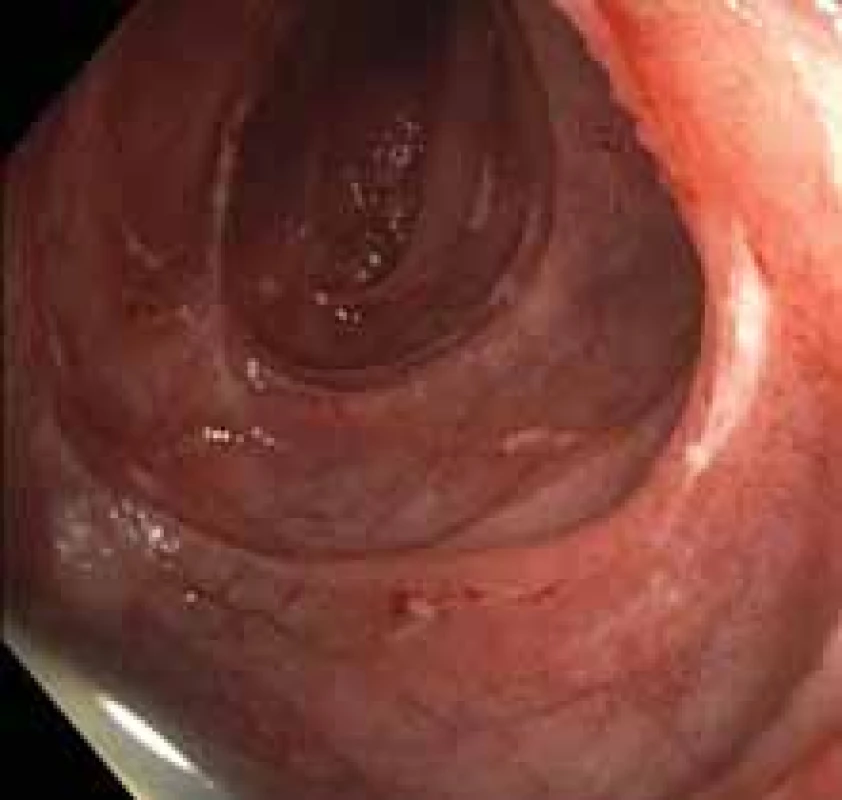
Posléze byla pacientka vyšetřena v gastroenterologické poradně. Vzhledem ke všem výše uvedeným nálezům a výsledkům jsme doplnili odběry k vyloučení trombofilního stavu (protein C a S, rezistence proti aktivovanému proteinu C, lupus antikoagulans, antikardiolipin – vše později negativní) a prvotně jsme pomýšleli na ZES. Bylo objednáno scintigrafické vyšetření (OctreoScan), které později prokázalo ložisko zvýšeného záchytu radiofarmaka v kaudě pankreatu (obr. 3), a odběr hladin gastrinu. Gastrin byl výrazně zvýšen na 1 517,0 ng/ l (norma 0–100 ng/ l). K verifikaci nálezu jsme v polovině března 2019 doplnili endosonografii pankreatu s cíleným odběrem vzorku – cytologický nález ohodnocen jako neuroendokrinní tumor pankreatu WHO grade 1, cytologicky dobře diferencovaný. Vzhledem k nepřítomnosti metastatického postižení bylo přistoupeno k chirurgickému zákroku. Byla provedena levostranná pankreatektomie se splenektomií. Histologie z operačního vzorku byla uzavřena jako středně diferencovaný neuroendokrinní tumor WHO grade 2, imunohistochemicky silná pozitivita synaptofyzinu, pozitivita chromograninu, index Ki67 5–7 %, počet mitóz na 10 zorných polí 3–4 (obr. 4), vzdálenost tumoru od resekčních okrajů asi 1 cm. Výkon byl považován za kurativní, zajištěna dispenzarizace na onkologii.
Obr. 3. Ložisko zvýšeného záchytu 111-In pentetreotidu v kaudě pankreatu.
Fig. 3. 111-In pentetreotide positive lesion of tail of pancrea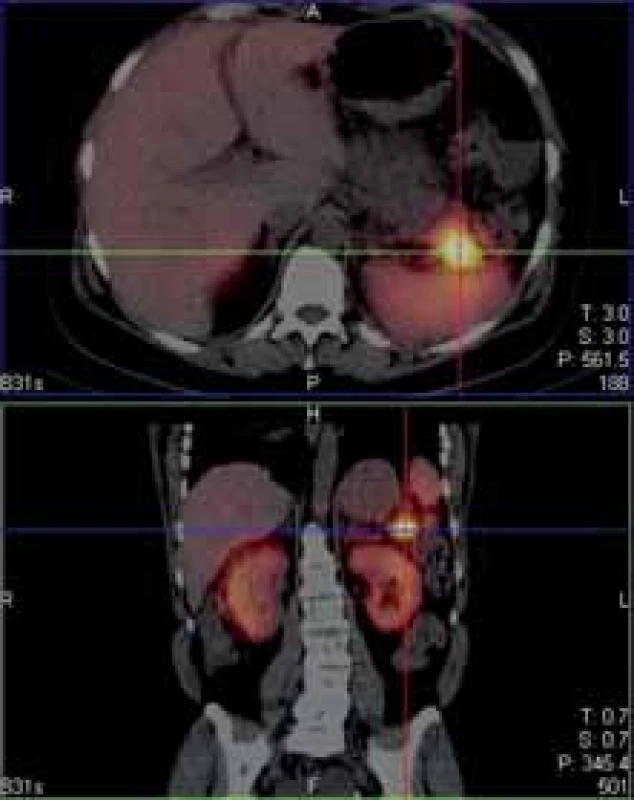
Obr. 4. Histologický obraz gatrinomu kaudy pankreatu (WHO 2010 grade 2), vpravo imunohistochemické barvení.
Fig. 4. Histological picture of gastrinoma of pancreatic tail (WHO 2010 grade 2), imunohistochemical staining on the right.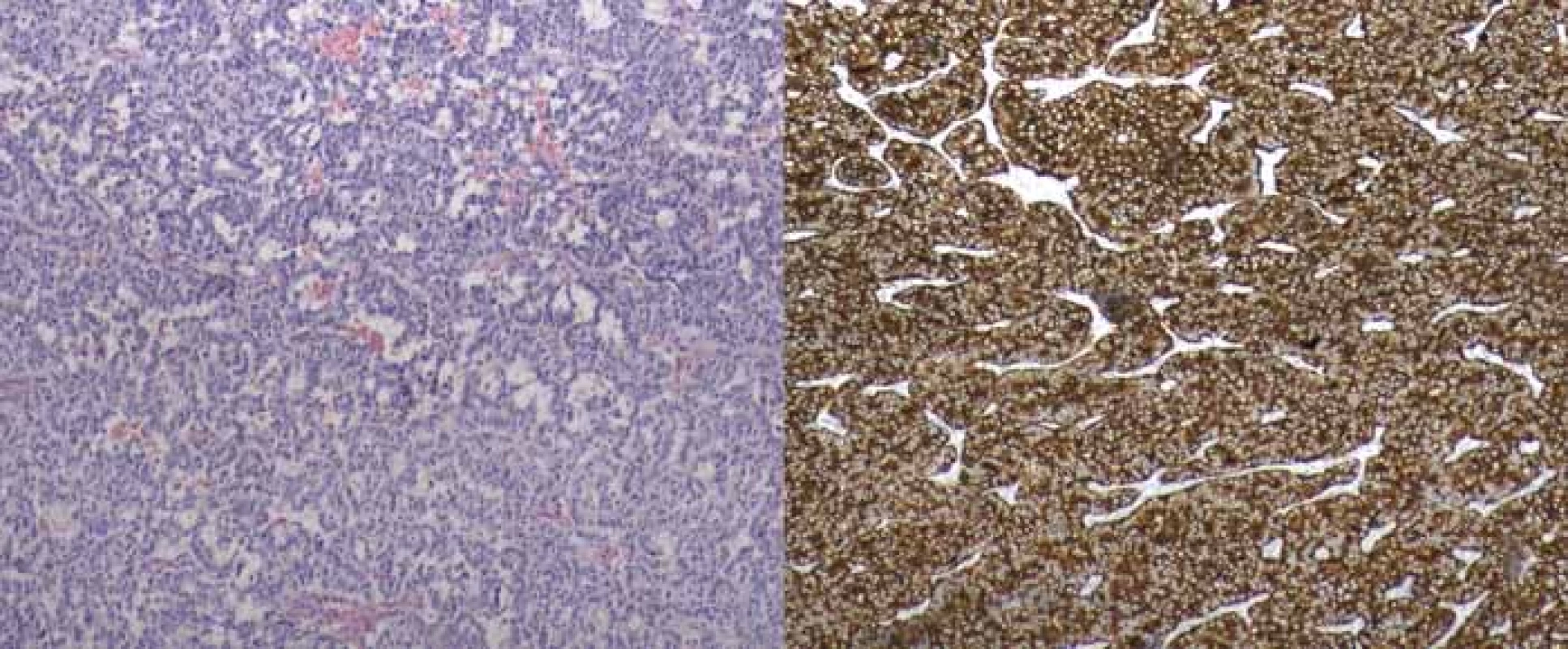
Od operace udává pacientka postupné zlepšení obtíží, bohužel pouze dočasné. Při kontrole na onkologii v květnu 2019 pacientka popisuje opět záchvatovité, vodnaté průjmy, kontrolní UZ břicha je bez akutních změn, kontrolní gastroskopie s nálezem zánětlivé gastropatie, tenké střevo nyní bez patologie, laboratorně je však elevace chromograninu A na 571,4 ng/ ml (norma 0–101,9 ng/ ml). Objednán kontrolní OctreoScan. Ještě před jeho zhotovením na konci června 2019 byla pacientka přijata na chirurgii s příznaky peritoneálního dráždění. Byla provedena akutní operace, při níž jsme objevili objemnou perforaci gastroenteroanastomózy (GEA) v terénu vředových lézí. Přechodně bylo nutné pacientku umístit na anesteziologicko-resuscitační oddělení pro septický šok. Při dimisi navyšujeme dávku pantoprazolu na 40 mg 4krát denně, která je od této chvíle podávána dlouhodobě.
Na kontrolním vyšetření OctreoScan z července 2019 byl přítomen solitární fokus patologické exprese somatostatinových receptorů ventromediálně nad horním pólem levé ledviny, indikujeme exstirpaci ložiska. Pacientka ji podstoupila v srpnu 2019, výkon proběhl bez komplikací, histologicky ohodnoceno jako WHO neuroendokrinní tumor grade 1. Při kontrole na onkologii v září 2019 však pacientka udává přibližně jednou týdně záchvaty profuzního průjmu s návaly horka, pocením a rudnutím obličeje. V říjnu jsme provedli gastroskopii s nálezem rozsáhlé ulcerace s bílou spodinou v místě GEA a dále několik drobných klidných ulcerací v obou kličkách tenkého střeva. Následně byl proveden již třetí OctreoScan – nově byla přítomna mnohočetná ložiska výrazné patologické exprese somatostatinových receptorů v játrech – podezření na metastázy známého gastrinomu (obr. 5), laboratorně i elevace chromograninu A na 3 159 ng/ ml. Na konci listopadu 2019 bylo pro přetrvávající projevy karcinoidového syndromu na onkologii zahájeno podávání analoga somatostatinu v depotní formě (Sandostatin LAR 20 mg jednou měsíčně). Celkový stav se mírně zlepšil, ale přetrvávají návaly horka a pocení. Po třech měsících byla dávka přípravku Sandostatin navýšena na 30 mg jednou měsíčně.
Obr. 5. Mnohočetná ložiska záchytu 111-In pentetreotidu v játrech.
Fig. 5. Multiple 111-In pentetreotide positive lesions of the liver.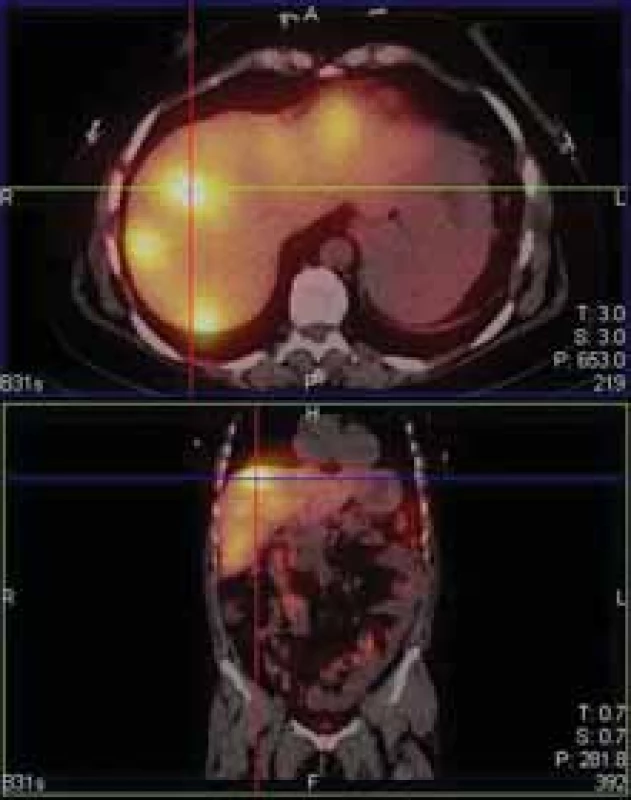
Kontrolní MR jater v únoru 2020 potvrzuje infiltraci jater desítkami metastatických ložisek různé velikosti, další OctreoScan v březnu 2020 potvrzuje, že se jedná o progresi ložisek gastrinomu, nově jsou přítomna i ložiska ve skeletu. Vzhledem k další progresi onemocnění byla zahájena paliativní chemoterapie karboxyplatinou v monoterapii. Byla podána pouze jedna dávka, pro hepatotoxicitu musela být léčba ukončena a pokračovalo se nadále v podávání analoga somatostatinu. Poslední kontrolní gastroskopie proběhla v březnu 2020 s nálezem perzistující ulcerace v místě GEA, nález však byl výrazně zlepšen oproti vyšetření předcházejícímu. Pacientka je v současné době dispenzarizována cestou onkologie a naší gastroenterologické poradny. Stav je nyní stabilizovaný, intermitentně s projevy karcinoidového syndromu. Vzhledem ke generalizaci onemocnění je však prognóza nepříznivá.
Diskuze
Gastrinom patří mezi funkční pankreatické neuroendokrinní tumory (f-pNET). Současná klasifikace neuroendokrinních neoplazií od WHO z roku 2019 je uvedena v tab. 1 [4]. Histologicky jde většinou o dobře diferencovaný nádor. Stejně jako u ostatních NET je v diagnostice využíváno imunohistologické vyšetření. Typická je přítomnost pozitivity pro synaptofyzin a chromogranin A.
Tab. 1. Klasifikace neuroendokrinních neoplazií dle WHO z roku 2019.
Tab. 1. WHO 2019 classification of neuroendocrine neoplasms.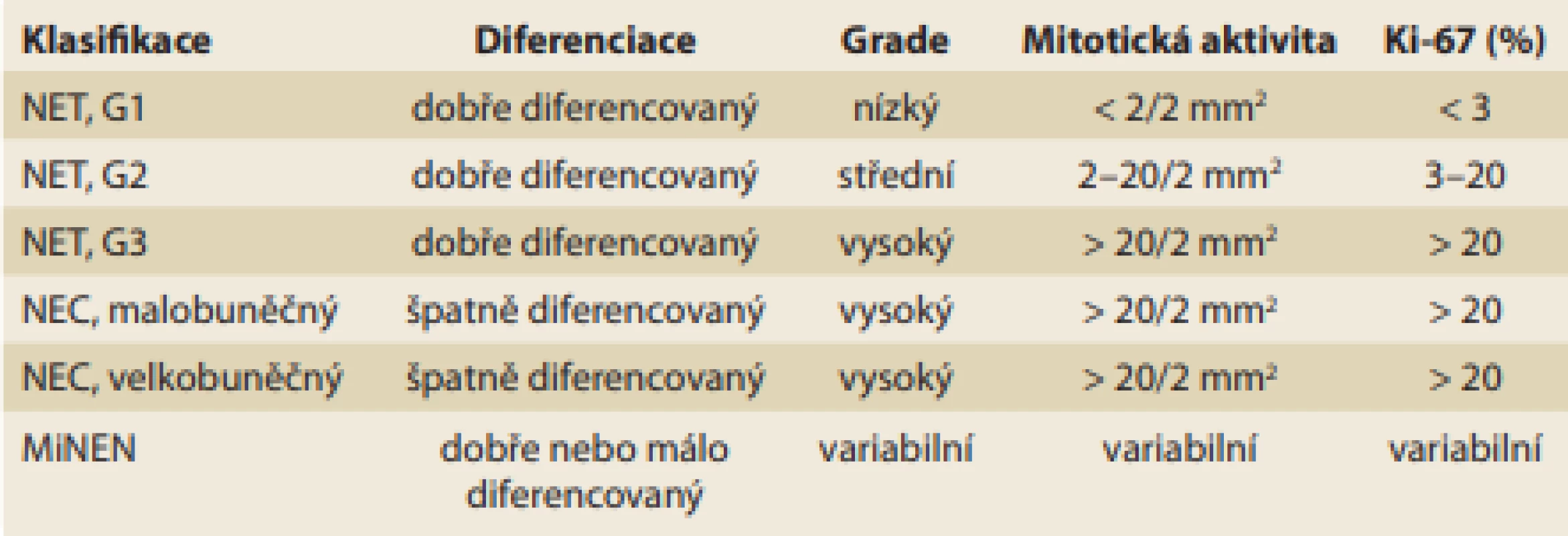
Nadměrná sekrece gastrinu stimuluje parietální a enterochromafinní buňky žaludku. To vede ke zvýšení bazálního výdeje žaludeční kyseliny, a to přibližně 4–6krát (může být ale i více než 10násobně), a také maximálního výdeje žaludeční kyseliny. Nejčastějšími klinickými projevy jsou vředová choroba (73–98 %) – typické je postižení tenkého střeva při absenci nálezu na žaludku, průjem (60–75 %), pálení žáhy (52–55 %), hmotnostní úbytek (7–53 %), dále pak komplikace vředové choroby samotné (krvácení, perforace, striktury) [5]. Průjem je způsoben kombinací několika mechanizmů – vysokým objemem žaludeční kyseliny, kterou není trávicí trakt schopen zpětně zcela vstřebat, nízkým pH v tenkém střevě (nadměrná produkce kyseliny převýší neutralizační kapacitu bikarbonátu), které vede k inaktivaci pankreatických enzymů a k nedostatečnému natrávení střevního obsahu. Vysoké hladiny gastrinu samotného navíc inhibují absorpci sodíku a vody v tenkém střevě [6]. Endoskopicky nacházíme v 90 % peptické vředy. Nejvíce je jich v první části dvanáctníku (až 75 %), následuje distální duodenum (14 %) a jejunum (11 %). Vředy se často po léčbě IPP vrací. Dalším typickým endoskopickým nálezem jsou zvětšené žaludeční řasy (90 %) či refluxní ezofagitida [7].
Na ZES bychom měli pomýšlet u pacientů s mnohočetnými nebo refrakterními peptickými vředy, při kombinaci vředové choroby a chronických průjmů, při přítomnosti zvětšených žaludečních řas a u pacientů s MEN1. Diagnostika se opírá o laboratorní vyšetření a zobrazovací metody. Vzhledem k vzácnému výskytu a projevům ZES imitujícím „běžnou“ vředovou chorobu může být diagnóza onemocnění obtížná a doba k určení diagnózy může trvat i několik let (4–6 let) [7]. Základním laboratorním vyšetřením je stanovení hladiny sérového gastrinu nalačno současně se stanovením hodnot žaludečního pH (jednorázový odběr během gastroskopie). Hladina gastrinu > 10násobek horní hranice normy (tzn. > 1 000 pg/ ml) za přítomnosti žaludečního pH < 2 je diagnostickým kritériem ZES. Vyšší hladiny častěji odpovídají gastrinomu pankreatu, větším tumorům a metastázám [7,8]. Měření žaludečního pH je důležité k vyloučení sekundární hypergastrinemie způsobené achlorhydrií (atrofická gastritida, užívání IPP, ledvinné selhání apod.). V těchto případech může být hladina gastrinu také > 1 000 pg/ ml, ale žaludeční pH > 2 [8]. V zahraniční literatuře je pak jako další krok doporučováno provedení sekretin stimulujícího test (SST) – v ČR je toho času nedostupný. Uplatňuje se k diagnostice gastrinomu při hypergastrinemii < 10násobek normy a při přítomnosti žaludečního pH < 2. Sekretin u pacientů s gastrinomem stimuluje uvolňování gastrinu, a jeho hodnota tak stoupá, naproti tomu normální žaludeční G-buňky jsou jím inhibovány. Test spočívá v měření sérových koncentrací gastrinu před intravenózním podáním sekretinu a po něm. Za pozitivní je hodnocen vzestup o 120 pg/ ml [6]. Výsledky odběrů hladiny sérového gastrinu i SST mohou být ovlivněny užíváním IPP, je tedy doporučováno vysadit je týden před vyšetřením – nutno vždy přihlédnout ke stavu pacienta, aby při vysazení léčby nedošlo ke komplikaci vředové choroby (perforace, krvácení apod.). Pokud to stav neumožňuje, doporučuje se kombinovat laboratorní vyšetření se zobrazovacími metodami [8]. Mezi další laboratorní test patří stanovení hladiny chromograninu A v séru. Ten bývá zvýšený u většiny pacientů s gastrinomem a jeho hladina dobře odpovídá velikosti nádoru samotného [9]. Nejedná se však o specifický marker, může být zvýšený i u jiných neuroendokrinních tumorů. Dříve používané měření bazálního výdeje žaludeční kyseliny již není v ČR dostupné. U pacientů s prokázaným ZES bychom měli pátrat po zbylých projevech MEN1. Je doporučováno doplnit odběry hladin parathormonu, ionizovaného kalcia a prolaktinu v krvi [10].
K lokalizaci nádoru může posloužit CT či MR. Přínosnější však bývají zobrazovací metody využívající somatostatinová analoga. U nás je zlatým standardem scintigrafie s 111-In pentetreotidem (OctreoScan). Mezi novější metody patří PET/ CT s Ga-68-DOTA-0-Phe1-Tyr3-Octreotidem (Ga-68 DOTATATE) či Gallium-68-DOTA-0-Phe1-Tyr3-Octreotidem (Ga-68 DOTATOC), ty jsou v současné době v zahraničí upřednostňovány pro svou vyšší senzitivitu [11], v ČR však nejsou běžně dostupné. Endosonografie může prokázat ložisko tumoru i při negativitě scintigrafických vyšetření, navíc umožňuje odběr vzorku biopsie tenkou jehlou k určení histologické povahy nádoru. Pro riziko diseminace nádoru však toto vyšetření není doporučováno v případě zobrazovacími metodami zjištěných, kurativně operabilních nádorů (pouze v případě diagnostických nejasností – stejně jako v našem případě).
Léčba ZES se dá rozdělit na dvě části. Léčba projevů ZES a odstranění samotného gastrinomu. Medikamentózní terapie projevů ZES spočívá v podávání vysokých dávek IPP (doporučováno je 40 mg omeprazolu 2krát denně, pantoprazolu pak 80 mg 2krát denně).
U pacientů se sporadickým gastrinomem bez průkazu metastatického postižení je namístě resekce samotného tumoru. U pacientů se ZES jako součást MEN1 se operační řešení nedoporučuje vzhledem k typicky víceložiskovému postižení a časté přítomnosti metastáz [5]. Výjimkou bývají nádory > 2 cm. Kurativní léčba metastazujícího nádoru v současné době neexistuje. V rámci standardní chemoterapie se nejčastěji podává streptozocin v kombinaci s 5-fluorouracilem nebo doxorubicinem. Léčba analogy somatostatinu (octreotid a lanreotid) může mít efekt nejen na hormonální produkci tumoru, ale i na jeho růst. Z moderní cílené léčby pak mají efekt inhibitor mTOR (everolimus) a inhibitor tyrosinkináz (sunitinib) [12]. Mezi další terapeutické možnosti patří lokoregionální ablační léčba – radiofrekvenční ablace (RFA), transarteriální chemoembolizace (TACE) či peptidová receptorové radiační terapie (PRRT). Radioterapie není obecně doporučována. Prognóza onemocnění závisí na histologické povaze nádoru a přítomnosti metastáz. Z pacientů s jaterními metastázami přežívá 10 let pouze 30 %, bez nich je pak 15leté přežití 83 %. Lepší prognózu mají nemocní s MEN1 [3].
Zollinger-Ellisonův syndrom je velmi vzácné onemocnění a k jeho správné diagnóze vede v první řadě to, že na něj vůbec pomyslíme. Proto bychom chtěli na závěr připomenout, abychom jej v rámci diferenciální diagnostiky zvážili u všech pacientů s ne zcela typickou vředovou chorobou – zvláště ve spojení s průjmy, s vředy v méně obvyklých lokalizacích, s vředy špatně reagujícími na léčbu – a aktivně po něm pátrali u všech pacientů s MEN1. Včasná diagnostika a léčba může totiž nejen ulevit od symptomů a předejít možným komplikacím peptických vředů, ale v případě lokalizovaného onemocnění může vést i k odstranění samotného gastrinomu, a tedy úplnému vyléčení pacienta.
Poděkování
Autoři článku mnohokrát děkují za poskytnutí obrazové dokumentace prim. MU Dr. Márie Hácové (Patologicko-anatomické oddělení, Nemocnice Pardubického kraje a.s., Pardubická nemocnice) a prim. MU Dr. Ireně Vyhnánkové (Oddělení nukleární medicíny, Nemocnice Pardubického kraje a.s., Chrudimská nemocnice).
Doručeno/ Submitted: 29. 7. 2020
Přijato/ Accepted: 26. 1. 2021
MU Dr. Václav Leksa
Interní oddělení
Nemocnice Pardubického kraje a.s.
Pardubická nemocnice
Kyjevská 44
532 03 Pardubice
Konflikt zájmů: Autoři deklarují, že text článku odpovídá etickým standardům, byla dodržena anonymita pacientů a prohlašují, že v souvislosti s předmětem článku nemají finanční, poradenské ani jiné komerční zájmy.
Publikační etika: Příspěvek nebyl dosud publikován ani není v současnosti zaslán do jiného časopisu pro posouzení. Autoři souhlasí s uveřejněním svého jména a e-mailového kontaktu v publikovaném textu.
Dedikace: Článek není podpořen grantem ani nevznikl za podpory žádné společnosti.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Conflict of Interest: The authors declare that the article/ manuscript complies with ethical standards, patient anonymity has been respected, and they state that they have no financial, advisory or other commercial interests in relation to the subject matter.
Publication Ethics: This article/ manuscript has not been published or is currently being submitted for another review. The authors agree to publish their names and e-mails in the published article/ manuscript.
Dedication: The article/ manuscript is not supported by a grant nor has it been created with the support of any company.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Zdroje
1. Zollinger RM, Ellison EH. Primary peptic ulcerations of the jejunum associated with islet cell tumors of the pancreas. Ann Surg 1955; 142(4): 709–728.
2. Epelboym I, Mazeh H. Zollinger-Ellison syndrome: classical considerations and current controversies. Oncologist 2014; 19(1): 44–50. doi: 10.1634/ theoncologist.2013-0369.
3. Weber HC, Venzon DJ, Lin JT et al. Determinants of metastatic rate and survival in patients with Zollinger-Ellison syndrome: a prospective long-term study. Gastroenterology 1995; 108(6): 1637–1649. doi: 10.1016/ 0016-5085(95)90124-8.
4. Klimstra DS, Kloppell G, La Rosa S et al. Classification of neuroendocrine neoplasms of the digestive system. In: WHO Classification of Tumours Editorial (ed). Digestive system tumours: who classification of tumours. 5th ed. Lyon: World Heatlh Orgn 2019 : 16.
5. Norton JA, Foster DS, Ito T et al. Gastrinomas: medical or surgical treatment. Endocrinol Metab Clin North Am 2018; 47(3): 577–601. doi: 10.1016/ j.ecl.2018.04.009.
6. Berna MJ, Hoffmann KM, Serrano J et al. Serum gastrin in Zollinger-Ellison syndrome: I. prospective study of fasting serum gastrin in 309 patients from the National Institutes of Health and comparison with 2229 cases from the literature. Medicine (Baltimore) 2006; 85(6): 295–330. doi: 10.1097/ 01.md.0000236956.74128.76.
7. Roy PK, Venzon DJ, Shojamanesh H et al. Zollinger-Ellison syndrome. Clinical presentation in 261 patients. Medicine (Baltimore) 2000; 79(6): 379–411. doi: 10.1097/ 00005792-200011000-00004.
8. Metz DC, Cadiot G, Poitras P et al. Diagnosis of Zollinger-Ellison syndrome in the era of PPIs, faulty gastrin assays, sensitive imaging and limited access to acid secretory testing. Int J Endocr Oncol 2017; 4(4): 167–185. doi: 10.2217/ ije-2017-0018.
9. Tomassetti P, Migliori M, Simoni P et al. Diagnostic value of plasma chromogranin A in neuroendocrine tumours. Eur J Gastroenterol Hepatol 2001; 13(1): 55–58. doi: 10.1097/ 000 42737-200101000-00010.
10. Jensen RT, Cadiot G, Brandi ML et al. ENETS Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms: functional pancreatic endocrine tumor syndromes. Neuroendocrinology 2012; 95(2): 98–119. doi: 10.1159/ 000335591.
11. Deppen SA, Liu E, Blume JD et al. Safety and efficacy of 68Ga-DOTATATE PET/ CT for diagnosis, staging, and treatment management of neuroendocrine tumors. J Nucl Med 2016; 57(5): 708–714. doi: 10.2967/ jnumed.115.163865.
12. Ito T, Igarashi H, Jensen RT. Therapy of metastatic pancreatic neuroendocrine tumors (pNETs): recent insights and advances. J Gastroenterol 2012; 47(9): 941–960. doi: 10.1007/ s00535-012-0642-8.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článek Kvíz z klinické praxeČlánek Editorial
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2021 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Dát či nedat vakcínu proti covid-19 pacientům s IBD?
- Kvíz z klinické praxe
- Idiopatické střevní záněty mají negativní dopad na reprodukční chování pacientů: první multicentrický průzkum v České republice
- Editorial
- Obezita a idiopatické střevní záněty
- The influence of microscopic inflammation at resection margins on early postoperative endoscopic recurrence after ileocaecal re-section for Crohn’s disease
- Komentář ke článku „The influence of microscopic in-flammation at resection margins on early postoperative endoscopic recurrence after ileocaecal resection for Crohn’s disease“ (Journal Crohn’s Colitis 2020; 14(3): 361–368
- Psychologické aspekty a možnosti psychologických intervencií u pacientov s nešpecifickými zápalovými ochoreniami čreva
- Posterior reversible encephalopathy syndrom u dítěte s ulcerózní kolitidou
- Rifaximin v terapii idiopatických střevních zánětů
- Vzácná příčina mnohočetných vředů tenkého střeva
- (Ne)tradičně komplikovaná pankreatitida
- Neuroendokrinní tumor periapendikulární oblasti dna céka – kazuistika
- Inhibitory protonové pumpy – známe je dobře? Jsou skutečně tak bezpečné? – část 3
- Výběr z mezinárodních časopisů
- Správná odpověď na kvíz Diferenciální diagnóza terminální ileitidy: Meckelův divertikl v atypické lokalizaci
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Vzácná příčina mnohočetných vředů tenkého střeva
- Psychologické aspekty a možnosti psychologických intervencií u pacientov s nešpecifickými zápalovými ochoreniami čreva
- Inhibitory protonové pumpy – známe je dobře? Jsou skutečně tak bezpečné? – část 3
- Neuroendokrinní tumor periapendikulární oblasti dna céka – kazuistika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



