-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Neobvyklý případ systémové AA amyloidózy
An unusual case of systemic AA amyloidosis
An unusual case of AA amyloidosis is presented. Pharmacotherapy of rheumatoid arthritis induced its 5-year clinical remission, yet despite this, the patient developed AA amyloidosis. Amyloidosis involved the stomach, duodenum and kidneys. AA amyloidosis did not impair the renal functions significantly. This case emphasized the importance of non-targeted biopsies of macroscopically normal mucosa of the stomach and duodenum that made it possible to diagnose amyloidosis. The patient remained without any gastrointestinal symptoms even during the subsequent follow-up.
Keywords:
AA amyloidosis – gastroscopy – non-targeted biopsies
Autori: Zhychko K. 1; Douda L. 1; Soukup T. 1; Podhola M. 2; Bělobrádková M. 1; Bureš J. 1
Pôsobisko autorov: II. interní gastroenterologická klinika LF UK a FN Hradec Králové 1; Fingerlandův ústav patologie LF UK a FN Hradec Králové 2
Vyšlo v časopise: Gastroent Hepatol 2021; 75(4): 331-334
Kategória: Klinická a experimentální gastroenterologie: kazuistika
doi: https://doi.org/10.48095/ccgh2021331Súhrn
Popsaná kazuistika je neobvyklým případem AA amyloidózy. Při farmakologické léčbě byla revmatoidní artritida 5 let v klinické remisi, přesto došlo k rozvoji amyloidózy. Byly postiženy žaludek, duodenum a ledviny. Komplikující amyloidóza zásadním způsobem nezhoršila renální funkce. Případ ukázal význam necílených biopsií makroskopicky normální sliznice při gastroskopii, ze kterých byla amyloidóza diagnostikována. Amyloidóza zůstala z hlediska gastrointestinálního traktu asymptomatická i v následujícím průběhu nemoci.
Klíčová slova:
AA amyloidóza – gastroskopie – necílené biopsie
Úvod
Amyloidóza označuje vzácnou heterogenní skupinu nemocí, při kterých dochází k ukládání abnormálního, konformačně změněného, původně rozpustného bílkovinného prekurzoru do mimobuněčného prostoru různých tkání ve formě vláknitých nerozpustných agregátů (amyloid). Amyloid je tvořen třemi komponentami: nefibrilární glykoprotein, fibrilární protein a glykoaminoglykany. Ukládání amyloidu vede k orgánové dysfunkci [1]. Onemocnění jako první popsal v roce 1842 Karel Rokitansky, rodák z Hradce Králové, patolog působící ve Vídni. Pojmenování pochází od Virchowa z roku 1854 (amyloid – látka škrobu podobná) [2].
Klasifikace amyloidóz není jednotná. Z praktického pohledu se nejvhodnějším jeví klinicko-patologické dělení na amyloidózy generalizované (postihující více orgánových systémů) a lokalizované (postihující jeden orgán) [3]. Konkrétní typ amyloidózy je dále určen identifikací specifického bílkovinného prekurzoru (tzv. amyloidogenního proteinu), kterých dosud bylo identifikováno více než 30 [4]. Terminologické označení amyloidózy vychází z kombinace písmene A („amyloidogenní protein“) a dalšího písmene odvozeného od vlastního amyloidogenního proteinu (např. L pro fragmenty imunoglobulinových lehkých řetězců, „light-chain imunoglobulin fragments“) [4]. Amyloidóza může být získaná, nebo vrozená [5,6]. Nejčastěji se vyskytují amyloidózy získané, z nich 70 % tvoří AL amyloidóza (dříve označovaná jako primární), jejímž podkladem je nadprodukce monoklonálních lehkých řetězců (dyskrazie plazmatických buněk) u různých hematologických onemocnění [7]. Systémová AA amyloidóza (dříve označovaná jako sekundární) představuje přibližně 25 % amyloidóz, provází chronická zánětlivá onemocnění (autoimunitní, infekční, nádorová) [7,8]. Diagnostika amyloidózy spočívá v histopatologickém průkazu amyloidu ve vzorku odebrané tkáně. Extracelulární tkáňové ukládání fibril složených z nízkomolekulárních podjednotek má charakteristický vzhled v elektronové mikroskopii, fibrily mají schopnost vázat konžskou červeň (zelená barva v polarizačním světle) a thioflavin T (žlutozelená fluorescence) [9,10].
Onemocnění může po dlouhou dobu probíhat asymptomaticky. Klinická symp - tomatologie je značně variabilní [7]. Amyloid se ukládá extracelulárně preferenčně do parenchymových orgánů, typické je postižení více orgánů současně. U AL amyloidózy je typické postižení ledvin (nefrotický syndrom), srdce (diastolická dysfunkce), jater (cholestáza) a jazyka (makroglosie). Častá je krvácivá diatéza (deficit faktoru X) a periferní neuropatie. Klinická symptomatologie je modifikována základním onemocněním (např. mnohočetným myelomem). Méně často jsou prvním projevem AL amyloidózy periodické horečky, myopatie, nodulární hyperplazie tenkého střeva s hypogamaglobulinemií nebo sicca syndrom [11–14].
Pro AA amyloidózu je typické postižení ledvin, hepatosplenomegalie a periferní neuropatie. Gastrointestinální trakt je postižen ve 2/3 případů obou nejčastějších typů, tedy AL a AA amyloidózy. V polovině případů se jedná o gastrointestinální postižení u AA amyloidózy při revmatoidní artritidě. Klinické projevy gastrointestinální amyloidózy zahrnují čtyři hlavní oblasti: krvácení, malabsorpce, exsudativní gastroenteropatie (protein-losing enteropathy) a poruchy gastrointestinální motility [10]. Základní patologickou změnou v trávicí trubici jsou depozita amyloidu ve sliznici duodena (až 100 %), žaludku a rekta (90 %) a jícnu (70 %) [9].
Rozpoznání amyloidózy může být velmi obtížné, zejména při neúplných klinických obrazech. V předložené kazuistice je popsán neobvyklý případ asymptomatické AA amyloidózy diagnostikované z necílených biopsií žaludku a duodena při gastroskopii.
Popis případu
Pacientka (nar. 1947) byla na jiném pracovišti od roku 2012 vyšetřována pro nefrotický syndrom a necharakteristické stěhovavé artralgie. Byla provedena biopsie ledviny (histologicky glomerulonefritida s minimálními změnami – „minimal change glomerulonephritis“), artralgie nebyly nozologicky zařazeny. Terapeuticky byly podávány systémové glukokortikoidy v nízkých dávkách (prednison 5 mg denně). V roce 2015 byla odeslána na naše pracoviště, na základě podrobného revmatologického vyšetření byla stanovena diagnóza RF-séronegativní revmatoidní artritidy. Byla zahájena léčba methotrexátem a leflunomidem, nemocná byla asymptomatická až do jara 2020, kdy došlo k progresi neselektivní proteinurie (4 g/den) a ke zhoršení renálních funkcí (sérový kreatinin 189 μmol/l, urea 13 mmol/l). Pro normocytární hypochromní anemii byla indikována gastroskopie (hemoglobin 86 g/l, hematokrit 0,271, střední objem erytrocytu 83,6 fl, barvivo v erytrocytu 26,5 pg). Při gastroskopii byl zjištěn endoskopický obraz nespecifické erytematózní pangastropatie (obr. 1), v duodenu byly mnohočetné lymfangiektazie (obr. 2). Z necílených biopsií žaludečního antra a duodena byla histologicky diagnostikována AA amyloidóza (obr. 3). Na základě tohoto nálezu byla provedena nová biopsie ledviny, která prokázala AA amyloidózu (obr. 4). Histologické vyšetření infiltrátu na pravé dolní končetině (obr. 5) neprokázalo ani vaskulitidu, ani amyloidózu, zjistilo pouze nespecifické změny (nevýrazná perivaskulární dermatitida). Echokardiografie neprokázala postižení srdce v rámci amyloidózy. Ultrazvukové vyšetření jater a sleziny bylo normální. Leflunomid byl přerušen pro anemii a léčba methotrexátem byla ukončena pro zhoršení renálních funkcí. Na jaře 2020 byla zahájena biologická léčba adalimumabem, která však musela být po 2 měsících ukončena pro nežádoucí vedlejší účinky (lupus-like reakce, autoprotilátky proti histonům). Následně byl nemocné podáván tocilizumab, tato biologická terapie se ukázala být neúčinnou, a proto byla ukončena. Od jara 2021 je pacientka léčena rituximabem. Při poslední klinické kontrole v květnu 2021 jsou základní ukazatele renálních funkcí stacionární (sérový kreatinin 195 μmol/l, urea 13 mmol/l) a došlo k regresi neselektivní proteinurie (2 g/den). Po celou dobu trvání onemocnění byla pacientka bez gastrointestinálních obtíží a bez klinických nebo laboratorních známek malnutrice.
Obr. 1. Vysokorozlišovací endoskopie, zobrazení v bílém světle. Žaludeční antrum, endoskopický obraz nespecifické difuzní erytematózní gastropatie.
Fig. 1. High-resolution white light endoscopy. Gastric antrum, endoscopic image of nonspecific diffuse erythematous gastropathy.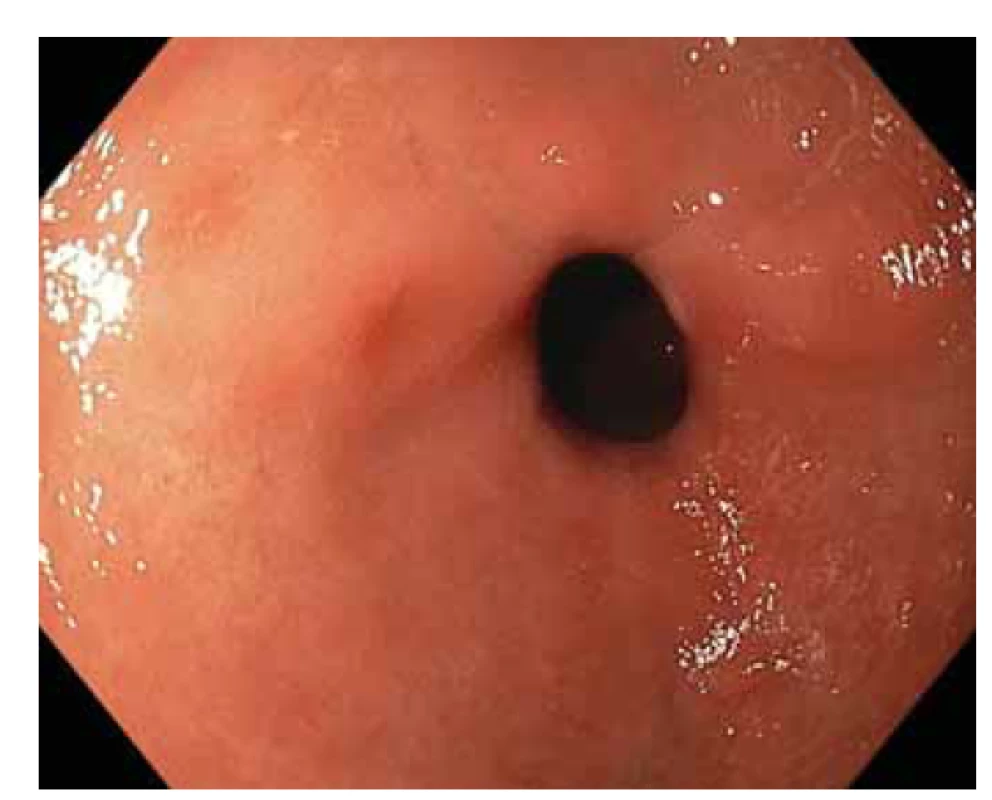
Obr. 2. Vysokorozlišovací endoskopie, zobrazení v bílém světle. V duodenu byly zjištěny mnohočetné lymfangiektázie (šipky). Z plochy bez lymfangiektazií (hvězdička) byla odebrána necílená biopsie, ze které byla diagnostikována AA amyloidóza.
Fig. 2. High-resolution white light endoscopy. Multiple lymphangiectasias were found in the duodenum (arrows). Non-targeted biopsy was taken from an area without lymphangiectasias (asterisk) and revealed AA amyloidosis.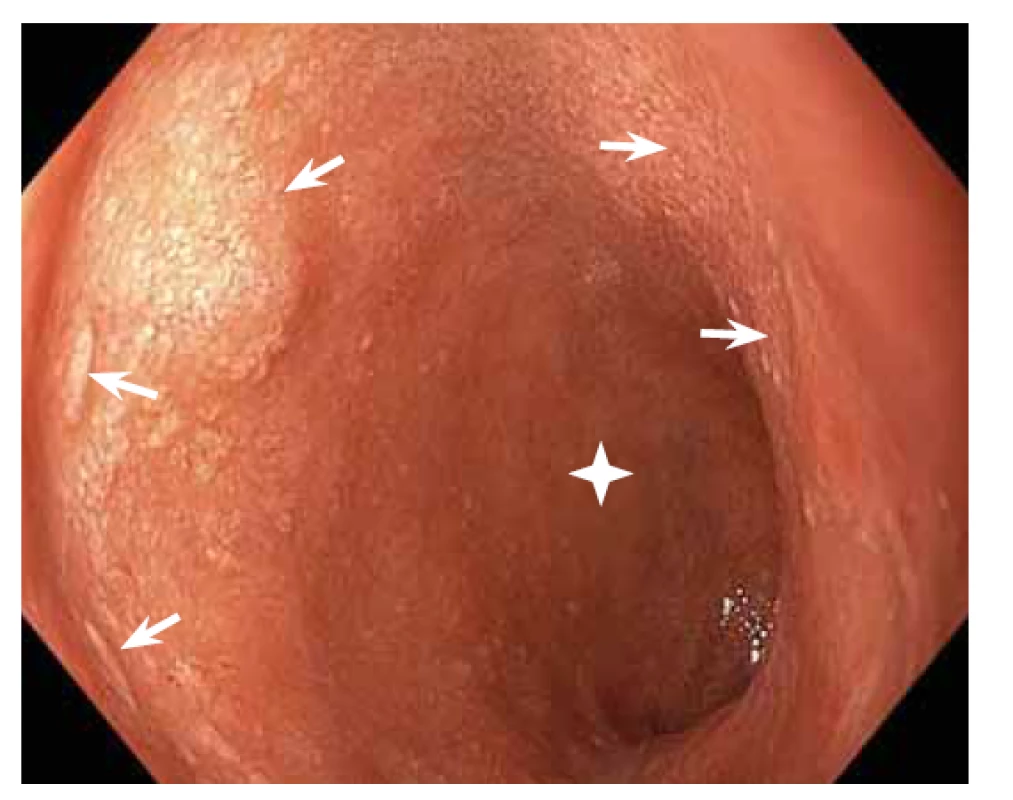
Obr. 3. Histologický obraz duodena prokazující v drobných cévách a intersticiu amorfní materiál, který je pozitivní v reakci na amyloid (sytě červený, barvení saturnovou červení).
Fig. 3. Histological image of the duodenum confirming amorphous material in small vessels and interstitium that is positive for amyloid (deep red, saturn red staining).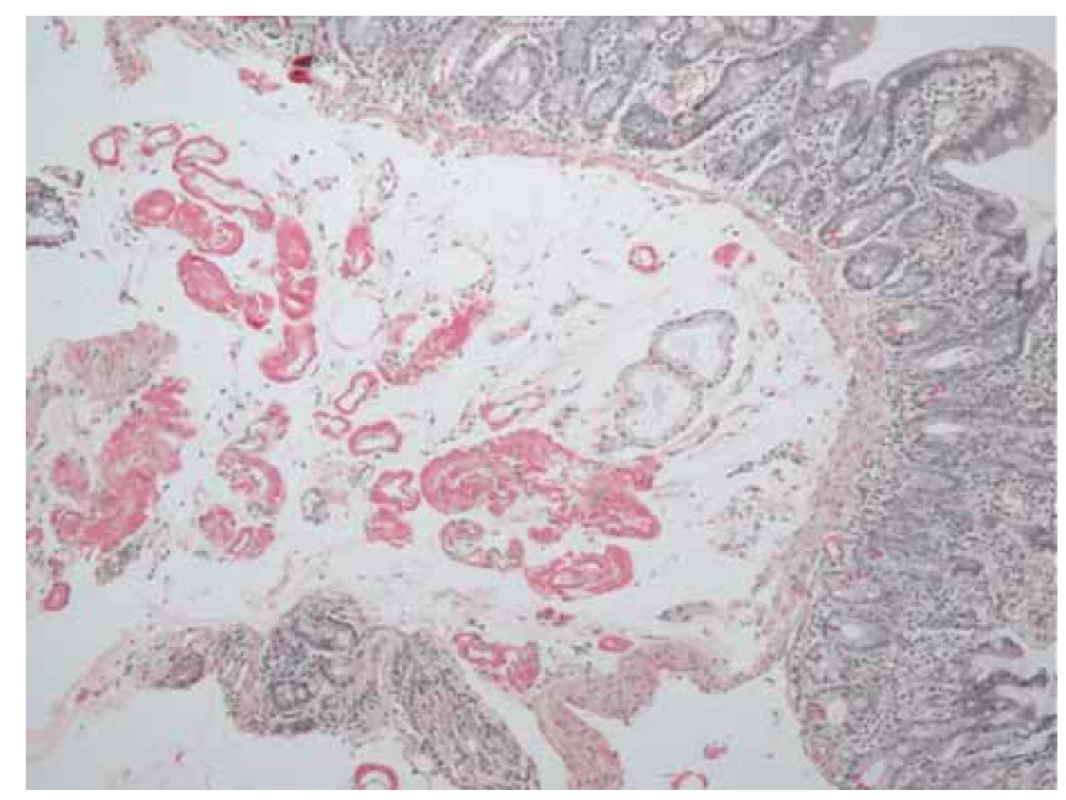
Obr. 4. Histologický obraz glomerulu ledviny, pozitivní amyloid sytě červený (barvení saturnovou červení).
Fig. 4. Histological image of a renal glomerulus, positive amyloid is deep red (saturn red staining).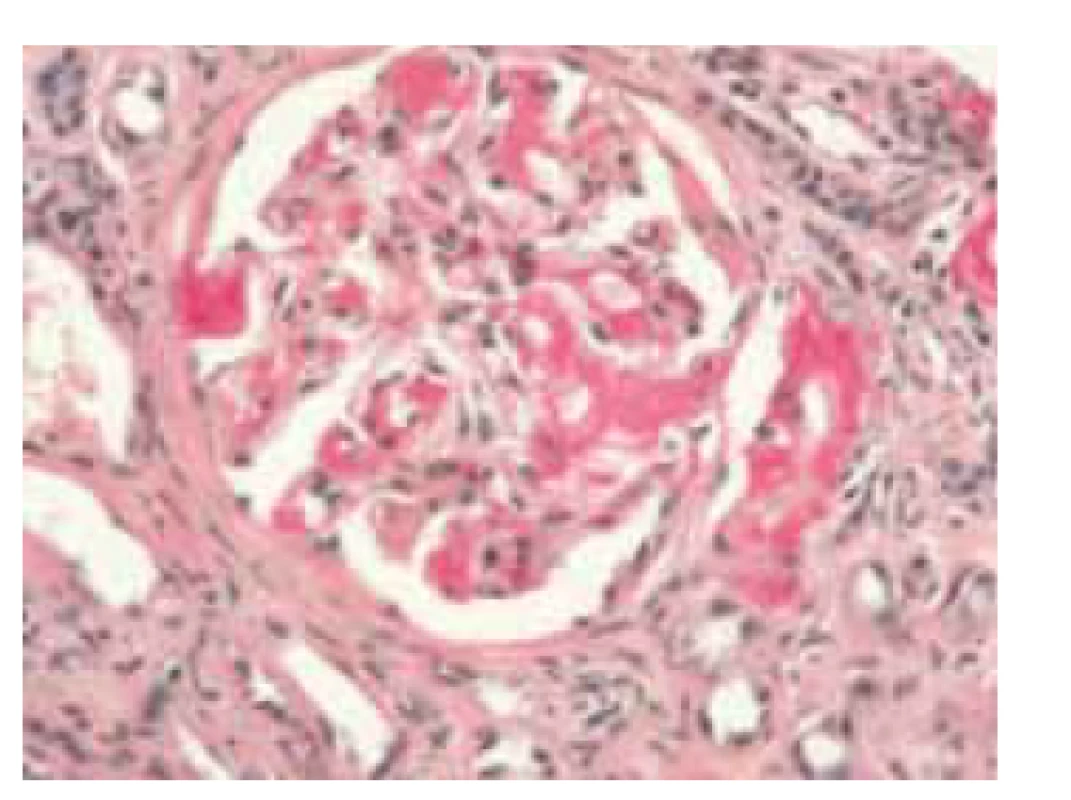
Obr. 5. Histologické vyšetření kožních infiltrátů na dolní končetině (šipky) zjistilo pouze nespecifické změny (nevýrazná perivaskulární dermatitida).
Fig. 5. Histology of skin infiltrates on the lower extremity (arrows) revealed non-specific changes only (mild perivascular dermatitis).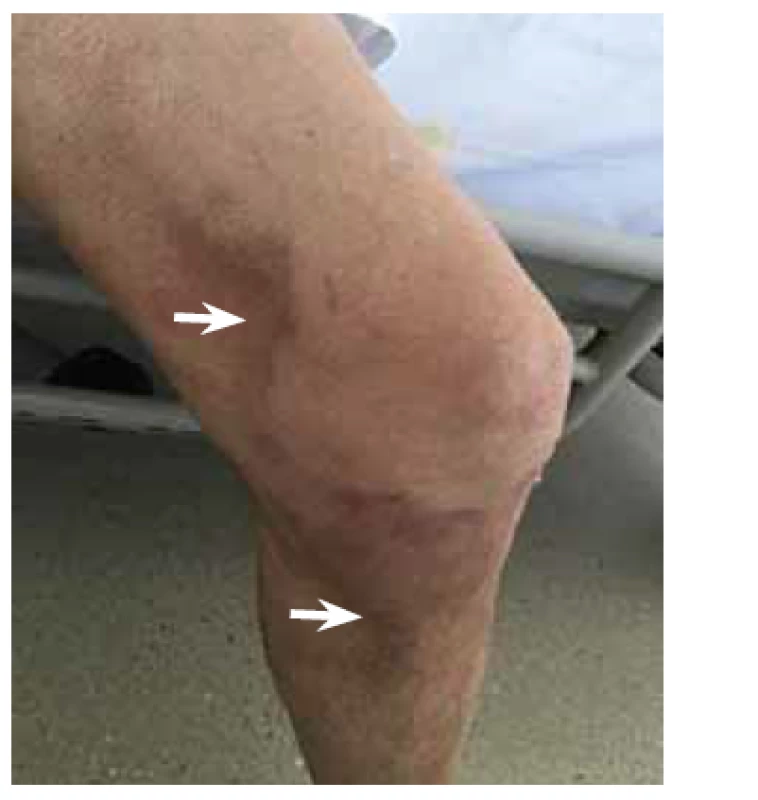
Diskuze
Popsaná kazuistika je neobvyklým případem AA amyloidózy z několika aspektů. Při farmakologické léčbě byla revmatoidní artritida téměř pět let v klinické remisi, přesto došlo k rozvoji amyloidózy. Komplikující amyloidóza zásadním způsobem nezhoršila renální funkce jistě i díky intenzifikované terapii. Případ ukázal velký význam necílených biopsií při gastroskopii, které umožnily časnou diagnózu dosud asymptomatické amyloidózy. Amyloidóza zůstala z hlediska gastrointestinálního traktu asymptomatická i v následujícím průběhu nemoci.
U AA amyloidózy je amyloidogenní protein tvořen játry v podobě amyloidu A (SAA sérový amyloid A) [15]. Postižení gastrointestinálního systému může být limitováno na trávicí trubici (případně játra nebo slinivku), nebo je součástí generalizovaného postižení více orgánů [9]. Při AA amyloidóze dochází k ukládání amyloidu v lamina propria mucosae s výsledným obrazem zrnité (granulární) a křehké sliznice s tendencí k tvorbě drobných slizničních defektů (erozí) [1]. Korelátem pro klinicky rozvinutou AA amyloidózu gastrointestinálního traktu jsou průjmy a malasimilační syndrom. Amyloid lze nicméně prokázat i v makroskopicky normální sliznici. Ve vzorku z trávicí trubice můžeme amyloidová depozita zastihnout ve sliznici nebo submukóze, nicméně nejpřínosnější je identifikace amyloidu v cévní stěně [9]. Byla prokázána vysoká korelace mezi histologickým nálezem a kvantifikací AA amyloidu v bioptických vzorcích, která tak může představovat užitečný nástroj v rámci screeningu, případně monitoringu průběhu onemocnění [16]. Pozitivní duodenální biopsie koreluje s výskytem amyloidózy u chronického renálního onemocnění [17]. Standardem pro diagnostiku, ale i sledování úspěšnosti léčby je vyšetření hladiny sérového amyloidu A (SAA), který patří mezi proteiny akutní fáze a je produkován hepatocyty (po předchozí stimulaci aktivovanými makrofágy, mimo jiné interleukinem-1) [18]. Štěpení SAA v cirkulujících monocytech a makrofázích má za následek tvorbu menších fragmentů (AA proteinu), které se následně mohou ukládat ve tkáních [19]. Léčba AA amyloidózy je založena na kontrole základního zánětlivého onemocnění, které přispívá ke stabilizaci a zlepšení funkce ledvin, snížení proteinurie a částečnému odstranění amyloidových depozit ze tkání [20]. V případě rozvoje pokročilé renální insuficience (ESRD – end stage renal disease) je postižení ledvin již ireverzibilní. Prognosticky nepříznivými faktory jsou vyšší věk pacienta, nižší koncentrace sérového albuminu a vysoká koncentrace SAA [20].
Závěr
Amyloidóza je vzácné onemocnění, které bývá v klinické praxi často diagnostikováno až v okamžiku nevratného postižení orgánových funkcí. Lékař provádějící endoskopické vyšetření trávicího traktu může přispět k diagnostice amyloidózy odběrem necílené biopsie ze sestupného duodena a žaludku. Při nejasné diagnostické rozvaze u pacienta se systémovým zánětlivým onemocněním je biopsie doporučována i v případě normálního makroskopického nálezu. Zahájení včasné léčby vede k potlačení aktivity zánětu, zlepšení kontroly onemocnění, kvality života a lepší prognóze.
Doručeno/Submitted: 7. 7. 2021
Přijato/Accepted: 19. 7. 2021
MUDr. Katsiaryna Zhychko
II. interní gastroenterologická klinika
LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
Konflikt zájmů: Autoři deklarují, že text článku odpovídá etickým standardům, byla dodržena anonymita pacientů a prohlašují, že v souvislosti s předmětem článku nemají finanční, poradenské ani jiné komerční zájmy.
Publikační etika: Příspěvek nebyl dosud publikován ani není v současnosti zaslán do jiného časopisu pro posouzení. Autoři souhlasí s uveřejněním svého jména a e-mailového kontaktu v publikovaném textu.
Dedikace: Práce vznikla v rámci projektu Specifický vysokoškolský výzkum Univerzity Karlovy (SVV 260542/ 2020).
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Conflict of Interest: The authors declare that the article/ manuscript complies with ethical standards, patient anonymity has been respected, and they state that they have no financial, advisory or other commercial interests in relation to the subject matter.
Publication Ethics: This article/ manuscript has not been published or is currently being submitted for another review. The authors agree to publish their names and e-mails in the published article/ manuscript.
Dedication: The work was created within the project Specific University Research of Charles University (SVV 260542/ 2020).
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Zdroje
1. Hokama A, Kishimoto K, Nakamoto M et al. Endoskopic and histopathological features of gastrointestinal amyloidosis. World J Gastrointest Endosc 2011; 3 (8): 157–161. doi: 10.4253/wjge.v3.i8.157.
2. Sipe JD, Cohen AS. Review: history of the amyloid fibril. J Struct Biol 2000; 130 (2–3): 88–98. doi: 10.1006/jsbi.2000.4221.
3. Zámečník J et al. Patologie. Praha: LD Prager Publishing 2019 : 69–74.
4. Sipe JD, Benson MD, Buxbaum JN et al. Amyloid fibril protein nomenclature: 2010 recommendations from the nomenclature committee of the Internation Society of Amyloidosis. Amyloid 2010; 17 (3–4): 101–104. doi: 10.3109/13506129.2010.526812.
5. Ryšavá R. Systémové amyloidózy a jejich léčba. Praha: Maxdorf Jessenius 2013.
6. Ryšavá R. Postižení gastrointestinálního traktu amyloidózou – kdy na ni myslet a jak diagnostikovat. Gastroent Hepatol 2019; 73 (2): 154–162. doi: 10.14735/amgh2019154.
7. Zahradová L. Systémová amyloidóza. Onkológia (Bratisl) 2016; 11 (6): 361–364.
8. Gorevic P, Lachmann H, Romain P. Causes and diagnosis of AA amyloidosis and relation to rheumatic diseases. 2020 [online]. Available from: https: //www.uptodate.com/contents/causes-and-diagnosis-of-aa-amyloidosis-and-relation-to-rheumatic-diseases.
9. Camilleri M, Friedman SL, Grover S. Gastrointestinal amyloidosis: clinical manifestations, diagnosis, and management. 2021 [online]. Available from: https: //www.uptodate.com/contents/gastrointestinal-amyloidosis-clinical-manifestations-diagnosis-and-management.
10. Bureš J, Rejchrt S et al. Vyšetření tenkého střeva a enteroskopický atlas. Praha: Grada Publishing 2001.
11. Kohoutová D, Špaček J, Papík Z et al. Dysphagia, sicca syndrome, chronic non-infectious diarrhoea – dominant symptoms of systemic AL amyloidosis. A case report. Folia Gastroenterol Hepatol 2006; 4 (2): 72–78.
12. Tošovský M, Soukup T, Bradna P et al. Myopatie a smíšená hyperlipoproteinemie jako první pro-jev systémové AL-amyloidózy. Vnitř Lék 2008; 54 (10): 1014–1019.
13. Živný P. Amyloidóza. In: Bureš J, Horáček J, Malý J et al. Vnitřní lékařství. Praha: Galén 2014.
14. Komárková O, Fixa B, Nožička Z. Nodulární lymfatická hyperplazie tenkého střeva, případ s hypogamaglobulinemií a amyloidozou. Čs Gastroent Výž 1983; 37 (2): 103–108.
15. Nienhuis HL, Bijzet J, Hazenberg BP. The prevalence and management of systemic amyloidosis in western countries. Kidney Dis (Basel) 2016; 2 (1): 10–19. doi: 10.1159/000444 206.
16. Yamada T, Okuda Y. AA amyloid quantification in biopsy samples from the stomach. Ann Clin Lab Sci 2012; 42 (1): 3–6.
17. Yilmaz M, Unsal A, Sokmen M et al. Duodenal biopsy for diagnosis of renal involment in amyloidosis. Clin Nephrol 2012; 77 (2): 114–118. doi: 10.5414/CN107139.
18. Pika T, Heřmanová Z, Flodrová P. Laboratorní aspekty systémové AA amyloidózy. Klin Biochem Metab 2017; 25 (46): 56–58.
19. Leung N, Appel G. Renal amyloidosis. 2021 [online]. Available from: https: //www.uptodate.com/contents/renal-amyloidosis.
20. Gorevic P. Treatment of AA (secondary) amyloidosis. 2021 [online]. Available from: https: //www.uptodate.com/contents/treatment-of-aa-secondary-amyloidosis.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článek Kvíz z klinické praxeČlánek Heydeho syndróm
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2021 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Klinická a experimentální gastroenterologie
- Kvíz z klinické praxe
- Infekce SARS-CoV-2 a postižení slinivky břišní
- Parkinsonova choroba a postihnutie GITu
- Heydeho syndróm
- Cytomegalovirová enteritida jako neobvyklý zdroj krvácení do gastrointestinálního traktu
- Význam sarkopenie a myosteatózy u kandidátů transplantace jater na peritransplantační průběh a přežívání pacientů a štěpů
- Serum anti-laminarin antibodies in colorectal cancer: a prospective pilot study
- Endoscopic management of ampullary tumors: European Society of Gastrointestinal Endoscopy (ESGE) Guideline and Endoscopic management of superficial nonampullary duodenal tumors: European Society of Gastrointestinal Endoscopy (ESGE) Guideline
- Neobvyklý případ systémové AA amyloidózy
- Vitamín D a nealkoholová steatóza pečene u detí
- Vliv CDED diety na rozvoj remise u pacienta s přetrvávající aktivitou Crohnovy choroby – kazuistické sdělení a zkušenosti pracoviště
- Aktualita z kongresu EASL-ILC: pokroky v poznání a léčbě primární biliární cholangitidy
- Výběr z mezinárodních časopisů
- Správná odpověď na předchozí kvíz Dlouhodobé bolesti břicha
- Kreditovaný autodidaktický test: klinická a experimentální gastroenterologie
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Heydeho syndróm
- Infekce SARS-CoV-2 a postižení slinivky břišní
- Vliv CDED diety na rozvoj remise u pacienta s přetrvávající aktivitou Crohnovy choroby – kazuistické sdělení a zkušenosti pracoviště
- Vitamín D a nealkoholová steatóza pečene u detí
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



