-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Subkutánní infliximab v léčbě refrakterních pacientů s Crohnovou nemocí – pilotní studie imunogenicity léčiva
Subcutaneous infliximab in the treatment of refractory Crohn‘s disease patients – a pilot study of drug immunogenicity
Introduction: Despite infliximab (IFX) still being the “gold standard” of biological therapy for Crohn’s disease (CD), its effectiveness may vary depending on many factors. One of these factors is the individual patient’s reaction to the drug. A significant clinical problem is the immunogenicity of IFX, where up to 60% of treated patients may develop antibodies against the drug, leading to a loss of response to treatment and/or adverse reactions to therapy. Since 2020, subcutaneous infliximab (IFX-SC) has been available for treating CD patients, characterized by its stable and high trough level (TL) concentration in blood. It is possible that one consequence of this property of IFX-SC is its lower rate of immunogenicity. We present a prospective study of patients diagnosed with CD with severe to refractory courses, treated with IFX-SC. The aim of the study was to monitor the immunogenicity of IFX-SC, including the dynamics of TL and anti-drug antibodies (anti-IFX). The dynamics of clinical, imaging, and laboratory markers of CD over one year of monitoring and treatment are described. Materials and methods: The study included 23 patients diagnosed with CD who had failed 2 to 6 previous lines of biological therapy, one of which was intravenous infliximab (IFX-IV). Patients were divided into two arms of induction therapy based on the presence of anti-IFX. Maintenance therapy consisted of 120 mg s.c. every 14 days, and intensification was 240 mg s.c. every 14 days if necessary. Patients were monitored at weeks W0, W4, W14, W30, and W52, recording Harvey-Bradshaw Index (HBI), serum C-reactive protein (CRP), fecal calprotectin (FC) concentrations, drug trough levels (TL IFX) and serum anti-drug antibodies (anti-IFX). Endoscopic and ultrasonographic disease scores (SES-CD and IUS) were determined, and HLA DQA1*05 haplotype was examined in all patients. Data were analyzed using MedCalc® Statistical Software with non-parametric statistical methods and binary logistic regression. Results: 52-week persistence on IFX-SC treatment was recorded in 13 out of 23 patients (56.5%), with a significant decrease in all monitored clinical, imaging, and laboratory markers of CD activity. During the therapy, 8 out of 16 initially anti-IFX positive individuals seroconverted to negative anti-IFX (50%). None of the patients treated with IFX-SC in W52 needed concomitant immunomodulator treatment. No new sensitization to infliximab was recorded in the cohort during the 52-week therapy. Conclusion: The subcutaneous route of infliximab administration may be a suitable and successful solution in situations where reinduction of infliximab therapy is desired, including patients with the presence of neutralizing antibodies against the drug.
Keywords:
infliximab – inflammatory bowel disease – Crohn’s disease – biological treatment – subcutaneous infliximab – anti-infliximab antibodies – immunogenicity – trough infliximab levels
Autori: Karin Černá
; D. Ďuricová
; M. Lukáš
; N. Machková; V. Hrubá
; K. Kaštylová
; K. Mitrová
; M. Kostrejová; K. Kubíčková
; Š. Peterka
; M. Kolář
; J. Jirsa; G. Vojtěchová
; M. Lukáš
Pôsobisko autorov: Klinické a výzkumné centrum pro střevní záněty, Klinické centrum ISCARE a. s. a 1. LF UK v Praze
Vyšlo v časopise: Gastroent Hepatol 2023; 77(5): 419-426
Kategória: IBD: původní práce
doi: https://doi.org/10.48095/ccgh2023419Súhrn
Úvod: Přestože je infliximab (IFX) dosud „zlatým standardem“ biologické léčby Crohnovy nemoci (CN), jeho účinnost se může lišit v závislosti na mnoha faktorech. Jedním z nich je individuální reakce pacienta na lék. Významným klinickým problémem je imunogenicita IFX, kdy může až u 60 % léčených pacientů dojít k vývoji protilátek proti léčivu, což vede ke ztrátě odpovědi na léčbu a/nebo k nežádoucím reakcím na terapii. Od roku 2020 je k léčbě nemocných s CN k dispozici infliximab k subkutánnímu podání (IFX-SC), jehož farmakokinetika se vyznačuje stabilní a vysokou údolní koncentrací léčiva (TL – trough level) v krevním oběhu. Je možné, že jedním z důsledků této vlastnosti IFX-SC je jeho nižší míra imunogenicity. Předkládáme prospektivní studii sledování pacientů s diagnózou CN s velmi těžkým až refrakterním průběhem, kteří byli léčeni IFX-SC. Cílem studie bylo sledování imunogenicity IFX-SC včetně sledování dynamiky TL a protilátek proti léčivu (anti-IFX). Je popsána dynamika klinických, zobrazovacích a laboratorních markerů CN v průběhu jednoho roku sledování a léčby. Materiál a metodika: Do studie bylo zařazeno 23 pacientů s diagnózou CN s anamnézou selhání 2–6 předchozích linií biologické léčby, přičemž jednou z proběhlých terapií byl nitrožilní infliximab (IFX-IV). Pacienti byli rozděleni do dvou ramen indukční léčby na základě přítomnosti anti-IFX. Udržovací terapie představovala 120 mg s.c. à 14 dní, v případě potřeby intenzifikace se jednalo o 240 mg s.c. à 14 dní. Nemocní byli sledováni v týdnech (W – week) W0, W4, W14, W30 a W52, přičemž byly zaznamenány Harvey-Bradshawův index (HBI), sérová hladina C-reaktivního proteinu (CRP), fekální koncentrace kalprotektinu (FC), hladina léku (TL IFX) a anti-IFX. Dále bylo stanoveno endoskopické a ultrasonografické skóre nemoci (SES-CD a IUS) a u všech pacientů byl vyšetřen haplotyp HLA DQA1*05. Data byla analyzována pomocí softwaru MedCalc® s použitím neparametrických statistických metod a binární logistické regrese. Výsledky: U 13 z 23 pacientů (56,5 %) bylo zaznamenáno 52týdenní setrvání na léčbě IFX-SC se signifikantním poklesem všech sledovaných klinických, zobrazovacích i laboratorních markerů aktivity CN. V průběhu terapie došlo u 8 ze 16 vstupně anti-IFX pozitivních osob k sérokonverzi k negativním anti-IFX (50 %). Žádný z pacientů léčených IFX-SC ve W52 již nepotřeboval konkomitantní léčbu imunomodulátory. Během 52 týdnů terapie nebyla ve sledované kohortě zaznamenána ani jedna nová senzibilizace infliximabem. Závěr: Subkutánní cesta podání infliximabu může být vhodným a úspěšným řešením v situaci, kdy je žádoucí reindukce terapie infliximabem, a to včetně pacientů s přítomností neutralizujících protilátek proti léčivu.
Klíčová slova:
biologická léčba – infliximab – idiopatické střevní záněty – Crohnova nemoc – subkutánní infliximab – protilátky proti infliximabu – imunogenicita – údolní koncentrace infliximabu

Úvod
Infliximab (IFX) je biologický léčivý přípravek používaný v Evropské unii k léčbě idiopatických střevních zánětů (IBD – inflammatory bowel disease) od roku 1999. K vývoji léčiva přispěl mj. americký lékař a mikrobiolog slovenského původu Ján T. Vilček, jehož studie [1] se podílely na patentu uděleném v roce 1995 společnosti Centocor na léčivý přípravek s komerčním názvem Remicade. Od roku 2013 jsou schváleny k použití tzv. biosimilární verze IFX, např. molekuly CT-P13, SB2 nebo GP2013. Biosimilární přípravky jsou léky, které jsou podobné originálnímu biologickému léku a prokázaly svou podobnost ve struktuře, účinnosti a bezpečnosti.
Infliximab je dosud jedním z nejpoužívanějších a neúčinnějších biologických léčiv v terapii IBD. Účinnost IFX závisí na mnoha faktorech – na závažnosti onemocnění, lokalizaci zánětu, dávkování léčiva, komedikaci, intervalu podávání a na individuální reakci jednotlivých pacientů na lék.
Jedním z problémů provázejících biologickou terapii IFX je skutečnost, že velká chimérická molekula glykoproteinové povahy se může stát cílem pacientova imunitního systému. Vznikají protilátky proti léčivu, důsledkem čehož je ztráta odpovídavosti na léčbu a/nebo vznik nežádoucích polékových reakcí včetně časných a/nebo oddálených reakcí přecitlivělosti. Primární neodpovídavost na terapii IFX je udávána v rozmezí 10–30 % [2], sekundární ztráta odpovědi se může ročně týkat až 13 % léčených nemocných [3]. Údaje o imunogenicitě IFX u nemocných s IBD se značně liší, mohou se vyskytovat až u 60 % pacientů [4]. Selhání biologické terapie jedním biologikem z důvodu jeho imunogenicity je rizikovým faktorem pro neodpovídavost v dalších liniích biologické terapie [5].
V roce 2020 byl k použití u nemocných s IBD schválen biosimilární CT-P13 k podkožnímu podání (IFX-SC). Kromě uživatelských benefitů vyplývajících ze subkutánní aplikace léku (tedy komfort pro pacienta, úspora času pro pacienta i zdravotnické zařízení, vyřešení problému s podáním léku u osob s komplikovaným žilním vstupem apod.) se záhy ukázalo, že IFX-SC vede k dosažení signifikantně vyšších údolních koncentrací léčiva (trough levels, TL IFX) a tyto hladiny jsou v čase stabilní. Stabilita TL IFX bez velkých výkyvů je nejspíše důvodem dalšího benefitu IFX-SC, kterým je nižší imunogenicita léčiva [6].
Cílem této práce bylo sledování imunogenicity a výskytu neutralizujících protilátek proti IFX-SC (anti-IFX) u refrakterních pacientů s Crohnovou nemocí (CN), kteří v minulosti selhali na dvou a více liniích biologické léčby, přičemž jedním z dříve podávaných biologik byl IFX-IV. Sekundárním cílem práce byla analýza 52týdenního setrvání na léčbě IFX-SC, faktorů ovlivňujících tuto perzistenci na terapii a vývoj klinických a laboratorních markerů u nemocných s roční perzistencí na terapii IFX-SC.
Pacienti a metodika
V prospektivní studii sledování pacientů jednoho terciárního IBD centra tvořili kohortu nemocní s diagnózou CN s velmi těžkým až refrakterním průběhem, kteří selhali na dvou a více liniích biologické léčby, přičemž jedním z dříve podávaných/selhaných biologik byl IFX-IV. U uvedených nemocných rozhodl ošetřující lékař o „switchování“ ze stávajícího biologického léčiva na IFX-SC.
Před indukcí léčby IFX-SC byla u všech pacientů vyšetřena aktuální hladina anti-IFX v séru. Pacienti bez cirkulujících anti-IFX následně dostali dvě indukční dávky IFX-IV v dávce 5 mg/kg v rozmezí 14 dnů a 4 týdny po druhé nitrožilní indukční dávce pokračovali v udržovací léčbě IFX-SC 120 mg à 14 dní. U pacientů s přítomností anti-IFX v séru byla indukční léčba realizována čtyřmi subkutánními injekcemi IFX-SC v dávce 120 mg jednou týdně, následnou udržovací terapii rovněž představoval IFX-SC v dávce 120 mg jednou za 2 týdny. Pokud ošetřující lékař rozhodl o potřebě intenzifikace terapie IFX-SC, dávka léku byla navýšena na 240 mg jednou za 2 týdny.
U všech sledovaných pacientů byly v týdnech (W – week) W0, W4, W14, W30 a W52 zaznamenány: Harvey-Bradshawův index (HBI), sérová hladina C-reaktivního proteinu (CRP), fekální koncentrace kalprotektinu (FC) a hladina neutralizujících protilátek proti infliximabu (anti-IFX) detekovaná s pomocí „drug sensitive“ testu. Kromě W0 byla ve všech časových bodech provedena vyšetření sérových koncentrací infliximabu (TL IFX). Ve W0, W30 a W52 bylo provedeno ultrasonografické vyšetření střev a stanoven index aktivity nemoci (IUS – intestinal ultrasound score) dle metodiky popsané Kucharczikem et al [7]. Ve W0 a W52 byli nemocní vyšetřeni endoskopicky se stanovením endoskopického skóre aktivity nemoci (SES-CD – simple endoscopic score for Crohn’s disease) [8]. U všech nemocných byl vyšetřen haplotyp HLA DQA1*05 (rs 2097432) metodou qPCR.
Data byla analyzována s pomocí softwaru MedCalc® Statistical Software version 22.007 (MedCalc Software Ltd, Belgie). Kvantitativní proměnné byly testovány na normalitu pomocí Shapiro-Wilkova testu, a protože nebylo prokázáno normální rozdělení dat, byly použity neparametrické statistické přístupy. Spojité proměnné byly prezentovány jako mediány a interkvartilové rozmezí (IQR), u kategoriálních proměnných byly uvedeny jejich absolutní a relativní počty. K porovnání analyzovaných skupin byly použity Kruskal-Wallisův a chí-kvadrát test. K analýze faktorů ovlivňujících 52týdenní perzistenci na léčbě IFX-SC byla použita binární logistická regrese. Za signifikantní byla přijata hodnota p ≤ 0,05.
Projekt byl schválen Etickou komisí Klinického centra ISCARE č. 2022/IVa.
Výsledky
V týdnu W0 zahájilo studii celkem 23 pacientů s CN, 12 mužů a 11 žen s mediánem věku 31 let (IQR 26–35 let). Medián trvání CN byl 14 let (IQR 11–18,75 roku) a medián času od poslední podané dávky IFX-IV byl 8 let (IQR 4,5–11 let).
U nemocných zařazených do studie byl IFX-SC třetí až sedmou linií biologické terapie (medián předchozího počtu biologik byl roven 4, IQR 3–5). Hlavním důvodem pro ukončení léčby IFX-IV v minulosti byla infuzní alergická reakce u 3 pacientů (13 %), závažné infekční komplikace u 2 pacientů (9 %), těžká paradoxní psoriáza u 1 nemocného (4 %) a zejména ztráta odpovědi na terapii s progresí nemoci u 17 pacientů (74 %). Ke dříve podávaným biologickým léčivům kromě IFX-IV patřily adalimumab, ustekinumab, vedolizumab, etrolizumab a risankizumab, čtyři pacienti byli v minulosti léčeni mj. duální terapií (tedy kombinací adalimumab + vedolizumab a infliximab + ustekinumab).
Základní klinické údaje o pacientech uvádí tab. 1.
Tab. 1. Klinické údaje pacientů v den zařazení do studie (W0), n = 23.Tab. 1. Baseline clinical data of patients (W0), n = 23. 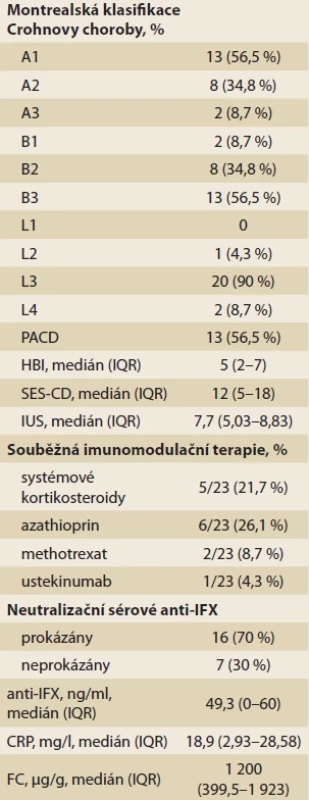
PACD – perianální Crohnova nemoc; IQR – interkvartilové rozmezí; HBI – Harvey-Bradshawův index; SES-CD – simple endoscopic score of Crohn’s disease; IUS – intestinal ultrasound score; anti-IFX – protilátky proti infliximabu; CRP – C-reaktivní protein; FC – fekální kalprotektin Tab. 2. Příčiny ukončení terapie IFX-SC před 52. týdnem léčby.Tab. 2. Reasons for discontinuation of IFX-SC therapy before the 52nd week of treatment. 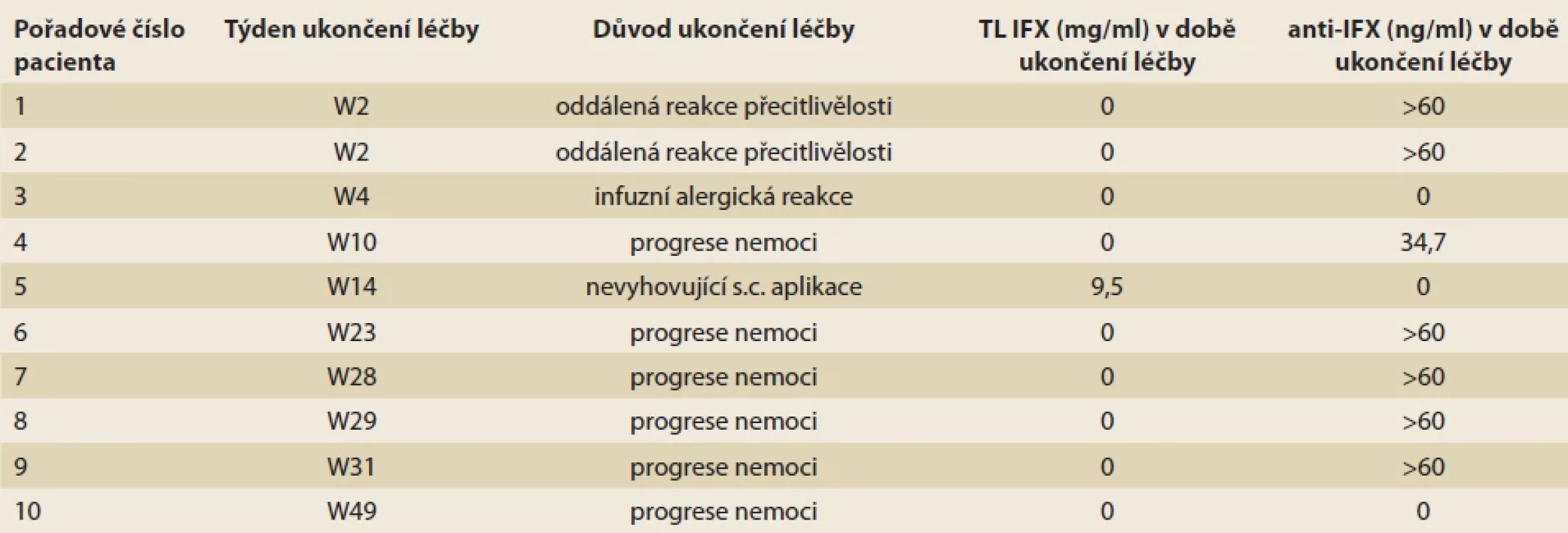
TL IFX – údolní koncentrace infl iximabu v séru; anti-IFX – sérové neutralizující protilátky proti infl iximabu Graf 1. Dynamika vývoje neutralizujících protilátek proti infl iximabu v průběhu 52 týdnů sledování léčby IFX-SC.Graph 1. Dynamics of the development of neutralizing antibodies against infl iximab during the 52 weeks of IFX-SC treatment. 
Setrvání na léčbě IFX-SC v průběhu sledovaných 52 týdnů
Ve sledovaném období 52 týdnů došlo k vyřazení dvou nemocných ze studie již po první indukční dávce léku. V týdnech W14 a W30 pokračovalo ve studii 18 z původních 23 pacientů (78,3 %) a v týdnu W52 celkem 13 z původního počtu pacientů (56,5 %). Příčiny ukončení léčby IFX-SC v průběhu 52týdenního sledování shrnuje tab. 2.
Lze konstatovat, že k selhání léčby IFX-SC došlo především u osob s nulovými TL IFX a s perzistencí anti-IFX.
Na začátku sledování (ve W0) užívalo 13 z 23 pacientů (56,5 %) systémové imunomodulátory, tj. kortikosteroidy, thiopuriny nebo methotrexát, jeden nemocný kromě IFX-SC dostával též ustekinumab (tzv. duální terapie). Na konci sledovaného období ve W52 neužíval ani jeden ze 13 pacientů setrvávajících na léčbě žádný z uvedených imunomodulátorů, pouze mladý muž s těžkým průběhem nemoci nadále dostával duální léčbu IFX-SC v kombinaci s ustekinumabem.
V průběhu 52 týdnů sledování nedošlo ani u jednoho nemocného ke vzniku klinicky závažné infekce, která by vedla k nutnosti ukončení léčby. Nebyly zaznamenány závažné kožní ani kloubní komplikace s možnou souvislostí s podáním IFX-SC.
Vývoj tvorby neutralizačních anti-IFX
V průběhu 52 týdnů terapie došlo k sérokonverzi z původní anti-IFX pozitivity k negativním anti-IFX u 8 z původně 16 anti-IFX pozitivních osob (50 %). Všichni pacienti po této sérokonverzi setrvali po dobu 52 týdnů na léčbě IFX-SC. Týdne W52 v klinické remisi dosáhli pouze pacienti s negativními anti-IFX (graf 1).
Sérokonverze z anti-IFX pozitivního do anti-IFX negativního stavu byla provázena signifikantním vzestupem TL IFX (graf 3).
U žádného pacienta, který zahajoval léčbu s negativními anti-IFX, nedošlo nově v průběhu léčby k indukci tvorby protilékových protilátek.
Binární logistickou regresí nebyl identifikován žádný vstupní faktor, který by byl signifikantně sdružen s 52týdenní odpovídavostí na léčbu IFX-SC. Genotyp HLA-DQA1*05 ani vstupní hodnoty tíže systémového a střevního zánětu neměly vliv na roční perzistenci na léčbě. Trend ke statistické významnosti byl patrný u hladin anti-IFX, věku pacientů a u délky trvání CN (tab. 3, grafy 3a–c).
Graf 2. Vývoj koncentrací anti-IFX a TL IFX v průběhu 52 týdnů léčby IFX-SC.Graph 2. Development of anti-IFX and TL IFX concentrations during 52 weeks of IFX-SC treatment. 
Tab. 3. Odhad pravděpodobnosti 52týdenního setrvání na léčbě IFX-SC ve vztahu k vybraným sledovaným klinickým parametrům.Tab. 3. Estimation of the probability of a 52-week IFX-SC treatment persistence in relation to assessed clinical parameters. 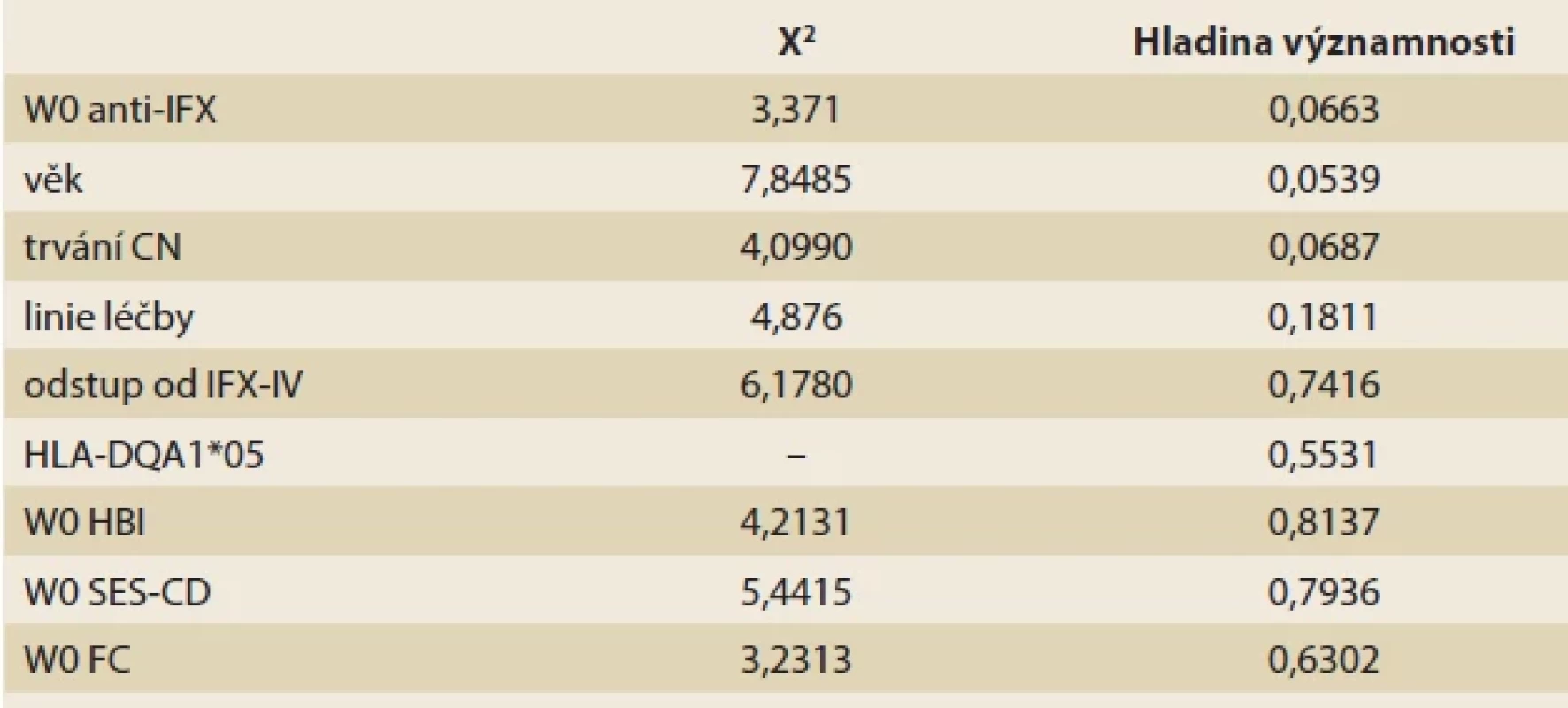
anti-IFX – sérové neutralizující protilátky proti infl iximabu; CN – Crohnova nemoc; IFX-IV – nitrožilní infl iximab; HBI – Harvey-Bradshawův index; SES-CD – simple endoscopic score of Crohn’s disease; FC – fekální kalprotektin Graf 3. Predikce 52týdenní odpovídavosti na terapii IFX-SC – binární logistická regrese.Graph. 3. Prediction of 52-week IFX-SC treatment persistence – binary logistic regression. 
Tab. 4. Klinické, zobrazovací a laboratorní markery CN u pacientů s klinickou odpovídavostí na léčbu IFX-SC v týdnu W52, n = 13.Tab. 4. Clinical, imaging, and laboratory markers of CN in patients with clinical response to IFX-SC treatment at week W52, n = 13. 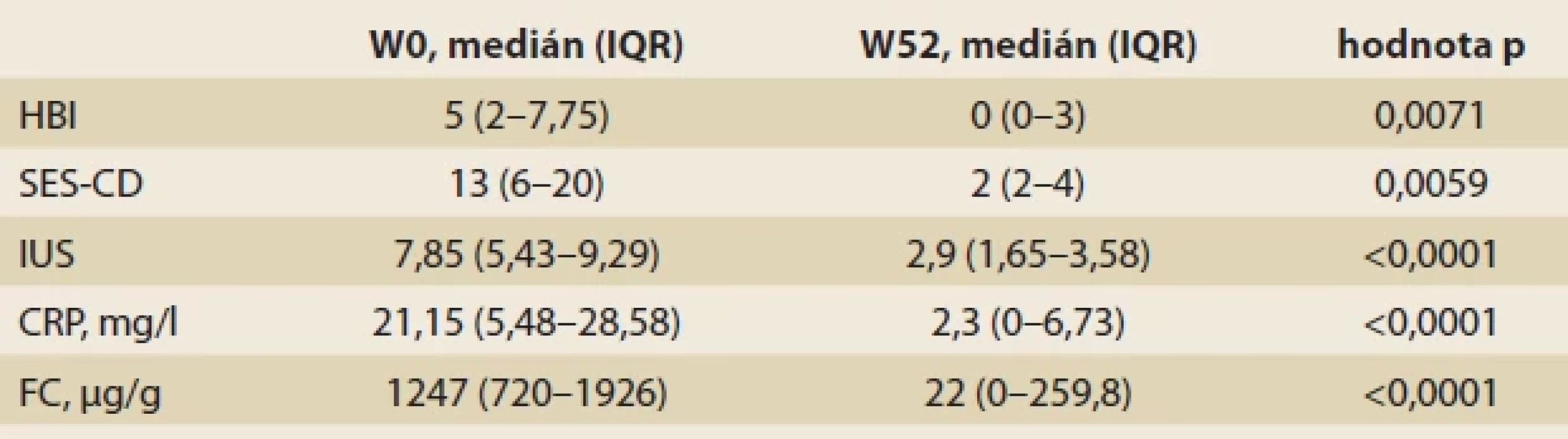
HBI – Harvey-Bradshawův index; SES-CD – simple endoscopic score of Crohn’s disease; IUS – intestinal ultrasound score; CRP – C-reaktivní protein; FC – fekální kalprotektin Klinický stav pacientů v týdnu W52
Celkem 56,5 % zařazených pacientů dosáhlo W52. U všech je patrný signifikantní pokles všech sledovaných klinických, zobrazovacích i laboratorních markerů aktivity CN (tab. 4).
Diskuze
Předkládaná studie je první českou prací, která poukazuje na možnost reindukce infliximabu subkutánním podáním u pacientů, kteří dříve selhali na léčbě nitrožilním léčivem. Za důležitou lze považovat skutečnost, že u poloviny z pacientů, kteří léčbu IFX-SC zahajovali s přítomností neutralizujících protilátek proti infliximabu, došlo během několika týdnů léčby k sérokonverzi a k vymizení těchto protilátek. Během ročního sledování pak ani u jednoho ze vstupně anti-IFX negativních pacientů nedošlo k nové senzibilizaci s tvorbou protilátek proti léčivu.
Možná nižší míra imunogenicity by mohla být slibnou výhodou IFX-SC. Tradičně se má za to, že subkutánně podávaná biologika jsou imunogennější než intravenózní léčba díky teoretické expozici antigen prezentujícím buňkám v epidermis a dermis [9], ačkoli objektivní důkazy podporující vyšší tvorbu protilátek po podání léčiva touto cestou jsou rozporuplné [10]. Existuje několik dosud diskutovaných hypotéz, proč je IFX-SC méně imunogenní než IFX-IV. Patří k nim mj.:
- teorie o stabilitě sérových hladin léčiva, která při subkutánním podání brání velkým výkyvům „peak-trough“, a tudíž snižuje imunogenicitu molekuly IFX [6], nebo
- hypotéza o tom, že vyšší TL IFX-SC spouští mechanizmy navození tolerance v nadbytku antigenu nebo snižují tvorbu imunogenních komplexů antigen-protilátka [11]. Zde ovšem není zcela jasné, proč by se tyto mechanizmy přednostně aktivovaly při stabilních mírných hladinách léčiva při subkutánní léčbě, a nikoli při vysokých „peak“ koncentracích při intravenózní léčbě.
Na nižší imunogenicitu IFX-SC upozornily již dřívější práce. Ve Schreiberově otevřené, randomizované, placebem kontrolované studii podkožního podávání infliximabu pacientům s aktivní CN [12] byly analyzovány anti-IFX a jejich neutralizační potenciál s pomocí „drug-tolerant“ metody ECLIA. V této studii se u 7 z 12 pacientů (58 %) v intravenózní větvi ve srovnání s pouhými 3 z 30 (10 %) v subkutánní větvi objevily do 30. týdne protilátky proti léčivu. Po 54 týdnech terapie mělo v subkutánním rameni studie signifikantně méně pacientů neutralizační protilátky proti léčivu proti intravenózní větvi (18 vs. 37 %; p = 0,019). V největší dosud publikované reálné kohortě 181 pacientů po změně léčby z intravenózní na subkutánní se protilátky proti léčivu objevily pouze u 14 pacientů (8 %) [13].
V naší kohortě dosáhlo 52týdenní perzistence na léčbě IFX-SC 56,5 % pacientů. Jelikož se jednalo o refrakterní pacienty po několikanásobném selhání jiných biologických léčiv (pro některé z léčených subjektů byl IFX-SC až sedmou linií biologické terapie), lze tuto „treatment persistence“ považovat za uspokojivou. Pro takto specifickou skupinu pacientů je však dosud k dispozici málo dat z reálné klinické praxe. Pro srovnání lze uvést výsledky studie německých autorů [14], kteří publikovali 70% setrvání na léčbě IFX-SC do týdne W12 u 10 pacientů s předchozí senzibilizací na IFX-IV.
Studie prokázala, že podkožní podání infliximabu významně zvyšuje bezpečnost léčby, protože v týdnu W52 nebylo potřebné u žádného z pacientů pokračujících v terapii IFX-SC podávat konkomitantní imunosupresiva a/nebo kortikosteroidy. Nedávná D‘Haensova studie [15] prokázala srovnatelnou klinickou účinnost a farmakokinetiku IFX u pacientů, kteří dostávali IFX-SC se souběžnými perorálními imunomodulátory (azathioprin nebo methotrexát), nebo bez nich.
Přísný výběr refrakterních pacientů s anamnézou přechozích terapeutických selhání je příčinou nízké četnosti sledované kohorty. Extrapolace získaných dat je proto omezená a jejich reprezentativnost pro standardní IBD populaci nízká. Naše data naznačují, že selhání terapie IFX-SC by mohlo být pravděpodobnější u osob se vstupně vysokými koncentracemi anti-IFX, toto riziko by mohlo dále stoupat s věkem a s délkou trvání nemoci. V žádné z uvedených analýz nebylo dosaženo statistické signifikance, nicméně tyto parametry byly identifikovány jako rizikové faktory neodpovídavosti na IFX terapii již v předchozích studiích [16–18].
Přínos studie lze spatřovat v poukázání na to, že nová subkutánní cesta podání infliximabu může být vhodným a úspěšným řešením v situaci, kdy je žádoucí reindukce terapie infliximabem u nemocných s komplikovanou anamnézou, dokonce i u pacientů s přítomností neutralizujících protilátek proti léčivu. Naše poznatky naznačují možnost optimalizace terapeutických režimů a zlepšení klinických výsledků u pacientů s obtížně zvladatelnou CN. Zobecnění závěrů malé pilotní studie však není možné a k potvrzení našich výsledků a rozšíření znalostí o podání subkutánního infliximabu v léčbě CN budou potřebné další rozsáhlé studie. Tyto výzkumy by měly také zahrnovat sledování bezpečnosti a snášenlivosti tohoto terapeutického přístupu.
Zdroje
1. Knight DM, Trinh H, Le J et al. Construction and initial characterization of a mouse-human chimeric anti-TNF antibody. Mol Immunol 1993; 30 (16): 1443–1453. doi: 10.1016/ 0161-5890 (93) 90106 - l.
2. Schnitzler F, Fidder H, Ferrante M et al. Long-term outcome of treatment with infliximab in 614 patients with Crohn’s disease: results from a single-centre cohort. Gut 2009; 58 (4): 492–450. doi: 10.1136/gut.2008.155812.
3. Assa A, Hartman C, Weiss B et al. Long-term outcome of tumor necrosis factor alpha antagonist’s treatment in pediatric Crohn’s disease. J Crohns Colitis 2013; 7 (5): 369–376. doi: 10.1016/j.crohns.2012.03.006.
4. Tighe D, McNamara D. Clinical impact of immunomonitoring in the treatment of inflammatory bowel disease. World J Gastroenterol 2017; 23 (3): 414–425: doi: 10.3748/wjg.v23.i3. 414.
5. Albshesh A, Taylor J, Savarino EV et al. Effectiveness of Third-Class Biologic Treatment in Crohn’s Disease: A Multi-Center Retrospective Cohort Study. J Clin Med 2021; 10 (13): 2914. doi: 10.3390/jcm10132914.
6. Little RD, Ward MG, Wright E et al. Therapeutic Drug Monitoring of Subcutaneous Infliximab in Inflammatory Bowel Disease-Understanding Pharmacokinetics and Exposure Response Relationships in a New Era of Subcutaneous Biologics. J Clin Med 2022; 11 (20): 6173. doi: 10.3390/jcm11206173.
7. Kucharzik T, Wilkens R, D‘Agostino MA et al. STARDUST Intestinal Ultrasound study group. Early Ultrasound Response and Progressive Transmural Remission After Treatment with Ustekinumab in Crohn’s Disease. Clin Gastroenterol Hepatol 2023; 21 (1): 153–163.e12. doi: 10.1016/j.cgh.2022.05.055.
8. Daperno M, D’Haens G, Van Assche G et al. Development and validation of a new, simplified endoscopic activity score for Crohn’s disease: the SES-CD. Gastrointest Endosc 2004; 60 (4): 505–512. doi: 10.1016/s0016-5107 (04) 018 78-4.
9. Malissen B, Tamoutounour S, Henri S. The origins and functions of dendritic cells and macrophages in the skin. Nat Rev Immunol 2014; 14 (6): 417–428. doi: 10.1038/nri3683.
10. Kim H, Alten R, Cummings F et al. Innovative approaches to biologic development on the trail of CT-P13: Biosimilars, value-added medicines, and biobetters. MAbs 2021; 13 (1): 1868078. doi: 10.1080/19420862.2020.1868078.
11. Bar-Yoseph H, Pressman S, Blatt A et al. Infliximab-Tumor Necrosis Factor Complexes Elicit Formation of Anti-Drug Antibodies. Gastroenterology 2019; 157 (5): 1338–1351.e8. doi: 10.1053/j.gastro.2019.08.009.
12. Schreiber S, Jang BI, Borzan V et al. Novel Formulation of CT-P13 (Infliximab Biosimilar) for Subcutaneous Administration: Initial Results from a Phase I Open-Label Randomized Controlled Trial in Patients with Active Crohn’s Disease. Gastroenterology 2018; 154 : 1371. doi: 10.1016/S0016-5085 (18) 344 77-9.
13. Smith PJ, Critchley L, Storey D et al. Efficacy and Safety of Elective Switching from Intravenous to Subcutaneous Infliximab (Ct-P13): A Multi-Centre Cohort Study. J Crohn’s Colitis 2022; 16 (9): 1436–1446. doi: 10.1093/ecco-jcc/jjac053.
14. Husman J, Matthes K, Gilger M et al. Subcutaneous infliximab in IBD patients with previous immunogenic failure of intravenous infliximab. J Crohns Colitis 2023; 17 (Suppl): i920.
15. D‘Haens G, Reinisch W, Schreiber S et al. Comparison of combination subcutaneous infliximab and an immunomodulator versus subcutaneous infliximab monotherapy: post-hoc analysis of a randomised clinical trial (UEG Week 2021). 2021 [online]. Dostupné z: https: //programme.ueg.eu/week2021/#/details/presenta - tions/1284.
16. Kennedy NA, Heap GA, Green HD et al. UK Inflammatory Bowel Disease Pharmacogenetics Study Group. Predictors of anti-TNF treatment failure in anti-TNF-naive patients with active luminal Crohn’s disease: a prospective, multicentre, cohort study. Lancet Gastroenterol Hepatol 2019; 4 (5): 341–353. doi: 10.1016/S2468-1253 (19) 30012-3.
17. Lionetti P, Bronzini F, Salvestrini C et al. Response to infliximab is related to disease duration in paediatric Crohn‘s disease. Aliment Pharmacol Ther 2003; 18 (4): 425–431. doi: 10.1046/j.1365-2036.2003.01672.x.
18. Juillerat P, Sokol H, Froehlich F et al. Factors associated with durable response to infliximab in Crohn’s disease 5 years and beyond: a multicenter international cohort. Inflamm Bowel Dis 2015; 21 (1): 60–70. doi: 10.1097/MIB. 0000000000000225.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2023 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Screening kolorektálního karcinomu v České republice
- Editorial
- Anemický pacient
- Výsledky z evaluace screeningu kolorektálního karcinomu v České republice
- Trendy v predčasných úmrtiach na zhubné nádory tráviacej sústavy na Slovensku v rokoch 2011–2020: 8 diagnóz počas 10 rokov
- Smíšený adenoneuroendokrinní karcinom žaludku – kazuistika
- Subkutánní infliximab v léčbě refrakterních pacientů s Crohnovou nemocí – pilotní studie imunogenicity léčiva
- Terapeutické monitorovanie hladín biologickej liečby chronických črevných zápalov – odporúčania do praxe
- Urolitiáza u pacientů s idiopatickými střevními záněty – možnosti prevence a metabolického ovlivnění
- Výběry z mezinárodních časopisů
- Životní jubileum prof. MUDr. Miroslava Zavorala, Ph.D.
- Současné možnosti využití tofacitinibu u ulcerózní kolitidy v tuzemské praxi
- Subkutánní infliximab – léčebné postupy a nové možnosti po klinickou praxi
- Kýžené cíle léčby IBD a jak jich dosáhnout
- Registry – okno do skutečného světa klinické praxe
- Nejdůležitějším cílem je kvalita života
- Kreditovaný autodidaktický test: Gastrointestinální onkologie
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Terapeutické monitorovanie hladín biologickej liečby chronických črevných zápalov – odporúčania do praxe
- Výsledky z evaluace screeningu kolorektálního karcinomu v České republice
- Smíšený adenoneuroendokrinní karcinom žaludku – kazuistika
- Urolitiáza u pacientů s idiopatickými střevními záněty – možnosti prevence a metabolického ovlivnění
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



