-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Snížená hladina magnezia v moči po ileokolické resekci u pacientů s Crohnovou chorobou
Reduced urinary magnesium levels after ileocolic resection in patients with Crohn’s disease
: Introduction: Urinary excretion of magnesium is an important preventive factor against nephrolithiasis by inhibiting several key processes in its pathogenesis. Patients with Crohn’s disease (CD) have an approximately 2-fold higher risk of lithiasis, especially those after ileocolic (IC) resection. The aim is to determine the magnesuria level in these patients and compare it with patients with CD and IC involvement without resection and then both groups with healthy controls. The secondary objective was to assess calciuria and other modifying factors. Methods: CD patients aged 18 years or older with IC resection (group 1) and terminal ileal involvement without resection (group 2) were enrolled in the study, with subjects without known bowel disease as controls (group 3). Exclusion criteria were citrate therapy, severe renal insufficiency (GFR < 30 ml/ min/ 1.73 m2), more than two bowel resections, ileostomy, colectomy, short bowel syndrome, acute urinary tract infection and evidence of CD relapse. Anamnestic data were collected by questionnaire, blood and fresh urine samples were collected, renal and gallbladder ultrasound was performed for the presence of lithiasis, and patients underwent 24-hour urine collection to determine oxaluria, citraturia, magnesuria and calciuria. Results: 107 subjects were included in the study, including 34 patients with IC resection, 42 with CD without resection and 31 healthy controls. 43% were women, mean age was 38 ± 11.5 years. There was a significant difference in magnesuria values between the resection and non-resection group (median 2.28 vs. 3.97 mmol/ l; P = 0.047) and especially between the resection group and healthy controls (median 2.28 vs. 4.31 mmol/ l; P = 0.0003). The group without resection vs. healthy controls did not reach a significant difference (median 3.97 vs. 4.31 mmol/ l; P = 0.455). Calciuria values did not differ significantly between groups (median 3.75 vs. 4.6 vs. 4.3 mmol/ l; P = 0.293). Conclusion: Magnesuria values of CD patients after IC resection were significantly lower compared to the group of CD patients with IC involvement without resection and healthy controls. The group without resection achieved results comparable to controls. Calciuria values were not significantly different between groups in our study. We hypothesize that patients with CD after IC resection at higher risk of urolithiasis might benefit from Mg supplementation to prevent concretion formation. However, confirmation of this thesis will require verification by further research.
Autori: V. Navrátil 1
; Lumír Kunovský 1-3
; B. Pipek 1,4
; Jan Křivinka 1
; J. Zapletalová 5; Přemysl Falt 1
Pôsobisko autorov: II. interní klinika – gastroenterologická a geriatrická LF UP a FN Olomouc 1; Chirurgická klinika LF MU a FN Brno 2; Gastroenterologické oddělení a digestivní endoskopie, Masarykův onkologický ústav, Brno 3; Centrum péče o zažívací trakt, Nemocnice AGEL Ostrava-Vítkovice a. s. 4; Ústav lékařské biofyziky LF UP v Olomouci 5
Vyšlo v časopise: Gastroent Hepatol 2024; 78(1): 19-26
Kategória: IBD
doi: https://doi.org/10.48096/ccgh202419Súhrn
Úvod: Močová exkrece magnezia je důležitý preventivní faktor chránící před vznikem nefrolitiázy, a to inhibicí několika klíčových dějů v její patogenezi. Pacienti s Crohnovou chorobou (CD) mají riziko litiázy přibližně 2krát vyšší, zejména pacienti po ileokolické (IC) resekci. Cílem je stanovit hladinu magnesurie u těchto pacientů a porovnat ji s pacienty s IC postižením bez resekce a poté obě skupiny se zdravými kontrolami. Sekundárním cílem bylo posouzení kalciurie a dalších modifikujících faktorů. Metody: Do studie byli zařazeni pacienti s CD starší 18 let s IC resekcí (skupina 1) a s postižením terminálního ilea bez resekce (skupina 2) a jako kontrolní skupina osoby bez známého střevního onemocnění (skupina 3). Vylučovacími kritérii byla terapie citráty, závažná renální insuficience (GFR < 30 ml/ min/ 1,73 m2), více než dvě střevní resekce, ileostomie, kolektomie, syndrom krátkého střeva, akutní infekce močových cest a známky relapsu CD. Anamnestické údaje byly zjišťovány dotazníkem, byl odebrán vzorek krve a čerstvé moči, bylo provedeno ultrazvukové vyšetření ledvin a žlučníku na přítomnost litiázy a u pacientů byl proveden 24hodinový sběr moči ke stanovení oxalurie, citraturie, magnesurie a kalciurie. Výsledky: Do studie bylo zařazeno 107 osob, z toho 34 pacientů po resekci IC, 42 s CD bez resekce a 31 zdravých kontrol. Ženy tvořily 43 %, průměrný věk byl 38 ± 11,5 let. V hodnotách magnesurie byl prokázán signifikantní rozdíl mezi skupinou s resekcí a bez resekce (medián 2,28 vs. 3,97 mmol/ l; p = 0,047) a zejména mezi skupinou s resekcí a zdravými kontrolami (medián 2,28 vs. 4,31 mmol/ l; p = 0,0003). Skupina bez resekce proti zdravým kontrolám nedosáhla signifikantního rozdílu (medián 3,97 vs. 4,31 mmol/ l; p = 0,455). Hodnoty kalciurie se mezi skupinami významně nelišily (medián 3,75 vs. 4,6 vs. 4,3 mmol/ l; p = 0,293). Závěr: Hodnoty magnesurie pacientů s CD po IC resekci jsou významně nižší proti skupině pacientů s CD s IC postižením bez provedené resekce i od zdravých kontrol. Skupina bez resekce dosáhla výsledků srovnatelných s kontrolami. Hodnoty kalciurie se v naší práci mezi skupinami významně nelišily. Předpokládáme, že pacienti s CD po IC resekci s vyšším rizikem vzniku urolitiázy by mohli profitovat ze suplementace magnezia v rámci prevence tvorby konkrementů. Potvrzení této teze bude ovšem vyžadovat ověření dalším výzkumem.
Snížená hladina magnezia v moči po ileokolické resekci u pacientů s Crohnovou chorobou 
Úvod
Idiopatické střevní záněty (IBD – inflammatory bowel disease) představují skupinu chronických zánětlivých onemocnění gastrointestinálního traktu (GIT) neznámé etiologie, které se vyznačují střídáním období relapsů a remisí. Rozlišujeme dvě hlavní formy IBD, a to Crohnovu chorobu (CD – Crohn’s disease) a ulcerózní kolitidu (UC – ulcerative colitis), nověji se rozlišuje také neklasifikované IBD (IBD-U – IBD unclassified). CD je charakterizována transmurálním zánětem stěny GIT, který může postihnout kteroukoli jeho část od úst až po konečník, přičemž nejčastěji je postiženo terminální ileum a proximální část tlustého střeva [1].
Idiopatické střevní záněty bývají poměrně často komplikovány přítomností extraintestinálních projevů (EIM – extraintestinal mainfestations). IBD jsou imunitně podmíněná onemocnění, zánětlivým procesem mohou být ale postiženy i jiné orgány než jen trávicí trubice. Proto EIM sdílejí s IBD některé společné patofyziologické mechanizmy [2]. Často je nutná protizánětlivá terapie, někdy je vyžadováno i podávání biologické léčby – zastoupeny jsou tedy všechny základní skupiny léčiv [3,4]. Stavy, které vznikají jiným mechanizmem, se označují jako extraintestinální komplikace (EIC – extraintestinal complications). Ty vznikají v důsledku metabolických, anatomických nebo jiných změn v rámci IBD nebo jako nežádoucí účinek léčby IBD. Hranice mezi těmito pojmy je však často tenká a je obtížné ji jasně definovat.
Výskyt EIM a EIC se uvádí v poměrně širokém rozmezí, a to u 6–47 % všech pacientů s IBD. Přibližně čtvrtina z nich pak trpí více než jedním EIM, v některých případech až pěti. EIM se mohou projevit ještě před stanovením diagnózy IBD, což se týká 25,8 % pacientů. Riziko vzniku EIM zvyšuje perianální forma CD, postižení tlustého střeva a kouření cigaret [5,6].
Urolitiáza u Crohnovy choroby
Urolitiáza neboli tvorba močových kamenů je častým EIC u IBD, zejména u pacientů s CD. Tato komplikace je významná především pro svůj potenciál významné morbidity a zhoršení kvality života [7]. U pacientů s CD je riziko vzniku urolitiázy zvýšené v důsledku řady faktorů. Mezi ty nejvýznamnější patří dehydratace, malabsorpce, zvýšené vylučování oxalátů a změna pH moči [8]. Urolitiáza u pacientů s CD je mnohdy obtížně řešitelná a často recidivuje, což vyžaduje velký důraz nejen na diagnostiku a léčebné strategie této komplikace, ale zejména na její prevenci [9].
Epidemiologie
Urolitiáza postihuje přibližně jednoho z jedenácti lidí ve Spojených státech amerických [10]. Prevalence urolitiázy se zvyšuje, postižena je především populace v produktivním věku. Mezi rizikové faktory patří mužské pohlaví, muži jsou postiženi v 10,6 % oproti 7,1 % u žen. Dále jsou ve vyšším riziku osoby s nadváhou a obezitou, a to bez ohledu na pohlaví [11]. Ženy mají, pravděpodobně v důsledku častějšího výskytu infekcí močových cest, vyšší pravděpodobnost vzniku struvitových kamenů. Riziko recidivy je vysoké, do 5 let od první symptomatické epizody urolitiázy dosahuje až 50 % [12]. Část pacientů může v důsledku urolitiázy dospět až do terminálního selhání ledvin (ESRD – end-stage renal disease). U 3,2 % pacientů s nově diagnostikovaným ESRD je jako příčina stavu označena právě urolitiáza [13].
Urolitiáza, zejména nefrolitiáza, je nejčastější komplikací IBD v močovém systému. Riziko výskytu urolitiázy je u pacientů s IBD 2krát vyšší než u referenční populace [14]. Prevalence litiázy je vyšší u CD než u UC, u pacientů s IBD je 6–23 %, u pacientů s CD je 12–28 %. Riziko je vyšší zejména po rozsáhlejších střevních resekcích [15].
Patofyziologie
Vznik litiázy v močovém systému je možný za vhodných fyzikálních a chemických podmínek. Kromě zvýšené koncentrace litogenních látek je nutné nižší pH moči a další faktory, jako je přítomnost urátových krystalů jako krystalizačních jader. Velký význam má snížení účinnosti antilitogenních mechanizmů, jako je exkrece hořčíku nebo citrátů v moči [16].
Urolitiázu je možné dle umístění kamene rozdělit na nefrolitiázu (kámen v dutém systému ledvin, blíže pak kalikolitiáza a pyelolitiáza, popř. v parenchymu, nefrokalcinóza), ureterolitiázu (konkrement v močovodu), cystolitiázu (v močovém měchýři) a uretrolitiázu (v močové trubici) [17]. Další dělení je dle složení konkrementů. Přibližně 80 % kamenů je tvořeno oxaláty (šťavelany) nebo fosforečnanem vápenatým. Mezi další typy kamenů patří urátové kameny (kyselina močová) – asi 9 %, struvitové kameny (fosforečnan hořečnato-amonný) – 10 % a cystinové kameny – 1 % [18]. U pacientů s IBD je litiáza nejčastěji tvořena oxalátem vápenatým.
Významný vliv na riziko vzniku urolitiázy má provedení ileokolické (IC) resekce, která je častým chirurgickým zákrokem u pacientů s CD [9,19,20]. Ztráta absorpční plochy, zejména v ileu, vede k narušení normální absorpce živin a elektrolytů. To může vést k různým metabolickým změnám predisponujícím k tvorbě kamenů [21]. Po resekci ilea dochází ke zvýšenému vylučování oxalátu močí, což je způsobeno snížením jeho vazby na vápník ve střevě a následným zvýšením jeho absorpce ve střevě a vylučováním močí [22]. Tento jev, známý jako hyperoxalurie, je jedním z hlavních rizikových faktorů pro vznik oxalátových kamenů [9,23]. V kombinaci se ztrátami tekutin během průjmu a vyšší koncentrací moči je pak dosaženo vhodných podmínek pro vznik litiázy [7]. Oxalátová litáza je typická nejen pro pacienty s CD s IC resekcí, ale i pro osoby po jiných resekčních výkonech na GIT včetně bariatrických operací [24].
Tvorba litiázy vzniká v několika krocích. Vstupně je nutné přesycení (supersaturace) moči roztokem litogenních látek. Vysrážením roztoku (tzv. nukleace) vznikají krystaly, a to snadněji okolo krystalizačních jader, kterými mohou být např. urátové krystaly. Novotvořené krystaly se poté shlukují (agregace) a nadále rostou [10]. Hořčík (Mg – magnezium) má schopnost blokovat všechny výše uvedené kroky. Patří proto spolu s citráty, které mají podobný efekt, mezi nejdůležitější inhibitory litogeneze [25].
Pacienti s CD, zvláště po prodělaných resekčních výkonech, často trpí malabsorpcí. Jejím následkem je mimo jiné i snížené vstřebávání magnezia a citrátů, riziko tvory kamenů je tedy zvýšeno [23]. Není dosud přesvědčivě prokázáno, zda funkční vyřazení IC oblasti střevním zánětem má stejný efekt na riziko vzniku litiázy jako resekce téže oblasti. Z tohoto důvodu byla provedena studie zaměřená právě na problematiku magnesurie u pacientů s CD.
Metodika
Uspořádali jsme prospektivní observační studii, prováděnou na II. interní klinice gastroenterologie a geriatrie FN a LF UP Olomouc, tedy v terciárním gastroenterologickém centru se zaměřením na léčbu IBD. Zařazovány byly tři skupiny osob: skupina 1 – pacienti s CD s anamnézou provedené IC resekce, skupina 2 – pacienti s CD s IC postižením bez anamnézy střevní resekce a skupina 3 – zdravé kontroly, osoby bez známého zánětlivého střevního onemocnění.
Vyřazovací kritéria byla věk < 19 let, probíhající léčba citráty, selhání ledvin definované jako stupeň 4–5 dle klasifikace KDIGO čili glomerulární filtrace < 30 ml/ min/ 1,73 m2 [26], anamnéza tří a více střevních resekcí, anamnéza kolektomie, syndrom krátkého střeva, aktuálně probíhající infekce močového traktu a relaps CD definovaný jako nutnost systémové kortikoterapie, hospitalizace, nového nasazení či změny biologické terapie či jiné úpravy chronické léčby v posledních 2 měsících.
Studie byla schválena etickou komisí FN a LF UP Olomouc (9. 11. 2020, jednací číslo 170/ 20) a nábor pacientů byl realizován od 15. února 2021 do 3. září 2023. Všechny osoby byly zařazeny dobrovolně a po podepsání informovaného souhlasu.
Anamnestická data byla zjišťována pomocí dotazníku, byla odebrána základní antropometrická data, dále klinické charakteristiky související s výskytem litiázy v osobní či rodinné anamnéze, informace ohledně aktuálně užívané medikace a dotaz na kouření včetně semikvantitativního hodnocení. Pacientům bylo provedeno UZ vyšetření břicha se zaměřením na ledviny a žlučník k detekci event. litiázy, dále byly provedeny odběry krve k biochemickému vyšetření a vyšetření moči jak z jednorázového vzorku ke zhodnocení pH moči, tak i 24hodinový sběr ke stanovení hodnot odpadů oxalátu, citrátu, magnezia a kalcia za 24 hod. Před sběrem moči pacienti nedrželi žádnou speciální dietu a na týden vysadili preparáty magnezia a kalcia.
Tab. 1. Charakteristika souboru. 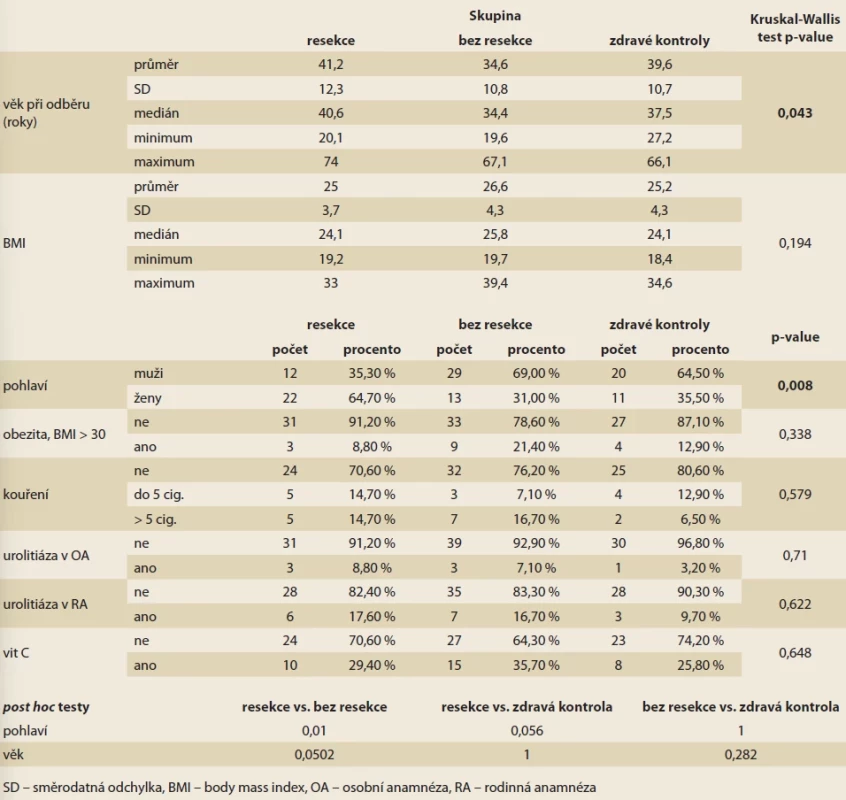
Tab. 1. Population characteristics. Statistická analýza
K analýze dat byl použit statistický software IBM SPSS Statistics verze 24 (Armonk, NY: IBM Corp.). K porovnání skupin v kvalitativních parametrech byl použit chí-kvadrát test, resp. Fisherův exaktní test. V kvantitativních parametrech byly skupiny porovnány Kruskal-Wallisovým testem. Jako post hoc test byl použit Mann-Whitney U test s Bonferroniho korekcí signifikance. Normalita dat byla testována pomocí Shapiro-Wilkova testu. Všechny testy byly prováděny na hladině významnosti 0,05. Statistickou analýzu studie provedl biomedicínský statistik.
Výsledky
Do studie bylo zařazeno celkem 107 pacientů, z toho 34 byli pacienti s CD po IC resekci (skupina 1), 42 pacienti s CD s IC postižením bez provedené resekce (skupina 2) a 31 jedinců bez prokázaného střevního zánětlivého onemocnění (skupina 3). Ve zkoumané populaci bylo 61 mužů (57 %) a 46 žen (43 %), průměrný věk byl 38 let (± 11,5), medián 37 let, s rozsahem od 20 do 74 let. Podrobnější charakteristiku souboru naleznete v tab. 1.
Ve skupině pacientů s resekcí ve srovnání se skupinou pacientů bez resekce bylo zjištěno signifikantně více mužů (64,7 vs. 31,0 %; p = 0,010), dle post hoc analýzy byl rozdíl v rozložení pohlaví významný mezi skupinou 1 a 2 (resekce a bez resekce), jinak byly základní charakteristiky srovnatelné.
Pacienti s CD byli léčeni širokou škálou medikace, nejčastější byla imunosupresiva, poté biologická terapie a poté topické kortikosteroidy, nebyly signifikantní rozdíly mezi skupinou s resekcí a bez resekce (tab. 2). V souboru bylo celkem 19 pacientů bez výše uvedené terapie (část z nich léčena aminosalicyláty), 8 pacientů na „kombo terapii“ biologikem a imunosupresivem, 7 s kombinací kortikoidu a imunosupresiva, 2 s biologikem a kortikoidem a konečně jeden pacient se všemi třemi skupinami léčiv.
Tab. 3 shrnuje výsledky biochemických vyšetření z krevních odběrů. Všechny 3 skupiny měly srovnatelné sérové hladiny vápníku, hořčíku a kyseliny močové. Signifikantní rozdíl mezi skupinami byl zaznamenán v hladinách urey, kreatininu a vitaminu D. Podrobná analýza ovšem prokázala signifikantní rozdíl ve všech 3 hodnotách pouze mezi skupinou s IC resekcí a zdravými kontrolami. Pro ureu byl medián 4,6 mmol/ l; resp. 5,4 mmol/ l (p = 0,036), pro kreatinin 77,5 µmol/ l; resp 83 µmol/ l (p = 0,025) a pro vitamin D 65,3 nmol/ l; resp. 71,8 nmol/ l (p = 0,017). Mezi skupinou s CD bez resekce a zdravými kontrolami byl tento trend zaznamenán u urey a vitaminu D, nicméně nedosáhl statistické významnosti. Skupiny s CD s resekcí a bez resekce se lišily nevýznamně.
Výsledky analýzy moči jsou zaznamenány v tab. 4. Vyšetření pH moči se významně neliší mezi všemi třemi skupinami. Je zaznamenán trend nižší močové exkrece vápníku ve skupině po IC resekci, nicméně rozdíl nedosahuje statistické významnosti. Rozdíly v močové exkreci hořčíku byly signifikantní. Podrobnější test prokázal signifikantní rozdíl mezi skupinou s resekcí a bez resekce (medián 2,28 vs. 3,97 mmol/ l; p = 0,047) a zejména mezi skupinou s resekcí a zdravými kontrolami (medián 2,28 vs. 4,31 mmol/ l; p = 0,0003). Skupina bez resekce proti zdravým kontrolám nedosáhla signifikantního rozdílu.
Tab. 2. Terapie u zařazených pacientů s CD. 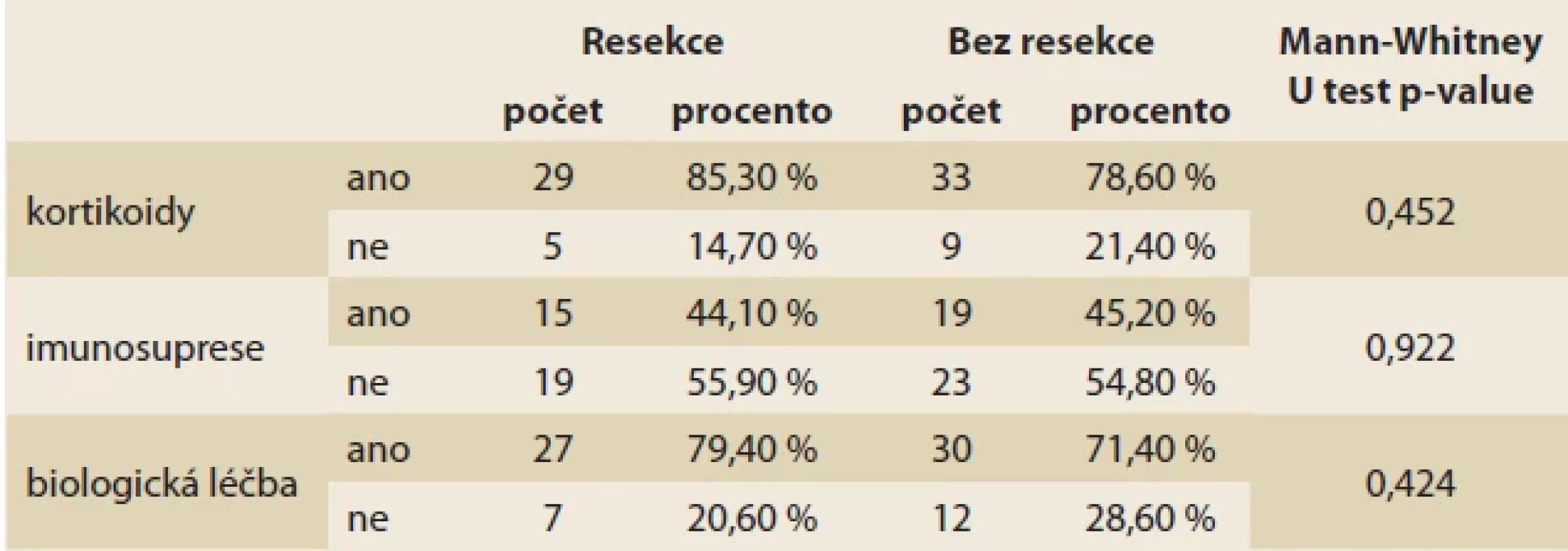
Tab. 2. Therapy of the included patients with CD. Tab. 3. Výsledky vyšetření krve. 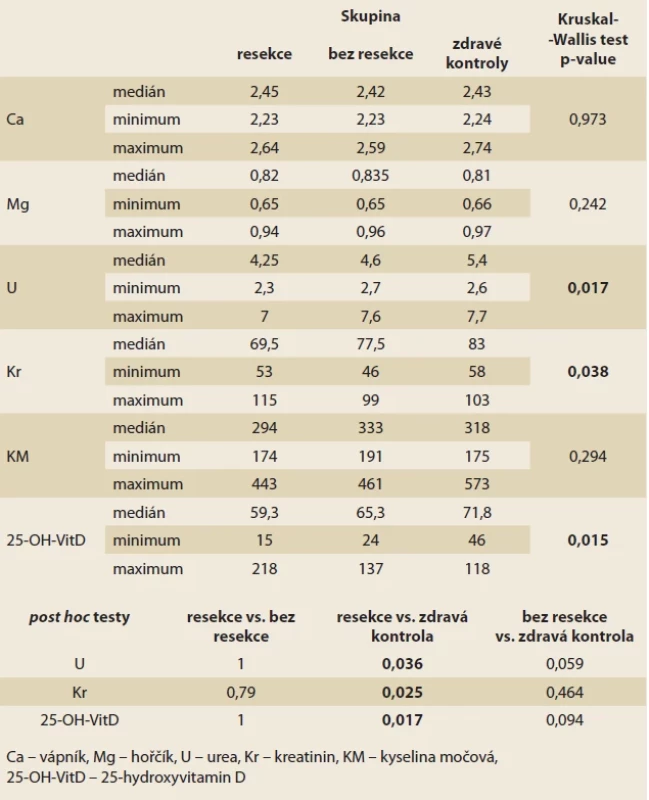
Tab. 3. Blood tests results. Tab. 4. Výsledky analýzy moči. 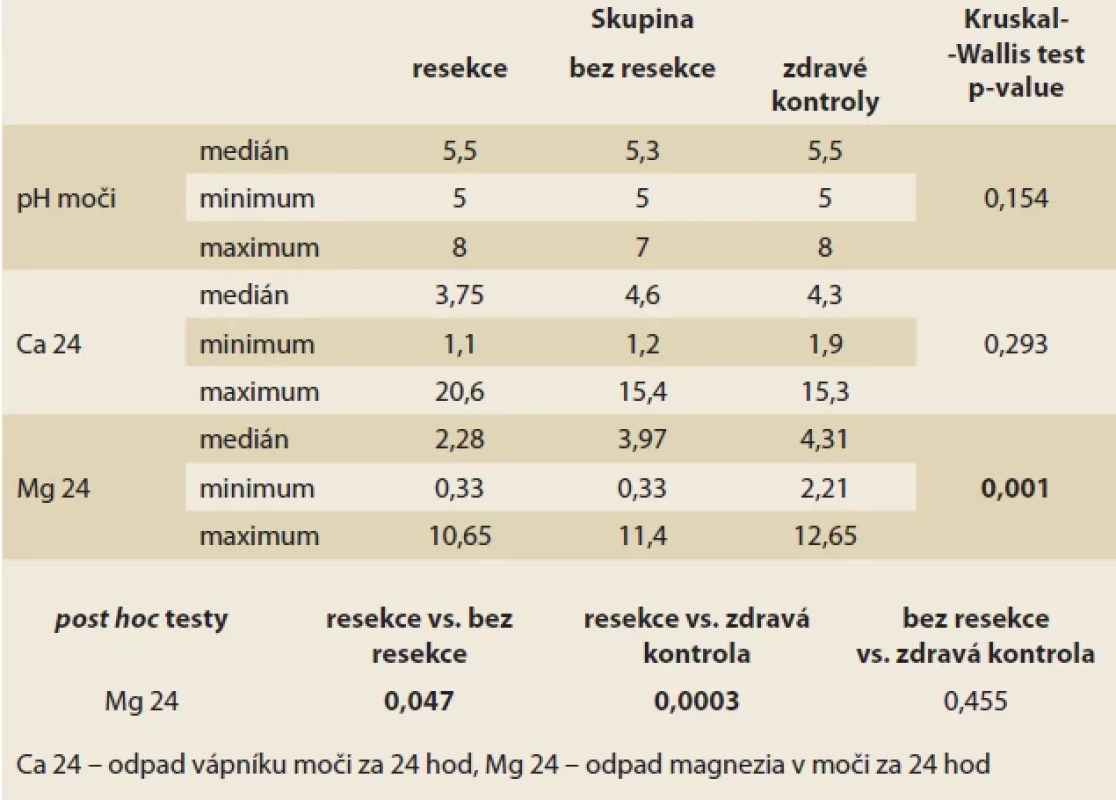
Tab. 4. Results of urine analysis. Diskuze
Tvorba urolitiázy je proces zahrnující několik kroků. Prvotní je vylučování litogenních substancí, jako je vápník a oxalát, do moči v takovém množství, které vede k dosažení bodu přesycení. Následuje nukleace krystalů, agregace a nakonec růst kamenů [10]. Mg může bránit litogenezi mnoha různými způsoby. Močový oxalát hořečnatý je 100krát rozpustnější než oxalát vápenatý, a proto jeho zvýšená koncentrace snižuje nasycení moči oxalátem vápenatým [27]. Hsu et al. prokázali za použití speciálního krystalizátoru, že Mg snižuje rychlost nukleace i růstu krystalů oxalátu vápenatého [28].
Novotvořené oxalátové krystaly dále rostou, Mg může zpomalit i tento proces. In vitro dokáže též bránit adhezi oxalátových krystalů na ledvinové buňky, které mohou sloužit jako krystalizační povrch, jak prokázali Lieske et al. [29]. Dále je Mg schopno vazby na oxalát ve střevě, čímž snižuje jeho vstřebávání, jak prokazují Jaeger et al. v roce 2004 [30], což je ale v rozporu s údaji z jiných zdrojů, např. s prací Allieho a Rodgerse z roku 2003 [31].
Mg se vstřebává převážně v terminálním ileu a v proximálním tračníku [32]. Resekce této oblasti nebo její postižení při CD zvyšují riziko urolitiázy mimo jiné právě proto, že může proces absorpce Mg komplikovat. Hladina Mg v séru může být v těchto případech snížená, ale i normální [33]. Není dosud zřejmé, zda funkční vyřazení IC oblasti střevním zánětem může vést ke stejnému efektu na riziko vzniku urolitiázy jako resekce téže oblasti. Postižení při CD je transmurální, často vede ke vzniku stenóz a je mnohdy spojeno s malabsorpcí. Z tohoto důvodu se dá očekávat, že dopad těchto změn na faktory vedoucí ke vzniku litiázy (např. absorpce Mg, Ca, žlučových kyselin a volných mastných kyselin, střevní mikrobiota a permeabilita pro oxalát) může být podobný jako efekt IC resekce.
V této práci předkládáme prospektivní monocentrickou observační studii hodnotící hodnotu močové exkrece Mg u pacientů s CD po IC resekci ve srovnání s pacienty s CD s IC postižením bez provedené resekce. Obě skupiny byly porovnány ještě s kontrolní skupinou osob bez známého střevního onemocnění. Nejnižších hodnot v našem souboru dosahovala resekovaná skupina, středních hodnot skupina s CD bez resekce a nejvyšších hodnot zdravé kontroly (2,86 ± 2,03 mmol/ 24 hod; resp. 3,90 ± 2,18 mmol/ 24 hod; resp. 5,13 ± 2,83 mmol/ 24 hod). Rozdíl mezi skupinou s resekcí a zdravými kontrolami (p = 0,0003), ale i skupinami s resekcí a bez resekce byl signifikantní (p = 0,047), skupina pacientů s CD bez resekce oproti zdravým kontrolám statisticky významného rozdílu nedosáhla (p = 0,455). Tento výsledek odpovídá vstupním očekáváním, neboť po resekcích je nejen ovlivněna absorpce Mg, ale může docházet i ke ztrátám Mg stolicí. Z výše uvedených dat lze usuzovat, že samotné postižení IC oblasti zánětlivým procesem při CD nemá tak významný dopad na magnesurii jako IC resekce.
Podobné výsledky byly zaznamenány i v jiných pracích. Parks et al. prokázali nižší míru magnesurie u pacientů s anamnézou resekce pro IBD (1,97 ± 0,25 mmol/ 24 hod) oproti zdravým kontrolám (4,15 ± 0,45 mmol/ l; p < 0,01) [34]. McConnell et al. popsali snížený poměr Mg/ kreatinin v moči u pacientů resekovaných pro CD v porovnání s kontrolní skupinou (0,17 vs. 0,32; p = 0,012) [35]. Na druhou stranu Kumar et al. ve své práci z roku 2004 popsali vyšší magnesurii u pacientů s CD v porovnání s kontrolní skupinou (5,0 vs. 2,49 mmol/ 24 hod; p < 0,001) [36]. V literatuře ale převažují práce s nižší močovou exkrecí Mg u pacientů po střevních resekcích či s IBD ve srovnání se zdravou populací [25,35,37].
Hodnoty kalciurie byly srovnatelné ve všech třech skupinách osob (p = 0,293). K podobným výsledkům došli i McConnell et al., v jejich práci byl medián poměru Ca/ kreatinin 0,33 pro pacienty s CD i pro zdravé kontroly [35]. Parks et al. popsali signifikantně nižší kalciurii u pacientů s resekcí tenkého střeva proti kontrolní populaci (4,82 ± 0,52 mmol/ 24 hod vs. 5,51 ± 0,05 mmol/ 24 hod; p < 0,001), výrazněji nižších hodnot pak dosahovali pacienti po operacích tračníku, zejm. po kolektomii [34].
Sérové hodnoty Mg byly v naší práci srovnatelné ve všech skupinách (p = 0,242) i přes rozdílné hodnoty magnesurie. Obdobně Geerling et al. neprokázali signifikantní rozdíl v sérovém Mg mezi pacienty s CD a kontrolami (0,79 ± 0,09 mmol/ l vs. 0,82 ± 0,06 mmol/ l) [38], nicméně v literatuře nacházíme častěji výsledky odlišné. Parks et al. popsali nižší hladiny Mg v séru u pacientů s IBD s tenkostřevní resekcí než u zdravých kontrol (0,79 ± 0,02 mmol/ l vs. 0,84 ± 0,00 mmol/ l; p < 0,05) [34]. McConnell naměřil u pacientů s CD signifikantně nižší hodnoty sérového Mg než u kontrolní skupiny (0,77 ± 0,05 mmol/ l vs. 0,83 ± 0,06 mmol/ l; p = 0,001) [35].
Ca v séru bylo v našem souboru bez významných rozdílů mezi sledovanými skupinami (p = 0,973). Literární reference poskytují podobné výsledky. Parks et al. popsali srovnatelné hladiny Ca v séru u pacientů s IBD s tenkostřevní resekcí, bez operace a u zdravých kontrol (2,38 ± 0,02 mmol/ l pro IBD pacienty s operací i bez ní vs. 2,39 ± 0,02 mmol/ l pro kontroly) [34].
Limitací naší práce je zejména její monocentrický design. Další limitací je celková velikost zkoumaného souboru. Pacienti před odběrem moči měli vysazenou suplementaci Mg a Ca, nedrželi ale žádnou speciální dietu. Vzhledem k tomu, že se jednalo o populaci stran urolitázy převážně asymptomatickou, nebyla do studie zahrnuta podrobnější analýza složení stravy z hlediska příjmu Mg a Ca u testovaných osob. Případné rozdíly ve složení stravy by pak částečně mohly vysvětlovat některé rozdíly našich výsledků oproti některým literárním datům. Na druhou stranu některé močové parametry jsou dietou ovlivněny jen minimálně (např. kalciurie), jak prokázali McIntosh a Seraglia [39].
Závěr
Naše práce se důkladně věnuje problematice urolitiázy u pacientů s CD a studuje močovou exkreci Mg a Ca jako důležitých faktorů v patogenezi jejího vzniku. U pacientů s CD se nejčastěji vyskytuje kalcium-oxalátová litiáza a dostatečná močová exkrece Mg je jedním z protektivních faktorů bránících jejímu vzniku. Z našich dat vyplývá, že hodnota magnesurie pacientů s CD po IC resekci je významně nižší proti skupině pacientů s CD s IC postižením bez provedené resekce i od zdravých kontrol. Skupina bez resekce nedosáhla statisticky významného rozdílu oproti kontrolám. Domněnka, že zánětlivé změny IC oblasti mohou mít obdobný efekt na magnesurii jako resekce téže oblasti, se tedy nepotvrdila. Dle dostupných literárních dat je riziko urolitiázy u IBD asi dvakrát vyšší než u běžné populace, toto riziko tedy bude patrně podmíněno mimo jiné právě i snížením močové exkrece Mg, zvláště u pacientů s IC resekcí. Dalším z faktorů litogeneze je kalciurie, která se ale v naší práci mezi skupinami významně nelišila.
Vzhledem k výsledkům práce předpokládáme, že pacienti s CD po IC resekci s vyšším rizikem vzniku urolitiázy by mohli profitovat ze suplementace Mg v rámci prevence tvorby konkrementů. Pro potvrzení tohoto předpokladu bude ovšem za potřebí dalšího výzkumu s větším množstvím zařazených pacientů.
Zdroje
1. Torres J, Mehandru S, Colombel JF et al. Crohn’s disease. Lancet 2017; 389(10080): 1741–1755. doi: 10.1016/ S0140-6736(16)31711-1.
2. Ferreira SD, Oliveira BB, Morsoletto AM et al. Extraintestinal manifestations of inflammatory bowel disease: Clinical aspects and pathogenesis. J Gastroenterol Dig Dis 2018; 3(1): 4–11.
3. Lukáš M. Možnosti medikamentózní léčby u Crohnovy nemoci a ulcerózní kolitidy. Med praxi 2011; 8(9): 360–363.
4. Bortlík M, Ďuricová D, Douda T et al. Doporučení pro po dávání biologické léčby pacientům s idiopatickými střevní mi záněty: čtvrté, aktualizované vydání. Gastroent Hepatol 2019; 73(1): 11–24.
5. Vavricka SR, Schoepfer A, Scharl M et al. Extraintestinal Manifestations of Inflammatory Bowel Disease. Inflamm Bowel Dis 2015; 21(8): 1982–1992. doi: 10.1097/ MIB.0000000 000000392.
6. Navrátil V, Cveková S, Slodička P et al. Extraintestinal complications of inflammatory bowel diseases. Mimostřevní komplikace idiopatických střevních zánětů. Vnitr Lek 2021; 67(2): 92–96.
7. Gaspar SR da S, Mendonça T, Oliveira P et al. Urolithiasis and crohn’s disease. Urol Ann 2016; 8(3): 297–304. doi: 10.4103/ 0974-7796.184879.
8. Miyajima S, Ishii T, Watanabe M et al. Risk factors for urolithiasis in patients with Crohn’s disease. Int J Urol 2021; 28(2): 220–224. doi: 10.1111/ iju.14442.
9. Teplan V, Netušil R, Lukáš M. Urolitiáza u pacientů s idiopatickými střevními záněty – možnosti prevence a metabolického ovlivnění. Gastroent Hepatol 2023; 77(5): 437–446. doi: 10.48095/ ccgh2023446.
10. Thakore P, Liang TH. Urolithiasis. In: StatPearls. Treasure Island (FL): StatPearls Publishing 2023. Dostupné z: https:/ / www.ncbi.nlm.nih.gov/ books/ NBK559101/ .
11. Scales CD Jr, Smith AC, Hanley JM et al. Urologic Diseases in America Project. Prevalence of kidney stones in the United States. Eur Urol 2012; 62(1): 160–165. doi:10.1016/ j.eururo. 2012.03.052.
12. Khan SR, Pearle MS, Robertson WG et al. Kidney stones. Nat Rev Dis Primers 2016; 2 : 16008. doi: 10.1038/ nrdp.2016.8.
13. Sobotka R, Hanuš T. Příčiny a rizikové faktory vzniku urolitiázy. Urol praxi 2012; 13(1): 11–15.
14. Dimke H, Winther-Jensen M, Allin KH et al. Risk of Urolithiasis in Patients With Inflammatory Bowel Disease: A Nationwide Danish Cohort Study 1977–2018. Clin Gastroenterol Hepatol 2021; 19(12): 2532–2540. doi: 10.1016/ j.cgh.2020.09.049.
15. Corica D, Romano C. Renal Involvement in Inflammatory Bowel Diseases. J Crohns Colitis 2016; 10(2): 226–235. doi: 10.1093/ ecco-jcc/ jjv138.
16. Katsanos K, Tsianos EV. The kidneys in inflammatory bowel disease. Ann Gastroenterol 2002; 15(1): 41–52.
17. Rokyta R et al. Fyziologie a Patologická Fyziologie: Pro Klinickou Praxi. Praha: Grada Publishing 2015.
18. Chung MJ. Urolithiasis and nephrolithiasis. JAAPA 2017; 30(9): 49–50. doi: 10.1097/ 01.JAA.0000522145.52305.aa.
19. Gajendran M, Loganathan P, Catinella AP et al. A comprehensive review and update on Crohn’s disease. Dis Mon 2018; 64(2): 20–57. doi: 10.1016/ j.disamonth.2017.07.001.
20. Šerclová Z, Ryska O, Bortlík M et al. Doporučené postupy chirurgické léčby pacientů s nespecifickými střevními záněty – 2. část: Crohnova nemoc. Gastroent Hepatol 2015; 69(3): 223–238. doi: 10.14735/ amgh2015223.
21. Nazzal L, Puri S, Goldfarb DS. Enteric hyperoxaluria: an important cause of end-stage kidney disease. Nephrol Dial Transplant 2016; 31(3): 375–382. doi: 10.1093/ ndt/ gfv005.
22. Bianchi L, Gaiani F, Bizzarri B et al. Renal lithiasis and inflammatory bowel diseases, an update on pediatric population. Acta Biomed 2018; 89(9-S): 76–80. doi: 10.23750/ abm.v89i9-S.7908.
23. Worcester EM. Stones from bowel disease. Endocrinol Metab Clin North Am 2002; 31(4): 979–999. doi: 10.1016/ s0889-8529(02)000 35-x.
24. Teplan V, Lukáš M. Urolithiasis in patients with inflammatory bowel diseases. Gastroent Hepatol 2015; 69(6): 561–569. doi: 10.14735/ amgh2015561.
25. Shringi S, Raker CA, Tang J. Dietary Magnesium Intake and Kidney Stone: The National Health and Nutrition Examination Survey 2011–2018. R I Med J (2013) 2023; 106(11): 20–25.
26. Levey AS, Eckardt KU, Tsukamoto Y et al. Definition and classification of chronic kidney disease: a position statement from Kidney Disease: Improving Global Outcomes (KDIGO). Kidney Int 2005; 67(6): 2089–2100. doi: 10.1111/ j.1523-1755.2005.00365.x.
27. Israr B, Frazier RA, Gordon MH. Effects of phytate and minerals on the bioavailability of oxalate from food. Food Chem 2013; 141(3): 1690–1693. doi: 10.1016/ j.foodchem.2013.04. 130.
28. Hsu YC, Lin YH, Shiau LD. Effects of Various Inhibitors on the Nucleation of Calcium Oxalate in Synthetic Urine. Crystals 2020; 10(4): 333. doi: 10.3390/ cryst10040333.
29. Lieske JC, Farell G, Deganello S. The effect of ions at the surface of calcium oxalate monohydrate crystals on cell-crystal interactions. Urol Res 2004; 32(2): 117–123. doi: 10.1007/ s00240-003-0391-5.
30. Jaeger P, Robertson WG. Role of dietary intake and intestinal absorption of oxalate in calcium stone formation. Nephron Physiol 2004; 98(2): 64–71. doi: 10.1159/ 000080266.
31. Allie S, Rodgers A. Effects of calcium carbonate, magnesium oxide and sodium citrate bicarbonate health supplements on the urinary risk factors for kidney stone formation. Clin Chem Lab Med 2003; 41(1): 39–45. doi: 10.1515/ CCLM.2003.008.
32. Guillen B, Atherton NS. Short Bowel Syndrome. In: StatPearls. Treasure Island (FL): StatPearls Publishing 2023.
33. Jabłońska B, Mrowiec S. Nutritional Status and Its Detection in Patients with Inflammatory Bowel Diseases. Nutrients 2023; 15(8): 1991. doi: 10.3390/ nu15081991.
34. Parks JH, Worcester EM, O’Connor RC et al. Urine stone risk factors in nephrolithiasis patients with and without bowel disease. Kidney Int 2003; 63(1): 255–265. doi: 10.1046/ j.15 23-1755.2003.00725.x.
35. McConnell N, Campbell S, Gillanders I et al. Risk factors for developing renal stones in inflammatory bowel disease. BJU Int 2002; 89(9): 835–841. doi: 10.1046/ j.1464-410x.2002.02739.x.
36. Kumar R, Ghoshal UC, Singh G et al. Infrequency of colonization with Oxalobacter formigenes in inflammatory bowel disease: possible role in renal stone formation. J Gastroenterol Hepatol 2004; 19(12): 1403–1409. doi:10.1111/ j.1440-1746.2004.03510.x.
37. Caudarella R, Rizzoli E, Pironi L et al. Renal stone formation in patients with inflammatory bowel disease. Scanning Microsc 1993; 7(1): 371–380.
38. Geerling BJ, Badart-Smook A, Stockbrügger RW et al. Comprehensive nutritional status in recently diagnosed patients with inflammatory bowel disease compared with population controls. Eur J Clin Nutr 2000; 54(6): 514–521. doi: 10.1038/ sj.ejcn.1601049.
39. McIntosh HW, Seraglia M. Urinary Excretion of Calcium and Citrate in Normal Individuals and Stone Formers with Variation in Calcium Intake. Can Med Assoc J 1963; 89(24): 1242–1243.
ORCID autorů
V. Navrátil 0000-0002-9323-1996,
L. Kunovský 0000-0003-2985-8759,
B. Pipek 0000-0002-0315-8845,
J. Křivinka 0009-0008-2705-1357,
P. Falt 0000-0001-8843-4716.
Doručeno/ Submitted: 21. 12. 2023
Přijato/ Accepted: 15. 1. 2024MU Dr. Vít Navrátil
II. interní klinika – gastroenterologická a geriatrická
LF UP a FN Olomouc
Zdravotníku 248/ 7
779 00 Olomouc
vit.navratil@fnol.czŠtítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2024 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
-
Všetky články tohto čísla
- Editorial
- Heuréka!
- Jaké bude vaše doporučení pro terapii těžké ulcerózní kolitidy?
- Doporučení Pracovní skupiny pro idiopatické střevní záněty pro diagnostiku Crohnovy choroby
- Snížená hladina magnezia v moči po ileokolické resekci u pacientů s Crohnovou chorobou
- Mirikizumab – první protilátka anti-IL12 p19 v terapii ulcerózní kolitidy
- Efficacy and safety of switching from intravenous to subcutaneous CTP-13 treatment in IBD patients – a one-year retrospective study from large Slovak IBD centre
- Metotrexát – znovuobjevený lék u Crohnovy nemoci
- Hidradenitis suppurativa, intestinal microbiome and SIBO – a comprehensive overview of the issue
- Idiopatický hypereozinofilní syndrom s postižením zažívacího traktu
- Simultánní robotická resekce kolorektálního karcinomu a jaterní metastázy – naše první zkušenosti
- Výběry z mezinárodních časopisů
- Hoffmanová I. Abdominální sonografie žlučníku a žlučových cest
- Kreditovaný autodidaktický test: IBD
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Metotrexát – znovuobjevený lék u Crohnovy nemoci
- Idiopatický hypereozinofilní syndrom s postižením zažívacího traktu
- Mirikizumab – první protilátka anti-IL12 p19 v terapii ulcerózní kolitidy
- Doporučení Pracovní skupiny pro idiopatické střevní záněty pro diagnostiku Crohnovy choroby
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



