-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Význam stanovení S100B proteinu u pacientů s izolovaným poraněním hlavy
Importance of the S100B protein Assessment in Patients with Isolated Brain Injury
Objective:
The objective of the study was to assess the importance of S100B protein in patients with CNS injury for clinical practice.The method:
The study included 98 patients who were admitted to the Teaching Hospital of Pilsen from January 2004 to June 2006 due to isolated head injury. Generally used scoring protocols were used to evaluate the clinical status of the patients upon admittance and release, i.e. the Glasgow Coma Scale (CGS), APACHE II, Injury Severity Score (ISS) and Trauma Revised Injury Severity Score (TRISS) upon admittance, and the Glasgow Outcome Scale (GOS) upon release. The values of S100B protein were measured upon admittance and after 6, 12, 24 and 72 hours. The level of S100B protein was measured with the use of the Liaison immunoanalyser, DiaSorin, Italy.Results:
We proved the relation between the absolute values of the S100B protein levels at all the times observed and the resulting clinical status for the patient sample we monitored. Best related to the resulting clinical status is the S100B protein value 24 hours after admittance (r = –0,540, p<0.0001). The value of 100B protein after at 24 hours over 1.17 μg/l means 12.8 times higher risk of negative resulting clinical status (p<0.0001) A drop in the level below 0.2 μg/l within 72 hours post-admittance is, on the contrary, associated with a 92% probability of a satisfactory clinical status.Conclusion:
In practice, dynamic monitoring of S100B values of protein can be recommended, the most significant being the level 24 hours post-admittance, while the values below 0.2 μg/l predict a good resulting clinical status of the patient. With values over 0.2 μg/l, it is necessary to follow the level at 72 hours.Key words:
S100B protein – isolated head injury – CT finding – Glasgow Coma Scale – ISS – TRISS – Glasgow Outcome Scale – resulting clinical status
Autori: P. Lavička 1; R. Pikner 2; S. Kormunda 3; O. Topolčan 2; R. Bosman 4; I. Chytra 4; L. Holubec 2; M. Choc 1
Pôsobisko autorov: Neurochirurgické oddělení LF UK a FN, Plzeň 1; Oddělení nukleární medicíny, úsek imunodiagnostiky, LF UK a FN, Plzeň 2; Ústav sociálního lékařství LF UK a FN, Plzeň 3; Anesteziologicko-resuscitační klinika LF UK a FN, Plzeň 4
Vyšlo v časopise: Cesk Slov Neurol N 2007; 70/103(5): 521-526
Kategória: Původní práce
Tato práce byla podpořena grantem IGA MZ NR 7874-3/2004
Súhrn
Cíl:
Cílem naší práce bylo posoudit význam stanovení S100B proteinu u nemocných s poraněním CNS pro klinickou praxi.Metodika:
Do studie bylo zařazeno 98 pacientů, kteří byli přijati do FN Plzeň v období od ledna 2004 do června 2006 s izolovaným poraněním hlavy. Při přijetí i propuštění byly ke zhodnocení klinického stavu použity obecně užívané skórovací protokoly, při přijetí Glasgow Coma Scale (GCS), APACHE II, Injury Severity Score (ISS) a Trauma Revised Injury Severity Score (TRISS), při propuštění pak Glasgow Outcome Scale (GOS). Hodnoty S100B proteinu byly stanoveny při přijetí, po 6, 12, 24 a 72 hodinách. Hladina S100B proteinu byla stanovována na imunoanalyzátoru Liaison, DiaSorin, Itálie.Výsledky:
V námi monitorovaném souboru pacientů jsme prokázali souvislost mezi absolutními hodnotami hladin S100B proteinu ve všech sledovaných časech a výsledným klinickým stavem. Nejlepší vztah k výslednému klinickému stavu vykazuje hodnota S100B proteinu ve 24 hodině od přijetí (r = –0,540; p<0,0001). Hodnota 100B proteinu ve 24. hodině nad 1,17 μg/l znamená 12,8× vyšší riziko špatného výsledného klinického stavu (p < 0,0001). Pokles hladiny pod 0,2 μg/l do 72 hodin od přijetí je naopak spojen s 92% pravděpodobností uspokojivého klinického stavu.Závěr:
V praxi lze doporučit dynamické sledování hodnot S100B proteinu, klinicky největší význam má hladina 24 hodin od přijetí, hodnoty pod 0,2 μg/l předvídají dobrý výsledný klinický stav pacienta. Při hodnotách nad 0,2 μg/l je nutné se orientovat dle hladiny v čase 72 hodin.Klíčová slova:
S100B protein – izolované poranění hlavy – CT nález – Glasgow Coma Scale – ISS – TRISS – Glasgow Outcome Scale – výsledný klinický stavÚvod
Dopravní nehody jsou v současné době nejčastější příčinou smrti zejména u mladé populace. Jejich zvýšený počet a zlepšení úrovně přednemocniční péče vede k trvale se zvyšujícímu počtu nemocných s těžkými poraněními CNS přijímaných k hospitalizaci. Neurologický nález těchto pacientů je často výrazně modifikován intubací, farmakologickou sedací, svalovou relaxací a řízenou ventilací, a to jak v přednemocniční fázi, tak i v průběhu hospitalizace. To vše zastírá klinický obraz hodnocení stavu CNS. Proto je trvalý zájem hledat nové metody sledování pacientů. Jako slibný marker pro hodnocení rozsahu poškození CNS i odhad průběhu onemocnění a výsledného klinického stavu se jeví S100B protein, který patří do skupiny Ca vážících proteinů [1] a jehož hladina signifikantně stoupá při poškození CNS [2,3,4,5,6]. U savců je hlavní podjednotkou v gliálních buňkách centrálního a periferního nervového systému, chondrocytech, melanocytech a adipocytech, dále je exprimován i v subpopulacích neuronů a buňkách neuroendokrinního systému [1,7,8,9].
Cílem naší práce bylo posoudit význam stanovení hladin S100B proteinu v séru v prvních 72 hodinách hospitalizace u pacientů přijímaných pro izolované poranění CNS ve vztahu k výslednému klinickému stavu nemocných.
Metodika
Do studie bylo zařazeno 98 pacientů, 18 žen a 80 mužů, s izolovaným poraněním hlavy, kteří byli přijati do FN Plzeň v období od ledna 2004 do června 2006. Průměrný věk pacientů byl 48,8 let, rozmezí 18-90 let.
Pacienti byli přijati na oddělení neodkladných příjmů FN Plzeň a u všech bylo provedeno akutní CT vyšetření hlavy. Doba od úrazového děje do přijetí ve FN Plzeň byla kratší než 6 hodin. Za izolované poranění hlavy bylo považováno poranění CNS spojené s pozitivním nálezem na vstupním CT vyšetření hlavy ve smyslu nitrolebečního krvácení (subdurální hematom, epidurální hematom, traumatické subarachnoidální krvácení), kontuze mozku, pneumocefalu, difuzního axonálního traumatu, průkazu zlomeniny baze lebeční či kalvy. V případě negativního nálezu na CT vyšetření hlavy museli pacienti splňovat pozitivní anamnézu mozkové komoce (amnezie, anamnéza ztráty vědomí, bolestí hlavy, nauzea, zvracení, závratě).
Hodnoty S100B proteinu jsme stanovovali z periferní krve v následujících intervalech: při přijetí (0 hod.), po 6, 12, 24 a 72 hodinách od přijetí. Vzhledem k výrazné variabilitě hladin S100B v prvních 12 hodinách nejspíše vlivem zahájené léčby byly pro statistické zhodnocení výsledného klinického stavu použity pouze vstupní hodnoty (0 hodin) a hodnoty S100B proteinu po 24 a 72 hodinách.
Při přijetí i propuštění byly ke zhodnocení klinického stavu použity obecně využívané skórovací protokoly, při přijetí Glasgow Coma Score (GCS), APACHE II, Injury Severity Score (ISS) a Trauma Revised Injury Severity Score (TRISS), při propuštění a za 6 měsíců od propuštění pak Glasgow Outcome Score (GOS).
Pacienti byli rozděleni do 2 skupin podle výsledného klinického stavu na pacienty s uspokojivým a neuspokojivým výsledným klinickým stavem. Jako uspokojivý jsme hodnotili takový klinický stav pacienta, který mu umožňoval plné zapojení do života, tzn. soběstačnost minimálně v běžném životě bez závislosti na svém okolí s žádným nebo lehkým neurologickým deficitem. Této definici odpovídá hodnota GOS 4-5. Jako neuspokojivý jsme považovali takový klinický stav pacienta, který ho natolik omezoval v běžném životě, že se nedokázal obejít bez pomoci cizí osoby. Jako neuspokojivý klinický stav jsme hodnotili i smrt jedince. V souladu s definicí se jedná o pacienty s GOS 1-3.
Analýza výsledného klinického stavu pacientů a vztahu S100B byla provedena 2 způsoby:
- zhodnocení absolutních hodnot v čase 0, 24 a 72 hodin vůči GOS při propuštění a GOS 6 měsíců od propuštění
- zhodnocení výsledného klinického stavu pacientů dle nalezených mezních hodnot
Stanovení referenční hladiny
Stanovení referenční hladiny („normální hladiny“) jsme provedli na základě vyšetření 50 zdravých dobrovolníků, u 10 dobrovolníků jsme provedli hodnocení v intervalech 0, 12 a 24 hodin. Jako referenční mez byla zvolena hodnota 95 percentilu, tj. hodnota 0,2 μg/l, bez ohledu na pohlaví a věk.
Hladina S100B proteinu byla stanovována pomocí komerčně dodávané luminiscenční nekompetitivní imunonanalýzy na plně automatizovaném imunoanalyzátoru Liaison, DiaSorin, Itálie.
Statistické zhodnocení bylo provedeno pomocí SW CRAN. Pro dané skupiny a podskupiny byla počítána základní deskriptivní statistika a zkoumány frekvence. Pro porovnání vztahů mezi proměnnými byly užity tyto statistické testy: Spearmanův korelační koeficient, χ2-test dobré shody s výpočtem odds ratio, logistická multivariační regrese (stepwise metoda).
Výsledky
Rozdělení do skupin na lehké, středně těžké a těžké poranění hlavy bylo provedeno na základě hodnocení vstupního GCS. Dle v literatuře obecně používaného dělení jsou jako lehké poranění hlavy označováni pacienti s příjmovou hodnotou GCS 13-15, jako středně těžká poranění pacienti s hodnotou GCS 9-12 a jako těžká poranění pacienti s hodnotou GCS 8 a méně (tab. 1).
Tab. 1. Rozdělení pacientů s izolovaným poraněním hlavy dle tíže poškození CNS. 
Rozdělení pacientů dle diagnóz sledovaného souboru jsme provedli na základě hodnocení vstupních nálezů na CT vyšetření mozku. Pozitivní nález na CT vyšetření hlavy mělo 86 pacientů (88 %). Negativní nález na iniciálním CT mozku mělo 12 pacientů (12 %).
Z celkového počtu 98 pacientů byl u 48 pacientů (49 %) proveden neurochirurgický zákrok spojený s odstraněním nitrolebeční expanze. U 3 pacientů s nálezem vícečetných kontuzí a otoku mozku bylo zavedeno nitrolební čidlo k monitoraci nitrolebního tlaku bez dalšího operačního zákroku. Základní statistické charakteristiky vývoje S100B proteinu ve skupině s uspokojivým a neuspokojivým výsledným klinickým stavem jsou zobrazeny v tab. 2 a 3. Hodnoty S100B proteinu pacientů v obou sledovaných skupin v prvních 24 hodinách většinou klesají, což je dáno zahájením léčby (evakuace expanze, antiedémová léčba, sedace apod). Pokud nedošlo k poklesu hladin v čase 6 a 12 hodin, pak se jednalo o dekompenzaci poškození mozku a neschopnost reagovat na léčbu a tito pacienti měli 100% úmrtnost. Ve skupině s příznivým výsledným klinickým stavem je jasná tendence k normalizaci hodnot, naopak u pacientů s nepříznivým výsledným klinickým stavem přetrvávají hodnoty S100B proteinu dlouhodobě nad normou (graf 1). Nárůst původně negativních hodnot S100B proteinu v prvních 24 hodinách svědčí pro rozvoj sekundární nitrolební komplikace (krvácení, ischemie, otok mozku).
Graf 1. Hladiny S100B proteinu v časech odběrů ve skupině s uspokojivým a neuspokojivým výsledným klinickým stavem. 
Tab. 2. Hodnoty S100B proteinu ve sledovaných časech – uspokojivý výsledný klinický stav. 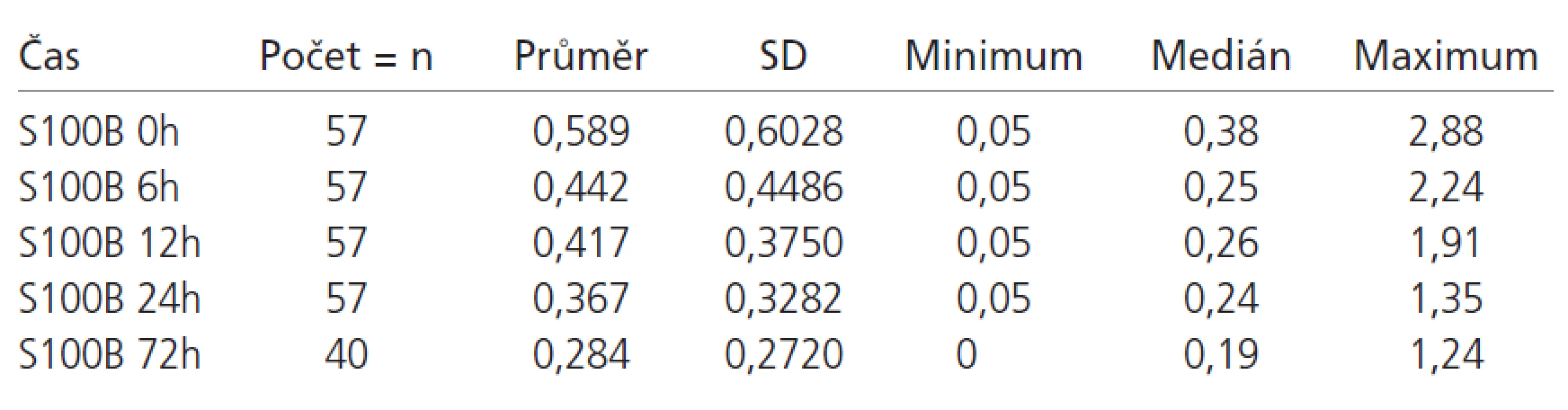
Tab. 3. Hodnoty S100B proteinu ve sledovaných časech – neuspokojivý výsledný klinický stav. 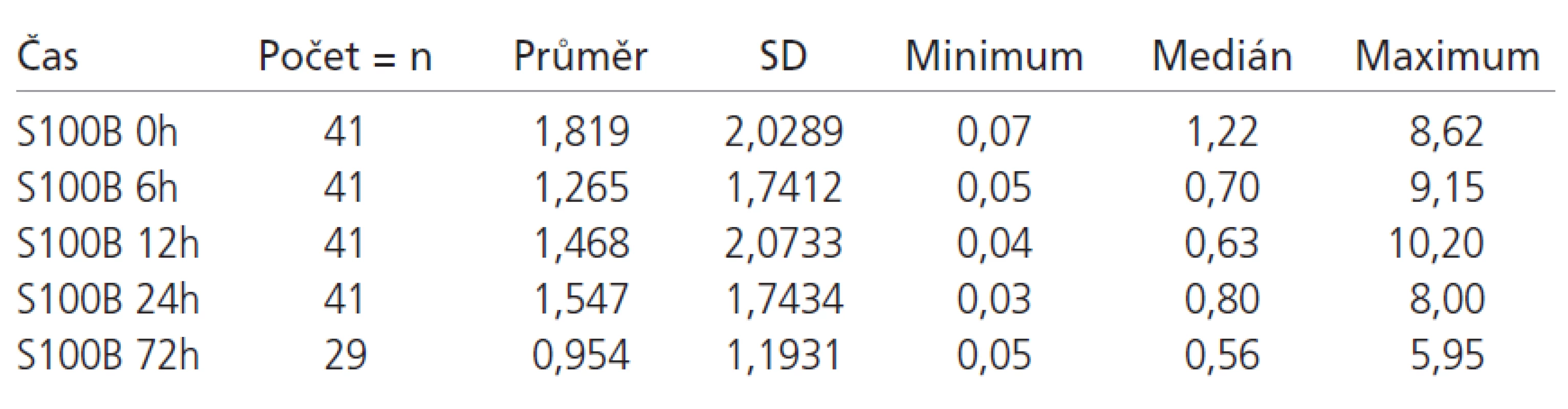
Při porovnání vztahu hladin S100B proteinu a skórovacích protokolů (GCS, APACHE II, ISS a TRISS) vůči výslednému klinickému stavu pacientů při propuštění a po 6 měsících jsme zjistili, že nejtěsněji korelují vůči výslednému klinickému stavu při propuštění a vůči klinickému stavu po 6 měsících hodnoty TRISS, APACHE II a ISS, následované hladinami S100B proteinu v čase 24, 0 a 72 hodin (tab. 4).
Tab. 4. Korelace jednotlivých skórovacích systémů a hodnot S100B proteinu s GOS. 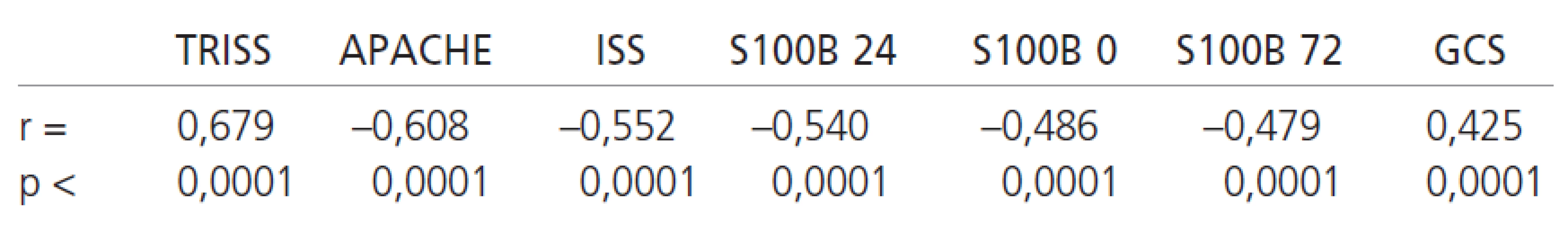
Na základě analýzy absolutních hodnot S100B proteinu a jejich vývoje v čase vůči klinickému stavu při propuštění a klinickému stavu po 6 měsících od propuštění jsme zjistili, že největší výpovědní hodnotu pro uspokojivý klinický stav má v našem souboru rychlost poklesu hladiny S100B proteinu pod referenční hodnotu (graf 2). Z grafu je patrné, že hladiny S100B proteinu se v obou skupinách pacientů významně lišily ve všech sledovaných časech.
Graf 2. Průběh hladin S100B proteinu v čase u skupiny pacientů s uspokojivým a neuspokojivým výsledným klinickým stavem – vztah ke stavu za 6 měsíců od propuštění. 
Pacienti s hodnotami hladiny S100B proteinu v čase 24 hodin nižšími než 0,2 µg/l měli 87,5% pravděpodobnost uspokojivého klinického stavu při propuštění (n=25) a 80% pravděpodobnost uspokojivého klinického stavu po 6 měsících (n=21).
Hodnota hladiny S100B proteinu v čase 24 hodin vyšší než 1,17 µg/l znamenala 12,8x vyšší riziko neuspokojivého klinického stavu (p<0,0001), což představuje 95% pravděpodobnost neuspokojivého klinického stavu při propuštění v tomto sledovaném souboru (n = 19) a 84% pravděpodobnost neuspokojivého klinického stavu po 6 měsících od propuštění (n = 19).
Jelikož hodnoty S100B proteinu ve 24. hodině umožňují selekci pacientů s nízkým a vysokým rizikem pro dobrý a špatný výsledný klinický stav, navrhli jsme schéma hodnocení S100B proteinu v čase 24 hod, jako dolní mez (hodnotu pro dobrý klinický stav) jsme použili referenční hodnotu S100B proteinu tzn. 0,20 µg/l. Jako horní mez (hodnotu pro špatný klinický stav) v čase 24 hodin jsme použili hodnotu 1,17 µg/l. Takto můžeme již za 24 hodin po přijetí pacienta odhadnout pravděpodobnost uspokojivého a neuspokojivého klinického stavu.
Podle výše hladiny S100B proteinu v čase 24 hod. od přijetí jsme tedy rozdělili pacienty do 3 skupin. Rozdělení do skupin a vztah hladin S100B proteinu k výslednému klinickému stavu při propuštění a za 6 měsíců od propuštění zachycuje tab. 5.
Tab. 5. Rozdělení pacientů dle hodnoty S100B proteinu v čase 24 hod.od přijetí a výsledný klinický stav při propuštění a za 6 měsíců od propuštění. 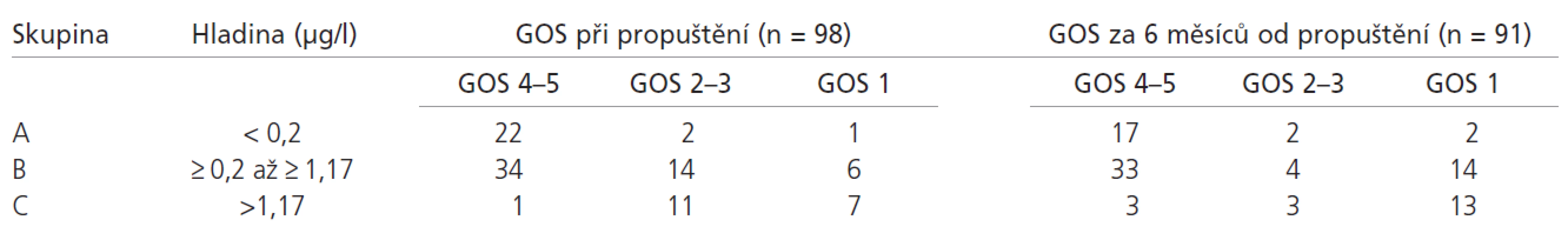
V hodnocení pacientů po 6 měsících od propuštění je počet probandů snížen o 7 pacientů, kteří se nedostavili ke kontrole ani po opakovaném vyzvání. Rozbor příčin úmrtí je nad rámec tohoto článku. Celková úmrtnost v celém souboru pacientů za 6 měsíců od propuštění byla 29 pacientů (30 %).
U skupiny pacientů s hodnotami S100B proteinu mezi 0,2 – 1,17 µg/l (skupina B) nás zajímalo, zda další pokles hladiny v čase 72 hodin ovlivní výsledný klinický stav, protože v pásmu neuspokojivého klinického stavu přežilo 14 pacientů (26 %). Z 54 pacientů zařazených do skupiny B byla hladina S100B proteinu 72 hod od přijetí stanovena u 45 pacientů. Jelikož S100B protein má vysokou negativní predikční hodnotu a naším cílem bylo najít skupinu pacientů s uspokojivým výsledným klinickým stavem, zvolili jsme jako dělící hladinu opět referenční hodnotu, tzn. 0,20 µg/l. Pacienti byli rozděleni do skupiny s hladinou pod a nad touto referenční hodnotou. U pacientů ze skupiny s hodnotou S100B proteinu v čase 72 hodin pod 0,2 µg/l byli 4 pacienti (8 %) při propuštění ve stavu neuspokojivého klinického stavu, žádný z nich nezemřel, do 6 měsíců zemřeli v této skupině 3 pacienti, žádný v přímé příčinné souvislosti s poraněním CNS (vysoký věk, komorbidity, alkoholizmus). Ve skupině pacientů s hodnotami S100B v čase 72 hod nad 0,2 µg/l došlo v jednom případě ke zlepšení pacienta na uspokojivý klinický stav, ale 10 ze 14 pacientů (71 %) s neuspokojivým klinickým stavem při propuštění zemřelo do 6 měsíců (tab. 6).
Tab. 6. Rozdělení pacientů dle hladiny S100B 72 hodin a výsledný klinický stav při propuštění a za 6 měsíců od propuštění. 
Diskuse
Role S100B proteinu v centrálním nervovém systému resp. v buňkách nervového systému není dosud zcela jistá. Celá skupina S100 proteinů se podílí na regulaci celé řady intracelulárních procesů [1,7]. Některé práce z poslední doby dokonce soudí, že S100B protein v nervové buňce může mít roli v reparativních procesech v CNS [10]. Z nejnovějších poznatků vyplývá, že v nanomolárních koncentracích má pozitivní vliv na růst a přežívání neuronů, v makromolárních koncentracích naopak vyvolává uvolnění prozánětlivých cytokinů a indukuje apoptózu [11].
Využití S100B proteinu jako markeru rozsahu poškození CNS traumatem a jeho schopnost predikce výsledného klinického stavu vychází z předpokladu uvolnění tohoto markeru z poškozené nervové tkáně. Řada autorů považuje S100B protein za jednoznačně velmi přínosný marker v hodnocení pacientů s poraněním CNS, je přitom zdůrazňována jeho negativně predikční hodnota a zároveň velmi dobrá korelace s výsledným klinickým stavem pacientů a kvalitou života po traumatu CNS [4,5,12,13]. Němečtí autoři využívají monitorace S100B proteinu jako predikčního markeru akutního zhoršení klinického stavu u pacientů, kde je omezeno hodnocení klinického stavu např. vlivem tlumících látek [14]. Při hodnocení iniciální hladiny je nutno počítat i s přirozenou eliminací S100B proteinu [15].
Je samozřejmé, že tento marker nemůže nahradit klinické sledování a komplexní monitoraci pacienta, zdá se však, že může být velmi prospěšný právě ve stavech, kdy je klinický obraz nehodnotitelný vlivem jiných okolností, než je poškození CNS, a zároveň je i dobrým markerem umožňujícím odhad výsledku naší léčby.
Při hodnocení výsledného klinického stavu ve srovnání hodnoty S100B proteinu vůči skórovacím systémům (TRISS, ISS, APACHE, GCS) mají tyto skórovací systémy lepší korelaci s výsledným klinickým stavem, kromě GCS. U GCS to lze vysvětlit relativně jednoduchým zhodnocením stavu CNS, tedy stejného cílového orgánového systému jako je zdroj S100B proteinu. Naopak ostatní skórovací systémy poskytují komplexnější odhad klinického stavu pacienta (nezohledňují pouze poranění CNS, ale i funkce orgánových systémů, věk, tíži poranění ostatních orgánových systémů). Na druhé straně nejsou tyto protokoly specifické pro poškození CNS, a proto se nehodí k monitoraci vývoje poškození CNS.
V naší studii jsme se pokusili zhodnotit význam dynamického monitorování v prvních hodinách od úrazu. Zjistili jsme, že pro určení výsledného klinického stavu má rozhodující vliv ne iniciální hladina, ale hladina S100B proteinu v čase 24 hodin. Tato hladina má velmi dobrou korelaci s výsledným klinickým stavem a umožňuje další selekci, kdy pro skupiny pacientů nad a pod mezní hodnotou můžeme s velkou pravděpodobností předpovědět výsledný klinický stav. V souladu s dalšími autory i z naší práce vyplývá význam negativní predikční hodnoty S100B proteinu [3,5]. Mezní hodnota pro příznivý průběh onemocnění v našem souboru pacientů odpovídá referenční hodnotě stanovené vyšetřením skupiny zdravých dobrovolníků. Tato tendence trvá, i pokud dojde k normalizaci hodnot do 72 hodin od přijetí [5,6]. V interpretaci zvýšených hodnot je nutné vzít do úvahy jak absolutní hodnoty markeru (korelují s rozsahem poškození tkáně), tak i dynamiku markeru (informuje o progresi či regresi poškození CNS [14,16].
Závěr
Autoři prokázali statistický významný vztah mezi hodnotami S100B proteinu a jednotlivými skórovacími protokoly při přijetí. Prokázali jednoznačnou souvislost mezi absolutnímu hodnotami hladin S100B proteinu ve všech sledovaných časech s výsledným klinickým stavem. Při sledování dynamiky markeru dochází k razantnímu poklesu v prvních 6 až 12 hodinách po přijetí. K poklesu nedochází pouze u pacientů s infaustní prognózou. Sledování změn hladin S100B proteinu v časech 6 a 12 hodin má význam pro posouzení schopnosti pacienta reagovat na léčbu a případné dekompenzace mozkového poškození. Pokud došlo k normalizaci výsledků S100B proteinu do 24 hod. od přijetí, měli pacienti uspokojivý klinický stav prakticky ve všech případech. U pacientů, kteří měli ve 24 hodinách hladinu S100B proteinu nad referenční hodnotou a došlo k normalizaci jejich hodnot v čase 72 hodin od přijetí, byl klinický stav rovněž příznivý. Pacienti s dlouhodobě přetrvávajícími hodnotami nad normou měli výrazně horší výsledný klinický stav. Čím vyšší je hodnota S100B proteinu v průběhu monitorace, tím je vyšší riziko úmrtí pacienta. Monitorace hladin S100B proteinu by měla být prováděna především u pacientů s omezenou možností objektivního klinického sledování neurologického nálezu (farmakosedace, relaxace, řízená ventilace). Negativní vstupní hodnota upozorňuje na minimální nebo žádné poškození CNS, ale u těchto pacientů může sledování hladiny S100B proteinu upozornit na rozvoj nitrolební komplikace ještě před její klinickou manifestací. Na základě výsledků studie autoři doporučují následující postup při monitoraci hladin S100B proteinu:
- Iniciální náběr u všech pacientů s podezřením na poranění CNS, zejména u pacientů, u kterých není možno sledovat neurologický nález.
- Kontrolní náběr vždy při změně stavu v průběhu prvních 24 hod. tzn. po provedení neodkladné operace, změně léčby nebo při změně neurologického nálezu – tato hodnota umožňuje posoudit reakci pacienta na léčbu.
- U všech sledovaných pacientů náběr po 24 hodinách – tato hodnota umožňuje posoudit schopnost CNS reagovat na léčbu a má silnou vazbu na výsledný klinický stav pacienta.
- U všech pacientů s přetrvávající zvýšenou nebo stoupající hodnotou S100B proteinu kontrolní náběr po 72 hodinách – tato hodnota zvyšuje schopnost odhadu průběhu onemocnění a pravděpodobnosti uspokojivého či neuspokojivého výsledného klinického stavu.
Přijato k recenzi: 2. 2. 2007
Přijato do tisku: 22. 2. 2007
MUDr. Pavel Lavička
Partyzánská 6
312 00 Plzeň
lavicka@fnplzen.cz
Zdroje
1. Heizmann CW, Fritz G, Schafer BW. S100 proteins: Structure, functions and pathology Front Biosci 2002; 7: d1356-1368.
2. Raabe A, Grolms C, Sorge O, Zimmermann M. Serum S-100B protein in Severe Head Injury. Neurosurgery 1999; 45 : 477-4783.
3. Rothoerl RD, Woertgen C, Holschuh M, Metz C, Brawanski A. S-100 Serum Levels after Minor and Major Head injury. J Trauma 1995; 45 : 765-767.
4. Woertgen C, Rothoerl RD, Brawanski A. Early S-100B serum level correlates to quality of life in patiens after severe head injury. Brain Injury 2002; 16 : 807-816.
5. Biberthaler P, Mussack T, Wiedemann E, Kanz K-G, Koelch M, Gipper-Steppert C et al. Evaluation of S100b as a specific marker for neuronal damage due to minor head trauma. World J Surg 2001; 25 : 93-7.
6. Ingebrigtsen T, Romner B, Marup-Jensen S, Dons M, Lundqvist C, Kellner J et al. The clinical value of serum S-100 protein measurements in minor head injury: a Scandinavian multicentre study. Brain Injury 2000; 14 : 1047-1055.
7. Zimmer DB, Cornwall EH, Landar A, Song W. The S100 protein family: history, function, and expression. Brain Res Bull 1995; 37 : 417–429.
8. Cocchia D, Michetti F, Donato R. S100 antigen in normal human skin. Nature 1981; 294 : 85–87.
9. Donato R. Perspectives in S100 protein biology. Cell Calcium 1991; 12 : 713–26.
10. Kleindienst A, Ross Bulock M. A critical analysis of the role of the neurothropic protein S100B in acute brain injury. J Neurotrauma 2006; 23 : 1185-2000.
11. Korfias S, Stranjalis G, Papadimitriou A, Psachoulia C, Daskalakis G, Antsaklis D et al. Serum S-100B protein as a biochemical marker of brain injury: a review of current concepts. Curr Med Chem 2006; 13 : 3719-3731.
12. Townend WJ, Guy MJ, Pani MA, Martin B, Yates DW. Head injury outcome prediction in the emergency department:a role for protein S100B. J Neurol Neurosurg Psychiatry 2002; 73 : 542-546.
13. Vos PE, Lamers KJ, Hendriks JC, van Haaren M, Beems T, Zimmermann C et al. Glial and neuronal proteins in serum predict outcome after severe traumatic brain injury. Neurology 2004; 62 : 1303-1310.
14. Raabe A, Kopetsch O, Woszczyk A, Lang J, Berlach R, Zimmermann M et al. S100B protein as a serum marker of secondary neurological complications in neurocritical care patiens. Neurol Res 2004; 26 : 440-445.
15. Townend W, Dibble C, Abid K, Vail A, Sherwood R, Leckz F. Rapid elimination of protein S-100B from serum after minor head trauma. J Neurotrauma 2006; 23 : 149-155.
16. Dimopoulou I, Korfias S, Dafni U, Anthi A, Psachoulia C, Jullien G et al. Protein S-100b serum levels in trauma-induced brain death. Neurology 2003; 60 : 947-951.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2007 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- CIDP: epidemiológia, klinický obraz a diagnostika v kocke
-
Všetky články tohto čísla
- Léčba epileptických syndromů u dětí
- Vliv antiepileptik na homeostázu hormonů štítné žlázy
- Léčebný potenciál lamotriginu v terapii epilepsie v dětství a adolescenci
- Zmeny v aktivite syntázy oxidu dusnatého v mieche po ligácii koreňov cauda equina v experimente
- Komentář ke článkům Vajtr D, Průša R, Kukačka J, Houšťava L, Šámal F, Pachl J, Pažout J. Dynamika vývoje GCS, hladiny NSE a S100b v séru a morfologie expanzní kontuze u pacientů s poraněním hlavy a Lavička P, Pikner R, Kormunda S, Topolčan O , Bosman R, Chytra I, Holubec L, Choc M. Význam stanovení S100B proteinu u pacientů s izolovaným poraněním hlavy.
- Dynamika vývoje GCS, hladiny NSE a S100B v séru a morfologie expanzní kontuze u pacientů s poraněním hlavy
- Význam stanovení S100B proteinu u pacientů s izolovaným poraněním hlavy
- Sledovanie objemových zmien nastávajúcich po stereotaktickej rádiochirurgickej liečbe v nide intrakraniálnych arteriovenóznych malformácií pomocou 3D volumetrickej štúdie na podklade MR-angiografie
- Pulzní radiofrekvenční terapie radikulární bolesti
- Hemimegalencefalie: přehled literatury a zkušenosti s chirurgickou léčbou 5 nemocných dětí
- Diagnostikujeme správně infekci virem West Nile?
- Hodnocení edému terče zrakového nervu
- Transforaminální lumbo-sakrální mezitělová fúze (TLIF) s instrumentací: prospektivní studie s minimálně 20měsíčním sledováním
- Měření tkáňového kyslíku v mozku jako součást multimodálního monitorování: kazuistiky
- „Inverzní“ syndrom Fostera-Kennedyho u nitrolebního meningeomu: kazuistika
- Jsou některé kontraindikace lumbální punkce dnes již obsoletní? Kazuistika
- Neobvyklá oboustranná atrofie endotelu rohovky a zrakového nervu po pravděpodobné intoxikaci insekticidem lambda-cyhalotrinem (Karate 5 CS) u 58letého vinaře: kazuistika
- Kombinovaná mikrochirurgická a endovaskulární terapie intramedulárního hemangioblastomu: kazuistika
- Epidurální hematom a impresivní fraktura lebky v důsledku bodového uchycení hlavy: zpráva o neobvyklé komplikaci: kazuistika
- Doporučené postupy pro léčbu Alzheimerovy nemoci a dalších onemocnění spojených s demencí
- Černý R, Machala L. Neurologické komplikace HIV/AIDS. Praha: Karolinum 2007. 303 stran. ISBN 978-80-246-1222-5.
- Webové okénko
- DOPORUČENÍ ČESKÉ MYELOMOVÉ SKUPINY (CZECH MYELOM GROUP - CMG) PRO ZAJIŠTĚNÍ ČASNÉ DIAGNOSTIKY MNOHOČETNÉHO MYELOMU V PODMÍNKÁCH AMBULANTNÍ KLINICKÉ PRAXE
-
Analýza dat v neurologii.
V. Přínos a důsledky transformace dat
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Léčba epileptických syndromů u dětí
- Hodnocení edému terče zrakového nervu
- Jsou některé kontraindikace lumbální punkce dnes již obsoletní? Kazuistika
- Transforaminální lumbo-sakrální mezitělová fúze (TLIF) s instrumentací: prospektivní studie s minimálně 20měsíčním sledováním
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



