Monitoring ptiO2 a změny frakce kyslíku ve vdechované směsi u pacientů po těžkém subarachnoidálním krvácení
Monitoring PtiO2 and Changes in Oxygen Fraction in the Breathed Mixture after Severe Subarachnoid Haemorrhage
Introduction:
The aim of this study was to evaluate any possible improvement in outcome for post-severe-SAH patients that might result from monitoring tissue oxygen in the brain (PtiO2, Licox system) and manipulation of the fraction of oxygen in the inhaled mixture of gases (FiO2) with respect to PtiO2 value. Material and methods: 45 patients with aneurysm SAH HH 3, 4 and 5 were enrolled in the study (2007–2009). All patients were artificially ventilated. The first group consisted of 22 patients with SAH HH 4 and 5 treated by coiling. The second group consisted of 23 patients with SAH HH 3 and 4 treated by clipping. The groups were randomly divided into experimental and control subgroups. In the experimental subgroups, PtiO2 was monitored. If the PtiO2 value dropped below 15 mmHg and had not improved after 30 minutes, FiO2 was increased from the default values (range 40–55%) to higher levels (range 70–85%). If the PtiO2 level reached 15 mmHg for at least an hour, FiO2 was brought back to a lower level. Treatment outcome was quantified using the Glasgow Outcome Scale (GOS) and evaluated 3 months after the SAH. Results: The treatment results for patients with and without the use of PtiO2 monitoring did not differ statistically. Conclusion: Therapy with FiO2 manipulation subsequent to PtiO2 measurements did not improve the outcome in patients suffering from SAH, HH 3, 4 and 5. It appears likely that vasospasm prevents PtiO2 increase in response to FiO2 elevation.
Keywords:
brain tissue oxygen – subarachnoid haemorrhage – vasospasm
Autori:
M. Smrčka; E. Neuman; K. Ďuriš; T. Svoboda; M. Duba
Pôsobisko autorov:
Neurochirurgická klinika LF MU a FN Brno
Vyšlo v časopise:
Cesk Slov Neurol N 2010; 73/106(6): 694-700
Kategória:
Původní práce
Súhrn
Cíl:
Cílem práce bylo vyhodnotit možné zlepšení výsledků v léčbě pacientů po těžkém SAK při použití monitoringu tkáňového kyslíku v mozku (PtiO2, systém Licox) a dle ní řízené manipulace s frakcí kyslíku ve vdechované směsi (FiO2). Soubor a metodika: Do studie (2007–2009) bylo celkem zařazeno 45 pacientů se SAK HH 3, 4 a 5 s prokázaným zdrojem krvácení (aneuryzmatem). Jednalo se ve všech případech o pacienty na řízené ventilaci. První skupinu tvořilo 22 pacientů se SAK HH 4 a 5 s aneuryzmatem ošetřeným coilingem. Druhá skupina sestávala z 23 pacientů se SAK HH 3 a 4 s aneuryzmatem ošetřeným clippingem. V obou skupinách (clipping, coiling) byli pacienti náhodně rozděleni na podskupinu experimentální a kontrolní. Pacienti experimentálních podskupin měli monitorováno PtiO2. Pokud hodnoty PtiO2 poklesly pod 15 mmHg a nezlepšily se po dobu 30 minut, byla zvýšena FiO2 ze standardní hodnoty (rozmezí 40–55 %) na vyšší hladinu (rozmezí 70–85 %). V případě normalizace hladiny PtiO2 trvající alespoň 1 hodinu byla frakce kyslíku snížena zpět na nižší hladinu. Vyhodnoceny byly výsledky léčby kvantifikované pomocí Glasgow Outcome Scale (GOS) tři měsíce po vzniku SAK. Výsledky: Mezi léčebnými výsledky pacientů léčených s použítím monitorování PtiO2 a bez jeho použití se neprokázal statisticky významný rozdíl. Závěr: Terapie využívající manipulaci s FiO2 v návaznosti na měření PtiO2 nezlepšila výsledky léčby pacientů po SAK HH 3, 4 a 5. Je pravděpodobné, že léčebné výsledky nelze zlepšit zvyšováním FiO2 z toho důvodu, že při přítomnosti vazospazmů dochází jen k malému zvyšování hladiny kyslíku v mozkové tkáni.
Klíčová slova:
tkáňový kyslík – subarachnoidální krvácení – vazospazmy
Práce vznikla za podpory grantu IGA MZ ČR NR/8837 a IGF FN Brno č. 7/06.
Úvod
Mozková ischemie (delayed cerebral ischemia, DCI) jako komplikace po proběhlém subarachnoidálním krvácení (SAK) se objevuje nejčastěji od 4. do 16. dne po ruptuře aneuryzmatu a je vedle časného opakovaného krvácení (rebleedingu) nejzávažnější a nejobávanější komplikací u pacientů se SAK. Postihuje asi 20–30 % pacientů [1–3] a u řady z nich vede k závažným neurologickým následkům, případně k úmrtí.
DCI je způsobena vazospazmy tepen mozkového řečiště. Navzdory mnoha letům intenzivního výzkumu nebyla patogeneze vzniku DCI zcela objasněna. Výskyt DCI souvisí s těžším stavem pacienta při přijetí [4–6], s rostoucím množstvím krve v subarachnoidálních prostorech [5–8], s vyšším věkem [4,9], s hyperglykemií [4], s hypotenzí při anestezii během operace aneuryzmatu [10], s přítomností akutního hydrocefalu při přijetí [11] a s délkou trvání bezvědomí bezprostředně po vzniku SAK [12].
Vazospazmy se diagnostikují rutinně pomocí transkraniálního dopplerovského vyšetření, případně jsou patrné na angiografickém vyšetření. Je i několik možností přímého měření oxygenace mozkové tkáně u pacientů na JIP.
Katetrizace vena jugularis interna a následně měření saturace venózní krve (odtékající z mozku) kyslíkem (SjO2) dovoluje zhodnocení stavu globální oxygenace mozku. Redukce SjO2 pod fyziologické hodnoty, tj. SjO2 < 55 %, indikuje, že dodávka kyslíku do mozku nedosahuje potřeb mozku [13]. Měření SjO2 není ale schopno zachytit lokální mozkovou ischemii [14]. Vezmeme-li v úvahu nutnost opakované kalibrace (cca po 4 hod) a zejména pak citlivost měřených hodnot na pozici katétru (při náhodném, a to i drobném pohybu dojde ke skokové změně měřené hodnoty a je nutná rekalibrace), bývá v praxi měření SjO2 poměrně obtížné.
Mikrodialýza mozku je dobře laboratorně ověřená metoda, která nyní nachází stále častější uplatnění jako součást multimodálního monitoringu u lůžka pacienta. Umístění mikrodialyzačního katétru do rizikových oblastí dovoluje sledovat biochemické změny ve tkáni, která je nejvíce ohrožena sekundárním inzultem. Měřit je možno hladinu glukózy, laktátu, pyruvátu, glycerolu a glutamátu [15].
Zlepšení technologie a nesnáze technik popsaných výše vedly k vývoji zařízení pro přímé měření parciálního tlaku kyslíku v mozkové tkáni (PtiO2, brain tissue oxygen pressure). PtiO2 je obrazem rovnováhy mezi spotřebou kyslíku a dodávkou kyslíku. Hodnota PtiO2 je ovlivněna změnami v kapilární perfuzi, tj. změnami v CBF (cerebral blood flow).
V současnosti je nejběžněji užíván systém Licox (GMS, Kiel-Mielkendorf, Germany) a do roku 2006 byl užíván systém Neurotrend (Codman, Johnson & Johnson, Raynham, MA, USA). Nově je k dispozici také multimodální čidlo Neurovent PTO (Raumedic). Protože reakce systémů pro měření PtiO2 jsou rychlé [16], a hodnoty PtiO2 jsou tak okamžitě dostupné, dovolují systémy pro měření PtiO2 terapeuticky reagovat na zjištěné biologické změny a sledovat odezvy, jichž bylo terapií dosaženo. Hodnoty PtiO2 které jsou označeny za hypoxické, musí být ale zvažovány i v kontextu typu použité sondy, místa zavedení sondy, typu patologie a také doby trvání hypoxie. Jako prahy hypoxie tak byly navrženy různé hodnoty PtiO2 (tab. 1).
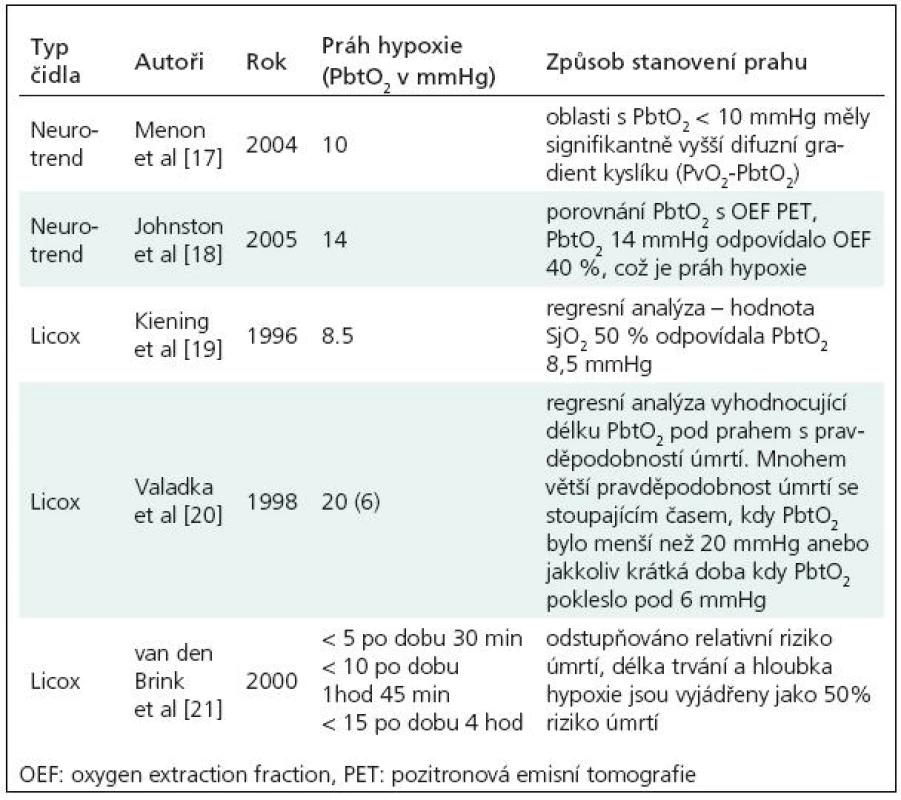
Na základě doporučení uvedených v tab. 1 považujeme za dostatečnou hodnotu tkáňového kyslíku alespoň 20 mmHg. Za alarmující považujeme pak hodnotu 10 mmHg.
Cílem práce bylo především vyhodnotit možné zlepšení výsledků v léčbě pacientů po SAK HH 3, 4 a 5 (klasifikace podle Hunta-Hesse), ohrožených rozvojem ischemických komplikací následkem cévních spazmů. K tomuto účelu bylo použito monitorování tkáňového kyslíku v mozku a manipulace s podílem kyslíku ve vdechované směsi. To mělo posloužit k vyhodnocení, zda takto rozšířené monitorování a léčba modifikovaná podle znalostí tkáňového kyslíku v mozku má přínos vůči dosud používanému standardnímu monitorování a léčbě řízené pomocí TK, ICP a CPP.
Soubor a metodika
Do studie (2007–2009) bylo celkem zařazeno 45 pacientů (17 mužů, 28 žen, průměrný věk 51 let, směrodatná odchylka věkového průměru 11 let) se SAK HH 3, 4 a 5 s prokázaným zdrojem krvácení (aneuryzmatem). Jednalo se ve všech případech o pacienty na řízené ventilaci. Pacienti HH 3 byli ponecháni na řízené ventilaci po zavedení zevní komorové drenáže nebo po výkonu na aneuryzmatu. Do studie nebyli zařazováni pacienti starší 70 let a pacienti s infaustní prognózou již při přijetí (oboustranná mydriáza, případně areflexie nad C1 v době přijetí na JIP).
U všech pacientů byla v nejkratší možné době provedena diagnostika zdroje krvácení mozkovou panangiografií (DSA), případně pomocí CT angiografie. Po diagnostice byla další léčba volena dle nálezu na diagnostických vyšetřeních a s přihlédnutím ke klinickému stavu pacientů (tj. coiling nebo clipping) podle obecně platných zásad a podle zvyklostí pracoviště.
Pacienti byli kategorizováni do dvou skupin podle typu ošetření (coiling nebo clipping). Ve všech případech bylo aneuryzma ošetřeno časně (1.–4. den od ruptury).
První skupinu tvořilo 22 pacientů se SAK HH 4 a 5 s prokázaným zdrojem krvácení (aneuryzmatem), u nichž bylo aneuryzma ošetřeno coilingem.
Druhou skupinu tvořilo 23 pacientů se SAK HH 3 a 4, u kterých bylo aneuryzma ošetřeno clippingem. U části pacientů této skupiny byl přítomen intracerebrální hematom vyžadující chirurgickou evakuaci.
Zatímco diagnostika a ošetření aneuryzmatu proběhly u všech zařazených pacientů obdobným a standardizovaným způsobem, monitoring pacientů na JIP při další léčbě se lišil. V rámci každé z obou jmenovaných skupin (clipping, coiling) byli pacienti náhodně rozděleni na podskupinu experimentální a podskupinu kontrolní (celkem tak vznikly čtyři podskupiny). Alokace pacientů do jednotlivých skupin byla provedena střídavě, podle pořadí jednotlivých konsekutivních pacientů. U všech podskupin byl na JIP monitorován nitrolební tlak (ICP, monitoring se prováděl buď parenchymovým čidlem Sophysa, nebo přes ventrikulostomii) a invazivní krevní tlak (TK, monitorován nejčastěji punkcí arteria radialis). Pacienti experimentálních podskupin byli ještě navíc monitorováni čidlem pro měření parciálního tlaku kyslíku v mozkové tkáni (PtiO2, systém Licox) a teplotním čidlem pro měření teploty tělesného jádra (močový měchýř, případně rektum, znalost teploty tělesného jádra je nutná pro korekci teplotní závislosti čidla pro tkáňovou oxymetrii). Čidlo pro tkáňovou oxymetrii bylo přednostně zaváděno do oblasti, kde jsme nejvíce předpokládali rozvoj vazospazmů, tj. do povodí tepny, na níž byla zjištěna výduť. V případě, že výduť byla zjištěna na ACA nebo ACoA, bylo čidlo umístěno mediálně od Kocherova bodu cca 1 cm od střední čáry na stejné straně, kde se nacházela výduť. V případě, že se výduť nacházela na ACM nebo ACI, bylo čidlo umístěno laterálně od Kocherova bodu (cca 4 cm od střední čáry, na stejné straně jako výduť). V případě nálezu aneuryzmatu v zadním povodí (a. basilaris, PICA...) bylo čidlo umístěno do pravého Kocherova bodu.
Čidlo Licox jsme zaváděli 4. den po vzniku SAK (zaváděno na JIP), neboť vazospazmy obvykle nevznikají dříve a čidlo nelze ponechat z důvodu rizika infekce déle než cca 8–10 dní. Čidlo zaváděné 4. den po SAK a ponechané 8–10 dní dobře pokryje předpokládané období trvání vazospazmů. Vzhledem k tomu, že čidlo ihned po zavedení ukazuje nevalidní hodnoty, byly hodnoty PtiO2 považovány za validní po 6 hodinách.
Pacienti v kontrolních podskupinách byli na JIP léčeni a monitorováni podle v současné době obecně používaných postupů. V experimentálních podskupinách byla léčba modifikována podle zjištěných hodnot PtiO2. Pokud hodnoty PtiO2 poklesly pod 15 mmHg a nezlepšily se po dobu 30 minut, byla zvýšena frakce kyslíku ve vdechované směsi plynů (FiO2) ze standardní hodnoty (udržované v rozmezí 40–55 %) na vyšší hladinu (rozmezí 70–85 %). V případě normalizace hladiny PtiO2 (tj. vzestup nad 15 mmHg) trvající alespoň 1 hodinu byla frakce kyslíku snížena zpět na nižší hladinu (tj. 40–55 %). Sledováno bylo i množství krve v subarachnoidálních prostorech pro ověření porovnatelnosti obou skupin pacientů. To bylo hodnoceno pomocí Fisherova skóre, jež předvídá stupeň rizika vazospazmu. Jednotlivé porovnávané skupiny se nelišily statisticky ani ve Fisherově skóre, ani v HH skóre.
Vyhodnocen byl přínos rozšířeného monitoringu (o PtiO2) a jím řízené manipulace s FiO2 na výsledek léčby kvantifikovaný pomocí Glasgow Outcome Scale (GOS) tři měsíce po vzniku SAK. Bylo použito dichotomizace GOS na výsledek dobrý (GOS 4 a 5) a špatný (GOS 1, 2, 3). GOS experimentální a kontrolní podskupiny obou skupin (coiling, clipping) bylo porovnáno pomocí chí-kvadrát (χ2) testu.
Výsledky
Skupina „coiling“, podskupina „kontrolní“
Metoda
Pacienti se SAK HH 4 a 5 s prokázaným aneuryzmatem léčeným coilingem, na řízené ventilaci, standardní monitoring (ICP, TK) na JIP.
Charakteristiky souboru
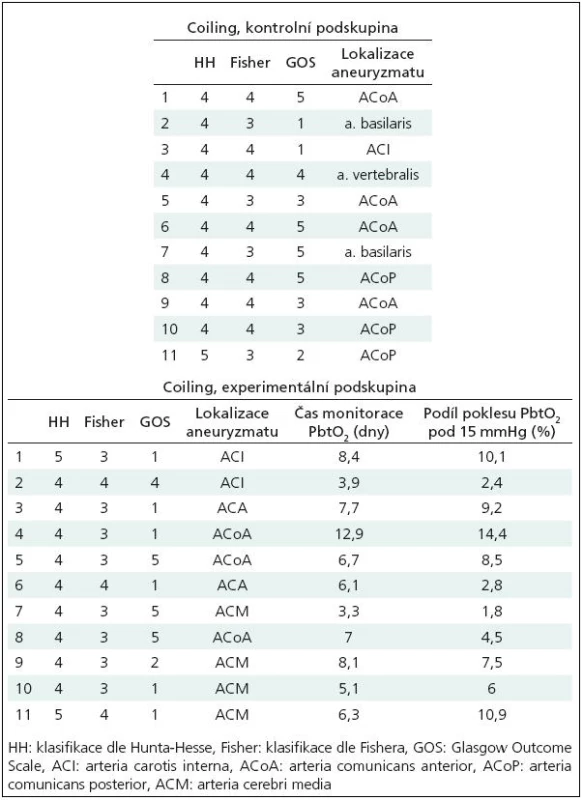
Jedenáct pacientů, 8 mužů, 3 ženy, průměrný věk 50 let, směrodatná odchylka věkového průměru 14 let. Fisherovo skóre 3 a 4. Detailnější údaje o pacientech v tab. 2.
Skupina „coiling“, podskupina „experimentální“
Metoda
Pacienti se SAK HH 4 a 5, s prokázaným aneuryzmatem léčeným coilingem, na řízené ventilaci, standardní monitorování na JIP (ICP, TK) rozšířená o PtiO2 monitorování. FiO2 výše popsaným způsobem měněno v závislosti na PtiO2.
Charakteristiky souboru
Jedenáct pacientů, 3 muži, 8 žen, průměrný věk 44 let, směrodatná odchylka věkového průměru 10 let. Fisherovo skóre 3 a 4, detailnější údaje o pacientech v tab. 2.
Skupina „clipping“, podskupina „kontrolní“
Metoda
Pacienti se SAK HH 3 a 4 s prokázaným aneuryzmatem ošetřeným clippingem, kteří vzhledem ke svému pooperačnímu stavu museli být v pooperačním období ponecháni na řízené ventilaci, standardní monitorování (ICP, TK) na JIP. U části pacientů byl přítomen intracerebrální hematom, který vyžadoval evakuaci.
Charakteristiky souboru
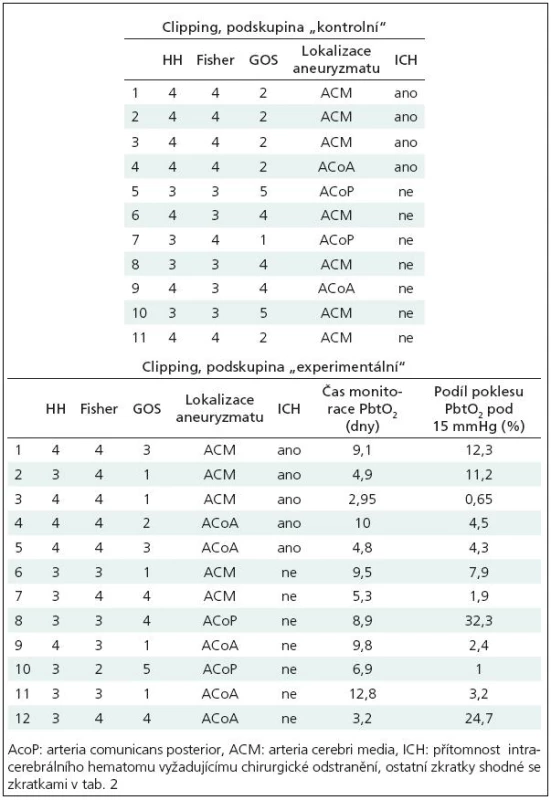
Charakteristiky souboru: 11 pacientů, 1 muž, 10 žen, průměrný věk 57 let, směrodatná odchylka průměru věku 9 let. Fisherovo skóre 3 až 4. Detailnější údaje o pacientech v tab. 3.
Skupina „clipping“, podskupina „experimentální“
Metoda
Pacienti se SAK HH 3 a 4, s prokázaným aneuryzmatem ošetřeným clippingem, kteří vzhledem ke svému pooperačnímu stavu museli být v pooperačním období ponecháni na řízené ventilaci. Standardní monitoring (ICP, TK) na JIP rozšířená o PtiO2 monitoring. FiO2 výše popsaným způsobem měněno v závislosti na PtiO2. U části pacientů byl přítomen intracerebrální hematom, který vyžadoval evakuaci.
Charakteristiky souboru
Charakteristiky souboru: 12 pacientů, 5 mužů, 7 žen, průměrný věk 51 let, směrodatná odchylka průměru 10 let, detailnější údaje o pacientech v tab. 3.
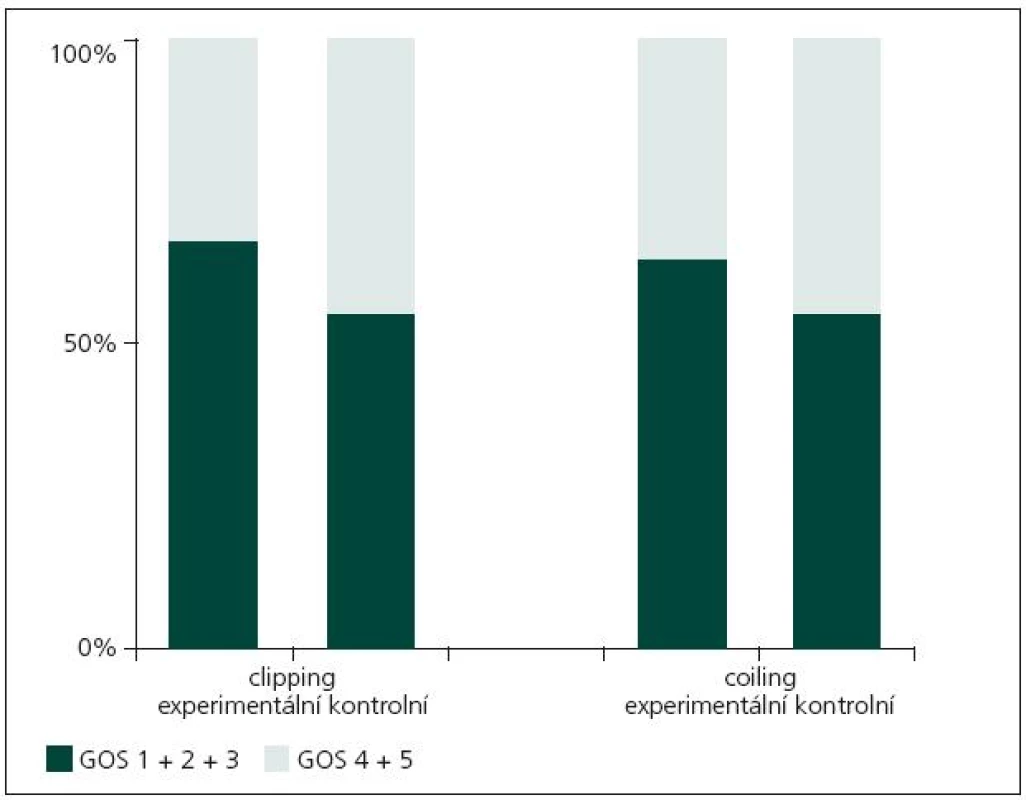
Grafické zhodnocení léčebných výsledků
Z obr. 1 je patrné, že léčebné výsledky jsou obdobné v obou podskupinách (kontrolní, experimentální) v rámci obou sledovaných skupin (coiling, clipping).
Statistické zhodnocení léčebných výsledků
Vzhledem k tomu, že léčebný výsledek je hodnocen ordinálními daty, zvolili jsme ke statistickému zhodnocení chí-kvadrát test. GOS všech pacientů ve všech skupinách jsou shrnuty v tab. 4. Ke statistickému hodnocení byly léčebné výsledky hodnocené pomocí GOS sloučeny do dvou kategorií – GOS 1, 2 a 3 jako špatný léčebný výsledek a GOS 4 a 5 jako dobrý léčebný výsledek.
Výsledek chí-kvadrát testu: χ2=1,23 (potřebné χ2 pro hladinu 0,05 = 3,84)
Výsledek chí-kvadrát testu není statisticky významný, to znamená, že se nepotvrdil rozdíl v léčebných výsledcích mezi podskupinami „kontrolní“ a „experimentální“ v rámci obou uvažovaných skupin. Nepotvrdil se tedy rozdíl mezi pacienty léčenými standardně a experimentálně při zvyšování FiO2 při poklesu PtiO2 pod 15 mmHg.
Diskuze
V České republice se problematikou monitorování zabývalo již několik autorů – Pachl et al [22] použili tuto metodu u pacientů se SAK, Hejčl et al [23] uveřejnili kazuistiku pacienta s kraniocerebrálním poraněním a kazuistiky pacientů se SAK a kraniocerebrálním poraněním publikovali také Gál et al [24]. Souhrnnou práci na téma PtiO2 publikovali Filaun et al [25]. Vesměs se jednalo o první zkušenosti se zmíněnou metodou, a proto dále v diskuzi citujeme výsledky některých zahraničních autorů.
Kett-White et al [26] monitorovali 40 pacientů (35 po SAK, 5 po komplexních operacích na aneuryzmatech) pomocí PtiO2 a mikrodialýzy. Podařilo se ale prokázat pouze slabou asociaci mezi epizodami nízkého PtiO2, abnormálními hodnotami v mikrodialýze a špatným léčebným výsledkem. Jako možné důvody pro velkou variabilitu v měřených hodnotách PtiO2 (jež byla příčinou slabé asociace) udává autor tyto možné důvody – variabilní vzdálenost čidla od cév (a následný gradient kyslíku), rozdíly mezi šedou a bílou hmotou (rozdíly v rychlosti metabolizmu a rozdílná hloubka inzerce při členitosti povrchu mozku – sulky, gyry).
Studie používající systém Neurotrend u 10 pacientů po SAK [27], z nichž u tří se vyvinuly vazospazmy, ukazuje signifikantní snížení pH a zvýšení PtiCO2 (p < 0,001). Nedokázala ale stanovit prahovou hodnotu PtiO2, u které se rozvíjí ischemie.
Meixensberger et al [28] prospektivně studovali 42 pacientů se SAK HH 4 a 5. Také nedokázali stanovit určitou hodnotu PtiO2, která by byla prediktorem úmrtí pacientů. Udávané důvody pro nemožnost stanovení takovéto hodnoty jsou malý počet pacientů ve studii, potíže s přesností zavádění sondy do postiženého teritoria a rovněž možnost, že spotřeba kyslíku byla v postižené oblasti více zasažena (tedy dodávaný kyslík nebyl spotřebováván), než bylo zasaženo CBF, a hodnota PtiO2 zůstávala vysoká.
Reakci PtiO2 na hyperoxii zkoumali ve své práci Hlatky et al [29]. Přestože se týkala kraniocerebrálních traumat, její závěry jsou zajímavé i z hlediska SAK. Hlatky v závěru práce konstatuje, že pokud je nízký CBF, pak je i zvýšení PtiO2 při hyperoxii malé, a že ačkoliv i malé zvýšení kyslíku může být při nízkém CBF důležité, vyšší terapeutické naděje pravděpodobně jsou v ovlivnění CBF.
Zatím není zcela jasné, jestli vůbec monitoring PtiO2 může být varující před nástupem vazospazmů a následných ischemií a když tomu tak je, tak jaká hodnota je ta kritická. Interpretace naměřených hodnot PtiO2 není totiž zcela přímočará. Změny v CBF nejsou jediné, které ovlivní PtiO2. Jak ukazují Menon et al, také překážky v difuzi kyslíku ovlivňují PtiO2 [17]. V důsledku patologických změn ve tkáni (perivaskulární edém, kolaps kapilár, endoteliální swelling) je difuze kyslíku z kapilár do extracelulární tekutiny zhoršena. Zhoršení difuze kyslíku se projeví zejména při omezení průtoku krve mozkem (hypotenze, hyperventilace). V takto postižených místech dochází k hypoxii, protože nemůže dojít ke zvýšení extrakce kyslíku z krve.
Dle studie s modelem globální ischemie závisí interpretace hodnot PtiO2 také na specifitě prostředí, ve kterém je čidlo umístěno, konkrétně, zda se nachází spíše v blízkosti arteriol nebo spíše vén [30]. Pokud je čidlo PtiO2 umístěno v blízkosti arteriol, pak změny PtiO2 sledují změny CBF. Pokud se čidlo PtiO2 nachází v blízkosti vén, pak změny PtiO2 kopírují změny ve velikosti arteriovenózní diference (tj. kopírují změny ve frakci extrahovaného kyslíku).
V našich vlastních výsledcích se neprokázal statistický rozdíl mezi léčbou pacientů se SAK s použitím monitoringu tkáňového kyslíku a se změnami v parciálním tlaku kyslíku ve vdechované směsi v porovnání se standardní léčbou. Již před časem jsme publikovali zjištění, že při zvyšování FiO2 je nárůst PtiO2 nižší u pacientů s prokázanými vazospazmy, než u pacientů bez vazospazmů [31]. Obr. 2 ilustruje tuto skutečnost.
![Ilustrace nárůstu PbtO<sub>2</sub> po zvýšení FiO<sub>2</sub> na 100 % z výchozí hodnoty (okolo 50%).
FiO<sub>2</sub> bylo skokově zvýšeno v čase 0. U pacientů s vazospazmy dochází k nižšímu nárůstu PbtO<sub>2</sub>. Podrobněji viz [31].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/aaabbe9445706b1f7bc24f6890b3929c.jpg)
S ohledem na tento fakt, že nárůst PtiO2 je nižší u pacientů s vazospazmy, než u pacientů bez vazospazmů, se dá soudit, že zvyšování FiO2 nepřinese benefit právě těm pacientům, kteří by to nejvíce potřebovali. Po zvýšení FiO2 se totiž hodnota PtiO2 zvýší jen málo a toto malé zvýšení nezabrání propadnutí ischemizovaných oblastí nekróze. Samotné zvyšování FiO2 se tak nejeví být účinnou metodou pro léčbu ischemických komplikací vyvolaných vazospazmy.
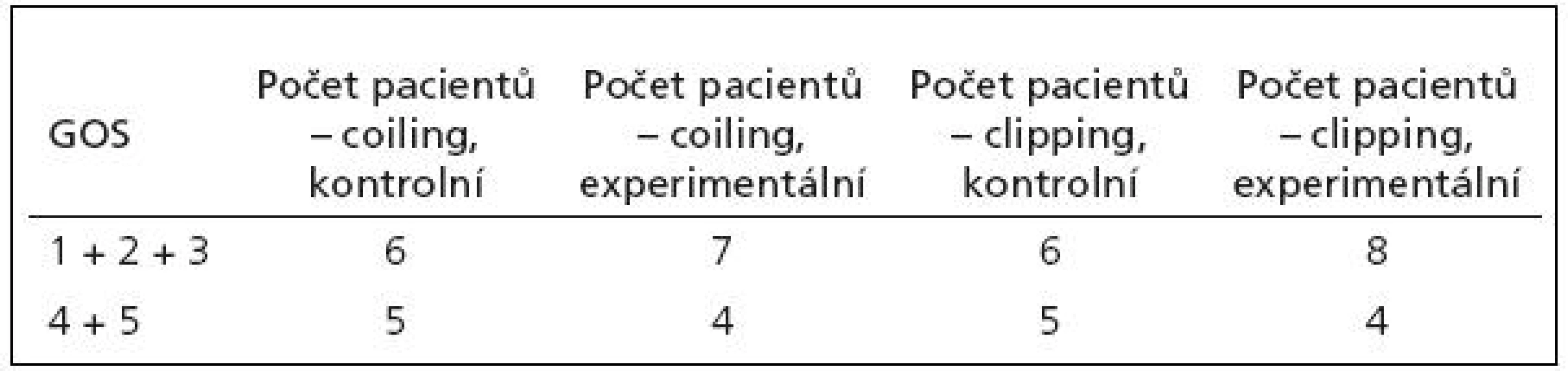
Dle našich zkušeností jsou hodnoty PtiO2 zpočátku víceméně u všech pacientů v pásmu normálních hodnot, byť často kolísají. Pro pacienty se špatným léčebným výsledkem je typické, že po různě dlouhém období relativně příznivých hodnot PtiO2 se objeví rychle klesající trend v hladině PtiO2 až do jasně patologických hodnot. Tyto nízké hodnoty mají tendenci dlouhodobě přetrvávat (buď hodiny, nebo již trvale), léčebně se je nedaří zvrátit. Po tomto poklesu PtiO2 nastává s určitým odstupem zhoršení klinického stavu pacienta (případně zhoršení na CT nálezu). Ukázka takového průběhu PtiO2 je na obr. 3. U pacientů s dobrým léčebným výsledkem je naopak typické jen zmíněné kolísání hodnot PtiO2.
Obecně jsou ale hodnoty měřené PtiO2 dosti individuální, jejich interpretace není jednoznačná, navíc se jedná o lokální hodnotu. Hodnoty PtiO2 lze dle našeho názoru využít jako časný ukazatel hrozící ischemizace jen tehdy, pokud jsou uvažovány v korelaci s CT nálezem, středním arteriálním tlakem, s podávanými vazodilatačními léky, nutná je znalost vlastností místa inzerce čidla (zdravá tkáň, penumbra, ischemizovaná oblast…). Pozitivní aspekt je, že se jedná o relativně stabilní a spolehlivou metodu, která přináší novou potenciálně využitelnou informaci. Jako určité řešení v interpretaci naměřených hodnot se jeví korelace této fokální metody s grafickým perfuzním vyšetřením (například mobilní perfuzní CT). Určitou možností do budoucna je vyzkoušet tkáňovou oxymetrii jako metodu monitorující efektivitu léčebných opatření k reverzi vazospazmů – např. účinnost zkoumaných vazoaktivních látek.
Závěr
Terapie využívající manipulaci s FiO2 nemá pravděpodobně příznivý efekt pro výsledek léčby pacientů po SAK HH 3, 4 a 5. Je pravděpodobné, že léčebné výsledky nelze zlepšit zvyšováním FiO2 z toho důvodu, že při přítomnosti vazospazmů dochází jen k malému zvyšování hladiny kyslíku v mozkové tkáni.
Monitoring PtiO2 se dle našich zkušeností jeví být spolehlivým časným ukazatelem ischemie u pacientů se SAK HH 3, 4, 5, avšak za podmínek, že interpretace hodnoty PtiO2 je prováděna v kontextu řady ostatních parametrů, z nichž nejdůležitější jsou vlastnosti místa inzerce.
prof. MUDr. Martin Smrčka, Ph.D., MBA
Neurochirurgická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: msmrcka@fnbrno.cz
Přijato k recenzi: 30. 3. 2010
Přijato do tisku: 15. 8. 2010
Zdroje
1. Heros RC, Zervas NT, Varsos V. Cerebral vasospasm after subarachnoid hemorrhage: an update. Ann Neurol 1983; 14(6): 599–608.
2. Van Gijn J, Rinkel GJ. Subarachnoid haemorrhage: diagnosis, causes and management. Brain 2001; 124(2): 249–278.
3. Kassell NF, Sasaki T, Colohan ART, Nazar G. Cerebral vasospasm following aneurysmal subarachnoid hemorrhage. Stroke 1985; 16(4): 562–572.
4. Charpentier C, Audibert G, Guillemin F, Civit T, Ducrocq X, Bracard S et al. Multivariate analysis of predictors of cerebral vasospasm occurrence after aneurysmal subarachnoid hemorrhage. Stroke 1999; 30(7): 1402–1408.
5. Inagawa T. Cerebral vasospasm in elderly patients treated by early operation for ruptured intracranial aneurysms. Acta Neurochir 1992; 115(3–4): 79–85.
6. Rabb CH, Tang G, Chin LS, Giannotta SL. A statistical analysis of factors related to symptomatic cerebral vasospasm. Acta Neurochir 1994; 127(1–2): 27–31.
7. Fisher CM, Kistler JP, Davis JM. Relation of cerebral vasospasm to subarachnoid hemorrhage visualized by computed tomographic scanning. Neurosurgery 1980; 6(1): 1–9.
8. Hirai S, Ono J, Yamaura A. Clinical grading and outcome after early surgery in aneurysmal subarachnoid hemorrhage. Neurosurgery 1996; 39(3): 441–447.
9. Lanzino G, Kassell NF, Germanson TP, Kongable GL, Truskowski LL, Torner JC et al. Age and outcome after aneurysmal subarachnoid hemorrhage: Why do older patients fare worse? J Neurosurg 1996; 85(3): 410–418.
10. Chang HS, Hongo K, Nakagawa H. Adverse effects of limited hypotensive anesthesia on the outcome of patients with subarachnoid hemorrhage. J Neurosurg 2000; 92(6): 971–975.
11. Fujii Y, Takeuchi S, Sasaki O, Minakawa T, Koike T, Tanaka R. Serial changes of hemostasis in aneurysmal subarachnoid hemorrhage with special reference to delayed ischemic neurological deficits. J Neurosurg 1997; 86(4): 594–602.
12. Hop JW, Rinkel GJ, Algra A, van Gijn J. Initial loss of consciousness and risk of delayed cerebral ischemia after aneurysmal subarachnoid hemorrhage. Stroke 1999; 30(11): 2268–2271.
13. Tisdall MM, Smith M. Multimodal monitoring in traumatic brain injury: current status and future directions. Br J Anaesth 2007; 99(1): 61–67.
14. Coles JP, Fryer TD, Smielewski P, et al. Defining ischemic burden after traumatic brain injury using 15O PET imaging of cerebral physiology. J Cereb Blood Flow Metab 2004; 24(2): 191–201.
15. Reinstrup P Stahl N, Mellergard P, Uski T, Ungerstedt U, Nordstrom CH. Intracerebral microdialysis in clinical practice: baseline values for chemical markers during wakefulness, anesthe sia, and neurosurgery. Neurosurgery 2000; 47(3): 701–709.
16. Hoelper BM, Alessandri B, Heimann A, Behr R, Kempski O. Brain oxygen monitoring: in-vitro accuracy, long-term drift and response-time of Licox - and Neurotrend sensors. Acta Neurochir (Wien) 2005; 147(7): 767–774.
17. Menon DK, Coles JP, Gupta AK, Fryer TD, Smielewski P, Chatfield DA et al. Diffusion limited oxygen delivery following head injury. Crit Care Med 2004; 32(6): 1384–1390.
18. Johnston AJ, Steiner LA, Coles JP, Chatfield DA, Fryer TD, Smielewski P et al. Effect of cerebral perfusion pressure augmentation on regional oxygenation and metabolism after head injury. Crit Care Med 2005; 33(1): 189–195.
19. Kiening KL, Unterberg AW, Bardt TF, Schneider GH, Lanksch WR. Monitoring of cerebral oxygenation in patients with severe head injuries: brain tissue PO2 versus jugular vein oxygen saturation. J Neurosurg 1996; 85(5): 751–757.
20. Valadka AB, Gopinath SP, Contant CF, Uzura M, Robertson CS. Relationship of brain tissue PO2 to outcome after severe head injury. Crit Care Med 1998; 26(9): 1576–1581.
21. van den Brink WA, van Santbrink H, Steyerberg EW, Avezaat CJ, Suazo JA, Hogesteeger C et al. Brain oxygen tension in severe head injury. Neurosurgery 2000; 46(4): 868–876.
22. Pachl J, Haninec P, Tencer T, Mizner P, Housťava L, Tomás R et al. The effect of subarachnoid sodium nitroprusside on the prevention of vasospasm in subarachnoid haemorrhage. Acta Neurochir 2005; 95 (Suppl): 141–145.
23. Hejčl A, Bartoš R, Humhej I, Bolcha M, Bejšovec D, Procházka J et al. Dekompresivní kraniektomie v léčbě posttraumatického edému mozku a přínos nových monitorovacích metod. Čas Lék čes 2007; 146(4): 307–312.
24. Gál R, Smrčka M, Štourač P, Straževská E, Neuman E. Měření tkáňového kyslíku v mozku jako součást multimodálního monitorování: kazuistiky. Cesk Slov Neurol N 2007; 70/103(5): 562–566.
25. Filaun M, Horáček M, Steindler J, Pekař L, Cvachovec K. Monitorování mozkové oxygenece. Cesk Slov Neurol N 2008; 71/104(6): 657–663.
26. Kett-White R, Hutchinson PJ, Al-Rawi PG, Gupta AK, Pickard JD, Kirkpatrick PJ. Adverse cerebral events detected after subarachnoid hemorrhage using brain oxygen and microdialysis probes. Neurosurgery 2002; 50(6): 1213–1221.
27. Charbel FT, Du X, Hoffman WE, Ausman JI. Brain tissue PO(2), PCO(2), and pH during cerebral vasospasm. Surg Neurol 2000; 54(6): 432–437.
28. Meixensberger J, Vath A, Jaeger M, Kunze E, Dings J, Roosen K. Monitoring of brain tissue oxygenation following severe subarachnoid hemorrhage. Neurol Res 2003; 25(5): 445–450.
29. Hlatky R, Valadka AB, Gopinath SP, Robertson CS. Brain tissue oxygen tension response to induced hyperoxia reduced in hypoperfused brain. J Neurosurg 2008; 108(1): 53–58.
30. Scheufler KM, Rohrborn HJ, Zentner J. Does tissue oxygen tension reliably reflect cerebral oxygen delivery and consumption? Anesth Analg 2002; 95(4): 1042–1048.
31. Ďuriš K, Smrčka M, Ševčík P, Gál R, Juráň V, Neuman E et al. Možnosti využití mozkové tkáňové oxymetrie v detekci vazospasmů u pacientů po subarachnoidálním krvácení. Anesteziologie a intenzivní medicína 2009; 20(2): 102–106.
Štítky
Detská neurológia Neurochirurgia NeurológiaČlánok vyšiel v časopise
Česká a slovenská neurologie a neurochirurgie

2010 Číslo 6
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Kombinace paracetamolu s kodeinem snižuje pooperační bolest i potřebu záchranné medikace
- CIDP: epidemiológia, klinický obraz a diagnostika v kocke
Najčítanejšie v tomto čísle
- Spontánní regrese sekvestru při lumbální herniaci disku – soubor tří kazuistik
- Posuzování zdravotního stavu a pracovní schopnosti osob po cévní mozkové příhodě – kazuistiky
- Dotazník Bristolská škála aktivit denního života BADLS-CZ pro hodnocení pacientů s demencí
- Autizmy
