-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Porucha pozornosti s hyperaktivitou (attention deficit/hyperactivity disorder – ADHD)
Attention Deficit/Hyperactivity Disorder
Attention-deficit/hyperactivity disorder (ADHD) is a neurodevelopmental disorder first appearing in early childhood and persisting at a rate of 60% until adulthood. Underlying it are structural and functional aberrations in a number of areas of the brain, especially the frontal cortex and basal ganglia, compounded by dysbalance of some neurotransmitters (dopamine and noradrenaline). ADHD etiology appears to be multifactorial as the coresponsible
factors include genetic predisposition and external environment effects. Disorder in the fronto-striato-thalamo-cortical circuit leads to executive (self-regulating) functions impairment and to basic clinical symptoms – inattention, hyperactivity and impulsiveness. In addition, ADHD also involves emotional changes, social maladaptation, and motor-perception problems. There are frequent comorbidities (oppositional defiant disorder, anxiety, depression, developmental learning disorders, tics) in what are further impediments to the ADHD patients´ progress at school, social assertion and emotional development. Diagnosis is based on clinical symptoms (Diagnostic and Statistical Manual of Mental Disorders – DSM-IV or International Classification of Diseases – ICD-10). Treatment makes use of psychostimulants and atomoxetin in combination with psychotherapeutic methods. Since paediatric neurologists are often the first medical specialists to examine children with ADHD, knowledge of the symptoms, diagnostic and therapeutic procedures can only upgrade correct care of those patients.Key words:
attention deficit/hyperactivity disorder – executive functions – neurodevelopmental disorder
Vyšlo v časopise: Cesk Slov Neurol N 2011; 74/107(4): 408-418
Kategória: Minimonografie
Súhrn
Porucha pozornosti s hyperaktivitou (ADHD) je vývojová porucha centrální nervové soustavy, která se projevuje již v časném dětském věku a v 60 % přetrvává do dospělosti. Podkladem jsou strukturální a funkční odchylky různých mozkových oblastí, především frontální kůry a bazálních ganglií, spojené s narušenou rovnováhou některých neurotransmiterů (zejména dopaminu a noradrenalinu). Etiologie ADHD je pravděpodobně multifaktoriální, na vzniku se podílejí genetická predispozice a vlivy vnějšího prostředí. Porucha ve fronto-striato-thalamokortikálním okruhu vede k postižení exekutivních (seberegulujících) funkcí a k základním klinickým projevům – nepozornosti, hyperaktivitě a impulzivitě. Kromě těchto příznaků je
ADHD spojena také s emočními změnami, poruchami sociální adaptace, motorickými a percepčními problémy. Velmi častý je výskyt komorbidních onemocnění (porucha opozičního vzdoru, úzkostná a depresivní porucha, vývojové poruchy učení, tiky), která dále ztěžují školní a sociální uplatnění pacientů s ADHD a jejich emoční vývoj. Diagnostika je založena na klinických příznacích (kritéria Diagnostického manuálu duševních poruch – DSM-IV, nebo Mezinárodní klasifikace nemocí – MKN-10). V léčbě se uplatňují především psychostimulancia a atomoxetin v kombinaci s psychoterapeutickými metodami. Dětský neurolog je často první odborný lékař, který dítě s ADHD vyšetřuje, a proto znalost příznaků, diagnostických a léčebných postupů přispívá ke správné péči o tyto pacienty.Klíčová slova:
porucha pozornosti s hyperaktivitou – exekutivní funkce – vývojová porucha mozkuÚvod
Porucha pozornosti s hyperaktivitou (ADHD) se svým výskytem u 4–12 % dětí řadí mezi nejčastější neuropsychiatrická onemocnění tohoto věku [1,2]. Mezi základní příznaky patří hyperaktivita, nepozornost a impulzivita. Příznaky trvají nejméně šest měsíců, objevují se již před sedmým rokem života v míře neodpovídající danému vývojovému věku a jsou patrny v různém prostředí. ADHD u 40–60 % pacientů přetrvává do dospělosti [2]. V dospělém věku jsou projevy méně charakteristické a mohou se skrývat pod obrazem deprese, úzkostné poruchy nebo poruchy osobnosti. Pacienti s neléčenou ADHD mají zvýšené riziko výskytu poruch chování, delikventního jednání a abúzu návykových látek. Včasná diagnostika a léčba ADHD tak může být pro další vývoj jedince a kvalitu jeho života rozhodující.
Historické poznámky a vývoj terminologie
První zprávy o ADHD pocházejí z roku 1902, kdy Still popsal skupinu pacientů s hyperaktivitou, nepozorností a problematickým chováním („deficitem morální kontroly“). Vyslovil předpoklad, že projevy jsou podloženy biologickými změnami, protože je nebylo možné vysvětlit zanedbáním výchovy nebo vlivem prostředí. Tato hypotéza byla podpořena v roce 1937, kdy Bradley zaznamenal pozitivní vliv léčby stimulancii na příznaky ADHD [3]. V 60. letech byla vypracována definice syndromu [4], pro který se začal používat název minimální mozkové postižení (minimal brain damage, minimal brain dysfunction) nebo lehká mozková dysfunkce (LMD). Předpokládalo se, že se jedná o difuzní poruchy mozku trvalého rázu vznikající především na podkladě prenatálního a perinatálního poškození [5]. LMD tak byla chápána jako „nejlehčí forma dětské mozkové obrny“ [6]. V 80. letech byla v americkém diagnostickém manuálu duševních poruch (DSM-III) a posléze v roce 1994 v DSM-IV přesně definována kritéria ADHD a rozdělení na tři základní podtypy [7]: s převládající poruchou pozornosti, s převládající hyperaktivitou a impulzivitou a smíšený typ. Podle Mezinárodní klasifikace nemocí 10. revize (MKN-10) odpovídá ADHD diagnóza F90.0 „porucha aktivity a pozornosti“, která je řazena pod hyperkinetické poruchy (F90) [8]. Pod hyperkinetické poruchy patří také „hyperkinetická porucha chování“ (F90.1), která je vyhrazena pro děti, u nichž se vyskytují zároveň symptomy poruchy chování, většinou lehčího rázu. V DSM-IV se přítomnost poruch chování kóduje samostatně, a není tedy součástí ADHD. V MKN-10 není na rozdíl od DSM-IV vyčleněn v kategorii hyperkinetických poruch subtyp s převládající poruchou pozornosti. Tyto klasifikační nesrovnalosti se odrážejí v údajích o epidemiologii ADHD a ztěžují srovnání výsledků výzkumných prací.
V našich podmínkách se setkáváme s oběma názvy – hyperkinetická porucha a porucha pozornosti s hyperaktivitou –ADHD. Termín lehká mozková dysfunkcese v klasifikaci nevyskytuje, a proto by seneměl používat. Z hlediska původníhokonceptu této poruchy se v našich zemíchpéče o pacienty tradičně soustřeďovalado rukou dětských neurologů. Současnýmstandardem je zajištění pedopsychiatrickéhovyšetření a léčby. Neurologickévyšetření zůstává důležitou součástíkomplexního posouzení dítěte s ADHD, včetně zhodnocení elektroencefalografického(EEG) nálezu, vyloučení epilepsie, jinýchneurologických onemocnění spojenýchs příznaky ADHD a poruchy spánkujako možného podkladu nepozornostia hyperaktivity.
Epidemiologie
ADHD je považována za vývojovou poruchumozku, která začíná v časném dětství,zvýrazňuje se ve školním věku a přetrváváv 40–60 % do dospělosti [2]. Pacientůs ADHD přibývá, ale pravděpodobně sejedná spíše o zlepšení diagnostiky nežo skutečný nárůst této poruchy. Údajeo prevalenci ovlivňuje do značné míry použitáklasifikace. Výskyt hyperkineticképoruchy se nejčastěji udává u 5–6 % dětsképopulace [1]. Kritéria DSM-IV jsou širšía měkčí než kritéria MKN-10 (tab. 1, 2), prevalence hodnocená podle DSM-IVse pohybuje mezi 8–12 % [2]. Výskytu dospělých je 1–4 %. ADHD je častějšíu chlapců, a to ve variabilním poměru 3–9 : 1 [1,9], v dospělosti je poměr obou pohlaví udáván 1 : 1 [10].
Tab. 1. Diagnostická kritéria hyperkinetické poruchy podle MKN-10. 
Tab. 2. Diagnostická kritéria pro ADHD podle DSM-IV. 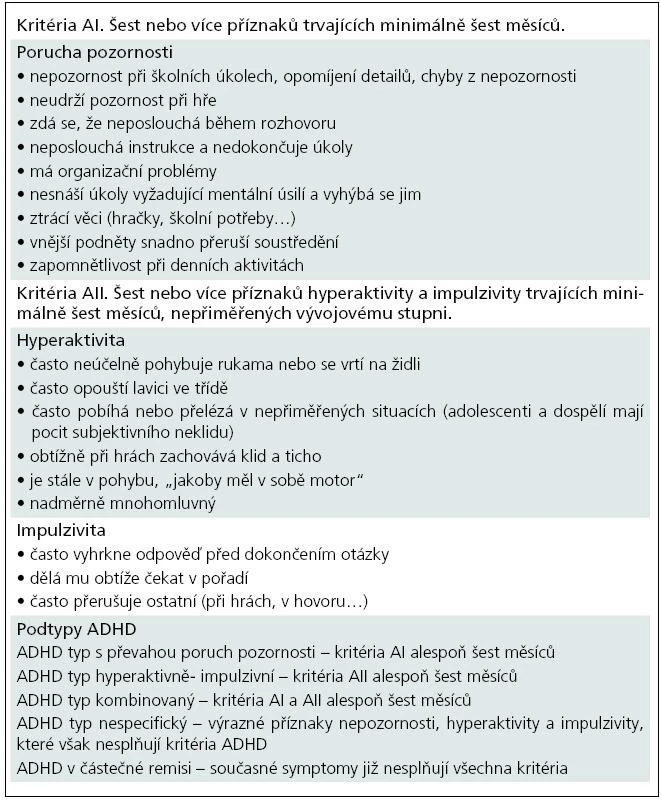
Etiologie a patogeneze
Klinické příznaky ADHD jsou způsobeny strukturálními a funkčními odchylkami v prefrontálním kortexu a subkortikálních oblastech, které se podílejí na řízení exekutivních funkcí. Předpokládá se, že značná část potíží je spojena s poruchou ve fronto-striato-thalamo-kortikálních okruzích, jež jsou důležité pro regulaci behaviorálních odpovědí, pozornosti a bdělosti (arousalu) [11]. Hlavními neurotransmitery v těchto oblastech jsou dopamin a noradrenalin. Katecholaminová hypotéza, která pokládala sníženou tvorbu nebo využití dopaminu a noradrenalinu v mozku za hlavní příčinu ADHD, byla vyslovena již v roce 1970 [12]. Předpokládá se, že hypofunkční katecholaminová projekce z oblasti bazálních ganglií do prefrontálního kortexu má za následek relativní hypoaktivitu kortikálního dopaminového systému a relativní hyperaktivitu
striatálního dopaminového systému [13]. Důkazem katecholaminové hypotézy v klinické praxi bylo zlepšení příznaků ADHD při léčbě stimulancii a jinými léky (atomoxetin, tricyklická antidepresiva), které zvyšují dopaminergní a noradrenergní přenos. Látky, jež ovlivňují pouze dopaminový systém (např. levodopa, amantadin), nebyly v léčbě ADHD účinné [14]. Pro poruchu v dopaminové oblasti svědčí studie uvádějící korelaci mezi sníženou hladinou kyseliny homovanilové, která je metabolitem dopaminu, v likvoru a mírou hyperaktivity a impulzivity [15]. U neléčených dětí s ADHD byla zjištěna zvýšená denzita receptorů dopaminového transportéru DAT1 ve striatu (o 17–70 %) a její úprava po léčbě metylfenidátem, který je blokátorem receptorů pro DAT1 [16,17].Zobrazovací vyšetření
Vyšetření centrální nervové soustavy (CNS) pomocí zobrazovacích a funkčních metod prokázalo řadu odchylek spojených s ADHD. Volumometrická měření pomocí magnetické rezonance (MR) zjistila změny objemu různých částí mozku: menší objem celého mozku (o 3–8 %), menší objem pravého frontálního laloku, zejména dorzolaterální části (o 8 %), nucleus caudatus (o 5–19 %) s převahou vpravo, globus pallidus (o 6 %), corpus callosum, mozečkových hemisfér a části vermis (o 12 %) [18–20]. Tyto změny byly patrny již ve věku šesti let, korelovaly s tíží příznaků ADHD a kromě objemu nucleus caudatus, který se upravoval do 18. roku, zůstávaly od dětství do adolescence neměnné a nezávislé na léčbě psychostimulancii [19]. Redukce objemu mozku se týkala více struktur pravé mozkové hemisféry; nebyla tedy zjištěna fyziologická asymetrie hemisfér ve prospěch pravé hemisféry jako u zdravých dětí, což svědčí pro odchylný vývoj mozku u ADHD [18–20]. Někteří autoři [21] prokázali také opožděnou kortikální maturaci u dětí s ADHD o tři roky s nejvýraznějším opožděním opět v oblasti frontálního laloku.
Funkční MR přináší důkazy o tom, že důsledkem odchylné maturace CNS je pozměněný vzorec mozkové aktivity u ADHD nejen v oblasti prefrontálního laloku a bazálních ganglií [22], ale i v dalších strukturách – mozečku a parietálním laloku. Průkazem nedokonalé motorické inhibice a abnormálního spojení mezi různými
regiony CNS jsou nálezy na funkční MR, kde je při motorických (ale také při pozornostních) testech patrná snížená neuronální aktivita ve fronto-striatálních okruzích, zejména v dorzolaterálním frontálním kortexu, a současně abnormní aktivace v parietálním kortexu a ventrálním prefrontálním kortexu [23–25]. Změny
klidové i funkční aktivity byly také prokázány v předním cingulu, které moduluje pozornost a selekci podnětů [26,27]. Zkoumá se úloha mozečku, jenž hraje roli v kognitivních funkcích a pozornosti a je spojen s prefrontálním okruhem. Dysfunkce cerebello-thalamo-prefrontálních okruhů může přispívat k poruše exekutivních funkcí u ADHD [28,29]. Předpokládá se, že nedostatečně funkční oblasti jsou ve své aktivitě nahrazovány oblastmi jinými [30].Genetické studie
Podle současných poznatků je ADHD multifaktoriálně podmíněná choroba daná interakcí mezi genetickými faktory a faktory prostředí. Jedná o onemocnění s výraznou genetickou predispozicí (77 %) a s předpokládanou polygenní dědičností [9,31]. Riziko vzniku ADHD u jednovaječných dvojčat je 11–18krát vyšší než u dvojvaječných a příbuzní prvního stupně trpí touto poruchou ve 20–25 % [32]. Byla identifikována řada kandidátních genů, které se vyskytují u jedinců s ADHD významně častěji [33]. Tyto geny mohou specificky ovlivňovat mozkovou neurotransmisi a některé fyziologické funkce. Alely spojené
s ADHD byly popsány na chromozomech 2q24, 5p13, 6q14, 6q13, 17p11. Zkoumány byly především geny, jež mají souvislost s dopaminovým systémem (gen pro dopaminový receptor DRD2, DRD4, dopaminový transportér DAT1, dopamin-β-hydroxylázu, katechol-O-metyltransferázu), ale také geny související s noradrenergním a serotoninergním systémem (gen pro monoaminooxidázu, serotoninový receptor 1B, serotoninový a noradrenalinový přenašeč) [34]. Nejvýraznější se ukazuje asociace s genem pro DRD4
a DAT1, což rovněž svědčí pro podstatnou úlohu dopaminu v patogenezi ADHD [31]. Dopaminový transportér zabezpečuje zpětné vychytávání dopaminu ze synaptické štěrbiny a dopaminový receptor D4 ovlivňuje postsynaptické působení dopaminu. Na zvířecích modelech je patrné, že myši postrádající gen pro DAT1 jsou výrazně hyperaktivní a nereagují na podávání psychostimulancií [35].Faktory vnějšího prostředí
Z vlivů prostředí je za rizikový faktor považována expozice alkoholu a kouření během těhotenství, nízká porodní hmotnost, úrazy hlavy v časném postnatálním období, okrajově je uváděn také vliv toxinů prostředí (umělých barviv v potravinách, radioaktivity). Expozice alkoholu během těhotenství působí zejména strukturální odchylky v mozečku; expozice nikotinu vede ke stimulaci nikotinových receptorů, které modulují dopaminergní aktivitu [33]. Působení olova během intrauterinního vývoje nebo postnatálně může mít za následek kognitivní poškození včetně příznaků ADHD [36]. Vnější faktory se pravděpodobně uplatní u jedinců s genetickou predispozicí, která obnáší sklon k selektivnímu vyčerpání dopaminu. Zevní vlivy jsou
pravděpodobně zodpovědné za 20–30 % případů ADHD [32].Klinické příznaky
U dětí s ADHD dochází k narušení exekutivních (seberegulujících) kognitivních funkcí, které jsou úzce spojeny s funkcí prefrontálního kortexu a modulovány subkortikálními strukturami. Hlavní příznaky
ADHD (hyperaktivita, porucha pozornosti a impulzivita) jsou klinickým vyjádřením této poruchy. Exekutivní funkce zahrnují plánování, řešení problémů, sebeovládání, včetně inhibice nepřiměřených odpovědí a řízení emocí. Patří do nich také pracovní paměť i pozornost a jsou úzce spojeny s udržováním bdělosti. Podle konceptu Barkleyho [11] je podkladem ADHD porucha inhibičních mechanizmů. Porucha pozornosti je pak
chápána jako důsledek této nedostatečné inhibice. Pacienti s ADHD nejsou schopni potlačit rušivé myšlenky a podněty, odložit akci a odměnu, podřizovat své chování vnitřní kontrole. Mají problémy s výběrem informací a s jejich dalším zpracováním. Výrazem nedostatečného útlumu v chování je také impulzivita, nízká frustrační
tolerance, hledání nových podnětů. V motorických projevech dominuje hyperaktivita jako neřízená, nadměrná, bezúčelná pohybová aktivita, trvalý hlasový a pohybový neklid. Často je patrná porucha pohybové koordinace a poruchy v oblasti percepční (porucha vizuomotorické koordinace, taktilní, sluchové a zrakové
diskriminace). Příznaky impulzivity a hyperaktivity se většinou projevují nebo zhoršují v situacích, které vyžadují soustředěnou pozornost či duševní úsilí a postrádají dojem novosti [32].Podle zastoupení klinických příznaků ADHD se na základě kritérií DSM-IV vydělují tři základní podtypy: s převládající poruchou pozornosti, s převládající hyperaktivitou a impulzivitou a smíšený typ. Nejčastější
je typ smíšený, který je následován typem s převládající poruchou pozornosti a nakonec typem s výraznou hyperaktivitou a impulzivitou. Typ s poruchou pozornosti pro svou nenápadnost častěji uniká diagnostice,
více se vyskytuje u dívek [37].Klinické příznaky se mění během dětství a dospívání v návaznosti na postupující vývoj mozku.
Klinické příznaky v závislosti na věku
V kojeneckém období se u dítěte projevuje porucha základních biorytmů. Kojenec špatně spí, má přehozený a narušený spánek, nepravidelnou a častou potřebu jídla s ublinkáváním. Dítě je nápadně dráždivé, často pláče. Psychomotorický vývoj bývá nerovnoměrný (např. dítě vynechá lezení, dříve se postaví než posadí).
V batolecím a předškolním věku se začíná projevovat nadměrná pohybová aktivita, děti jsou neklidné, střídají činnosti, hůře se soustředí, nevydrží sedět na místě. Patrná je afektivní labilita se záchvaty vzteku, nepřizpůsobivost, často se objevuje tendence k destruktivním hrám. Dlouho přetrvává období vzdoru. Děti mají problémy se sebeobsluhou, jsou méně obratné. Objevují se potíže s usínáním, častěji trvá noční pomočování.
Ve školním věku obraz ADHD krystalizuje do své charakteristické formy. Se stoupajícími nároky na udržení pozornosti, soustředění a pohybový klid se potíže stávají zřejmými, narušují vzdělávací proces a ztěžují přijetí dítěte vrstevníky, učiteli a často také rodiči. Dítě nevydrží sedět v lavici a být potichu, vyrušuje, není schopno dokončit úkol, naplánovat si činnosti, těká mezi různými předměty zájmu. Děti neposlouchají instrukce, zapomínají pomůcky, obtížně se zapojují do hry, která vyžaduje dodržování pravidel. Společenské projevy jsou nepřiměřené věku, familiární, nevhodné situaci. Děti jsou negativistické, nerespektují autority, mají
problémy v navazování vztahů. Dosahují horších školních výsledků, než by odpovídalo jejich intelektu (mimointelektové selhání). Školní výkony zhoršují přidružené poruchy učení, porucha jemné motoriky,
která ovlivňuje psaní, a porucha vizuomotorické koordinace (vázne rozlišení pravé a levé strany, rozlišení mezi celkem a částí, rozlišení velikosti a vzdálenosti). Asi u poloviny dětí dochází ke spontánnímu ústupu hyperaktivity před dosažením puberty, obvykle kolem 12. roku [37].V dospívání a dospělosti ADHD přetrvává u 40–60 % pacientů, ale příznaky se mění. Hyperaktivita ustupuje do pozadí (anebo se projevuje jako pocit vnitřního neklidu), přetrvává nepozornost a impulzivita.
Impulzivní, zkratkové jednání vede ke zvýšené nehodovosti a častějším úrazům [38]. Emoční nevyzrálost provází časté pocity nudy a rozlady [39]. Vzhledem ke snížené schopnosti sebeovládání a impulzivitě v dospívání existuje zvýšené riziko abúzu návykových látek nebo rozvoje poruch chování s vyhledáváním různých rizikových („adrenalinových“) aktivit a delikventním jednáním [36,40]. Často se vyskytuje deprese, úzkostná porucha nebo obsedantně-kompulzivní porucha [36,39]. Klinický obraz se pro ústup hyperaktivity
stává méně nápadným a pacienti s ADHD jsou nezřídka zařazeni pod základní diagnózu komorbidní poruchy nálady nebo poruchy osobnosti (specifická porucha osobnosti emočně nestabilní F 60.3 nebo disociální F 60.2) [39]. Za rizikové faktory pro rozvoj perzistentní formy ADHD je považován výskyt agresivity a poruch chování v časném věku, nízký intelekt, vzdorovitost vůči dospělým a chudé vztahy s vrstevníky. Při přetrvávání příznaků byl popsán také vyšší familiární výskyt ADHD [42].Dlouhodobé důsledky ADHD
ADHD je významný zdravotní problém, protože příznaky se projevují v řadě oblastí a snižují kvalitu života. V důsledku neléčené ADHD není dosahováno i při dobrém intelektu adekvátních školních výsledků, stupně vzdělání a následně pracovního uplatnění. Lidé s ADHD jsou často vyloučeni ze školy (32–40 %), zřídka dokončí vysokou školu (5–10 %) a zastávají nižší postavení v práci (70–80 %). ADHD je spojena s poruchou sociální adaptace (až v 50 %), užíváním návykových látek (ve 20–30 %) a delikventním chováním (v 60–75 %) [32]. Dochází častěji k úrazům a dopravním nehodám [38]. ADHD je také rizikovým faktorem pro rozvoj poruchy nálady a poruchy osobnosti v dospělém věku [32].
Komorbidní poruchy a onemocnění
U pacientů s ADHD se často vyskytují další onemocnění, především jiné psychiatrické poruchy, vývojové poruchy učení a motoriky, tiky. Údaje o prevalenci komorbidit se liší (tab. 3). Jako nejčastější (více než
u 50 % pacientů) je většinou uváděna porucha opozičního vzdoru a porucha chování. Velmi častá (u 50 %) je úzkostná porucha a vývojové poruchy učení a motoriky. Menší část pacientů (asi 20 %) má depresivní poruchu a tiky (10–15 %) [43–45]. Popisován je také častější výskyt bipolární poruchy u dětí s ADHD,
zejména v adolescenci [46], a obsedantně-kompulzivní poruchy. U dospělých stoupá výskyt deprese (50 %) a poruchy osobnosti (25 %), výskyt úzkostné poruchy zůstává podobný (50 %). Abúzus návykových látek je uváděn u 20–40 % pacientů [35,47]. Přítomnost komorbidních onemocnění zhoršuje prognózu pacienta a představuje zvýšené riziko přetrvávání ADHD do dospělosti [48]. Komorbidní onemocnění někdy v klinickém obraze dominuje a může vést k přehlédnutí ADHD jako základního onemocnění.Tab. 3. Výskyt komorbidních poruch u ADHD [43]. ![Výskyt komorbidních poruch u ADHD [43].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/32932401c130e8135745741185842189.jpg)
Častější jsou také poruchy spánku, které mohou zhoršovat hyperaktivitu a nesoustředěnost [49]. U ADHD byl
prokázán zvýšený výskyt syndromu neklidných nohou a periodických pohybů končetinami ve spánku [50]. Obě onemocnění mají za následek insomnii, nekvalitní spánek, denní ospalost. Podle údajů rodičů se vyskytují u 50–60 % dětí s ADHD různé problémy se spánkem (obtížné usínání, noční probouzení, neklidný spánek, měnlivá doba usínání a probouzení, zvýšená denní spavost) [51,52]. Tyto potíže jsou však do značné míry ovlivněny behaviorálními faktory a psychiatrickými komorbiditami [52,53]. Část dětí s ADHD a chronickou insomnií může mít poruchu cirkadiánní rytmicity ve smyslu zpožděné fáze spánku [54,55].ADHD je také nejčastější psychiatrickou komorbiditou u dětí s epilepsií [56]. Prevalence ADHD u epilepsie se pohybuje mezi 8 a 77 %, nejčastěji je uváděno 20–40 % [57–61]. Společný výskyt je natolik častý, že se uvažuje o společné etiopatogenezi obou onemocnění. Kognitivní a behaviorální projevy pacientů s epilepsií nelze hodnotit pouze jako následky opakovaných záchvatů či antiepileptické medikace [61]. Předpokládá se, že vývojová, geneticky daná porucha mozku se nejdříve projeví epileptiformními výboji, změnami kognitivních funkcí, jakož i chování a po vyčerpání kompenzačních mechanizmů posléze epileptickým záchvatem [62]. Na zvířecích modelech bylo prokázáno, že před vznikem prvního epileptického záchvatu se objevovaly poruchy učení, pozornosti a chování [63]. Také některé studie zaznamenaly, že projevy ADHD předcházely u dětí manifestaci epilepsie (viz níže) [58,60]. Nástup záchvatů je výsledkem komplexního
procesu epileptogeneze, který zahrnuje řetězec transkripčních změn zasahujících na úrovni plasticity, apoptózy a neurogeneze [61,63]. Zejména epileptická aktivita v oblastech spojených s exekutivními funkcemi může vést k rozvoji příznaků ADHD. S výskytem ADHD je nejvíce spojována epilepsie frontálního laloku a benigní dětská epilepsie s rolandickými hroty, z generalizovaných epilepsií zejména dětské absence [61]. ADHD u epilepsie vykazuje určité odlišnosti oproti výskytu v ostatní populaci; výskyt je stejný u obou pohlaví a převažuje typ s poruchou pozornosti [58–60]. Děti s epilepsií a ADHD měly 2–4krát vyšší pravděpodobnost zhoršení kvality života oproti pacientům bez ADHD [59]. Pacienti s epilepsií a ADHD tak mohou profitovat z léčby ADHD a naopak antiepileptická léčba může v některých případech zlepšovat příznaky ADHD. Předpokládaný prokonvulzivní efekt metylfenidátu nebyl potvrzen [64]. Současné studie prokazují bezpečnost podávání metylfenidátu u pacientů s ADHD a epilepsií nebo epileptiformní abnormitou na EEG [65,66]. Někteří autoři dokonce zaznamenali během léčby metylfenidátem zlepšení nebo vymizení EEG abnormity [67].O výskytu epilepsie u dětí s ADHD nejsou jednoznačné údaje. Některé studie zaznamenaly u dětí s nově diagnostikovanou epilepsií častější výskyt ADHD před začátkem manifestace epilepsie – u 31 % dětí [60] a 2,5krát častěji, než je výskyt v populaci [58].
Vyšetření a diagnostika ADHD
Diagnostika se opírá o klinický nález a je založena na hodnocení jádrových příznaků ADHD, které musí splňovat diagnostická kritéria podle DSM-IV nebo MKN-10 (tab. 1, 2) [7,8]. Diagnózu stanovuje dětský psychiatr na základě podrobného klinického vyšetření dítěte a pohovoru s rodičem. Lze využít také dotazníků
a škál včetně doplnění údajů od učitele (např. škála Connersové pro rodiče a učitele). V batolecím a někdy i v předškolním věku může být stanovení diagnózy obtížné vzhledem k velkým rozdílům v normě, projevy některých dětí mohou souviset s vrozeným temperamentem a osobnostními rysy. Nedílnou součástí vyšetření dítěte s ADHD je psychologické vyšetření. Kromě klinického hodnocení, pozorování dítěte a pohovoru jsou součástí psychologického vyšetření také testové baterie. Wechslerova škála inteligence (WISC-III) představuje základní nástroj v diagnostice ADHD. Používají se speciální testy pro posouzení pozornosti (např. Test cesty, Číselný čtverec), hodnotí se sluchové a zrakové precepční schopnosti (Zkouška sluchové analýzy nebo
diferenciace, Reverzní test), motorické a vizuomotorické schopnosti (obkreslování tvarů, kresba postavy). Pro vyšetření exekutivních funkcí, zejména paměti, slouží také např. Rey-Osterriethova komplexní figura nebo Paměťový test verbálního učení. V zahraničí jsou používány počítačové testy pozornosti (např. Continuous
Performance Task) [68]. U dospělých je diagnóza rovněž založena na kritériích DSM-IV; jako pomocné metody slouží škály (Connersové škála po dospělé nebo Wenderova škála) [41].Neurologické vyšetření
Vzhledem k novým poznatkům o etiologii ADHD a opuštěnému konceptu mozkového postižení způsobeného podobnými faktory jako dětská mozková obrna je patrná tendence k přesouvání péče o pacienty ADHD do rukou dětských psychiatrů. Nepostradatelnou úlohou dětského neurologa při vyšetření dítěte s příznaky
ADHD je posouzení vývojových schopností dítěte, vyloučení epilepsie a jiných neurologických onemocnění a zhodnocení EEG nálezu. Řada dětí s ADHD zůstává ve sledování dětského neurologa pro komorbidní neurologická onemocnění (zejména epilepsii, poruchy spánku, bolesti hlavy) [64]. Dětský neurolog tak představuje stále důležitou součást multidisciplinárního týmu pečujícího o děti s ADHD.Při neurologickém vyšetření mohou být patrny tzv. drobné neurologické příznaky, soft signs. Pro jejich hodnocení byla vypracována řada testů [6]. U dětí s ADHD jsou často zjevné poruchy okulomotoriky
(neplynulé sledování, strabizmus), mozečkové příznaky (porucha jemné i hrubé motoriky – vázne koordinace prstů, souhyby při chůzi, poskoky), neklidná statická inervace na končetinách (choreiformní dyskinézy ve výdrži), asymetrie reflexů či pozitivní pyramidové jevy iritační. Motorické poruchy jsou podle MKN 10 klasifikovány jako „specifická vývojová porucha motorických funkcí“ (F82) [8] nebo „vývojová porucha koordinace“ podle DSM-IV (pokud jsou tyto příznaky vyjádřeny ve výrazné míře narušující běžné aktivity dítěte) [7]. Jedná se o komorbidní poruchu, která se vyskytuje u 30–50 % dětí s ADHD [43]. Diskrétní poruchy jemné motoriky, rovnováhy a koordinace jsou však podle některých studií součástí celkového
klinického obrazu [69]. Nedokonalá motorická inhibice u ADHD je považována za další projev poruchy frontostriatálního systému a dopaminergní dysfunkce [69,70] nebo za projev porušené funkce mozečku a jeho spojů s frontálním motorickým kortexem [28,69].Nálezy na EEG
U 30–90 % dětí jsou patrny difuzní nespecifické abnormity, zpomalená základní aktivita vzhledem k věku nebo výskyt pomalých vln biokcipitálně [71]. Tyto změny jsou sice pro děti s ADHD typické, ale jsou nespecifické a nemohou potvrdit diagnózu. 6–30 % dětí s ADHD mělo na EEG epileptiformní projevy, zejména fokální, oproti 2–3 % v dětské populaci [72–75]. Během nočního spánku byly epileptiformní
výboje zjevné až u 53 % dětí s ADHD [76]. Praktický význam těchto abnormit není zcela objasněn. Některé studie prokázaly častější výskyt rolandických hrotů u dětí s ADHD [72,74,76], jejich spojení s výraznějšími příznaky hyperaktivity a impulzivity [72,77] a předpokládají, že rolandické výboje přispívají k manifestaci
ADHD, uspíší začátek příznaků a zhoršují průběh. Podle jedné studie zvyšovala epileptiformní abnormita na EEG u dětí s ADHD riziko výskytu křečí na 20 % proti dětem bez epileptiformní abnormity, u nichž bylo riziko stejné jako v běžné populaci [74]. Někteří autoři proto doporučují provedení EEG u všech dětí s ADHD [72,78]. V současnosti však není spolehlivě prokázáno, že epileptiformní abnormita na EEG u dětí s ADHD je spojena s vyšším rizikem rozvoje epilepsie [66].Subklinické epileptiformní výboje (generalizované i fokální) mohou být až v 50 % provázeny lehkými poruchami pozornosti, percepce, paměti a jiných kognitivních funkcí – „tranzientní kognitivní poškození“ (transitory cognitive impairment) [79–82]. U dětí s rolandickými hroty byl popsány kognitivní změny a poruchy chování podobné jako u ADHD [83,84]. Na užití terapie antiepileptiky u ADHD s epileptiformními výboji na EEG bez prokazatelných klinických záchvatů jsou kontroverzní názory. Podle některých autorů může antiepileptická léčba zlepšit kognitivní deficit nebo zastavit jeho progresi [80–82]. Popisován je příznivý
efekt terapie levetiracetamem [85] a sultiamem [86].Diferenciální diagnostika
Podrobný přehled onemocnění zvažovaných v diferenciální diagnostice je uveden v tab. 4. Důležité je odlišení epileptických záchvatů typu absencí nebo temporálních záchvatů, které mohou působit jako poruchy pozornosti. U frontální epilepsie mohou být rysy podobné ADHD – impulzivita, desinhibice, podrážděnost [62]. Příznaky hyperaktivity a nesoustředěnosti někdy předcházejí rozvoji neurologické symptomatologie u vzácných neurometabolických onemocnění. Doprovázejí některá neurologická onemocnění (tuberózní
skleróza, neurofibromatóza I. typu) a genetické syndromy. Z celkových onemocnění se podobné příznaky vyskytují jako součást klinického obrazu u poruch funkce štítné žlázy. Poruchy sluchu a zraku mohou mylně působit jako nepozornost a snižovat školní výkon. Také některé léky (např. antiepileptika a antihistaminika)
ovlivňují kognitivní funkce a chování. U starších dětí a adolescentů přichází v úvahu zneužívání návykových
látek. V diferenciální diagnostice je nutné vyloučit jiná psychiatrická onemocnění, která jsou navíc často komorbidní s ADHD, jako hlavní příčinu potíží. Největším problémem může být odlišení bipolární afektivní poruchy.Tab. 4. Diferenciální diagnostika ADHD. 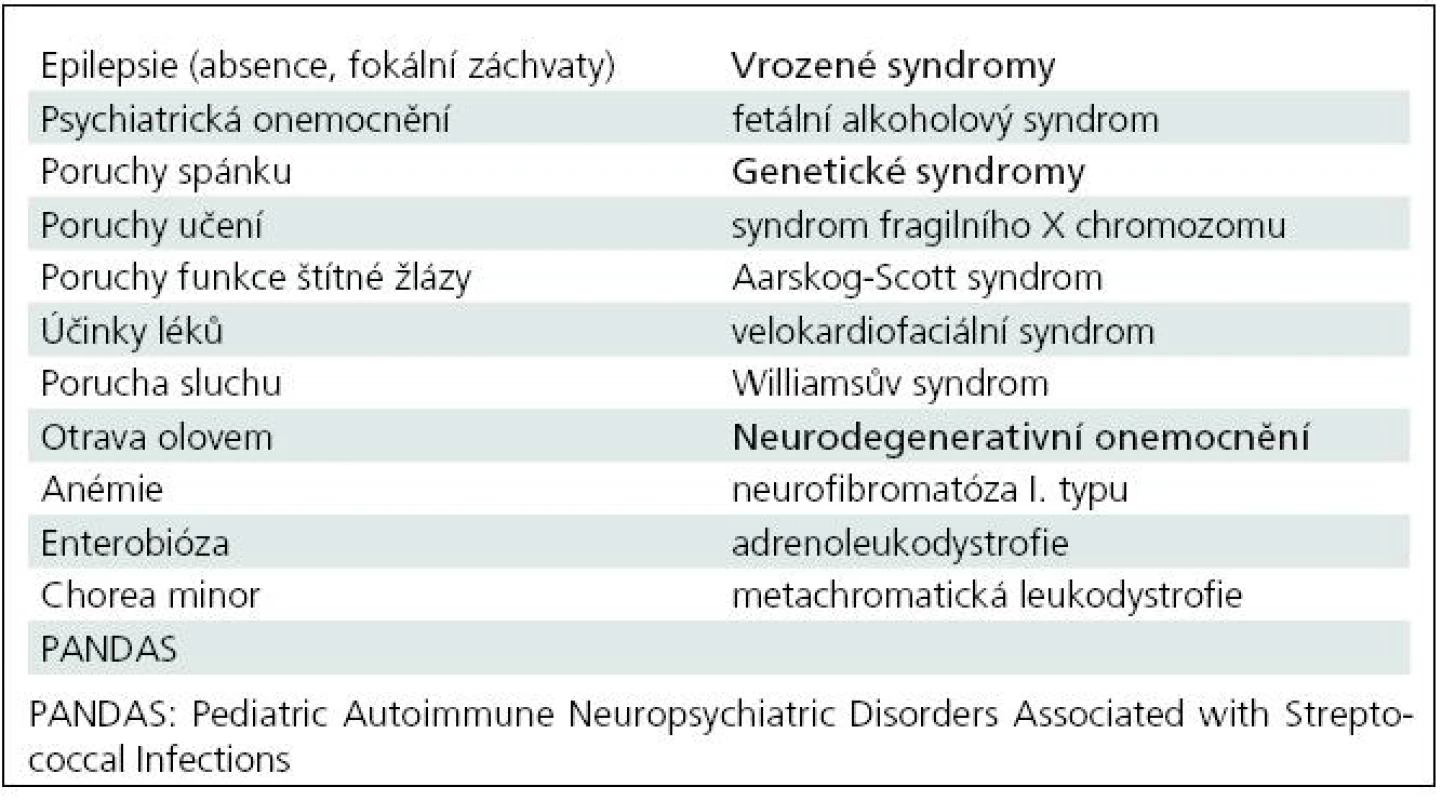
Projevy ADHD mohou napodobovat také primární poruchy spánku, především obstrukční spánková apnoe, syndrom neklidných nohou a periodické pohyby končetinami ve spánku [49]. Chronická spánková deprivace způsobuje v dětském věku změny kognitivních funkcí a chování, které připomínají příznaky ADHD. Dítě se
hůře soustředí, je nepozorné a ospalost během dne překonává hyperaktivitou. Léčba spánkové poruchy může odstranit nebo zmírnit příznaky ADHD.Příznaky hyperaktivity mohou být patrny také u pacientů s autizmem a s mentální retardací. Ačkoliv část pacientů s pervazivní vývojovou poruchou má klinicky významný hyperaktivní syndrom, ani jeden z diagnostických manuálů nepřipouští diagnostikovat současně dětský autizmus a hyperkinetickou poruchu nebo ADHD.
U lehkých mentálních retardací nemají být klasifikovány jako ADHD poruchy pozornosti a školního výkonu, které jsou součástí základní diagnózy. U těžkých mentálních retardací se často objevuje hyperaktivní chování a problémy s pozorností, včetně pohybových stereotypií. Neklasifikují se podle MKN-10 jako hyperkinetická porucha, ale jako „hyperaktivní porucha sdružená s mentální retardací a stereotypními pohyby“(F 84.4) [8].
Léčba a péče o dítě s ADHD
Léčba musí být komplexní, zaměřená jak na dítě, tak na rodinné i školní prostředí [32,87]. Spočívá v přístupu farmakologickém v kombinaci s psychoterapií a s režimovými opatřeními [32,87–89].Péče o dítě s ADHD je multidisciplinární. Podílejí se na ni obvykle lékaři (dětský lékař, dětský psychiatr, dětský neurolog), psychologové, pedagogové a speciální pedagogové, často také logoped. Nutná je vždy edukace rodiny a školy. Děti mají mít speciální vzdělávací program, odlišně strukturované prostředí, případně odlišný systém klasifikace. Důležitý je také trénink školních dovedností a vizuomotorické koordinace a nácvik sebekontroly. Nezbytnou součástí léčby je psychoterapie, která pomáhá z dlouhodobého hlediska modifikovat chování dítěte pozitivním posilováním. Dobře se uplatňuje kognitivně-behaviorální terapie v rámci psychoterapeutické práce s rodinou.
Základním léčebným přístupem je farmakoterapie [44,87–90]. Ačkoliv velká část dětí s ADHD farmakologickou léčbu potřebuje, je rozhodnutí o zahájení této léčby individuální, bere v úvahu nejen závažnost klinických příznaků, komorbidní onemocnění, ale také míru tolerance ze strany rodiny a školy a souhlas rodičů s farmakologickou terapií [89–91]. Nejlepší výsledky jsou patrny při kombinaci farmakologické léčby a psychoterapie [44,87,89]. Tato kombinace vedla ke snížení nezbytné dávky léků, a tím samozřejmě
i k omezení nežádoucích účinků [44,87]. Včasné zahájení behaviorálních a psychoterapeutických intervencí má proto zásadní význam z hlediska dlouhodobé terapie ADHD [87].Současné standardy farmakologické léčby doporučují jako léčbu první volby použití psychostimulancií, především metylfenidátu (v zahraničí se používá také amfetamin a jeho deriváty) (tab. 5) [90,92–94]. Použití psychostimulancií je v léčbě ADHD ověřené již po dobu 70 let řadou studií s prokázaným účinkem u 70–90 % dětí s ADHD. Metylfenidát se váže selektivně na dopaminový transportér a zabraňuje zpětnému vychytávání dopaminu, ale má také určitou afinitu k transportéru pro noradrenalin a kompenzuje tak neurotransmiterovou poruchu v oblasti katecholaminů. Příznivě ovlivňuje všechny základní příznaky ADHD. Používané dávky jsou 5 – 60 mg/den ve 2–3 denních dávkách vzhledem ke krátkému poločasu (2–3 hod) [87,88]. Začíná se dávkou 5 mg 1–2krát denně a po týdnu se zvyšuje o 5–10 mg s pečlivým vyhodnocováním efektu a titrováním optimální dávky. Zlepšení se objevuje již během prvního týdne. Nedojde-li ke zlepšení do jednoho měsíce, doporučuje se léčbu ukončit. Léčba se může vynechávat během víkendů nebo prázdnin.
Nežádoucí účinky jsou nespavost, bolest hlavy a břicha, nechutenství, úbytek na váze, někdy dráždivost a plačtivost, některé studie popisovaly růstovou retardaci. Během léčby se doporučuje sledovat výšku a váhu. Nebyl prokázán podíl stimulancií na vzniku tikové poruchy [95], ani zhoršení pacientů s epilepsií při podávání
metylfenidátu. Proto tato onemocnění nejsou kontraindikací k jejich podávání [65,66]. ADHD je spojena s tikovou poruchou jako komorbidním onemocněním a je pravděpodobné, že léčba stimulancii v některých případech může přispět k časnější manifestaci [95]. Závěry studií u pacientů s Touretteovým syndromem v současné době nenacházejí zvýšené riziko aktivace tiků při léčbě stimulancii [96]. Podle současných doporučení je při komorbidní tikové poruše upřednostňována léčba atomoxetinem [90,94].Tab. 5. Léky používané v léčbě ADHD a jejich dávkování [87]. ![Léky používané v léčbě ADHD a jejich dávkování [87].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/5a6c326335c5e13f07e823d4941cd2d2.jpg)
Nebyla rovněž prokázána souvislost medikace stimulancii a rizikem rozvoje drogové závislosti. Naopak léčba měla protektivní účinek a snižovala riziko užívání návykových látek o 50 % [87]. Zvýšené riziko úmrtí v souvislosti s psychostimulancii nebylo u dětí bez kardiovaskulárního onemocnění potvrzeno, takže není
nutné rutinně provádět kardiologické vyšetření před zahájením terapie. Metylfenidát je kontraindikován u dětí s kardiovaskulárním onemocněním (poruchy rytmu, kardiomyopatie) a s výskytem náhlých úmrtí v rodinné anamnéze [87]. Opatrnosti je potřeba u výrazné deprese a úzkosti, anorexie a lékové závislosti. Léčba je
zahajována krátkodobě působícím metylfenidátem [87,88]. Na našem trhu je rovněž dostupný metylfenidát s postupným uvolňováním a s poločasem 12 hodin.Podávání stimulancií se doporučuje až ve školním věku, protože u předškolních dětí jsou jejich účinky variabilní a účinnost není dostatečně ověřena. Stimulacia jsou předškolním dětem předepisována jenom tehdy, když příznaky ADHD jsou závažné. Dávky se pohybují mezi 2,5–30 mg/den nebo 0,15–1 mg/ kg s opatrným titrováním dávky. Byl pozorován vyšší výskyt nežádoucích účinků, jako je podrážděnost a plačtivost. Doporučeno je léčit šest měsíců a pak vyhodnotit efekt, protože příznaky mohou v této věkové skupině vymizet [87].
Na úroveň léčby první volby se dostává atomoxetin, který není klasické psychostimulans [92–94]. Působí především na noradrenergní systém (jako inhibitor presynatického noradrenalinového transportéru), ale pravděpodobně zvyšuje také koncentraci dopaminu v prefrontálním kortexu [97]. Léčba se zahajuje dávkou
0,5 mg/ kg/den a postupně se zvyšuje na dávku 1–1,2 mg/ kg/den. Plný účinek léčby se dostavuje až mezi 4. a 6. týdnem podávání.Má kontinuální efekt 24 hodin, dokáže tlumit příznaky ADHD ve večerních hodinách, ve kterých se již neuplatňuje účinek stimulancií, a jeho efekt přetrvává do rána dalšího dne. Mezi klasickými psychostimulancii a atomoxetinem není podstatný rozdíl stran účinnosti. Atomoxetin prokázal účinnost nejen v léčbě nekomplikovaných forem ADHD, ale také v případech ADHD s některými komorbidními poruchami, u kterých je efekt metylfenidátu nejistý nebo přímo může symptomatologii zhoršit [87,88]. Je preferován hlavně
u pacientů s problémem drogové závislosti nebo s komorbidními poruchami – anxietou, poruchou opozičního vzdoru a tiky [87,90]. Nezvyšuje koncentraci dopaminu v oblasti nucleus accumbens a ve striatu (na rozdíl od stimulancií), proto léčba není komplikovaná zhoršením nebo rozvojem tiků, rizikem zneužívání nebo vznikem závislosti [89,90,93]. Osvědčuje se také při poruchách spánku, zkracuje délku usnutí [98]. Nežádoucí účinky jsou sucho v ústech, nespavost, nauzea, nechutenství, obstipace. V České republice je preskripce omezena na dětské psychiatry a vyhrazena pro případy, kdy rodiče léčbu stimulancii odmítají, kdy byla léčba metylfenidátem neúspěšná nebo je nevhodná pro komorbidní poruchy [98].Léčba metylfenidátem a atomoxetinem je doporučována také u dospělých [88]. Základní údaje o metylfenidátu a atomoxetinu jsou uvedeny v tab. 5.
V léčbě ADHD byl také úspěšně použit modafinil, který zvyšuje centrální aktivitu sympatiku agonistickým působením na adrenergní alfa1-receptory a zřejmě stimuluje rovněž dopaminergní přenos. Jeho účinek nebyl větší než účinek stimulancií [93] a vzhledem k riziku kožní hypersenzitivity a neuropsychiatrických poruch je jedinou jeho indikací v současnosti narkolepsie.
Další možností léčby je podávání antidepresiv – tricyklických, inhibitorů zpětného vychytávání serotoninu nebo bupropionu. Jsou indikována zejména při komorbidní úzkostné poruše, depresi nebo obsedantně-kompulzivní poruše [87,88]. Tricyklická antidepresiva mohou mít nežádoucí účinky na kardiovaskulární systém (arytmie, riziko náhlého úmrtí), proto se doporučuje vstupní elektrokardiografické vyšetření a jeho opakování v průběhu léčby [88].
Doporučován je bupropion, monocyklické antidepresivum jako alternativa při neodpovídavosti na stimulancia a atomoxetin. Léky ze skupiny antihypertenziv (alfa adrenergní agonisté), především klonidin, se u nás neužívají.
U pacientů s ADHD a poruchami chování se osvědčuje risperidon, řazený mezi atypická neuroleptika. Používá se nejčastěji jako přídatná léčba k metylfenidátu, u pacientů s hmotností pod 50 kg v počáteční
dávce 0,25 mg/den s postupným zvyšováním do 1–2 mg/den [87].Pro tymoprofylaktické působení se v některých případech používají také antiepileptika (karbamazepin, valproát, lamotrigin) [32,88].
Zkratky
- ADHD - porucha pozornosti s hyperaktivitou
- DSM-IV - Diagnostický a statistický manuál duševních poruch, IV. verze
- MKN-10 - Mezinárodní klasifikace nemocí, 10. revize
- ICD-10 - International Classification of Diseases, Tenth Revision
- LMD - lehká mozková dysfunkce
- DSM-III - Diagnostický a statistický manuál duševních poruch, III. verze
- EEG - elektroencefalografie
- DAT1 - dopaminový transportér 1
- CNS - centrální nervová soustava
- MR - magnetická rezonance
- DRD - dopaminový receptor
Podpořeno výzkumným záměrem MŠM 0021620849
MUDr. Iva Příhodová, Ph.D.
Neurologická klinika a Centrum klinických neurověd 1. LF UK a VFN
Kateřinská 30
128 00 Praha 2
e-mail: iprih@lf1.cuni.czPřijato k recenzi: 2. 5. 2011
Přijato do tisku: 11. 7. 2011Recenzenti:
doc. MUDr. Hana Ošlejšková, Ph.D.
prof. MUDr. Ivana Drtílková, CSc.
doc. MUDr. Ivo Paclt, CSc.MUDr. Iva Příhodová, Ph.D.
Iva Příhodová studovala Fakultu dětského lékařství Univerzity Karlovy v letech 1982–1988. Po promoci pracovala jako sekundární lékařka na dětském oddělení okresní nemocnice v Havlíčkově Brodě (do roku 1993). V roce 1991 složila atestaci prvního stupně z dětského lékařství. Od roku 1993 pracuje na Neurologické klinice 1. LF UK a VFN, v současné době jako odborný asistent. V roce 1995 složila nástavbovou atestaci z dětské neurologie, v roce 1998 atestaci z neurologie, získala odbornou způsobilost v elektroencefalografii a spánkové medicíně. Kromě dětské neurologie se věnuje problematice spánkové medicíny dětí i dospělých. V roce 2010 ukončila postgraduální doktorské studium v oboru neurovědy na téma poruchy spánku u dětí s ADHD. Je autor nebo spoluautor 16 původních článků, z toho 12 publikovaných v časopisech s IF, a čtyř kapitol v monografii.
Zdroje
1. Polanczyk G, de Lima MS, Horta BL, Biederman J, Rohde LA. The worldwide prevalence of ADHD: a systematic review and metaregression analysis. Am J Psychiatry 2007; 164(6): 942–948.
2. Biederman J, Faraone SV. Attention-deficit hyperactivity disorder. Lancet 2005; 366(9481): 237–248.
3. Bradley C. The behavior of children receiving benzedrine. Am J Psychiatry 1937; 94 : 577–585.
4. Clements SD, Peters JE. Minimal brain dysfunctions in the school-age children. Diagnosis and treatment. Arch Gen Psychiatry 1962; 6 : 185–197.
5. Třesohlavá Z et al. Lehká mozková dysfunkce v dětském věku. 2nd ed. Praha: Avicenum 1983.
6. Lesný I. Malá mozková postižení. In: Lesný I (ed). Dětská neurologie. Praha: Avicenum 1980 : 234–238.
7. American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders, 4th ed. Washington: American Psychiatric Association 1994.
8. Mezinárodní klasifikace nemocí, 10. revize. Duševní poruchy a poruchy chování. Diagnostická kritéria pro výzkum. Praha: Psychiatrické centrum 1996.
9. Paclt I, Florian J. Deficit pozornosti u hyperaktivních dětí. Čes Slov Psychiatr 1996; 1 : 23–40.
10. Faraone SV, Biederman J, Mick E. The age-dependent decline of attention deficit hyperactivity disorder: a meta-analysis of follow-up studies. Psychol Med 2006; 36(2): 159–165.
11. Barkley RA. Behavioral inhibition, sustained attention, and executive function: constructing a unifying theory of ADHD. Psychol Bull 1997; 121(1): 65–94.
12. Drtílková I. Současné názory na biologické příčiny hyperkinetické poruchy. In: Drtílková I (ed). Hyperkinetická porucha: ADHD. Praha: Galén 2007 : 41–54.
13. Todd RD, Botteron KN. Is attention-deficit/hyperactivity disorder and energy deficiency syndrome? Biol Psychiatr 2001; 50(3): 151–158.
14. Pliszka SR. The neuropsychopharmacology of attention-deficit hyperactivity disorder. Biol Psychiatry 2005; 57(11): 1385–1390.
15. Castellanos FX, Elia J, Kruesi MJ, Gulotta CS, Mefford IN, Potter WZ et al. Cerebrospinal fluid monoamine metabolites in boys with attention-deficit hyperactivity disorder. Psychiatry Res 1994; 52(3): 305–316.
16. Krause KH, Dresel SH, Krause J, Kung HF, Tatsch K. Increased striatal dopamine transporter in adult patients with attention deficit hyperactivity disorder: effects of methylphenidate as measured by single photon emission computed tomography. Neurosci Lett 2000; 285(2): 107–110.
17. Feron FJ, Hendriksen JG, van Kroonenburgh MJ, Blom-Coenjaerts C, Kessels AG, Jolles J et al. Dopamine transporter in attention-deficit hyperactivity disorder normalizes after cessation of methylphenidate. Pediatr Neurol 2005; 33(3): 179–183.
18. Castellanos FX, Giedd JN, Marsh WL, Hamburger SD, Vaituzis AC, Dickstein DP et al. Quantitative brain magnetic resonance imaging in attention-deficit hyperactivity disorder. Arch Gen Psychiatry 1996; 53(7): 607–616.
19. Castellanos FX, Lee PP, Sharp W, Jeffries NO, Greenstein DK, Clasen LS et al. Developmental trajectories of brain volume abnormalities in children and adolescents with attention-deficit/hyperactivity disorder. JAMA 2002; 288(14): 1740–1748.
20. Hill DE, Yeo RA, Campbell RA, Hart B, Vigil J, Brooks W. Magnetic resonance imaging correlates of attention-deficit/hyperactivity disorder in children. Neuropsychology 2003; 17(3): 496–506.
21. Shaw P, Lerch J, Greenstein D, Sharp W, Clasen L, Evans A et al. Longitudinal mapping of cortical thickness and clinical outcome in children and adolescents with attention-deficit/hyperactivity disorder. Arch Gen Psychiatry 2006; 63(5): 540–549.
22. Rubia K, Overmeyer S, Taylor E, Brammer M, Williams SC, Simmons A et al. Hypofrontality in attention deficit hyperactivity disorder during higherorder motor control: a study with functional MRI. Am J Psychiatry 1999; 156(6): 891–896.
23. Silk T, Vance A, Rinehart N, Egan G, O‘Boyle M, Bradshaw JL et al. Fronto-parietal activation in attention-deficit hyperactivity disorder, combined type: functional magnetic resonance imaging study. Br J Psychiatry 2005; 187(3): 282–283.
24. Konrad K, Neufang S, Hanisch C, Fink GR, Herpertz-Dahlmann B. Dysfunctional attentional networks in children with attention deficit/hyperactivity
disorder: evidence from an event-related functional magnetic resonance imaging study. Biol Psychiatry 2006; 59(7): 643–651.
25. Vance A, Silk TJ, Casey M, Rinehart NJ, Bradshaw JL, Bellgrove MA et al. Right parietal dysfunction in children with attention deficit hyperactivity disorder, combined type: a functional MRI study. Mol Psychiatry 2007; 12(9): 826–832.
26. Tian L, Jiang T, Wang Y, Zang Y, He Y, Liang M et al. Altered resting-state functional connectivity patterns of anterior cingulate cortex in adolescents with attention deficit hyperactivity disorder. Neurosci Lett 2006; 400(1–2): 39–43.
27. Bush G, Frazier JA, Rauch SL, Seidman LJ, Whalen PJ, Jenike MA et al. Anterior cingulate cortex dysfunction in attention-deficit/hyperactivity disorder revealed by fMRI and the Counting Stroop. Biol Psychiatry 1999; 45(12): 1542–1552.
28. Berquin PC, Giedd JN, Jacobsen LK, Hamburger SD, Krain AL, Rapoport JL et al. Cerebellum in attention-deficit hyperactivity disorder: a morphometric MRI study. Neurology 1998; 50(4): 1087–1093.
29. Anderson CM, Polcari A, Lowen SB, Renshaw PF, Teicher MH. Effects of methylphenidate on functional magnetic resonance relaxometry of the cerebellar vermis in boys with ADHD. Am J Psychiatry 2002; 159(8): 1322–1328.
30. Bush G, Valera EM, Seidman IJ. Functional neuroimaging of ADHD: a review and suggested future directions. Biol Psychiatr 2005; 57(11): 1273–1284.
31. Faraone SV, Doyle AE. The nature and heritability of attention-deficit/hyperactivity disorder. Child Adolesc Psychiatr Clin N Am 2001; 10(2): 299–316.
32. Malá E. Hyperkinetické poruchy. Pediatr pro Praxi 2002; 3(1): 14–17.
33. Curatolo P, Paloscia C, D´Agati E, Moavero R, Pasini A. The neurobiology of attention deficit/hyperactivity disorder. Eur J Pediatr Neurol 2009; 13(4): 299–304.
34. Paclt I, Koudelová J, Krepelová A, Uhlíková P, Gazdíková M, Bauer P. Biochemical markers and genetic research of ADHD. Neuro Endocrinol Lett 2005; 26(4): 423–430.
35. Maher BS, Marazita ML, Ferrell RE, Vanyukov MM. Dopamine system genes and attention deficit hyperactivity disorder: a meta-analysis. Psychiatr Genet 2002; 12(4): 207–215.
36. Biederman J. ADHD, a selective overview. Biol Psychiatry 2005; 57(11): 1215–1220.
37. Drtílková I. Klinický obraz. In: Drtílková I (ed). Hyperkinetická porucha ADHD. Praha: Galén 2007 : 73–78.
38. Barkley RA, Murphy KR, Kwasnik D. Increased traffic violations and motor vehicle accidents in adolescents and adults with ADHD. Pediatrics 1996; 98(6):1089–1095.
39. Paclt I. Hyperkinetický syndrom v dospělosti. Remedia 2001; 11(6): 401–411.
40. Barkley RA, Fischer M, Smallish L, Fletcher K. The persistence of ADHD into young adulthood as a function of reporting source and definition of disorder. J Abnorm Psychol 2002; 111(2): 279–289.
41. Paclt I. Diagnostika hyperkinetického syndromu v dospělosti. Psychiatr pro praxi 2002; 3(3): 115–117
42. Faraone SV, Biederman J, Spencer T, Wilens T, Seidman LJ, Mick E et al. Attention-deficit/hyperactivity disorder in adults: an overview. Biological Psychiatry 2000; 48(1): 9–20.
43. Paclt I. Vývojové aspekty jednotlivých nosografických skupin a hyperkinetický syndrom. In: Paclt I (ed). Hyperkinetická porucha a poruchy chování. Praha: Grada 2007 : 69–75.
44. MTA Cooperative group. A 14-month randomized clinical trial of treatment strategies for ADHD. The MTA cooperative group. Multimodal treatment study of children with ADHD. Arch Gen Psychiatry 1999; 5(12): 1073–1086.
45. Jensen PS, Hinshaw S, Kraemer H, Lenora NBS, Newcorn JH, Abikoff HB et al. ADHD comorbidity findings from the MTA study: comparing comorbid subgroups. J Am Acad Child Adolesc Psychiatry 2001; 40(2): 147–158.
46. Sachs GS, Baldassano F, Truman C, Guille C. Comorbidity of ADHD with early and late onset bipolar disorder. Am J Psychiatry 2000; 157(3): 466–470.
47. Barkley RA. Major life activity and health outcomes associated with attention-deficit/hyperactivity disorder. J Clin Psychiatry 2002; 63 (Suppl 12): 10–15.
48. Drtílková I. Komorbidní poruchy u hyperkinetické poruchy (ADHD) a jejich léčba. In: Drtílková I (ed). Hyperkinetická porucha. Praha: Galén 2007 : 183–199.
49. Příhodová I. Nevšímalová S. Spánek a porucha pozornosti s hyperaktivitou - souhrn současných poznatků. Ces Slov Psychiatr 2006; 102(2): 80–84.
50. Sadeh A, Pergamin L, Bar-Haim Y. Sleep in children with attention-deficit hyperactivity disorder: a meta-analysis of polysomnographic studies. Sleep Med Rev 2006; 10(6): 381–398.
51. Corkum P, Tannock R, Moldofsky H. Sleep disturbances in children with attention-deficit/hyperactivity disorder J Am Acad Child Adolesc Psychiatry 1998; 37(6): 637–646.
52. Owens J, Maxim R, Nobile C, McGuinn M, Msall M. Parental and self-report of sleep in children with attention deficit/hyperactivity disorder. Arch Pediatr Adolesc Med 2000; 154(6): 549–555.
53. Prihodova I, Paclt I, Kemlink D, Skibova J, Ptacek R, Nevsimalova S. Sleep disorders and daytime sleepiness in children with attention-deficit/hyperactivity disorder: a two-night polysomnographic study with a multiple sleep latency test. Sleep Med 2010; 11(9): 922–928.
54. Gruber R, Sadeh A, Raviv A. Instability of sleep patterns in children with attention-deficit/hyperactivity disorder. J Am Acad Child Adolesc Psychiatry 2000; 39(4): 495–501.
55. van der Heijden KB, Smith MG, Van Someren EJ, Gunning WB. Idiopathic chronic sleep onset insomnia in attention-deficit/hyperactivity disorder: a circadian rhythm sleep disorder. Chronobiol Int 2005; 22(3): 559–570.
56. Salpekar JA, Foster LF. Comorbid attention deficit hyperactivity disorder and epilepsy. US Pediatr Rev 2007 : 27–28.
57. Dunn DW, Austin JK, Harezlak J, Ambrosius WT. ADHD and epilepsy in childhood. Dev Med Child Neurol 2003; 45(1): 50–54.
58. Hesdorffer DC, Ludvigsson P, Olafsson E, Gudmundsson G, Kjartansson O, Hauser WA. ADHD as a risk factor for incident unprovoked seizures and epilepsy in children. Arch Gen Psychaitry 2004; 61(7): 731–736.
59. Sherman EMS, Slick DJ, Connolly MB, Eyrl KL. ADHD, neurological correlates and quality of life in severe pediatric epilepsy. Epilepsia 2007; 48(6): 1083–1091.
60. Hermann B, Jones J, Dabbs K, Allen CA, Sheth R, Fine J et al. The frequency, complications and etiology of ADHD in new onset pediatric epilepsy. Brain 2007; 130(12): 3135–3148.
61. Cahová P, Pejčochová J, Ošlejšková H. Hyperkinetická porucha/“Attention Deficit Hyperactivity Disorder” u dětských pacientů s epilepsií. Cesk Slov Neurol N 2011; 74/107(2): 157–142.
62. Doose H, Brigger - Heuer B, Neubauer B. Children with focal sharp waves: clinical and genetic aspects. Epilepsia 1997; 38(7): 788–796.
63. Cortez MA, Perez Velazquez JL, Snead OC jr. Animal models of epilepsy and progressive effects of seizures. Adv Neurol 2006; 97 : 293–204.
64. Cahová P, Pejčochová J, Ošlejšková H. Hyperkinetická porucha v klinické praxi dětského neurologa. Postgraduální medicína 2010; 12(1): 8–18
65. Gucuyener K, Erdemoglu AK, Senol S, Serdaroglu A, Soysal S, Kockar AI. Use of methylphenidate for attention-deficit hyperactivity disorder in patients with epilepsy or electroencephalographic abnormalities. Child Neurol 2003; 18(2): 109–112.
66. Tan M, Appleton R. Attention deficit and hyperactivity disorder, methylphenidate, and epilepsy. Arch Dis Child 2005; 90(1): 57–59.
67. Clarke AR, Barry RJ, Bond D, Mc Carthy R, Selikowitz M. Effects of stimulant medication on the EEG of children with attention-deficit/hyperactivity disorder. Psychopharmacology 2002; 164(3): 277–284.
68. Ptáček R. Psychodiagnostika hyperkinetického syndromu (ADHD) u dětí. In: Paclt I (ed). Hyperkinetická porucha a poruchy chování. Praha: Grada 2007 : 59–68.
69. Stray LL, Stray T, Iversen S, Ruud A, Ellertsen B, Tønnessen FE. The Motor Function Neurological Assessment (MFNU) as an indicator of motor function problems in boys with ADHD. Behav Brain Funct 2009; 5 : 22
70. Sagvolden T, Johansen EB, Aase H, Russell VA. A dynamic developmental theory of attention-deficit/hyperactivity disorder (ADHD) predominantly hyperactive/impulsive and combined subtypes. Behav Brain Sci 2005; 28(3): 397–419.
71. Drtílková I. EEG u hyperkinetické poruchy. In: Drtílková I (ed). Hyperkinetická porucha. Praha: Galén 2007 : 125–130.
72. Holtman M, Becker K, Kentner-Figura B, Schmidt MH. Increased frequency of rolandic spikes in ADHD children. Epilepsia 2003; 44(9): 1241–1244.
73. Richer LP, Shevell MI, Rosenblatt BR. Epileptiform abnormalities in children with attention deficit-hyperactivity disorder. Pediatr Neurol 2002; 26(2): 125–129.
74. Hemmer SA, Pasternak JF, Zecker SG, Trommer BL. Stimulant therapy and seizure risk in children with ADHD. Pediatr Neurol 2001; 24(2): 99–102.
75. Hughes JR, DeLeo AJ, Mellyn MA. The electroencephalogram in attention deficit–hyperactivity disorder: emphasis on epileptiform discharges. Epilepsy Behavior 2000; 1(4): 271–277.
76. Silvestri R, Gagliano A, Calarese T, Aricò I, Cedro C, Condurso R et al. Ictal and interictal EEG abnormalities in ADHD children recorded over night by videopolysomnography. Epilepsy Research 2007; 75(2–3): 130–137.
77. Holtman M, Matei A, Hellman U, Becker K, Poustka F, Schmidt MH. Rolandic spikes increase impulsivity in ADHD - A neuropsychological pilot study. Bran Dev 2006; 28(10): 633–640.
78. Becker K, Holtmann M. Role of electroencephalography in attention-deficit hyperactivity disorder. Expert Rev Neurother 2006; 6(5): 731–739.
79. Binnie CD. Significance and management of transitory cognitive impairment due to subclinical EEG discharges in children. Brain Development 1993; 15(1): 23–30.
80. Laporte N, Sebire G, Gillerot Y, Guerrini R, Ghariani S. Cognitive epilepsy: ADHD related to focal EEG discharges. Pediatr Neurol 2002; 27(4): 307–311.
81. Marston D, Besag F, Binnie CD, Fowler M. Effects of transitory cognitive impairment on psychosocial functioning in children with epilepsy: a therapeutic trial. Dev Med Child Neurol 1993; 35(7): 574–581.
82. Holmes GL, Lenck-Santini PP. Role of interictal epileptiform abnromalities in cognitive impairment. Epilepsy Behavior 2006; 8(3): 504–515.
83. Deonna T, Zesiger P, Davidoff V, Maeder M, Mayor C, Roulet E. Benign partial epilepsy of childhood: a longitudinal neuropsychological and EEG
study of cognitive function. Dev Med Child Neurol 2000; 42(9): 595–603.
84. Gunduz E, Demirbilek V, Korkmaz B. Benign rolandic epilepsy: neuropsychological findings. Seizure 1999; 8(4): 246–249.
85. Duane DD, Heimburger G, Duane DC: Cognitive, behavioral and EEG effects of levetiracetam in pediatric developmental disorders of attention/learning. J Neuropsychiatry Clin Neurosci 2004; 16(2): 218–241.
86. Engler F, Maeder-Ingvar M, Roulet E, Deonna T. Treatment with sulthiame (Ospolot) in benign partial epilepsy of childhood and related syndromes: an open clinical and EEG study. Neuropediatrics 2003; 34(2): 105–109.
87. Goetz M. Současný pohled na léčbu ADHD. Remedia 2009; 19(3): 190–196.
88. Paclt I. Současnost a perspektivy psychofarmakoterapie ADHD v České republice a v zahraničí. Psychiatr Prax 2006; 1(7): 30–33.
89. Drtílková I. Farmakologická léčba hyperkinetické poruchy. In: Drtílková I (ed). Hyperkinetická porucha. Praha: Galén 2007 : 131–166.
90. Drtílková I, Hrdlička M, Paclt I. Hyperkinetické poruchy (ADHD) u dětí. In: Raboch J (ed). Psychiatrie: Doporučené postupy psychiatrické péče III. Brno: Tribun EU 2010 : 208–213.
91. Taylor E, Dopfner M, Sergeant J, Asherson P, Banaschewski T, Buitelaar J. European clinical guidelines for hyperkinetic disorder-first upgrade. Eur Child Adolesc Psychiatry 2004; 13(Suppl 1): 7–30.
92. AACAP Official Action. Practice parameters for the use of stimulant medications in treatment of children, adolescents and adults. J Am Acad Child Adolesc psychiatry 2002; 41 (Suppl 2): 26–49.
93. Biederman J, Spenser T, Wilens T. Evidence based pharmacotheraphy for attention-deficit hyperactivity disorder. Int J Neuropsychopharmacol 2004; 7(1): 77–97.
94. Hrdlička M. Postavení atomoxetinu v léčbě hyperkinetické poruchy u dětí a adolescentů. Čes slov psychiatr 2007; 103(5): 230–239.
95. Roessner V, Robatzek M, Knapp G, Banaschewski T, Rothenberger A. First-onset tics in patients with attention-deficit-hyperactivity disorder: impact of stimulants. Developmental Medicine Child Neurology 2006; 48(7): 616–621.
96. Tourette Syndrome Study Group. Treatment of ADHD in children with tics: a randomized controlled trial. Neurology 2002; 58(4): 527–536.
97. Bymaster FP, Katner JS, Nelson DL, Hemrick-Luecke SK, Threlkeld PG, Heiligenstein JH et al. Atomoxetine increases extracellular levels of norepinephrine and dopamine in prefrontal cortex of rat: a potential mechanism for efficacy in attention deficit/hyperactivity disorder. Neuropsychopharmacology 2002; 27(5): 699–711.
98. Sangal RB, Owens J, Allen AJ, Sutton V, Schuh K, Kelsey D. Effects of atomoxetine and methylphenidate on sleep in children with ADHD. Sleep 2006; 29(12): 1573–1585.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2011 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Porucha pozornosti s hyperaktivitou (attention deficit/hyperactivity disorder – ADHD)
- Neurální komponenty motivačních a rozhodovacích procesů v lidském mozku
- Histopatologická diagnostika mitochondriálních myopatií – indikace a přínos svalové biopsie
- Vztah genotypu apolipoproteinu E ke klinickému průběhu a následkům poranění mozku u dětí a mladistvých
- Výskyt mutácií v géne Leucine rich repeat kinase 2 u pacientov s Parkinsonovou chorobou na Slovensku
- Glatiramer acetát (Copaxone®) v léčbě atakovité formy roztroušené sklerózy mozkomíšní – klinická účinnost a bezpečnostní profil
- Opožděný akutní subdurální hematom
- Víčkové implantáty v terapii lagoftalmu
- Kognitivní účinky dlouhodobé léčby subkutánními apomorfinovými infuzemi u pacientů s pokročilou Parkinsonovou nemocí
- Vrozená myotonie na podkladě mutací v genu pro chloridový kanál ClC-1
- Opakovaná intradetruzorová aplikace botulinumtoxinu A u dětí s hyperaktivitou detruzoru
- Radikulopatia spôsobená lumbálnymi epidurálnymi varixami – kazuistika
- Dehiscence stěny kanálu a výhřez lícního nervu – kazuistiky
- Spinální komplikace u genetických syndromů – kazuistiky
- Neurologické komplikace při onemocnění herpes zoster – kazuistika
- K životnímu jubileu primářky MUDr. Evy Urbánkové
- Webové okénko
-
Analýza dat v neurologii
XXVIII. Hodnocení diagnostických testů – křivky ROC - Aktuální informace o postgraduálním vzdělávání
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Porucha pozornosti s hyperaktivitou (attention deficit/hyperactivity disorder – ADHD)
- Opožděný akutní subdurální hematom
- Neurologické komplikace při onemocnění herpes zoster – kazuistika
- Vrozená myotonie na podkladě mutací v genu pro chloridový kanál ClC-1
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




