-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
„Awake“ resekcia supratentoriálnych low-grade gliómov lokalizovaných vo vnútri alebo v priamom kontakte s elokventnými oblasťami
Awake Resection of Adult Supratentorial Low-grade Gliomas Located within or Adjacent to Eloquent Areas
Aim:
The aim of this work was to present the advantages and limits of the use of awake resection (AR) in the surgical treatment of supratentorial low-grade gliomas (LGG) located within or adjacent to eloquent areas; to evaluate the radicality of resections and functional outcome; and to document observations of certain brain structure functions. Patients and methods: The prospectively-studied series included 20 adult patients operated upon in a period of 41 months. All the tumours were located within or adjacent to speech and language, or motor eloquent, structures. Speech and language functions were intra-operatively assessed by a speech and language therapist. Calculation of tumour residua volumes was based on a postoperative fluid attenuated inversion recovery (FLAIR) magnetic resonance sequence. Results: Gross total removal was achieved in one patient, subtotal removal (residue smaller than 10 cm3) in 12, and partial removal in seven patients. Two temporary deficits and one minor permanent neurological deficit were observed. The use of direct electrical stimulation enabled anatomical localization and function of the following cortical and subcortical structures to be identified and observed: primary and supplementary motor area, motor pathways, Broca’s and Wernicke’s areas, fasciculus arcuatus, fasciculus subcallosus and corpus callosum. Conclusions: AR is a worthwhile contribution to the surgical treatment of supratentorial LGG. In addition to avoidance of surgical sequelae, AR allows an extensive, safe resection that may not be safely achievable with general anaesthesia even with the use of current diagnostic imaging methods and electrophysiological neuromonitoring, particularly in cases involving LGG located within or adjacent to speech and language areas. The incidence of new and permanent deficits is low. However, resection in certain areas remains problematical, even with the use of AR. Some complex neurological disorders of function may not be readily assessed intra-operatively, despite surgery in a patient who is awake. The methodology of intra-operative brain function testing should improve over time.Key words:
low-grade glioma – awake resection – eloquent area – direct electrical stimulation
Autoři: A. Šteňo 1; V. Šteňová 2; V. Belan 3; V. Hollý 4; J. Šurkala 1; J. Šteňo 1
Působiště autorů: UN Bratislava Neurochirurgická klinika LF UK 1; UN Bratislava Ambulancia klinickej logopédie 2; UN Bratislava Rádiodiagnostická klinika SZU 3; UN Bratislava Klinika anestéziológie a intenzívnej medicíny SZU 4
Vyšlo v časopise: Cesk Slov Neurol N 2011; 74/107(5): 539-549
Kategorie: Původní práce
Souhrn
Cieľ:
Cieľom práce je prezentovať výhody a limity využitia „awake“ resekcie (AR) pri operáciách supratentoriálnych low-grade gliómov (LGG) lokalizovaných vo vnútri alebo v priamom kontakte s elokventnými oblasťami mozgu, vyhodnotiť radikalitu resekcií a funkčné výsledky, a dokumentovať konkrétne pozorovania funkcií mozgových štruktúr. Súbor a metodika: Prospektívne vedený súbor tvorí 20 dospelých pacientov operovaných v období 41 mesiacov. Všetky nádory boli lokalizované vo vnútri alebo v priamom kontakte s rečovými a jazykovými (RaJ), alebo motorickými elokventnými štruktúrami. Rečové a jazykové funkcie boli intraoperačne testované logopédom. Objem rezíduí bol vypočítaný na základe pooperačnej FLAIR (Fluid Attenuated Inversion Recovery) sekvencie magnetickej rezonancie. Výsledky: V jednom prípade bola dosiahnutá radikálna, v 12 subtotálna (rezíduum menšie ako 10 cm3), u siedmich pacientov bola dosiahnutá parciálna resekcia. Zaznamenané boli dva prechodné a jeden ľahký trvalý neurologický deficit. Použitím priamej elektrickej stimulácie bola identifikovaná anatomická lokalizácia a pozorované funkcie nasledujúcich kortikálnych a subkortikálnych štruktúr: primárna a suplementárna motorická oblasť, motorické dráhy, Brocova a Wernickeho oblasť, fasciculus arcuatus, fasciculus subcallosus a corpus callosum. Závery: AR je prínosnou metódou v chirurgickej liečbe supratentoriálnych LGG. Umožňuje dosiahnutie rozsiahlej resekcie, ktorá by najmä v prípadoch LGG lokalizovaných vo vnútri alebo v kontakte s RaJ oblasťami nebola v celkovej anestézii bezpečne dosiahnuteľná ani za použitia súčasných zobrazovacích diagnostických metód a využitia elektrofyziologického neuromonitoringu. Incidencia trvalých novovzniknutých deficitov je nízka. Operácie LGG v určitých oblastiach však zostávajú problematické, aj pri využití AR. Poškodenie niektorých zložitých neurologických funkcií môže ostať aj napriek „awake“ monitoringu nepovšimnuté, metodiku intraoperačného testovania mozgových funkcií je potrebné naďalej zdokonaľovať.Kľúčové slová:
low-grade glióm – „awake“ resekcia – elokventná oblasť – priama elektrická stimuláciaÚvod
Maximálna možná resekcia gliómov II. stupňa malignity podľa Svetovej zdravotníckej organizácie (low-grade gliómy, LGG) je v súčasnosti považovaná za základnú terapeutickú metódu vždy, keď je bezpečne uskutočniteľná [1,2]. Pri resekciách LGG rastúcich vo vnútri alebo v kontakte s elokventnými štruktúrami však hrozí ich poškodenie a následný deficit, preto je počas týchto operácií dôležité sledovanie mozgových funkcií. Za jednu z najspoľahlivejších metód intraoperačného monitorovania funkcií elokventných štruktúr je považovaná resekcia pri vedomí – „awake“ resekcia (AR). Cieľom práce bolo v súbore pri vedomí operovaných dospelých pacientov so supratentoriálnymi LGG lokalizovanými vo vnútri alebo v priamom kontakte s elokventými štruktúrami vyhodnotiť počet dosiahnutých rádiologicky radikálnych alebo subtotálnych resekcií, t. j. resekcií pri ktorých je možné predpokladať zlepšenie prognózy pacientov v porovnaní s pacientmi s len parciálnou resekciou. Taktiež bolo naším cieľom vyhodnotiť frekvenciu novovzniknutých neurologických deficitov a zdokumentovať konkrétne pozorovania funkcií mozgových štruktúr.
Materiál a metodika
Charakteristika súboru a predoperačné vyšetrenia
Od januára 2003 do apríla 2010 sme realizovali 38 AR gliových tumorov lokalizovaných v blízkosti rečových a jazykových (RaJ), alebo motorických elokventných kortikálnych, alebo subkortikálnych oblastí, z toho bolo 21 operácii LGG (realizovaných od novembra 2006 do marca 2010). Až na jednu výnimku žiadny LGG neprerastal do kontralaterálnej hemisféry; u jednej pacientky sa jednalo o bifrontálny, prevažne ľavostranný LGG, prerastajúci RaJ oblasti. Táto pacientka nebola do súboru zaradená, nakoľko už predoperačne bolo zjavné, že prognosticky významná resekcia nie je dosiahnuteľná bez ťažkého trvalého neurologického poškodenia a cieľom bola len rozsiahla dekompresia vzhľadom na výrazný „mass“ efekt. AR bola indikovaná v snahe o minimalizáciu rizika novovzniknutého deficitu. Súbor tvorilo 20 pacientov s LGG, šesť žien a 14 mužov, vo veku od 26 do 51 rokov (priemer 37,5 roka). Osemnásť pacientov bolo operovaných primárne, dvaja pre recidívu po predchádzajúcej operácii v celkovej anestézii (CA). Z 18 primárne operovaných pacientov bol u 15 pacientov prvým príznakom epileptický záchvat, u dvoch dlhodobé parestézie hornej končatiny, u jedného pacienta cefalea. Osemnásť pacientov bolo pravoručných, dvaja ľavoruční. V čase operácie prvého ľavoručného pacienta nebola funkčná magnetická rezonancia (fMR) dostupná, u druhého pacienta fMR zobrazila intenzívnejšiu aktiváciu pravej hemisféry pri RaJ úlohách. U oboch ľavoručných pacientov bola lokalizácia RaJ centier v pravej hemisfére potvrdená peroperačne.
Predoperačné neurologické vyšetrenie motorických funkcií každého pacienta bolo vykonané neurochirurgom, predoperačné vyšetrenie RaJ funkcií bolo vykonané logopédom. Logopedické vyšetrenie pozostávalo z administrovania slovenskej adaptácie Western Aphasia Battery, slovenskej adaptácie Token testu, slovenského testu pomenovania obrázkov a vyšetrenia lexie a grafie. Predoperačný deficit RaJ funkcií bol zaznamenaný u dvoch pacientov, predoperačný deficit motorických funkcií zaznamenaný nebol. Predoperačné Karnofsky Performance Scale (KPS) skóre všetkých pacientov bolo 100 %. Lokalizácia nádorov je uvedená v tab. 1. Volumetria objemu nádorov bola vyhotovená nezávisle rádiológom (V. B.) a neurochirurgom (A. Š.) pomocou programu TomoCon (výrobca TatraMed s.r.o.) na základe axiálneho MR zobrazenia vo FLuid Attenuated Inverse Recovery (FLAIR) sekvencii; za nádorové bolo považované všetko hyperintenzívne tkanivo. Ako predoperačný objem nádoru bol akceptovaný priemer oboch nameraných hodnôt (tab. 1). Predoperačné zobrazenie tenzorov difúzie (Diffusion Tensor Imaging, DTI) a/alebo fMR boli realizované u 11 pacientov.
Tab. 1. Súbor dospelých pacientov so supratentoriálnymi LGG, operovaných pri vedomí od novembra 2006 do apríla 2010 na Neurochirurgickej klinike LF UK a UN Bratislava. 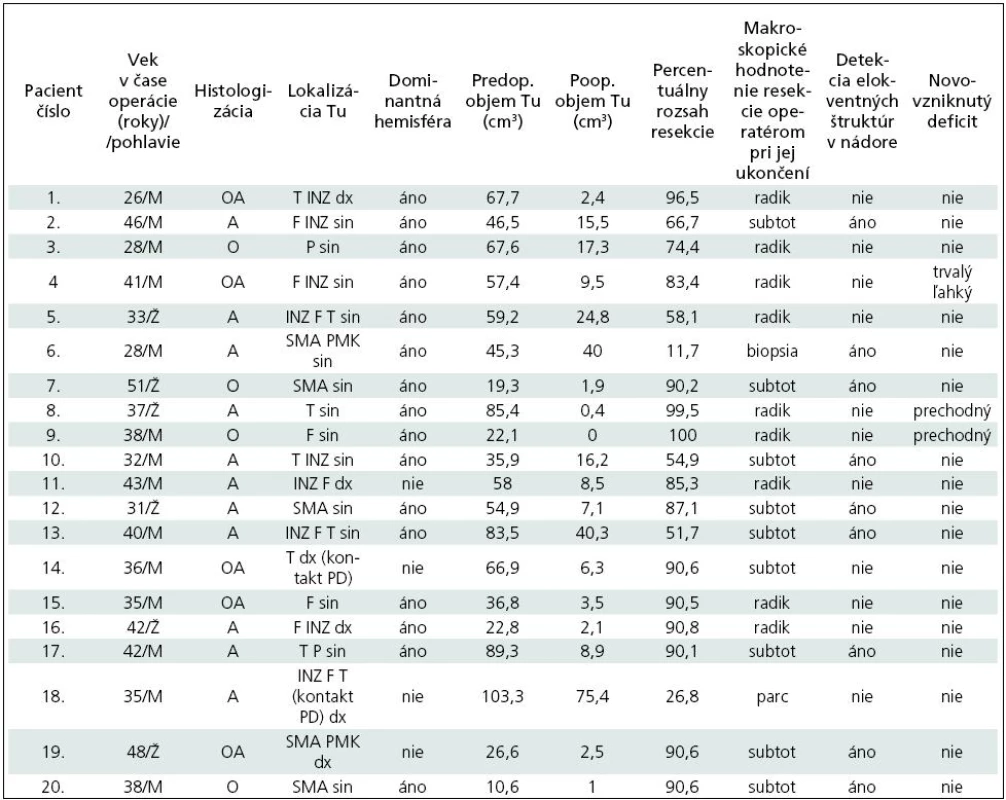
Tu: tumor; M: muž; Ž: žena; A: fibrilárny astrocytóm; O: oligodendroglióm; OA: oligoastrocytóm; F: frontálny lalok; T: temporálny lalok; P: parietálny lalok; INZ: inzula; SMA: suplementárna motorická oblasť; PMK: primárny motokortex; PD: pyramídová dráha; BG: bazálne gangliá; radik: radikálna resekcia, subtot: subtotálna resekcia, parc: parciálna resekcia. Pri uvádzaní lokalizácie nádoru je ako prvá uvádzaná oblasť s najväčším nádorovým postihnutím. Operačný postup
V štyroch prípadoch nádorov v nedominantnej hemisfére bolo cieľom AR monitorovať integritu motorických kortikálnych a subkortikálnych oblastí. V 16 prípadoch LGG lokalizovaných v dominantnej hemisfére boli okrem motorických monitorované i RaJ funkcie intraoperačne sledované logopédom. Všetky operácie boli vykonané s pomocou neuronavigácie, od roku 2008 s využitím 3D FLAIR sekvencie.
Pacienti, ktorí trvalo užívali antiepileptiká, užili rannú dávku o šiestej hodine (pri začiatku operácie o ôsmej hodine ráno). Anestézie boli vykonané intravenózne s použitím Propofolu a opiátov (Remifentanyl a Sufentanyl) na „Target controlled infusion“ pumpe. Dýchacie cesty boli zabezpečené laryngeálnou maskou. Každý pacient bol v CA od začiatku operácie až po dokončenie otvárania tvrdej mozgovej pleny. Štandardnou súčasťou peroperačnej medikácie bolo intravenózne podanie Fenytoínu v dávke 7,5 mg/kg hmotnosti v 90-minútovej infúzii, ktorá bola podávaná od začiatku anestézie.
Fáza kortikálnej stimulácie
V prípadoch, v ktorých bolo potrebné určiť polohu primárnej motorickej kôry (PMK), bola táto lokalizovaná priamou elektrickou stimuláciou (PES) ešte v CA, aby sa tak znížilo riziko intraoperačného epileptického záchvatu. Použitá bola bipolárna stimulácia bifázickými pravouhlými pulzmi v trvaní jednej milisekundy, pri frekvencii 100 hertzov a hodnote prúdu v rozsahu od 5 do 10 miliampérov (na začiatku stimulovania bola vždy zvolená najnižšia hodnota, ktorá bola podľa potreby postupne zvyšovaná až po dosiahnutie stimulačnej odpovede). Stimulačná odpoveď bola obyčajne vybavená do jednej až dvoch sekúnd od začiatku stimulovania, po dosiahnutí odpovede bola stimulácia prerušená. Dĺžka stimulácie nikdy nepresiahla štyri sekundy. Stimulácia sa prejavila pozitívnou odpoveďou – vybavením pohybu príslušnej časti tela. Po lokalizácii PMK bol pacient prebratý k vedomiu. Lokalizácia RaJ kortikálnych oblastí ich stimuláciou začala vždy až po úplnom prebratí sa pacienta k vedomiu. Hodnota prúdu počas „awake“ fázy bola v rozsahu od 3 do 8 miliampérov (na začiatku stimulovania bola vždy zvolená najnižšia hodnota, ktorá bola podľa potreby postupne zvyšovaná až po dosiahnutie stimulačnej odpovede), ostatné hodnoty (trvanie a frekvencia pulzov) boli rovnaké ako pri stimulácii PMK v CA. Elektrická stimulácia sa prejavila negatívnou odpoveďou – vyradením príslušných RaJ centier, čo sa prejavilo ako porucha RaJ funkcií. Dĺžka stimulovania bola štyri sekundy, v prípade skoršieho vybavenia poruchy RaJ funkcií bola stimulácia prerušená skôr. Pri operáciách nádorov lokalizovaných frontálne a temporálne bolo v prvej časti súboru (pacienti č. 1 až 8) sledované najmä pomenovanie obrázkov, pomenovanie na základe definície, pacientom z druhej časti súboru (č. 9 až 20) bola intraoperačne sledovaná spontánna rečová produkcia (SRP) na vopred pripravenú tému, riadená logopédom. Súčasťou riadeného rozhovoru boli vždy aj úlohy testujúce pomenovanie na základe definície (napr. „štvornohé zviera, ktoré stráži dom“). Pacientom s tumorom v parietálnom laloku alebo so zasahovaním do tzv. Wernickeho oblasti (celkovo dvaja) bolo sledované porozumenie reči kladením otázok, na ktoré logopéd vopred poznal odpovede na základe predoperačného rozhovoru. Taktiež bola testovaná oprava chybných viet (napr. „zviera, ktoré šteká, je mačka“). U týchto pacientov bola taktiež sledovaná SRP. Pri testovaní produkcie bola stimulačná sonda priložená na vyšetrované miesto počas reči pacienta. Ak sa jednalo o funkčne významnú časť kôry, stimulácia počas reči sa prejavila jej poruchou, napr. zástavou reči, poruchou artikulácie, poruchou iniciácie reči, anómiou atď. Pri testovaní porozumenia bola stimulačná sonda priložená na vyšetrované miesto počas čítania úlohy. Porucha porozumenia bola následne odhalená pri odpovediach pacienta, ktoré boli po stimulácii v miestach dôležitých pre porozumenie reči neadekvátne. Pretestovaná bola vždy kôra v celom rozsahu zamýšľanej resekcie ako aj v jej bezprostrednej blízkosti (obyčajne jeden až dva závity susediace s miestom plánovanej resekcie), jednotlivé miesta, ktoré boli stimulované, boli od seba vzdialené približne jeden centimeter.
Fáza resekcie a subkortikálnej stimulácie
Po lokalizácii kôrových motorických a RaJ centier pomocou PES, a lokalizácii hraníc tumoru pomocou neuronavigácie začala samotná resekcia. Hranice kortikálnej resekcie siahali do vzdialenosti jeden centimeter od miesta s vybavenou stimulačnou odpoveďou. V prípade, že nádor a elokventný kortex na seba bezprostredne naliehali, ale boli oddelené sulkom, resekcia siahala až po túto hranicu. Pri resekcii LGG v blízkosti alebo vo vnútri motorických štruktúr pacient komunikoval s anestéziológom a intermitentne hýbal monitorovanými končatinami. Svalová sila bola počas celej operácie vyšetrovaná anestéziológom. Po priblížení sa okrajov resekcie k motorickým dráham, boli tieto lokalizované pomocou PES, aby sa predišlo ich poškodeniu. Stimulácia motorických dráh sa prejavila vybavením pohybu príslušnej časti tela. Pri nádoroch lokalizovaných v kontakte alebo prerastajúcich RaJ oblastí (16 pacientov) boli RaJ funkcie intraoperačne testované počas celej doby resekcie. V prvej časti súboru (pacienti 1 až 8) bolo pri resekcii i subkortikálnej stimulácii sledované pomenovanie obrázkov, pomenovanie na základe definície a počítanie. S pacientmi z druhej časti súboru (9 až 20) logopéd komunikoval počas celej resekcie formou riadeného rozhovoru. Počas SRP pacienta boli sledované fluencia a tempo reči, udržanie témy, výskyt sémantických a fonemických parafázií, anomické pauzy, agramatizmy, zastavenie reči, oromotorika a neadekvátne odpovede. Pri výskyte akýchkoľvek zmien RaJ funkcií logopéd operatéra na poruchu ihneď upozornil. Subkortikálna stimulácia bola využívaná intermitentne počas AR, za účelom ozrejmenia polohy subkortikálnych RaJ dráh a prevencie ich poškodenia. Po objavení sa poruchy produkcie alebo porozumenia reči počas samotnej resekcie (nie počas subkortikálnej stimulácie), bola operácia vždy na krátky čas prerušená, až do odznenia poruchy. Následne bolo tkanivo, pri manipulácii, s ktorým deficit vznikol, elektricky stimulované, za účelom overenia či jeho stimulácia opakovane vyvolá poruchu produkcie, resp. porozumenia reči. Ak sa tkanivo ukázalo ako elokventné, resekcia bola v tomto mieste ukončená, a to aj v prípadoch, kedy bol dôvodný predpoklad, že sa jedná o nádorové tkanivo. V prípade, že sa poruchy RaJ funkcií, alebo pohybu neobjavili, resekcia pokračovala, až kým sa operatér nedomnieval, že resekcia je radikálna. Na zlepšenie anatomickej orientácie operatéra bola využívaná neuronavigácia. Doba trvania „awake“ fázy operácie bola od 60 do 180 (priemer 115) minút. Žiadny pacient sa počas operácie nesťažoval na inú, ako len miernu a dobre tolerovateľnú bolesť. Ku koncu operácie udávali traja pacienti únavu, žiadna operácia však nebola ukončená pre únavu predčasne. Doba, kedy únava nastala, bola individuálna (napr. pacient po trojhodinovej AR únavu neudával). Po ukončení resekcie bol pacient opäť uspatý, hemostáza a ďalšie fázy operácie prebehli obvyklými postupmi.
Pooperačné vyšetrenia
Histologické vyšetrenie všetkých nádorov potvrdilo glióm druhého stupňa malignity (tab. 1). Do 72 hod a o tri mesiace po operácii po zákroku boli všetci pacienti vyšetrení na MR. Volumetria objemu pooperačných rezíduí LGG bola vyhotovená rovnakým spôsobom ako volumetria predoperačných objemov na základe MR vyšetrenia realizovaného o tri mesiace po operácii. Ako výsledný pooperačný objem nádoru bol akceptovaný opäť priemer hodnôt nameraných nezávisle od seba rádiológom a neurochirurgom (tab. 1). Resekcia bola hodnotená ako radikálna len v prípadoch, ak bolo chirurgicky odstránené všetko predoperačne hyperintenzívne tkanivo LGG. Pri pooperačnom náleze hyperintenzívneho tkaniva mimo miest, kde sa nachádzalo predoperačne, bolo takéto tkanivo považované za pooperačnú gliózu a resekcia za radikálnu. Resekcia bola považovaná za subtotálnu v prípadoch, kedy objem pooperačného rezídua LGG nepresiahol 10 cm3. Ostatné resekcie boli považované za parciálne. Pooperačné neurologické zhodnotenie motorických funkcií bolo vykonané neurochirurgom; analogicky boli pooperačne rovnakými testami, ako pred operáciou logopédom zhodnotené RaJ funkcie. Po operácii bola všetkým pacientom položená cielená otázka, či by absolvovali operáciu mozgu pri vedomí na našom pracovisku aj v budúcnosti; všetci pacienti sa vyjadrili kladne.
Výsledky
Komplikácie
V troch prípadoch bol počas AR použitím PES vyvolaný epileptický záchvat. Všetky boli zastavené vyplachovaním operačného poľa studeným Ringerovým roztokom, s následným pokračovaním AR.
Volumetrické zhodnotenie radikality a príčiny ponechania rezídua
Rádiologicky radikálna resekcia bola dosiahnutá v jednom prípade (5 %), v 12 subtotálna (rezíduum menšie ako 10 cm3) resekcia (60 %). Viac ako 90% resekcia bola dosiahnutá u 10 pacientov (50 %). U siedmich pacientov (35 %) bola dosiahnutá parciálna resekcia.
Z 19 prípadov subtotálnej a parciálnej resekcie bolo v deviatich prípadoch rezíduum nutné ponechať pre intraoperačne verifikovanú infiltráciu elokventných štruktúr. U pacienta (č. 6) s nádorom dominantnej suplementárnej motorickej oblasti (Supplementary Motor Area, SMA) so súčasnou infiltráciou PMK bola resekcia včasne prerušená pre objavenie sa stredne ťažkej hemiparézy po resekcii malej časti jasne nádorového tkaniva. Hemiparéza sa objavila napriek tomu, že resekcia bola lokalizovaná viac ako jeden centimeter pred gyrus precentralis, ktorý bol jednoznačne verifikovaný pomocou PES. Vzhľadom na riziko trvalej poruchy hybnosti bola operácia ukončená biopsiou; hemiparéza sa upravila už v bezprostrednom pooperačnom období. V ôsmich prípadoch sa operatér rozhodol v resekcii nepokračovať, lebo ju považoval na základe neuronavigácie a makroskopického zhodnotenia za radikálnu. V jednom prípade (pacient č. 14) pravostranného temporálneho tumoru v kontakte s pyramídovou dráhou (PD) bola operácia ukončená po navigáciou verifikovanom tesnom (menej ako jeden centimeter) priblížení resekcie k PD; napriek negatívnej stimulačnej odpovedi bola ďalšia resekcia považovaná za rizikovú. V jednom prípade (pacient č. 18) bola operácia predčasne ukončená pre poruchu navigačného prístroja (plánovaná je reoperácia pri vedomí).
Pooperačné funkčné výsledky
Motorický pooperačný deficit nebol zaznamenaný, zaznamenaný bol jeden trvalý a dva prechodné novovzniknuté deficity RaJ funkcií. V jednom prípade (pacient č. 4) sa jednalo o ľahkú trvalú Brocovu afáziu. V druhom prípade (pacient č. 8) sa jednalo o ťažkú, avšak prechodnú poruchu SRP a porozumenia. V oboch prípadoch boli deficity diagnostikované až pooperačne, pri intraoperačnom testovaní (pomenovanie a počítanie) poruchy zaznamenané neboli. V treťom prípade (pacient č. 9) sa jednalo o ľahké prechodné symptómy transkortikálnej motorickej afázie (TMA), ktoré boli zaznamenané už intraoperačne. Pooperačné KPS skóre ostalo u všetkých pacientov nezmenené oproti predoperačnému stavu.
Pozorované mozgové štruktúry a ich funkcie
Pri použití PES a mechanickej manipulácii boli pozorované funkcie viacerých kortikálnych a subkortikálnych štruktúr. Väčšinou išlo o jednotlivé pozorovania, niektoré identické prejavy však boli pozorované u viacerých pacientov.
- Stimulácia PMK sa prejavila pohybom (tonickou kontrakciou) zodpovedajúcej časti tela. Pohyb končatiny pri stimulácii pacient vnímal ako vôľovo neovládateľný „samovoľný“ pohyb končatiny.
- Stimulácia zadnej časti SMA sa taktiež prejavila ako pohyb končatiny. Na rozdiel od stimulácie PMK však pacient tento pohyb vnímal, ako keby ho chcel sám spraviť. Na otázku prečo pri stimulácii nedominantnej SMA pacient zdvihol hornú končatinu, odpovedal „mal som taký pocit, že ju chcem zdvihnúť“.
- Stimulácia prednej časti dominantnej SMA sa prejavila ako úplná zástava reči. Pacient však túto situáciu nevnímal ako stav, keď chce niečo povedať, no nie je schopný, ale stav vnímal ako „zamyslenie sa“. Na otázku, prečo počas stimulácie dominantnej SMA neodpovedal, uviedol, že „nehovoril, lebo premýšľal nad tým, čo chcel povedať“.
- Stimulácia motorických dráh zadnej časti SMA rezultovala v pohyb kontralaterálnych končatín.
- Stimulácia a manipulácia s rečovými dráhami prednej časti dominantnej SMA, konkrétne fasciculus subcallosus sa prejavila ako porucha iniciácie reči.
- Stimulácia Brocovho centra sa prejavila ako zástava reči, pri ktorej pacient vydával monotónny zvuk, na rozdiel od stimulácie spodnej časti gyrus precentralis, kedy pacient nebol vôbec schopný fonácie.
- Stimulácia Wernickeho oblasti (gyrus angularis a gyrus supramarginalis) vyvolala poruchu porozumenia vety čítanej počas stimulácie.
- Stimulácia fasciculus arcuatus (FA) sa v jednom prípade prejavila perseveráciami v rečovom prejave, v druhom prípade ako výrazná porucha artikulácie.
- Resekcia na úrovni vláknenia corpus callosum v pravej hemisfére sa prejavila ako výrazné spomalenie psychomotorického tempa.
Ilustračné kazuistiky
Kazuistika 1 (pacient č. 8)
37-ročná praváčka, s astrocytómom temporálne vľavo (obr. 1a, b). Predoperačné vyšetrenie odhalilo ľahkú poruchu pomenovania. Intraoperačne bolo sledované pomenovanie obrázkov a počítanie. Pri stimulácii kôry gyrus temporalis superior nastalo komolenie reči, preto bola resekcia realizovaná po kortikotómii gyrus temporalis medius, pri stimulácii ktorého poruchy reči nenastali. Realizovaná bola rozsiahla resekcia nádoru, počas celej AR neboli zaznamenané žiadne novovzniknuté poruchy RaJ funkcií. Po operácii však bola výrazne narušená SRP, objavili sa i poruchy porozumenia. Dosiahnutá bola subtotálna resekcia s minimálnym rezíduom (obr. 1c, d). Za najpravdepodobnejšiu príčinu pacientkiných ťažkostí bola považovaná manipulácia s fasciculus frontooccipitalis inferior (odstraňovanie nádoru v jeho bezprostrednej blízkosti – obr. 1d). Na kontrolu sa dostavila až deväť mesiacov po operácii, bola zistená kompletná úprava všetkých príznakov až na ľahkú poruchu pomenovania, nezhoršenú oproti stavu pred operáciou.
Obr. 1a, b. Pacient č. 8. Predoperačné MR vo FLAIR sekvencii zobrazujúce astrocytóm ľavého temporálneho laloka. Obr. 1c, d. Pooperačné MR vo FLAIR sekvencii zobrazujúce subtotálne odstránenie nádoru. Prerušovaná šípka – minimálne nádorové reziduum. Plná šípka – lokalizácia časti fasciculus frontooccipitalis inferior. 
Kazuistika 2 (pacient č. 9)
38-ročný pravák, s oligodendrogliómom gyrus frontalis medius (obr. 2a). Predoperačné vyšetrenie nepreukázalo žiadny RaJ deficit, lexia aj grafia boli intaktné. Peroperačne bola prítomnosť Brocovho centra verifikovaná približne 1 cm od zadného dolného okraja kortikálnej časti nádoru (obr. 3a, b). Intraoperačne bola sledovaná SRP s dôrazom na komplexné gramatické štruktúry a tvorbu slovies. Pri dokončovaní odstraňovania subkortikálnej časti tumoru v blízkosti predného rohu bočnej komory sa u pacienta prejavili výrazné poruchy iniciácie reči. Dosiahnutá bola rádiologicky radikálna resekcia (obr. 2b). Štruktúra pri manipulácii, s ktorou nastali poruchy iniciácie reči, bola identifikovaná ako fasciculus subcallosus (obr. 2b). Pooperačne mal pacient signifikantnú agrafiu a veľmi mierne zhoršené porozumenie reči. Vyšetrenie mesiac po operácii ukázalo kompletnú úpravu všetkých príznakov, vrátane úpravy grafie a porozumenia reči.
Obr. 2a. Pacient č. 9. Predoperačné MR vo FLAIR sekvencii zobrazujúce oligodendroglióm gyrus frontalis medius. Obr. 2b. Pooperačné MR vo FLAIR sekvencii zobrazujúce radikálnu resekciu nádoru (hyperintenzívny lem na okraji resekčnej dutiny je pooperačná glióza, nachádza sa mimo miest, kde bolo hyperintenzívne tkanivo predoperačne). Šípka – časť fasciculus subcallosus pri prednom rohu ľavej bočnej komory. 
Obr. 3a. Pacient č. 9. Hranice nádoru lokalizované podľa neuronavigácie (zadný okraj kortikálnej časti nádoru je označnený číslami 1–5, vpredu siaha nádorové tkanivo až ku prednému okraju durotómie). Obr. 3b. Brocove centrum (označené číslom 8) intraoperačne lokalizované pomocou PES vo vzdialenosti cca 1 cm od zadného dolného okraja kortikálnej časti nádoru. Červený kríž – Sylviova ryha. 
Kazuistika 3 (pacient č. 12)
31-ročná praváčka, s astrocytómom dominantnej SMA (obr. 4a, b). Funkčná MR zobrazila priame naliehanie nádoru na gyrus precentalis (obr. 5a, b), DTI zobrazilo PD v bezpečnej vzdialenosti od tumoru (medzi nádorom a PD sa zobrazila ešte vrstva tkaniva – obr. 6). Počas celej AR sa neobjavili poruchy reči. Pri stimulácii v zadnej časti resekčnej dutiny boli opakovane vybavené pohyby na pravostranných končatinách, hoci bol v týchto miestach predpokladaný reziduálny nádor. Vzhľadom na fakt, že nebolo možné odlíšiť, či sa jedná o dráhy začínajúce v SMA, alebo o časť PD, ktorá sa pomocou DTI nezobrazila, bola AR ukončená. Pooperačné MR zobrazilo rezíduum v zadnej časti resekčnej dutiny, resekcia bola subtotálna (obr. 4c, d). Pooperačne nebol prítomný RaJ ani motorický deficit.
Obr. 4a, b. Pacient č. 12. Predoperačné MR vo FLAIR sekvencii zobrazujúce astrocytóm ľavej SMA. Obr. 4c, d. Pooperačné MR vo FLAIR sekvencii zobrazujúce subtotálne odstránenie nádoru. Šípka ukazujú miesto (nádorové reziduum) v zadnej časti resekčnej dutiny, pri stimulácii ktorého boli vybavené pohyby pravostranných končatín. 
Obr. 1. Pacient č. 12. Funkčná magnetická rezonancia zobrazujúca vzťah nádoru ku PMK pre pohyby hornej (a) a dolnej končatiny (b). Vyšetrenie realizované prof. Beisteinerom (Study Group Clinical fMRI , Department of Neurology, Medical University of Vienna, Austria, roland.beisteiner@meduniwien.ac.at) 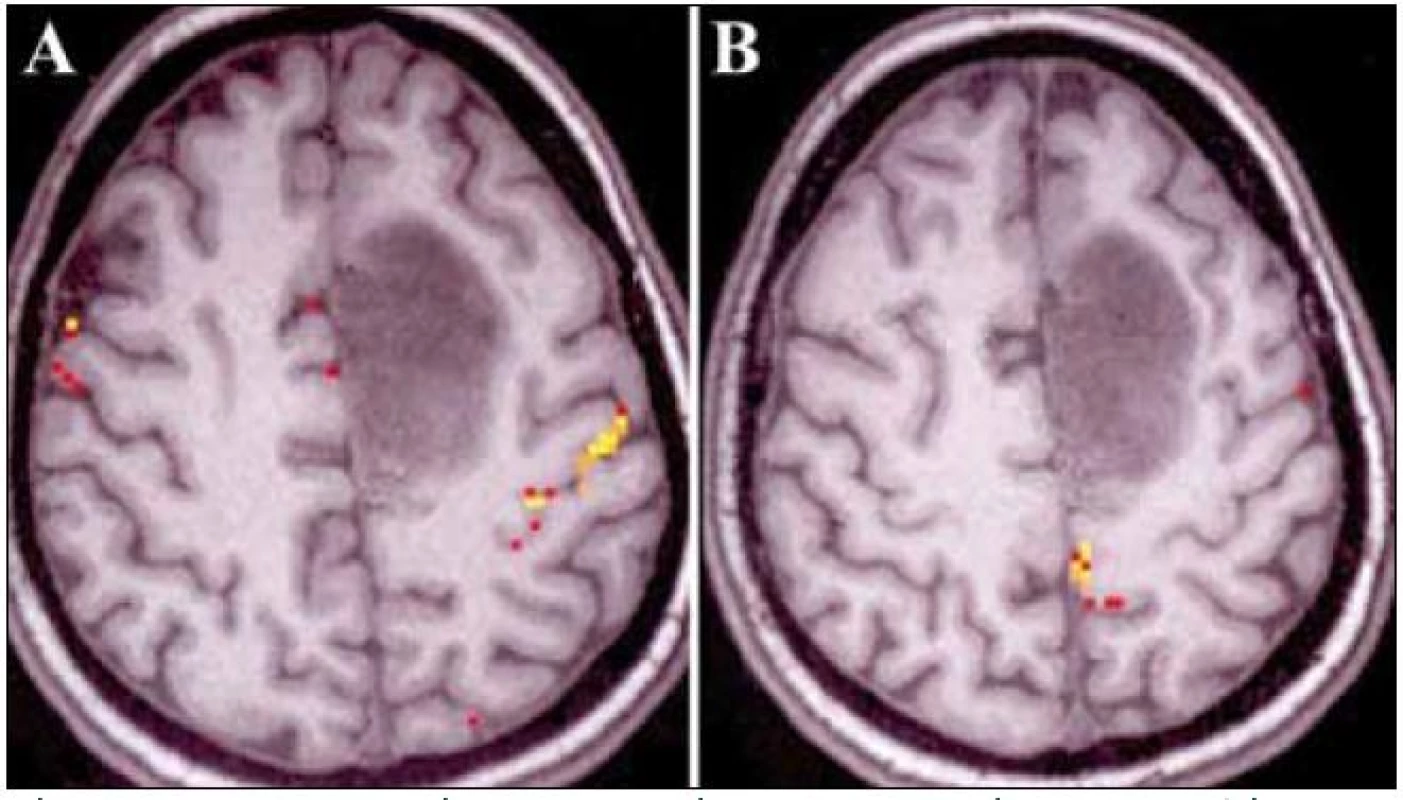
Obr. 2. Pacient č. 12. Trojrozmerná rekonštrukcia DTI vyšetrenia (traktografia) zobrazujúca pyramídovú dráhu, ktorá nie je v priamom kontakte so zadným okrajom nádoru. 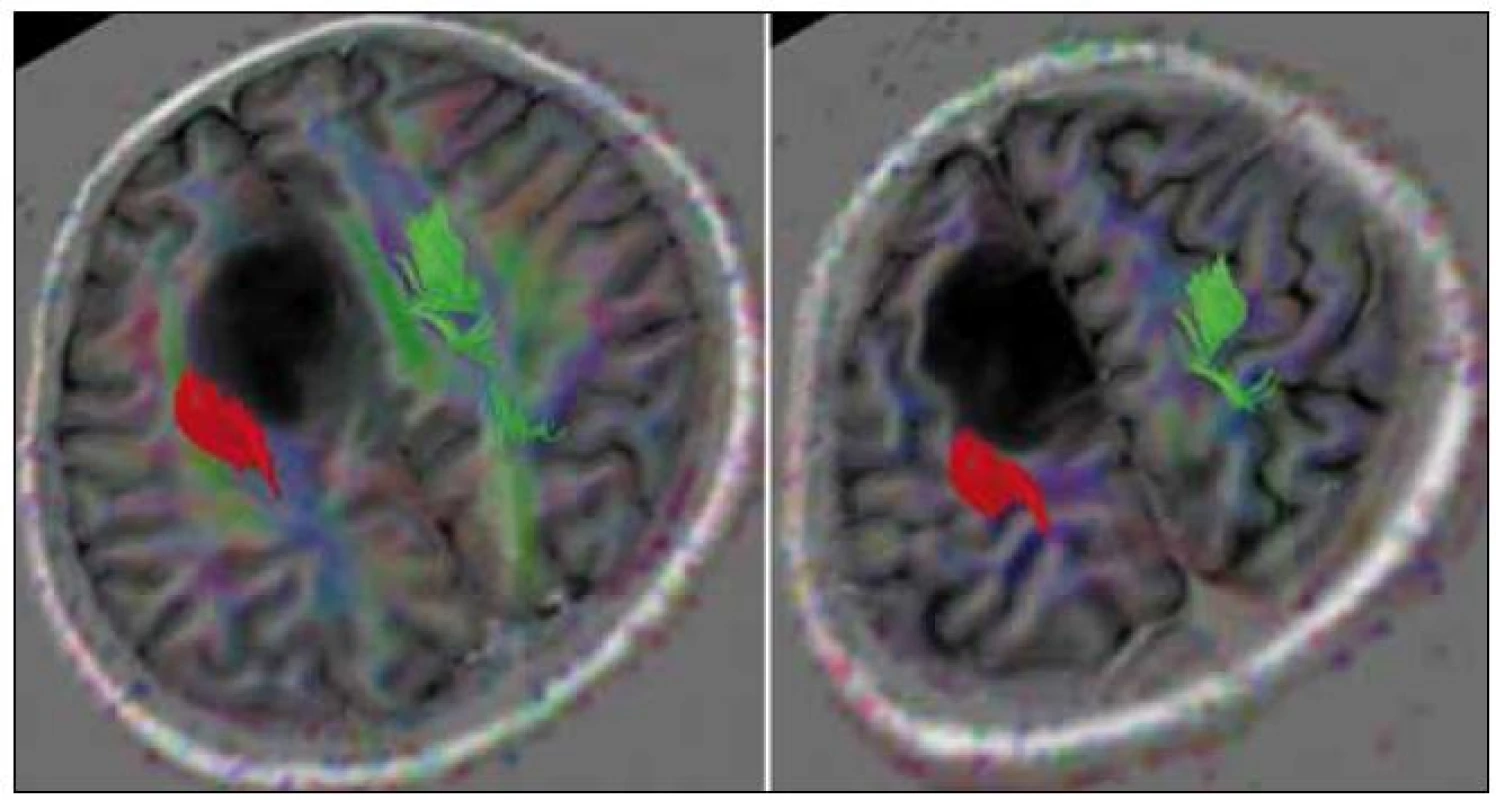
Diskusia
Dospelí pacienti so supratentoriálnymi LGG v súčasnosti nie sú chirurgicky (ani inak) vyliečiteľní, nakoľko biologicky radikálna resekcia LGG vzhľadom na ich infiltratívny rast nie je možná [3]. V poslednom čase bolo však publikovaných niekoľko prác dokladujúcich zlepšenie prognózy po rozsiahlej resekcii LGG [4–8]. Ako prognosticky významné faktory sa ukázali objem rezídua, ako aj percentuálny rozsah resekcie hyperintenzívneho tkaniva LGG zobrazeného vo FLAIR alebo T2 sekvencii. Rádiologicky radikálna a subtotálna (pod 10 cm3 reziduálneho tkaniva) resekcia, rovnako ako resekcia viac ako 90 % predoperačného objemu LGG signifikante predlžujú prežívanie pacientov, v porovnaní s pacientmi, u ktorých sa takúto resekciu nepodarilo dosiahnuť [4–8]. Resekcia je však komplikovaná infiltratívnym rastom LGG, kedy často nie je tkanivo LGG vizuálne odlíšiteľné od normálneho mozgu, alebo naopak sa aj v makroskopicky zjavne nádorovom tkanive môžu nachádzať funkčné mozgové štruktúry [9]. Vo vnútri tkaniva LGG je nález funkčne dôležitých štruktúr dokonca častejší ako v gliómoch tretieho a štvrtého stupňa malignity (high-grade gliómoch, HGG) [10], a LGG častejšie ako de novo glioblastómy rastú v sekundárne elokventných oblastiach (najmä v inzule a SMA), t. j. v oblastiach bezprostredne susediacich s primárnymi elokventnými oblasťami [11]. Operácie v elokventných oblastiach navyše sťažuje fakt, že použitím klasických anatomických kritérií nie je možné úplne spoľahlivo určiť ich presnú lokalizáciu z dôvodu posunu tkaniva spôsobeného tumorom, funkčnej reorganizácie v dôsledku mozgovej plasticity [12] a taktiež interindividuálnej variability ich umiestnenia [13]. Variabilné môže byť usporiadanie PMK [14], no najmä usporiadanie RaJ kôrových oblastí, kedy klasický model usporiadania RaJ centier v dominantnej hemisfére zďaleka neodráža skutočnú variabilitu ich lokalizácie u jednotlivých pacientov [13,15]. Predoperačné určenie polohy RaJ kortikálnych a subkortikálnych štruktúr pomocou fMR a DTI má limitovanú presnosť a nie je úplne spoľahlivé [16,17]. Preto je dôležité, okrem využitia metód slúžiacich k spresneniu anatomickej orientácie chirurga, aj čo najpresnejšie intraoperačné sledovanie funkcií mozgu.
Za jednu z najspoľahlivejších metód monitorovania mozgových funkcií je v súčasnosti považovaná AR, ktorá umožňuje rozsiahlu resekciu nádoru, pri súčasnej vysokej bezpečnosti výkonu [18]. Využitím AR je možné resekovať aj také LGG, ktoré boli donedávna považované za inoperabilné, resp. pri resekcii ktorých bol často spôsobený trvalý neurologický deficit [4,19]. Na základe výsledkov našej práce môžeme uvedené zistenia potvrdiť. U väčšiny (65 %) pacientov v našom súbore sme dosiahli radikálnu alebo subtotálnu resekciu, teda resekciu, pri dosiahnutí ktorej je možné predpokladať zlepšenie prognózy a signifikantné predĺženie času prežívania (v porovnaní s pacientmi s parciálnou resekciou). Porovnateľné počty dosiahnutých radikálnych a subtotálnych resekcií LGG lokalizovaných vo vnútri alebo v kontakte s elokventnými oblasťami uvádzajú viaceré práce. Duffau et al v súbore 122 LGG operovaných s použitím PES (v celom súbore) a AR (v 73 prípadoch LGG RaJ oblastí) udávajú 25,4 % radikálnych a 50,8 % subtotálnych resekcií [4]. Bello et al v súbore pacientov s LGG RaJ oblastí udávajú 64,2 % radikálnych a subtotálnych resekcií v prípadoch AR s intraoperačnou identifikáciou RaJ dráh a 68,8 % radikálnych a subtotálnych resekcií v prípadoch AR bez intraoperačnej identifikácie RaJ dráh [20]. V súbore pacientov s LGG v RaJ oblastiach operovaných pri vedomí udávajú Duffau et al 32 % radikálnych a 51 % subtotálnych resekcií [21]. Kim et al v súbore LGG v blízkosti elokventných štruktúr operovaných pri vedomí udávajú 37,9 % resekcií nad 95 % objemu tkaniva LGG (označených ako radikálne resekcie) a 62,1% pod 95 % objemu tkaniva LGG [22]. Ako málo uspokojivý hodnotíme fakt, že v našom súbore bola dosiahnutá len jedna skutočne rádiologicky radikálna resekcia. Môžeme hypotetizovať niekoľko príčin tohto stavu. V prvom rade boli použité prísne kritériá na hodnotenie resekcie. Na rozdiel od niektorých nových prác, v ktorých je za radikálnu považovaná aj resekcia LGG s malým rezíduom [8,22], sme v našom súbore aj nález minimálneho množstva hyperintenzívneho tkaniva (v mieste, kde sa hyperintezívne tkanivo nachádzalo aj predoperačne) považovali za subtotálnu resekciu. Za druhý dôvod môžeme považovať mimoriadne opatrné operovanie s nízkym výskytom trvalých pooperačných deficitov. Chirurg resekciu ukončil vždy, keď ju považoval za radikálnu; na rozdiel od niektorých autorov [20,23] nebolo našou stratégiou zakaždým pokračovať v resekcii, až pokým nie sú pomocou PES lokalizované okolité subkortikálne elokventné štruktúry. Takýmto postupom je síce možné dosiahnuť vyšší počet radikálnych resekcií [20,23], hrozí však väčšie riziko iatrogénneho poškodenia [22,24]. Manipulácia vo vzdialenosti menšej ako 10 mm od pyramídovej dráhy zvyšuje riziko jej ischemického poškodenia [25]. Tretím dôvodom bol fakt, že v čase operácií pacientov v prezentovanom súbore sme nemali k dispozícii intraoperačné zobrazovacie zariadenie. Neuronavigácia, vzhľadom na problém „brainshiftu“, nemôže intraoperačné zobrazovanie nahradiť [26]. U viacerých pacientov môžeme predpokladať, že by bolo možné dosiahnuť radikálnu resekciu, ak by operatér použitím intraoperačného zobrazovacieho zariadenia zistil, v ktorej časti resekčnej dutiny sa rezíduum nachádza.
Snahe o maximálne zachovanie funkčného tkaniva mozgu zodpovedal aj spôsob, akým sme monitorovali RaJ funkcie. Najčastejšie testovanými úlohami počas AR sú pomenovanie obrázkov a produkcia číselného radu [15,17,21,27–30]. Viaceré práce však dokladujú, že intraoperačným testovaním pomenovania sa nemusia poruchy niektorých RaJ funkcií prejaviť. Ojemann et al identifikovali u viacerých pacientov na kôre frontálneho, temporálneho a parietálneho laloka dominantnej hemisféry miesta, kde PES síce nenarušila pomenovanie obrázkov, avšak pri stimulácii týchto miest nastala porucha tvorby slovies [31]. Lubrano et al identifikovali na kôre dominantného gyrus frontalis medius miesta, pri stimulácii ktorých bolo selektívne narušené len písanie, bez poruchy pomenovania [32]. Bello et al vo viacerých prípadoch identifikovali na kôre dominantného gyrus frontalis inferior a gyrus temporalis superior miesta, kde PES nevyvolala poruchu pomenovania, ale len poruchy sémantických asociácií [20]. Guisanni et al opakovane identifikovali na kôre dominantného frontálneho a temporálneho laloka miesta, kde PES narušila pomenovanie známych tvárí, avšak nenarušila pomenovanie objektov [33]. Ellmore at al zaznamenali pri stimulácii tej istej časti FA selektívne poruchy porozumenia, bez poruchy produkcie reči [34]. Vzhľadom na to, že u dvoch pacientov v prvej časti súboru sme zaznamenali deficity (jeden ľahký trvalý; a jeden ťažký, ktorý sa až po deviatich mesiacoch ukázal ako reverzibilný), prestali sme intraoperačne testovať len automatické rady (počítanie) a pomenovanie, ale sústredili sme sa na čo najpodrobnejšie sledovanie pragmatickej roviny jazyka intraoperačným testovaním SPR a testovaním porozumenia. Oba prípady mali totiž spoločné to, že pooperačne sa deficit vyskytol napriek tomu, že počas intraoperačného testovania pomenovania zaznamenaný nebol. Testovanie SPR (popri iných testoch) počas resekcie tumoru uvádzajú vo svojich prácach Bello et al [20] a Mikuni et al [35]. Považujeme za dôležité, že normálny výkon v izolovanej lingvistickej úlohe nemusí byť vždy predpokladom pre efektívnu komunikáciu v bežnom živote [36–38], a najdôležitejšie pre udržanie kvality života pacienta je zachovanie pragmatickej roviny jazyka [39]. Zároveň však pripúšťame, že intraoperačné testovanie pomenovania obrázkov môže byť dostatočne silným nástrojom na odhalenie väčšiny RaJ porúch, umožňujúcim vďaka nižšej senzitivite rozsiahlejšie resekcie. Túto problematiku je potrebné naďalej skúmať na veľkých súboroch s precíznym predoperačným a pooperačným logopedickým a neuropsychologickým zhodnotením stavu pacienta. Funkčné výsledky v našom súbore považujeme za uspokojivé i v porovnaní s prácami špičkových zahraničných pracovísk. Duffau et al v súbore LGG operovaných s použitím PES (v celom súbore) a AR (v prípadoch nádorov v blízkosti RaJ oblastí) udávajú 6,5 % ťažkých trvalých deficitov [4]. V súbore pacientov s LGG v RaJ oblastiach operovaných s využitím AR udávajú Duffau et al 2 % trvalých neurologických deficitov [21]. V súbore LGG a HGG v RaJ oblastiach operovaných s využitím AR udávajú Bello et al 2,3 % [20], Sanai et al 3,2 % [13]; Kim et al v súbore s 92 % zastúpením LGG a HGG v blízkosti elokventných štruktúr operovaných pri vedomí udávajú 7 % trvalých deficitov [22].
Za alternatívu „awake“ monitoringu RaJ funkcií je niektorými autormi považované operovanie pacienta pomocou stimulačného gridu [40]. Túto metódu vzhľadom na to, že neumožňuje monitorovať integritu elokventných subkortikálnych štruktúr, nepovažujeme za plnohodnotnú alternatívu AR. V kombinácii s traktografiou RaJ dráh začlenenou do neuronavigácie je ju však možné použiť napr. v prípade pacienta odmietajúceho operáciu pri vedomí [41]. Často používanou metódou neuromonitoringu motorických funkcií v CA je monitoring integrity PD pomocou motorických evokovaných potenciálov (MEP). Táto metóda je často využívaná a je považovaná za bezpečnú [42–44], niektorí autori však upozorňujú na riziko ireverzibilného poškodenia motorických dráh predtým, ako je zaznamenaná zmena amplitúdy MEP [30,45]. Inou, bežne používanou, formou neuromonitoringu pri resekciách gliómov lokalizovaných v kontakte alebo vo vnútri motorických kôrových centier a dráh je využívanie PES u pacienta v CA. Hoci sú funkčné výsledky pri používaní tejto metódy neuromonitoringu dobré [4,23], niektorí autori napriek tomu uprednostňujú „awake“ monitoring funkcií motorických elokventných štruktúr, napr. pri operáciách dominantných aj nedominantných inzulárnych nádorov [46]. Za užitočné považujeme využitie AR aj pri odstraňovaní gliómov centrálnej krajiny postihujúcich gyrus postcentralis. Podľa našich skúseností je možné takéto nádory pomocou AR zresekovať bez novovzniknutých pooperačných porúch citlivosti. Niektorí autori považujú „awake“ monitoring dokonca za natoľko bezpečnú a spoľahlivú metódu, že ho používajú rutinne a neselektívne pri všetkých operáciách supratentoriálnych nádorov, pri ktorých nie je kontraindikovaný [47]. „Awake“ monitoring je možné doplniť o súčasné využitie ďalších foriem elektrofyziologického neuromonitoringu. Využitie PES je štandardnou súčasťou AR, nami používanú techniku stimulácie bližšie popisuje Galanda [48]. U pacienta pri vedomí je možné monitorovať integritu PD aj pomocou MEP, a spojiť tak výhody týchto foriem monitoringu funkcií mozgových štruktúr [49].
Dôležitým aspektom AR je limitovaná doba trvania „awake“ fázy z dôvodu únavy niektorých pacientov [23]. Časovo značne náročné sú predovšetkým resekcie inzulárnych gliómov [42], preto je nevyhnutné, aby bola AR nádorov v tejto lokalite vykonávaná skúseným operatérom. Využitím „awake“ monitoringu je však možné aj v prípade náročných operácií gliómov inzuly dosiahnuť rozsiahlu resekciu tkaniva nádoru pri nízkej trvalej pooperačnej morbidite [50].
Na základe našich skúseností považujeme AR za pacientmi subjektívne veľmi dobre tolerovanú metódu, všetci pacienti súboru sa k možnosti prípadnej ďalšej AR vyjadrili kladne. V súbore 16 AR autorov Bartoš et al neudávali výraznú mieru psychickej záťaže u 88 % pacientov, 93 % pacientov udávalo počas zákroku žiadnu alebo len miernu bolesť [51].
Počas operácii sa nám podarilo zistiť niekoľko neurofyziologických poznatkov. V zhode s Duffau et al sme pri stimulácii, ako i manipulácii s tkanivom fasciculus subcallosus (vlákna bielej hmoty spájajúce dominantnú SMA a gyrus cinguli s nucleus caudatus) pri prednom rohu boč-nej komory pozorovali symptómy TMA (poruchy iniciácie reči) [21,28]. Pooperačne mal jeden z pacientov agrafiu, ktorá taktiež zapadá do obrazu TMA. Pripájame sa k autorom, ktorí považujú za problematickú resekciu nádorov SMA. Po resekcii dominantnej SMA totiž môže nastať trvalý deficit reči alebo iniciácie pohybu, ako i trvalá spasticita [52], a preto je odporúčané intraoperačné sledovanie týchto funkcií u pacienta pri vedomí [53]. Riziková z hľadiska trvalého neurologického deficitu je najmä resekcia, kedy je infiltrovaná okrem SMA aj PMK [54]. Na druhej strane sú motorické deficity a deficity RaJ funkcií po resekcii SMA všeobecne považované za reverzibilné a operovanie pacienta pri vedomí môže viesť k predčasnému ukončeniu resekcie z dôvodu objavenia sa motorického deficitu narušením SMA a jej dráh, nerozoznateľného od trvalého deficitu spôsobeného porušením PMK alebo PD [55]. V zhode s Ellmore et al [34] sme pozorovali pri stimulácii FA poruchy artikulácie. Rozličné prejavy pri stimulácii tejto štruktúry pozorované ako viacerými autormi [17,21,28,34], tak aj u pacientov v nami prezentovanom súbore svedčia o doteraz nie úplne objasnenej a komplexnej funkcii FA. Za zaujímavé považujeme i pozorovanie výrazného spomalenia psychomotorického tempa pri manipulácii s bielou hmotou vláknenia corpus callosum v pravej hemisfére. Spomalenie psychomotorického tempa pri stimulácii viacerých častí corpus callosum popísali Schaltenbrand et al [56].
Záver
Na základe dosiahnutej radikality resekcií (65 % radikálnych a subtotálnych resekcií) a pooperačných funkčných výsledkov (nulová ťažká trvalá morbidita, jeden ľahký trvalý deficit) považujeme AR za prínosnú metódu v chirurgickej liečbe supratentoriálnych LGG lokalizovaných vo vnútri alebo v priamom kontakte s elokventnými štruktúrami. Umožňuje dosiahnutie rozsiahlej resekcie, ktorá by najmä v prípadoch LGG lokalizovaných vo vnútri alebo v priamom kontakte s RaJ oblasťami nebola v celkovej anestézii bezpečne dosiahnuteľná ani za použitia súčasných zobrazovacích diagnostických metód a využitia elektrofyziologického neuromonitoringu. Okrem adekvátnej liečby nádorového ochorenia umožňuje AR i unikátny pohľad na funkcie jednotlivých štruktúr mozgu. Operácie LGG v určitých oblastiach však zostávajú problematické, aj pri využití AR. Poškodenie niektorých zložitých neurologických funkcií môže ostať aj napriek operovaniu pri vedomí nepovšimnuté, metodiku intraoperačného testovania mozgových funkcií počas AR je potrebné naďalej zdokonaľovať.
Zoznam skratiek
- AR „awake“ resekcia
- CA celková anestézia
- DTI zobrazenie tenzorov difúzie (Diffusion Tensor Imaging)
- FA fasciculus arcuatus
- FLAIR FLuid Attenuated Inverse Recovery
- fMR funkčná magnetická rezonancia
- HGG high-grade gliómy
- KPS Karnofského skóre výkonnosti (Karnofsky Performance Scale)
- LGG low-grade gliómy
- MEP motorické evokované potencionály
- PD pyramídová dráha
- PES priama elektrická stimulácia
- PMK primárna motorická kôra
- RaJ rečové a jazykové
- SMA suplementárna motorická oblasť (Supplementary Motor Area)
- SRP spontánna rečová produkcia
- TMA transkortikálna motorická afázia
Prijaté k recenzii: 25. 2. 2011
Prijaté do tlače: 7. 4. 2011MUDr. Andrej Šteňo
Neurochirurgická klinika LF UK UN Bratislava Nemocnica ak. L. Dérera
Limbová 5
833 04 Bratislava
e-mail: andrej.steno@gmail.com
Zdroje
1. Pouratian N, Schiff D. Management of low-grade glioma. Curr Neurol Neurosci Rep 2010; 10(3): 224–231.
2. Soffietti R, Baumert BG, Bello L, von Deimling A, Duffau H, Frénay M et al. Guidelines on management of low-grade gliomas: report of an EFNS-EANO Task Force. Eur J Neurol 2010; 17(9): 1124–1133.
3. Sanai N, Berger MS. Glioma extent of resection and its impact on patient outcome. Neurosurgery 2008; 62(4): 753–764.
4. Duffau H, Lopes M, Arthuis F, Bitar A, Sichez JP, Van Effenterre R et al. Contribution of intraoperative electrical stimulations in surgery of low grade gliomas: a comparative study between two series without (1985–1996) and with (1996–2003) functional mapping in the same institution. J Neurol Neurosurg Psychiatry 2005; 76(6): 845–851.
5. Claus EB, Horlacher A, Hsu L, Schwartz RB, Dello-Iacono D, Talos F et al. Survival rates in patients with low-grade glioma after intraoperative magnetic resonance image guidance. Cancer 2005; 103(6): 1227–1233.
6. Smith JS, Chang EF, Lamborn KR, Chang SM, Prados MD, Cha S et al. Role of extent of resection in the long-term outcome of low-grade hemispheric gliomas. J Clin Oncol 2008; 26(8): 1338–1345.
7. McGirt MJ, Chaichana KL, Attenello FJ, Weingart JD, Than K, Burger PC et al. Extent of surgical resection is independently associated with survival in patients with hemispheric infiltrating low-grade gliomas. Neurosurgery 2008; 63(4): 700–707.
8. Ahmadi R, Dictus C, Hartmann C, Zürn O, Edler L, Hartmann M et al. Long-term outcome and survival of surgically treated supratentorial low-grade glioma in adult patients. Acta Neurochir (Wien) 2009; 151(11): 1359–1365.
9. Skirboll SS, Ojemann GA, Berger MS, Lettich E, Winn HR. Functional cortex and subcortical white matter located within gliomas. Neurosurgery 1996; 38(4): 678–684.
10. Schiffbauer H, Ferrari P, Rowley HA, Berger MS, Roberts TP. Functional activity within brain tumors: a magnetic source imaging study. Neurosurgery 2001; 49(6): 1313–1320.
11. Duffau H, Capelle L. Preferential brain locations of low-grade gliomas. Cancer 2004; 100(12): 2622–2626.
12. Duffau H, Denvil D, Capelle L. Long term reshaping of language, sensory, and motor maps after glioma resection: a new parameter to integrate in the surgical strategy. J Neurol Neurosurg Psychiatry 2002; 72(4): 511–516.
13. Sanai N, Mirzadeh Z, Berger MS. Functional outcome after language mapping for glioma resection. N Engl J Med 2008; 358(1): 18–27.
14. Lehéricy S, Duffau H, Cornu P, Capelle L, Pidoux B, Carpentier A et al. Correspondence between functional magnetic resonance imaging somatotopy and individual brain anatomy of the central region: comparison with intraoperative stimulation in patients with brain tumors. J Neurosurg 2000; 92(4): 589–598.
15. Ojemann G, Ojemann J, Lettich E, Berger M. Cortical language localization in left, dominant hemisphere. An electrical stimulation mapping investigation in 117 patients. J Neurosurg 1989; 71(3): 316–326.
16. Giussani C, Roux FE, Ojemann J, Sganzerla EP, Pirillo D, Papagno C. Is preoperative functional magnetic resonance imaging reliable for language areas mapping in brain tumor surgery? Review of language functional magnetic resonance imaging and direct cortical stimulation correlation studies. Neurosurgery 2010; 66(1): 113–120.
17. Leclercq D, Duffau H, Delmaire C, Capelle L, Gatignol P, Ducros M et al. Comparison of diffusion tensor imaging tractography of language tracts and intraoperative subcortical stimulations. J Neurosurg 2010; 112(3): 503–511.
18. Otani N, Bjeljac M, Muroi C, Weniger D, Khan N, Wieser HG et al. Awake surgery for glioma resection in eloquent areas - Zurich’s experience and review. Neurol Med Chir (Tokyo) 2005; 45(10): 501–510.
19. Bertani G, Fava E, Casaceli G, Carrabba G, Casarotti A, Papagno C et al. Intraoperative mapping and monitoring of brain functions for the resection of low-grade gliomas: technical considerations. Neurosurg Focus 2009; 27(4): E4.
20. Bello L, Gallucci M, Fava M, Carrabba G, Giussani C, Acerbi F et al. Intraoperative subcortical language tract mapping guides surgical removal of gliomas involving speech areas. Neurosurgery 2007; 60(1): 67–80.
21. Duffau H, Peggy Gatignol ST, Mandonnet E, Capelle L, Taillandier L. Intraoperative subcortical stimulation mapping of language pathways in a consecutive series of 115 patients with Grade II glioma in the left dominant hemisphere. J Neurosurg 2008; 109(3): 461–471.
22. Kim SS, McCutcheon IE, Suki D, Weinberg JS, Sawaya R, Lang FF et al. Awake craniotomy for brain tumors near eloquent cortex: correlation of intraoperative cortical mapping with neurological outcomes in 309 consecutive patients. Neurosurgery 2009; 64(5): 836–845.
23. Duffau H, Capelle L, Denvil D, Sichez N, Gatignol P, Taillandier L et al. Usefulness of intraoperative electrical subcortical mapping during surgery for low-grade gliomas located within eloquent brain regions: functional results in a consecutive series of 103 patients. J Neurosurg 2003; 98(4): 764–778.
24. Keles GE, Lundin DA, Lamborn KR, Chang EF, Ojemann G, Berger MS. Intraoperative subcortical stimulation mapping for hemispherical perirolandic gliomas located within or adjacent to the descending motor pathways: evaluation of morbidity and assessment of functional outcome in 294 patients. J Neurosurg 2004; 100(3): 369–375.
25. Kamada K, Todo T, Ota T, Ino K, Masutani Y, Aoki S et al. The motor-evoked potential threshold evaluated by tractography and electrical stimulation. J Neurosurg 200; 111(4): 785–795.
26. Nimsky C, Ganslandt O, Cerny S, Hastreiter P, Greiner G, Fahlbusch R. Quantification of, visualization of, and compensation for brain shift using intraoperative magnetic resonance imaging. Neurosurgery 2000; 47(5): 1070–1079.
27. Haglund MM, Berger MS, Shamseldin M, Lettich E, Ojemann GA. Cortical localization of temporal lobe language sites in patients with gliomas. Neurosurgery 1994; 34(4): 567–576.
28. Duffau H, Capelle L, Sichez N, Denvil D, Lopes M, Sichez JP et al. Intraoperative mapping of the subcortical language pathways using direct stimulations. An anatomo-functional study. Brain 2002; 125(Pt 1): 199–214.
29. Ilmberger J, Ruge M, Kreth FW, Briegel J, Reulen HJ, Tonn JC. Intraoperative mapping of language functions: a longitudinal neurolinguistic analysis. J Neurosurg 2008; 109(4): 583–592.
30. Berger MS, Hadjipanayis CG. Surgery of intrinsic cerebral tumors. Neurosurgery 2007; 61 (Suppl 1): 279–304.
31. Ojemann JG, Ojemann GA, Lettich E. Cortical stimulation mapping of language cortex by using a verb generation task: effects of learning and comparison to mapping based on object naming. J Neurosurg 2002; 97(1): 33–38.
32. Lubrano V, Roux FE, Démonet JF. Writing-specific sites in frontal areas: a cortical stimulation study. J Neurosurg 2004; 101(5): 787–798.
33. Giussani C, Roux FE, Bello L, Lauwers-Cances V, Papagno C, Gaini SM et al. Who is who: areas of the brain associated with recognizing and naming famous faces. J Neurosurg 2009; 110(2): 289–299.
34. Ellmore TM, Beauchamp MS, O’Neill TJ, Dreyer S, Tandon N. Relationships between essential cortical language sites and subcortical pathways. J Neurosurg 2009; 111(4): 755–566.
35. Mikuni N, Okada T, Enatsu R, Miki Y, Hanakawa T, Urayama S et al. Clinical impact of integrated functional neuronavigation and subcortical electrical stimulation to preserve motor function during resection of brain tumors. J Neurosurg 2007; 106(4): 593–598.
36. Beeke S, Wilkinson R, Maxim J. Exploring aphasic grammar. 2: Do language testing and conversation tell a similar story? Clin Linguist Phon 2003; 17(2): 109–134.
37. Horton S. Critical reflection in speech and language therapy: research and practice. Int J Lang Commun Disord 2004; 39(4): 486–490.
38. Wilkinson R. Reflecting on talk in speech and language therapy: some contributions using conversation analysis. Int J Lang Commun Disord 2004; 39(4): 497–503.
39. Simmons-Mackie N. Social approach to aphasia intervention. In: Chapey R (ed). Language intervention strategies in aphasia and related neurogenic communication disorders. 5th ed. Baltimore: Lippincott Williams & Wilkins 2008 : 290–318.
40. Kral T, Kurthen M, Schramm J, Urbach H, Meyer B. Stimulation mapping via implanted grid electrodes prior to surgery for gliomas in highly eloquent cortex. Neurosurgery 2006; 58 (Suppl 1): ONS36–ONS43.
41. Bartoš R, Ceé J, Zolal A, Hejčl A, Bolcha M, Prokšová J et al. Extraoperativní mapování pomocí kortikálního gridu před resekcí difuzního oligodendrogliomu v řečově dominantní hemisféře – alternativa „awake kraniotomie“ – kazuistika. Cesk Slov Neurol N 2008; 71/104(6): 718–721.
42. Bartoš R, Sameš M, Zolal A, Radovnický T, Hejčl A, Vachata P et al. Resekce inzulárních gliomů – volumetrické měření radikality. Cesk Slov Neurol N 2009; 72/105(6): 534–541.
43. Neuloh G, Pechstein U, Schramm J. Motor tract monitoring during insular glioma surgery. J Neurosurg 2007; 106(4): 582–592.
44. Ostrý S, Stejskal L. Evokované odpovědi a elektromyografie v intraoperační monitoraci v neurochirurgii. Cesk Slov Neurol N 2010; 73/106 (1): 8–19.
45. Kombos T, Suess O, Ciklatekerlio O, Brock M. Monitoring of intraoperative motor evoked potentials to increase the safety of surgery in and around the motor cortex. J Neurosurg 2001; 95(4): 608–614.
46. Hentschel SJ, Lang FF. Surgical resection of intrinsic insular tumors. Neurosurgery 2005; 57 (Suppl 1): 176–183.
47. Serletis D, Bernstein M. Prospective study of awake craniotomy used routinely and nonselectively for supratentorial tumors. J Neurosurg 2007; 107(1): 1–6.
48. Galanda M. Intraoperačné neurofyziologické monitorovanie. In: Haruštiak S (ed). Princípy chirurgie II. Bratislava: Slovak Academic Press 2010 : 26–30.
49. Szelényi A, Bello L, Duffau H, Fava E, Feigl GC, Galanda M et al. Intraoperative electrical stimulation in awake craniotomy: methodological aspects of current practice. Neurosurg Focus 2010; 28(2): E7.
50. Duffau H, Moritz-Gasser S, Gatignol P. Functional outcome after language mapping for insular World Health Organization Grade II gliomas in the dominant hemisphere: experience with 24 patients. Neurosurg Focus 2009; 27(2): E7.
51. Bartoš R, Sameš M, Vachata P, Červenka M, Jech R, Vymazal J et al. Výsledky a tolerance „awake“ resekcí mozkových tumorů. Cesk Slov Neurol N 2005; 68/101(1): 39–45.
52. Fontaine D, Capelle L, Duffau H. Somatotopy of the supplementary motor area: evidence from correlation of the extent of surgical resection with the clinical patterns of deficit. Neurosurgery 2002; 50(2): 297–303.
53. Peraud A, Meschede M, Eisner W, Ilmberger J, Reulen HJ. Surgical resection of grade II astrocytomas in the superior frontal gyrus. Neurosurgery 2002; 50(5): 966–975.
54. Duffau H, Capelle L, Denvil D, Sichez N, Gatignol P, Lopes M et al. Functional recovery after surgical resection of low grade gliomas in eloquent brain: hypothesis of brain compensation. J Neurol Neurosurg Psychiatry 2003; 74(7): 901–907.
55. Fontaine D, Capelle L, Duffau H. Somatotopy of the supplementary motor area: evidence from correlation of the extent of surgical resection with the clinical patterns of deficit. Neurosurgery 2002; 50(2): 297–303.
56. Schaltenbrand G, Spuer H, Wahren W. Electroanatomy of the corpus callosum radiation according to the facts of stereotactic stimulation in man. Z Neurol 1970; 198(1): 79–92.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článek Webové okénko
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2011 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Kognitivní evokované potenciály
- Vyšetření očních pohybů v neurologické praxi
- Agregometrie v sekundární prevenci cévních mozkových příhod. Aspirinová rezistence
- Vývojová porucha koordinace – vývojová dyspraxie
- „Awake“ resekcia supratentoriálnych low-grade gliómov lokalizovaných vo vnútri alebo v priamom kontakte s elokventnými oblasťami
- Jaroslav Opavský. Bolest v ambulantní praxi
- Kognitivní dysfunkce u pacientů s klinickým izolovaným syndromem a roztroušenou sklerózou
- Zkušenosti s evakuací chronického subdurálního hematomu z návrtu kalvy
- Prevence žilní trombózy a plicní embolizace v neurochirurgii
- Kvalita života po hluboké mozkové stimulaci u pacientů s pokročilou Parkinsonovou nemocí
- Hereditární časná forma Alzheimerovy nemoci v důsledku zárodečné mutace p.M139V v genu PSEN1 – kazuistika
- Oboustranná ischemická retinopatie a neuropatie optiku jako izolovaný oční projev vysokohorské nemoci – kazuistika
- Progredující spasticita, kognitivní deficit a nevýbavné kortikální motorické evokované potenciály jako klinické příznaky pravděpodobné primární laterální sklerózy – kazuistika
- Kalcifikující pseudoneoplazma nervového systému – tři kazuistiky
- Vysoké štátne vyznamenanie prof. Danielovi Bartkovi
- Přímý inhibitor trombinu dabigatran etexilát schválen v Evropě pro prevenci cévních mozkových příhod u pacientů s fibrilací síní
- Webové okénko
- Analýza dat v neurologii XXIX. - Spolehlivost (reliabilita) klinických testů
- 7. olomoucké neuroimunologické sympozium s mezinárodní účastí - Olomouc, 22.–23. září 2011
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Vývojová porucha koordinace – vývojová dyspraxie
- Kognitivní evokované potenciály
- Progredující spasticita, kognitivní deficit a nevýbavné kortikální motorické evokované potenciály jako klinické příznaky pravděpodobné primární laterální sklerózy – kazuistika
- Zkušenosti s evakuací chronického subdurálního hematomu z návrtu kalvy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



