-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Prostorová orientace při fyziologickém a patologickém stárnutí
Prostorová orientace při fyziologickém a patologickém stárnutí
Prostorová orientace je schopnost určování a udržování trasy z jednoho místa do druhého. V průběhu fyziologického stárnutí dochází k postupnému mírnému zhoršování prostorové orientace. Nicméně výrazné postižení prostorové orientace může být první známkou počínající Alzheimerovy choroby, ještě před plným rozvojem syndromu demence, ve stadiu mírné kognitivní poruchy. Především pacienti, kteří mají velmi vysoké riziko rozvoje Alzheimerovy choroby, pacienti s mírnou kognitivní poruchou s postižením paměti hipokampálního typu projevující se poruchou ukládání a vybavování informací mají výrazně porušenu prostorovou orientaci podobného charakteru jako pacienti s lehkou Alzheimerovou chorobou. Testování prostorové orientace u starší populace a vývoj počítačových testů pro rutinní klinické použití tedy představují nejen možnost dále prozkoumat tuto kognitivní doménu, ale zejména možnost velmi časné diagnostiky Alzheimerovy choroby. Jelikož velká část základního výzkumu kognice a preklinického zkoušení kognitiv u laboratorních zvířat je prováděna testy prostorové kognice, má výzkum prostorové orientace u lidí velký význam i z hlediska translačního výzkumu.
Klíčová slova:
prostorová orientace – fyziologické stárnutí – patologické stárnutí – mírná kognitivní porucha – Alzheimerova choroba
Spatial Navigation in Physiological and Pathological Ageing
Spatial navigation is a process of determining and maintaining a course or trajectory from one place to another. There is a mild progressive decline of spatial navigation in the course of physiological ageing. Nevertheless, severe spatial navigation deficit might be the first sign of incipient Alzheimer’s disease at the stage of mild cognitive impairment, before the full dementia syndrome develops. Patients with mild cognitive impairment with memory deficit of hippocampal type, manifested by encoding and retrieval impairment, are at very high risk of Alzheimer’s disease. These patients have the same pattern of spatial navigation impairment as patients with mild Alzheimer’s disease. Spatial navigation testing in older patients and a development of computerized tests for routine clinical use thus represent a possibility to further investigate this cognitive domain as well as an opportunity of an early diagnosis of Alzheimer’s disease. Spatial navigation in humans is of great significance for translational research as spatial navigation tests form a major part of basic cognitive research and are also used in preclinical testing of cognitive drugs in laboratory animals.
Key words:
spatial navigation – physiological ageing – pathological ageing – mild cognitive impairment – Alzheimer’s disease
Autoři: I. Gažová; K. Vlček; Z. Nedělská; I. Mokrišová; E. Hynčicová; J. Laczó; J. Hort
Působiště autorů: Kognitivní centrum, Neurologická klinika, UK v Praze, 2. LF a FN v Motole, Praha 1; Mezinárodní centrum klinického výzkumu, FN u sv. Anny v Brně 2; Oddělení neurofyziologie paměti, Fyziologický ústav AV ČR 3
Vyšlo v časopise: Cesk Slov Neurol N 2012; 75/108(4): 411-414
Kategorie: Přehledný referát
Souhrn
Prostorová orientace je schopnost určování a udržování trasy z jednoho místa do druhého. V průběhu fyziologického stárnutí dochází k postupnému mírnému zhoršování prostorové orientace. Nicméně výrazné postižení prostorové orientace může být první známkou počínající Alzheimerovy choroby, ještě před plným rozvojem syndromu demence, ve stadiu mírné kognitivní poruchy. Především pacienti, kteří mají velmi vysoké riziko rozvoje Alzheimerovy choroby, pacienti s mírnou kognitivní poruchou s postižením paměti hipokampálního typu projevující se poruchou ukládání a vybavování informací mají výrazně porušenu prostorovou orientaci podobného charakteru jako pacienti s lehkou Alzheimerovou chorobou. Testování prostorové orientace u starší populace a vývoj počítačových testů pro rutinní klinické použití tedy představují nejen možnost dále prozkoumat tuto kognitivní doménu, ale zejména možnost velmi časné diagnostiky Alzheimerovy choroby. Jelikož velká část základního výzkumu kognice a preklinického zkoušení kognitiv u laboratorních zvířat je prováděna testy prostorové kognice, má výzkum prostorové orientace u lidí velký význam i z hlediska translačního výzkumu.
Klíčová slova:
prostorová orientace – fyziologické stárnutí – patologické stárnutí – mírná kognitivní porucha – Alzheimerova chorobaÚvod
Prostorová orientace je fylogeneticky jedna z nejstarších kognitivních funkcí, z evolučního hlediska významná při hledání potravy, partnera či vyhýbání se nepříteli a nebezpečným místům. U člověka představuje schopnost pohybu v prostoru a zapamatování si cesty.
Pojem prostorová orientace v užším významu označuje proces určování a udržování trasy z jednoho bodu do druhého s využitím základních orientačních strategií. Zhoršení prostorové orientace je častá obtíž i stížnost starší populace a významnou měrou určuje kvalitu života seniorů. Může být prvním příznakem demence.
Vzhledem k tomu, že velká část poznatků o fungování paměti byla na zvířecích modelech získána právě studiem prostorové orientace a paměti v Morrisově vodním bludišti a tato metoda je dodnes používána u zvířat v časných stadiích zkoušení nových léků, zdá se testování prostorové orientace u lidí velmi důležité z hlediska translačního výzkumu.
V následujícím článku shrneme poznatky o změnách prostorové orientace při fyziologickém a patologickém stárnutí u lidí a jejich praktický význam pro včasnou diagnostiku Alzheimerovy choroby (ACH).
Patologické a fyziologické stárnutí
Fyziologické stárnutí je podle současných poznatků spojeno s nerovnoměrným poklesem kognice, který však nevede ke zhoršení soběstačnosti. Typická je lehká porucha zejména vybavování nových paměťových stop, časté je i postižení pozornosti, pracovní paměti a exekutivních funkcí, zatímco sémantická paměť a fatické funkce zůstávají z velké části zachovány [1].
Zhoršení soběstačnosti vlivem kognitivní poruchy je již považováno za projev demence. Pojmem demence je označován chronický a zpravidla progredující pokles kognitivních funkcí omezující každodenní aktivity jedince, zpočátku instrumentální (telefonování, finance, nakupování), pak bazální (stolování, oblékání, hygiena) [2].
Rozvoji syndromu demence často předchází stadium označované jako mírná kognitivní porucha (MCI, z anglického Mild Cognitive Impairment) [3,4]. MCI je charakterizována jako soubor příznaků vyplývajících z lehkého postižení kognitivních funkcí, přičemž nedochází k výraznému narušení každodenních aktivit a postižené osoby tedy nesplňují kritéria demence. Klinicky je detekovatelná porucha v jedné či více kognitivních doménách (paměť, exekutivní funkce, pozornost, řeč a vizuospaciální funkce) nebo intraindividuální pokles kognice při opakovaném testování s odstupem času. Podle posledních diagnostických kritérií se zhoršení skóre v neuropsychologických testech pohybuje mezi 1 až 1,5 SD pod průměrem stanoveným pro daný věk a vzdělání [5]. MCI syndrom může vyústit do různých typů demencí, přičemž formy MCI, u kterých je postižena paměť, přecházejí typicky do demence Alzheimerova typu [6].
ACH je nejčastějším typem demence. Nemoc byla poprvé popsána Aloisem Alzheimerem na případu pacientky Augusty D., záznam také obsahuje zmínku o poruše orientace v prostoru [7].
ACH je v časné fázi charakterizována převažujícím postižením hipokampu a později i konvexity temporálního a parietálního laloku. Klinickým korelátem je porucha deklarativní paměti s dominantním postižením anterográdní epizodické paměti, porucha exekutivních a vizuospaciálních funkcí, a dále fatická porucha, obvykle na začátku anomická afázie [8] a v rozvinutém stadiu transkortikální senzorická či Brocova afázie [9].
Definitivní diagnóza ACH může být stanovena až post mortem imunohistochemickým průkazem neuritických plak tvořených β amyloidem a neurofibrilárních klubíček obsahujících tau protein v neokortexu a limbickém systému [10].
Klinická diagnóza ACH je založena na komplexním klinickém a neuropsychologickém vyšetření.
S vývojem nových léků vystupuje do popředí důležitost včasné diagnostiky ACH, nejlépe již ve stadiu MCI. Jako pomocné vyšetření se nabízí využití řady biomarkerů, které jsou v současnosti široce studovány a staly se součástí nových diagnostických kritérií [5]. Pojem biomarker označuje objektivně měřitelný indikátor normálních a patologických procesů (onemocnění). Mezi biomarkery ACH se řadí například měření β amyloidu a tau proteinu v cerebrospinálním moku [11]. Další výzkum biomarkerů probíhá v oblasti genetického testování, zobrazovacích metod a dalších. Rutinnímu klinickému využití mnoha biomarkerů zatím brání jejich invazivita, vysoká cena či nedostatek důkazů pro jejich použití [12]. Podle některých studií je jedním z potenciálních psychologických markerů ACH postižení prostorové orientace, které je detekovatelné již v časnému stadiu nemoci [13,14], a dokonce i v jejím prodromálním stadiu [15–18].
Základní typy orientačních strategií
Schopnost orientace v prostoru je založena na tvorbě kognitivních map, které představují vnitřní reprezentaci prostoru. Podle způsobu, jakým je kognitivní mapa utvářena, se rozlišují tři základní navigační strategie. První typ, egocentrická orientace, se zakládá na určování směru a vzdálenosti vzhledem k vlastní pozici subjektu. V rámci tohoto typu se vyčleňuje orientace k blízké značce (z anglického cued navigation), při které subjekt rozlišuje orientační značky v bezprostředním okolí a pohybuje se směrem k nim. Druhým typem je allocentrická orientace, která využívá informace o vzdálenostech v prostředí nezávisle na pozici subjektu [19]. Třetí typ, integrace dráhy (z anglického path integration), je typ orientace, při kterém je kognitivní mapa utvářena bez použití zraku, na základě informací o směru a rychlosti pohybu v prostředí vycházejících ze signálů z vestibulárního ústrojí, gravireceptorů a proprioreceptorů.
Morfologické koreláty poruch prostorové orientace
Pro schopnost orientace v prostoru jsou klíčové struktury středního spánkového laloku, zejména hipokampus [19–21]. V roce 1971 O’Keefe et al objevili v hipokampu potkana specifické místové buňky (z anglického place cells), které se aktivují, pokud se zvíře nachází na určitém konkrétním místě v prostoru [19]. Role hipokampu v prostorové navigaci byla doložena ve studii, kde Morris et al zjistili, že u potkanů s lézí v oblasti hipokampu dochází k poruše prostorové orientace detekované v Morrisově vodním bludišti [21]. Podobně i studie u lidí dokazují, že hipokampus je nezbytný pro správnou orientaci v prostoru [22,23]. Předpokládá se, že role hipokampu spočívá hlavně ve zpracovávání a ukládání informace o prostředí [24], která je následně skladována v prostorové paměti ve formě kognitivní mapy. Z toho vyplývá, že funkce hipokampu je důležitá zejména pro allocentrickou navigaci. Tuto teorii podporuje studie, ve které Holdstock et al testovali pacienta YR se selektivním postižením obou hipokampů a zjistili, že YR měl větší problémy při vybavení allocentrické prostorové informace (určené vzájemnou polohou orientačních bodů) než při vybavení egocentrické prostorové informace (závislé na pozici subjektu) [25]. Předpokládá se, že egocentrická orientace není na hipokampu závislá a podílí se na ní zejména parietální kortex [26].
Ve své longitudinální studii Raz et al [27] uvádějí, že u lidí dochází se zvyšujícím se věkem ke zmenšování objemu hipokampu, na základě čeho se můžeme domnívat, že stárnutí ovlivňuje zejména allocentrickou navigaci [28].
Podobně funkční zobrazovací metody ukazují sníženou aktivaci hipokampu a přilehlých struktur při plnění navigačních úkolů u starších jedinců a poukazují na možnou souvislost snížené funkce hipokampu a poruchy prostorové orientace u starších lidí [29,30]. Rovněž při rozvoji ACH jsou hipokampus a struktury středního spánkového laloku postiženy již na začátku onemocnění [31].
Postižení prostorové orientace při fyziologickém a patologickém stárnutí
Porucha orientace v prostoru je častou obtíží seniorů omezující jejich každodenní aktivity a snižující jejich soběstačnost. Senioři mnohdy upozorňují na problémy s prostorovou orientací především při řízení auta, v důsledku kterých se vyhýbají neznámým místům a trasám, což má negativní dopad na jejich mobilitu [32]. Starší jedinci mají větší problémy se zapamatováním trasy a určením správného směru při orientaci [33]. Při vyšetřování prostorové orientace se často používají testy vycházející z testů používaných v animálním výzkumu. Nejčastěji takto používaným modelem je MWM, jehož lidská analogie byla použita v mnoha studiích. Z těchto studií vyplývá, že u seniorů je porušena schopnost ukládání a vybavení informace v rámci prostorové paměti [34]. Senioři také potřebují delší čas k vytvoření kognitivní mapy okolního prostředí a při jejím použití k orientaci v prostoru se dopouští více chyb než mladí jedinci [35]. Studie zaměřené na rozdíly mezi pohlavími svědčí pro obecně lepší schopnost prostorové orientace u mužů [36,37] v různých věkových kategoriích [38].
Moffat a Resnick [39] testovali věkem podmíněné rozdíly ve využití navigačních strategií pomocí virtuální verze MWM. Tato studie ukázala, že starší jedinci se při orientaci v prostoru řídí více pomocí blízkých orientační bodů a nejsou schopni adekvátně využít vzdálené orientační značky. Z toho vyplývá, že jejich schopnost tvorby a využití kognitivní mapy prostředí je omezená. Tyto výsledky naznačují, že ve vyšším věku dochází k postižení zejména allocentrické navigační strategie, při které jsou kognitivní mapy využívány. V souladu s těmito nálezy vyplývá ze závěrů recentní studie [28], že u starších jedinců výrazně převažuje využití egocentrické navigační strategie, zatímco u mladších jedinců je rovnoměrně zastoupené využití obou strategií. Podkladem těchto změn je podle autorů nejspíše dysfunkce hipokampu.
U pacientů s ACH je prokázáno postižení prostorové orientace již v časných stadiích nemoci [13,14]. Postižena je jak allocentrická, tak egocentrická orientační strategie [40]. Další studie naznačují, že porucha prostorové orientace je detekovatelná i ve stadiu MCI [15–18,41].
MCI je heterogenní skupina, kterou lze rozdělit na amnestickou MCI (s poruchou paměti) a nemanestickou (bez poruchy paměti) [42]. Z dosavadního výzkumu vyplývá, že pacienti s amnestickou MCI (aMCI) mají zvýšené riziko rozvoje ACH [42]. Současný výzkum se proto zaměřil na testování prostorové orientace u pacientů s amnestickou MCI a hledáním souvislosti s rozvojem ACH. Amnestickou MCI lze dále dělit podle charakteru postižení paměti na nehipokampální aMCI (NHaMCI), s izolovanou poruchou vybavování a hipokampální aMCI (HaMCI), s poruchou ukládání i vybavování paměťové informace, která podle recentních poznatků představuje prodromální stadium ACH. Postižení prostorové orientace u pacientů s HaMCI se zabývala studie autorů Laczó et al [16], která prokázala výraznější postižení prostorové orientace u této skupiny ve srovnání se skupinou NHaMCI. Pacienti s HaMCI měli podobný výkon jako pacienti s lehkou ACH. Na základě těchto výsledků se autoři domnívají, že porucha prostorové orientace u HaMCI může být první známkou počínající ACH a že měření prostorové orientace u pacientů s aMCI umožní identifikovat pacienty s vyšším rizikem rozvoje ACH [16,41].
Pro ověření této hypotézy jsou však nutné další, zejména longitudinální studie. Pro praxi je dále důležité, že výsledky testů prostorové orientace v reálném prostředí byly replikovány i v ekvivalentních počítačových 2D verzích [43]. Toto vyšetření je v České republice dostupné v Laboratoři prostorové kognice, která se nachází v Kognitivním centru 2. LF UK a FN v Motole. Zde je umístněna Blue Velvet Arena (BVA), která představuje lidskou analogii MWM (obr. 1). Testování probíhá paralelně pomocí 2D počítačových testů. Výsledky jsou zpracovány softwarem. Toto experimentální vyšetření je dostupné v indikovaných případech, pacienti jsou objednáni po vyšetření v kognitivním centru.
Obr. 1. Blue Velvet Arena – schéma tří orientačních úloh: (zleva) allocentrická + egocentrická, egocentrická, allocentrická. 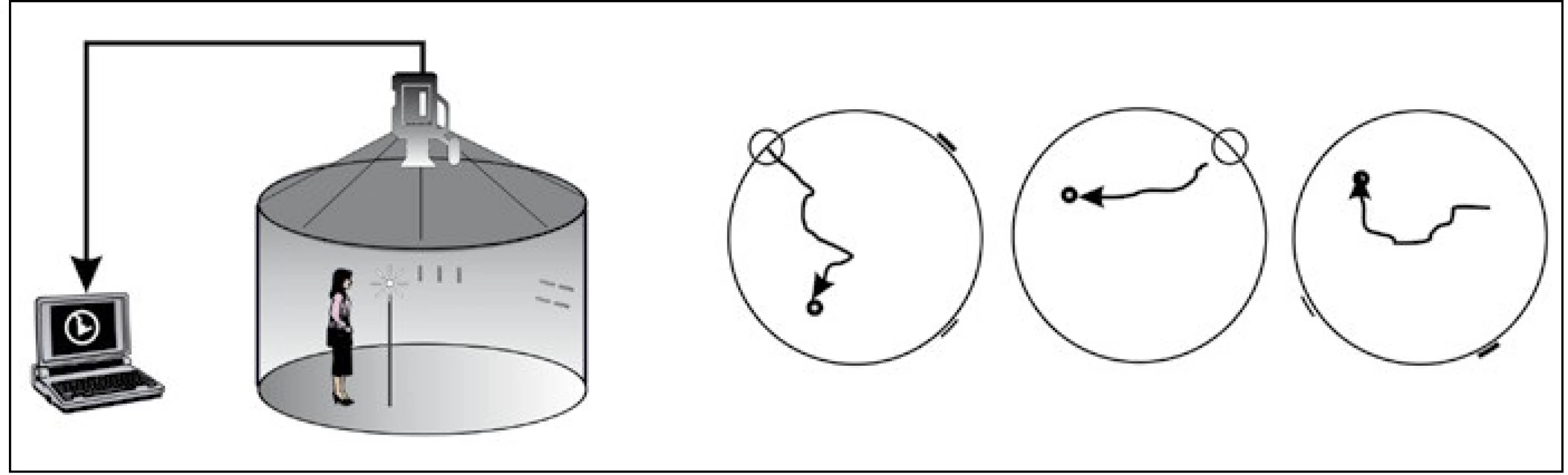
Závěr
V průběhu fyziologického stárnutí dochází k detekovatelnému zhoršení prostorové orientace, a to zejména v allocentrické složce. Podkladem tohoto zhoršení je pravděpodobně dysfunkce hipokampu. V souvislosti s nejnovějšími poznatky o patofyziologii ACH by se mohlo jednat o jednu z prvních známek preklinické ACH, předcházející vlastní demenci o mnoho let. To by pak relativizovalo rozdíly mezi tím, co je považováno za fyziologické a patologické stárnutí vzhledem ke vzniku demence. Přesvědčivý klinický důkaz však dosud chybí.
Porucha prostorové orientace byla prokázána již ve fázi MCI a jako taková je pravděpodobně velmi časným psychologickým indikátorem počínající demence.
Testování prostorové navigace u pacientů s MCI by v budoucnosti mohlo sloužit k identifikaci jedinců s vyšším rizikem rozvoje ACH. K testování prostorové orientace je možné použít nejen testy v reálném prostředí, ale i počítačové 2D testy.
Do budoucna je nutné pokračovat ve vývoji a validizaci počítačových testů použitelných v rutinní klinické praxi a v rámci translačního výzkumu při zkoušení nových léků. Také se ukazuje nutnost doplnit nové longitudinální studie zaměřené na poruchu prostorové navigace a její korelaci s biomarkery AD u zdravé starší populace a v jednotlivých podskupinách pacientů s MCI.
MUDr. Ivana Gažová
Neurologická klinika
2. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
e-mail: ivana.gazova1@gmail.com
Přijato k recenzi: 5. 12. 2011
Přijato do tisku: 17. 1. 2012
Zdroje
1. Park DC. Basic mechanisms accounting for age--related decline in cognitive functions. In: Park DC, Schwarz N (eds). Cognitive ageing: a primer. Philadelphia: Psychology Press 2000 : 3–22.
2. Ressner P, Hort J, Rektorova I, Bartoš A, Rusina R, Linek V et al. Doporučené postupy pro diagnostiku Alzheimerovy nemoci a dalšich onemocnění spojených s demencí. Cesk Slov Neurol N 2008; 71/104(4): 494–501.
3. Morris JC, Storandt M, Miller JP, McKeel DW, Price JL, Rubin EH et al. Mild cognitive impairment represents early-stage Alzheimer disease. Arch Neurol 2001; 58(3): 397–405.
4. Petersen RC. Mild cognitive impairment as a diagnostic entity. J Intern Med 2004; 256(3):
183–194.
5. Albert MS, DeKosky ST, Dickson D, Dubois B, Feldman HH, Fox NC et al. The diagnosis of mild cognitive impairment due to Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. Alzheimers Dement 2011; 7(3): 270–279.
6. Yaffe K, Petersen RC, Lindquist K, Kramer J, Miller B.
Subtype of mild cognitive impairment and progression to dementia and death. Dement Geriatr Cogn Disord 2006; 22(4): 312–319.
7. Strassnig M, Ganguli M. About a peculiar disease of the cerebral cortex: Alzheimer’s original case revisited. Psychiatry (Edgmont) 2005; 2(9): 30–33.
8. Baudic S, Barba GD, Thibaudet MC, Smagghe A, Remy P, Traykov L. Executive function deficits in early Alzheimer’s disease and their relations with episodic memory. Arch Clin Neuropsychol 2006; 21(1): 15–21.
9. Kertesz A, Appell J, Fisman M. The dissolution of language in Alzheimer’s disease. Can J Neurol Sci 1986; 13(4): 415–418.
10. Ball MJ, Murdoch GH. Neuropathological criteria for the diagnosis of Alzheimer’s disease: are we really ready yet? Neurobiol Aging 1997; 18(4): S3–12.
11. Hort J, Glosová L, Vyhnálek M, Bojar M, Škoda D,
Hladíková M. Tau protein a beta amyloid v likvoru u Alzheimerovy choroby. Cesk Slov Neurol N 2007; 70/103(1): 30–36.
12. Hort J, O’Brien JT, Gainotti G, Pirttila T, Popescue BO, Rektorova I et al. EFNS guidelines for the diagnosis and management of Alzheimer’s disease. Eur J Neurol 2010; 17(10): 1236–1248.
13. Monacelli AM, Cushman LA, Kavcic V, Duffy CJ. Spatial disorientation in Alzheimer’s disease: the remembrance of things passed. Neurology 2003; 61(11): 1491–1497.
14. Pai MC, Jacobs WJ. Topographical disorientation in community-residing patients with Alzheimer’s disease. Int J Geriatr Psychiatry 2004; 19(3): 250–255.
15. Hort J, Laczó J, Vyhnálek M, Bojar M, Bures J, Vlcek K: Spatial navigation deficit in amnestic mild cognitive impairment. Proc Natl Acad Sci USA 2007; 104(10): 4042–4047.
16. Laczó J, Vlcek K, Vyhnálek M, Vajnerová O, Ort M, Holmerová I et al. Spatial navigation testing discriminates two types of amnestic mild cognitive imairment. Behav Brain Res 2009; 202(2): 252–259.
17. Mapstone M, Steffenella TM, Duffy CJ. A visuospatial variant of mild cognitive impairment: getting lost between aging and AD. Neurology 2003; 60(5): 802–808.
18. DeIpolyi AR, Rankin KP, Mucke L, Miller BL, Gorno-Tempini ML. Spatial cognition and the human navigation network in AD and MCI. Neurology 2007; 69(10): 986–997.
19. O’Keefe J, Nadel L. The hippocampus as a cognitive map. Oxford: Clarendon 1978.
20. O’Keefe J, Dostrovsky J. The hippocampus as a spatial map. Preliminary evidence from unit activity in the freely-moving rat. Brain Res 1971; 34(1): 171–175.
21. Morris RG, Garrud P, Rawlins JN, O’Keefe J. Place navigation impaired in rats with hippocampal lesions. Nature 1982; 297(5868): 681–683.
22. Astur RS, Taylor LB, Mamelak AN, Philpott L, Sutherland RJ. Humans with hippocampus damage display severe spatial memory impairments in a virtual Morris water task. Behav Brain Res 2002; 132(1):
77–84.
23. Brandt T, Schautzer F, Hamilton DA, Brüning R,
Markowitsch HJ, Kalla R, Darlington C, Smith P, Strupp M. Vestibular loss causes hippocampal atrophy and impaired spatial memory in humans. Brain 2005; 128(11): 2732–2741.
24. Squire LR. Memory and the hippocampus: a synthesis from findings with rats, monkeys and humans. Psychol Rev 1992; 99(2): 195–231.
25. Holdstock JS, Mayes AR, Cezayirli E, Isaac CL, Aggleton JP, Roberts N. A comparison of egocentric and allocentric spatial memory in a patient with selective hippocampal damage. Neuropsychologia 2000; 38(4): 410–425.
26. Maguire EA, Burgess N, Donnett JG, Frackowiak RS,
Frith CD, O’Keefe J. Knowing where and getting there: a human navigation network. Science 1998; 280(5365): 921–924.
27. Raz N, Lindenberger U, Rodrigue KM, Kennedy KM, Head D, Williamson A et al. Regional brain changes in aging healthy adults: general trends, individual differences and modifiers. Cereb Cortex 2005; 15(11): 1676–1689.
28. Rodgers MK, Sindone III JA, Moffat SD. Effects of age on navigation strategy. Neurobiol Aging 2012; 33(1): 202.
29. Antonova E, Parslow D, Brammer M, Dawson GR, Jackson SH, Morris RG Age-related neural activity during allocentric spatial memory. Memory 2009; 17(2): 125–143.
30. Moffat SD, Elkins W, Resnick SM. Age differences in the neural systems supporting human allocentric spatial navigation. Neurobiology of Aging 2006; 27(7): 965–972.
31. Braak H, Braak E. Neuropathological staging of Alzheimer-related changes. Acta Neuropathol 1991; 82(4): 239–259.
32. Burns PC. Navigation and the mobility of older drivers. J Gerontol B Psychol Sci Soc Sci 1999; 54(1): S49–S55.
33. Wilkniss SM, Jones MG, Korol DL, Gold PE, Manning CA. Age-related differences in an ecologically based study of route learning. Psychol Aging 1997; 12(2): 372–375.
34. Newman MC, Kaszniak AW. Spatial memory and aging: Performance on a human analog of the Morris Water Maze Task. Aging, Neuropsychology, and Cognition 2000; 7(2): 86–93.
35. Iaria G, Palermo L, Committeri G, Barton JJ. Age differences in the formation and use of cognitive maps. Behav Brain Res 2009; 196(2): 187–191.
36. Moffat SD, Hampson E, Hatzipantelis M. Navigation in a “Virtual” Maze: Sex Differences and Correlation With Psychometric Measures of Spatial Ability in Humans. Evol Hum Behav 1998; 19(2): 73–87.
37. Astur RS, Ortiz ML, Sutherland RJ. A characterization of performance by men and women in a virtual Morris water task: a large and reliable sex difference. Behav Brain Res 1998; 93(1–2): 185–190.
38. Driscoll I, Hamilton DA, Yeo RA, Brooks WM, Sutherland RJ. Virtual navigation in humans: the impact of age, sex, and hormones on place learning. Horm Behav 2005; 47(3): 326–335.
39. Moffat SD, Resnick SM. Effects of age on virtual environment place navigation and allocentric cognitive mapping. Behavioral Neurosci 2002; 116(5):
851–859.
40. Weniger G, Ruhleder M, Lange C, Wolf S, Irle E. Egocentric and allocentric memory as assessed by virtual reality in individuals with amnestic mild cognitive impairment. Neuropsychologia 2011; 49 (3):
518–527.
41. Laczó J, Andel R, Vlček K, Maťoška V, Vyhnálek M, Tolar M et al. Spatial Navigation and APOE in Amnestic Mild Cognitive Impairment. Neurodegenerative Dis 2011; 8(4): 169–177.
42. Petersen RC, Doody R, Kurz A, Mohs RC, Morris JC, Rabins PV et al. Current concepts in mild cognitive impairment. Arch Neurol 2001; 58(12): 1985–1992.
43. Laczó J, Andel R, Vyhnalek M, Vlcek K, Magerova H, Varjassyova A et al. From Morris Water Maze to computer tests in the prediction of Alzheimer’s disease. Neurodegener Dis 2012; 10(1–4): 153–157.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2012 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Komentář k minimonografii P. Štourače
- Imunomodulační léčba roztroušené sklerózy mozkomíšní v klinických a zobrazovacích parametrech
- Prostorová orientace při fyziologickém a patologickém stárnutí
- Porucha spánku s rytmickými pohyby
- Meningeomy pochev zrakového nervu – přehled současných léčebných možností
- Stanovení prognostických faktorů trombolytické léčby u pacientů s akutním mozkovým infarktem – analýza registru SITS
- Koagulopatia pri kraniocerebrálnom poranení u detí a mladistvých
- Léčba obstrukční spánkové apnoe pomocí CPAP snižuje nezávisle hladinu A-FABP a CRP
- Přístrojově asistované kvantitativní testování senzitivity – normativní data
- Vyšetření hustoty intraepidermálních nervových vláken z kožní biopsie – normativní data
- Oswestry dotazník, verze 2.1a – výsledky u pacientů s lumbální spinální stenózou, srovnání se starší verzí dotazníku
- Peroperační elektromyografie svěračového komplexu anorekta dětí s anorektálními malformacemi
- Vliv novorozenecké žloutenky na vznik autizmu
- Izolovaná sfenoidální sinusitida – možná příčina bolestí hlavy a závažných komplikací
- Mozkové arachnoidální cysty u dospělých – retrospektivní analýza výsledků chirurgické terapie
- Hyperbarická oxygenační terapie závažných kraniocerebrálních poranění u dětí a adolescentů
- Primárně extradurální meningeom prezentující se Garcinovým syndromem – kazuistika
- Austrianův syndrom: pneumokoková meningitida, pneumonie a endokarditida – kazuistika
- Lewisův- Sumnerův syndrom – kazuistika
- Webové okénko
-
Analýza dat v neurologii
XXXIV. Bayesovské sítě - V. neuromuskulární kongres, 3.–4. května 2012 v Brně
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Mozkové arachnoidální cysty u dospělých – retrospektivní analýza výsledků chirurgické terapie
- Porucha spánku s rytmickými pohyby
- Izolovaná sfenoidální sinusitida – možná příčina bolestí hlavy a závažných komplikací
- Oswestry dotazník, verze 2.1a – výsledky u pacientů s lumbální spinální stenózou, srovnání se starší verzí dotazníku
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



