-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Nová antikoagulancia v prevenci kardioembolických iktů u pacientů s nevalvulární fibrilací síní
Novel Anticoagulants in Prevention of Cardioembolic Stroke in Patiens with Non-Valvular Atrial Fibrillation
Anticoagulant therapy plays an important role in primary and secondary prevention of brain embolism in patients with non-valvular atrial fibrillation. Warfarin is the most commonly used anticoagulant in these indications. Warfarin significantly reduces the risk of stroke and death but increases the risk of bleeding. Life-threatening intracerebral haemorrhage is the most serious complication of anticoagulant therapy, with a mortality potentially exceeding 50%. Direct thrombin inhibitor (dabigatran) and factor Xa inhibitors (rivaroxaban, apixaban) present promising alternatives to warfarin. This new anticoagulant therapy is as, or more, effective than warfarin and has demonstrated significantly better safety profile. In many patients, this therapy rightfully replaces warfarin.
Key words:
anticoagulant therapy – stroke – atrial fibrillation – warfarin – direct thrombin inhibitors – direct Xa factor inhibitors
The author declare he has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autori: doc. MUDr. Jiří Bauer, CSc.
Pôsobisko autorov: 1. LF UK a VFN v Praze ; Neurologická klinika
Vyšlo v časopise: Cesk Slov Neurol N 2013; 76/109(5): 550-558
Kategória: Přehledný referát
Súhrn
Antikoagulační léčba hraje důležitou roli v primární i v sekundární prevenci embolizace do mozkových tepen u pacientů s nevalvulární fibrilací síní. Nejčastěji užívané antikoagulans v této indikaci je warfarin. Tento lék významně snižuje riziko iktu i mortalitu, ale zvyšuje riziko krvácení. Život ohrožující intracebrální hemoragie je nejzávažnější komplikací antikoagulační léčby s mortalitou přesahující 50 %. Novou alternativou léčby warfarinem jsou přímé inhibitory trombinu (dabigatran) a plazmatického faktoru Xa (rivaroxaban, apixaban). Tato nová antikoagulancia jsou srovnatelně účinná nebo účinnější než warfarin a mají signifikantně lepší bezpečnostní profil. V mnoha případech oprávněně nahradí léčbu warfarinem.
Klíčová slova:
antikoagulační terapie – iktus – fibrilace síní – warfarin – přímé inhibitory trombinu – přímé inhibitory faktoru XaÚvod
Ischemické cévní mozkové příhody (iCMP) jsou onemocnění, která lze v současnosti již v mnohých případech nejen úspěšně léčit, ale vhodnými preventivními opatřeními jim lze i předcházet. V primární i v sekundární prevenci ischemického iktu má bezpochyby své významné postavení léčba antikoagulační, pokud je přítomen natolik závažný hyperkoagulační stav, že antiagregační léčba nemůže být dostatečně účinná a hrozí nebezpečí trombotických a embolických komplikací, především kardioembolizmu. Jeho nejčastější příčinou je nevalvulární fibrilace síní. Antikoagulační léčba je v prevenci iktu jednou z nejúčinnějších preventivních terapií, její přínos však může být znehodnocen rizikem závažných komplikací, především hemoragického charakteru včetně intrakraniálního krvácení [1]. Proto před jejím zahájením je nutno nejen správně pochopit princip této léčby, ale i pečlivě zvážit její indikace a rizika. Nová antikoagulancia ze skupiny gatranů a xabanů dnes zásadně mění navyklou terapeutickou strategii.
Nevalvulární fibrilace síní
Nevalvulární fibrilace síní (FS) je nejčastější klinicky významná arytmie. Její příčinou je disociace elektrické aktivity srdečních síní, což je provázeno ztrátou mechanické kontrakce. Jde o věkově vázané onemocnění, přítomné u 0,5 – 1 % dospělé populace, v devátém deceniu však již u každého desátého jedince. Počet nemocných s fibrilací síní stále pozvolně narůstá, někdy je proto tato arytmie označována za epidemii 21. století. Předpokládá se, že se prevalence FS do roku 2050 více než zdvojnásobí [2]. Prioritním opatřením by měla být její detekce ještě před vznikem komplikací [3]. Podle doporučení Evropské kardiologické společnosti (European Society of Cardiology) ze srpna 2012 je proto vhodné u osob starších 65 let provádět aktivní skríning palpací pulzu a následným provedením EKG vyšetření, je‑li tep nepravidelný [4]. Díky novým možnostem dlouhodobého monitorování a kvalitnější detekce této arytmie (dnes i pomocí implantačních přístrojů, které umožňují telemetrické sledování srdeční akce i po dobu několika měsíců) lze prokázat i epizody tzv.„silent AF“ (klinicky němá fibrilace), jež jsou časté např. u nemocných s arteriální hypertenzí. Tyto subklinické fibrilace jsou z hlediska kardioembolizmu stejně závažné jako fibrilace symptomatické [5]. Z neurologického hlediska je především významná skutečnost, že fibrilace síní je zdaleka nejčastější příčinou kardioembolizace. Ohroženi jsou především nemocní s větším objemem levé srdeční síně, s dysfunkcí levé komory, s průkazem trombů v oušku levé síně a denzního spontánního echokontrastu. Průměrné roční riziko embolizace u neléčených osob je 5 %, v 90 % jde o embolizaci do mozkových tepen. FS zvyšuje riziko ischemické cévní mozkové příhody pětinásobně a zdvojnásobuje riziko úmrtí [6,7]. Kardioembolizace je příčinou 25 – 30 % iCMP, u osob starších 80 let až 36 %. Jde obvykle o závažný iktus s častými recidivami (obr. 1).
Obr. 1. Rozsáhlá expanzivně se chovající malacie v celém povodí pravostranné střední mozkové tepny s významnou hemoragickou infarzací. Kardioembolický iktus při fibrilaci síní. Kontrolní CT vyšetření 24 hod po příhodě. 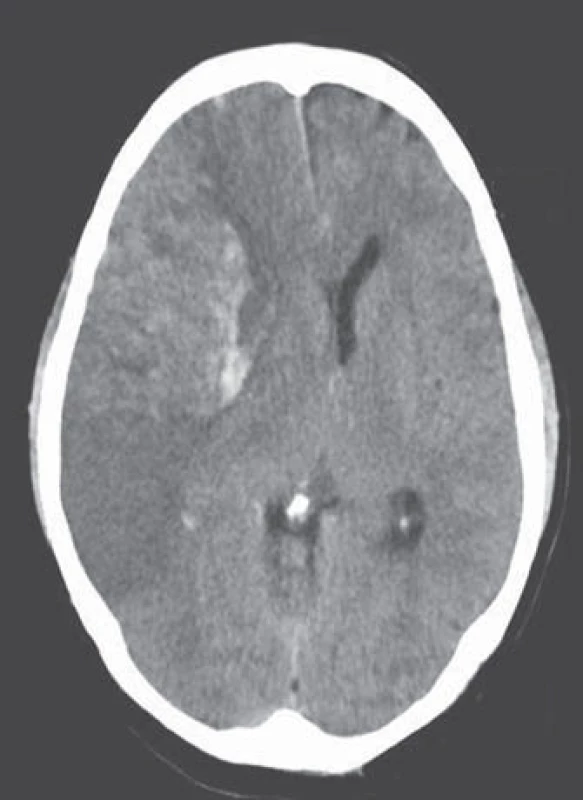
Léčba FS je zaměřena na léčbu a prevenci onemocnění, která jsou v kauzální souvislosti s FS, na léčbu samotné arytmie a na prevenci tromboembolických příhod (léčba farmakologická, chirurgická, endovaskulární, kardioverze, kardiostimulace) [8,9]. Farmakologická léčba FS spočívá buď v normalizaci a stabilizaci srdeční frekvence, nebo ve verzi fibrilace na sinusový rytmus. Obě metody jsou srovnatelné, pokud jde o životní prognózu, tromboembolické komplikace a kvalitu života. U starších pacientů s FS, se kterými se v neurologické praxi setkáváme nejčastěji, je pokládána za vhodnější normalizace srdeční frekvence s tolerancí hodnot do 110 tepů/ min. Nezbytné je současné zahájení dlouhodobé preventivní léčby antikoagulační [4,10 – 17].
Klasická antikoagulancia
Antikoagulancia cíleně inhibují plazmatickou koagulační kaskádu, a to na její různé úrovni (schéma 1). Klasickým inhibitorem koagulace, který je v praxi používán již více než 50 let, je kumarinový derivát warfarin. Působí jako antagonista syntézy vitamin Kdependentních koagulačních faktorů v játrech – faktoru VII, IX, X a protrombinu. Klíčovou roli v syntéze těchto faktorů má vitamin K. Antikoagulační efekt warfarinu spočívá v inhibici jaterního enzymu epoxyd reduktázy, čímž je znemožněna recyklace vitaminu K, jehož následný deficit vede k produkci koagulačních faktorů s redukovanou koagulační aktivitou. Warfarin jako nepřímé antikoagulans má multifaktoriální efekt, inhibuje koagulační kaskádu na několika úrovních. Intenzita antikoagulačního efektu warfarinu se hodnotí pomocí tromboplastinového testu vyjádřeného formou INR (International Normalization Ratio), obvyklá terapeutická hodnota je 2,0 – 3,0. Četné studie i jejich metaanalýza prokazují, že warfarin je v prevenci kardioembolizmu lék vysoce účinný, snižuje riziko iktu až o 79 % a mortalitu o 25 % (BAATAF, Boston Area Anticoagulation Trial for Atrial Fibrillation, CAFA, Canadian Atrial Fibrillation Anticoagulation, SPAF I – III, Stroke Prevetion in Atrial Fibrillation, AFASAK, Atrial Fibrillation, Aspirin, Anticoagulation, SPINAF, Stroke Prevention in Nonvalvular Atrial Fibrillation) [18,19]. Podle posledních doporučení ESO (European Stroke Organisation) z roku 2008 je u nemocných s fibrilací síní, včetně paroxyzmální fibrilace síní, indikována antikoagulační léčba warfarinem s cílovou hodnotou INR 2,0 – 3,0 vždy po proběhlé embolizační cévní mozkové příhodě nebo tranzitorní ischemické příhodě (TIA, Transient Ischemic Attack) a dále v rámci primární prevence, je‑li fibrilace síní provázena závažnými vaskulárními rizikovými faktory [20].
Schéma 1. Cílená inhibice hemokoagulační kaskády antikoagulační terapií. 
Léčba warfarinem je však bohužel často doprovázena závažným rizikem hemoragických komplikací [21 – 24]. Jejich roční riziko se pohybuje v rozmezí 5 – 6 %, intracerebrálního krvácení 0,5 %, u starších pacientů narůstá až na 1,7 %. Léčba warfarinem zvyšuje riziko intracerebrálního krvácení až desetinásobně, podle některých statistických údajů je v souvislosti s warfarinizací 15 – 20 % hemoragických iktů [25,26]. V důsledku navozené perzistentní koagulopatie je krvácení často progredující, vícečetné a recidivující, především v prvních hodinách hemoragické příhody, což je provázeno postupným zvětšováním hematomu a deteriorací klinického stavu (obr. 2, 3) [27 – 29]. Není proto překvapující, že u tohoto typu krvácení je 30denní mortalita vyšší než 50 % [30 – 32].
Obr. 2. Progredující intracerebrální krvácení u warfarinizovaného pacienta (INR 2,0). Obr. 2a) Nevelké krvácení v centrálních strukturách pravé mozkové hemisféry. CT vyšetření 2 hod po příhodě. Obr. 2b) Výrazná progrese velikosti hematomu a provalení krve do komorového systému v důsledku navozené perzistentní koagulopatie. Kontrolní CT vyšetření s odstupem 4 hod. 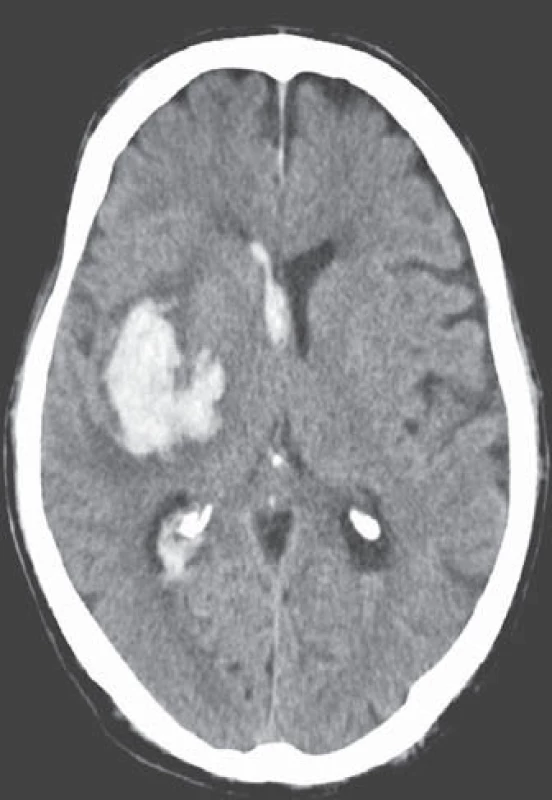
Obr. 3. Vícečetné současné intracerebrální krvácení u warfarinizovaného pacienta (INR 4,0). Obr. 3a) Krvácení v pravé mozečkové hemisféře. CT vyšetření 1,5 hod po příhodě. Kvalita zobrazení ovlivněna neklidem pacienta. Obr. 3b) Krvácení v levé parietální krajině. CT vyšetření 1,5 hod po příhodě. 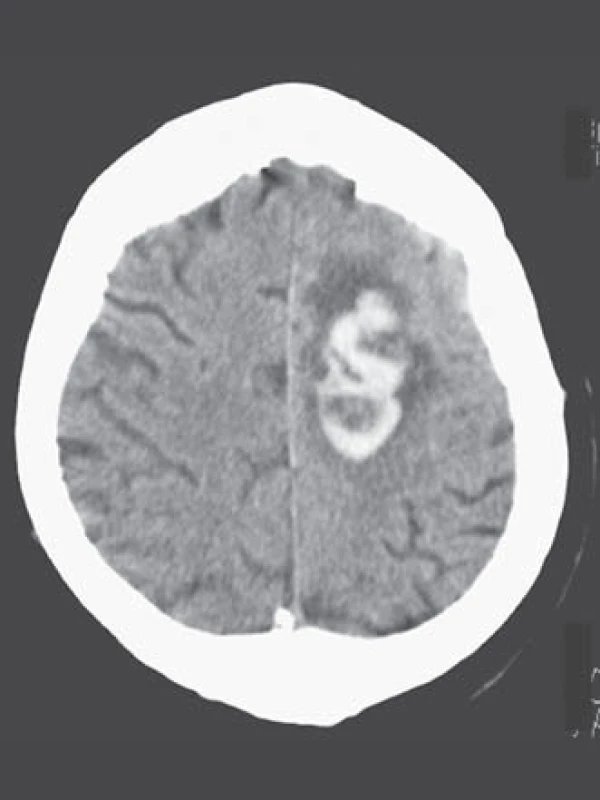
Léčba warfarinem má však další neméně významná úskalí. Úzké terapeutické okno, odpovídající obvykle hodnotám INR 2,0 – 3,0, vyžaduje pečlivý monitoring léčby a časté úpravy dávky, především při zahájení terapie, neboť nástup účinku warfarinu, stejně jako jeho odeznívání, je pomalý (několik dní) [33,34]. Velkým problémem je časté kolísání plazmatické hladiny warfarinu i v průběhu léčby. Doporučené terapeutické hodnoty se v běžné praxi dosahují v průměru jen ve 44 – 51 % (tzv. TTR, Time in Therapeutic Range). Pacient je tedy minimálně polovinu léčebného období poddávkován nebo předávkován, a léčba se tak stává rizikovou a méně efektivní (70 % kardioembolických iktů u warfarinizovaných pacientů s fibrilací síní vzniká při INR < 2,0). Další komplikací léčby warfarinem jsou časté potravinové a lékové interakce, což se týká až 80 % léčených pacientů, v 64 % jde o potencování jeho aktivity. Závažná je i nepředvídatelná odpověď na léčbu, jednak pro rezistenci, kdy je nutno podávat vysoké denní dávky, jindy naopak pro hypersenzitivitu v důsledku geneticky podmíněných mutací, přítomných až u 40 % kavkazské populace (mutace genu VKORC1, C1 subjednotky cílového enzymu metabolického cyklu vitaminu K epoxid reduktázy a mutace genu cytochromu P450 2C9, řídící biotransformaci warfarinu) [35 – 37]. Není překvapující, že léčba warfarinem je po léčbě inzulinem druhou nejčastější příčinou emergentního příjmu z důvodu iatrogenního postižení.
Důsledkem všech těchto skutečností je na jedné straně obava lékaře z rizikové léčby, především z krvácení (lékař je vždy více ovlivněn tím, co může způsobit, než čemu může zabránit), na druhé straně špatná compliance pacienta. To vede k podhodnocení léčby warfarinem, především u starších osob, kde léčbu dostává jen 15 – 44 % vhodných pacientů, z nich je navíc správně léčena přibližně jen jedna polovina. Při prevalenci fibrilace síní v České republice, která je zhruba 150 000 osob, jde jistě o velmi závažné zjištění.
K upřesnění indikačních kritérií antikoagulační terapie u pacientů s nevalvulární FS je velmi vhodné využít skórovací systémy doporučené Evropskou kardiologickou společností [4]. CHA2DS2 – VASc skóre bodově hodnotí nejzávažnější rizikové faktory embolizace (tab. 1). Celkové skóre 0 léčbu nevyžaduje, riziko embolizace je malé, skóre 1 představuje středně závažné riziko a je možná volba mezi léčbou antiagregační (duální terapie kyselinou acetylosalicylovou s klopidogrelem) a antikoagulační, antikoagulační léčba je však dnes ve většině případů preferována [15]. Je-li jediným rizikovým faktorem ženské pohlaví, není třeba antitrombotickou léčbu zvažovat. Skóre 2 a vyšší již znamená vysoké riziko a jednoznačně indikuje antikoagulační terapii [38 – 40]. Je‑li antikoagulační léčba z nějakého důvodu kontraindikována, je vhodná antiagregační terapie, kombinovaná léčba kyselinou acetylsalicylovou s klopidogrelem je preferována před monoterapií samotnou kyselinou acetylosalicylovou. HAS ‑ BLED skóre hodnotí rizikové faktory hemoragických komplikací. Hodnoty 3 a vyšší již představují vysoké riziko, které sice pacienta z antikoagulační léčby nevyřazuje, ale nabádá ke zvýšené opatrnosti (tab. 2) [41]. Porovnáním obou skóre lze objektivně zhodnotit poměr rizika embolizace a rizika krvácení, a tím zpřesnit volbu terapie. Zavedení těchto skórovacich systémů do klinické praxe, podobně jako soustředění léčby do specializovaných antikoagulačních center s co nejširším využitím systému „point of cure“, je jistě cestou ke zkvalitnění antikoagulační terapie warfarinem, léčba však i nadále zůstává terapií rizikovou, neboť ani její správné provádění nevylučuje riziko závažnějšího krvácení.
Tab. 1. CHA<sub>2</sub>DS<sub>2</sub>-VASc skóre. 
Nová antikoagulancia
Hlavní strategií antikoagulační léčby u pacientů s nevalvulární fibrilací síní by mělo být maximální snížení rizika kardioembolizace, co nejrychlejší dosažení stabilní účinné léčebné dávky, udržení této dávky v terapeutických mezích, vyloučení významnějšího předávkování a maximální snížení rizika závažných komplikací. Dlouhodobá warfarinizace v prevenci kardioembolických iktů není jistě z tohoto pohledu ideální. Proto se intenzivně hledají nová antikoagulancia, která by měla v porovnání s warfarinem vyšší nebo alespoň stejnou účinnost a současně byla bezpečnější, měla rychlý nástup i rychlé odeznění účinku, nízkou toxicitu, minimální lékové a potravinové interakce, jednoduché schéma dávkování a minimální potřebu monitorování [42 – 44].
V průběhu posledních let jsou u pacientů s nevalvulární FS zkoušena nová antikoagulancia, která zasahují do hemokoagulační kaskády jiným mechanizmem než warfarin, selektivně ovlivňují jen určitý specifický koagulační faktor – přímé inhibitory trombinu, centrálního enzymu koagulační kaskády (gatrany – dabigatran) a přímé inhibitory plazmatického faktoru Xa (xabany – rivaroxaban, apixaban, edoxaban, betrixaban, otamixaban, darexaban) (schéma 1). Výsledky již ukončených studií lze hodnotit jako velmi příznivé, neboť tato antikoagulancia nové generace (NOAC, Novel Oral AntiCoagulans) již do značné míry splňují výše definované požadavky na moderní antikoagulační léčbu [45 – 49].
V roce 2009 byla publikována studie RE ‑ LY porovnávající dlouhodobou účinnost a bezpečnost přímého inhibitoru trombinu – dabigatranu (dabigatran etexilate) s adjustovanou dávkou warfarinu (INR v rozmezí 2,0 – 3,0) v prevenci cévní mozkové příhody a systémové embolizace u rizikových pacientů s nevalvulární fibrilací síní [50,51]. Studie prokázala, že podávání dabigatranu v dávce 150 mg 2krát denně signifikantně snížilo riziko cévní mozkové příhody a systémové embolizace v porovnání s léčbou warfarinem, a to o 35 %. Významným zjištěním je 25 % snížení rizika ischemického iktu. Účinnost nižší dávky dabigatranu (110 mg 2krát denně) byla srovnatelná s warfarinem. Bezpečnost dabigatranu byla přitom příznivá, v porovnání s warfarinem vyšší dávkování (150 mg 2krát denně) snížilo počet život ohrožujících krvácení o 20 % a celkový počet klinicky závažných a nezávažných krvácení o 9 %, nižší dávkování (110 mg 2krát denně) snížilo počet závažného krvácení o 20 %. Dabigatran byl především významně bezpečnější než warfarin, a to nezávisle na tom, zda bylo použito nižší nebo vyšší dávkování, při hodnocení počtu intakraniálních krvácení (snížení o 70, resp 59 %) a počtu hemoragických iktů (snížení o 69, resp 74 %). Vyšší dávkování vedlo též k 12% snížení rizika úmrtí ze všech příčin a k 15% snížení rizika úmrtí z vaskulárních důvodů [52]. Léčba dabigatranem v dávce 150 mg 2krát denně byla provázena lehkým zvýšením počtu krvácení do gastrointestinálního traktu. Následně provedená subanalýza studie RE ‑ LY prokázala, že účinek dabigatranu byl konzistentní bez ohledu na CHA2DS2 – VASc skóre sledovaných pacientů, jejich věk, typ fibrilace síní a bez ohledu na skutečnost, zda léčbě předcházela nebo nepředcházela cévní mozková příhoda anebo dřívější terapie warfarinem [53,54]. Na základě těchto vysoce pozitivních výsledků byl dabigatran etexilat (Pradaxa) schválen k použití v klinické praxi v indikaci prevence cévní mozkové příhody a systémové embolizace u dospělých pacientů s nevalvulární FS s jedním nebo s více vaskulárními rizikovými faktory, a to nejprve v USA (FDA, Food and Drug Administration, říjen 2010), následně i v jiných mimoevropských státech a v srpnu 2011 i ve státech Evropské unie (EMA, Evropská léková agentura). Za rizikové faktory jsou považovány: cévní mozková příhoda, tranzitorní ischemická příhoda nebo systémová embolizace v anamnéze, ejekční frakce levé srdeční komory nižší než 40 %, symptomatické srdeční selhání třídy 2 či vyšší podle klasifikace NYHA, věk 75 let a vyšší i věk 65 – 74 let u osob s diabetes mellitus, ischemickou chorobou srdeční nebo arteriální hypertenzí. Doporučená dávka je 150 mg 2krát denně. Nižší dávkování (110 mg 2krát denně) je vhodné u pacientů starších 80 let a při současné léčbě verapamilem (zvyšuje inhibicí glukoproteinu P plazmatickou hladinu dabigatranu). Na základě individuálního posouzení rizika tromboembolie vůči riziku krvácení je třeba zvážit nižší dávkování i u osob věkové kategorie 75 – 80 let, u nemocných se středně významnou poruchou funkce ledvin (CrCl 30 – 49 mL/ min) a u nemocných s gastritidou, ezofagitidou, gastroduodenálním refluxem a s jinými možnými příčinami zvýšeného rizika krvácení (HAS ‑ BLED skóre 3 a vyšší). V rámci sekundární prevence je doporučeno zahájit léčbu dabigatranem okamžitě po TIA, s odstupem 3 – 5 dní po lehkém iktu, 5 – 7 dní po středně závažném iktu a 14 dní po těžké cévní mozkové příhodě.
V roce 2010 byla publikována studie ROCKET ‑ AF porovnávající účinnost a bezpečnost přímého inhibitoru plazmatického faktoru Xa – rivaroxabanu s adjustovanou dávkou warfarinu (INR v rozmezí 2,0–3,0) v prevenci cévní mozkové příhody a systémové embolizace u rizikových pacientů s nevalvulární fibrilací síní [55,56]. Studie prokázala, že účinnost rivaroxabanu v dávce 20 mg 1krát denně, hodnocená snížením výskytu cévních mozkových příhod a systémové embolizace a warfarinu, je srovnatelná (On ‑ treatment analýza prokázala, že rivaroxaban je o 21 % účinnější ve snížení kombinovaného rizika pro CMP, systémovou embolii a kardiovaskulární úmrtí). Počet všech krvácivých komplikací byl rovněž srovnatelný, významně byl však snížen počet fatálních krvácení (o 50 %) a intrakraniálních krvácení (o 33 %). V porovnání s léčbou warfarinem byl o něco častější výskyt slizničních krvácení (epistaxe, krvácení z dásní, v gastrointestinálním a urogenitálním traktu). Výhodou je dávkování v jedné denní dávce. Rivaroxaban je tedy přípravek minimálně stejně účinný jako warfarin, ale bezpečnější. Na základě těchto výsledků byla koncem roku 2011, a to jak v USA (FDA) a v některých jiných státech, tak i ve státech Evropské unie (EMA) schválena léčba rivaroxabanem (Xarelto) v indikaci prevence cévní mozkové příhody a systémové embolizace u dospělých pacientů s nevalvulární FS s jedním nebo s více rizkovými faktory, jako jsou srdeční selhání, hypertenze, věk 75 let a vyšší, diabetes mellitus a anamnéza iCMP nebo TIA. Doporučená dávka je 20 mg 1krát denně, u pacientů se středně závažnou renální insuficiencí (CrCl 30 – 49 mL/ min) je doporučeno snížení dávky na 15 mg 1krát denně. Tuto dávku lze podle SPC (souhrn údajů o přípravku) s opatrností podat i u pacientů se závažnou renální insuficiencí (CrCl 15 – 29 mL/ min).
V roce 2011 byla publikována studie ARISTOTLE porovnávající účinnost a bezpečnost jiného přímého inhibitoru plazmatického faktoru Xa – apixabanu s adjustovanou dávkou warfarinu (INR v rozmezí 2,0 – 3,0), a to rovněž v prevenci cévní mozkové příhody a systémové embolizace u rizikových pacientů s nevalvulární fibrilací síní [57]. Studie prokázala, že účinnost apixabanu v denní dávce 5 mg 2krát denně byla v porovnání s warfarinem o 21 % vyšší, zároveň měl apixaban lepší bezpečnostní profil, počet „major bleeding“ (velkých závažných krvácení) byl nižší o 31%, intrakraniálních krvácení o 58 % a mortalita byla nižší o 11 %. Apixaban je tedy další velmi účinné a v porovnání s warfarinem výrazně bezpečnější antikoagulans, které vstupuje do hry v prevenci iktu u pacientů s nevalvulární fibrilací síní. Studie ARISTOTLE navázala na studii AVERROES, která byla předčasně ukončena pro jednoznačně vyšší účinnost apixabanu v porovnání s kyselinou acetylsalicylovou v prevenci iktu u nemocných s nevalvulární fibrilací síní a kontraindikací léčby warfarinem [58]. Na základě těchto výsledků byla v listopadu 2012 ve státech Evropské unie (EMA) a o měsíc později v USA (FDA) schválena léčba apixabanem (Eliquis) v indikaci prevence cévní mozkové příhody a systémové embolizace u dospělých pacientů s nevalvulární FS s jedním nebo s více rizikovými faktory, jako jsou iCMP nebo TIA v anamnéze, věk 75 let a vyšší, arteriální hypertenze, diabetes mellitus, symptomatické srdeční selhání (NYHA 2 nebo vyšší). Doporučená dávka je 5 mg 2krát denně. Snížená dávka (2,5 mg 2krát denně) je doporučena, jsou‑li přítomny nejméně dva z následujících rizikových faktorů: věk 80 let a vyšší, tělesná hmotnost 60 kg a nižší a hodnota kreatininu v séru 133 µmol/ L a vyšší.
Nová antikoagulancia byla navzájem porovnávána zatím jen nepřímo. Kansal se spolupracovníky hodnotí dabigatran jako lék účinnější a finančně výhodnější v porovnání s rivaroxabanem [59].
V současnosti probíhají studie i s jinými přímými inhibitory plazmatického faktoru Xa v prevenci iktu u nemocných s nevalvulární fibrilací síní (studie ENGAGE AF TIMI 48 s edoxabanem, studie EXPLORE ‑ Xa s betrixabanem), testují se i další léky ze skupiny xabanů (otamixaban, darexaban) a též antikoagulancia působící na odlišných místech hemokoagulační kaskády (rekombinantní inhibitor tkáňového faktoru, syntetický inhibitor IX plazmatického faktoru a některá další).
Dnes jsou tedy vedle warfarinu k dispozici další, nová účinná perorální antikoagulancia schválená příslušnými institucemi a doporučená odbornými společnostmi k prevenci kardioembolizace u nemocných s nevalvulární fibrilací síní (dabigatran, rivaroxaban, apixaban).
V kterých indikacích je podle současných vědomostí vhodné nahradit warfarin novými antikoagulancii?
- V úvahu budou především přicházet pacienti s obtížně korigovatelnou hladinou warfarinu s kolísajícími hodnotami INR, tedy když dvě ze šesti naměřených hodnost nejsou v terapeutickém rozmezí (INR 2,0 – 3,0). Kolísání hladiny warfarinu je rizikovou situací, a to jak z hlediska možné embolizace (poddávkování), tak i hemoragických komplikací (předávkování). Půjde především o nemocné s hypersenzitivitou na warfarin v důsledku genetických mutací, a dále o polymorbidní nemocné s pestrou medikací a vysokou pravděpodobností lékových interakcí. Subanalýza studie RE ‑ LY skutečně prokázala, že výhoda podávání dabigatranu vůči warfarinu byla více patrná tam, kde bylo dosaženo horších výsledků v udržení hodnot INR v terapeutickém rozmezí ve větvi léčené warfarinem.
- Léčba novými antikoagulanciemi bude vhodná i tehdy, bude‑li léčba warfarinem provázena nežádoucími účinky, především krvácením, vzácně alergickými reakcemi, průjmy, zvracením nebo alopecií.
- Další indikací je rezistence na warfarin, kdy k dosažení terapeutických hodnot je potřebná denní dávka vyšší než 10 mg.
- Indikací k léčbě novými antikoagulancii by měli být i nemocní, pro které je obtížné docházet na pravidelné kontroly a monitorování léčby warfarinem (starší špatně pohybliví nemocní).
Všechny tyto indikace jsou doporučeny Evropskou kardiologickou společností pro FS (2012) a v našem zdravotnictví jsou podmínkou částečné úhrady léčby (rozhodnutí SÚKL, Státní úřad pro kontrolu léčiv, 2012).
Logicky by nová antikoagulancia měla být vhodnější i tam, kde je vysoké riziko embolizace (CHA2DS2 - VASc skóre 2a vyšší), neboť nová antikoagulancia jsou vesměs účinnější než warfarin (dabigatran v denní dávce 300 mg je účinnější o 35 % a apixaban v denní dávce 10 mg o 21 %) [50,55,57]. Z tohoto pohledu je výhodný především dabigatran v denní dávce 300 mg, který jediný signifikantně snižuje i riziko ischemických iktů (tab. 3), i když benefit u vysoce rizikových pacientů byl v porovnání s warfarinem prokázán i u apixabanu a rivaroxabanu. U nemocných se středním rizikem kardioembolizace (CHA2DS2-VASc skóre 1) byl benefit prokázán u obou dávek dabigatranu a u apixabanu [4].
Tab. 3. Účinnost a bezpečnost nových antikoagulancií v porovnání s warfarinem. 
Podobně bychom měli postupovat i v situaci, kdy se pacient nachází ve vysokém riziku hemoragických komplikací. I když je nutno mít na zřeteli, že jakákoliv antikoagulační léčba zvyšuje riziko krvácení, všechna nová antikoagulancia v porovnání s warfarinem významně snižují výskyt život ohrožujícího intrakraniálního krvácení (dabigatran v denní dávce 220 mg o 70 %, v denní dávce 300 mg o 59 %, rivaroxaban v denní dávce 20 mg o 33 %, apixaban v denní dávce 10 mg o 58 %) (tab. 3). Subanalýza studie RE ‑ LY prokázala ve skupině osob léčených dabigatranem signifikantní snížení fatálních intrakraniálních hemoragií, a to jak spontánních, tak i posttraumatických [60].
Podle nových doporučení ACCP (American College of Chest Physicians, 9. edice, únor 2012) a ECS (European Society of Cardiology, srpen 2012) je u nemocných, u kterých je v prevenci kardioembolizace vhodná perorální antikoagulační léčba, považován dabigatran za vhodnější antikoagulans než warfarin [4,17].
Na druhé straně u nemocných léčených warfarinem, kteří jsou dobře kompenzováni, mají stabilní hodnoty INR (TTR je větší než 70 %) a riziko embolizace i riziko hemoragických komplikací není vysoké, je warfarinizace opodstatněná a není potřeba tuto terapii měnit. Změna na nová antikoagulacia je však možná i v těchto případech, pokud o to nemocný projeví zájem a bude akceptovat úhradu. Léčbu warfarinem je možno též zvažovat u pacientů se závažnou chronickou renální insuficiencí a zvýšeným rizikem krvácení do gastrointestinálního traktu.
Zásadním přínosem nových perorálních antikoagulancií, v porovnání s warfarinem, je vedle větší účinnosti a bezpečnosti i skutečnost, že léčba nevyžaduje monitoring hemokoagulace, interakce s ostatními léky jsou podstatně menší, nejsou nutná dietní opatření a nástup účinku léku a jeho odeznívání jsou rychlé (za 2 – 4 hod). Nespornou výhodou nových antikoagulancií je, že není potřeba léčbu monitorovat. Výjimkou jsou urgentní stavy, jako například urgentní operace nebo závažné krvácení, dále předávkování, ischemická CMP vhodná k trombolytické terapii, renální selhání, především při léčbě dabigatranem a špatná compliance pacienta. V těchto případech lze pro rychlou orientaci provést vyšetření aPTT (aktivovaný parciální trombopastinový čas) k monitorování účinku dabigatranu a vyšetření PT (protrombinového času) nebo stanovení aktivity anti Xa (test inhibice aktivovaného faktoru Xa) k monitorování účinku rivaroxabanu a apixabanu. Nová antikoagulancia však ovlivňují tyto koagulační testy pouze nespecificky, proto mají jen orientační výpovědní hodnotu, jsou‑li však naměřené hodnoty v normě, riziko krvácení nehrozí. Při normální hodnotě aPTT je tak např. možno podat trombolytickou terapii u nemocných léčených dabigatranem (u nemocných léčených rivaroxabanem a apixabanem jsou zkušenosti zatím jen velmi omezené, proto současné podávání těchto přípravků s trombolytiky není podle SPC doporučeno). Je‑li však hodnota aPTT zvýšena 2 – 3násobně, je již riziko krvácení významné. K přesnému stanovení plazmatické koncentrace dabigatranu je třeba provést vyšetření za použití Hemoclot testu (stanovení kalibrovaného dilutovaného trombinového času), kde hodnoty vyšší než 200 ng/ ml signalizují zvýšené riziko krvácení. Při léčbě přímými inhibitory plasmatického faktoru Xa může být stav hemostázy hodnocen testováním mPT (modifikovaný protrombinový čas) za použití neoplastinu nebo pomocí kalibrovaného testu ke stanovení aktivity antiXa (analýza Rotachrom®). Odběr krve je nutno provést v době minimální plazmatické koncentrace, tedy v době, kdy by měla být podána další léčebná dávka [61].
Určitým problémem léčby novými antikoagulanciemi je skutečnost, že neexistuje vhodné antidotum. Pro jejich krátký eliminační poločas však protrahované krvácení není příliš pravděpodobné, proto při mírnějším krvácení se doporučuje pouze vynechání dávky. Při středně závažném krvácení je vhodná náhrada cirkulujícího objemu, popř. transfuze a podání aktivního uhlí, pokud od podání poslední léčebné dávky neuplynulo více než 2 hod, při život ohrožujícím krvácení se zvažuje podání rFVIIa (NovoSevn) nebo koncentrátu koagulačních faktorů (Prothromplex), v některých případech hemodialýza (dabigatran) [62,63]. Zhruba lze říci, že v případě krvácivých komplikací je postup stejný jako u krvácení při léčbě warfarinem, s výjimkou podání vitaminu K. Podle doporučení EMA je však třeba tyto postupy ještě upřesnit. Ve fázi výzkumu je použití monoklonálních protilátek a univerzálního antidota anti‑Xa.
Důležitou podmínkou léčby novými antikoagulancii je podrobná edukace pacientů se zdůrazněním nutnosti nepřerušovat léčbu. Vynechání léků, které mají velmi krátký poločas, může totiž vést ke vzniku protrombogenní situace a riziku kardioembolizmu daleko snadněji než u warfarinu. Další podmínkou je ověření funkce ledvin před zahájením terapie, neboť nová antikoagulancia se vylučují převážně ledvinami (dabigatran z 80 %, rivaroxaban z 66 %, apixaban z 27 %). Při středně závažné renální poruše (CrCl 30–49 mL/min) je proto možno podle doporučení ECS (2012) podat jen redukované dávky (dabigatran v denní dávce 220 mg, rivaroxaban v denní dávce 15 mg, apixaban v denní dávce 5 mg). Toto doporučení však není zcela ve shodě s SPC pro Pradaxu, kde snížení dávky je doporučeno jen v případě současně zvýšeného rizika krvácení (HAS-BLED skóre 3 a vyšší). Při závažné renální poruše (CrCl < 30 mL/m) se podle doporučení ECS (2012) léčba novými antikoagulancii nedoporučuje, podle SPC pro Xarelto a Eliquis lze však se zvýšenou opatrností podat tyto léky v redukované dávce i při hodnotách CrCl 15–29 mL/min. Během léčby je též nutno renální funkce pravidelně kontrolovat. Bezpečnost léčby zvyšuje též sledování krevního tlaku a jeho normalizace. Opatrnost je na místě při současném podávání antikoagulační léčby s léčbou antiagregační (kyselina acetylsalicylová, klopidogrel), neboť tato kombinace zvyšuje dvojnásobně riziko hemoragických komplikací. Bezpečnější je přidání samotného klopidogrelu než jeho kombinace s kyselinou acetylsalicylovou. Nedostatek informací nedovoluje podávat nová antikoagulancia v době těhotenství a laktace. V graviditě tak zůstávají lékem volby nízkomolekulární hepariny.
Výsledky farmakoekonomických studií provedených s dabigatranem prokazují jeho přínos i z hlediska ekonomického [59,64].
Závěr
Zavedení nových antikoagulancií – přímého inhibitoru trombinu a přímých inhibitorů plazmatického faktoru Xa – do klinické praxe přerušilo 50letou hegemonii warfarinu jako jediného perorálního antikoagulačního přípravku. Nová antikoagulancia se dnes stávají významnou součástí léčebné strategie v prevenci kardioembolického iktu. Jejich účinnost a bezpečnost prokázanou studiemi bude jistě nutno ještě ověřit praxí [65]. Největší zkušenosti jsou zatím s dabigatranem. Podle informací EMA z května 2012 lze konstatovat, že výskyt fatálních krvácení při léčbě dabigatranem je v klinické praxi signifikantně nižší, než bylo prokázáno studiemi. K pozitivním závěrům dospěla i Mini‑Sentinel pilot of the Sentinel Initiative, pilotní postmarketingová studie sponzorovaná FDA, která prokázala, že riziko intrakraniálního i gastrointestinálního krvácení u pacientů s fibrilací síní a nově nasazenou antikoagulační léčbou nebylo ve skupině léčené dabigatranem vyšší, ale naopak nižší než ve skupině léčené warfarinem [66]. Na kongresu American Heart Association (AHA), pořádaném v listopadu 2012, byla prezentována studie RELY ‑ ABLE, jež pokračovala ve sledování pacientů ze studie RE ‑ LY, kteří dostávali dabigatran, a potvrdila výsledky této studie [67]. V jiném sdělení byla hodnocena léčba pacientů s fibrilací síní dabigatranem a warfarinem v běžné klinické praxi a bylo prokázáno, že výskyt inkrakraniálního krvácení a krvácení do zažívacího traktu byl stejný jako ve studii RE ‑ LY, a nebylo zjištěno vyšší riziko infarktu myokardu u nemocných léčených dabigatranem v porovnání s nemocnými léčenými warfarinem [68]. Zajímavé výsledky přinese jistě i hodnocení registrů GLORIA (Global Registry of Long-Term Oral Anti-thrombotic Treatment in Patients With Atrial Fibrillation), GARFIELD (Global Anticoagulant Registry in the Field) a ORBITA-AF (Outcomes Registry for Better Informed Treatment of Atrial Fibrillation), které shromažďují informace o pacientech s novým záchytem fibrilace síní a sledují úspěšnost a bezpečnost nových antikoagulancií v prevenci kardioembolického iktu v klinické praxi [69–71].
Zkušenost z klinické praxe jistě v nejbližší době prokáže, které antikoagulans a v které konkrétní situaci je pro daného pacienta nejvhodnější..
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Jiří Bauer, CSc.
Neurologická klinika
1. LF UK a VFN v Praze
Kateřinská 30
120 00 Praha 2
e-mail: jiri.bauer@lf1.cuni.cz
Přijato k recenzi: 6. 12. 2012
Přijato do tisku: 7. 2. 2013
Zdroje
1. Paciaroni M, Agnelli G, Micheli S, Caso V. Efficacy and safety of anticoagulant treatment in acute cardioembolic stroke. A meta‑analysis of randomized controlled trials. Stroke 2007; 38(2): 423 – 430.
2. Lloyd ‑ Jones DM, Wang TJ, Leip EP, Larson MG, Levy D, Ramachandran S et al. Lifetime risk for development of atrial fibrillation: The Framingham Heart Study. Circulation 2004; 110(9): 1042 – 1046.
3. Kirchhof P, Lip GY, Van Gelder IC, Bax J, Hylek E, Kaab E et al. Comprehensive risk reduction in patients with atrial fibrillation: Emerging diagnostic and therapeutic options. Executive summary of the report from the 3rd AFNET/ EHRA concensus conference. Europace 2012; 14(1): 8 – 27.
4. Camm AJ, Lip GYH, De Caterina R, Savelieva I,Atar D, Hohnloser SH et al. 2012 focused update of the ESC Guidelines for the management of atrial fibrillation: an uptade of the 2010 ESC Guidelines for the management of atrial fibrillation. Developed with the special contribution of the European Heart Rhytm Association. Eur Heart J 2012; 33(21): 2719 – 2747.
5. Healey JS, Connolly SJ, Gold MR, Israel CW, Van Gelder IC, Capucci A et al. Subclinical atrial fibrillation and the risk of stroke. E Engl J Med 2012; 366(2): 120 – 129.
6. Wang TJ, Massaro JM, Levy D, Vasan RS, Wolf PA, D’Ágostino RB et al. A risk score for predicting stroke or death in individuals with new‑onset atrial fibrillation in the community. The Framingham Hearth Study. JAMA 2003; 290(8): 1049 – 1056.
7. Čihák R, Heinc P, Haman L, Fiala M, Neužil P, To-man O. Fibrilace síní. Cor Vasa 2011; 53 (Suppl 1):27 – 52.
8. Fuster V, Rydén LE, Cannom DS, Crijns HJ, Curtis AB, Ellenbogen KA et al. ACC/ AHA/ ASC 2006 Guidelines for the Management of Patiens With Atrial Fibrillation: a report of the American College of Cardiology/ American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Revise the 2001 Guidelines for the Management of Patients With Atrial Fibrillation): developed in collaboration with the European Heart Rhythm Association and the Heart Rhythm Society. Circulation 2006; 114(4): 257 – 354.
9. Camm AJ, Kirchhof P, Lip GY,Schotten U, Savelieva I, Ernst S et al. Guidelines for the management of atrial fibrillation: The Task ‑ Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC). Eur Heart J 2010; 31(19): 2369 – 2429.
10. Bauer J. Prevence kardioembolických cévních mozkových příhod. Interní Med 2012; 14(1): 26 – 29.
11. Bauer J. Antikoagulační terapie v prevenci a léčbě ischemických iktů. Cesk Slov Neurol N 2010; 73/ 106(5): 480 – 490.
12. Hart RG, Pearce LA, Aguilar MI. Meta‑analysis: antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation. Ann Intern Med 2007; 146(12): 857 – 867.
13. Hart RG, Palacio S, Pearce LA. Atrial fibrillation, stroke, and acute antithrombotic therapy: analysis of randomized clinical trials. Stroke 2002; 33(11): 2722 – 2727.
14. Dalen JE. Prevention of embolic strokes: the role of the American College of Chest Physicians. Chest 2012; 141(2): 294 – 299.
15. Gayatt GH, Akl EA, Crowther M, Gutterman DD, Schuünemann HJ. Executive summary: Antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians evidence‑based clinical practice guedelines. Chest 2012; 141 (Suppl 2):7S – 47S.
16. Holbrook A, Schulman S, Witt DM, Vandvik PO, Fish J, Kovacs MJ et al. Evidence‑based management of anticoagulant therapy: Antithrombotic therapy and prevention of thrombosis, 9th ed. American College of Chest Physicians evidence‑based clinical practice guedelines. Chest 2012; 141 (Suppl 2): e152S – e184S.
17. You JJ, Singer DE, Howard PA, Lanc DA, Eckman MH, Fang MC et al. Antithrombotic therapy for atrial fibrillation: Antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians evidence‑based clinical practice guedelines. Chest 2012; 141 (Suppl 2): e495S – e530S.
18. Hart RG, Pearce LA, Aguilar MI. Meta‑analysis: antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation. Ann Intern Med 2007; 146(12): 857 – 867.
19. Connolly SJ, Poque J, Eikelboom J, Flaker G, Commerford P, Franzosi MG et al. Benefit of oral anticoagulant over antiplatelet therapy in atrial fibrillation depens on the quality of international normalized radio control achived by centers and countries as measured by time in therapeutic range. Circulation 2008; 118(20): 2029 – 2037.
20. The European Stroke Organisation (ESO) Executive Committee and the ESO Writing Committee. Guidelines for management of ischaemic stroke and transient ischaemic attack 2008. Cerebrovasc Dis 2008; 25(5): 457 – 507.
21. Steiner T, Rosand J, Diringer M. Intracerebral hemorrhage associated with oral anticoagulant therapy. Stroke 2006; 37(1): 256 – 262.
22. Aguilar MI, Hart RG, Kase CS, Freeman WD, Hoeben BJ, García RC et al. Treatment of warfarin‑associated intracerebral hemorrhage: literature review and expert opinion. Mayo Clin Proc 2007; 82(1): 82 – 92.
23. Přibáň V, Holý M, Vonke I. Intrakraniální hematomy u warfarinizovaných pacientů – kazuistiky a doporučení léčby. Cesk Slov Neurol N 2009; 72/ 105(6): 570 – 574.
24. Huhtakangas J, Tetri S, Juvela S, Soloheimo P, Bode MK, Hillbom M. Effect of increased warfarin use on warfarin‑related cerebral hemorrhage; a longitudinal population‑based study. Stroke 2011; 42(9): 2431 – 2435.
25. Steiner T, Rosand J, Diringer M. Intracerebral hemorrhage associated with oral anticoagulant therapy. Stroke 2006; 37(1): 256 – 262.
26. Bauer J. Etiopatogeneze a současné možnosti terapie intracerebrálního krvácení. Cesk Slov Neurol N 2006; 69/ 102 (Suppl 2): 30 – 33.
27. Gumulec J, Kessler P, Procházka V, Brejcha M, Penka M, Zänger M et al. Krvácivé komplikace a předávkování antikoagulační léčby. Vnitř Lék 2009; 55(3): 277 – 289.
28. Bauer J. Léčba intracerebrálního krvácení – skepse nebo optimizmus? Neurol Prax 2006; 6 : 328 – 330.
29. Huttner HB, Schellinger PD, Hartmann M, Köhrmann M, Juettler E, Wikner J et al. Hematoma growth and outcome in treated neurocritical care patiens with intracerebral hemorrhage related to oral anticoagulant therapy: comparison of acute treatment strategies using vitamin K, fresh frozen plasma, and prothrombin complex concentrates. Stroke 2006; 37(6): 1465 – 1470.
30. Hart RG, Aguilar MI. Anticoagulation in atrial fibrillation: selected controversies including optima anticoagulation intensity, treatment of intracerebral hemorrhage. J Tromb Thrombolysis 2008; 25(1): 26 – 32.
31. Fang MC, Go AS, Chang Y, Hylek EM, Henault LE, Jensvold NG et al. Death and disability from warfarin‑associated intracranial and extracranial hemorrhages. Am J Med 2007; 120(8): 700 – 705.
32. Fang MC, Go AS, Hylek EM, Chan Y, Henault LE, Jensvold NG et al. Age and the risk of warfarin‑associated hemorrhage: the anticoagulation and risk factors in atrial fibrillation study. J Am Geriatr Soc 2006; 54(8): 1231 – 1236.
33. Gallagher AM, Setakis E, Plumb JM, Clemens A, van Staa TP. Risk of stroke and mortality associated with suboptimal anticoagulation in atrial fibrillation patients. Thromb Haemost 2011; 106(5): 968 – 977.
34. Pecka M. Laboratorní monitorování antikoagulační léčby. Doporučení pro klinickou praxi (16. 3. 2006) [on-line]. Available from URL: http:/ / www.onkologickécentrum.cz/ downloads/ prirucky/ monitoring ‑ antikoagulace ‑ STH ‑ III.06.pdf.
35. Kvasnička J, Hájková J, Bobčíková P, Kvasnička T, Dušková D, Poletínová Š et al. Prevalence polymorfismů CYP2C9 a VKORC1 v České republice a zamyšlení nad výhledy antikoagulační léčby warfarinem. Cor Vasa 2011; 53(10): 522 – 526.
36. Remková A. Farmakogenetický algoritmus stanovenia dávky warfarínu. Interná Med 2008; 8(6): 3 – 5.
37. Matýšková M, Penka M. Interakce antikoagulačních léků s potravinami a potravinovými doplňky. Intern Med Prax 2000; 5(2): 20 – 23.
38. Olesen JB, Lip GY, Lane DA, Kober L, Hansen ML, Karasoy D et al. Vascular disease and stroke risk in atrial fibrillation: a Nationwide Cohort Study. Am J Med 2012; 125(8): 826.e13 – 826.e23.
39. Lip GY, Nieuwlaat R, Pisters R, Lane DA, Crijns HJ. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor‑based approach: the euro heart survey on atrial fibrillation. Chest 2010; 137(2): 263 – 272.
40. Olesen JB, Fauchier L, Lane DA, Taillandier S, Lip GY. Risk factor for stroke and thromboembolism in relation to age among patients with atrial fibrillation: the Loire Valley atrial fibrillation Project. Chest 2012; 141(1): 147 – 153.
41. Kakar P, Lane D, Lip GY. Bleeding risk statification models in deciding on anticoagulation in patiens with atrial fibrillation: a useful complement to stroke risk stratification schema. Chest 2006; 130(5): 1296 – 1299.
42. Ansell J. Warfarin versus new agents: interpreting the data. Hematology Am Soc Haematol Educ Program 2010; 2010 : 221 – 228.
43. Hylek EM. The need for new oral anticoagulants in clinical practice. J Cardiovasc Med 2009; 10(8): 605 – 609.
44. Mega JL. A new era for anticoagulation in atrial fibrillation. N Engl J Med 2011; 365(11): 1052 – 1054.
45. Eriksson BI, Quinlan DJ, Eikelboom JW. Novel oral factor Xa and thrombin inhibitors in the management of thromboembolism. Annu Rev Med 2011; 62 : 41 – 57.
46. Zikria JC, Ansell J. Oral anticoagulation with factor Xa and thrombin inhibitors: on the threshold of change. Curr Opin Hematol 2009; 16(5): 347 – 356.
47. Turpie AG. New oral anticoagulants in atrial fibrillation. Eur Heart J 2008; 29(2): 155 – 165.
48. Ogawa S, Koretsune Y, Yasaka M, Aizawa Y, Atarashi H, Inoue H et al. Antithrombotic therapy in atrial fibrillation. Evaluation and positioning of new oral anticoagulant agents. Circ J 2011; 75(7): 1539 – 1547.
49. Nutescu EA, Shapiro NL, Chevalier A. New anticoagulant agents: direct thrombin inhibitors. Cardiol Clin 2008; 26(2): 169 – 187.
50. Connolly SJ, Ezekowitz MD, Yusuf S, Eikelboom J, Oldgren J, Parekh A et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361(12): 1139 – 1151.
51. Connolly SL, Ezekowitz MD, Yusuf S, Wallentin L.Newly identified events in the RE ‑ LY trial. N Eng J Med 2010; 363(19): 1875 – 1876.
52. Eisert WG, Hauel N, Stangier N, Wiener W, Clemens A, nav Ryn J. Dabigatran: an oral novel potent reversible nonpeptide inhibitor of thrombin. Arterioscler Tromb Vasc Biol 2010; 30(10): 1885 – 1889.
53. Wallenin L, Yusuf S, Ezekowitz MD, Alings M, Flather M, Franzosi MG et al. Efficasy and safety of dabigatran compared with warfarin et different levels of international normalised ratio control for stroke prevention in atrial fibrillation: an anylysis of the RE ‑ LY trial. Lancet 2010; 376(9745): 975 – 983.
54. Oldgren J, Alings M, Darius H, Diener HC, Eikelboom J, Ezekowitz MD et al. Risk of stroke, bleeding, and death in patients with atrial fibrillation receiving dabigatran or warfarin in relation to the CHADS2 score: a subgroup analysis of the RE ‑ LY trial. Ann Intern Med 2011; 155(10): 660 – 667.
55. ROCKET AF Study Investigators. Rivaroxaban ‑ once daily, oral, direct factor Xa inhibition Compared with vitamin K antagonism for prevention of stroke and Embolism Trial in Atrial Fibrillation: rationale and design of the ROCKET AF study. Am Heart J 2010; 159(3): 340 – 347.
56. Patel MR, Mahaffey KW, Garg J, Pan G, Singer DE, Hacke W et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med 2011; 365(10): 883 – 891.
57. Granger CB, Alegander JH, Mc Murray JJ, Lopes RD, Hylek EM, Hanna M et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2011; 365(11): 981 – 992.
58. Connolly SJ, Eikelboom J, Joyner C, Diener HC, Hart R, Golitsyn S, Flaker G et al. Apixaban in patients with atrial fibrillation. N Engl J Med 2011; 364(9): 806 – 817.
59. Kansal AR, Sharma M, Bradley ‑ Kennedy C, Clemens A, Monz U, Peng S et al. Dabigatran versus rivaroxaban for the prevention of stroke and systemic embolism in atrial fibrillation in Canada. Comparative efficacy and cost‑effectiveness. Thromb Haemost 2012; 108(4): 672 – 682.
60. Hart RG, Diener HC, Yang S, Connolly SJ, Wallentin L, Reilly P at al. Intracranial hemorrhage in atrial fibrillation patients during anticoagulation with warfarin or dabigatran: the RE ‑ LY trial. Stroke 2012; 43(6): 1511 – 1517.
61. Baglin T, Hillarp A, Tripodi A, Elalamy I, Buller H, Ageno W. Measuring Oral Direct Inhibitors (ODIs) of thrombin and factor Xa: a recommendation from the Subcommittee on Control of Anticoagulation of the Scientific and Standardisation Committee of the International Society on Thrombosis and Haemostasis. J Thromb Haemost 2013; 11(4): 756–760.
62. van Ryn J, Stangier J, Haertter S, Liesenfeld KH, Wiener W, Feuring M et al. Dabigatran etexilate – a novel reversible oral direct thrombin inhibitor: interpretation of coagulation assays and reversal of anticoagulant activity. Thromb Haemost 2010; 103(6): 116 – 127.
63. Marlu R, Hodaj E, Paris A, Albaladejo P, Crackowski JL, Pernod G. Effect on non‑specific reversal agents on anticoagulant activity of dabigatran, rivaroxaban: a randomised crossover ex vivo study in healthy volunteers. Thromb Haemost 2012; 108(2): 217 – 224.
64. Shah SV, Gage BF. Cost‑effectiveness of dabigatran for stroke prophylaxis in atrial fibrillation. Circulation 2011; 123(22): 2562 – 2570.
65. Banerjee A, Lane DA, Torp ‑ Pedersen C, Lip GY. Net clinical benefit of new oral anticoagulants (dabigatran, rivaroxaban, apixaban) vs no treatment in a “real world“ atrial fibrillation population: a modelling analysis based on a nationwide cohort study. Thromb Haemost 2012; 107(3): 584 – 589.
66. FDA Drug Communication: Update on the risk for serious bleeding events with the anticoagulant Pradaxa. 2. 11. 2012 [on‑line]. Available from: htpp:/ / www.fda.gov/ Drugs/ Drugsafety/ ucm326580.htm.
67. Connolly SJ. Randomised comparison of the effecs of two doses of Dabigatran Etexilate of clinical outcomes over 4,3 years: Results of the RELY – ABLE trial. American Heart Association. Congress Report. Los Angeles, USA, 3 – 7 November 2012, Session CS.04 [on‑line]. Available from: htpp:/ / www.spaf ‑ academy.com/ speaker ‑ toolbox/ congress ‑ reports? dm.
68. Thelus R, Villines TC, Costner TS. Dabigatran versus warfarin among patients with atrial fibrillation: real ‑ world postmarket results. American Heart Association. Congress Report. Los Angeles, USA, 3 – 7 November 2012, Session APS.215.02 [on‑line]. Available from: htpp:/ / www.spaf ‑ academy.com/ speaker ‑ toolbox/ congress ‑ reports? dm.
69. GLORIA ‑ AF Registry Program (Phase I). Last updated October 17, 2012 [on‑line]. Available from: htpp:/ / www.clinicaltrials.gov/ show/ NCT01428765.
70. Apenteng PN, Murray ET, Holder R, Hobbs FD, Fitzmaurice DA. UK GARFIELD Investigators and GARFIELD Steering committee. An international longitunal registry of patients with atrial fibrillation at risk of stroke (GARFIELD): the UK protocol. BMC Cardiovasc Disord 2013; 13 : 31.
71. Piccini JP, Fraulo ES, Ansell JE, Fonarow GC, Gersh BJ, Go AS et al. Outcomes registry for better informed treatment of atrial fibrillation: rationale and design of ORBIT-AF. Am Heart J 2011; 162(4): 606.e1–612.e1.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2013 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Wilsonova nemoc
- Nová antikoagulancia v prevenci kardioembolických iktů u pacientů s nevalvulární fibrilací síní
- Homocysteín a sclerosis multiplex
- Kvantifikace postižení u pacientů s lumbální spinální stenózou
- Multiformní glioblastom – přehled nových poznatků o patogenezi, biomarkerech a perspektivách léčby
- Současné možnosti využití magnetické rezonance v diagnostice normotenzního hydrocefalu
- Neurologické komplikace dengue – možné nebezpečí pro střední Evropu
- Přesnost farmakogenetických algoritmů pro výpočet denní dávky warfarinu
- Interrater variabilita v hodnocení míry atrofie hipokampů pomocí Scheltensovy škály
- Porovnání peroperační radiační expozice při otevřené a miniinvazivní transpedikulární fixaci hrudní a bederní páteře
- Erratum
- Test 3F Dysartrický profil – normativní hodnoty řeči v češtině
- Operační léčba syndromu supinátorového kanálu
- Strategie diagnostiky, terapie a dispenzarizace pacientů s hemangioblastomy v CNS z pohledu neurochirurga
- Synkopy, hluchota a slepota u karcinomu prsu – kazuistika
- Gitelmanův syndrom provázený manifestní tetanií – kazuistika
- Konzumace marihuany jako rizikový faktor ischemické cévní mozkové příhody – kazuistika
- Tumoriformní varianta roztroušené sklerózy – dvě kazuistiky
- Souběžný výskyt mutace v genu ZNF9 (myotonická dystrofie typu 2) a v genu CLCN1 (myotonia congenita) v jedné rodině – kazuistika
- Webové okénko
-
Analýza dat v neurologii
XLI. Simpsonův paradox
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Wilsonova nemoc
- Multiformní glioblastom – přehled nových poznatků o patogenezi, biomarkerech a perspektivách léčby
- Tumoriformní varianta roztroušené sklerózy – dvě kazuistiky
- Test 3F Dysartrický profil – normativní hodnoty řeči v češtině
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy






