-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Fluorescencí navigovaná resekce vysokostupňových gliomů mozku
Fluorescence Guided Resection of High‑grade Gliomas
Fluorescence guided resection of high grade gliomas using 5-aminolevulinic acid (5-ALA) is a recently developed neurosurgical method, the objective of which is to achieve higher radicality in glioma resection, in terms of maximal cyto-reduction. Therefore, better initial conditions for adjuvant cancer therapy are prepared. Significant facilitation of peroperative tumour tissue identification is the main advantage of fluorescence-guided resection. Due to its fluorescing properties, 5-ALA and its biological product protoporphyrin IX serve as a metabolic marker of tumour cell presence throughout the neurosurgical procedure. The aim of this review is to describe theoretical principles of the method, as well as its surgical aspects, and to evaluate its benefits for patients with high grade gliomas from the perspective of evidence-based medicine.
Key words:
high grade glioma – 5-aminolevulinic acid – fluorescence guided resection
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: T. Krčík 1; R. Lipina 1,2; T. Paleček 1; T. Hrbáč 1; M. Smrčka 3
Působiště autorů: Neurochirurgická klinika FN Ostrava 1; Lékařská fakulta OU v Ostravě 2; Neurochirurgická klinika LF MU a FN Brno 3
Vyšlo v časopise: Cesk Slov Neurol N 2014; 77/110(3): 308-313
Kategorie: Přehledný referát
Souhrn
Fluorescencí navigovaná resekce vysokostupňových gliomů mozku s použitím kyseliny 5 ‑ aminolevulinové (5 ‑ ALA) je nová metoda v současné onkoneurochirurgii, která si klade za cíl dosažení vyšší radikality chirurgické resekce ve smyslu dokonalejší cytoredukce. Jsou tím vytvořeny lepší podmínky pro adjuvantní onkologickou léčbu. Základním přínosem fluorescencí navigované resekce je významné zlepšení peroperační identifikace nádorové tkáně vysokostupňového gliomu. 5 ‑ ALA a její biologický produkt protoporfyrin IX díky svým fluorescenčním vlastnostem totiž slouží jako metabolický marker přítomnosti gliomových buněk v průběhu neurochirurgického výkonu. Cílem tohoto přehledného článku je popsat teoretické základy a principy metody, její chirurgické aspekty a zhodnotit její přínos pro nemocné z pohledu medicíny založené na důkazech.
Klíčová slova:
vysokostupňový gliom – kyselina 5-aminolevulinová – fluorescencí navigovaná resekceÚvod
Vysokostupňové gliomy mozku představují i nadále obtížně zdolatelný problém s neblahými následky pro nemocné. I přes rozmach poznatků o etiologii a genetice těchto nádorů a vývoj nových způsobů léčby zůstává prognóza nemocných nadále nepříznivá. V neurochirurgii byla a je otázka radikality resekce vysokostupňových gliomů vděčné téma k diskuzím a zároveň i hnací motor dalšího vývoje. V poslední době narůstá množství důkazů, že radikalita neurochirurgické intervence ovlivňuje i celkovou dobu přežití [1 – 4], přičemž pozitivně ovlivňuje rovněž účinnost následné adjuvantní terapie [5]. Dosáhnout úplného odstranění přinejmenším kontrast ‑ enhancující porce nádoru však nemusí být jednoduché, o čemž svědčí data z 90. let 20. století, kdy se to podařilo v méně než 30 % případů [6,7]. Jednou z příčin je obtížné odlišení a identifikace „okraje“ infiltrativně rostoucího gliomu od jeho okolí. Fluorescencí navigovaná resekce vysokostupňových gliomů se v poslední době stala účinným nástrojem v neurochirurgii, jenž umožňuje dosáhnout výrazně vyšší radikality, než tomu bylo v minulosti.
Stručná historie
Snaha o identifikaci nádoru v operačním poli a jeho odlišení od zdravé tkáně doprovází onkoneurochirurgii od jejích počátků. Zásadním zlepšením bylo zavedení operačního mikroskopu. Prostým optickým zvětšením operovaného pole, spolu s lepším osvětlením, je operatér schopen lépe vizuálně odlišit nádor od okolí. Poprvé (1. srpna 1957) použil operační mikroskop v neurochirurgii Theodor Kurze v USA [8].
K dalšímu vývoji došlo začátkem 80. let. Pomohla tomu špatná prognóza pacientů s vysokostupňovými gliomy mozku. Snaha o nové způsoby léčby vedla k vzniku tzv. fotodynamické terapie. Zjednodušeně lze říci, že po podání fotosenzitující látky dojde k její akumulaci predilekčně v nádorových buňkách a následným osvětlením postresekčního lůžka nádoru světlem s určitou vlnovou délkou nastane destrukce nádorových buněk. Nejdříve byla tato možnost popsána na modelu karcinomu močového měchýře [9], u gliomů mozku v experimentu později [10]. Následně proběhly studie s použitím fotodynamické terapie v praxi [11], ale klinický efekt nebyl prokázán [12]. Fotodynamická terapie se tudíž zatím nestala standardním terapeutickým postupem, nicméně schopnost nádorových buněk akumulovat a syntetizovat látku, která má fluorescenční vlastnosti, nabídla možnost jejího využití k identifikaci nádorové tkáně během operačního výkonu. První podrobnější in vitro a in vivo studie o akumulaci porfyrinů po podání 5 ‑ ALA v buňkách gliomů byly publikovány v roce 1998 [13,14]. První pacient s multiformním glioblastomem byl operován s použitím fluorescence v roce 1995 v Mnichově a první zkušenosti s použitím této metody u devíti pacientů byly publikovány v roce 1998 [15]. Následovala první klinická studie [16], jež ověřovala bezpečnost metody a technické aspekty, zároveň byla zaznamenána vyšší radikalita resekce ve srovnání s klasickou resekcí bez použití fluorescence. Pilotní multicentrická randomizovaná studie v Německu potvrdila významný efekt na radikalitu resekce (65 % ve skupině ALA, pouze 36 % v kontrolní skupině) a statisticky významné prodloužení interval do progrese (PFS) u pacientů s fluorescencí navigovanou resekcí [16,17]. Studie otevřela dveře 5 ‑ ALA k registraci v Evropě v roce 2007, v České republice (SÚKL) byla 5 ‑ ALA registrována 1. 5. 2008.
5 ‑ aminolevulinová kyselina a principy fluorescence
Fluorescence je fyzikální jev, při němž dochází k emisi světla látkou, která absorbovala světlo nebo jiné elektromagnetické záření. Emitované světlo má obvykle větší vlnovou délku, a tím i nižší energii než původní záření.
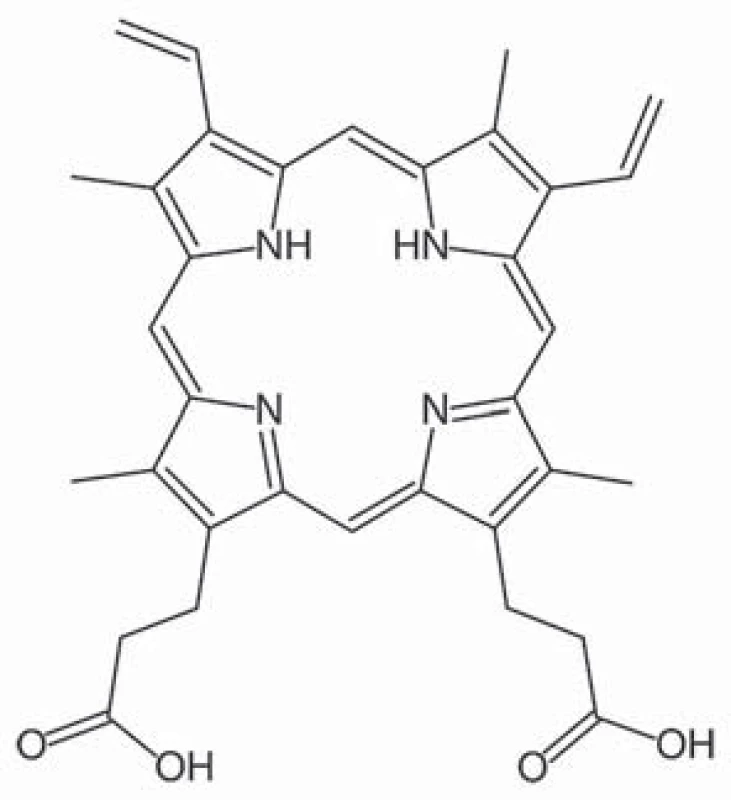
5 ‑ aminolevulinová kyselina (taxonomický název 5 ‑ amino ‑ 4 – oxo ‑ pentanová kyselina) je základní stavební prvek v syntéze porfyrinů, které jsou u živočichů součástí hemu, u rostlin chlorofylu (obr. 1). U živočichů vzniká syntézou z glycinu a sukcinylkoenzymu A pomocí enzymu ALA syntáza. Porfyriny jsou aromatické sloučeniny, jež obsahují čtyři pyrolová jádra spojená methinovými můstky. Jejich molekula má konjugovaný systém elektronů, který je schopný absorbovat fotony s určitou vlnovou délkou, přičemž při návratu elektronu zpět na původní energetickou hladinu dochází k emisi fotonu, což je příčinou fotodynamických vlastnosti porfyrinů, tj. fluorescence. Slovo porfyrin pochází z řečtiny a znamená purpurový. Protoporfyrin IX je specifický porfyrin lidského hemu (obr. 2). Pro protoporfyrin IX se excitační záření pohybuje v oblasti ultrafialového spektra o vlnové délce kolem 400 nm. Emitované záření se pohybuje v oblasti kolem 600 nm [18].
Obr. 1. Kyselina 5-aminolevulinová. 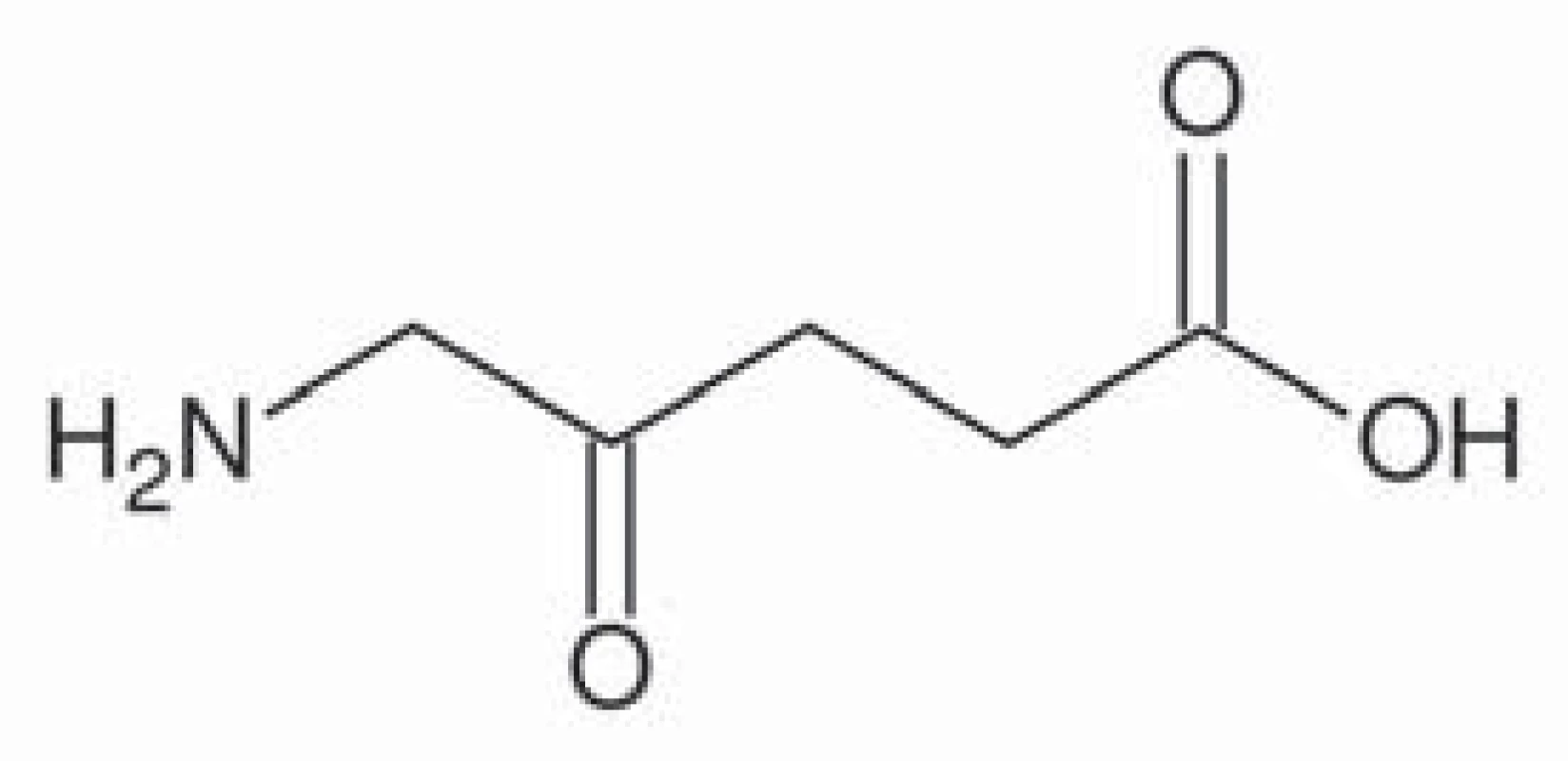
Bylo zjištěno, že několik druhů nádorů (např. karcinomy GIT, močového měchýře, gliomy) má, v případě zajištění dostatečného přísunu prekurzoru 5 ‑ ALA, schopnost syntetizovat protoporfyrin IX ve zvýšené míře. Akumulace protoporfyrinu IX přitom není způsobena selektivním vychytáváním 5 ‑ ALA nádorem, neboť koncentrace 5 ‑ ALA v cytozolu nádorových buněk byla srovnatelná s koncentrací v přilehlých zdravých fibroblastech, ale zvýšenou aktivitou porfobilinogen ‑ deaminázy a ferochelatázy nádorových buněk, tj. enzymů v syntetické cestě porfyrinů [19]. K akumulaci protoporfyrinu IX tudíž dochází výhradně intracelulárně.
5 ‑ ALA je vysoce polární molekula a normální hematoencefalická bariéra je pro ni prakticky nepropustná [20]. Narušení hematoencefalické bariéry, konkrétně disrupce tight junctions endotelu, jak je tomu u high‑grade gliomů, je proto další podmínka pro dodávku 5 ‑ ALA k buňkám nádoru.
Praktické aspekty fluorescencí navigované resekce gliomů
Fluorescencí navigovaná resekce gliomů mozku vyžaduje určité materiálně technické zabezpečení pracoviště, pozornost je třeba věnovat i naplánovaní operačního výkonu v návaznosti na podání 5 ‑ ALA pacientovi.
Operační mikroskop musí být vybaven výkonným zdrojem světla a filtry v zónách 400 nm a pro excitační a remitující světlo. Zdrojem světla je zvláštní xenonová lampa, která se zapíná pouze v módu modrého světla, šetří se tím její životnost, která je podstatně kratší (pouze 250 hod) než u hlavního zdroje. V současnosti všichni přední světoví výrobci operačních mikroskopů disponují touto technologií.
V experimentálních studiích se zjistilo, že fluorescence je nejvýraznější po dobu 6 hod od podání 5 ‑ ALA [13]. V praxi to vyžaduje naplánování operačního výkonu v návaznosti na užití 5 ‑ ALA. Na našem pracovišti podáváme 5 ‑ ALA 3 hod před plánovaným přesunem pacienta na operační sál, další hodina je vyhrazena na anesteziologickou přípravu, uvedení do celkové anestezie, polohování a registraci polohy hlavy do kraniální bezrámové navigace. Kraniotomie spolu s odstraněním většiny jednoznačně identifikovatelného nádoru trvá přibližně 90 min, takže ve chvíli posuzování resekčních okrajů je dosaženo maximální fluorescence. V případě odložení začátku výkonu pro nepředvídatelné okolnosti pokračujeme v provedení výkonu bez dalšího navýšení dávky 5 ‑ ALA. Z vlastní zkušenosti, i ze zkušenosti z jiných pracovišť, je ověřeno, že fluorescence je přítomna během výkonu i 12 až 16 hod po podání 5 ‑ ALA. Dochází však k pozvolnému snížení její intenzity, proto je lépe, pokud možno se této situaci vyhnout.
Dávkování a vedlejší účinky
Předoperační příprava pacienta se v zásadě neliší od standardní přípravy pacienta s gliomem mozku. 5 ‑ ALA je distribuována ve formě prášku, který se rozpustí v 50 ml pitné vody a užije perorálně. Hodnocení farmakokinetiky, které bylo součástí preklinické studie Phase I/ II (MC ‑ ALS.8 – I/ GLI), ukázalo, že dochází k úplné resorpci celé podané dávky 5 ‑ ALA během první hodiny po podání, takže v čase úvodu do anestezie je roztok již z GIT vstřebán [21]. Perorální způsob podání je velmi jednoduchý pro pacienta i personál. Roztok má mírně hořkou chuť. Podávání chronické medikace, antiepileptik a kortikoidů nemá vliv na farmakokinetiku 5 ‑ ALA.
V preklinické studii se zjistilo, že optimální dávka 5 ‑ ALA je 20 mg/ kg tělesné hmotnosti [13]. Další zvyšování dávky nevedlo k zvýraznění intenzity fluorescence, avšak došlo k zvýšení výskytu nežádoucích účinků, a to hypotenze, nauzey, zvracení a elevaci jaterních enzymů. V této studii byly testovány i menší dávky (0,2 a 2 mg/ kg), při kterých došlo k významné redukci intenzity fluorescence [21].
Z nežádoucích účinků se jako nejčastější uvádí fotosenzitizace kůže [22,23]. K fotosenzitizaci kůže dochází v prvních 24 hod po podání 5 ‑ ALA. Projevuje se pálivým zčervenáním, při těžkém průběhu i s tvorbou bul. Proto se doporučuje, aby pacienti v perioperačním období nebyli vystaveni intenzivnímu zdroji světla nebo přímému slunci. V praxi jsme se s fotosenzitizací kůže zatím nesetkali, běžné pokojové světlo tyto příznaky nevyvolalo, nicméně při pobytu na JIP bezprostředně po operaci je vhodné, aby osvětlení pokoje bylo tlumenější, a v případě, že je lůžko pacienta v dosahu přímého slunečního světla by mělo být odstíněno. Po 24 hod od podání 5 ‑ ALA již omezení vystavení pacienta světlu není nutné.
Fluorescencí navigovaná resekce vysokostupňového gliomu – specifika operační techniky
Po uvedení pacienta do celkové anestezie proběhne standardní proces fixace a polohování hlavy, registrace polohy hlavy do kraniální bezrámové navigace, příprava operačního pole s vyznačením incize. Kraniální bezrámová navigace je použita na přesné určení místa kraniotomie. Po provedení kraniotomie a durotomie je operační mikroskop s patřičným vybavením pro fluorescenci přistaven do pracovní pozice a dále používán v průběhu operace. Po nastavení mikroskopu a prohlédnutí operačního pole v bílém světle je vhodné již v úvodu krátce zkontrolovat funkčnost fluorescenčního módu a prohlédnout obnaženou mozkovou kůru. I v případě nádoru infiltrujícího kortex mozku, který je bez zaváhání identifikován v bílém světle, se při použití fluorescence může lépe ozřejmit rozsah infiltrace kortexu nádorem, což umožní preciznější naplánování kortikotomie. V případě subkortikální lokalizace nádoru může fluorescence lehce prosvítat nebo se objevit na dně sulku. V případě hlubšího uložení tumoru je možno opět použít kraniální navigaci, nebo alternativně peroperační sonografii, k iniciální lokalizaci nádoru.
Resekce jasně identifikovatelných částí glioblastomu, včetně porce centrální nekrózy, je většinou provedena pomocí ultrasonoaspirátoru s použitím bílého světla operačního mikroskopu. Poté následuje inspekce postresekční dutiny v módu modrého excitačního světla. Je důležité, aby posuzovaná oblast byla zbavena krve odsátím a irigací. Volná krev totiž zakrývá fluorescenci tkáně. Jak bylo uvedeno výše, zdrojem fluorescence je protoporfyrin IX, který je akumulován intracelulárně, v gliomových buňkách. Proto irigací operačního pole nehrozí „vypláchnutí“ fluorescence. Další resekce může probíhat v módu modrého světla, s občasným přepnutím do bílého světla, když je potřeba lepší rozlišení, např. při stavění krvácení z cév nádoru. Je důležité postupovat systematicky tak, aby všechny resekční plochy, včetně převislých okrajů v blízkosti kortikotomie, byly prohlédnuty v bílém i modrém excitačním světle.
Intenzita fluorescence není v tumoru rovnoměrně zastoupena. Například v centrální nekrotické části glioblastomu může zcela chybět. Můžeme rozlišit dvě intenzity fluorescence, a to jasně červenou, která odpovídá maximálnímu zastoupení maligních buněk ve tkáni, a dále slabší růžovofialovou na okrajích, jež se zvolna ztrácí (obr. 3). To odpovídá infiltrativnímu způsobu růstu vysokostupňových gliomů, jejich invazi do okolí a parciálnímu zastoupení maligních buněk v tkáni. Někdy se setkáváme se situací, zejména u operací recidiv glioblastomu po proběhlé onkologické léčbě, méně u primooperací, kdy fluorescence může sledovat průběh svazků bílé hmoty mozku, a to do značné vzdálenosti od centra nádoru. V tomto případě by pokračování v resekci (tzv. hon za fluorescencí – osobní komunikace s prof. Stummerem) znamenalo podstatné zvýšení rizika pooperačního neurologického deficitu. Přítomnost nádorových buněk v tkáni neznamená, že není nositelem funkce. Během celého výkonu si operatér musí být vědom, že úplné odstranění fluorescence se nerovná úplnému odstranění glioblastomu. Orientace v operačním poli a identifikace elokventních oblastí jsou tedy stejně důležité jako u resekcí tumorů klasickou technikou. V případě umístění nádoru v blízkosti elokventních zón je v současnosti již standardem použití neurofyziologického monitoringu k snížení rizika vzniku pooperačního neurologického deficitu.
Obr. 3. Peroperační fotografie zachycující dno resekční dutiny se solidní rezidulání porcí jasné purpurově červené fluorescence vlevo dolů, okrsek slabší růžové fluorescence vpravo nahoře reprezentuje „okraj“ nádoru. 
Z vlastní zkušenosti (obr. 4) i ze zmínek v literatuře [24] se jeví, že 5 ‑ ALA indukovaná fluorescence může přesahovat objem kontrast ‑ enhancující porce dle MR. Na druhé straně i po peroperačně zaznamenané kompletní resekci fluorescenční tkáně může pooperační MR odhalit kontrast sytící se reziduum. Stačí, aby mezi hlavní masou nádoru a drobným satelitním ložiskem byla vmezeřena tenká vrstva normální tkáně, která zakrývá fluorescenci, a dojde k chybnému dojmu kompletní resekce [25]. Obě metody se tudíž považují za vzájemně se doplňující. Kombinace fluorescencí navigované resekce a peroperační MR má synergický efekt s dosažením vyššího procenta kompletních resekcí kontrast ‑ enhancující porce glioblastomu [25 – 27].
Obr. 4. MR obraz pacienta s glioblastoma multiforme. 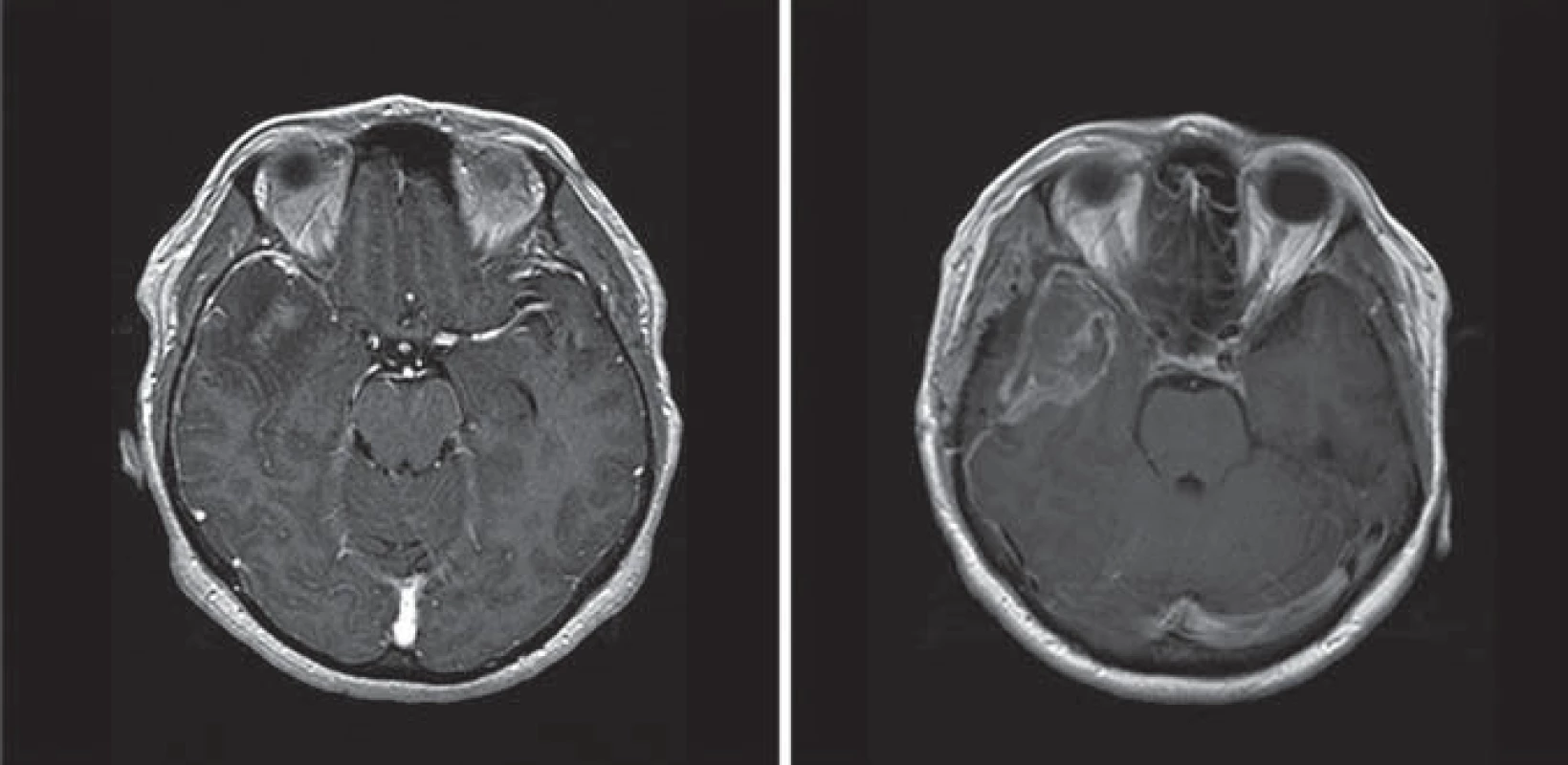
Srovnání T1 obrazů s kontrastní látkou Gd, před a po operaci provedené s fluorescencí navigovanou resekcí. Na pooperačním MR je patrné, že rozsah resekce jednoznačně přesahuje kontrast-enhancující porci na předoperačním snímku. Fluorescence po podání 5 ‑ ALA byla pozorována i u nádorů jiného původu než gliálního, např. u lymfomů a metastáz. Protože v těchto případech nelze pozorovanou fluorescenci považovat za identifikátora nádoru, je vždy v případě pochybností potřebné ověřit původ nádoru rychlou peroperační histologií [21]. Na našem pracovišti je zpravidla ještě před vlastním výkonem provedena punkční navigované biopsie s cílem potvrdit diagnózu vysokostupňového gliomu.
Fluorescencí navigovaná resekce z pohledu medicíny založené na důkazech
Prognóza nemocných s maligním gliomem mozku stále zůstává nepříznivá i přesto, že v poslední době došlo k výraznému rozvoji poznatků o biologických a genetických vlastnostech těchto nádorů. Zdali radikalita resekce u maligních gliomů má vliv na průměrnou délku přežití, je neustále řešeným tématem v neurochirurgii. Jednoznačný důkaz na úrovni I dle Oxford Centre for Evidence ‑ Based Medicine zatím chybí, i když intuitivně tušíme, že čím více se nám podaří z tumoru odstranit, tím déle je pacient bez známek rekurence nemoci, za předpokladu absolvování následné onkologické léčby [28]. Podrobnější analýza rozsáhlé klinické studie pacientů s maligním gliomem mozku léčených konkomitantní radiochemoterapií s temozolomidem, pod záštitou European Organisation for Research and Treatment of Cancer (EORTC study 26981), ukázala, že pacienti s „kompletní“ resekcí profitovali z režimu s temozolomidem nejvíc [29]. Termín cytoredukce proto možná lépe vystihuje situaci než resekce. Zmenšením poolu maligních buněk dojde k lepší startovací pozici pro následnou onkologickou léčbu, bez které by doba přežití byla podstatně kratší. Na druhé straně je však velmi důležité, aby snaha o radikalitu nevedla k zhoršení funkčního stavu pacienta, jež by mohlo přístup k adjuvantní onkoterapii znemožnit.
Fluorescencí navigovaná resekce maligních gliomů mozku je nová metoda, která má díky zlepšení identifikace nádorové tkáně gliomu v parenchymu mozku za cíl zvýšit pravděpodobnost dosažení radikálnější resekce. Protoporfyrin IX, odpovědný za fluorescenční jev, je syntetizován a akumulován intracelulárně, v buňkách gliomu. A to za předpokladu dostatku prekurzoru 5 ‑ ALA, což je podmíněno porušením hematoencefalické bariéry (neoangiogeneze), a za předpokladu funkční syntetické cesty porfyrinů. Růst vysokostupňových gliomů je charakterizován invazí do okolního parenchymu mozku, kde se buňky glioblastomu díky schopnosti rozrušit extracelulární matrix a své vlastní motilitě dostávají do značné vzdálenosti od centra nádoru, např. až do kontralaterální mozkové hemisféry [30]. Z výše uvedeného vyplývá, že k vzniku fluorescence je nutná souhra okolností, která však nemusí být zajištěna v celém rozsahu nádoru.
Vliv fluorescencí navigované resekce u maligních gliomů na radikalitu a klinický výsledek byl zkoumán v multicentrické, randomizované studii, jež proběhla v 18 centrech v Německu [17]. Tři sta dvacet dva pacientů bylo randomizováno do skupiny s fluorescencí navigovanou resekcí po podání 5 ‑ ALA nebo do skupiny s klasickým mikrochirurgickým výkonem s použitím bílého světla. Do konečné analýzy bylo zahrnuto nakonec 270 pacientů, u kterých byla histologicky potvrzena diagnóza maligního gliomu mozku a kteří splnili radiologická kritéria – vyloučeni byli jedinci s tumorem lokalizovanými ve střední čáře, bazálních gangliích, mozkovém kmeni a mozečku. Primárními cíli této studie bylo zjistit počet pacientů bez kontrast ‑ enhancující porce tumoru na časném pooperačním MR a šestiměsíční přežití bez progrese (progression free survival) opět dle MR. Progrese byla definována jako výskyt nové léze s objemem větším než 0,175 cm3, anebo zvětšení reziduálního objemu nádoru o 25 %. Zjistilo se, že kompletní odstranění kontrast ‑ enhancující porce nádoru došlo u 65 % operovaných v 5 ‑ ALA skupině, kdežto tohoto výsledku se podařilo dosáhnout pouze u 36 % operovaných v kontrolní skupině (p < 0,0001). 5 ‑ ALA skupina si vedla i lépe ve smyslu oddálení recidivy nemoci (střední progression free survival 5,1 měsíce v 5 ‑ ALA skupině vs 3,6 měsíce v kontrolní skupině, p = 0,003), avšak v délce celkového přežití nebyl pozorován významný rozdíl mezi skupinami. V 5 ‑ ALA skupině byl i signifikantně nižší počet reintervencí od počátku léčby až po smrt pacienta (p = 0,03). Za reintervenci se považoval další chirurgický zákrok nebo další onkologická léčba po ukončení iniciální radioterapie.
Jiná analýza dat z této studie se zabývala hodnocením celkového přežití u pacientů s dosaženou kompletní resekcí ve srovnání se skupinou s inkompletní resekcí [31], bez ohledu na to, zdali byli operováni s použitím 5 ‑ ALA nebo bez ní. Bylo zjištěno, že ve skupině s kompletní resekcí bylo dosaženo signifikantně delší celkové přežití (16,7 vs 11,8 měsíce, p < 0,0001). Skupina s kompletní resekcí však měla o něco jinou charakteristiku – bylo v ní více pacientů mladších než 60 let a dále méně častá přítomnost elokventní zóny v blízkosti tumoru. K eliminaci tohoto šumu byli proto ještě pacienti stratifikováni do skupin podle věku (pod 60 a nad 60 let) a elokventní lokalizace. Rozdíl v celkové délce přežití ovšem zůstal statisticky významný i v těchto skupinách ve prospěch kompletní resekce. Tato data poskytla důkaz na úrovni IIb, že průměrná doba celkového přežití závisí na dosažení kompletnosti resekce kontrast ‑ enhancující porce maligního glioblastomu.
Z pohledu bezpečnosti se skupina 5 ‑ ALA a kontrolní skupina nelišily ve výskytu nežádoucích událostí v bezprostředním poooperačním období, které bylo stanoveno na sedm dní [17]. Šest týdnů po operaci byla medián pro hodnotu Karnofsky skóre 90 v obou skupinách. V intervalu šest měsíců od operace obě skupiny vykazovaly opět velmi podobný pokles v Karnofsky skóre – u 28 % pacientů v 5 ‑ ALA skupině došlo ke snížení pod 60 %, ve srovnání s 31 % v kontrolní skupině bílého světla. K hodnocení neurologických funkcí a neurologického deficitu autoři použili citlivou škálu US National Institute of Health Stroke Scale (NIH ‑ SS). Obě skupiny se předoperačně v NIH ‑ SS signifikantně nelišily. Pooperačně došlo ve skupině 5 ‑ ALA k signifikantně vyššímu výskytu nového neurologického deficitu ve srovnání s kontrolní skupinou bílého světla (u 33 z 136 (24 %) vs u 19 z 130 (15 %)) v období prvních 48 hod (p = 0,462). V dalších sledovaných intervalech sedm dnů, šest týdnů a šest měsíců však již rozdíly v NIH ‑ SS nedosáhly statistické významnosti, i když trend skóre NIH ‑ SS ve skupině 5 ‑ ALA byl horší. V jiné analýze [32], jejímž cílem bylo vyhodnotit toto riziko a porovnat potencionální přínos, se ukázalo, že vyšší riziko nového pooperačního deficitu je zejména u pacientů, u nichž byl přítomen jistý neurologický deficit již předoperačně a současně nereagoval na léčbu kortikoidy. Na druhé straně srovnání mezi 5 ‑ ALA skupinou a skupinou bílého světla v intervalu do progrese (PFS) i při zahrnutí neurologické deteriorace do hodnocení ukázalo, že 5 ‑ ALA skupina si udržela signifikantně lepší výsledky, což autoři považují za vyvážení rizika zhoršení neurologického stavu pooperačně.
Další možnosti použití 5 ‑ ALA indukované fluorescence v neurochirurgii
I u dalších intraaxiálních tumorů mozku může zlepšení peroperační detekce znamenat přínos. Přítomnost 5 ‑ ALA indukované fluorescence byla popsána u intramedulárního ependymomu [33], intramedulárního gliomu [34], meduloblastomu [35], meningeomu [36], hemangioblastomu [37]. U těchto nozologických jednotek je význam fluorescencí navigované resekce předmětem dalšího výzkumu. Kuriozitou je přítomnost fluorescence u plaku sclerosis multiplex, který byl předoperačně mylně považován za glioblastom [38].
Praktickým přínosem je možnost detekce anaplastických ložisek v rámci difuzního nízkostupňového astrocytomu. V některých případech difuzních astrocytomů, kdy na předoperačním MR jsou zaznamenány oblasti slabého sycení po podání kontrastní látky, připadá do úvahy, že tumor obsahuje části s vyšším stupněm malignity. Po podání 5 ‑ ALA nedochází k fluorescenci v nízkostupňové části nádoru, ale v anaplastických částech ano, což bylo potvrzeno následným histopatologickým vyšetřením. Přesná histopatologická diagnostika stupně malignity má velký význam pro další management i prognózu nemocného [39 – 41].
Závěr
Fluorescencí navigovaná resekce s 5 ‑ ALA je nová metoda dnešní neurochirurgie s významným a na důkazech založeným přínosem v léčbě nemocných s vysokostupňovými gliomy mozku. Její využití je namístě v případě, kdy je nádor považován za radikálně resekabilní. Zlepšuje identifikaci tkáně gliomu a jeho „okrajů“ během operace, a tím významně zvyšuje pravděpodobnost dosažení kompletní resekce kontrast ‑ enhancující porce nádoru ve srovnání s klasickou resekcí za použití bílého světla mikroskopu. Zvýšená radikalita vede k prodloužení intervalu do progrese onemocnění a k snížení výskytu reoperací. Na druhé straně zvyšuje pravděpodobnost přechodného neurologického deficitu v prvních 48 hod po výkonu [17]. Dosažení kompletní resekce kontrast ‑ enhancující porce nádoru vede k prodloužení doby celkového přežití nemocných [31]. Díky relativně přijatelné materiálně technické náročnosti (např. ve srovnání s intraoperační MR) je možné tuto metodu používat na většině neurochirurgických pracovišť.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Tomáš Krčík
Neurochirurgická klinika FN
17. listopadu 1790
708 52 Ostrava
e-mail: tomkrcik@gmail.com
Přijato k recenzi: 30. 7. 2013
Přijato do tisku: 24. 2. 2014
Zdroje
1. McGirt MJ, Chaichana KL, Gathinji M, Attenello FJ, Than K, Olivi A et al. Independent association of extent of resection with survival in patients with malignant brain astrocytoma. J Neurosurg 2009; 110(1): 156 – 162. doi: 10.3171/ 2008.4.17536.
2. Sanai N, Polley MY, McDermott MW, Parsa AT, Berger MS. An extent of resection threshold for newly diagnosed glioblastomas. J Neurosurg 2011; 115(1): 3 – 8. doi: 10.3171/ 2011.2.JNS10998.
3. Vecht CJ, Avezaat CJ, van Putten WL, Eijkenboom WM, Stefanko SZ. The influence of the extent of surgery on the neurological function and survival in malignant glioma. A retrospective analysis in 243 patients. J Neurol Neurosurg Psychiatry 1990; 53(6): 466 – 471.
4. Lacroix M, Abi ‑ Said D, Fourney DR, Gokaslan ZL, Shi W, DeMonte F et al. A multivariate analysis of 416 patients with glioblastoma multiforme: prognosis, extent of resection, and survival. J Neurosurg 2001; 95(2): 190 – 198.
5. Stummer W, van den Bent MJ, Westphal M. Cytoreductive surgery of glioblastoma as the key to successful adjuvant therapies: new arguments in an old discussion. Acta Neurochir (Wien). 2011; 153(6): 1211 – 1218. doi: 10.1007/ s00701 - 011 - 1001 - x.
6. Kowalczuk A, Macdonald RL, Amidei C, Dohrmann G, Erickson RK, Hekmatpanah J et al. Quantitative imaging study of extent of surgical resection and prognosis of malignant astrocytomas. Neurosurgery 1997; 41(5): 1028 – 1036.
7. Albert FK, Forsting M, Sartor K, Adams HP, Kunze S.Early postoperative magnetic resonance imaging after resection of malignant glioma: objective evaluation of residual tumor and its influence on regrowth and prognosis. Neurosurgery 1994; 34(1): 45 – 60.
8. Donaghy R. The history of microsurgery in neurosurgery. Clin Neurosurg 1979; 26 : 619 – 625.
9. Jocham D, Staehler G, Chaussy C, Hammer C, Löhrs U. Laser treatment of bladder tumors following photosensitization with hematoporphyrin derivative. First experimental experiences. Urologe A 1981; 20 (Suppl): 340 – 343.
10. Kaye AH, Morstyn G, Ashcroft RG. Uptake and retention of hematoporphyrin derivative in an in vivo/ in vitro model of cerebral glioma. Neurosurgery 1985; 17(6): 883 – 890.
11. Kaye AH, Morstyn G, Brownbill D. Adjuvant high‑dose photoradiation therapy in the treatment of cerebral glioma: a phase 1 – 2 study. J Neurosurg 1987; 67(4): 500 – 505.
12. Obwegeser A, Ortler M, Seiwald M, Ulmer H, Kostron H. Therapy of glioblastoma multiforme: a cumulative experience of 10 years. Acta Neurochir (Wien) 1995; 137(1 – 2): 29 – 33.
13. Stummer W, Stocker S, Novotny A, Heimann A, Sauer O, Kempski O et al. In vitro and in vivo porphyrin accumulation by C6 glioma cells after exposure to 5 ‑ aminolevulinic acid. J Photochem Photobiol B 1998; 45(2 – 3): 160 – 169.
14. Hebeda KM, Saarnak AE, Olivo M, Sterenborg HJ,Wolbers JG. 5 ‑ aminolevulinic acid induced endogenous porphyrin fluorescence in 9L and C6 brain tumours and in the normal rat brain. Acta Neurochir (Wien) 1998; 140(5): 503 – 512.
15. Stummer W, Stocker S, Wagner S, Stepp H, Fritsch C, Goetz C et al. Intraoperative detection of malignant gliomas by 5 ‑ aminolevulinic acid‑induced porphyrin fluorescence. Neurosurgery 1998; 42(3): 518 – 525.
16. Stummer W, Novotny A, Stepp H, Goetz C, Bise K, Reulen HJ. Fluorescence ‑ guided resection of glioblastoma multiforme by using 5 ‑ aminolevulinic acid‑induced porphyrins: a prospective study in 52 consecutive patients. J Neurosurg 2000; 93(6): 1003 – 1013.
17. Stummer W, Pichlmeier U, Meinel T, Wiestler OD, Zanella F, Reulen HJ et al. Fluorescence ‑ guided surgery with 5 ‑ aminolevulinic acid for resection of malignant glioma: a randomised controlled multicentre phase III trial. Lancet Oncol 2006; 7(5): 392 – 401.
18. Stummer W, Stepp H, Möller G, Ehrhardt A, Leonhard M, Reulen HJ. Technical principles for protoporphyrin‑IX ‑ fluorescence guided microsurgical resection of malignant glioma tissue. Acta Neurochir (Wien) 1998; 140(10): 995 – 1000.
19. Krieg RC, Messmann H, Rauch J, Seeger S, Knuechel R. Metabolic characterization of tumor cell ‑ specific protoporphyrin IX accumulation after exposure to 5 ‑ aminolevulinic acid in human colonic cells. Photochem Photobiol 2002; 76(5): 518 – 525.
20. Ennis SR, Novotny A, Xiang J, Shakui P, Masada T, Stummer W et al. Transport of 5 ‑ aminolevulinic acid between blood and brain. Brain Res 2003; 959(2): 226 – 234.
21. Tonn JC, Stummer W. Fluorescence ‑ guided resection of malignant gliomas using 5 ‑ aminolevulinic acid: practical use, risks, and pitfalls. Clin Neurosurg 2008; 55 : 20 – 26.
22. Regula J, MacRobert AJ, Gorchein A, Buonac-corsi GA, Thorpe SM, Spencer GM et al. Photosensitisation and photodynamic therapy of oesophageal, duodenal, and colorectal tumours using 5 aminolaevulinic acid induced protoporphyrin IX: a pilot study. Gut 1995; 36(1): 67 – 75.
23. Mlkvy P, Messmann H, Debinski H, Regula J, Conio M, MacRobert A et al. Photodynamic therapy for polyps in familial adenomatous polyposis – a pilot study. Eur J Cancer 1995; 31A(7 – 8): 1160 – 1065.
24. Tonn JC, Stummer W. Fluorescence ‑ guided resection of malignant gliomas using 5 ‑ aminolevulinic acid: practical use, risks, and pitfalls. Clin Neurosurg 2008; 55 : 20 – 26.
25. Feigl GC, Ritz R, Moraes M, Klein J, Ramina K, Gharabaghi A et al. Resection of malignant brain tumors in eloquent cortical areas: a new multimodal approach combining 5 ‑ aminolevulinic acid and intraoperative monitoring. J Neurosurg 2010; 113(2): 352 – 357. doi: 10.3171/ 2009.10.JNS09447.
26. Eyüpoglu IY, Hore N, Savaskan NE, Grummich P,Roessler K, Buchfelder M et al. Improving the extent of malignant glioma resection by dual intraoperative visualization approach. PLoS One. 2012; 7(9): e44885. doi: 10.1371/ journal.pone.0044885.
27. Tsugu A, Ishizaka H, Mizokami Y, Osada T, Baba T,Yoshiyama M et al. Impact of the combination of 5 ‑ aminolevulinic acid‑induced fluorescence with intraoperative magnetic resonance imaging ‑ -guided surgery for glioma. World Neurosurg 2011; 76(1 – 2): 120 – 127. doi: 10.1016/ j.wneu.2011.02.005.
28. Ausman JI. Does gross total removal of a brain tumor produce greater longevity? Surg Neurol 2009; 71(1): 154. doi: 10.1016/ j.surneu.2008.10.012.
29. Stupp R, Mason WP, van den Bent MJ, Weller M, Fisher B, Taphoorn MJ et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med 2005; 352(10): 987 – 996.
30. Chi A, Norden AD, Wen PY. Inhibition of angiogenesis and invasion in malignant gliomas. Expert Rev Anticancer Ther 2007; 7(11): 1537 – 1560.
31. Stummer W, Reulen HJ, Meinel T, Pichlmeier U,Schumacher W, Tonn JC et al. Extent of resection and survival in glioblastoma multiforme: identification of and adjustment for bias. Neurosurgery 2008; 62(3): 564 – 576. doi: 10.1227/ 01.neu.0000317304.31579.17.
32. Stummer W, Tonn JC, Mehdorn HM, Nestler U, Franz K, Goetz C et al. Counterbalancing risks and gains from extended resections in malignant glioma surgery: a supplemental analysis from the randomized 5 ‑ aminolevulinic acid glioma resection study. Clinical article. J Neurosurg 2011; 114(3): 613 – 623. doi: 10.3171/ 2010.3.JNS097.
33. Inoue T, Endo T, Nagamatsu K, Watanabe M, Tominaga T. 5 ‑ aminolevulinic Acid Fluorescence ‑ guided Resection of Intramedullary Ependymoma: Report of 9 Cases. Neurosurgery 2013 Jun;72 (2 Suppl Operative): ons159 – 68. doi: 10.1227/ NEU.0b013e 31827bc7a3.
34. Eicker SO, Floeth FW, Kamp M, Steiger HJ, Hänggi D. The impact of fluorescence guidance on spinal intradural tumour surgery. Eur Spine J 2013; 22(6): 1394 – 401. doi: 10.1007/ s00586 - 013 - 2657-0.
35. Eicker S, Sarikaya ‑ Seiwert S, Borkhardt A, Gierga K,Turowski B, Heiroth HJ et al. ALA‑induced porphyrin accumulation in medulloblastoma and its use for fluorescence ‑ guided surgery. Cent Eur Neurosurg 2011; 72(2): 101 – 103. doi: 10.1055/ s ‑ 0030 - 1252010.
36. Bekelis K, Valdés PA, Erkmen K, Leblond F, Kim A, Wilson BC et al. Quantitative and qualitative 5 ‑ aminolevulinic acid‑induced protoporphyrin IX fluorescence in skull base meningiomas. Neurosurg Focus 2011; 30(5): E8. doi: 10.3171/ 2011.2.FOCUS1112.
37. Utsuki S, Oka H, Sato K, Shimizu S, Suzuki S,Fujii K. Fluorescence diagnosis of tumor cells in hemangioblastoma cysts with 5 ‑ aminolevulinic acid. J Neurosurg 2010; 112(1): 130 – 132. doi: 10.3171/ 2009.5.JNS08442.
38. Nestler U, Warter A, Cabre P, Manzo N. A case of late ‑ onset multiple sclerosis mimicking glioblastoma and displaying intraoperative 5 ‑ aminolevulinic acid fluorescence. Acta Neurochir (Wien) 2012; 154(5): 899 – 901. doi: 10.1007/ s00701 – 012 – 1319 – z.
39. Widhalm G, Wolfsberger S, Minchev G, Woehrer A, Krssak M, Czech T et al. 5 ‑ aminolevulinic acid is a promising marker for detection of anaplastic foci in diffusely infiltrating gliomas with nonsignificant contrast enhancement. Cancer 2010; 116(6): 1545 – 1552. doi: 10.1002/ cncr.24903.
40. Ewelt C, Floeth FW, Felsberg J, Steiger HJ, Sabel M,Langen KJ et al. Finding the anaplastic focus in diffuse gliomas: the value of Gd ‑ DTPA enhanced MRI, FET ‑ PET, and intraoperative, ALA ‑ derived tissue fluorescence. Clin Neurol Neurosurg 2011; 113(7): 541 – 547. doi: 10.1016/ j.clineuro.2011.03.008.
41. Šteňo A, Illéš R, Rychlý B, Fabian M, Šteňo J. Detection of anaplastic foci within infiltrative gliomas with nonsignificant contrast enhancement using 5 ‑ aminolevulic acid – a report of five cases. Cesk Slov Neurol N 2012; 75/ 108(2): 227 – 232.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2014 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- CIDP: epidemiológia, klinický obraz a diagnostika v kocke
-
Všetky články tohto čísla
- Funkční poruchy hybnosti
- Přehled méně častých primárních bolestí hlavy
-
Komentář ke článku autorů Kotase a Polívky
Přehled méně častých primárních bolestí hlavy - Spasticita po iktu jako projev maladaptivní plasticity a její ovlivnění botulotoxinem
- Méně obvyklé indikace hluboké mozkové stimulace
- Projekt ncRNAPain
- Fluorescencí navigovaná resekce vysokostupňových gliomů mozku
- Neurologické hypotézy u panické poruchy
- Účinky intoxikace metanolem na kognitivní funkce
- Možnosti kontinuálního monitoringu průtoku krve mozkem v detekci vazospazmů u pacientů po těžkém subarachnoidálním krvácení
-
Komentář ke článku autorů Mrliana, Ďuriše, Neumana, Vybíhala a Smrčky
Možnosti kontinuálního monitoringu průtoku krve mozkem v detekci vazospazmů u pacientů po těžkém subarachnoidálním krvácení - Pupilární reakce na barevné podněty
- Klíšťová encefalitida, průběh a komplikace – naše poznatky z let 2009– 2012
- Naše zkušenosti s mobilní náhradou krčního disku Mobi‑ C – výsledky studie s intervalem sledování pět let
- Neuromodulace sakrálních nervů při řešení inkontinence stolice
- Kombinovaný paramediánní supracerebellární‑ transtentoriální a miniinvazivní subokcipitální přístup při resekci gliomu celé délky mediobazální temporální oblasti
- Selektivní denervace karpu při řešení artrotického postižení zápěstí
- Flekční cervikální myelopatie (Hirayamova choroba) – skutečnost, nebo mýtus? Dvě kazuistiky
- Simultánní výskyt leptomeningeálních a intramedulárních metastáz glioblastoma multiforme – kazuistika
- Blister aneuryzma arteria carotis interna – kazuistika a přehled literatury
- Doporučený postup pro intravenózní trombolýzu v léčbě akutního mozkového infarktu – verze 2014
- Prof. Josef Vymazal starší – in memoriam
- Webové okénko
- Recenze knih
-
Analýza dat v neurologii
XLV. Grafy usnadňující studium zavádějících faktorů v asociačních studiích – III. Spojitá data
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Funkční poruchy hybnosti
- Přehled méně častých primárních bolestí hlavy
- Doporučený postup pro intravenózní trombolýzu v léčbě akutního mozkového infarktu – verze 2014
- Neurologické hypotézy u panické poruchy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy