-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vazospazmy jako komplikace subarachnoidálního krvácení – kazuistika
Vasospasms as a Complication of Subarachnoid Hemorrhage – a Case Report
Vasospasms are considered to be the major cause of high mortality and bad prognosis in patients with subarachnoid hemorrhage caused by a rupture of an aneurysm. Our case report describes a 30-year-old patient admitted with Glasgow Coma Scale 14 and severe left-sided hemiparesis. Computed tomography revealed subarachnoid hemorrhage. Its etiology was ruptured aneurysm of the right middle cerebral artery. The aneurysm was clipped. Mechanical and pharmacological angioplasty was repeatedly performed to manage symptomatic vasospasms. Despite these interventions, an ischemic lesion developed in the right brain hemisphere that prompted us to perform decompressive craniectomy. Finally, vasospasms, as well as the neurological deficit, disappeared. Four years after the surgery, the patient is independent, without any limb movement disorder and with normal cognitive functions.
Key words:
vasospasms – subarachnoid hemor-rhage – delayed ischemic deficit – calcium channel blockers – angioplasty
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autori: L. Jurák; P. Buchvald; V. Beneš III.; M. Kaiser; P. Suchomel
Pôsobisko autorov: Neurochirurgické oddělení, Krajská nemocnice Liberec, a. s.
Vyšlo v časopise: Cesk Slov Neurol N 2014; 77/110(5): 642-646
Kategória: Kazuistika
doi: https://doi.org/10.14735/amcsnn2014642Súhrn
Vazospazmy jsou považovány za hlavní příčinu vysoké mortality a špatné prognózy pacientů se subarachnoidálním krvácením způsobeným rupturou aneuryzmatu. Námi popisovaná kazuistika se týká 30leté pacientky, která byla přijata s Glasgow Coma Scale 14 a těžkou levostrannou hemiparézou. Počítačová tomografie odhalila subarachnoidální krvácení. Jeho příčinou byla ruptura aneuryzmatu na arteria cerebri media vpravo. Aneuryzma bylo zaklipováno. Pro symptomatické vazospazmy jsme opakovaně provedli mechanickou i farmakologickou angioplastiku. Přesto došlo k rozvoji ischemie v pravé mozkové hemisféře, což nás vedlo k dekompresivní kraniektomii. Finálně vazospazmy regredovaly a nastala úplná úprava neurologického deficitu. Čtyři roky po operaci je pacientka plně soběstačná, bez poruchy hybnosti končetin, s nedotčenými kognitivními funkcemi.
Klíčová slova:
vazospazmy – subarachnoidální krvácení – pozdní ischemický deficit – blokátory kalciových kanálů – angioplastikaÚvod
Subarachnoidální krvácení (SAK) způsobené rupturou aneuryzmatu představuje velmi závažnou chorobu s vysokou mortalitou a morbiditou. Přibližně 11 % pacientů po ruptuře aneuryzmatu zemře v terénu před jakýmkoliv možným zdravotnickým zásahem a 40 % pacientů umírá v průběhu prvních čtyř týdnů od přijetí do nemocnice. Až u 30 % přeživších přetrvává významná morbidita, která zapříčiňuje jejich každodenní závislost na pomoci druhých [1], a téměř 50 % přeživších má kognitivní poruchy, jež negativně a trvale ovlivňují kvalitu jejich života [2].
Za hlavní příčinu vysoké mortality a špatné prognózy pacientů se SAK jsou považovány vazospazmy (VS) [3], přesněji jejich následek ve formě pozdního ischemického deficitu (Delayed Ischemic Deficit, DID). Včasná diagnostika a správná léčba VS může rozvoji DID zabránit nebo minimalizovat jeho klinické projevy.
Předkládáme kazuistiku pacientky se SAK komplikovaným těžkými a recidivujícími VS. Dále o VS a DID uvádíme základní fakta z dostupných literárních zdrojů.
Kazuistika
Třicetiletá pacientka, do té doby zcela zdráva, neléčila se s žádnou chorobou ani neužívala žádné léky. Po návratu domů ze sportovního zápasu upadla náhle do bezvědomí. Při příjetí do nemocnice měla GCS 14 s těžkou levostrannou hemiparézou. Subjektivně udávala bolest hlavy v oblasti pravého spánkového laloku. Akutně provedená počítačová tomografie (CT) diagnostikovala atypický intracerebrální hematom (ICH) frontálně vpravo a subarachnoidální krvácení v oblasti pravé mozkové hemisféry jak na konvexitě, tak v bazálních cisternách (obr. 1). Na provedené CT angiografii (CTAg) byly zjištěny dva defekty na arteria cerebri media (ACM) v oblasti její bifurkace M1/ 2 vpravo. V diferencionální diagnostice se mohlo jednat o emboly nebo zachycené VS. Aneuryzma či jiná cévní patologie potvrzeny nebyly. Následně byla uskutečněna digitální subtrakční angiografie (DSA) s nálezem aneuryzmatu na ACM M1/ 2 vpravo. Navíc bylo vysloveno podezření na možnost, že aneuryzma je trombozované (obr. 2). Toto podezření bylo podpořeno i zobrazením na magnetické rezonanci (MR). Pacientka byla zhodnocena jako Hunt Hess 3, World Federation of Neurological Surgeons 3, Fisher 4. Po nasazení antiedematózní léčby došlo k regresi poruchy vědomí i lateralizace. Od začátku hospitalizace byl pacientce podáván blokátor kalciového kanálu nimodipin v perorální formě a intravenózní magnezium sulfát. Druhého dne bylo převážně ztrombozované aneuryzma zaklipováno a ICH byl evakuován. Operační výkon proběhl bez komplikací. Trval 250 min, krevní ztráty byly 400 ml. Pacientka byla ponechána na umělé plicní ventilaci, nicméně po snížení sedace se budila opět do kontaktu, vyhověla, bez zjevné lateralizace. Třetího dne hospitalizace došlo dle transkraniální dopplerometrie (TCD) k rozvoji VS na ACM vpravo (střední rychlost 170 cm/ s, Lindegaardův index (LI) 4,86) (graf 1). Do medikace byl pacientce přidán statin Sortis. Čtvrtého dne se VS staly symptomatickými. Pacientka měla plegickou levou horní končetinu (LHK) a těžce paretickou levou dolní končetinu (LDK). Péče o pacientku byla rozšířena o 3H terapii a bylo jí zavedeno čidlo na měření nitrolebního tlaku (ICP) Sophysa Pressio a další čidlo k monitorování průtoku krve mozkem (CBF) Codman Hemedex. Obě čidla byla zavedena z pravostranného frontálního přístupu do povodí ACM. Pro pokles CBF a vzestup rychlostí na ACM vpravo dle TCD (střední rychlost 180 cm/ s, LI 5,14) byla indikována DSA s grafickým potvrzením VS (obr. 3). Proto byla provedena kombinovaná (mechanická i farmakologická) angioplastika s následným částečným zlepšením hybnosti levostranných končetin (grafy 1, 2). Jako vazodilatační léčivo aplikované těsně před místo uzávěru byl použit nitroglycerin Perlinganit v celkové dávce 0,25 mg. Sedmého dne došlo k opětovnému nástupu klinicky symptomatických VS – plegie levostranných končetin s poklesem CBF a vzestupem rychlostí na ACM vpravo dle TCD (střední rychlost 190 cm/ s, LI 5,28). Byla zopakována kombinovaná angioplastika s dočasným zlepšením neurologického nálezu v podobě těžké parézy LHK a středně těžké parézy LDK (grafy 1, 2). Jako vazodilatační agens aplikované těsně před místo uzávěru byl použit nitroglycerin Perlinganit v celkové dávce 1,0 mg. Desátého dne byl zjištěn další vrchol symptomatických VS na ACM vpravo dle TCD (střední rychlost 250 cm/ s, LI 6,25) s plegií levostranných končetin. Hodnoty CBF nebyly pro poruchu přístroje k dispozici. Byla provedena třetí kombinovaná angioplastika (graf 1). Jako vazodilatační agens aplikované těsně před místo uzávěru byl použit nitroglycerin Perlinganit v celkové dávce 0,75 mg. Následně byla dle CT zjištěna expanzivně se chovající lehce prokrvácená ischemie v povodí ACM vpravo zasahující až do oblasti nucleus caudatus (obr. 4). Pacientka podstoupila další neurochirurgický zákrok – dekompresivní kraniektomii frontotemporoparietálně vpravo. Operační výkon proběhl bez komplikací. Trval 50 min, krevní ztráty byly 200 ml. Během následujících dnů hospitalizace došlo k regresi zaznamenaných VS a levostranné symptomatologie (graf 1). Devětatřicátý den byla pacientka dimitována do domácího prostředí, subjektivně bez potíží, objektivně bez neurodeficitu. Po čtyřech týdnech následovala nekomplikovaná kranioplastika.
Obr. 1. Výpočetní tomografie mozku, transverzální projekce, atypický nehomogenní intracerebrální hematom frontálně vpravo (červená šipka), subarachnoidální krvácení v oblasti pravé Sylvijské rýhy a mezi temporálními gyry. 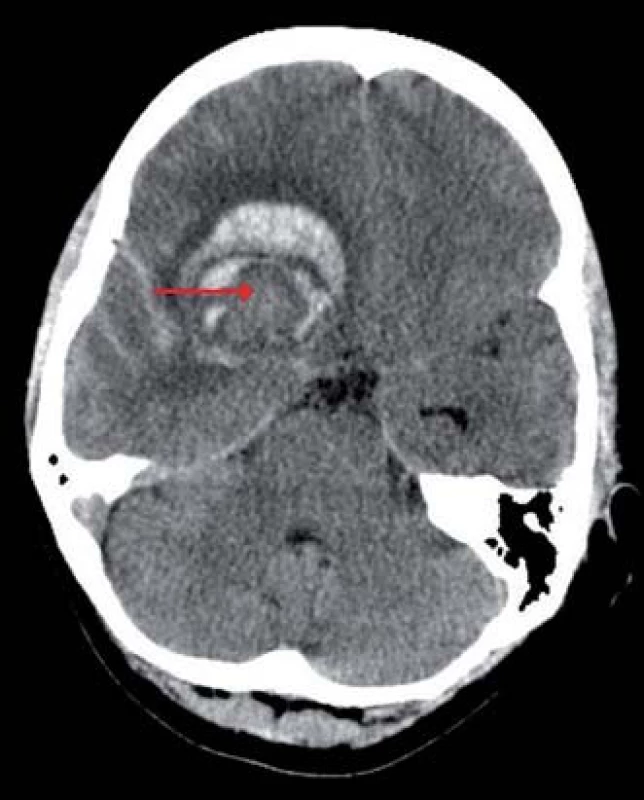
Obr. 2. Digitální subtrakční angiografie mozku, koronární projekce, široké kopulovité rozšíření středního úseku ACM M1 vpravo s plnícím se drobným sekundárním vakem na jejím hrotu (červená šipka), nelze vyloučit objemnější trombozované aneuryzma s krčkem odstupujícím proximálně. 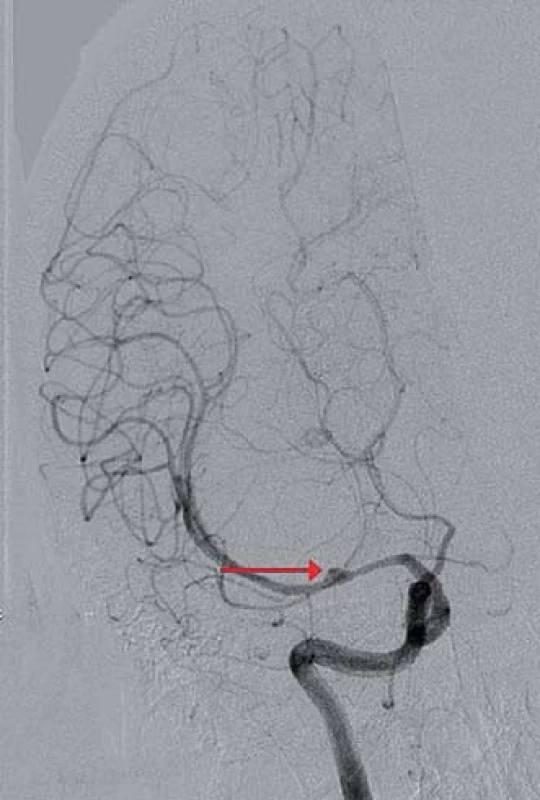
Obr. 3. Digitální subtrakční angiografie mozku, koronární projekce, významná stenóza ACI C7 vpravo a dále ACM M1 a ACA A1 vpravo (červená šipka). 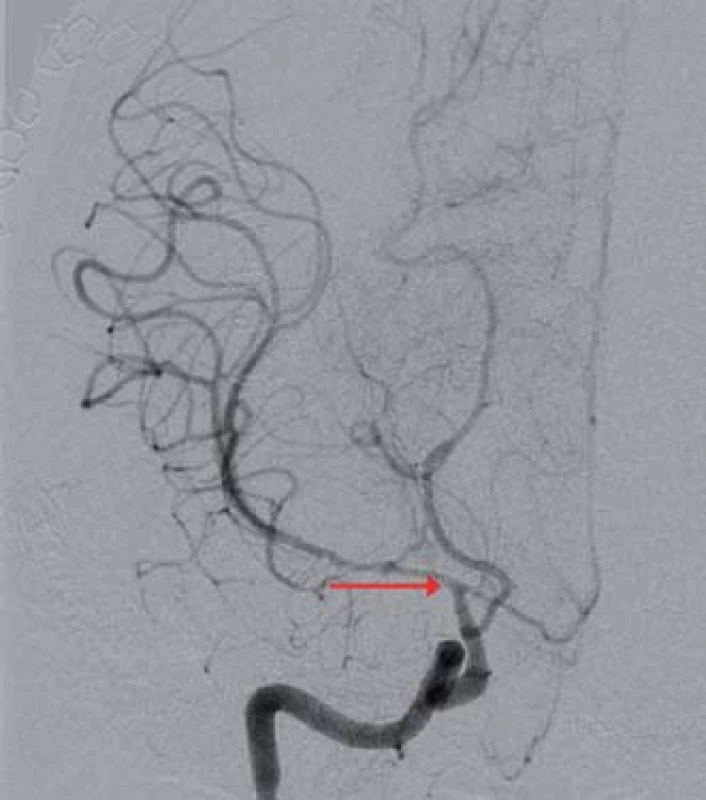
Obr. 4. Výpočetní tomografie mozku, transverzální projekce, expanzivně se chovající lehce prokrvácená ischemie v povodí ACM vpravo zasahující až do oblasti nucleus caudatus (červená šipka), přetlak střední čáry doleva. 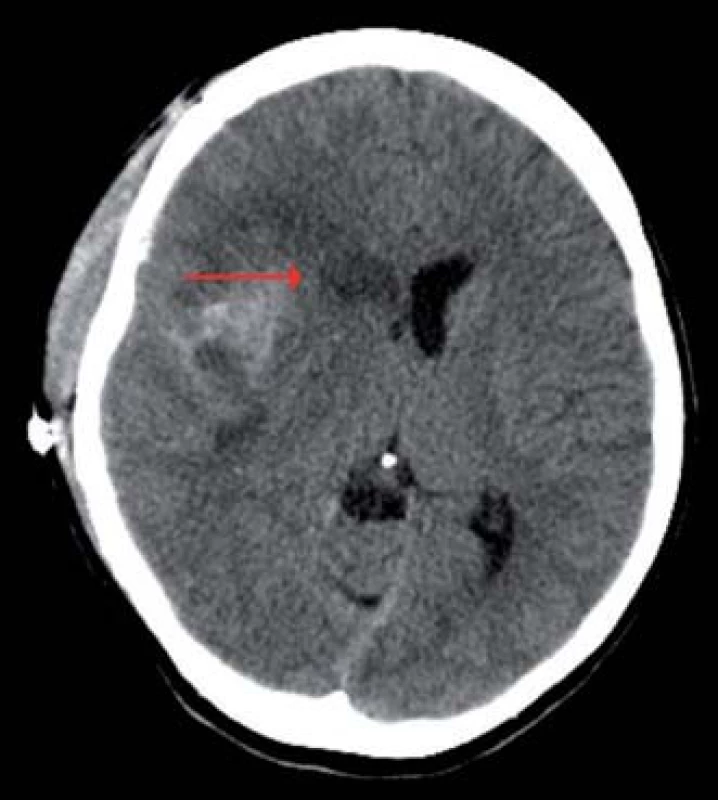
Graf 1. Graf znázorňující průběh hospitalizace pacientky, zaznamenány důležité dny či časové úseky, kdy došlo ke změně klinického stavu a k intervencím charakteru perkutánní transluminální angioplastiky či dekompresivní kraniektomie v korelaci s hodnotami střední rychlosti toku krve v ACM vpravo. 
Graf 2. Graf znázorňující období měření průtoku krve mozkem pacientky a provedení perkutánních transluminálních angioplastik. 
V současné době, pět let po ruptuře aneuryzmatu, je pacientka plně soběstačná, bez poruchy hybnosti končetin, s nedotčenými kognitivními funkcemi.
Diskuze
V české literatuře je publikováno nemálo prací popisujících vazospazmy u pacientů se SAK, jejich etiologii, patofyziologii, klinickou manifestaci a modality k jejich včasné diagnostice a terapii [4 – 6]. Monitoringem tkáňové oxymetrie (PtiO2) u pacientů se SAK se zabývá několik autorských kolektivů [7 – 10]. Habalová et al popisují využití regionální mozkové oxymetrie u pacientů se SAK [11]. Hejčl et al se věnují sledování mozkového metabolizmu pomocí mikrodialýzy u pacientů se SAK [8,12].
Vazospazmus je způsoben přítomností krve v subarachnoidálním prostoru. Rozpadové produkty krve, zejména oxyhemoglobin, spouští kaskádu událostí, které finálně vedou ke svalové kontrakci uvnitř stěny tepny nebo k strukturálním změnám se ztluštěním stěny arterie [3].
Existují dvě varianty VS – grafické a klinické. Grafické VS jsou viditelná zúžení (většinou fokální, ale mohou být i difuzní) mozkových cév znázorněná na DSA [13]. Obvykle se objevují třetí den po ruptuře aneuryzmatu s vrcholem mezi šestým až osmým dnem a trvají celkem dva až tři týdny [14]. Přítomnost VS také můžeme potvrdit pomocí TCD v případě naměřené střední rychlosti na střední mozkové tepně větší než 120 cm/ s [15]. Některé vyšší rychlosti toku krve zaznamenané pomocí TCD nemusí ukazovat na přítomnost VS, ale jen na hyperemii dané oblasti mozku. Z toho důvodu bylo do praxe zavedeno počítání Lindergaardova indexu. Poměr středních rychlostí toku krve v ACM a ACI vyšší než tři naznačuje přítomnost středně těžkých VS. V případě, že je poměr vyšší než šest, jedná se o těžké VS [16].
Ačkoliv jsou angiografické VS zachyceny u 70 % pacientů po SAK, pouze u 30 % z nich jsou klinické neboli symptomatické a dochází ke vzniku DID [3]. Tento stav je definován náhle vzniklou progresí v kvantitativní i kvalitativní složce vědomí následované poruchou hybnosti končetin a/ nebo poruchou řeči [13,17]. DID nezahrnuje jen symptomatickou deterioraci neurologického stavu, ale i radiologický důkaz probíhající či proběhlé ischemické cévní mozkové příhody (iCMP) na podkladě VS. Tento důkaz je optimálně stanoven s využitím perfuzního CT (PCT). Díky tomu jsme schopni zabránit progresi penumbry do hotové ischemie a zavčas indikovat modifikaci léčby VS. Často je vznik klinických VS předznamenán zhoršující se bolestí hlavy a stoupajícími hodnotami systémového krevního tlaku [13]. Diagnóza je nejčastěji stanovena vyloučením jiných příčin této změny neurologického stavu v podobě hydrocefalu, opětovné ruptury aneuryzmatu, hypoxie nebo metabolických dysbalancí [13,17]. Bez adekvátní léčby 30 % pacientů s DID umírá a dalších 34 % má trvalý deficit [18].
Existují prediktivní faktory rozvoje VS u pacientů se subarachnoidálním krvácením způsobeným rupturou aneuryzmatu. Symptomatické VS vznikají častěji u pacientů v špatném vstupním klinickém stavu, s hypertenzí při přijetí a přítomností silné vrstvy krve v bazálních cisternách. Angiografické VS vznikají častěji u pacientů ve špatném vstupním klinickém stavu, mladšího věku, s anamnézou kouření a přítomností intracerebrálního hematomu [19].
K detekci grafických vazospazmů bývají využívány již zmíněné TCD a DSA. V diagnostice klinických vazospazmů, tedy k odhalení mozkové hypoperfuze, přicházejí na řadu jiné modality, jako EEG, měření CBF a PtiO2 a mikrodialýza. Jejich výsledky jsou přínosné, zejména v období, kdy pacient není klinicky zhodnotitelný, nicméně jejich hlavním limitem je sledování jen určité oblasti mozku dle místa zavedení snímacích prvků. Rovněž významně vyšší finanční náročnost těchto technologií je nezanedbatelná.
V rámci prevence vzniku či terapie vazospazmů je prvořadé vyřazení prasklého aneuryzmatu z cirkulace pomocí klipingu či koilingu, což umožňuje agresivnější a časnější postup vůči VS [20].
Již standardní zavedený způsob terapie pacientů se SAK způsobeným rupturou aneuryzmatu je podávání blokátorů kalciového kanálu, nejčastěji se jedná o nimodipin. Nimodipin nezabrání vzniku VS ani nezvrátí již rozvinuté vazospazmy, v tom jeho efekt není signifikantní. Působí spíše zesílení piální kolaterální cirkulace, snížení rezistence menších cév a jako neuroprotekce cestou redukce vápníkovými kationty zprostředkované excitotoxicity [21]. Bylo prokázáno, že pokud jsou VS léčeny podáváním intravenózního nimodipinu a 3H terapií, dochází až ke dvoutřetinové redukci špatných prognostických stavů ve srovnání s přirozeným průběhem choroby [3]. V dnešní době byla modifikována 3H terapie na udržování euvolemie a hypertenze z důvodu zjištěných vyšších nežádoucích účinků než benefitu ze strany hypervolemie a hemodiluce [22].
V roce 2006 bylo prokázáno, že užívání statinů po vzniku SAK vede ke zmírnění VS, nejspíše na podkladě protizánětlivých účinků [23]. V současné době se doporučuje pouze pokračovat v terapii statiny, pokud je pacient užíval již premorbidně [22].
Jinou možnou léčebnou modalitou je podávání magnezium sulfátu k dosažení a/ nebo udržení adekvátní hladiny kationtů hořčíku v séru. Hypomagnezemie je relativně častá u pacientů po SAK a bývá spojena s častějším výskytem VS a i horší prognózou [24]. Aktuálně platí, že je vhodné zabránit vzniku jak hypo‑, tak i hypermagnezemie [22].
V případě, že dojde ke vzniku DID, je za účelem přímého ovlivnění VS indikováno provedení mechanické a/ nebo farmakologické perkutánní transluminální angioplastiky (PTA) [22]. Primárně je ovšem nutný nález pouhé penumbry, nikoliv ischemie na PCT. Jen tak se po úspěšné angioplastice zamezí průniku krve do ischemické mozkové tkáně. Mechanická PTA je vhodná na krátké lokalizované vazospastické úseky a její účinek má dlouhodobější trvání. Farmakologická PTA se užívá v případě difuzních VS či při jejich lokalizaci v distálních větvích tepen Willisova okruhu. Nicméně její účinek bývá krátkodobý [25 – 28]. Rozhodně není doporučována profylaktická angioplastika angiografických VS při nepřítomnosti odpovídající klinické deteriorace [22].
Závěr
Vazospazmy jsou považovány za hlavní příčinu vysoké morbidity a mortality pacientů se subarachnoidálním krvácením způsobeným rupturou aneuryzmatu. Je nutné o pacienty s probíhajícími VS intenzivně bojovat a velmi aktivně do léčebného plánu prosazovat procedury, které by měly pomoci při odvrácení VS a jejich následků. Pokud nejsou VS včas odhaleny nebo je jejich terapie nedostatečná, dochází k významnému zhoršení prognózy postižených pacientů.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Lubomír Jurák
Neurochirurgické oddělení
Krajská nemocnice Liberec, a.s.
Husova 10
460 63 Liberec
e-mail: lubomir.jurak@nemlib.cz
Přijato k recenzi: 31. 3. 2014
Přijato do tisku: 27. 5. 2014
Zdroje
1. Wardlaw JM, White PM. The detection and management of unruptured intracranial aneurysms. Brain 2000; 123(2): 205 – 221.
2. Kreiter KT, Copeland D, Bernardini GL, Bates JE, Peery S, Claassen J et al. Predictors of cognitive dysfunction after subarachnoid hemorrhage. Stroke 2002; 33(1): 200 – 208.
3. Dorsch NW. Cerebral arterial spasm – a clinical review. Br J Neurosurg 1995; 9(3): 403 – 412.
4. Adamkov J, Náhlovský J, Habalová J, Krajina A, Řehák S, Kanta M et al. Cerebrální vazospasmy po subarachnoidálním krvácení – možnosti diagnostiky, monitorace a léčby. Cesk Slov Neurol N 2014; 77/ 110(2): 158 – 167.
5. Beneš V, Netuka D, Kramář F, Charvát F. Současný stav péče o intrakraniální aneuryzmata. Cesk Slov Neurol N 2006; 69/ 102(3): 160 – 174.
6. Krajina A, Lojík M, Česák T, Krajíčková D, Žižka J, Zeleňák K et al. Endovaskularni lečba intrakranialnich aneuryzmat – metodika, indikace, komplikace. Cesk Slov Neurol N 2012; 75/ 108(5): 552 – 560.
7. Ďuriš K, Neuman E, Mrlian A, Vybíhal V, Juráň V,Kýr M et al. Vztah mezi parametry transkraniální dopplerometrie a tkáňovou oxymetrií u pacientů s těžkým subarachnoidálním krvácením. Cesk Slov Neurol N 2014; 77/ 110(2): 196 – 201.
8. Hejčl A, Bolcha M, Procházka J, Sameš M. Multimodální monitorování mozku u pacientů s těžkým kraniocerebrálním traumatem a subarachnoidálním krvácením v neurointenzivní péči. Cesk Slov Neurol N 2009; 72/ 105(4): 383 – 387.
9. Smrčka M, Ďuriš K, Juráň V, Neuman E, Kyr M. Peroperační monitoring tkáňové oxymetrie a perooperační užití hypotermie v chirurgii mozkových aneuryzmat. Cesk Slov Neurol N 2009; 72/ 150(2): 245 – 249.
10. Smrčka M, Neuman E, Ďuriš K, Svoboda T, Duba M.Monitoring ptiO2 a změny frakce kyslíku ve vydechované směsi u pacientů po těžkém subarachnoidálním krvácení. Cesk Slov Neurol N 2010; 73/ 106(6): 694 – 700.
11. Habalová J, Kanta M, Ehler E, Náhlovský J, Bartoš M.Využití regionální mozkové oxymetrie jako neinvazivní metody ke sledování pacientů v neurointenzivní péči. Cesk Slov Neurol N 2010; 73/ 106(3): 285 – 293.
12. Hejčl A, Sameš M. Mikrodialýza v neurochirurgii. Cesk Slov Neurol N 2009; 72/ 105(6): 511 – 517.
13. Kassell NF, Sasaki T, Colohan AR, Nazar G. Cerebral vasospasm following aneurysmal subarachnoid hemorrhage. Stroke 1985; 16(4): 562 – 572.
14. Wilkins RH. Cerebral vasospasm. Crit Rev Neurobiol 1990; 6(1): 51 – 77.
15. Vora YY, Suarez ‑ Almazor M, Steinke DE, Martin ML, Findlay JM. Role of transcranial Doppler monitoring in the diagnosis of cerebral vasospasm after subarachnoid hemorrhage. Neurosurgery 1999; 44(6): 1237 – 1247.
16. Lindegaard KF, Bakke SJ, Sorteberg W, Nakstad P,Nornes H. A non‑invasive Doppler ultrasound method for the evaluation of patients with subarachnoid hemorrhage. Acta Radiol 1986; Suppl (369): 96 – 98.
17. Kolias AG, Sen J, Belli A. Pathogenesis of cerebral vasospasm following aneurysmal subarachnoid hemorrhage: putative mechanisms and novel approaches. J Neurosci Res 2009; 87(1): 1 – 11. doi: 10.1002/ jnr.21823.
18. Dorsch NW. Therapeutic approaches to vasospasm in subarachnoid hemorrhage. Curr Opin Crit Care 2002; 8(2): 128 – 133.
19. Frontera JA, Fernandez A, Schmidt JM, Claassen J, Wartenberg KE, Badjatia N et al. Defining vasospasm after subarachnoid hemorrhage: what is the most clinically relevant definition? Stroke 2009; 40(6): 1963 – 1968. doi: 10.1161/ STROKEAHA.108.544700.
20. Solomon RA, Fink ME, Lennihan L. Early aneurysm surgery and prophylactic hypervolemic hypertensive therapy for the treatment of aneurysmal subarachnoid hemorrhage. Neurosurgery 1988; 23(6): 699 – 704.
21. Dorhout Mees SM, Rinkel GJ, Feigin VL, Algra A,van den Bergh WM, Vermeulen M et al. Calcium antagonists for aneurysmal subarachnoid hemorrhage. Cochrane Database Syst Rev 2007; 3: CD000277.
22. Diringer MN, Bleck TP, Claude Hemphill J 3rd, Menon D, Shutter L, Vespa P et al. Critical care management of patients following aneurysmal subarachnoid hemorrhage: recommendations from the Neurocritical Care Society‘s Multidisciplinary Consensus Conference. Neurocrit Care 2011; 15(2): 211 – 240. doi: 10.1007/ s12028 ‑ 011 ‑ 9605 ‑ 9.
23. McGirt MJ, Pradilla G, Legnani FG, Thai QA, Recinos PF, Tamargo RJ et al. Systemic administration of simvastatin after the onset of experimental subarachnoid hemorrhage attenuates cerebral vasospasm. Neurosurgery 2006; 58 : 945 – 951.
24. van den Bergh WM, Algra A, van Kooten F, Dirven CM, van Gijn J, Vermeulen M et al. Magnesium sulfate in aneurysmal subarachnoid hemorrhage: a randomized controlled trial. Stroke 2005; 36(5): 1011 – 1015.
25. American Society of Interventional and Therapeutic Neuroradiology. Mechanical and pharmacologic treatment of vasospasm. AJNR Am J Neuroradiol 2001; 22 (Suppl 8): S26 – S27.
26. Elliott JP, Newell DW, Lam DJ, Eskridge JM, Douville CM, Le Roux PD et al. Comparison of balloon angioplasty and papaverine infusion for the treatment of vasospasm following aneurysmal subarachnoid hemorrhage. J Neurosurg 1998; 88(2): 277 – 284.
27. Eskridge JM, Song JK. A practical approach to the treatment of vasospasm. AJNR Am J Neuroradiol 1997; 18(9): 1653 – 1660.
28. Schuknecht B, Fandino J, Yuksel C, Yonekawa Y, Valavanis A. Endovascular treatment of cerebral vasospasm: assessment of treatment effect by cerebral angiography and transcranial colour Doppler sonography. Neuroradiology 1999; 41(6): 453 – 462.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2014 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Leukodystrofie – klinické a rádiologické aspekty
- Bariéry nervového systému za fyziologických a patologických stavů
- Experimentální a klinické aplikace mezenchymálních kmenových buněk u míšního poranění
- Volumetrické hodnocení resekability gliomů inzuly
- Validita Testu 16 slov pro diferenciální diagnostiku demence Alzheimerova typu a behaviorální formy frontotemporální demence
- Asymetrie trojklaného nervu u klasické neuralgie trigeminu – zhodnocení pomocí magnetické rezonance
- Komentář ke článku autorů Urgosik et al Trigeminal Nerve Asymmetry in Classic Trigeminal Neuralgia – Evaluation by Magnetic Resonance Imaging
- Česká tréninková verze Montrealského kognitivního testu (MoCA‑ CZ1) k časné detekci Alzheimerovy nemoci
-
Komentár ke článku autorů Bartoš et al. Česká tréninková verze Montrealského kognitivního testu (MoCA-CZ1) k časné detekci Alzheimerovy nemoci
Skríning kognitívnych porúch v klinickej praxi - Standardizace české verze testu Londýnské věže – administrace, skórování, validita
- Repetitivní transkraniální magnetická stimulace v léčbě depresivní poruchy – randomizovaná, jednoduše slepá, antidepresivy kontrolovaná studie
- Výsledky operační léčby adenomů hypofýzy na Neurochirurgické klinice FN Olomouc
- Komentář k článku autorů Krahulík et al Výsledky operační léčby adenomů hypofýzy na Neurochirurgické klinice FN Olomouc
- Endoskopická endonazální technika v léčbě kraniofaryngeomů
- Neuroborrelióza imitující mozkový nádor u dětí a vice versa
- Anti‑N‑ metyl‑ D‑ aspartát receptorová encefalitida
- Projekt ncRNAPain
- Chirurgická léčba supratentoriálních kortiko‑ subkortikálních kavernomů
- Neutralizační protilátky a Myxovirus resistance protein A při sledování biologické účinnosti interferonu β
- Vazospazmy jako komplikace subarachnoidálního krvácení – kazuistika
- Polyurie v neurointenzivní péči – kazuistika
- Webové okénko
-
Analýza dat v neurologii
XLVII. Modelové příklady spojování výsledků vzájemně nezávislých asociačních studií - Časná a individualizovaná terapie se zapojením pacienta do terapeutického procesu byly hlavními tématy letošního mezinárodního setkání odborníků v oblasti roztroušené sklerózy
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Česká tréninková verze Montrealského kognitivního testu (MoCA‑ CZ1) k časné detekci Alzheimerovy nemoci
- Leukodystrofie – klinické a rádiologické aspekty
- Bariéry nervového systému za fyziologických a patologických stavů
- Chirurgická léčba supratentoriálních kortiko‑ subkortikálních kavernomů
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



