-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Ovlivnění výsledku traktografie pyramidové dráhy volbou oblasti zájmu trasování – kazuistika
The Effect of the Region of Interest Choice on the Results of Pyramidal Tract Representation by Diffusion Tensor Imaging – a Case Report
In our short report, we show the relative nature of pyramidal tract representation using Diffusion Tensor Imaging in a patient with a precentral gyrus glioma and we discuss the factors that may affect tract reconstruction. We believe that, so far, inadequate attention has been paid in the published literature to the region of interest selection even though this is the key determinant of the imaging outcome.
Key words:
glioma – navigation – tractography – electric cortical stimulation
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: R. Bartoš 1,2; A. Malucelli 1,2; P. Bartoš 2; D. Adámek 3; J. Zárubová 4; M. Sameš 1
Působiště autorů: Neurochirurgická klinika UJEP a Krajská zdravotní a. s., Masarykova nemocnice v Ústí nad Labem, o. z. 1; ICRC – Mezinárodní centrum klinického výzkumu, FN u sv. Anny v Brně 2; Radiodiagnostické oddělení, Krajská zdravotní a. s., Masarykova nemocnice v Ústí nad Labem, o. z. 3; Neurologická klinika 2. LF UK a FN v Motole, Praha 4
Vyšlo v časopise: Cesk Slov Neurol N 2015; 78/111(3): 354-358
Kategorie: Kazuistika
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amcsnn2015354Souhrn
V krátkém sdělení dokumentujeme u pacienta s gliomem postihujícím precentrální gyrus relativitu výsledku zobrazení pyramidové dráhy pomocí DW traktografie a diskutujeme o faktorech, které mohou ovlivnit zobrazení dráhy. Dle našeho názoru se v dostupné literatuře nevěnuje dostatečná pozornost volbě oblasti zájmu trasování, přičemž právě ta je klíčovým determinantem výsledku.
Klíčová slova:
gliom – navigace – traktografie – elektrická kortikální stimulaceÚvod
Zobrazení tenzoru difuze (Diffusion Tensor Imaging; DTI) je moderní zobrazovací metoda, která umožňuje trasování drah neboli traktografii. Zobrazení drah se rutinně používá na všech neurochirurgických pracovištích v našem prostředí.
Na příkladu mladého pacienta s nízkostupňovým gliomem uloženým přímo v precentrálním gyru však dokumentujeme výraznou relativitu zobrazení pyramidové dráhy danou změnou volby oblastí zájmu (ROI) během trasování. Nepřesné zobrazení pyramidové dráhy by mohlo nepříznivě ovlivnit klinický výsledek operace. Domníváme se, že tento fakt může způsobit určitou renezanci využití předoperační motorické funkční magnetické rezonance (fMR) právě pro optimalizaci trasování mozkových drah.
Kazuistika
Pacient (44 let) byl od roku 2009 sledován pro suspektní nízkostupňový gliom (LGG) vlevo parietálně, prvním příznakem byl epileptický záchvat. Dle obdržené dokumentace byl nádor vstupně zhruba 30 mm v průměru a během sledování nedocházelo k jeho růstu. Na naše pracoviště se dostavil v roce 2014 pro zvyšující se frekvenci fokálních senzomotorických epileptických záchvatů, které přicházely zhruba dvakrát denně, byly vyprovokovány např. vibracemi, mírným nárazem hlavy o opěrku či houpavým pohybem v dopravních prostředcích, prudším pohybem či zátěží pravé ruky. Pacient pracoval jako masér. Docházelo k extenzi a lehké abdukci pravé horní končetiny (PHK) a současně k difuzní intenzivní bolesti od ramene distálně, mimovolním pohybům prstů, někdy cítil bolest v celé pravé polovině těla včetně hlavy. Během záchvatů normálně vnímal okolí, ale pro bolest nemohl mluvit, pouze sténal, záchvat trvával 30 s až 5 min. Po skončení záchvatů měl sníženou citlivost PHK difuzně od ramene distálně, oslabení PHK, ojediněle docházelo k oslabení pravé dolní končetiny (PDK), což trvalo asi 30 s až 1 min. Záchvaty byly refrakterní na léčbu levetiracetamem (Keppra) v dávce 2 × 1 500 mg, v březnu 2014 byly záchvaty na jiném pracovišti vyhodnoceny jako neepileptické a Keppra byla vysazována, došlo k uvedenému zvyšování se frekvence záchvatů. Epileptologem (J. Z.) byl nasazen eslicarbazepin (Zebinix) v dávce 1 200 mg/ den, poté došlo k částečnému zlepšení stavu.
Ve srovnání s MR provedenou roku 2012 s aktuální došlo k nárůstu velikosti nádoru na 36 mm v max. průměru (obr. 1a).
Po pohovoru s pacientem jsme indikovali resekci nádoru. Ta byla provedena v květnu 2014, s využitím vědomé fáze operace (awake) a při použití kortikální stimulace (ECS) Ojemannovým stimulátorem (4 mA). Během operace jsme zjistili, že nádor vychází přímo z precentrálního gyru, odděluje primární motorickou kůru pro horní a dolní končetinu a zasahuje až k postcentrálnímu gyru, během jehož stimulace pacient popisoval senzorické vjemy (obr. 1b). Nádor jsme za monitorace neurologického stavu pacienta a při opakované kortiko ‑ subkortikální stimulaci odstranili (obr. 1c,d).
Obr. 1. Nízkostupňový gliom v centrální krajině – MR obraz a pooperační situace. 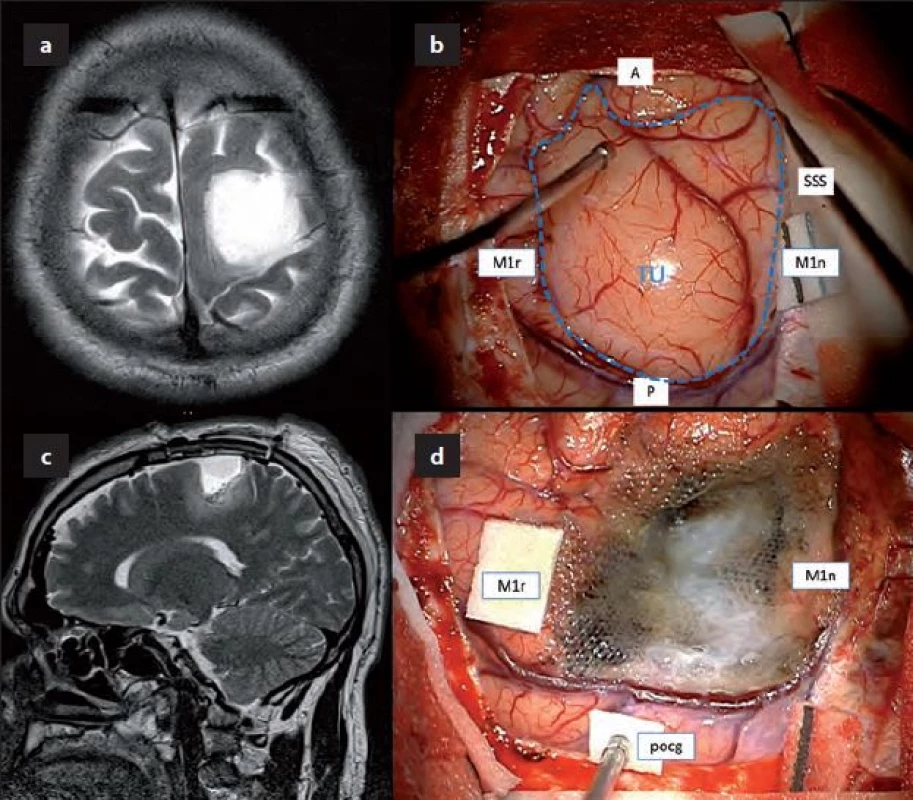
Obr. 1a) T2W zobrazení LGG P sin, na předoperačním vyšetření není „Ω sign“ diferencovatelný. Obr. 1b) Intraoperační fotografie zobrazující expanzi obtížně odlišitelnou od normálního kortexu. Obr. 1c) Časná pooperační MRT2W zobrazující postresekční dutinu. Obr. 1d) Fotografi e po resekci nádoru; je patrné, že nádor prakticky rozděloval precentrální gyrus a dosahoval k postcentrálnímu gyru (pocg). TU – nádor (kortikální propagace dle navigace znázorněna přerušovanou modrou linií), A – anterior, P – posterior, SSS – sinus saggitalis superior, M1r – primární motorická oblast horní končetinu dle ECS, M1n – primární motorická kůra pro dolní končetinu dle ECS. Po operaci pacient zůstává na antiepileptické medikaci v monoterapii eslicarbazepinem (Zebinix 800 1/2 – 0 – 1). Výsledkem histologického vyšetření byl smíšený oligoastrocytom grade II, IDH1+, bez kodelece 1p/ 19q, Ki ‑ 67 do 5 %, další onkologická léčba nebyla indikována. Došlo k vymizení epileptických záchvatů, nezhoršila se hybnost PHK a pacient pokračuje v práci maséra.
Traktografie pyramidové dráhy před operací
Před operací jsme provedli MR vyšetření na 1,5T scanneru (Siemens Avanto) v DTI sekvenci s následujícími parametry: 20 směrů měření difuze, b = 1 000 s/ mm2; matice 138 × 192; FOV 276 × 384 mm; a TR/ TE 8 000/ 94 ms, trasování bylo prováděno programem StealthWiz (Medtronic, Mineaopolis, Minnesota), FA 0,1 – 0,2, < 60°, ROI jsme standardně umístili do oblasti pedunklu mezencefala (end mask) tak, aby byl lokalizován pouze v oblasti motorických vláken mimo lemniscus medialis [1]; genu a zadního raménka vnitřní capsuly (waypoint mask); problémem bylo však určení ROI kortikálně a subkortikálně (seed mask), jelikož precentrální gyrus nebylo z anatomického zobrazení možné precizně lokalizovat. Rozhodli jsme se jej definovat symetricky do bezprostřední oblasti nádoru, včetně nádoru, tedy ze 3D objemu. Trasování probíhalo kraniokaudálním směrem (obr. 2b). Výsledek trasování jsme fúzovali s T2W anatomickým zobrazením nádoru. Výsledné zobrazení předpokládané lokalizace motorické dráhy zobrazuje široký svazek s výraznou kortikální disperzí po celém posteromediálním obvodu nádoru, malá část vláken zasahuje i anterolaterálně (obr. 2a,c). Výsledný objem dráhy činil 17,9 cm3. Nepomohlo ani trasování ze dvou jasně definovaných ROI pyramidové dráhy (pedunkl mezencefala a zadní raménko vnitřní capsuly), bez použití kortikálního ROI, takto trasovaná pyramidová dráha měla ještě více nespecifickou distribuci a podstatně větší objem 33,5cm3 (obr. 2d). Nejednoznačnost DTI vyšetření byla jedním z důvodů, proč jsme se rozhodli pacienta operovat „awake“.
Obr. 2. Traktografie pyramidové dráhy před operací. 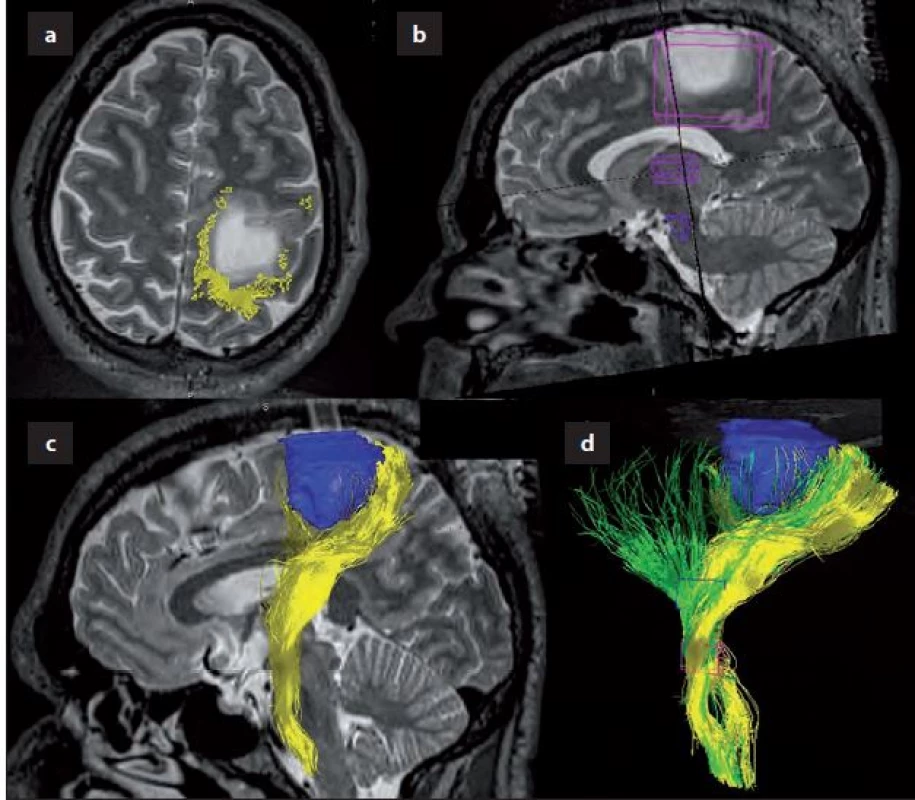
Obr. 2a) Fúze předoperační traktografie, zobrazující širokou posteromediální, laterální a částečně i anterolaterální distribuci zakončení pyramidové dráhy (žlutě). Obr. 2b) ROIs of interest během trasování. Obr. 2c) 3D zobrazení dráhy ve vztahu k nádoru (modrý). Obr. 2d) Srovnání široké projekce pyramidové dráhy (zeleně) při trasování pouze ze 2 ROI (capsula interna a pedunkl mesencefala). Traktografie pyramidové dráhy po operaci
Za tři měsíce po operaci jsme při první pravidelné MR kontrole z výzkumných důvodů provedli taktéž akvizici dat pro traktografii a fMR pro repetitivní stisk pravé horní končetiny (p < 0,05 s FWE korekcí) (obr. 3a,b). Na anatomickém zobrazení T1 a T2 byl překvapením takřka úplný zánik postresekční dutiny a znovuobjevení „Ω znaku“ primární motorické oblasti pro PHK, což naše možnosti trasování významně zlepšilo (obr. 3a). Při trasování pyramidové dráhy jsme umístili 3D kortiko ‑ subkortikální ROI přímo na anatomicky určený precentrální gyrus s ohledem na funkční topografii, umístění seed masek pro ruku a dolní končetinu jsme dle našeho dojmu zpřesnili peroperačními výsledky ECS; oblast pro ruku byla během operace nalezena laterálně od zbytku dutiny, resp. od centra postresekčních změn a oblast pro dolní končetinu byla mediálně od okraje resekce (obr. 1b,d a 3b,d). Umístění seed masky pro ruku jsme ještě zpřesnili korelací s výsledkem fMR (obr. 3a). Získali jsme relativně úzký a jasně definovaný svazek odděleně pro část motorické dráhy z primární motorické kůry pro PHK o objemu 7,4 cm3 (zeleně) a PDK o objemu 3,8 cm3 (červeně) (obr. 3b – d).
Obr. 3. Traktografie pyramidové dráhy po operaci (M1). 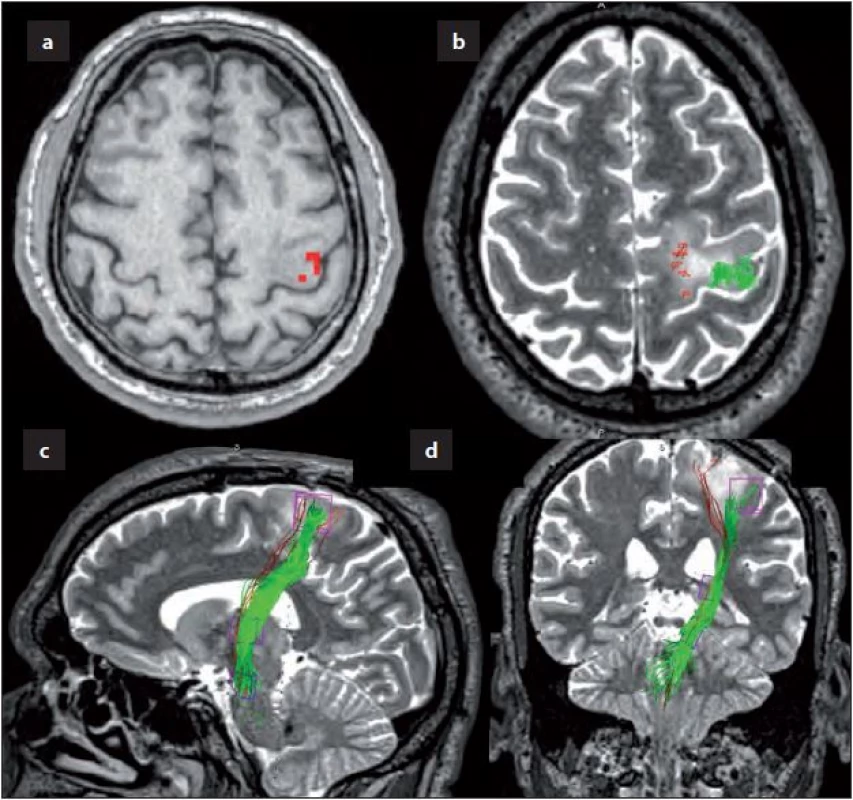
Obr. 3a) Fúze T1W MRI s BOLD aktivovanými voxely během vyšetření fMR, po exstirpaci nádoru došlo k znovuobnovení normální anatomické situace a je dobře patrný „Ω sign“, vyšetření provedeno tři měsíce po operaci. Obr. 3b) Výsledek kortikální distribuce selektivního trasování pyramidové dráhy při použití ROI z kortiko-subkortikortikální oblasti (aproximováno dle ECS) pro horní končetinu (zeleně) a dolní (červeně) ve fúzi s T2W anatomickým zobrazením, taktéž tři měsíce po operaci. Obr. 3c) Výsledek trasování pyramidové dráhy stejnou metodikou na saggitálním skenu. Obr. 3d) Výsledek trasování pyramidové dráhy stejnou metodikou na koronárním skenu. Diskuze
Traktografie (DTI) je široce užívaná metoda umožňující neurochirurgovi předpokládat lokalizaci jednotlivých drah, nejčastějšího užití se dostává trasování motorické dráhy. U pacienta popisovaného v naší kazuistice se bohužel před operací nebylo možno zachytit jakéhokoli anatomického znaku, tedy seed masku jsme museli umístit kortikálně do okolí celého nádoru, včetně něj. Následně jsme se snažili zpřesnit širokou distribuci dráhy metodou subkortikálního trasování z pedunklu mezencefala do zadního raménka vnitřní capsuly, což výsledek bohužel nezlepšilo. V následujících řádcích se pokusíme, alespoň částečně, tento náš „neúspěch“ rozvést.
V klinické praxi se nejčastěji provádí trasování na deterministickém principu (Fiber Assignement by Continuous Tracking; FACT), který je však zatížen celou řadou možných nepřesností: je to jednak volba limitů frakční anizotropie (FA), jednak volba prahu změny angulace vektoru a volbou ROI, která může být výrazně znesnadněna nepřehledností anatomické situace u kortikálně a subkortikálně uložených nádorů. V tab. 1 se zaměřujeme na rešerši techniky trasování pyramidové dráhy některých významných prací s ohledem na volbu ROI.
Tab. 1. Parametry trasování pyramidové dráhy v literatuře. 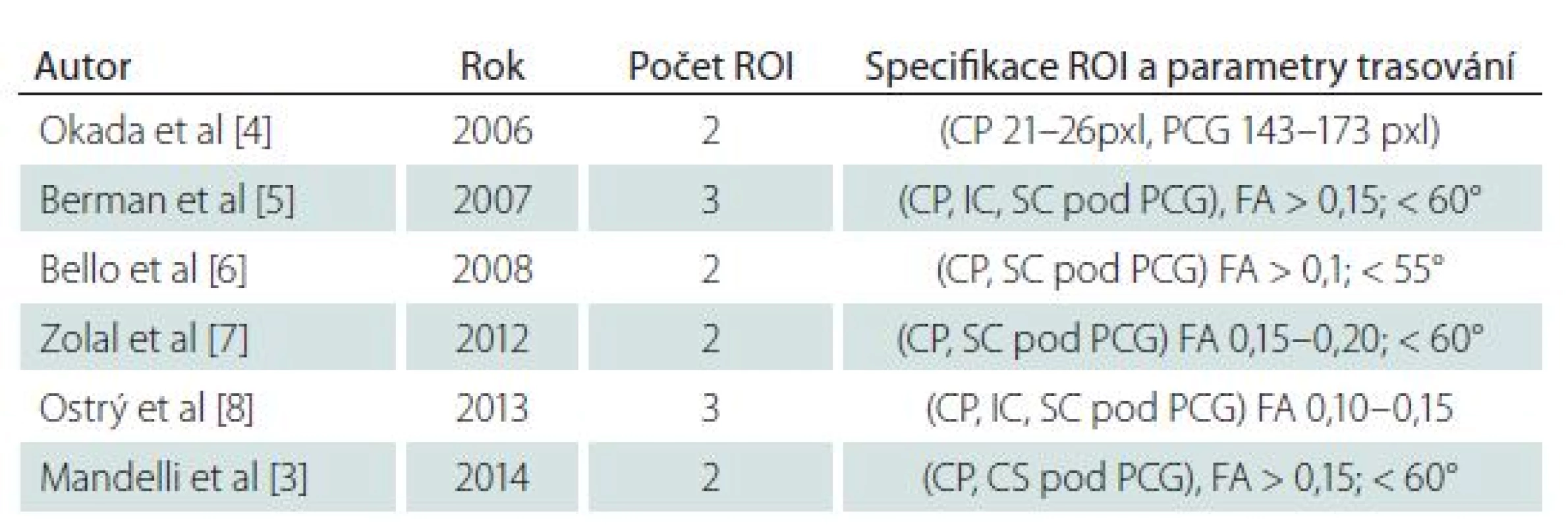
CP – pedunkl mesencefala, IC – vnitřní capsula, SC pod PCG – subkortikální oblast pod precentrálním gyrem, FA – frakční anisotropie, ROI – Region Of Interest. Výsledný tenzor může být také nejednoznačný v oblastech mnohočetných a křížících se svazků. Během plánování operace je zájmem neurochirurga trasovat část pyramidové dráhy vycházející z primární motorické kůry (M1).Při trasování však může zřejmě docházet k její „kontaminaci“ porcemi vycházejícími z primárního somatosenzorického kortexu (S1), dorzálního premotorického kortexu (dPMC) a suplementární motorické oblasti (SMA).
Seo et al u 36 zdravých dobrovolníků objemově kvantifikovali tyto jednotlivé složky pyramidové dráhy a zjistili signifikantní rozdíly v jejich objemu: M1 2 373,6 mm3; 37,3 %; S1 2 037,7 mm3; 32,0 %; SMA 1 307,2 mm3; 20,5 % a dPMC 647,0 mm3; 10,2 %. Jednotlivé složky pyramidové dráhy se navíc lišily FA (dPMC, SMA > M1, S1). Objem SMA byl předpokládatelně vyšší v levé hemisféře, ale autoři zjistili také signifikantní rozdíl ve FA u M1 a S1 mezi oběma hemisférami [2]. U našeho pacienta zobrazuje tyto složky pyramidové dráhy z parietálního kortexu pooperační traktografie (obr. 4a,b), ROI byly voleny dle anatomie kortexu a metodiky výše uvedeného článku [2]. Pozorujeme tedy opět rozsáhlejší distribuci složky M1 ve srovnání s obr. 3, kde byly ROI definovány pouze dle odhadu míst pozitivní elektrické kortikální stimulace.
Obr. 4. Složky pyramidové dráhy. 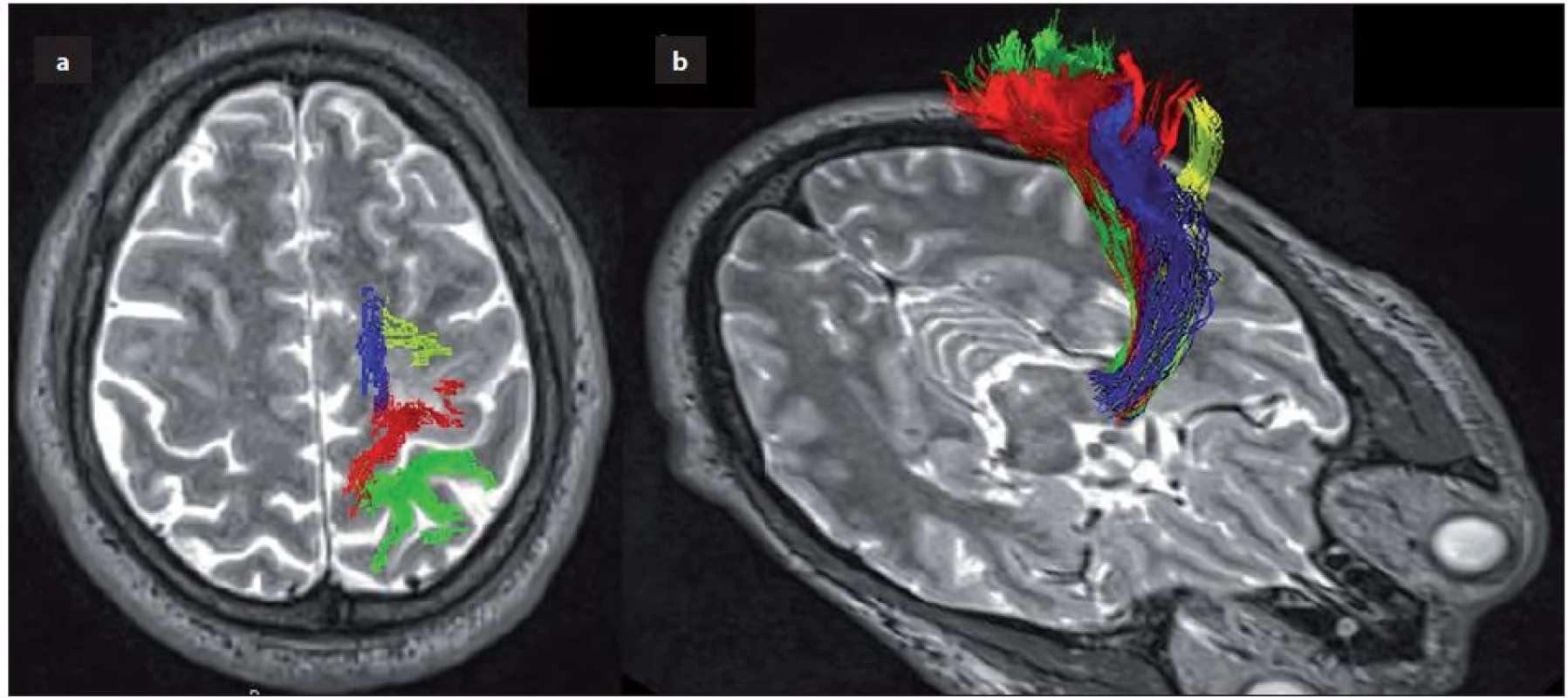
Obr. 4a) Kortikální distribuce DTI fronto-parietálních složek pyramidové dráhy (modře – SMA, žlutě – dPMC, červeně – M1, zeleně – S1). Obr. 4b) 3D průběh dráhy. Ve výzkumné fázi jsou pokročilejší způsoby trasování mimo klasické deterministické metody. Probabilistická metoda trasování, například bootstrap technikou, pracuje s vyšší přesností hodnotící i oblasti s nižšími hodnotami FA. Obě metodiky trasování v recentním článku srovnávali Mandelli et al zajímavou metodikou. Během operací mozkových nádorů u 21 pacientů validovali 35 kortikálních a 16 subkortikálních míst s motorickou odpovědí, místa pozitivní kortikální stimulace zpětně transponovali jako výchozí ROI pro trasování pyramidové dráhy oběma metodikami. Probabilistické trasování vytvořilo zobrazení dráhy signifikantně blíže ke subkortikálně stimulovaným oblastem (střední vzdálenost 6,5 ± 2,9 mm) oproti klasickému deterministickému trasování (střední vzdálenost 7,2 ± 3,7 mm). Výhodou probabilistické metody je tedy nižší riziko možného podcenění objemu dráhy.
Ve srovnání s dalšími pokročilými metodami trasování (Q ‑ Ball, sférická dekonvoluce) dochází však i u bootstrap techniky k ablaci laterální části motorické dráhy [3].
Závěr
K výsledku traktografického zobrazení dané – v tomto případě motorické – dráhy je nutno stejně jako ke kortikální lokalizaci mozkové funkce pomocí fMR přistupovat s určitou obezřetností a snažit se metodiku trasování co nejvíce optimalizovat. Zobrazení dráhy závisí mimo jiné na volbě ROI předpokládaného průběhu dráhy. Pokud je přítomna distorze anatomického obrazu expanzivním či infiltrativním chováním nádoru respektive kolaterálním edémem, je výsledek traktografie možno optimalizovat volbou kortiko ‑ subkortikálního ROI určeného pomocí M1 BOLD „enhancementu“ na fMR. Další možností by bylo trasování provést během operace až po určení primárního motorického kortexu pomocí elektrické stimulace.
Supported by European Regional Development Fund – Project FNUSA ‑ ICRC (No. CZ.1.05/ 1.1.00/ 02.0123).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 2. 1. 2015
Přijato do tisku: 2. 4. 2015
MUDr. Robert Bartoš, Ph.D.
Neurochirurgická klinika
Masarykova nemocnice
Sociální péče 3316/12A
401 13 Ústí nad Labem
e-mail: robert.bartos@kzcr.eu
Zdroje
Literatura
1. Kamada K, Sawamura Y, Takeuchi F, Kawaguchi H, Kuriki S, Todo T et al. Functional identification of the primary motor area by corticospinal tractography. Neurosurgery 2005; 56 (Suppl 1): 98 – 109.
2. Seo JP, Jang SH. Different characteristics of the corticospinal tract according to the cerebral origin: DTI Study. Am J Neuroradiol 2013; 34(7): 1359 – 1363.
3. Mandelli ML, Berger MS, Bucci M, Berman JI, Amirbekian B, Henry RG. Quantifying accuracy and precision of diffusion MR tractography of the corticospinal tract in brain tumors. J Neurosurg 2014; 121(2): 349 – 358. doi: 10.3171/ 2014.4.JNS131160.
4. Okada T, Mikuni N, Miki Y, Kikuta K, Urayama S, Hanakawa T et al. Corticospinal tract localization: integration of diffusion ‑ tensor tractography at 3 – T MR imaging with intraoperative white matter stimulation mapping – preliminary results. Radiology 2006; 240(3): 849 – 857.
5. Berman JI, Berger MS, Chung S, Nagarajan SS, Henry RG.Accuracy of diffusion tensor magnetic resonance imaging tractography assessed using intraoperative subcortical stimulation mapping and magnetic source imaging. J Neurosurg 2007; 107 : 488 – 494.
6. Bello L, Gambini A, Castellano A, Carrabba G, Acerbi F. Motor and language DTI Fiber Tracking combined with intraoperative subcortical mapping for surgical removal of gliomas. NeuroImage 2008; 39(1): 369 – 382.
7. Zolal A, Hejčl, Vachata P, Bartoš R, Humhej I, Malucelli Aet al. The use of diffusion tensor images of the corticospinal tract in intrinsic brain tumor surgery; a comparison with direct subcortical stimulation. Neurosurgery 2012; 71(2): 331 – 340. doi: 10.1227/ NEU.0b013e31825b1c18.
8. Ostrý S, Belšan T, Otáhal J, Beneš V, Netuka D. Is intraoperative diffusion tensor imaging at 3.0T comparable to subcortical corticospinal tract mapping? Neurosurgery 2013; 73(5): 797 – 807. doi: 10.1227/ NEU.0000000000000087.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článek Využití škály QUALID k hodnocení kvality života u pacientů v pozdní fázi demence v České republiceČlánek Projekt ncRNAPainČlánek Výskyt periferního primitivního neuroektodermálního nádoru v průběhu spinálního kořene – kazuistikaČlánek ErratumČlánek Webové okénkoČlánek Analýza dat v neurologii
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2015 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- CIDP: epidemiológia, klinický obraz a diagnostika v kocke
-
Všetky články tohto čísla
- Diagnostika epileptických záchvatů
- Míšní šok – od patofyziologie ke klinickým projevům
- Biomarkery roztroušené sklerózy – současné možnosti a perspektivy
- Vplyv rýchlosti rastu supratentoriálnych grade II gliómov na ich prognózu
- Příčiny vzniku Parkinsonovy nemoci – nové představy a nové výzvy
- Testy verbální fluence, česká normativní studie pro osoby vyššího věku
- Addenbrookský kognitivní test – orientační normy pro českou populaci
- Komise pro funkční odbornost v EEG upozorňuje
- Současný stav léčby anaplastických gliomů v České republice
- Využití škály QUALID k hodnocení kvality života u pacientů v pozdní fázi demence v České republice
- Výsledky chirurgické léčby pacientů s „čistým“ úrazovým epidurálním krvácením
- Neuropsychologický výkon u pacientů s první epizodou schizofrenie
- Kennedyho choroba v materiáli Centra pre neuromuskulárne ochorenia Bratislava
- Absces zadní jámy lební s obstrukčním hydrocefalem u dítěte s dermoidální cystou s dermálním sinusem – kazuistika
- Projekt ncRNAPain
- Výskyt periferního primitivního neuroektodermálního nádoru v průběhu spinálního kořene – kazuistika
- Erratum
- Absces mozku jako první klinická manifestace hereditární hemoragické teleangiektázie – tři kazuistiky
- Ovlivnění výsledku traktografie pyramidové dráhy volbou oblasti zájmu trasování – kazuistika
- Vzduchová embolie mozku – kazuistika
- Životní jubileum profesorky Soni Nevšímalové
- Zvečnená spomienka na profesora Cigánka
- Prof. MUDr. Peter Kukumberg, PhD., 70- ročný
- Webové okénko
- Analýza dat v neurologii
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Addenbrookský kognitivní test – orientační normy pro českou populaci
- Míšní šok – od patofyziologie ke klinickým projevům
- Diagnostika epileptických záchvatů
- Testy verbální fluence, česká normativní studie pro osoby vyššího věku
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



