-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Srovnání účinnosti subkutánně podávaného interferonu β-1a 44 μg, dimetyl fumarátu a fingolimodu v reálné klinické praxi – multicentrická observační studie
A comparison of efficacy of subcutaneous interferon β-1a 44 μg, dimethyl fumarate and fingolimod in the real-life clinical practise – a multicenter observational study
Introduction:
Multiple sclerosis is a chronic inflammatory demyelinating and neurodegenerative disease affecting the CNS. Interferon (IFN) β-1a 44 μg, dimethyl fumarate (DMF) and fingolimod are established medications for the treatment of relapsing-remitting MS (RR MS). The aim of the project (analysis from registry ReMuS) was a comparison of the efficacy of IFN β-1a 44 μg, DMF and fingolimod in patients with RR MS in real world evidence in the Czech Republic. This treatment was started within 90 days after relapse.Patients and methods:
A total of 279 patients with RR MS who experienced one relapse during the first line treatment (IFN β-1a 22 μg given 3× weekly, IFN β-1a 30 μg given 1× weekly, IFN β-1b 250 μg given each other day, teriflunomid 14 mg given daily, glatiramer acetate 20mg given daily or glatiramer acetate given 40mg given 3× weekly) and who were switched to the treatment with IFN β-1a 44 μg, DMF or fingolimod were included into the study. The observed parameters were annualized relapse rate (ARR), time to next relapse, proportion of relapse free patients and change in Expanded Disability Status Scale (EDSS) at 1-year after treatment.Results:
We found out significant improvement in observed outcomes during 1-year observation after treatment change in all particular medications. Comparison of IFN β-1a 44 μg group (83 patients) vs. DMF or fingolimod group (196 patients) showed more significant improvement in observed parameters (ARR and change of EDSS) in DMF or fingolimod group. When we used propensity score matching method (83 patients from IFN β-1a 44 μg group vs. 83 patients from DMF or fingolimod group), the sustained improvement in observed parameters has persisted before and after change of treatment in both groups but no significant differences were observed between groups.Conclusion:
IFN β-1a 44 μg, DMF and fingolimod proved the effectivness in escalation of treatment in the selected group of patients in observed parameters – change of EDSS and time to next relapse).Key words:
multiple sclerosis – interferon β-1a 44 μg – dimethyl fumarate – fingolimodThe authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
皮下干扰素β-1a44μg,富马酸二甲酯和芬戈莫德在现实临床实践中的疗效比较 - 一项多中心观察研究
介绍:
多发性硬化是一种慢性炎性脱髓鞘和神经退行性疾病,影响中枢神经系统。 干扰素(IFN)β-1a44μg,富马酸二甲酯(DMF)和芬戈莫德是用于治疗复发缓解型MS(RR MS)的药物。 该项目的目的(来自登记处ReMuS的分析)是比较IFNβ-1a44μg,DMF和芬戈莫德在捷克共和国现实世界中RR MS患者的疗效。 该治疗在复发后90天内开始。
患者和方法:共有279例RR MS患者在一线治疗期间复发一次(IFNβ-1a22μg,每周3次,IFNβ-1a30μg,每周1次,IFNβ-1b250μg) 每隔一天给予teriflunomid,每天给予14mg醋酸格拉替雷,或每日给予20mg醋酸格拉替雷或每周3次给予醋酸格拉替雷40mg,并将其转换为用IFNβ-1a治疗44μg,DMF或芬戈莫德作为研究。 观察到的参数是治疗后1年的年复发率(ARR),再次复发的时间,无复发患者的比例和扩大残疾状态量表(EDSS)的变化。
结果:我们发现在所有特定药物治疗变化后的1年观察期间观察到的结果有显著改善。 IFNβ-1a的比较44μg组(83名患者)与DMF或芬戈莫德组(196名患者)在DMF或芬戈莫德组中观察到的参数(ARR和EDSS的变化)显着改善。 当我们使用倾向评分匹配方法(来自IFNβ-1a44μg组的83名患者与来自DMF或芬戈莫德组的83名患者)时,观察到持续改进参数保存两组治疗前后的变化,但观察组之间无显著差异。
结论:IFNβ-1a44μg,DMF和芬戈莫德证实了所选择的一组患者治疗升级的有效性,观察参数 - EDSS的变化和下次复发的时间。
关键词:
多发性硬化症 - 干扰素β-1a44μg - 富马酸二甲酯 - 芬戈莫德
Autori: Z. Pavelek 1; L. Sobíšek 2,3; D. Horáková 4
; M. Vališ 1
Pôsobisko autorov: Neurologická klinika LF UK a FN Hradec Králové 1; Nadační fond IMPULS, Praha 2; Katedra statistiky a pravděpodobnosti, Vysoká škola ekonomická v Praze 3; Neurologická klinika a Centrum klinických neurověd 1. LF UK a VFN v Praze 4
Vyšlo v časopise: Cesk Slov Neurol N 2018; 81(4): 457-465
Kategória: Původní práce
doi: https://doi.org/10.14735/amcsnn2018457Súhrn
Úvod:
Roztroušená skleróza je chronické zánětlivé a neurodegenerativní onemocnění postihující CNS. Mezi etablované léky pro relaps-remitentní RS (RR RS) patří interferon (IFN) β-1a 44 μg, dimetyl fumarát (DMF) a fingolimod. Cílem projektu, resp. výstupem z analýzy z registru ReMuS, bylo srovnat účinnost subkutánně podávaného IFN β-1a 44 μg, DMF a fingolimodu u pacientů s RR RS, u nichž byla zahájena tato léčba do 90 dní od počátku relapsu, v reálné klinické praxi v ČR.Soubor a metodika:
Do projektu bylo zahrnuto celkem 279 pacientů s RR RS, kteří prodělali při léčbě 1. linie (IFN β-1a 22 μg 3× týdně, IFN β-1a 30 μg 1× týdně, IFN β-1b 250 μg obden, teriflunomid 14 mg denně, glatiramer acetát 20 mg denně nebo glatiramer acetát 40 mg 3× týdně) jeden relaps a kterým byla léčba změněna buď na IFN β-1a 44 μg nebo DMF či fingolimod. Sledovanými parametry byly roční počet relapsů (annualized relapse rate; ARR), doba do dalšího relapsu, zastoupení pacientů bez relapsu a změna Expanded Disability Status Scale (EDSS) po roce od změny léčby u jednotlivých preparátů.Výsledky:
Po změně terapie došlo u všech třech sledovaných preparátů během roční observace k signifikantnímu zlepšení analyzovaných parametrů. Při porovnání skupiny pacientů s léčbou IFN β-1a 44 μg (83 pacientů) vs. fingolimod nebo DMF (196 pacientů) bylo ve druhé skupině významnější zlepšení v parametru ARR a změna EDSS. Po spárování pacientů na terapii IFN β-1a 44 μg se skupinou léčenou DMF nebo fingolimodem v poměru 1 : 1 metodou propensity score matching (83 vs. 83 pacientů) zůstal signifikantní vliv na zlepšení sledovaných parametrů před změnou terapie a po ní v obou skupinách, neprokázali jsme ale již signifikantní rozdíl efektu mezi skupinami.Závěr:
IFN β-1a 44 μg, DMF i fingolimod prokázaly svou účinnost v rámci eskalace léčby na vybrané skupině pacientů v parametrech změna EDSS a čas do dalšího relapsu.Klíčová slova:
roztroušená skleróza – interferon β-1a 44 μg – dimetyl fumarát – fingolimodÚvod
Roztroušená skleróza je autoimunitní onemocnění, které je nejčastější neurologickou příčinou invalidity u mladší a střední věkové populace. Léčba RS vykazuje od konce 20. století a na počátku 21. století značný pokrok. S vývojem nových léků se mění i cíle léčby. V 90. letech 20. století, kdy se objevovaly první preparáty patřící do skupiny DMD (disease modifying drugs), bylo primárním cílem léčby RS snížení počtu relapsů a zmírnění progrese onemocnění. V současné době je snahou postihnout více parametrů, které mohou být ovlivněny RS. Tyto parametry jsou součástí konceptu léčby RS – no evidence of disease activity (NEDA). Ten je obvykle definován absencí relapsů, progrese disability a aktivity na MR [1,2].
Terapie RS vyžaduje individuální přístup, pečlivé monitorování efektu a nežádoucích účinků [3,4]. Počátkem roku 2018 byly publikovány nové evropské doporučené postupy pro léčbu pacientů s RS [5]. V současné době jsou pro léčbu pacientů s RR RS v EU registrovány následující preparáty: interferon (IFN) β, glatiramer acetát, dimetyl fumarát (DMF), teriflunomid, fingolimod, natalizumab, alemtuzumab, kladribin a ocrelizumab. Evropská doporučení jasně říkají, že rozhodnutí o výběru léčby by mělo být výsledkem diskuze mezi lékařem a pacientem a mělo by být ovlivněno pouze charakteristikou pacienta a jeho komorbiditami, tíží a aktivitou nemoci, bezpečnostním profilem a dostupností léku. Bohužel v ČR stále přetrvávají restriktivní úhradová kritéria, která definují dostupnost léků i s ohledem na jejich cenu. Aktuálně lze v ČR zahájit léčbu imunomodulačním lékem první volby. Při jeho nedostatečném efektu nebo nesnášenlivosti dochází ke změně léku v rámci 1. linie (tzv. switch-in) či eskalaci léčby do linie vyšší (switch-out). Mezi léky 1. linie řadíme IFN, glatiramer acetát a teriflunomid. Skutečnost je taková, že poměrně velká část pacientů léčená léky první volby vykazuje nedostatečnou nebo žádnou terapeutickou odpověď (30 – 60 % léčených pacientů) [6,7]. DMF a fingolimod lze indikovat u nemocných se známkami nepříznivé prognózy onemocnění, u kterých došlo navzdory léčbě nejméně jedním lékem 1. linie k rozvoji alespoň jednoho středně těžkého nebo těžkého relapsu (hovoříme o 1,5 linii). Rovněž je lze indikovat u pacientů s rychle progredující závažnou relaps-remitentní (RR) RS, kteří prodělali nejméně dva relapsy v 1 roce a současně vykazují jednu nebo více gadolinium vychytávajících lézí na MR mozku nebo zvýšení objemu T2 hyperintenzních lézí ve srovnání s předchozí MR. Natalizumab a alemtuzumab jsou v ČR řazeny do linie druhé. Jsou indikovány u pacientů s RR RS, u kterých nedošlo navzdory léčbě nejméně jedním lékem 1. linie k poklesu počtu relapsů pod dvě ataky ročně, nebo u pacientů s rychle progredující závažnou formou RR RS, kteří prodělali nejméně dva relapsy v 1 roce a současně vykazují jednu nebo více gadolinium vychytávajících lézí na MR mozku nebo zvýšení objemu T2 lézí ve srovnání s předchozí MR.
Metodika
Do studie byli retrospektivně zařazeni pacienti z 15 center pro diagnostiku a léčbu demyelinizačních onemocnění v ČR. Počet pacientů zařazených z jednotlivých center je uveden v příloze 1, 2 (v závěru článku). Zdrojem dat byl český celostátní registr pacientů s roztroušenou sklerózou (ReMus). ReMuS ke dni 31. 12. 2017 obsahoval informace o 13 057 pacientech, kteří měli zaznamenánu alespoň jednu návštěvu v RS centru od roku 2010 [7]. Všichni pacienti podepsali informovaný souhlas se zařazením do registru ReMuS.
Příloha 1. Počty pacientů z jednotlivých RS center – nespárované skupiny. 
CB – České Budějovice, FNB – Fakultní nemocnice Brno, FNKV – Fakultní nemocnice Královské Vinohrady, FNM – Fakultní nemocnice Motol, FNP – Fakultní nemocnice Plzeň, FTN – Thomayerova nemocnice, HK – Hradec Králové, JI – Jihlava, OL – Olomouc, OV – Ostrava, PA – Pardubice, TP – Teplice, USA – fakultní nemocnice u sv. Anny v Brně, VFN – Všeobecná fakultní nemocnice v Praze, ZL – Zlín Příloha 2. Počty pacientů z jednotlivých RS center – spárované skupiny. 
CB – České Budějovice, FNB – Fakultní nemocnice Brno, FNKV – Fakultní nemocnice Královské Vinohrady, FNM – Fakultní nemocnice Motol, FNP – Fakultní nemocnice Plzeň, FTN – Thomayerova nemocnice, HK – Hradec Králové, JI – Jihlava, OL – Olomouc, OV – Ostrava, PA – Pardubice, TP – Teplice, USA – fakultní nemocnice u sv. Anny v Brně, VFN – Všeobecná fakultní nemocnice v Praze, ZL – Zlín Z celkového počtu pacientů 13 057 bylo identifikováno 279 pacientů, kteří splnili následující výběrová kritéria:
- byla u nich zahájena léčba IFN β-1a 44 μg, DMF nebo fingolimodem po jednom relapsu; léčba byla zahájena do 90 dnů od počátku relapsu;
- délka sledování nově zahájené léčby je alespoň 10 měsíců;
- předchozí léčba (před relapsem) byla IFN β-1a 22 μg 3× týdně, IFN β-1a 30 μg 1× týdně, IFN β-1b 250 μg obden, teriflunomid 14 mg denně nebo glatiramer acetát 20 mg denně nebo 40 mg 3× týdně.
Vybraných 279 pacientů bylo rozděleno do dvou skupin:
- 83 pacientů ve skupině switch-in se zahájenou léčbou IFN β-1a 44 μg po jednom relapsu (v rámci switch-in z IFN β-1a 22 μg, IFN β-1a 30 μg 1× týdně, IFN β-1b, teriflunomidu nebo glatiramer acetátu). V této skupině byla léčba zahájena v rozmezí listopad 2010 až říjen 2016. Medián a průměr data zahájení léčby byl březen 2013 a červen 2013.
- 196 pacientů ve skupině switch-out se zahájenou léčbou DMF a fingolimodem po relapsu (v rámci switch-out z IFN β-1a 22 μg, IFN β-1a 30 μg 1× týdně, IFN β-1b, teriflunomidu nebo glatiramer acetátu). V této skupině byla léčba zahájena v rozmezí červen 2012 až únor 2017. Medián a průměr data zahájení léčby byly leden 2016 a listopad 2015.
Ve skupinách byl statistickými testy porovnán vývoj následujících klinických parametrů vystihujících tíži nemoci před změnou léčby a po ní:
- anualizovaná absolutní změna EDSS (dEDSS);
- roční počet relapsů (annualized relapse rate; ARR);
- doba do dalšího relapsu;
- proporce pacientů bez relapsu.
Pro posouzení toho, zda došlo k významnému zlepšení parametrů dEDSS a ARR v období před změnou léčby a po ní v každé skupině zvlášť, byly testovány párové hodnoty parametrů dEDSS a ARR z období 1 rok před změnou léčby a po ní pomocí neparametrického Wilcoxonova párového t-testu pro každou skupinu zvlášť.
Dále bylo testováno, zda se skupiny mezi sebou liší ve všech čtyřech parametrech v období 1 roku po změně léčby. Rozdíly mezi skupinami pro dEDSS a ARR byly statisticky testovány pomocí neparametrického t-testu (Kruskal-Wallisův test). Rozdíl v čase do dalšího relapsu byl testován parametrickým t-testem. Proporce pacientů bez relapsu byla testována chí-kvadrát testem nezávislosti v kontingenční tabulce.
Rovněž byly odhadnuty funkce přežití(Kaplan-Meier) času do relapsu pro každou skupinu (switch-in/ out) a rozdílný vývoj těchto funkcí byl testován pomocí log rank testu.
Závěry analýzy byly následně validovány na spárovaných skupinách. Ke skupině 83 pacientů ze switch-in bylo spárováno 83 pacientů ze skupiny switch-out (196). Důvodem pro párování a provedení validační analýzy bylo minimalizovat potenciální vliv exogenních proměnných na rozdílný vývoj ve sledovaných klinických parametrech disability (EDSS, tendence k výskytu relapsů) mezi skupinami. Exogenní proměnné, dle nichž optimalizační algoritmus (propensity scoring algoritmus) implementovaný v balíčku MatchIT napároval pacienty ze skupiny switch-out k pacientům ve switch-in, jsou: pohlaví, věk, délka nemoci a EDSS ke dni změny terapie a ARR před změnou léčby [8].
Zvolená hladina významnosti je 5 %. Všechny výpočty byly provedeny ve statistickém systému R (The R Foundation, Vídeň, Rakousko).
Výsledky – nespárované skupiny
Studijní populace
Proporce žen ve skupinách se různí – 81 vs. 72 %, ale nejedná se o statisticky významný rozdíl (p = 0,165). Pacienti ve skupině switch-in jsou přibližně o 1 rok mladší (medián 35 vs. 36 let, p = 0,402), a tedy i doba trvání RS je u této skupiny přibližně o 1 rok kratší (6,5 vs. 7,3; p = 0,044). Míra postižení ke dni změny léčby se liší o 0,5 bodu (2,5 vs. 3,0; p = 0,031). Délka předchozí léčby se statisticky významně neliší (2,6 vs. 2,1; p = 0,395). Změna terapie po relapsu v rámci stejné linie nastala dříve (37 dní) než eskalace na vyšší linii (54 dní). Tab. 1 zobrazuje celkové (pro 279 pacientů) a dílčí (skupina switch-in a switch-out) popisné statistiky (průměr ± směrodatná odchylka; medián) sledovaných proměnných.
Tab. 1. Charakteristiky a porovnání nespárovaných skupin switch-in a switch-out. 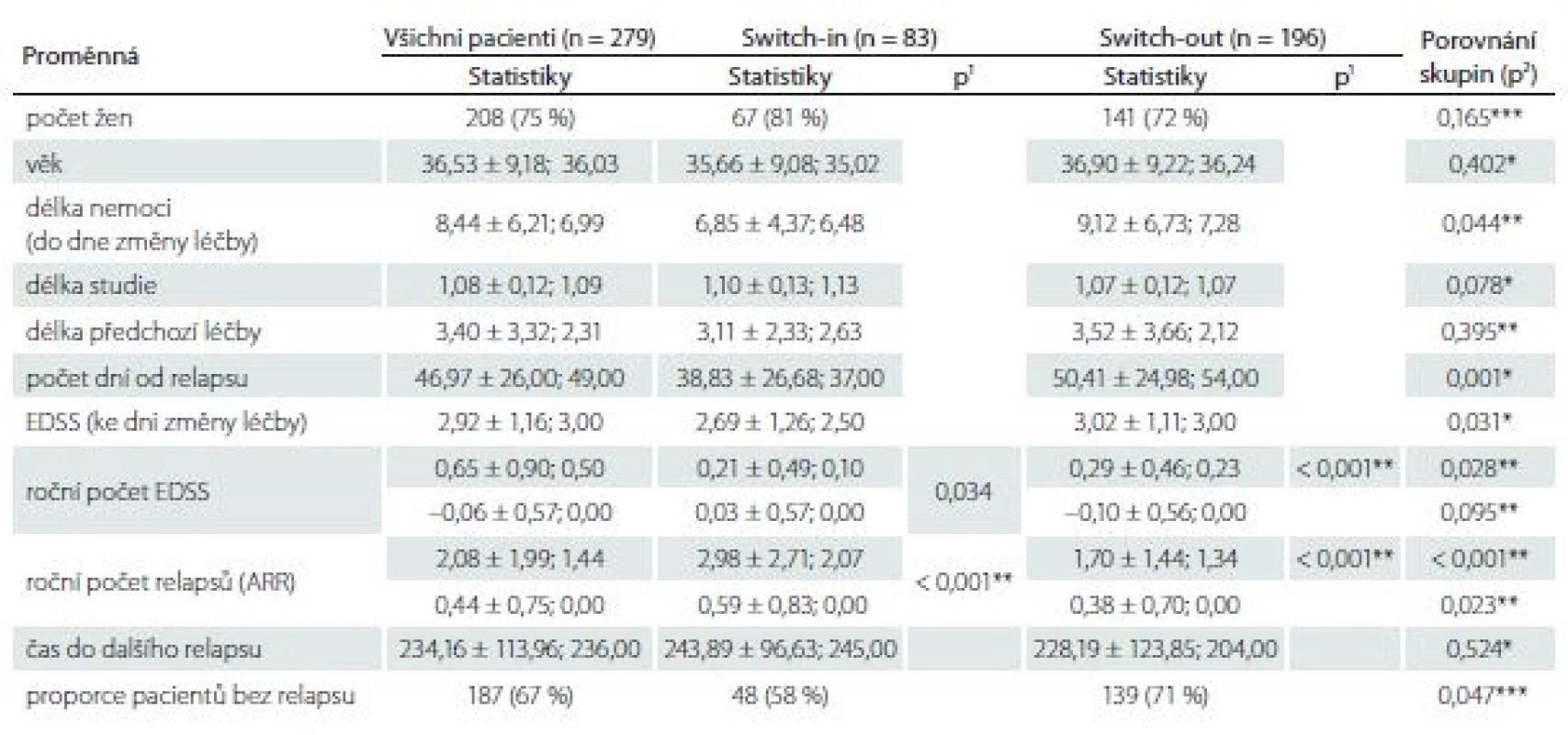
V tabulce jsou zobrazeny (vyjma počtu žen a proporce pacientů bez relapsu) statistiky: průměr ± směrodatná odchyka; median. Hodnota p1 je výstupem párového t-testu pro porovnání párových hodnot (před a po) v dané skupině, hodnota p2 je výstupem t-testu pro porovnání rozdílů mezi skupinami.
EDSS – Expanded Disability Status Scale
* parametrický t-test, ** neparametrický t-test, *** chí-kvadrát test nezávislosti v kontingenční tabulce switch-ARR – roční počet relapsů
Roční počet relapsů se v obou skupinách po změně významně zlepšil, u switch-in z 2,07 (medián) relapsů za rok na 0 a u switch-out z 1,34 na 0 (p < 0,001). U skupiny switch-out je v roce po eskalaci ARR statisticky významně nižší (průměry 0,59 vs. 0,38; p = 0,023) (obr. 1). V obou skupinách nebyla v následujícím roce více než polovina pacientů postižena atakou. U skupiny switch-in bylo 58 % pacientů bez ataky, ve druhé skupině pak 71 %; p = 0,047.
Obr. 1. ARR (roční počet relapsů).
Fig. 1. ARR (annualized relapse rate).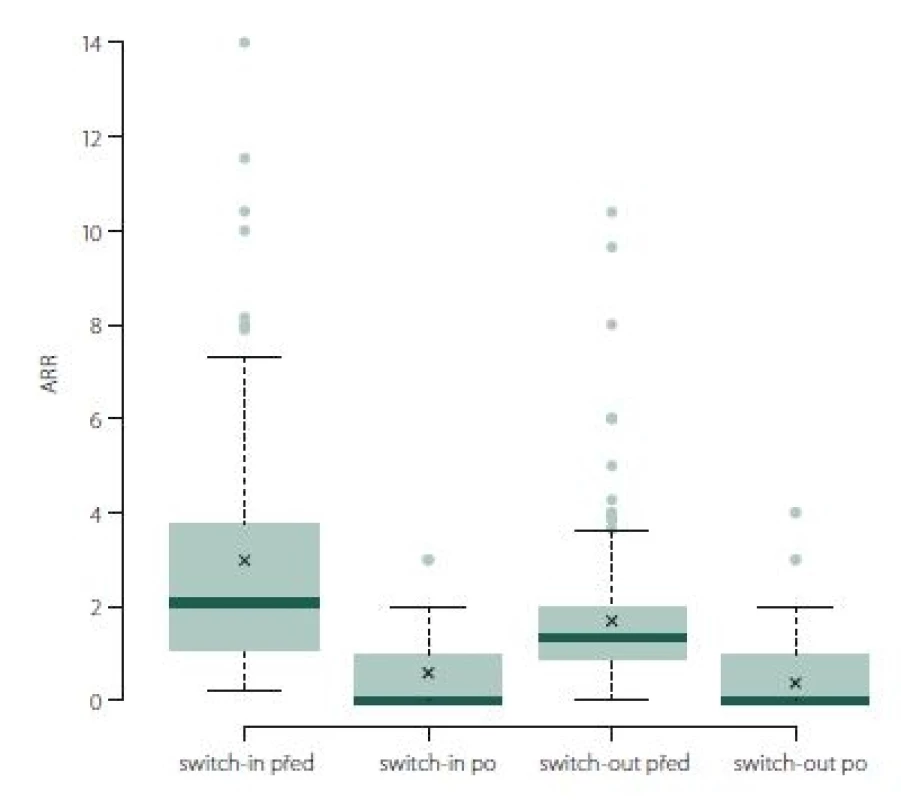
Zastoupení pacientů bez relapsu
Obr. 2, 3 (Kaplan-Meierův odhad funkce přežití) ukazují kumulativní míru rizika relapsu a proporce pacientů bez relapsu ode dne změny léčby. Ve skupině switch-in nastává první relaps po 71 dnech, ve skupině switch-out je to 31 dní. Zhruba v období 2 měsíce až půl roku je riziko výskytu relapsů vyšší u skupiny switch-out. Ve 2 měsících je odhad proporce pacientů bez relapsu 98 – 100 % (95% intervalový odhad) u switch-out a u switch-in 97 – 100 %. Přibližně po půl roce (170 dnů) jsou proporce opačné 83 – 93 % (switch-out), 86 – 98 % (switch-in). Poté se riziko výskytu relapsu u této skupiny významně snižuje a proporce pacientů bez výskytu relapsu se vyrovnávají. Přibližně od 11. měsíce (305 dní) do konce roku je významně nižší riziko výskytu relapsu a proporce pacientů bez relapsu (75 – 86 %) je vyšší u skupiny switch-out než u skupiny switch-in (59 – 79 %).
Obr. 2. Kumulativní míra rizika (hazard plot) relapsu.
Fig. 2. Hazard plot of relapse.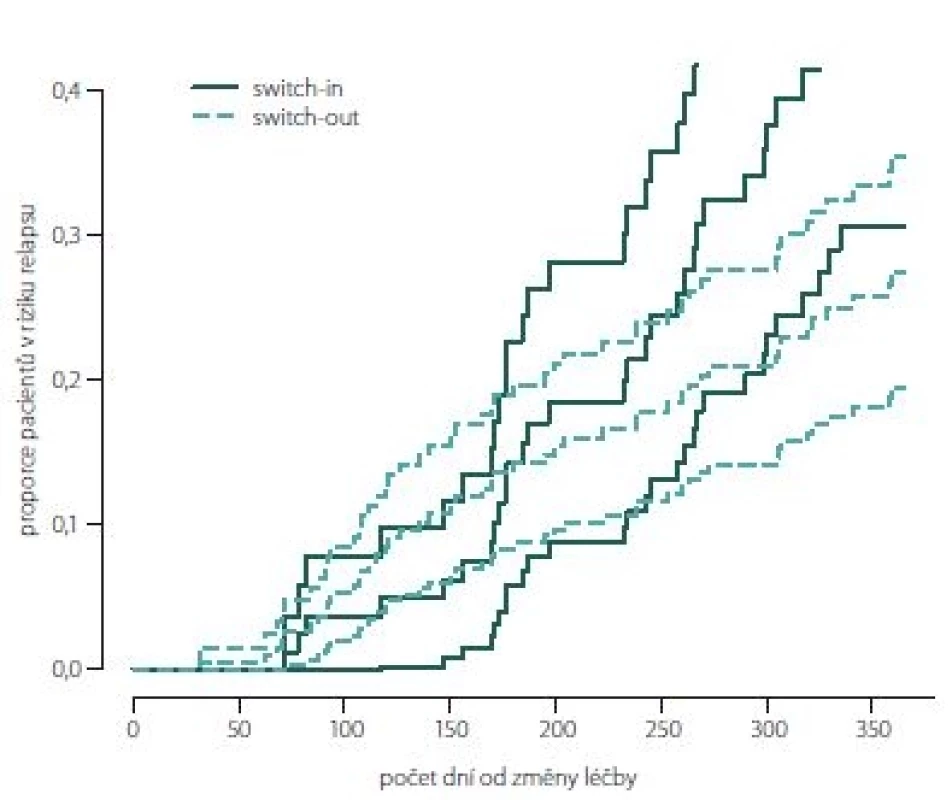
Obr. 3. Proporce pacientů bez relapsu dle skupin switch-in/out (Kaplan-Meierova funkce přežití).
Fig. 3. The proportion of relapse free patients according to groups switch-in/out (Kaplan-Meier survival function).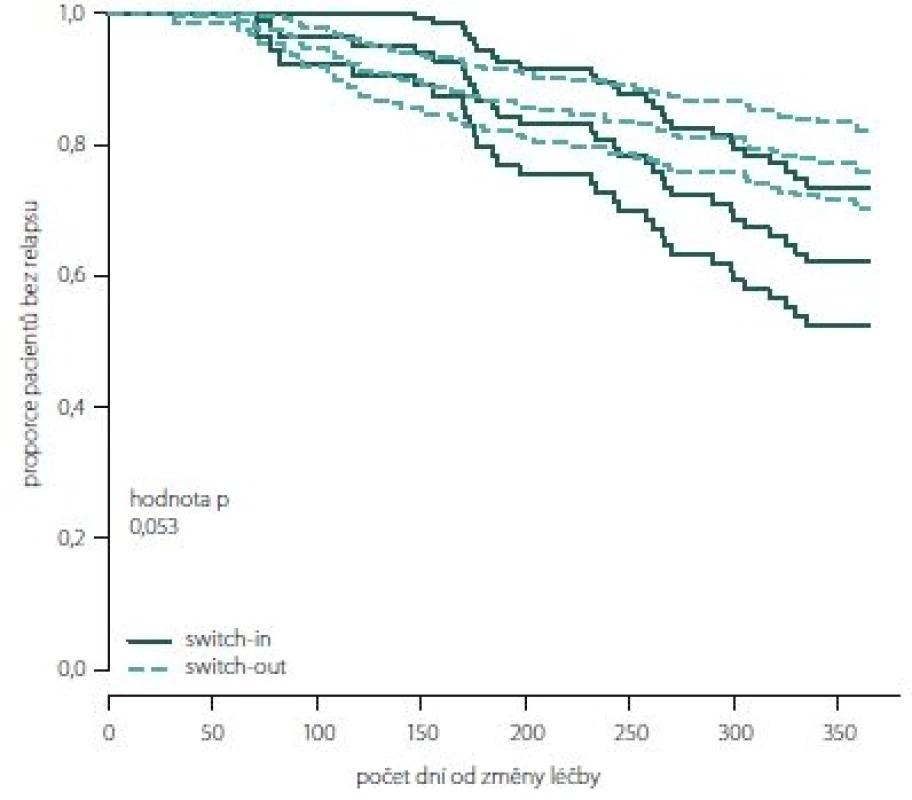
Doba do dalšího relapsu
Relaps nastal v následujícím roce u 92 (switch-in) a 57 (switch-out) pacientů. Průměrná doba do vzniku tohoto relapsu se významně neliší – 244 vs. 229 dní; p = 0,524 (obr. 4).
Obr. 4. Doba do dalšího relapsu
Fig. 4. Time to next relapse.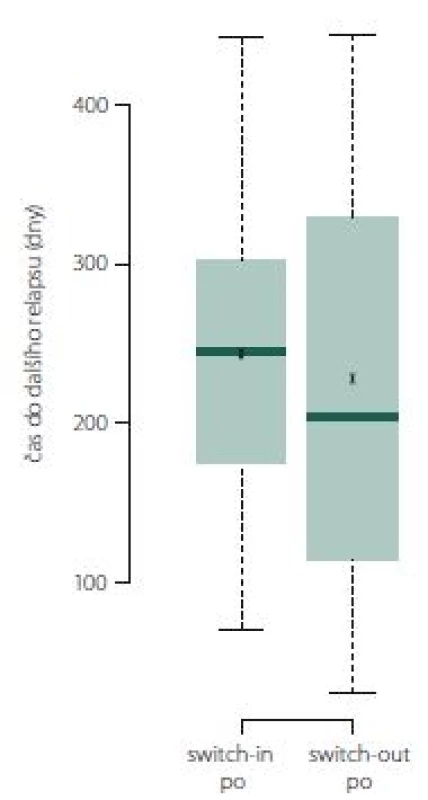
Změna EDSS po roce léčby u jednotlivých preparátů
V období před změnou terapie se obě skupiny významně lišily v průměrné roční změně EDSS. Ve skupině switch-out byla před eskalací průměrná roční změna EDSS horší (zhoršení o 0,23) než v předchozí skupině (0,1); p = 0,028.
U více než poloviny pacientů ze skupiny swith-in docházelo k (průměrnému ročnímu) nárůstu EDSS před změnou léčby (0,1). Během následujícího roku po změně terapie (switch-in) se min. u 50 % pacientů nárůst zastavil a v několika případech se hodnota EDSS zlepšila. Rozdíl je statisticky významný (0,034). Po eskalaci došlo ve druhé skupině (switch-out) k významnému zlepšení (medián = 0, průměrné zlepšení o 0,1); p < 0,001. Rozdíl mezi skupinami po změně terapie není významný; p = 0,095 (obr. 5).
Obr. 5. Změna Expanded Disability Status Scale po roce léčby u jednotlivých preparátů.
Fig. 5. The change of Expanded Disability Status Scale after one year of treatment.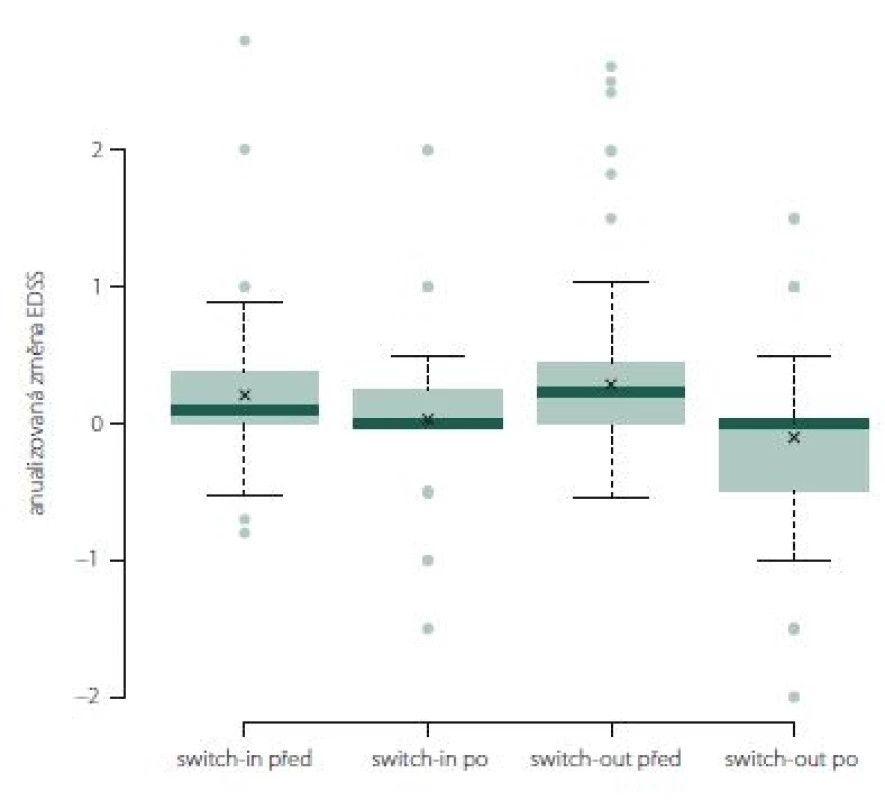
Výsledky – spárované skupiny
Studijní populace
Ze 196 pacientů ze skupiny switch-out spároval statistický algoritmus podsoubor 83 pacientů z této skupiny ke skupině switch-in. Tato podskupina se statisticky významně neliší od skupiny switch-in v kontrolovaných vlivných faktorech, dle kterých se párovalo. Pacienti ze spárované podskupiny switch-out jsou mladší o 1 rok (34 vs. 35 let) a jedná se o pacienty s kratší dobou trvání nemoci o 1 rok (5,4 vs. 6,5). EDSS a ARR před změnou léčby je v obou skupinách shodné. Tab. 2 zobrazuje celkové (pro 166 pacientů) a dílčí (skupina switch-in a switch-out) popisné statistiky (průměr ± směrodatná odchylka; medián) sledovaných proměnných.
Tab. 2. Charakteristiky a porovnání spárovaných skupin switch-in a switch-out. 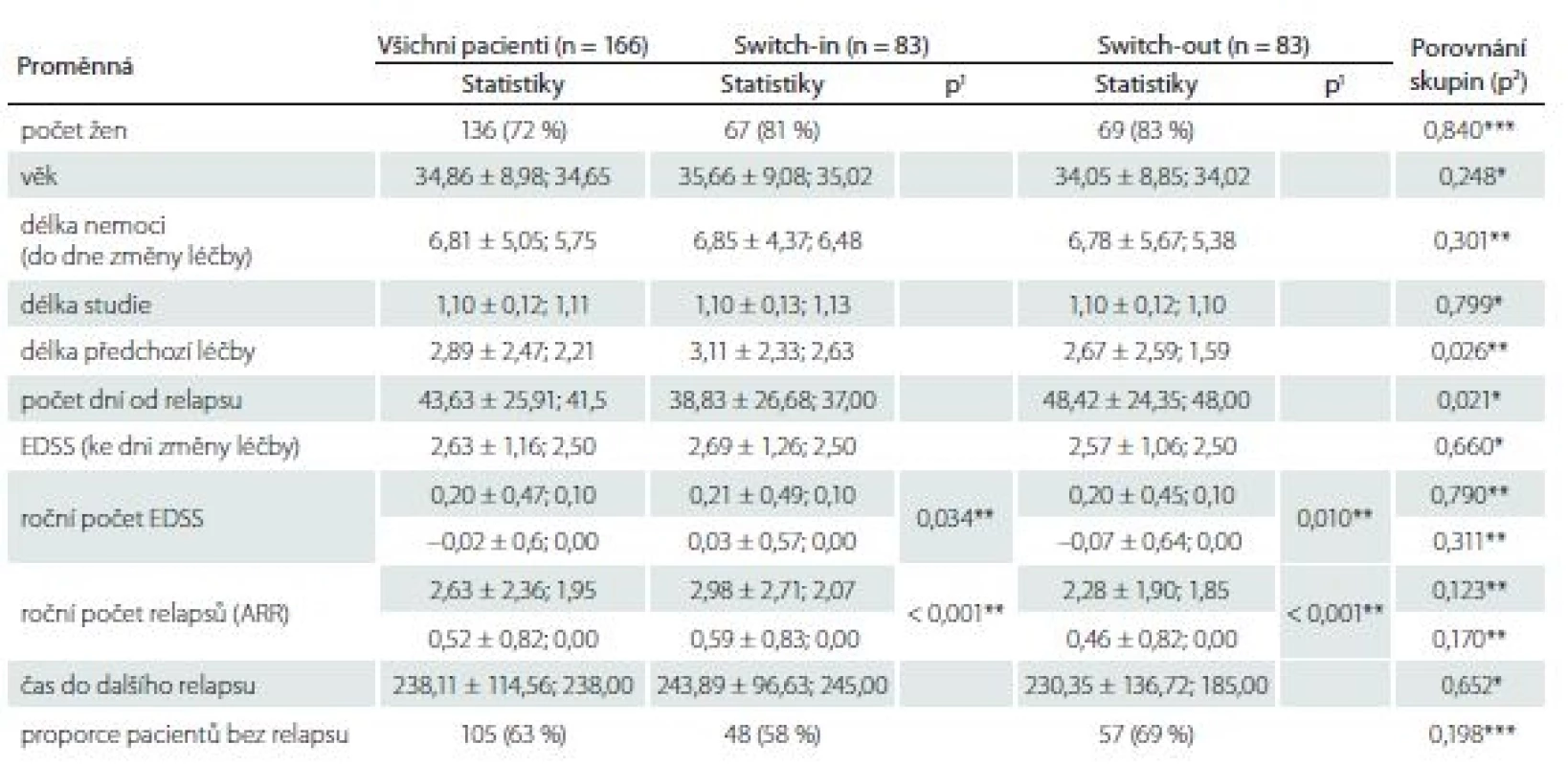
V tabulce jsou zobrazeny (vyjma počtu žen a proporce pacientů bez relapsu) statistiky: průměr ± směrodatná odchyka; median. Hodnota p1 je výstupem párového t-testu pro porovnání párových hodnot (před a po) v dané skupině, hodnota p2 je výstupem t-testu pro porovnání rozdílů mezi skupinami.
EDSS – Expanded Disability Status Scale
* parametrický t-test, ** neparametrický t-test, *** chí-kvadrát test nezávislosti v kontingenční tabulceARR – roční počet relapsů
ARR během sledovaného období poklesl významně u skupiny switch-out (medián z 1,85 na 0; p < 0,001). ARR (po změně terapie) je pro spárované skupiny switch-in a switch-out srovnatelný (medián 0 a 0, průměr 0,46 vs. 0,59; p = 0,170) (obr. 6).
Obr. 6. ARR (roční počet relapsů).
Fig. 6. ARR (annualized relapse rate).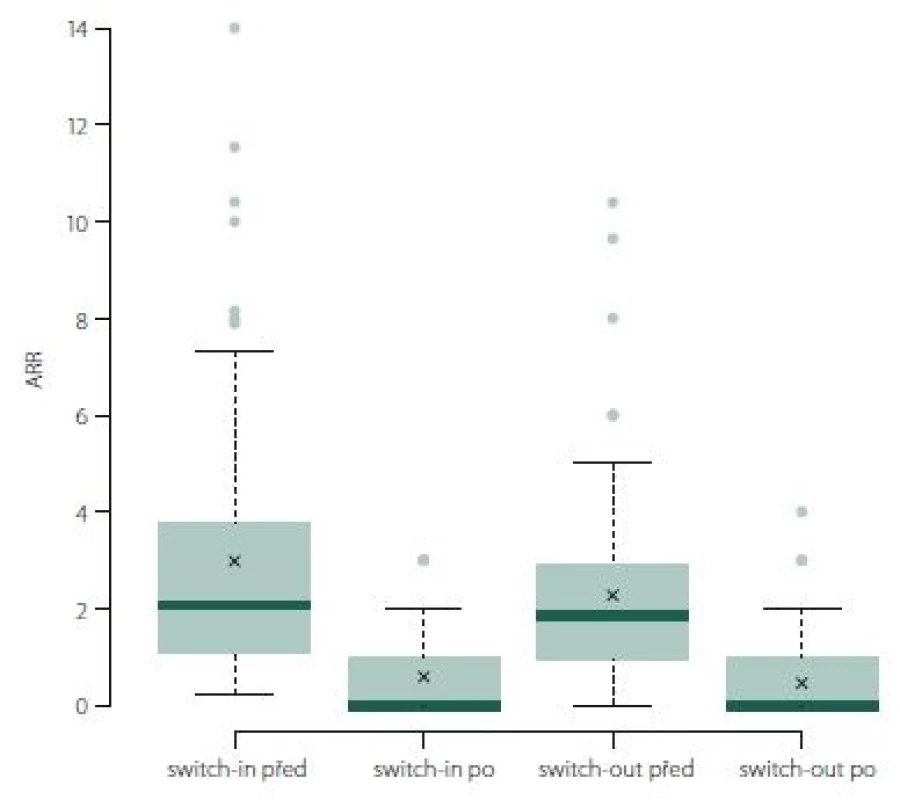
Zastoupení pacientů bez relapsu
Obr. 7, 8 (Kaplan-Meierův odhad funkce přežití) ukazují kumulativní míru rizika relapsu a proporce pacientů bez relapsu od dne změny léčby. Proporce pacientů bez relapsu je větší ve skupině switch-out 69 % oproti skupině switch-in 58 %. Rozdíl není statisticky významný (p = 0,198). Vývoj je u spárované skupiny switch-out (83) obdobný vývoji celé skupiny před párováním (196).
Obr. 7. Kumulativní míra rizika (hazard plot) relapsu spárovaných skupin.
Fig. 7. Hazard plot of relapse (paired groups).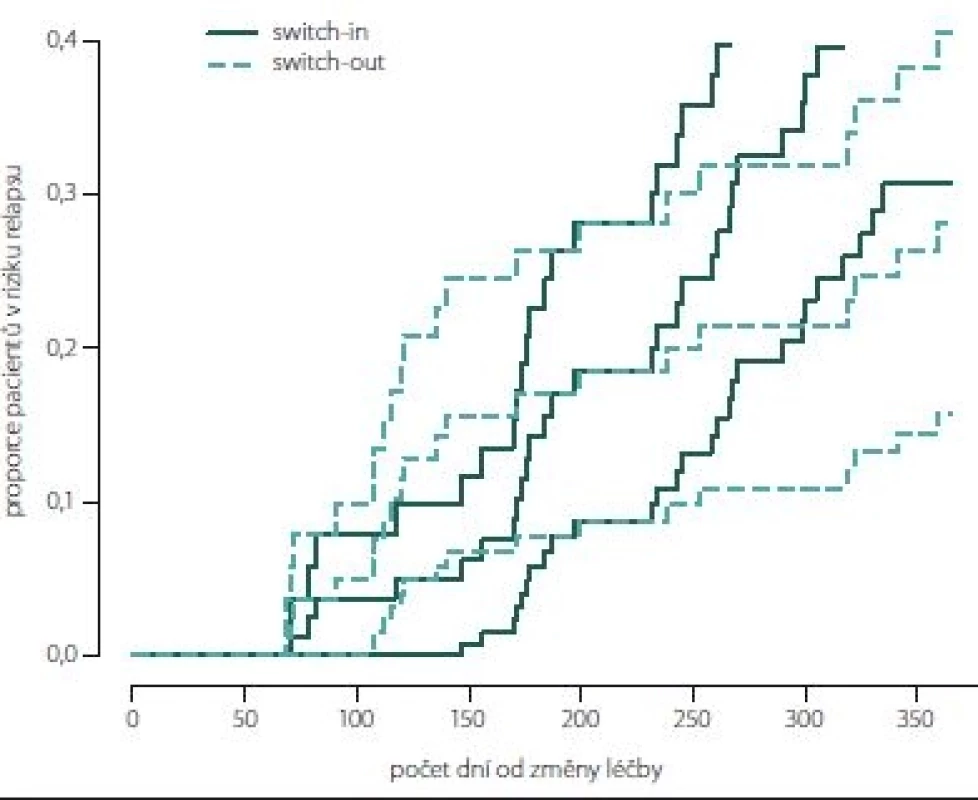
Obr. 8. Proporce pacientů bez relapsu dle spárovaných skupin switch-in/out (Kaplan-Meierova funkce přežití).
Fig. 8. The proportion of relapse free patients according to paired groups switch-in/out (Kaplan-Meier survival function).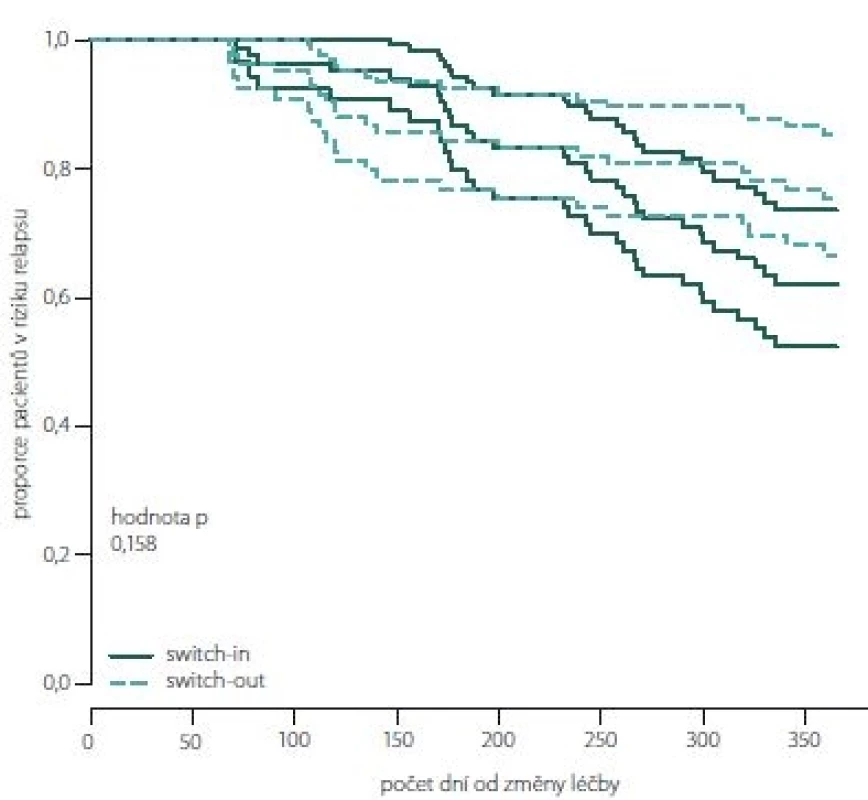
Doba do dalšího relapsu
Pokud došlo k relapsu, tak ve skupině switch-out nastal obecně dříve o 2 měsíce než u skupiny switch-in. Relaps nastal u 50 % pacientů ze skupiny switch-out mezi 113. (dolní kvartil) a 355. (horní kvartil) dnem. Medián je 185 dní. U skupiny switch-in je interkvartilové rozpětí 175 – 302 dní (medián 245). Rozdělení ukazuje obr. 9.
Obr. 9. Doba do dalšího relapsu.
Fig. 9. Time to next relapse.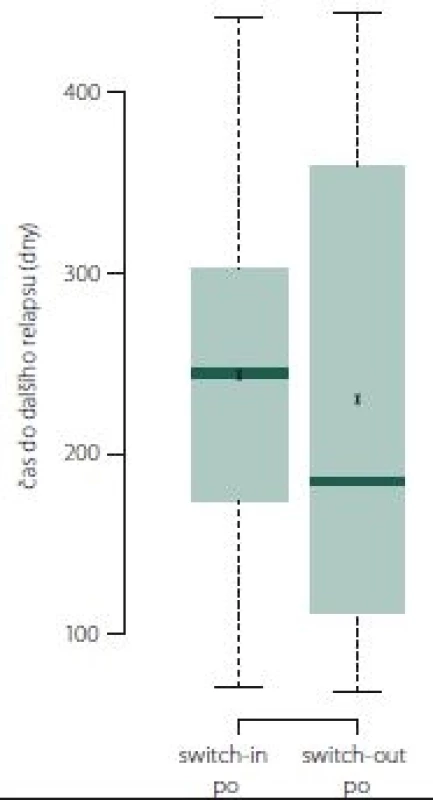
Změna EDSS po roce léčby u jednotlivých preparátů
Anualizovaná změna EDSS ve skupině switch-out významně poklesla z 0,1 na 0 (medián; p = 0,01). Rozdíl mezi skupinami není (obr. 10).
Obr. 10. Změna Expanded Disability Status Scale po roce léčby u jednotlivých preparátů.
Fig. 10. The change of Expanded Disability Status Scale after one year of treatment.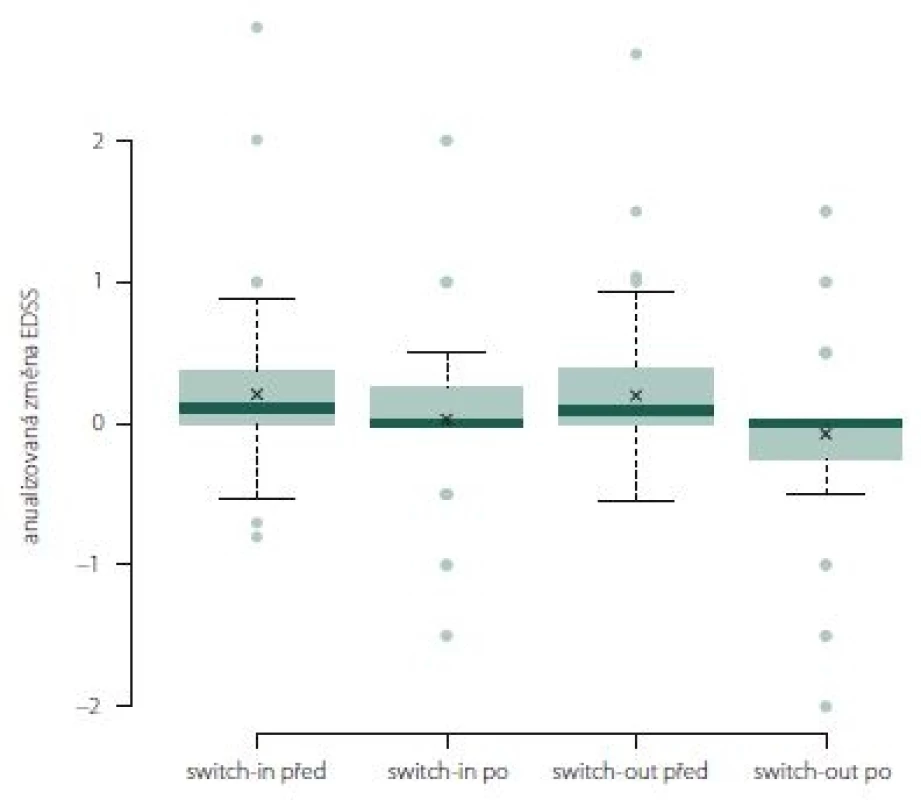
Diskuze
V ČR je v rámci úhradových kritérií u pacientů s RR RS léčených prvoliniovými preparáty (IFN, glatiramer acetát, teriflunomid) po jednom středně těžkém nebo těžkém relapsu doporučena změna léčby na DMF nebo fingolimod. Před uvedením těchto léčebných přípravků do lékového portfolia RS a vznikem 1,5 linie podstupovali někteří nemocní s RR RS po jednom středně těžkém nebo těžkém relapsu změnu léčby z jiných prvoliniových léků na IFN β-1a 44 μg. Naše analýza měla posoudit účinnost změny léčby na IFN β-1a 44 µg ve srovnání se současnými doporučeními.
IFN β-1a 44 ug, DMF i fingolimod prokázaly svou účinnost v řadě studií, pokud došlo k jejich nasazení z důvodu nedostatečně účinné předcházející léčby. Studie EVIDENCE [9] (n = 677) srovnávala podávání IFN β-1a 44 µg a IFN β-1a 30 µg. IFN β-1a 44 µg vykazoval oproti IFN β-1a 30 µg vyšší účinnost v oddálení prvního relapsu, ročním počtu relapsů, podílu pacientů bez relapsu i v parametrech MR, a to v počtu nových T2 hyperintenzních lézí. Zároveň byla zjištěna prospěšnost léčby u nemocných, kteří podstoupili switch-in z IFN β-1a 30 µg na 44 µg. Došlo k signifikantnímu snížení počtu relapsů a aktivity na MR. Naopak ve studii QUASIMS (n = 4 754) nebyl zjištěn signifikantní rozdíl v ročním počtu relapsů. ARR byl 0,51 pro IFN β-1a 30 µg, 0,52 pro IFN β-1b, 0,53 pro IFN β-1a 22 µg a 0,63 pro IFN β-1a 44 µg [10]. Kalincik et al porovnával ve své práci (n = 3 326) účinnost IFN β a glatiramer acetátu. Nepatrně nižší výskyt relapsů byl zaznamenán u pacientů léčených glatiramer acetátem a IFN β-1a s.c., oproti IFN β-1a i. m. a IFN β-1b s.c (p ≤ 0,001). Rozdíl v 12měsíční progresi disability nebyl zjištěn [11].
S ohledem na nekonzistentní data u pacientů s přetrvávající aktivitou nemoci není lékový switch mezi interferony a glatiramer acetátem primárně doporučen [9 – 16]. Pro tyto pacienty s trvající aktivitou onemocnění se jeví jako účinnější změna na jinou léčbu – DMF, fingolimod, natalizumab či alemtuzumab.
Ve studii CONFIRM (n = 1 430) byli pacienti v poměru 1 : 1 : 1 : 1 randomizováni na 2 roky trvající léčbu DMF v dávce 240 mg 2× denně nebo 3× denně nebo na léčbu placebem či na léčbu glatiramer acetátem 20 mg denně ve formě podkožní injekce. ARR byl po 2 letech signifikantně nižší ve skupině léčených nemocných DMF oproti placebové skupině – DMF 2× denně (0,22), glatiramer acetát (0,29). Ve srovnání DMF a glatiramer acetátu nebyly zjištěny signifikantní rozdíly v ročním počtu relapsů [17]. Naproti tomu Miclea et al prokázali retrospektivní analýzou dat ze dvou německých RS center po nasazení DMF redukci ARR 72 % u nemocných dříve léčených interferony a 78 % u pacientů na předchozí léčbě glatiramer acetátem [18].
Ve studii TRANSFORMS (n = 1 292) byl účinek fingolimodu podávaného ve dvou dávkách (1,25 mg a 0,5 mg) porovnáván s IFN β-1a v dávce 30 μg. ARR byl významně nižší u pacientů léčených fingolimodem – 0,2 ve skupině léčené 1,25 mg a 0,16 ve skupině léčené 0,5 mg oproti 0,33 ve skupině léčené IFN β-1a v dávce 30 μg [19].
V naší studii jsme analyzovali vývoj klinických parametrů u 279 pacientů, kteří na terapii léky 1. linie prodělali jeden relaps a jejichž léčba byla změněna buď na IFN β-1a 44 μg (switch-in = 83) nebo DMF či fingolimod (switch-out = 196). Výsledky nespárovaných skupin ukazují, že IFN β-1a 44 μg, DMF i fingolimod prokázaly svou účinnost v rámci změny (eskalace) léčby ve vybrané skupině pacientů. Po změně léčby se míra progrese nemoci, měřená změnou EDSS a ARR, zlepšila. Na 5% hladině významnosti se u nespárovaných skupin ukázalo, že pacienti eskalovaní na DMF nebo fingolimod měli nižší riziko výskytu relapsu během 1 roku po změně léčby než při změně terapie na IFN β-1a 44 μg. Změna terapie měla pozitivní efekt na zastavení nežádoucích klinických změn v následujícím roce.
Vzhledem k tomu, že popsaná analýza představuje porovnání skupin z reálné klinické praxe, kde nebyla provedena randomizace, tak jsme ve druhém kroku provedli validační analýzu se spárováním skupin podle vybraných vlivných faktorů (switch-in = 83) a (switch-out = 83). Tato analýza potvrzuje, že se obě skupiny významně zlepšily (tendence k výskytu relapsů a změna EDSS) během roku po změně léčby. Léčba má tedy pozitivní efekt na krátkodobou změnu parametrů EDSS a výskyt relapsů. U změny EDSS jsou rozdíly oproti období před nasazením léčby menší. Pro tento parametr by byla vhodnější delší doba sledování. Rozdíl mezi spárovanými skupinami switch-in a switch-out nebyl významný, tj. oba dva typy změny léčby měly stejný efekt.
Předložené závěry reprezentují výsledky z reálné klinické praxe a autoři si jsou vědomi všech hlavních bias, která tato data přinášejí [20 – 22]. V tomto typu porovnání skupin zejména chybí randomizace, porovnání skupin je tedy vždy ovlivněno řadou faktorů, které mohou mít zásadní vliv na výsledek. Cílem validační analýzy bylo alespoň částečně odfiltrovat vliv některých z těchto faktorů, je nutno ale zdůraznit, že můžeme korigovat pouze faktory známé, zatímco výsledek může být ovlivněn i řadou neznámých proměnných. Závěry získáné z této analýzy je tedy nutné interpertovat se znalostí uvedených faktorů.
Závěr
Na základě prezentovaných výstupů z registru ReMuS byl prokázán pozitivní přínos změny léčby na IFN β-1a 44 μg, DMF a fingolimodu u pacientů s RR RS, u nichž byla tato léčba zahájena po jednom relapsu při jiné prvoliniové léčbě. Zároveň lze, v kontextu 1,5 linie, považovat za prospěšnou změnu léčby na IFN β-1a 44 µg z jiných prvoliniových preparátů v případě, že nebude možné eskalovat léčbu na DMF či fingolimod (kontraindikace či nežádoucí účinky léčby). Uvedené výsledky jsou ukázkou toho, co může registr ReMuS nabídnout s vědomím všech slabin, které byly popsány výše.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 14. 2. 2018
Přijato do tisku: 7. 6. 2018
MUDr. Zbyšek Pavelek
Neurologická klinika LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: zbysekpavelek@email.cz
Zdroje
1. Lu G, Beadnall HN, Barton J et al. The evolution of „No Evidence of Disease Activity“ in multiple sclerosis. Mult Scler Relat Disord 2018; 20 : 231 – 238. doi: 10.1016/ j.msard.2017.12.016.
2. Parks NE, Flanagan EP, Lucchinetti CF et al. NEDA treatment target? No evident disease activity as an actionable outcome in practice. J Neurol Sci 2017; 383 : 31 – 34. doi: 10.1016/ j.jns.2017.10.015.
3. Broadley SA, Barnett MH, Boggild M et al. A new era in the treatment of multiple sclerosis. Med J Aust 2015; 203(3): 139 – 141.
4. Montalban X, Gold R, Thompson AJ et al. ECTRIMS/ EAN Guideline on the pharmacological treatment of people with multiple sclerosis. Mult Scler 2018; 24(2): 96 – 120. doi: 10.1177/ 1352458517751049.
5. Trojano M, Liguori M, Paolicelli D et al. Interferon beta in relapsing-remitting multiple sclerosis: an independent postmarketing study in southern Italy. Mult Scler 2003; 9(5): 451 – 457.
6. Waubant E, Vukusic S, Gignoux L et al. Clinical characteristics of responders to interferon therapy for relapsing MS. Neurology 2003; 61(2): 184 – 189.
7. Nadační fond IMPULS. Pravidelný výstup z registru ReMuS – export dat ke dni 31. 12. 2017. [online]. Do-stupné z URL: http:/ / nfimpuls.cz/ images/ docs/ remus_zaverecne-zpravy/ zaverecna-zprava_2017_12_souhrnna_rocni_web_2v-1.pdf.
8. Ho DE, Imai K, King G et al. MatchIt: Nonparametric Preprocessing for Parametric Causal Inference. J Stat Soft 2011; 42(8): 1 – 28.
9. Schwid SR, Thorpe J, Sharief M et al. Enhanced benefit of increasing interferon beta-1a dose and frequency in relapsing multiple sclerosis: the EVIDENCE Study. Arch Neurol 2005; 62(5): 785 – 792.
10. Limmroth V, Malessa R, Zettl UK et al. Quality Assessment in Multiple Sclerosis Therapy (QUASIMS): a comparison of interferon beta therapies for relapsing-remitting multiple sclerosis. J Neurol 2007; 254(1): 67 – 77. doi: 10.1007/ s00415-006-0281-1.
11. Kalincik T, Jokubaitis V, Izquierdo G et al. Comparative effectiveness of glatiramer acetate and interferon beta formulations in relapsing-remitting multiple sclerosis. Mult Scler 2015; 21(9): 1159 – 1171. doi: 10.1177/ 1352458514559865.
12. Carrá A, Onaha P, Luetic G et al. Therapeutic outcome 3 years after switching of immunomodulatory therapies in patients with relapsing-remitting multiple sclerosis in Argentina. Eur J Neurol 2008; 15(4): 386 – 393. doi: 10.1111/ j.1468-1331.2008.02071.x.
13. Durelli L, Verdun E, Barbero P et al. Every-other-day interferon beta-1b versus once-weekly interferon beta-1a for multiple sclerosis: results of a 2-year prospective randomised multicentre study (INCOMIN). Lancet 2002; 359(9316): 1453 – 1460.
14. Gajofatto A, Bacchetti P, Grimes B et al. Switching first-line disease-modifying therapy after failure: impact on the course of relapsing-remitting multiple sclerosis. Mult Scler 2009; 15(1): 50 – 58. doi: 10.1177/ 1352458508096687.
15. Koch-Henriksen N, Sørensen PS, Christensen T et al. A randomized study of two interferon-beta treatments in relapsing-remitting multiple sclerosis. Neurology 2006; 66(7): 1056 – 1060.
16. Prosperini L, Borriello G, De Giglio L et al. Management of breakthrough disease in patients with multiple sclerosis: when an increasing of Interferon beta dose should be effective? BMC Neurol 2011; 11 : 26. doi: 10.1186/ 1471-2377-11-26.
17. Fox RJ, Miller DH, Phillips JT et al. Placebo-controlled phase 3 study of oral BG-12 or glatiramer in multiple sclerosis. N Engl J Med 2012; 367(12): 1087 – 1097.
18. Miclea A, Leussink VI, Hartung HP et al. Safety and efficacy of dimethyl fumarate in multiple sclerosis: a multi-center observational study. J Neurol 2016; 263(8): 1626 – 1632. doi: 10.1007/ s00415-016-8175-3.
19. Cohen JA, Barkhof F, Comi G et al. Oral fingolimod or intramuscular interferon for relapsing multiple sclerosis. N Engl J Med 2010; 362(5): 402 – 415. doi: 10.1056/ NEJMoa0907839.
20. Trojano M, Tintore M, Montalban X et al. Treatment decisions in multiple sclerosis – insights from real-world observational studies. Nat Rev Neurol 2017; 13(2): 105 – 118. doi: 10.1038/ nrneurol.2016.188.
21. Kalincik T, Butzkueven H. Observational data: Understanding the real MS world. Mult Scler 2016; 22(13): 1642 – 1648.
22. Piťha J. Individualizovaný přístup k léčbě roztroušené sklerózy. Cesk Slov Neurol N 2016; 79/ 112(5): 528 – 533.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článek EditorialČlánek Agresivní léčba intracerebrální hemoragie se snižováním krevního tlaku a indikací operace - ANOČlánek Agresivní léčba intracerebrální hemoragie se snižováním krevního tlaku a indikací operace - NE
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2018 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- CIDP: epidemiológia, klinický obraz a diagnostika v kocke
-
Všetky články tohto čísla
- Editorial
- Detekce nestabilního karotického plátu v prevenci ischemické cévní mozkové příhody
- Agresivní léčba intracerebrální hemoragie se snižováním krevního tlaku a indikací operace - ANO
- Agresivní léčba intracerebrální hemoragie se snižováním krevního tlaku a indikací operace - NE
- Agresívna liečba intracerebrálnej hemoragie so znižovaním krvného tlaku a indikáciou operácie
- Léčba cílená na B lymfocyty – významný pokrok v léčbě roztroušené sklerózy
- Biomarkery progrese onemocnění a prognózy u pacientů s roztroušenou sklerózou
- Možnosti regulace neuroimunitních a neuroendokrinních dějů pomocí fyzioterapie
- Parietální atrofický skór na magnetické rezonanci mozku u normálně stárnoucích osob
- Zobrazení periferních nervů pomocí difuzního tenzoru a MR traktografie
- Rozdíly v klinických, radiologických a léčebných modalitách intramedulárních arachnoidálních cyst a syringomyelie v oblasti krční páteře – 12 případů
- Vzťah medzi intenzitou tinnitu a mierou senzorineurálnej straty sluchu z aspektu prínosu hyperbarickej oxygenoterapie
- Vzťah medzi intenzitou tinnitu a mierou senzorineurálnej straty sluchu z aspektu prínosu hyperbarickej oxygenoterapie
- Antiagregačná a antikoagulačná liečba pri karotickej endarterektómii
- Skoré pooperačné komplikácie po plánovaných operáciách degenerovanej driekovej chrbtice u starších pacientov
- Srovnání účinnosti subkutánně podávaného interferonu β-1a 44 μg, dimetyl fumarátu a fingolimodu v reálné klinické praxi – multicentrická observační studie
- Soubor obrázků s protikladnou náročností pojmenovatelnosti
- Faryngo-cerviko-brachiální varianta Guillain-Barrého syndromu
- Bradykininem indukovaný angioedém po podání tkáňového aktivátoru plazminogenu u akutní cévní mozkové příhody – terapie s nebo bez inhibitoru C1 esterázy
- Oboustranná paréza nervus abducens po úrazu hlavy a krční páteře
- Huntingtonova nemoc se začátkem v seniu – přehlížená diagnóza
- Analýza dat v neurologii - LXX. Kovariance
- Výroční setkání věnované novinkám v léčbě roztroušené sklerózy
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Antiagregačná a antikoagulačná liečba pri karotickej endarterektómii
- Oboustranná paréza nervus abducens po úrazu hlavy a krční páteře
- Zobrazení periferních nervů pomocí difuzního tenzoru a MR traktografie
- Huntingtonova nemoc se začátkem v seniu – přehlížená diagnóza
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



