-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Diagnostika kořenové avulze u poranění brachiálního plexu před chirurgickým výkonem
Autori: Š. Brušáková 1,2; I. Holečková 2; J. Lodin 3; J. Ceé 1; H. Zítek 3; V. Skálová 4; I. Humhej 3
Pôsobisko autorov: Neurologické oddělení, Krajská, zdravotní, a. s., Masarykova nemocnice, v Ústí nad Labem, o. z. 1; Neurochirurgická klinika, LF UK a FN Plzeň 2; Neurochirurgická klinika Fakulty zdravotnických, studií Univerzity, J. E. Purkyně v Ústí nad Labem, a Krajské zdravotní a. s. – Masarykovy, nemocnice v Ústí nad Labem, o. z. 3; Radiologická klinika Fakulty zdravotnických, studií Univerzity J. E. Purkyně, v Ústí nad Labem a Krajské zdravotní, a. s. – Masarykovy nemocnice v Ústí, nad Labem, o. z. 4
Vyšlo v časopise: Cesk Slov Neurol N 2023; 86(4): 231-238
Kategória: Přehledný referát
doi: https://doi.org/10.48095/cccsnn2023231Súhrn
Složitost struktury brachiálního plexu, různorodost lézí a častá přítomnost dalších přidružených poranění vyžadují multidisciplinární diagnostický proces, zahrnující kromě klinického vyšetření použití zobrazovacích a elektrofyziologických metod. Žádný z používaných testů není samostatně pro diagnostiku avulze dostatečně senzitivní ani specifický. Při nesprávné interpretaci může být předoperační diagnóza často chybná. Falešně pozitivní výsledky vedou ke zbytečné či špatně naplánované operaci, falešně negativní způsobují nevratnou morbiditu. Základem diagnostiky zůstává pečlivé klinické vyšetření. Neurofyziologické metody v předoperační fázi zahrnují elektroneurografii, jehlovou elektromyografii a evokované potenciály a hodnotí funkce jednotlivých částí plexu. Zobrazovací vyšetření hodnotí strukturu brachiálního plexu, v praxi je nejčastěji využívána CT perimyelografie, magnetická rezonance nebo jejich kombinace. Článek shrnuje současné metody, jejichž kombinací se zvyšuje senzitivita i specificita předoperačního vyšetření. To umožňuje přesnou identifikaci kandidátů včasné operace bez zbytečné časové prodlevy.
Klíčová slova:
magnetická rezonance – regenerace – plexus brachialis – avulze – kořen – neurotransfer – elektrofyziologie – CT perimyelografie
Úvod
Včasná diagnostika poranění pažní pleteně (brachiálního plexu; BP) a správně časovaný operační výkon s volbou odpovídajícího způsobu rekonstrukce jsou v případě těžkého postižení podmínkou budoucího zlepšení funkcí horní končetiny. Kromě lézí perinatálních (s udávanou četností 0,4–2/1 000 porodů) [1–4] je zdaleka nejčastější příčinou poranění brachiálního plexu dospělých pacientů zavřená trakční léze způsobená vysokoenergetickým traumatem (typicky dopravní nehody), obvykle jako součást rozsáhlejšího polytraumatu.
Dle anatomické lokalizace lze poranění BP členit na pre - a postgangliové. Toto členění je prognosticky rozhodující i pro volbu patřičného operačního postupu. Možnosti chirurgické léčby zahrnují neurolýzu (uvolnění struktur BP z jizev) a rekonstrukci nervových struktur: suturou end to end, rekonstrukcí nervovými štěpy nebo nervovými transfery. V případě postgangliového postižení (axonotméza se zachovalou kontinuitou nervových struktur a formací neuromů až rupturou nervů) je poranění lokalizováno distálněji, chirurg má tedy k dispozici funkční proximální pahýl nervového kořene, který může být použit k rekonstrukci nervovými štěpy. V případě pregangliové léze (avulze, vytržení nervového kořene z míchy) je spontánní regenerace nemožná a jedinou chirurgickou možností je použití nervových transferů (neurotizací) spočívající v přenesení funkčního dárcovského nervu na nefunkčního příjemce. Obecně by měl být primární operační výkon s rekonstrukcí poraněných nervových struktur proveden do šesti měsíců od traumatu, v případě průkazu avulzního poranění dříve, protože u těchto poranění není šance na spontánní regeneraci. S delším časovým odstupem je pak možné provádět další sekundární chirurgické výkony ke zlepšení funkce postižené horní končetiny (šlachové transfery, volné svalové přenosy, ortopedické korekční výkony).
Anatomie
Míšní nervy vycházejí z míchy jako kořenová vlákna (fila radicularia), která se spojují a formují přední a zadní míšní kořen. Oba kořeny se spojují do kmene míšního nervu (nervus spinalis) a vstupují do meziobratlového otvoru (foramen intervertebrale). Na zadním kořenu se nachází spinální ganglion (ganglion spinale) obsahující těla senzitivních pseudounipolárních neuronů. Míšní kořeny jsou až do úrovně výstupu z meziobratlového otvoru uloženy v dura mater, která postupně splývá s epineuriem míšního nervu a tvoří kořenovou pochvu. Připojení nervu ke kostěné drážce mezi tuberculum anterius a posterius processus transversus je jediné kotvení, které jej stabilizuje a chrání slabá fila radicularia před trakčním poraněním. Je dobře vyvinuto zejména pro C5, slabší pro C6 a C7 a nejslabší nebo chybějící pro C8 a Th1, což je příčinou vulnerability dolních kořenů a jejich větší náchylnosti k avulznímu poranění [5]. Přední míšní kořeny jsou eferentní (motorické), zadní aferentní (senzitivní), ač byla prokázána i přítomnost opačně vedoucích vláken v obou kořenech, zejména sakrálních [6]. Po výstupu z meziobratlového otvoru míšní nerv vysílá ramus meningealis pro inervaci mening zpět do páteřního kanálu, rami communicantes (albus a griseus pro propojení se sympatickými ganglii) a nakonec se dělí na dominantní ramus ventralis a slabší ramus dorsalis pro inervaci zádového svalstva a kůže v oblasti páteře. Rami ventrales C5–Th1 formují brachiální plexus (s možností spoluúčasti C4 a Th2, prefixovaný a postfixovaný typ BP) [5,7,8]. Spinální nervy po výstupu z meziobratlového otvoru a před spojením do primárních svazků (trunci) jsou často nazývány kořeny (např. kořen C5). Ačkoliv tato nomenklatura není správná, je běžně užívaná [5].
Mechanizmus avulze
Avulze – vytržení míšního kořene z míchy – je nejtěžším poraněním periferní nervové soustavy. V naprosté většině vzniká působením vysoké energie na oblast ramene nárazem nebo tahem (náraz ramenem ve vyšší rychlosti u motocyklistů, ale i např. u lyžařů, či pádem těžkého předmětu na rameno). Typicky dochází při násilné trakci končetiny směrem dolů a pohybu hlavy a krku od ipsilaterálního ramene (distrakční poranění) k vytržení predominantně horních kořenů, zatímco při násilné abdukci končetiny postihuje avulze spíše kořeny dolní. Obecně se ovšem může týkat jakékoliv úrovně (C4–Th2), vč. panavulzních lézí (avulze všech kořenů formujících BP).
Trakční postižení oblasti spinálního nervu může způsobit poranění všech struktur – míchy, fila radicularia, durální kořenové pochvy i cévních struktur. Vzácně může poškození durální kořenové pochvy s následným únikem mozkomíšního moku mimo durální vak způsobit formaci likvorové pseudocysty (pseudomeningokély) i v případě zachování anatomické a funkční integrity části (parciální avulze) nebo všech kořenových vláken. Nález pseudomeningokély na zobrazovacím vyšetření byl v minulosti považován za průkaz přítomnosti avulze kořene. V současné době platí, že je pouze přímou známkou poranění durální kořenové pochvy trakcí a pouze nepřímým důkazem postižení anatomicky blízkých nervových struktur. I v pseudomeningokéle mohou existovat intaktní a funkční nervová vlákna [4,9–14].
Avulze tedy není fenomén „vše nebo nic“ [14]. Fakt, že mohou nastat různé kombinace parciálních či kompletních lézí (i na úrovni pouze předního nebo zadního míšního kořene) u všech (C4–Th2) kořenů potenciálně formujících BP, vede k velkému počtu kombinací a vzorců jejich poranění. Zatím není dostatečně prozkoumaný klinický význam parciálních avulzí ani není dostupná metoda kvantifikace zbylých funkčních axonů; totéž platí pro hodnocení budoucího regeneračního potenciálu. Jistou perspektivu do budoucna představuje MR traktografie [15]. Tato témata jsou zajímavou oblastí dalšího výzkumu, neboť i částečné ušetření funkčních (zejména motorických) axonů může změnit chirurgický přístup, zejména u velmi těžkých poranění, kde je nedostatek k rekonstrukci použitelných zdravých struktur.
Klinické příznaky podporující diagnózu avulze
Klinické vyšetření pacientů s poraněním BP je vysoce důležité, ale nedokáže samo o sobě spolehlivě rozlišit postižení pre - a postgangliové. Kromě samotného hodnocení trofiky, motoriky, čití a bolesti je dále sledována přítomnost či nepřítomnost Hornerova syndromu, Tinelova příznaku, změn postavení kostěných struktur (lopatka, krční páteř, ramenní kloub) a v indikovaných případech (pravděpodobná avulze C5) hodnocení funkce bránice [3,4,12,16]. Některé z klinických příznaků predikují vyšší pravděpodobnost avulze.
Hodnocení motoriky
Každý sval na horní končetině je zásoben minimálně dvěma kořeny, každý pohyb je zajištěn více svaly (tab. 1). Vyšetření je prováděno pro tzv. klíčové svaly (tab. 2), které mají dominantní, tzv. autonomní, zásobení predilekčně z jednoho kořene. Vstupní motorická síla je klasifikována dle British Medical Research Council (MRC) škály hodnocení svalové síly. U kompletního poškození lze očekávat plný výpad motoriky i senzitivity v daném myotomu a dermatomu (plegie, anestezie).
Tab. 1. Zajištění pohybů horní končetiny (hlavní svaly tučně), hlavní zúčastněné kořeny; vlastní modifikace schémat různých autorů. 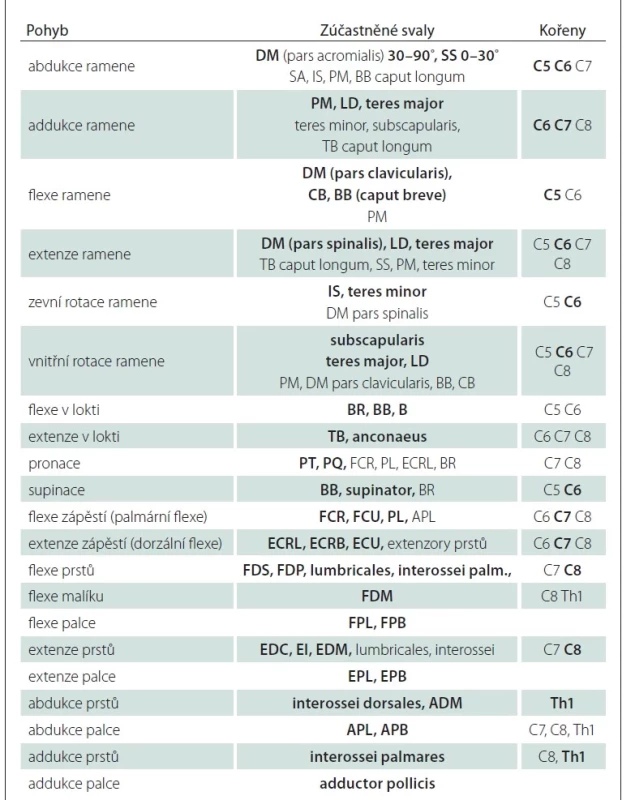
ADM – m. abductor digiti minimi; APB – m. abductor pollicis brevis; APL – m. abductor pollicis longus; B – m. brachialis; BB – m. biceps brachii; BR – m. brachioradialis; CB – m. coracobrachialis; DM – m. deltoideus; ECRB – m. extensor carpi radialis brevis; ECRL – m. extensor carpi radialis longus; ECU – m. extensor carpi ulnaris; EDC – m. extensor digitorum communis; EDM – m. extensor digiti minimi; EI – m. extensor indicis; EPB – m. extensor pollicis brevis; EPL – m. extensor pollicis longus; FCR – m. flexor carpi radialis; FCU – m. flexor carpi ulnaris; FDM – m. flexor digiti minimi; FDP – m. flexor digitorum profundus; FDS – m. flexor digitorum superficialis; FPB – m. flexor pollicis brevis; FPL – m. flexor pollicis longus; IS – m. infraspinatus; LD – m. latissimus dorsi; PL – m. palmaris longus; PM – m. pectoralis major; PQ – m. pronator quadratus; PT – m. pronator teres; SA – m. serratus anterior; SS – m. supraspinatus; TB – m. triceps brachii Tab. 2. Klinické zhodnocení funkce jednotlivých kořenů. 
APB – m. abductor pollicis brevis; B – m. brachialis; BB – m. biceps brachii; BR – m. brachioradialis; D1–5 – prsty 1–5; DM – m. deltoideus; EI – m. extensor indicis; EPL – m. extensor pollicis longus; FCR – m. flexor carpi radialis; FCU – m. flexor carpi ulnaris; FDI – m. interosseus dorsalis I.; FDP – m. flexor digitorum profundus; FDS – m. flexor digitorum superficialis; FPL – m. flexor pollicis longus; IS – m. infraspinatus; LD – m. latissimus dorsi; PT – m. pronator teres; S – m. supinator; SS – m. supraspinatus; TB – m. triceps brachii Protrakční test
Zásadní pro protrakci ramene (pohyb směrem dopředu a mediálně k hrudní stěně) je horní porce m. serratus anterior, inervovaná větvemi n. thoracicus longus odstupujícími přímo z proximálního úseku kořene CS; menší podíl na pohybu mají pektorální svaly. Testování je prováděno vleže na zádech, hodnotíme pohyb ramene dopředu (lopatka od podložky, odpor vyšetřujícího na přední straně ramene). Snažíme se vyloučit pomocnou elevaci (účast trapézu a m. levator scapulae). Dosažení síly M4–M5 hodnotíme jako pozitivní protrakční test. Negativní protrakční test podporuje diagnostiku avulze C5 [12].
Testování mm. rhomboidei
M. rhomboideus major a minor jsou inervovány n. dorsalis scapulae, který také obvykle odstupuje z kořene C5 ještě před jeho spojením s C6 do truncus superior. Jsou obtížněji hmatné (téměř celé jsou překryté trapézem, který je u lézí BP zpravidla nepostižený) a při jejich paréze není deviace lopatky výrazná. Testování (skapulární retrakce, pozice „v pozoru“) je tedy méně spolehlivým testem; při plné plegii je ale pozorovatelný stranový rozdíl. V tomto případě může být nápomocné i provedení jehlové EMG. Dalším důvodem obtížné interpretace funkčnosti mm. rhomboidei je měnlivá účast inervace z C4.
Trofické změny
Atrofie nebývají v časných stádiích po poranění BP znatelné. Postupem času dochází u denervovaných svalů k významné hypotrofii. Je nutné udržovat viabilitu postižených svalů po celou dobu reinervace rehabilitacemi (protahování, udržování pasivního rozsahu pohybu) a elektrostimulacemi. U novorozenců pozorujeme vstupně spíše asymetrii končetinových kožních záhybů než jasné hypotrofie (menší objem svalů, silnější podkoží), u těžších poranění později dochází ke vzniku končetinové hypotrofie (redukce muskuloskeletálního růstu končetiny při denervaci) a dysplázií nezralých kloubů [17].
Vyšetření reflexů
Očekávatelným nálezem je snížení reflexů horní končetiny. Vzácněji můžeme na postižené končetině pozorovat i reflexy zvýšené (přidružená časná nebo pozdní myelopatie u avulzí, současná cerebrální léze u polytraumat, syringomyelie, intra - nebo extradurální kolekce) [18].
Změny postavení kostěných struktur
Nejčastěji pozorovanými abnormitami jsou subluxace ramenního kloubu, typická pro postižení C5,6 nebo n. axillaris, a odstávající lopatka (léze C5,6, n. thoracicus longus, n. dorsalis scapulae) [19]. Je nutné si uvědomit, že u změn postavení lopatky je výraznější nález u lehčích (inkompletních) poranění BP, kdy zachování funkce antagonistů postiženého svalu zvýrazňuje klinický obraz; u kompletních lézí plexu bývá nález nevýrazný. Dále můžeme u avulzí, kdy je porušen i ramus dorsalis, pozorovat cervikální skoliózu, kyfózu až dropped head syndrom [20].
Hodnocení senzitivity
Dermatomy mají ještě větší interindividuální variabilitu než myotomy. Jejich významný překryv plus anatomické variety samotného plexu (pre-, postfixovaný typ) vylučují jednoznačnou lokalizaci léze dle výpadu čití. Vyšetření čití je navíc validní pouze u dospělých pacientů. V souladu s literaturou hodnotíme senzitivní dermatomy vyšetřením čití v oblasti laterální paže (C5), laterálního předloktí a palce (C6), 2. a 3. prstu (C7), malíku (C8) a vnitřního předloktí (Th1).
Hodnocení bolesti
Incidence neuropatické bolesti u avulzí dospělých pacientů je vysoká, dosahující až 95 % [21,22]. Kromě primárního poškození nervových kořenů se na vzniku a progresi neuropatické bolesti podílí i centrální složka související s „odpojením“ (deaferentační bolest); je velmi refrakterní k léčbě a často vyžaduje modulační či ablativní neurochirurgické zásahy.
Tinelův příznak
Jemný poklep na supraklavikulární oblast postižené strany vyvolávající parestezie či bolest vyzařující do oblasti paže (C5) či laterálního předloktí (C6) je považován za pozitivní Tinelův příznak a s vysokou pravděpodobností (80–90 % pro kořen C5) [4,12] znamená přítomnost graftovatelného kořene. Falešná negativita tohoto testu bývá způsobena polohou pahýlu kořene v retroskalenické oblasti [12], falešně pozitivní testování může být způsobeno i zachovalými kořeny C4 nebo C7. Dle práce Landiho a Copelanda [23] je vhodné rozlišovat klasický Tinelův příznak (nebolestivé parestezie v příslušném dermatomu) jako známku růstu senzitivních vláken od bolestivých parestezií, způsobených perkusí neuromu a dráždících nociceptivní aferenty. Toto rozlišení má význam pro prognózu – bolestivé parestezie by měly být pokládány za známku ruptury kořenů spíše než za znak spontánní regenerace.
Hornerův syndrom
Mióza (obrna pupilární dilatace), ptóza (obrna m. tarsalis superior) a anhidrosa jsou příznakem ipsilaterální léze sympatické inervace. Až v 90 % Hornerův příznak odpovídá avulzi C8 a/nebo Th1 [4,12,16]. Ptóza vymizí relativně brzy (kompenzace funkcí m. levator palpebrae superioris), mióza přetrvává měsíce. Jedná se o poruchu dilatace pupily, fotoreakce je tedy normální a anizokorie je lépe viditelná za šera.
Obrna n. phrenicus
N. phrenicus nevychází z brachiálního plexu, ale formuje se z předních větví kořenů C3–5. Obvykle sledujeme jeho lézi nepřímo jako zvýšené postavení a snížené exkurze bránice na postižené straně (mezi nádechem a výdechem pohyb o méně než dva interkostální prostory). Diagnostika se provádí ultrazvukem [24] či RTG. Lze využít i jehlovou EMG, která prokáže denervace v bránici. Avulze kořene C4 může být přítomna u panavulzních poranění plexu. Porucha funkce n. phrenicus byla pozorována i u avulzí C5 (v závislosti na množství C5 vláken v nervu).
Průkaz avulze na zobrazovacím vyšetření
V současné době jsou standardními metodami pro průkaz pregangliového postižení CT perimyelografie (CT PMG) a MR. CT PMG je stále zlatým standardem a zřejmě nejspolehlivější metodou pro vyšetření intradurálního průběhu kořenů. Myelografická klasifikace z roku 1989 [25] člení radiologický nález do šesti typů na základě zobrazení kořenové pochvy, kořenových vláken (fila radicularia) a ev. přítomnosti traumatické pseudomeningokély (obr. 1). Vizualizace zachování fila radicularia (rootlet imprint) je považována za důkaz zachování integrity kořene; srovnání probíhá s nepostiženou stranou. Senzitivita vyšetření je uváděna dle různých autorů 81–95 %, specificita i vyšší [4,10,16,25,26].
Obr. 1. CT C páteře s podáním kontrastní látky do durálního vaku. Patrna kontrastem se plnící nepravidelná pseudomeningokéla plněná přes prostor C6/7 dosahující až mezi mm. scaleni vpravo (šipky).
Fig. 1. CT of the cervical spine with contrast agent administration into the dural sac. A contrast enhanced irregular pseudomeningocele is seen over the C6/7 space and distracting the scaleni muscles on the right (arrows).
MR je v předoperační diagnostice pacientů s poraněním BP používána stále častěji. Kromě klasického zobrazení lze správným nastavením parametrů docílit potlačení signálu tuku i bez podání kontrastní látky a tím ozřejmit poměry v likvorovém kompartmentu (MR myelografie, obr. 2 a 3). Doplňují se dále difuzí vážené obrazy (DWI), které hodnotí kontinuitu nervových struktur v oblasti samotného BP. Na významu získávají tzv. pokročilé techniky MR, tj. MR neurografie a experimentálně i MR traktografie [15]. Za přímý průkaz avulze (totální nebo parciální) jsou při hodnocení MR myelografie považovány změny fila radicularia: přerušení, snížení počtu, chybění, případně ztluštění, způsobené hemosiderinovými depozity na zbývajících vláknech. Ostatní změny (pseudomeningokély, denervační edém paravertebrálních svalů, deviace míchy) jsou pokládány za nálezy nepřímé, avulzi pouze podporující.
Obr. 2. MR obraz likvorové pseudocysty na úrovni C6/7 vpravo (šipka). Tekutina v T2 skenech hyperintenzní.
Fig. 2. MR image of a liquor pseudocyst at C6/7 level on the right (arrow). Hyperintense fluid in T2 scans.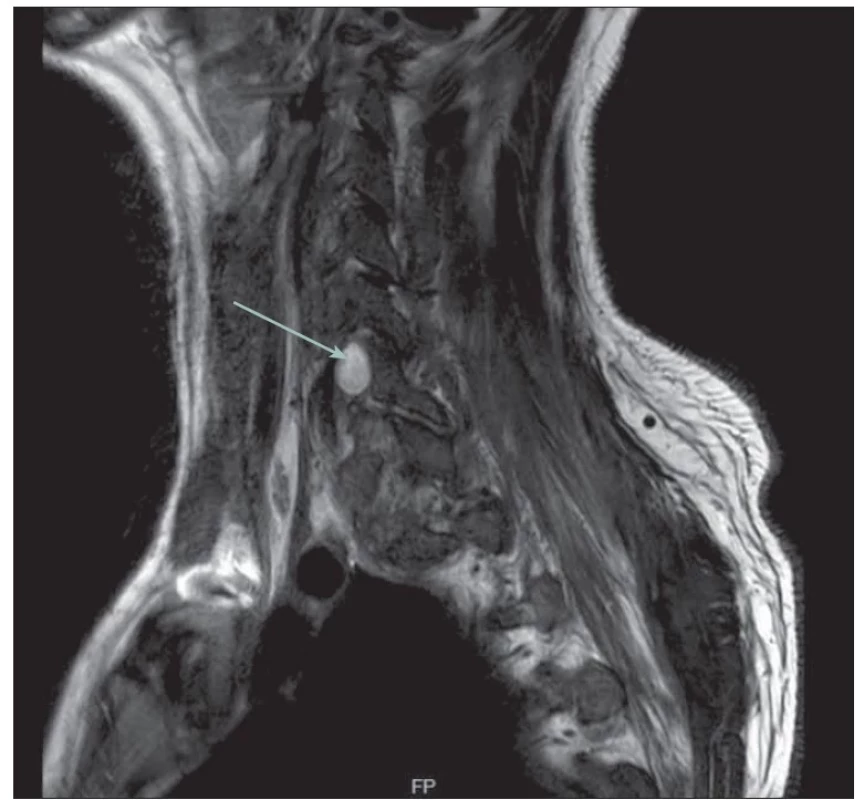
Obr. 3. MR T2 vážený obraz 3D drive sekvence u 3 měsíčního kojence. Likvorové pseudocysty u avulze kořenů C6 a C7 vpravo (šipka).
Fig. 3. MRI T2-weighted image 3D drive sequence a 3-month-old infant. Liquor pseudocysts in C6 and C7 root avulsions on the right (arrow).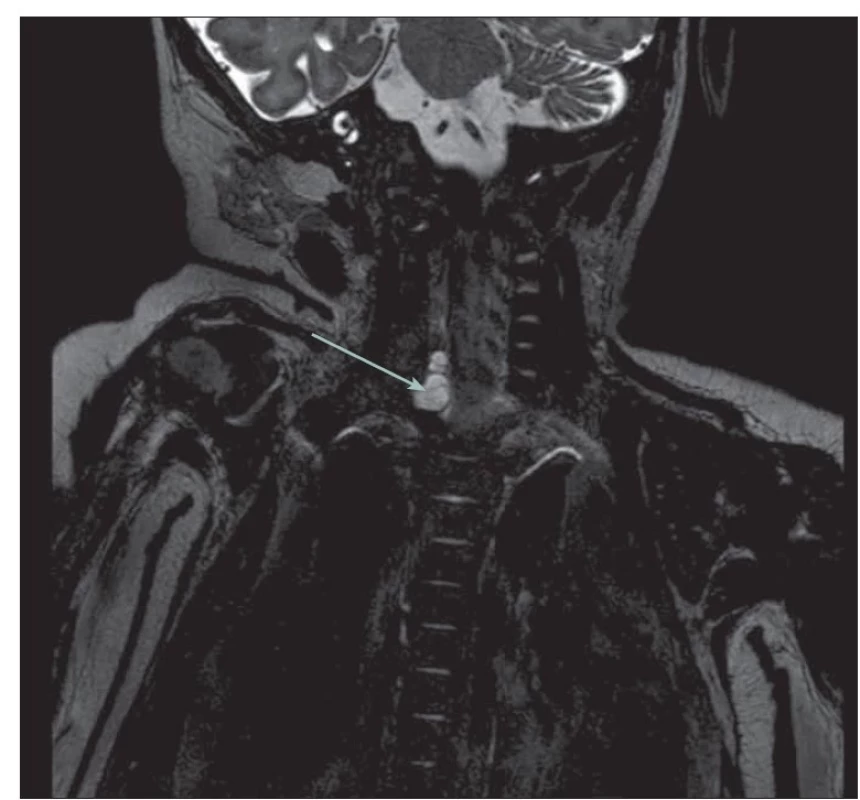
V diagnostice lézí pažní pleteně je v rostoucí míře používán i ultrazvuk, a to zatím jako komplementární vyšetření především u dětí. Jeho výhodou je možnost vyšetření bez sedace. Dokáže identifikovat a lokalizovat především postgangliové postižení oblasti horního a středního trunku [27]. Zlepšování technických parametrů, a tudíž vizualizačních možností, může do budoucna zvýšit jeho využití [28].
Kombinace CT PMG a MR zvyšuje senzitivitu a specificitu záchytu poranění BP. Je otázkou, zda je standardní provádění dvojkombinace vyšetření ospravedlnitelné. Do rozhodnutí je nutné zahrnout radiační riziko a invazivitu (nutnost provedení lumbální punkce s aplikací kontrastní látky) u CT PMG, možné kontraindikace MR, zvyklosti pracoviště, technické vybavení a zkušenost laborantů a popisujících radiologů.
Elektrofyziologický průkaz avulze
Elektrofyziologie hodnotí funkční integritu struktur a dynamiku průběhu procesu případné reinervace. Druhy technik používaných v diagnostice lézí BP (elektroneurografie [ENG], EMG, somatosenzorické – SSEP a motorické – MEP evokované potenciály) a interpretace jejich výsledků jsou široce popsány v dostupné literatuře [29–34].
Elektrofyziologický průkaz avulze kořene je založen na průkazu kompletní motorické léze v myotomu spolu s výbavností senzitivního potenciálu (dendrity periferního senzitivního nervu zůstávají ve spojení s tělem ve spinálním gangliu) při kompletním výpadu čití v příslušném dermatomu (tab. 2).
V naprosté většině je v době prvního vyšetření (cca 3 týdny až 3 měsíce po poranění) u pacientů s avulzním poraněním přítomna klinicky těžká léze celého plexu s funkční plegií končetiny nebo zachovanou zbytkovou hybností pouze některých segmentů (horní/dolní). Zásadní úlohou vstupní elektrofyziologie je rozlišit, zda se jedná o kompletní či inkompletní lézi v každém segmentu, a určit, zda je výbavný senzitivní neurogram.
Rozsáhlá vyšetření jsou kontraproduktivní; s délkou vyšetření klesají tolerance a spolupráce pacientů a výtěžnost není úměrná časové náročnosti. U pacientů s těžkými nebo kompletními lézemi je vzhledem k anestezii či hypestezii lépe tolerováno jehlové vyšetření končetinových svalů než vyšetření svalů lopatkových, paravertebrálních či hrudních (m. pectoralis major, m. serratus anterior). Pro hodnocení horní porce m. serratus anterior většinou využíváme klinický protrakční test. Pro mm. rhomboidei je provedení jehlové EMG výhodné k verifikaci motorické funkce kořene C5, nejlépe v oblasti dolního úhlu lopatky (2–3 cm od dolního úhlu lopatky na mediální hraně), kde není m. rhomboideus major krytý trapézem. V navigaci je možné pomoci si ultrazvukem [35]. Elektrická stimulace, zejména v oblasti Erbova bodu, je hůře tolerována než stimulace magnetická (MEP). K orientačnímu posouzení motorických funkcí využíváme MEP klíčových svalů (m. deltoideus, biceps brachii, triceps brachii, abductor pollicis brevis, abductor digiti minimi), poskytující užitečnou informaci o funkci proximálních částí plexu. EMG paraspinálních svalů i přes její výtěžnost většinou neprovádíme, neboť stejnou informaci (denervační edém svalů) získáme z MR [36,37].
SSEP sice verifikují výši léze, ale vzhledem k cílení operačního výkonu na obnovu motorických funkcí předoperačně neposkytují zásadní informace. Ani využití speciálních metodik (např. kožní perioda útlumu) se neukázalo být lokalizačně přínosné [31,32].
Interpretace předoperačních elektrofyziologických výsledků by měla být opatrná s vědomím existence parciálních a double crush lézí, plurisegmentální inervace, anatomické variability a možných technických problémů (zejména při vyšetření kojenců). Avulze se může týkat pouze ventrálních či pouze dorzálních fila radicularia, což je fakt vysvětlující diagnostické rozpaky při interpretaci elektrofyziologických výsledků (např. výbavný senzitivní potenciál s výpadem senzitivity v dermatomu při zachovalé motorice). Téměř u všech dětí s porodním poraněním BP, vč. nejtěžších typů s avulzemi, dochází elektrofyziologicky ke zlepšování nálezu, které však nemusí být doprovázeno odpovídajícím zlepšením klinickým. Výsledky elektrofyziologických vyšetření je tedy vždy nutno korelovat s klinikou a zobrazovacím vyšetřením.
Souhrn užitečných klinických a elektrofyziologických známek pro diagnostiku pre - a postgangliové léze ukazuje tab. 3.
Tab. 3. Klinické a elektrofyziologické známky podporující diagnózu avulze u jednotlivých kořenů. 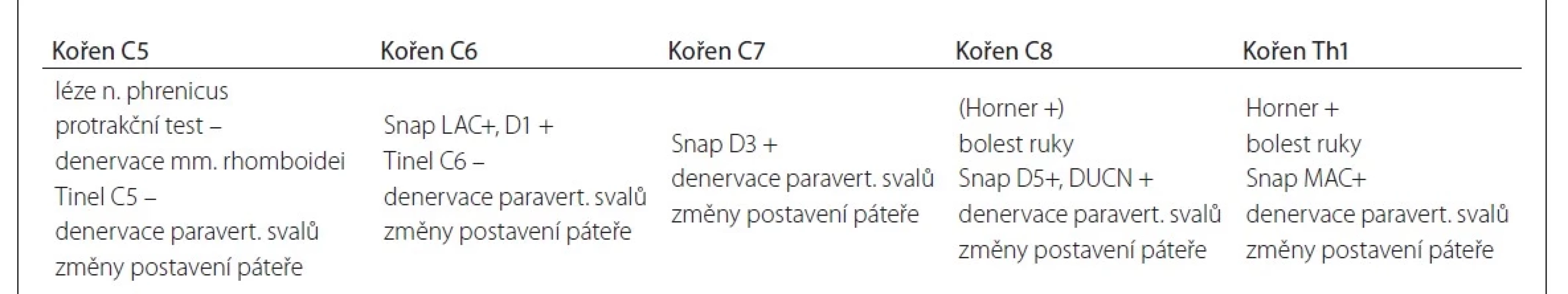
D1–5 – prst 1–5; DUCN – r. dorsalis nervi ulnaris; LAC – n. cutaneus antebrachii lateralis; MAC – n. cutaneus antebrachii medialis; Snap – sumační akční potenciál senzitivního nervu Diskuze
MR má dominantní roli v diagnostice poškození měkkých tkání a jasnou superioritu oproti CT v hodnocení průběhu struktur BP; v hodnocení intradurálního průběhu nervových kořenů však při použití běžných protokolů nedosahuje senzitivity a specificity vyšetření CT PMG [4,9,38]. Výsledky studií, které hodnotí diagnostickou přesnost zobrazovacích vyšetření, používají různý hodnotící standard a jsou často protichůdné. Metaanalýza diagnostické přesnosti MR pro detekci avulzí plexu [13] hodnotila 11 studií s celkem 275 pacienty (1992–2016) a prokázala průměrnou senzitivitu MR pro avulzi kořene 93 % a specificitu 72 %. Přesnost samotné MR se tedy v současné době zdá být pro chirurgické plánování nedostatečná. Autoři Elsakka et al. [11] uvádějí na svém souboru 100% senzitivitu a 97,1% specificitu při využití speciálního protokolu MR (3D-T2-DRIVE), soubor ovšem zahrnuje pouze 24 pacientů. Do budoucna lze jistě předpokládat technický pokrok, vyšší rozlišení a standardizaci použitých protokolů. Osobně se domníváme, že vzhledem k relativně malému počtu pacientů s poraněným BP, závažnosti těchto poranění a důležitosti co nejpřesnější předoperační diagnostiky v plánování dalšího terapeutického postupu je v tuto chvíli odůvodnitelná kombinace CT PMG a MR.
Za referenční standard hodnocení senzitivity a specificity zobrazovacích vyšetření je stále považována chirurgická explorace. Ta není srovnatelná mezi jednotlivými pracovišti – zdaleka ne všichni operatéři revidují foraminální oblast, či dokonce intradurální průběh fila radicularia pro neodůvodnitelnou invazivitu. Takto mohou být za „intaktní“ považovány kořeny, které, ač vytržené z míchy, nejsou retrahovány, protože jsou fibrotickými změnami přijizveny k meziobratlovým otvorům. V takovém případě je řešením použití intraoperační elektrofyziologie s průkazem zachované či porušené vodivosti nervových vláken. Ani její protokoly ovšem nejsou standardizovány.
Zachované kořeny mají různý regenerační potenciál, parametr zachování kořene (či dárcovského nervu) tedy negarantuje dobrý výsledek operační léčby a naopak – nedobře probíhající reinervace neznamená špatnou chirurgickou techniku. Přerušení nervu vede ke složitým strukturálním a funkčním změnám nervové buňky, proximálního i distálního pahýlu, efektorů a terminálních zakončení [39–41]. Výsledek regenerace tak závisí na mnoha dějích, z nichž známe jen některé jasně ovlivňující funkční výsledek (věk, typ poranění, časování operace, druh poraněného nervu, lokalizace a stupeň poškození). Významnou roli hrají zajisté také přidružená poranění, kvalita pooperační péče, rehabilitace a compliance pacienta. Přesto v současné době neexistuje jasná možnost predikce funkčního výsledku. Do procesu vstupují další proměnné (regenerační potenciál nervu, centrální reorganizační plasticita a další), na jejichž ovlivnění (biofeedback, mirror terapie, virtuální realita, svalové stimulanty, virové vektory, podpora axonálního sproutingu) je cílen současný výzkum [42–45].
Závěr
Zásadní otázkou, kterou je po poranění BP potřeba zodpovědět, je, zda existuje potenciál ke spontánní úpravě, nebo je potřebná rekonstrukční operace.
Kombinace klinického a grafického vyšetření zvyšuje přesnost předoperační diagnostiky typu poranění BP na 90 a více % [12]. S využitím elektrofyziologického vyšetření je korelace s peroperačním nálezem ještě vyšší. V diagnostice je užitečné zaměřit se na vyšetření svalů, které jsou inervovány nervy odstupujícími z proximálních úseků míšních nervů ještě před formací primárních svazků. Jedná se o svaly zásobené dorzální větví spinálního nervu (paravertebrální svaly), bránici, m. serratus anterior a mm. rhomboidei.
Zvýšení senzitivity předoperačního vyšetření kombinací výše uvedených testů umožňuje lépe selektovat pacienty, u kterých je vysoká šance na spontánní úpravu, a tak se potenciálně vyhnout nepotřebné explorativní operaci (redukce morbidity, nákladů), případně rovnou, bez časové ztráty, provést rekonstrukci poraněného BP štěpy či nervovými transfery.
Grantová podpora
Tato práce byla podpořena grantem IGA KZ 217112007.
Konflikt zájmů
Autoři deklarují, že v souvislosti s touto prací nemají žádný konflikt zájmů.
MUDr. Štěpánka Brušáková
Neurologické oddělení
Krajská zdravotní, a.s.,
Masarykova nemocnice
v Ústí nad Labem, o.z.
Sociální péče 3316
400 11 Ústí nad Labem
e-mail: stepanka.brusakova@kzcr.euPřijato k recenzi: 31. 3. 2023
Přijato do tisku: 29. 6. 2023
Zdroje
1. Van der Looven R, Le Roy L, Tanghe E et al. Risk factors for neonatal brachial plexus palsy: a systematic review and meta-analysis. Dev Med Child Neurol 2020; 62 (6): 673–683. doi: 10.1111/dmcn.14381.
2. O’Berry P, Brown M, Phillips L et al. Obstetrical brachial plexus palsy. Curr Probl Pediatr Adolesc Health Care 2017; 47 (7): 151–155. doi: 10.1016/j.cppeds.2017.06.003.
3. Shah V, Coroneos CJ, Ng E. The evaluation and management of neonatal brachial plexus palsy. Paediatr Child Health 2021; 26 (8): 493–497. doi: 10.1093/pch/ pxab083.
4. Haninec P, Kaiser R. Operační léčba poranění plexus brachialis. Cesk Slov Neurol N 2011; 74/107 (6): 619–630.
5. Russell S. Brachial plexus anatomy. In: Examination of peripheral nerve injuries: an anatomical approach. New York: Thieme 2015 : 85–138.
6. Schalow G. Ventral root afferent and dorsal root efferent fibres in dog and human lower sacral nerve roots. Gen Physiol Biophys 1992; 11 (1): 123–131.
7. Guday E, Bekele A, Muche A. Anatomical study of prefixed versus postfixed brachial plexuses in adult human cadaver. ANZ J Surg 2017; 87 (5): 399–403. doi: 10.1111/ans.13534.
8. Pellerin M, Kimball Z, Tubbs RS et al. The prefixed and postfixed brachial plexus: a review with surgical implications. Surg Radiol Anat 2010; 32 (3): 251–260. doi: 10.1007/s00276-009-0619-3.
9. Wade RG, Takwoingi Y, Wormald JCR et al. Magnetic resonance imaging for detecting root avulsions in traumatic adult brachial plexus injuries: protocol for a systematic review of diagnostic accuracy. Syst Rev 2018; 7 (1): 76. doi: 10.1186/s13643-018-0737-2.
10. Laohaprasitiporn P, Wongtrakul S, Vathana T et al. Is pseudomeningocele an absolute sign of root avulsion brachial plexus injury? J Hand Surg Asian Pac Vol 2018; 23 (3): 360–363. doi: 10.1142/S2424835518500376.
11. Elsakka TO, Kotb HT, Farahat AA et al. Axial T2-DRIVE MRI myelography is highly accurate in diagnosing preganglionic traumatic brachial plexus injuries: why pseudomeningoceles should not be used as a primary diagnostic sign. Clin Radiol 2022; 77 (5): 377–383. doi: 10.1016/j.crad.2022.01.052.
12. Bertelli JA, Ghizoni MF. Use of clinical signs and computed tomography myelography findings in detecting and excluding nerve root avulsion in complete brachial plexus palsy. J Neurosurg 2006; 105 (6): 835–842. doi: 10.3171/jns.2006.105.6.835.
13. Wade RG, Takwoingi Y, Wormald JCR et al. MRI for detecting root avulsions in traumatic adult brachial plexus injuries: a systematic review and meta-analysis of diag - nostic accuracy. Radiology 2019; 293 (1): 125–133. doi: 10.1148/radiol.2019190218.
14. Smith BW, Chang KWC, Parmar HA et al. MRI evaluation of nerve root avulsion in neonatal brachial plexus palsy: understanding the presence of isolated dorsal/ventral rootlet disruption. J Neurosurg Pediatr 2021; 27 (5): 589–593. doi: 10.3171/2020.9.PEDS20326.
15. Humhej I, Ibrahim I, Sameš M et al. Zobrazení periferních nervů pomocí difuzního tenzoru a MR traktografie. Cesk Slov Neurol N 2018; 81/114 : 420–426. doi: 10.14735/amcsnn2018csnn.eu3.
16. Sakellariou VI, Badilas NK, Mazis GA et al. Brachial plexus injuries in adults: evaluation and diagnostic approach. ISRN Orthop 2014; 2014 : 726103. doi: 10.1155/2014/726103.
17. Ruoff JM, van der Sluijs JA, van Ouwerkerk WJ et al. Musculoskeletal growth in the upper arm in infants after obstetric brachial plexus lesions and its relation with residual muscle function. Dev Med Child Neurol 2012; 54 (11): 1050–1056. doi: 10.1111/j.1469-8749.2012.04383.x.
18. Clifton WE, Stone JJ, Kumar N et al. Delayed myelopathy in patients with traumatic preganglionic brachial plexus avulsion injuries. World Neurosurg 2019; 122: e1562–e1569. doi: 10.1016/j.wneu.2018.11.102.
19. Raksakulkiat R, Leechavengvongs S, Malungpaishrope K et al. Restoration of winged scapula in upper arm type brachial plexus injury: anatomic feasibility. J Med Assoc Thai 2009; 92 (Suppl 6): S244–S250.
20. Kumar A, Leodante D. Dropped head syndrome in brachial plexus injury: a technical note. Neurol India 2017; 65 (2): 411–413. doi: 10.4103/neuroindia.NI_1160_15.
21. Lovaglio AC, Socolovsky M, Di Masi G et al. Treatment of neuropathic pain after peripheral nerve and brachial plexus traumatic injury. Neurol India 2019; 67 (Suppl): S32–S37. doi: 10.4103/0028-3886.250699.
22. Teixeira MJ, da Paz MG, Bina MT et al. Neuropathic pain after brachial plexus avulsion – central and peripheral mechanisms. BMC Neurol 2015; 15 : 73. doi: 10.1186/s12883-015-0329-x.
23. Landi A, Copeland S. Value of the Tinel sign in brachial plexus lesions. Ann R Coll Surg Engl 1979; 61 (6): 470–471.
24. Fayssoil A, Behin A, Ogna A et al. Pathophysiology and ultrasound imaging in neuromuscular disorders. J Neuromuscul Dis 2018; 5 (1): 1–10. doi: 10.3233/JND-170276.
25. Nagano A, Ochiai N, Sugioka H et al. Usefulness of myelography in brachial plexus injuries. J Hand Surg Br 1989; 14 (1): 59–64. doi: 10.1016/0266-7681 (89) 90 017-x.
26. Abul-Kasim K, Backman C, Björkman A et al. Advanced radiological work-up as an adjunct to decision in early reconstructive surgery in brachial plexus injuries. J Brachial Plex Peripher Nerve Inj 2010; 5 : 14. doi: 10.1186/1749-7221-5-14.
27. Gunes A, Bulut E, Uzumcugil A et al. Brachial plexus ultrasound and MRI in children with brachial plexus birth injury. AJNR Am J Neuroradiol 2018; 39 (9): 1745–1750. doi: 10.3174/ajnr.A5749.
28. Gu S, Zhao Q, Yao J et al. Diagnostic ability of ultrasonography in brachial plexus root injury at different stages post-trauma. Ultrasound Med Biol 2022; 48 (6): 1122–1130. doi: 10.1016/j.ultrasmedbio.2022.02. 013.
29. Wiertel-Krawczuk A, Huber J. Standard neurophysiological studies and motor evoked potentials in evaluation of traumatic brachial plexus injuries – a brief review of the literature. Neurol Neurochir Pol 2018; 52 (5): 549–554. doi: 10.1016/j.pjnns.2018.05.004.
30. Antonovich D, Dua A. Electrodiagnostic evaluation of brachial plexopathies. Treasure Island (FL): StatPearls Publishing 2022.
31. Burkholder LM, Houlden DA, Midha R et al. Neurogenic motor evoked potentials: role in brachial plexus surgery. Case report. J Neurosurg 2003; 98 (3): 607–610. doi: 10.3171/jns.2003.98.3.0607.
32. Vasko P, Bocek V, Mencl L et al. Preserved cutaneous silent period in cervical root avulsion. J Spinal Cord Med 2017; 40 (2): 175–180. doi: 10.1179/2045772315Y.0000000053.
33. Vaško P, Leis A, Boček V et al. Neurofyziologická vyšetření u traumatických lézí brachiálního plexu. Cesk Slov Neurol N 2016; 79/112 (5): 595–599.
34. Krishnan KR, Sneag DB, Feinberg JH et al. Localization of brachial plexopathies using a novel diagnostic program. HSS J 2022; 18 (1): 78–82. doi: 10.1177/1556331 6211001358.
35. Kim KH, Kim GY, Lim SG et al. A more precise electromyographic needle approach for examination of the rhomboid major. PM R 2018; 10 (12): 1380–1384. doi: 10.1016/j.pmrj.2018.05.009.
36. Uetani M, Hayashi K, Hashmi R et al. Traction injuries of the brachial plexus: signal intensity changes of the posterior cervical paraspinal muscles on MRI. J Comput Assist Tomogr 1997; 21 (5): 790–795. doi: 10.1097/00004728-199709000-00026.
37. Balakrishnan G, Kadadi BK. Clinical examination versus routine and paraspinal electromyographic studies in predicting the site of lesion in brachial plexus injury. J Hand Surg Am 2004; 29 (1): 140–143. doi: 10.1016/j.jhsa.2003.08.004.
38. Bordalo-Rodrigues M, Siqueira MG, Kurimori CO et al. Diagnostic accuracy of imaging studies for diagnosing root avulsions in post-traumatic upper brachial plexus traction injuries in adults. Acta Neurochir (Wien) 2020; 162 (12): 3189–3196. doi: 10.1007/s00701-020-04465-9.
39. Menorca RM, Fussell TS, Elfar JC. Nerve physiology – mechanisms of injury and recovery. Hand Clin 2013; 29 (3): 317–330. doi: 10.1016/j.hcl.2013.04.002.
40. Gordon T, English AW. Strategies to promote peripheral nerve regeneration: electrical stimulation and/or exercise. Eur J Neurosci 2016; 43 (3): 336–350. doi: 10.1111/ejn.13005.
41. Kaiser R, Haninec P. Degeneration and regeneration of the peripheral nerve. Cesk Fysiol 2012; 61 (1): 9–14.
42. Gordon T, Amirjani N, Edwards DC et al. Brief post-surgical electrical stimulation accelerates axon regeneration and muscle reinervation without affecting the functional measures in carpal tunnel syndrome patients. Exp Neurol 2010; 223 (1): 192–202. doi: 10.1016/j.expneurol.2009.09.020.
43. Nordmark PF, Johansson RS. Disinhibition of human primary somatosensory cortex after median nerve transection and reinnervation. Front Hum Neurosci 2020; 14 : 166. doi: 10.3389/fnhum.2020.00166.
44. Krarup C, Boeckstyns M, Ibsen A et al. Remodeling of motor units after nerve regeneration studied by quantitative electromyography. Clin Neurophysiol 2016; 127 (2): 1675–1682. doi: 10.1016/j.clinph.2015.08.008.
45. Feger MA, Isaacs J, Mallu S et al. Follistatin protein enhances satellite cell counts in reinnervated muscle. J Brachial Plex Peripher Nerve Inj 2022; 17 (1): e12–e21. doi: 10.1055/s-0042-1748535.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2023 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Editorial
- Diagnostika kořenové avulze u poranění brachiálního plexu před chirurgickým výkonem
- Klonální hematopoéza neurčitého potenciálu je možná a dosud nepopsaná příčina cévní mozkové příhody
- Zrakové evokované potenciály lze vyšetřit novým mobilním přístrojem kdekoliv
- Výsledky léčby aneuryzmatického subarachnoidálního krvácení u seniorů
- Psychometrická validácia dotazníka MSQOL-54 na Slovensku – pilotná štúdia
- Efekt dvojího úkolu na rychlost chůze u starších jedinců s kognitivním poklesem
- Neuralgická amyotrofie asociovaná s hepatitidou E jako vzácná příčina dyspnoe
- Anti-HMGCR pozitivní imunitně zprostředkovaná nekrotizující myopatie
- Manažment pacientov s roztrúsenou sklerózou liečených perorálnym kladribínom po štyroch rokoch od začiatku liečby
- Vyšetrenie ľahkého reťazca neurofilamentu v krvi pacientov s roztrúsenou sklerózou
- Kleinová L, Cerman J, Hlávka J et al. Nové farmakologické možnosti v léčbě Alzheimerovy nemoci.
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Psychometrická validácia dotazníka MSQOL-54 na Slovensku – pilotná štúdia
- Diagnostika kořenové avulze u poranění brachiálního plexu před chirurgickým výkonem
- Klonální hematopoéza neurčitého potenciálu je možná a dosud nepopsaná příčina cévní mozkové příhody
- Anti-HMGCR pozitivní imunitně zprostředkovaná nekrotizující myopatie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



