Delirium a spánek v intenzivní péči I – epidemiologie, rizikové faktory a důsledky
Autori:
M. Kovář 1,2,5; J. Bednařík 3,5; L. Bakošová 3,5; D. Kec 3,5; E. Klabusayová 1,2,5; T. Bönischová 1,2,5; J. Klučka 1,2,5; J. Maláska 1,2,4,5
Pôsobisko autorov:
Klinika dětské anesteziologie a resuscitace FN Brno
1; Ústav simulační medicíny, LF MU Brno
2; Neurologická klinika FN Brno
3; II. Anesteziologicko-resuscitační oddělení, FN Brno
4; LF MU, Brno
5
Vyšlo v časopise:
Cesk Slov Neurol N 2023; 86(5): 299-303
Kategória:
Přehledný referát
doi:
https://doi.org/10.48095/cccsnn2023299
Súhrn
Špatná kvalita spánku a rozvoj deliria jsou časté komplikace v intenzivní péči. Incidence obou komplikací je vysoká a pohledem medicíny založené na důkazech jsou v obou případech signifikantně prokázané závažné konsekvence. Stran deliria je k dispozici více dat, zatímco u zhoršené kvality spánku je i vzhledem k technickým limitacím monitorace a diagnostiky významný prostor k dalšímu výzkumu. Tento článek shrnuje data, která jsou k dispozici stran epidemiologie a rizikových faktorů snížené kvality spánku i deliria v prostředí intenzivní péče.
Klíčová slova:
intenzivní péče – spánek – delirium – rizikové faktory – výsledky intenzivní péče
Úvod
Delirium je častá komplikace na jednotkách intenzivní péče (JIP) s prevalencí až cca 31 % [1]. Špatná kvalita spánku v intenzivní péči byla zaznamenána u cca jedné třetiny pacientů bez sedace a až u 60–97 % sedovaných pacientů [2,3]. Navzdory vysoké prevalenci je identifikace rizikových faktorů, krátkodobých i dlouhodobých důsledků klinickou výzvou [4,5]. Velká recentní studie s 5 936 pacienty prokázala asociaci deliria s rizikem vyšší mortality v prvních 30 dnech po propuštění z nemocnice a zároveň výskyt deliria během hospitalizace na JIP zvýšil riziko nutnosti opakované hospitalizace nebo nutnosti ošetření na pohotovosti či urgentním příjmu [6]. Realitu klinické praxe v diagnostice deliria reflektuje recentní dotazníková studie prováděná na pracovištích v ČR. Odhadovaná prevalence deliria u pacientů s iktem široce kolísá mezi 5–60 %, což autoři porovnávají s daty světové literatury (10–48 %) [7].
Spánek – obecně
Pacienti s akutní spánkovou deprivací (SD) projevují sníženou psychomotorickou výkonnost a zhoršení krátkodobé paměti [8]. SD ve studii na zdravých dospělých vedla k poruchám nálady, rozvoji úzkosti, depresi, podrážděnosti a k paranoii [9]. Dle dostupného systematického review se již po jednom dni SD začínají projevovat psychopatologické symptomy: po 24–48 h zkreslené vnímání (konkrétně ve vizuální modalitě v 90 %, somatosenzorické v 52 % a sluchové v 33 %), úzkost, podrážděnost, časová dezorientace a depersonalizace. Po 48–90 h pak komplexní halucinace a poruchy myšlení. Po 72 h se projevují bludy a klinický obraz se podobá akutní psychóze či deliriu [10]. Delirium je kvalitativní porucha vědomí, která se projevuje akutní poruchou pozornosti, v průběhu času kolísá a je doprovázena změnou kognitivního výkonu a změnami psychomotorické aktivity [11].
Během spánku dochází k cyklickému střídání několika stadií spánku. Tento cyklus trvá cca 90–110 min [12] a během noci se opakuje čtyřikrát až pětkrát. Střídání spánku a bdění je kontrolováno cirkadiánním regulačním systémem a homeostatickým procesem spánku. Hlavní pacemaker cirkadiánního systému se nachází v suprachiasmatickém jádře v hypotalamu. Cirkadiánní regulační systém je zodpovědný za řadu biologických procesů vč. endokrinní regulace některých hormonů, jako jsou kortizol, tyreotropní hormon a růstový hormon. Hladina kortizolu je nejnižší o půlnoci, 2–3 h od začátku spánku jeho hladina postupně roste do jeho ranního maxima. Největší puls růstového hormonu je během první N3 fáze spánku [13]. Hlavním hormonem, který se ale podílí na řízení cyklu spánku a bdění, je melatonin. Jelikož produkce tohoto hormonu navíc s věkem klesá, předpokládá se, že deficit melatoninu je alespoň částečně zodpovědný za poruchy spánku. Léčba tohoto deficitu souvisejícího s věkem se proto jeví jako přirozený způsob obnovy kvality spánku [14]. Homeostatický proces spánku je naopak ovlivněn délkou předchozí bdělosti. Dlouhé trvání bdělosti vytváří silný signál a zvýšenou potřebu spánku [15].
U zdravých dobrovolníků SD ovlivňuje imunitu a zánětlivou odpověď. Např. modifikuje cirkadiánní oscilace koncentrace kortizolu, která se po ukončení SD adaptuje během cca 5 dní [16]. Několik dní trvající SD také snižuje hladinu thyreotropního hormonu, i když paradoxně první noc jsou hladiny thyreotropní osy zvýšené [17].
Dále SD zvyšuje počet leukocytů, zejména neutrofilů, zvyšuje hladinu kortizolu, inzulinovou rezistenci a zvyšuje aktivitu sympatiku [18]. Těmito mechanizmy SD zvyšuje riziko rozvoje arteriální hypertenze a indukuje rozvoj metabolického syndromu. Zvýšené večerní hladiny kortizolu během SD mohou vyvolávat poruchy paměti. K analogickým změnám paměti dochází ve stáří.
Stadia a parametry spánku
Pomocí polysomnografie (PSG) v průběhu spánku u zdravého dospělého jedince rozlišujeme na podkladě hodnocených změn mozkové aktivity, svalového tonu a pohybu očí tzv. non-rapid eye movement (NREM) a rapid eye movement (REM) spánek. NREM se dále dělí na tři stadia označovaná N1–3. Při N1 se jedná o lehký spánek s pomalým pohybem očí a vyšším tonem svalů. Při N2 se zastavuje pohyb očí a mozková aktivita na EEG se zpomaluje, svalový tonus klesá.
Pro skórování epochy spánku jako N2 je podmínkou přítomnost alespoň jednoho spánkového vřeténka (sleep spindle) a/nebo alespoň jednoho K-komplexu (K-complex). Spánkové vřeténko je definováno jako aktivita o frekvenci 11–16 Hz (nejčastěji 12–14 Hz) vřetenovitého (sinusoidálního) charakteru o trvání minimálně 0,5 s, charakteristicky nejvíce vyjádřená v centrálních regionech. K-komplex je definován jako negativní ostře konturovaná vlna s následnou pozitivní komponentou přesahující 0,5 s. Nejméně probudný je člověk při prvním NREM cca hodinu po usnutí. V rámci jednoho spánkového cyklu je člověk méně probudný ve fázi N3. Slow wave spánek je definován dle Americké akademie spánkové medicíny (American Academy of Sleep Medicine; AASM) přítomností vln o frekvenci 0,5–2,0 Hz o amplitudě přesahující 75 µV na EEG. Svou frekvencí odpovídají vlnám delta (definovány 0–4 Hz), a proto někdy v českém prostředí používáme termín delta spánek. Epocha stadia N3 je definována dle AASM jako přítomnost aktivit slow wave (pomalých vln, jak definováno výše) v ≥ 20 % dané epochy. Přítomnost tranzientů (charakteristických pro N2) v průběhu N3 je běžná [19]. Při N3 může být ještě zaznamenána nízká tonická svalová aktivita (k pohybům nedochází) dle EMG. Během REM spánku elektrookulografie (EOG) zaznamenává rychlý pohyb očí, mohou být i drobné záškuby mimického svalstva a zvyšuje se dechová i srdeční frekvence, je však plná svalová atonie [20]. Kromě již zmíněných EEG, EOG a EMG patří do PSG i monitorace EKG, pulzní oxymetrie, měření dechového úsilí, proudění vzduchu nosem, záznam chrápání a záznam pohybu těla a zvuku vč. kamery s nočním viděním.
Spánek na JIP
Přestože celkový čas spánku na JIP je stejný nebo jen mírně redukovaný, jeho distribuce se u hospitalizovaných na JIP značně liší. Pacienti na JIP mají spánek fragmentovaný do krátkých period a až 50 % doby spánku probíhá během dne [21]. Tímto vzniká nesoulad mezi cirkadiánním regulačním systémem a homeostatickým procesem spánku [22]. Dále jsou poruchy spánku v prostředí JIP charakterizovány prodloužením délky lehkého spánku (stupně N1 a N2) a zkrácením délky N3 stadia a REM spánku [23].
Je prokázána asociace mezi poruchou spánku a rozvojem deliria [24], mezi poruchou spánku a delší dobou na umělé plicní ventilaci (UPV) [25] a predikcí selhání neinvazivní umělé ventilace (NIV) u pacientů přijatých s globální respirační insuficiencí [26]. Spánková deprivace snižuje ventilační odpověď na hypoxemii a hyperkapnii [25]. Závažná hyperkapnie působí hypnoticky, prohlubuje hypoxii a ještě více negativně ovlivňuje cirkadiánní rytmus.
Epidemiologie spánku na JIP
U pacientů bez sedace nebo pouze s lehkou sedací bývá abnormální záznam na PSG v cca 23–31 % a u sedovaných pacientů je prevalence abnormity v 60–97 % [2,27]. Abnormitou v PSG je míněna odchylka od standardního záznamu PSG, charakteristiky normálního polysomnografu a hodnocení abnormit je možno hodnotit dle standardních hodnoticích nástrojů, např. Skórovacího manuálu AASM [28].
Variabilitu prevalence abnormálního PSG záznamu vysvětluje přítomnost faktorů (např. sedace, sepse a delirium), o nichž je známo, že generují neobvyklé vzorce spánkového elektroencefalogramu [23]. Při užití jiných metod monitorace spánku jako aktigrafie a Richards-Campbell Sleep Questionnaire (RCSQ) byla prevalence nekvalitního spánku 47 % (RCSQ < 50), u podskupiny pacientů na UPV dosáhla až 66 % oproti 33 % v podskupině bez UPV [3].
Epidemiologie deliria na JIP
Recentní metaanalýza, která zahrnovala 48 studií, uvádí souhrnnou prevalenci deliria 31 %. Prevalence jednotlivých motorických podtypů deliria byla následující: hyperaktivní (4 %), hypoaktivní (17 %) a smíšená (10 %) [1].
Z českého prostředí máme omezené množství dat pocházejících ze studie u smíšené populace pacientů traumatologických, chirurgických a interních hospitalizovaných na JIP [29], kde incidence JIP deliria dosáhla 31,2 %. Vyšší riziko rozvoje deliria je u pacientů s primárně interním onemocněním a po traumatu ve srovnání s pacienty chirurgickými. K dispozici jsou i česká data ze studií brněnských autorů o incidenci dalších subtypů deliria, konkrétně pooperačního deliria [30] a deliria po CMP [31].
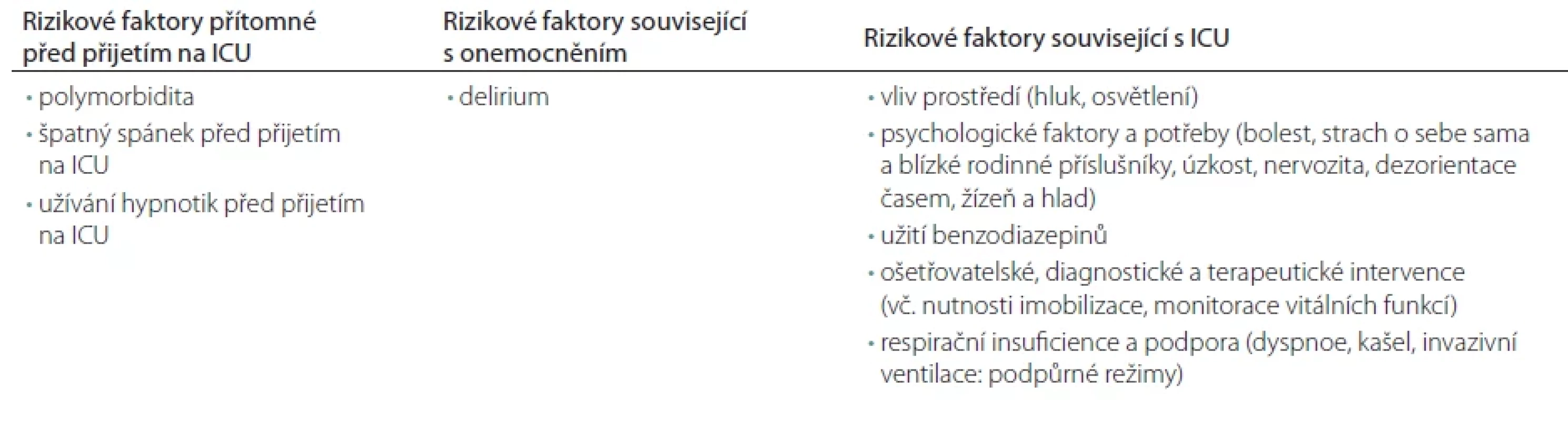

Rizikové faktory špatné kvality spánku a rozvoje deliria
Rizikové faktory deliria na základě provedených výzkumů a jejich asociace s kvalitou spánku jsou často heterogenní. Přesto z více studií vyplývají pro nízkou kvalitu spánku a riziko rozvoje deliria tyto rizikové faktory: ztráta režimu den-noc, spolu s vlivem vyšší intenzity světla a hluku v nočních hodinách, nedostatečná analgetizace, imobilizace pacienta, omezená schopnost komunikovat, strach z neznámého prostředí a obavy o svoji budoucnost, vliv farmak a další. Souhrn zjištění z jednotlivých studií a determinaci rizikových faktorů poruch spánku na JIP provedli ve svojí práci Honarmand et al. [4] (tab. 1). Rizikové faktory deliria jsou uvedeny v tab. 2 [23,32–36]. Tyto jsou rozšířeny o 33 predisponujících faktorů v recentně publikované práci Ormsetha et al. [37] zahrnující 101 114 pacientů z 315 studií, v této práci byly identifikovány faktory asociované i se snížením rizika rozvoje deliria.
Nejsilnějším ochranným faktorem byla kognitivní rezerva, což je schopnost jedince odolávat změnám nebo zátěži mozkových funkcí. U pacientů s demencí, kde je kognitivní rezerva snížena již před hospitalizací na JIP, je vyšší výskyt deliria a poruch spánku oproti zdravé populaci.
Důsledky špatné kvality spánku na JIP
U kriticky nemocných s těžším stupněm encefalopatie byla prokázána kratší perioda až vymizení spánku ve fázi N2. A zároveň změny N2 stadia oproti spánku zdravých jedinců (vymizení K-komplexů a spánkových vřeten na EEG). Nižší zastoupení stadia N2 a jeho alterace koreluje negativně s vyšší pravděpodobností úmrtí a může mít důležitou prognostickou hodnotu [38]. Při intervenční studii porovnávající kvalitu spánku dotazníkovými metodami a incidenci deliria po zavedení multimodální nefarmakologické podpory spánku došlo k významnému snížení podílu dnů, kdy pacienti trpěli deliriem [39]. Existuje asociace mezi špatnou kvalitou spánku, vznikem deliria a zvýšenou mortalitou. Vzhledem k velké variabilitě možností monitorace spánku a výsledků studií jsou důsledky špatné kvality spánku v aktuálních doporučeních PADIS (Pain, Agitation/Sedation, Delirium, Immobility, and Sleep Disruption) sumarizována jako nejasná souvislost mezi kvalitou spánku a délkou nutnosti mechanické ventilační podpory, délkou pobytu na JIP a úmrtností na JIP u kriticky nemocných dospělých. Stejně tak vliv kvality spánku a změn cirkadiánního rytmu na výstupy kriticky nemocných pacientů po propuštění z JIP je třeba dále zkoumat [23].
Důsledky vzniku deliria
Aktuální doporučení PADIS publikovaná v roce 2018 a shrnující výsledky studií uvádí tato stanoviska: delirium je silně asociováno s kognitivními poruchami ve sledovaných intervalech, tj. 3 a 12 měsíců po propuštění z JIP, a je možná asociace deliria s celkovou delší dobou hospitalizace. Naopak dle závěrů těchto doporučení delirium neprodlužuje pobyt na JIP, není rizikovým faktorem pro vznik deprese, neovlivňuje místo, kam bude pacient propuštěn, nezhoršuje závislost na ostatních a mortalitu [23]. Ovšem tyto závěry nesouhlasí se zjištěním předchozího přehledu, kdy u pacientů s deliriem byla významně vyšší úmrtnost, delší doba UPV a delší doba hospitalizace v nemocnici i v intenzivní péči [5]. Recentní studie porovnávající dvě kohorty (každá kohorta čítá 2 968 pacientů) prokázala asociaci deliria s rizikem vyšší mortality v prvních 30 dnech od propuštění z nemocnice a dále výskyt JIP deliria během hospitalizace zvyšuje riziko nutnosti opakované hospitalizace nebo pobytu na pohotovosti či urgentním příjmu [6]. Není ustanoven koherentní závěr ani ve fundamentálních důsledcích vzniku deliria na JIP.
Spánek a delirium
Vztah mezi spánkem a deliriem na JIP je komplexní a navzájem provázaný. Spánková deprivace způsobuje nebo zhoršuje delirium, výskyt deliria může přispívat k poruchám spánku, a vytvářet tak potenciální circulus vitiosus u kriticky nemocných pacientů [15]. Při dlouhodobém sledování bylo zjištěno, že celková doba trvání deliria na JIP je významně spojena se zvýšenou poruchou spánku při dlouhodobém sledování (průměrně 5 měsíců po propuštění z nemocnice) [40].
Limitací v nynějším poznání je fakt, že hypotézy o vztazích mezi spánkem a deliriem byly z velké části odvozeny ze studií na zdravých jedincích nebo pacientech mimo JIP [15]. Monitorace spánku u pacientů v kritickém stavu na JIP je obtížná oproti kontrolovanému prostředí spánkové laboratoře a samotná monitorace spánku pomocí PSG může ovlivňovat spánek.
Závěr
V průběhu hospitalizace v intenzivní péči má většina pacientů sníženou kvantitu a kvalitu spánku, s tím je spojené zvýšené riziko vzniku JIP deliria. Rozvinuté JIP delirium má zároveň dopad na kvalitu spánku pacientů. Špatná kvalita spánku a JIP delirium se tedy ovlivňují navzájem a v přístupu k nim je od sebe nelze izolovat. Přestože špatná kvalita spánku a JIP delirium bývají časté komplikace, nejsou dosud příliš popsány dopady, zejména ty dlouhodobé, na pacientův stav po propuštění z akutní péče.
Grantová podpora
Podpořeno MZ ČR – RVO (FNBr, 65269705), MŠMT projektem VVI CZECRIN (LM2023049) a projektem specifického výzkumu MU Brno (MUNI/A/1186/2022, MUNI/A/1109/2022 a MUNI/A/1105/2022).
Konflikt zájmů
Autoři prohlašují, že nemají střet zájmů v souvislosti s tématem práce.
MUDr. Jan Maláska, Ph.D., EDIC
Klinika dětské anesteziologie a resuscitace
LF MU a FN Brno
Černopolní 212/9,
662 63 Brno
e-mail: jan.malaska@med.muni.cz
Přijato k recenzi: 15. 3. 2023
Přijato do tisku: 2. 10. 2023
Zdroje
1. Krewulak KD, Stelfox HT, Leigh JP et al. Incidence and prevalence of delirium subtypes in an adult ICU: a systematic review and meta-analysis. Crit Care Med 2018; 46 (12): 2029–2035. doi: 10.1097/CCM.0000000000003402.
2. Foreman B, Westwood AJ, Claassen J et al. Sleep in the neurological intensive care unit: feasibility of quantifying sleep after melatonin supplementation with environmental light and noise reduction. J Clin Neurophysiol 2015; 32 (1): 66–74. doi: 10.1097/WNP.0000000000000110.
3. Sinha S, Soneja M, Naik RD et al. Sleep quality and quantity in intensive care unit patients: a cross-sectional study. Indian J Crit Care Med 2018; 22 (6): 408–414. doi: 10.4103/ijccm.IJCCM_65_18.
4. Honarmand K, Rafay H, Le J et al. A systematic review of risk factors for sleep disruption in critically ill adults. Crit Care Med 2020; 48 (7): 1066–1074. doi: 10.1097/CCM.0000000000004405.
5. Salluh JIF, Wang H, Schneider EB et al. Outcome of delirium in critically ill patients: systematic review and meta-analysis. BMJ 2015; 350: h2538–h2538. doi: 10.1136/bmj.h2538.
6. Fiest KM, Soo A, Hee Lee C et al. Long-term outcomes in ICU patients with delirium: a population-based cohort study. Am J Respir Crit Care Med 2021; 204 (4): 412–420. doi: 10.1164/rccm.202002-0320OC7.
7. Hrežová L, Bednařík J. Management deliria v neurointenzivní péči v České republice – dotazníková studie. Cesk Slov Neurol N 2022; 85 (4): 325–329. doi: 10.48095/cccsnn2022325.
8. Pilcher JJ, Huffcutt AI. Effects of sleep deprivation on performance: a meta-analysis. Sleep 1996; 19 (4): 318–326. doi: 10.1093/sleep/19.4.318.
9. Kahn-Greene ET, Killgore DB, Kamimori GH et al. The effects of sleep deprivation on symptoms of psychopathology in healthy adults. Sleep Med 2007; 8 (3): 215–221. doi: 10.1016/j.sleep.2006.08.007.
10. Waters F, Chiu V, Atkinson A et al. Severe sleep deprivation causes hallucinations and a gradual progression toward psychosis with increasing time awake. Front Psychiatry 2018; 9: 303. doi: 10.3389/fpsyt.2018.00303.
11. American Psychiatric Association. Diagnostic and statistical manual of mental disorders. American Psychiatric Association 2013. doi: 10.1176/appi.books.9780890425596.
12. Carskadon MA, Dement WC. Normal human sleep. In: Principles and practice of sleep medicine. Elsevier 2017; 15–24.e3. doi: 10.1016/B978-0-323-24288-2.00002-7.
13. Hirotsu C, Tufik S, Andersen ML. Interactions between sleep, stress, and metabolism: from physiological to pathological conditions. Sleep Sci 2015; 8 (3): 143–152. doi: 10.1016/j.slsci.2015.09.002.
14. Poza JJ, Pujol M, Ortega-Albás JJ et al. Melatonin in sleep disorders. Neurología (Engl Ed) 2022; 37 (7): 575–585. doi: 10.1016/j.nrleng.2018.08.004.
15. Pisani MA, D’Ambrosio C. Sleep and delirium in adults who are critically ill. Chest 2020; 157 (4): 977–984. doi: 10.1016/j.chest.2019.12.003.
16. Faraut B, Boudjeltia KZ, Vanhamme L et al. Immune, inflammatory and cardiovascular consequences of sleep restriction and recovery. Sleep Med Rev 2012; 16 (2): 137–149. doi: 10.1016/j.smrv.2011.05.001.
17. Spiegel K, Leproult R, Van Cauter E. Impact of sleep debt on metabolic and endocrine function. Lancet 1999; 354 (9188): 1435–1439. doi: 10.1016/S0140-6736 (99) 01376-8.
18. Boudjeltia KZ, Faraut B, Stenuit P et al. Sleep restriction increases white blood cells, mainly neutrophil count, in young healthy men: a pilot study. Vasc Health Risk Manag 2008; 4 (6): 1467–1470. doi: 10.2147/vhrm.s3934.
19. Berry RB, Brooks R, Gamaldo CE al et. The AASM manual for the scoring of sleep and associated events: rules, terminology and technical specifications. Version 2.4. American Academy of Sleep Medicine 2017. doi: 10.5664/jcsm.6576.
20. Memar P, Faradji F. A novel multi-class EEG-based sleep stage classification system. IEEE Trans Neural Syst Rehabil Eng 2018; 26 (1): 84–95. doi: 10.1109/TNSRE. 2017.2776149.
21. Friese RS, Diaz-Arrastia R, McBride D et al. Quantity and quality of sleep in the surgical intensive care unit: are our patients sleeping? J Trauma Inj Infect Crit Care 2007; 63 (6): 1210–1214. doi: 10.1097/TA.0b013e31815b83d7.
22. Gazendam JAC, Van Dongen HPA, Grant DA et al. Altered circadian rhythmicity in patients in the ICU. Chest 2013; 144 (2): 483–489. doi: 10.1378/chest.12-2405.
23. Devlin JW, Skrobik Y, Gélinas C et al. Clinical practice guidelines for the prevention and management of pain, agitation/sedation, delirium, immobility, and sleep disruption in adult patients in the ICU. Crit Care Med 2018; 46 (9): e825–e873. doi: 10.1097/CCM.00000 00000003299.
24. Trompeo AC, Vidi Y, Locane MD et al. Sleep disturbances in the critically ill patients: role of delirium and sedative agents. Minerva Anestesiol 2011; 77 (6): 604–612.
25. White DP, Douglas NJ, Pickett CK et al. Sleep deprivation and the control of ventilation. Am Rev Respir Dis 1983; 128 (6): 984–986. doi: 10.1164/arrd.1983.128.6.984.
26. Roche Campo F, Drouot X, Thille AW et al. Poor sleep quality is associated with late noninvasive ventilation failure in patients with acute hypercapnic respiratory failure. Crit Care Med 2010; 38 (2): 477–485. doi: 10.1097/CCM.0b013e3181bc8243.
27. Watson PL, Pandharipande P, Gehlbach BK et al. Atypical sleep in ventilated patients: empirical electroencephalography findings and the path toward revised ICU sleep scoring criteria. Crit Care Med 2013; 41 (8): 1958–1967. doi: 10.1097/CCM.0b013e31828a3f75.
28. Berry RB, Brooks R, Gamaldo C et al. AASM Scoring Manual Updates for 2017 (Version 2.4). J Clin Sleep Med 2017; 13 (5): 665–666. doi: 10.5664/jcsm.6576.
29. Káňová M, Burda M, Povová J et al. Delirium u kriticky nemocných – prospektivní studie. Cesk Slov Neurol N 2015; 78/111 (6): 662–667.
30. Mitášová A, Mitáš L, Urbánek I et al. Incidence a rizikové faktory pooperačního deliria. Cesk Slov Neurol N 2012; 75 (108 (5): 574–580.
31. Mitasova A, Kostalova M, Bednarik J et al. Poststroke delirium incidence and outcomes: validation of the confusion assessment method for the intensive care unit (CAM-ICU). Crit Care Med 2012; 40 (2): 484–490. doi: 10.1097/CCM.0b013e318232da12.
32. Lobo-Valbuena B, Gordo F, Abella A et al. Risk factors associated with the development of delirium in general ICU patients. A prospective observational study. PLoS One 2021; 16 (9): e0255522. doi: 10.1371/journal.pone.0255522.
33. Zaal IJ, Devlin JW, Peelen LM et al. A systematic review of risk factors for delirium in the ICU. Crit Care Med 2015; 43 (1): 40–47. doi: 10.1097/CCM.0000000000000 625.
34. Kotfis K, Marra A, Ely EW. ICU delirium – a diagnostic and therapeutic challenge in the intensive care unit. Anaesthesiol Intensive Ther 2018; 50 (2): 160–167. doi: 10.5603/AIT.a2018.0011.
35. Pan Y, Yan J, Jiang Z et al. Incidence, risk factors, and cumulative risk of delirium among ICU patients: a case-control study. Int J Nurs Sci 2019; 6 (3): 247–251. doi: 10.1016/j.ijnss.2019.05.008.
36. Steinberg BE, Sundman E, Terrando N et al. Neural control of inflammation. Anesthesiology 2016; 124 (5): 1174–1189. doi: 10.1097/ALN.0000000000001 083.
37. Ormseth CH, LaHue SC, Oldham MA et al. Predisposing and precipitating factors associated with delirium: a systematic review. JAMA Netw Open 2023; 6 (1): e2249950. doi: 10.1001/jamanetworkopen.2022.49 950.
38. Knauert MP, Gilmore EJ, Murphy TE et al. Association between death and loss of stage N2 sleep features among critically ill patients with delirium. J Crit Care 2018; 48: 124–129. doi: 10.1016/j.jcrc.2018.08.028.
39. Tonna JE, Dalton A, Presson AP et al. The effect of a quality improvement intervention on sleep and delirium in critically ill patients in a surgical ICU. Chest 2021; 160 (3): 899–908. doi: 10.1016/j.chest.2021.03.030.
40. Altman MT, Knauert MP, Murphy TE et al. Association of intensive care unit delirium with sleep disturbance and functional disability after critical illness: an observational cohort study. Ann Intensive Care 2018; 8 (1): 63. doi: 10.1186/s13613-018-0408-4.
Štítky
Detská neurológia Neurochirurgia NeurológiaČlánok vyšiel v časopise
Česká a slovenská neurologie a neurochirurgie

2023 Číslo 5
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- 100 let s metamizolem: jaké je jeho současné postavení v léčbě bolesti
Najčítanejšie v tomto čísle
- Výběr vhodné operační techniky při léčbě nejčastější kraniosynostózy
- Delirium a spánek v intenzivní péči I – epidemiologie, rizikové faktory a důsledky
- 3D tisk v neurochirurgii – naše zkušenost
- Delirium a spánek v intenzivní péči II – možnosti monitorace a diagnostiky
