Delirium a spánek v intenzivní péči II – možnosti monitorace a diagnostiky
Delirium and sleep in intensive care II – monitoring and diagnostic options
Monitoring sleep quality and delirium are essential in providing modern intensive care. They present both equipment and personnel challenges. Not only because certain monitoring methods, such as polysomnography, affect monitored sleep themselves. Although new alternatives exist, polysomnography remains the gold standard in diagnosing and researching sleep disorders for the validity of the data obtained. Without monitoring and screening methods, delirium and sleep disorders cannot be reliably diagnosed in intensive care. Without a clearly established diagnosis, the outcomes of delirium and reduced sleep quality cannot be investigated. This article summarizes various options for monitoring both sleep and delirium, their advantages and limitations in the critical care setting.
Keywords:
monitoring – intensive care – sleep – delirium – polysomnography – sleep quality – actigraphy
Autori:
M. Kovář 1,2,5; J. Bednařík 3,5; L. Bakošová 3,5; D. Kec 3,5; E. Klabusayová 1,2,5; T. Bönischová 1,2,5; J. Klučka 1,2,5; J. Maláska 1,2,4,5
Pôsobisko autorov:
Klinika dětské anesteziologie a resuscitace FN Brno
1; Ústav simulační medicíny, LF MU Brno
2; Neurologická klinika FN Brno
3; II. Anesteziologicko-resuscitační oddělení, FN Brno
4; LF MU, Brno
5
Vyšlo v časopise:
Cesk Slov Neurol N 2023; 86(5): 304-309
Kategória:
Přehledný referát
doi:
https://doi.org/10.48095/cccsnn2023304
Súhrn
Monitorace kvality spánku a deliria jsou naprosto zásadní pro poskytování moderní intenzivní péče. Představují však přístrojovou a personální výzvu. Nejen proto, že určité metody monitorace, např. polysomnografie, monitorovaný spánek samy ovlivňují. Ačkoliv existují nové alternativy, polysomnografie zůstává zlatým standardem v diagnostice a výzkumu poruch spánku pro nejlepší validitu získaných dat. Bez monitorace a screeningových metod nelze spolehlivě diagnostikovat delirium a poruchy spánku v intenzivní péči a bez jasně stanovené diagnózy nelze zkoumat dopady deliria a snížené kvality spánku. Tento článek shrnuje jednotlivé možnosti monitorace spánku i deliria, jejich výhody a limitace v prostředí intenzivní péče.
Klíčová slova:
monitorace – intenzivní péče – spánek – delirium – polysomnografie – kvalita spánku – aktigrafie
Úvod
Navzdory vysoké prevalenci jednotek intenzivní péče (JIP) deliria a zjištění velkého množství rizikových faktorů [1] se nedaří konzistentně určit důsledky rozvoje deliria v krátkodobém a dlouhodobém horizontu. Toto lze vysvětlit různými etiologiemi vzniku deliria, proto jsou výsledky jednotlivých studií zkoumající důsledky deliria velmi často neporovnatelné [2]. Na druhou stranu, akutní i dlouhodobé dopady prodělaného deliria na JIP jsou podstatné pro pacienta a jeho zdraví. Bez předchozí a správné diagnostiky deliria nelze tyto důsledky identifikovat. Klinickou praxi diagnostiky deliria v neurointenzivní péči v ČR mapovala recentní dotazníková studie. Přestože významná většina respondentů (97 %) považuje delirium za významný klinický a výzkumný problém, majorita pracovišť (89 %) se shoduje na problému poddiagnostikování deliria. Samotný screening provádí pouze lehce nadpoloviční většina (57 %) a necelá čtvrtina (21 %) k diagnostice používá validované nástroje [3]. S rozvojem deliria jsou asociovány poruchy cyklu spánek-bdění, které souvisejí s narušením cirkadiánního rytmu, proto při dalším studiu dopadů rozvoje deliria je třeba hodnotit i spánek a jeho kvalitu [4]. K tomu slouží řada metod monitorace spánku a deliria, ale každá z nich má v prostředí intenzivní péče svoje limity [5].
Možnosti monitorace spánku a jeho kvality
Spánek a jeho kvalitu a kvantitu můžeme monitorovat objektivně přístrojovou monitorací polysomnografií (PSG), dalšími metodami založenými na EEG a aktigrafií. S technickou i personální náročností metody stoupá i validita naměřených dat a tu největší má PSG. Proti PSG byly validovány i některé dotazníkové techniky, které hodnotí spánek subjektivně. Na dotazníky odpovídá přímo pacient nebo ošetřovatelský personál v rámci klinické observace. Výhody a limitace metod shrnuje tab. 1.

Polysomnografie
Za zlatý standard monitorující aspekty kvality a kvantity spánku je považována PSG [6], která monitoruje více parametrů, a to: EEG, EKG, elektrookulografii (EOG), EMG z dolních končetin a brady, dechové úsilí pomocí hrudních a břišních pletysmografických pásů, pulzní oxymetrii, proud vydechovaného vzduchu a nazálního tlaku, pozici těla během spánku, monitoraci chrápání a kameru s nočním viděním. K objektivizaci kvality a kvantity spánku sledujeme tyto parametry PSG [7]:
- Total Recording Time (TRT) – celková doba nahrávání;
- Total Bed Time (TBT) – celková doba na lůžku – často stejná jako TRT;
- Sleep Latency (SL) – latence usnutí – doba od uložení pacienta ke spánku
- od „zhasnutí světel“) k usnutí, obvykle udávaná v minutách, za normu je považováno 5–15 min k usnutí;
- Total Sleep Time (TST) – celkové trvání spánku – během něj probíhají N1–3 a fáze REM (rapid eye movement);
- Sleep Efficiency (SE) – efektivita spánku – vyjadřuje podíl doby spánku a doby strávené v posteli, za normální se pokládá 80 % a více;
- Wake after Sleep Onset (WASO) – délka bdělosti po prvním usnutí. Doba WASO odráží fragmentaci spánku spolu s počtem probuzení;
- REM latency – latence REM spánku – doba od usnutí k prvnímu období REM spánku, za normu se považuje 70–110 min.
Užití PSG v rámci JIP je složité z hlediska technického i personálního. Navíc je zpochybňováno užití PSG u hospitalizovaných sledovaných pacientů, protože hodnoticí algoritmy (původní Rechtschaffen a Kalesa, následně jeho nástupce používaný od roku 2007: American Academy of Sleep Medicine; AASM) [8,9] byly vyvinuty pro ambulantní pacienty a pacienti na JIP mají atypický záznam mozkové aktivity [5]. Sedativa, opioidy, stresová odpověď a umělá plicní ventilace (UPV) ovlivňují mozkovou aktivitu [10], svalový tonus, pohyby končetin a očí, které bývají při PSG sledovány v rámci jednotlivých modalit [11]. Prostředí JIP je zdrojem i četných artefaktů (pohybové artefakty, artefakty z UPV, kontaminace snímaných elektrických signálů jinými přístroji). Drouot et al. ve své studii, kde byli sledováni ventilovaní JIP pacienti při vědomí, uvádí, že v 28 % k hodnocení spánku nemohla být použita standardní kritéria, a postuluje dva nové stavy: atypický spánek (spánek s atypickým záznamem EEG) a patologickou bdělost (pomalý EEG záznam, když byl pacient vzhůru) [12]. Přestože dochází k vývoji nových hodnoticích algoritmů a metod k hodnocení subpopulace JIP pacientů [13], v prostředí intenzivní péče aktuálně není žádný hodnoticí algoritmus považován za standardizovanou normu. Další limitací PSG může být obtížná monitorace všemi modalitami při kritickém stavu pacienta. Samotný záznam může prohloubit diskomfort pacienta, a je-li pořizován při provozu na JIP, musí být zajištěno dodržení parametrů spánkové laboratoře (kontrola hluku, okolních ruchů, expozice světlu a dalších enviromentálních aspektů).
Bispektrální index (BIS)
Modifikovanou modalitou EEG, více vyhovující prostředí JIP a kriticky nemocným pacientům, je monitor BIS (bispektrální index), který zaznamenává EEG pomocí pouze čtyř elektrod a zpracovává jej do numerické škály 100 (odpovídá plné bdělosti) – 0 (žádná mozková aktivita). Detailněji jsou hodnoty BIS indexu uvedeny v tab. 2. Některé studie ověřující možnosti užití BIS ke sledování stadií spánku uvádí, že v rámci NREM spánku klesají i hodnoty BIS. BIS index je ale falešně vyšší při REM spánku artefakty způsobenými rychlými pohyby očí a překrývají se se stadiem N1, tímto se snižuje senzitivita BIS [14]. Další studie potvrzuje uspokojivou specificitu a senzitivitu užití BIS k identifikaci spánku ve stadiu spánku N3 (BIS index 60–40 je také cílená hodnota při celkové anestezii). Ostatní NREM (non rapid eye movement) stadia nelze jednotlivě odlišit, stejně tak studie připouští neschopnost odlišit REM spánek a probuzení. Pro další studie autoři doporučují užití kombinace BIS a EMG nebo EOG [15]. Užití kombinace bylo také doporučeno při validační studii BIS a PSG u pacientů se 40h spánkovou deprivací, kde korelovaly NREM stadia a použití EMG aktivity bylo navrženo k odlišení REM spánku [16]. Algoritmicky zpracované EEG má potenciál stát se modalitou schopnou měřit kvalitu spánku na JIP, zatím ale ve studiích nebylo dosaženo dostatečné korelace mezi BIS a PSG [5]. Předností BIS oproti PSG je její menší technická i personální náročnost.
Aktigrafie
Aktigraf je senzor sledující pohyb – akcelerometr – v dnešní době používán ve většině mobilních telefonů a chytrých zařízení, které uživatel nosí na sobě. Pomocí algoritmů rozlišuje spánek a dobu probuzení dle různě dlouhých epoch aktivity [17]. Spánek je popisován podle již zmíněných časových parametrů. Aktigraf lze umístit nejčastěji na zápěstí nebo okolo kotníku, a tím se vyhnout zavedeným vstupům nebo dalším přístrojům, které slouží k monitoraci vitálních funkcí pacientů na JIP. Hlavní výhodou je jednoduchost oproti PSG, ale za cenu nižší validity metody. Validita měření se snižuje či úplně mizí u hluboce sedovaných pacientů, absolutně u pacientů s nutností myorelaxace, kde nedochází k pohybu na monitorované končetině/končetinách. Toto nadhodnocení času spánku u sedovaných pacientů, a tím i efektivity spánku oproti PSG, se ukazuje v několika komparačních studiích [17,18]. Stejný trend se objevuje v porovnání s dotazníkovou systematickou observací ošetřovatelského personálu [19]. Přesto dosahuje aktigrafie až 90% shody s PSG [20,21] a v roce 2007 ji AASM uznala jako spolehlivou a validní k hodnocení poruch cirkadiánního rytmu, u ostatních spánkových poruch (parasomnie, insomnie, hypersomnie, poruchy ventilace ve spánku a další) zatím její validita prokázána nebyla [22].
Systematická observace
Jedná se o metody založené na sběru dat pozorovateli, v případě JIP ošetřujícím personálem, který sleduje chování pacienta. Mohou mít podobu průběžného sledování nebo bývají data o spánku získána retrospektivně, např. z videozáznamu. Mezi využívané metody patří např. Sleep Observational Tool, který je validovaný s PSG. Ošetřující personál provádí každých 15 min po dobu 4 h 5sekundové pozorování a hodnotí, jestli pacient spí, je vzhůru, případně se nelze vyjádřit. V 81,9 % bylo hodnocení spánku ošetřujícím personálem shodné s PSG [23]. Přestože jsou k dispozici další observační metody, jejich validace s ostatními metodami hodnotícími spánek nebyla průkazná [24] nebo byla prokázána pouze slabá korelace [17]. Systematickou observací hodnocení spánku lze sledovat kohortu pacientů, která není schopná vzhledem ke svému stavu podat subjektivní hodnocení spánku. Limitací je neschopnost odlišit některé aspekty spánku, např. počet probuzení, dobu usnutí, a dále mohou být nezanedbatelné interindividuální rozdíly v hodnocení spánku mezi jednotlivými hodnotiteli.
Subjektivní hodnocení pacientem
Při hodnocení spánku subjektivními metodami získáváme data, jak vnímá spánek a jeho kvalitu samotný pacient. K získání těchto dat se používá několik dotazníků. Např. Jeffs et al. ve svém přehledovém článku analyzovali 17 metod z 38 studií, většina z nich nebyla validovaných a pro další studie spánku na JIP doporučují užití Richards Campbell Sleep Questionnaire (RCSQ) [25].
RCSQ je složen z pěti vizuálních analogových škál (VAS), které měří pět oblastí spánku: latenci, efektivitu, hloubku, počet probuzení a celkovou kvalitu. RCSQ je validován oproti PSG [26]. Jeho užití doporučují i doporučení PADIS pro monitoraci poruch spánku na JIP [27]. Český překlad RCSQ byl validován [28]. Mezi dalšími dotazníky byla ve studiích využita škála Verran Snyder-Halpern Sleep Scale (VSH). Jedná se o VAS složenou z 9–15 položek, původně vytvořenou a validovanou pro zdravou populaci [29], nicméně byla použita i v prostředí JIP [20]. Další škálou je Numeric Rating Scale for Sleep (NRS-Sleep) [30] jednopoložkové škály od 0 (nejhorší noční spánek) do 10 (nejlepší noční spánek), která byla v roce 2019 validována s RCSQ. Nepodkročitelnou podmínkou a limitací v prostředí JIP je bohužel schopnost samotného pacienta zodpovědět dotazník.
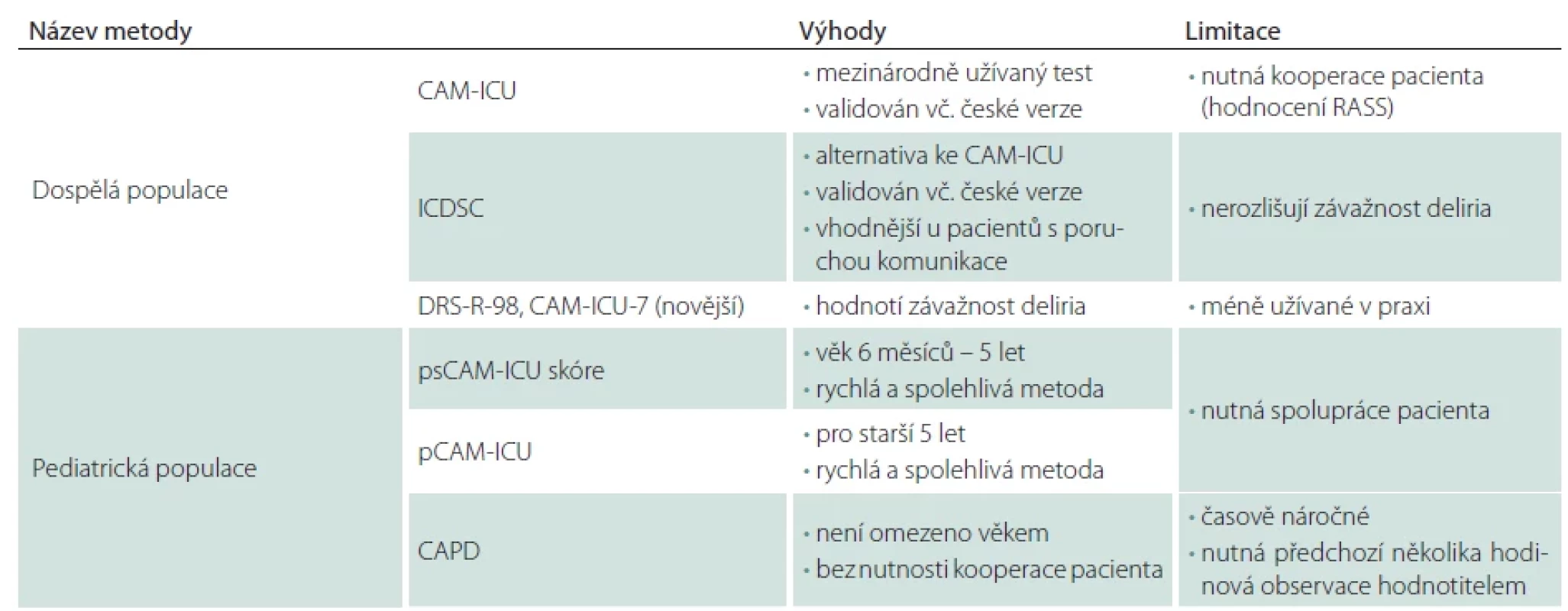
Monitorace deliria
Diagnostiku deliria usnadňují screeningové dotazníky, jejich přehled je uveden v tab. 3. Nejčastěji používaný dotazník je tzv. Confusion Assessment Method for the ICU (CAM-ICU) [31], přeložený do 19 jazyků [32], kde byl standardizovaný překlad do češtiny validován [33], nebo Intensive Care Delirium Screening Checklist (ICDSC) [34]. Použití ICDSC se jeví jako vhodnější u pacientů s poruchou komunikace (např. afázií). ICDSC byl také přeložen do češtiny a vydán v rámci doporučených postupů České neurologické společnosti [35]. Screening deliria pomocí těchto metod je rychlý (2–5 min) a vykazuje vysokou specificitu a senzitivitu [36]. Jedním z nezbytných předpokladů k využití zmíněných dotazníkových technik je nutnost hodnocení sedace/agitace pacientů pomocí škály Richmond Agitation-Sedation Scale (RASS).
Četné studie na JIP i mimo ně zjistily, že bez validovaných screeningových nástrojů sestry a lékaři u lůžka delirium bohužel vždy nerozpoznají [27]. Výhoda screeningových nástrojů deliria byla dokumentována na mnoha souborech, např. byla zjištěna asociace mezi lepším výsledkem léčby ventilovaných pacientů, u kterých byl proveden screening deliria [37]. Výše zmíněné screeningové metody neposkytují informaci o závažnosti deliria, která bývá dávána do souvislosti s výsledným stavem pacientů, pro získání těchto informací byly vyvinuty Delirium Rating Scale – Revised-98 (DRS-R-98) [38] a novější CAM-ICU-7 [39]. Probíhají také snahy identifikovat biomarker asociovaný s rizikem nebo rozvojem deliria. Často uváděné hypotézy v rozvoji deliria bývají snížení cholinergní aktivity [40], deficit melatoninu, zvýšená hladina glutamátu, noradrenalinu nebo dopaminu a kolísání hladin GABA (gama-aminomáselné kyseliny), histaminu a serotoninu [4]. V etiopatogenezi bývá zvažován i podíl inflamace, zkoumán byl např. C-reaktivní protein [41]. Ačkoli bylo studováno mnoho biomarkerů, žádný z nich nebyl dosud validován pro klinické použití [32].
Pediatrická populace
V pediatrické intenzivní péči je delirium častým problémem, jeho incidence dosahuje podle různých zdrojů až 49 % [42]. Stejně jako u dospělých pacientů má jeho rozvoj vliv jak na délku pobytu pacienta na JIP, tak na mortalitu, délku UPV i na vznik dlouhodobých kognitivních poruch [43]. U pediatrických pacientů je pro screening deliria doporučeno používat skóre The Preschool Confusion Assessment Method for the ICU (psCAM-ICU) pro děti od 6 měsíců do 5 let a pro pacienty starší 5 let The Pediatric Confusion Assessment Method for the ICU (pCAM-ICU) [44]. Tyto metody jsou považovány za spolehlivé, rychlé a vykazují vysokou specifitu i senzitivitu [44,45]. Mezi další možné skórovací systémy patří např. The Cornell Assessment of Pediatric Delirium (CAPD), který nevyžaduje kooperaci dětského pacienta a může být použit v jakémkoliv věku, nevýhodou je však jeho časová náročnost, hodnocení by měla předcházet observace pacienta sestrou po dobu 4–6 h [46].
Prediktivní modely vzniku deliria
Vzhledem k doporučení užívat multimodální nefarmakologické strategie k prevenci rozvoje deliria [27] jsou tendence předpovídat rozvoj deliria na základě rizikových faktorů. Byly vytvořeny a validovány dva modely PREdiction of DELIRium in ICu patients (PRE-DELIRIC) [47,48] s 10 prediktory a E-PRE-DELIRIC model s devíti prediktory sloužící k identifikaci pacientů s vysokým rizikem rozvoje deliria k následné prevenci rozvoje deliria. Jejich limitací je, že mnohé rizikové faktory nejsou modifikovatelné, tzv. predispoziční faktory (např. věk, APACHE II scóre), a nejsou konzistentní data ukazující zlepšení pacientova zdravotního stavu po propuštění (outcome) při redukci známých rizikových faktorů. Větší část rizikových faktorů vzniká v průběhu samotného onemocnění, během hospitalizace na JIP (např. metabolické abnormality či enviromentální faktory) [1]. Tyto rizikové faktory jsou označovány jako precipitační faktory. Precipitační faktory by bylo možné během hospitalizace monitorovat a úplně se jich vyvarovat či je alespoň omezit. Při probíhajícím rozvoji umělé inteligence se začíná v problematice predikce rozvoje deliria využívat modelů strojového učení, které zpracovávají zdravotní údaje z elektronických zdravotních záznamů. Jejich schopnost předpovědět delirium je přesná a výhodou je i průběžné dynamické hodnocení v čase [49].
Závěr
V současné době existuje více validovaných možností screeningu, monitoringu a diagnostiky spánku v prostředí JIP, každá tato metoda má však svoje limitace a nelze ji univerzálně použít pro všechny pacienty hospitalizované na JIP. Je to také jedna z příčin, proč jsou pouze omezeně identifikovány jednoznačné dopady špatné kvality spánku a rozvoje deliria na výsledek léčby pacientů, jak v krátkodobém i dlouhodobém časovém horizontu. Užití více modalit souběžně a systematické provádění dalšího výzkumu jsou zásadní k zodpovězení všech otázek týkajících se vztahu spánku a deliria na JIP.
Grantová podpora
Podpořeno MZ ČR – RVO (FNBr, 65269705), MŠMT projektem VVI CZECRIN (LM2023049) a projektem specifického výzkumu MU Brno (MUNI/A/1186/2022, MUNI/A/1109/2022 a MUNI/A/1105/2022).
Konflikt zájmů
Autoři prohlašují, že nemají střet zájmů v souvislosti s tématem práce
MUDr. Jan Maláska, Ph.D., EDIC
Klinika dětské anesteziologie
a resuscitace
LF MU a FN Brno
Černopolní 212/9
662 63 Brno
e-mail: jan.malaska@med.muni.cz
Přijato k recenzi: 15. 3. 2023
Přijato do tisku: 2. 10. 2023
Zdroje
1. Ormseth CH, LaHue SC, Oldham MA et al. Predisposing and precipitating factors associated with delirium: a systematic review. JAMA Netw Open 2023; 6 (1): e2249950. doi: 10.1001/jamanetworkopen.2022.49950.
2. Salluh JIF, Wang H, Schneider EB et al. Outcome of delirium in critically ill patients: systematic review and meta-analysis. BMJ 2015; 350: h2538–h2538. doi: 10.1136/bmj.h2538.
3. Hrežová L, Bednařík J. Management deliria v neurointenzivní péči v České republice – dotazníková studie. Cesk Slov Neurol N 2022; 85/118 (4): 325–329. doi: 10.48095/cccsnn2022325.
4. Daou M, Telias I, Younes M et al. Abnormal sleep, circadian rhythm disruption, and delirium in the ICU: are they related? Front Neurol 2020; 11: 549908. doi: 10.3389/fneur.2020.549908.
5. Richards KC, Wang Y, Jun J et al. A systematic review of sleep measurement in critically ill patients. Front Neurol 2020; 11: 542529. doi: 10.3389/fneur.2020.542529.
6. Delaney LJ, Haren FV, Currie M et al. Sleep monitoring techniques within intensive care. Int J Nurs Clin Pract 2015; 2 (2): 114. doi: 10.15344/2394-4978/2015/114.
7. Shrivastava D, Jung S, Saadat M et al. How to interpret the results of a sleep study. J Community Hosp Intern Med Perspect 2014; 4 (5): 24983. doi: 10.3402/jchimp.v4.24983.
8. Kales A, Rechtschaffen A. A manual of standardized terminology: techniques and scoring system of sleep stages of human subjects. Los Angeles: UCLA 1968.
9. Iber C, Ancoli-Israel S, Chesson AL et al. The AASM manual for the scoring of sleep and associated events: rules, terminology and technical specifications. Westchester: American Academy of Sleep Medicine: 2007.
10. Cooper AB, Thornley KS, Young GB et al. Sleep in critically ill patients requiring mechanical ventilation. Chest 2000; 117 (3): 809–818. doi: 10.1378/chest.117.3.809.
11. Bourne RS, Mills GH. Sleep disruption in critically ill patients – pharmacological considerations. Anaesthesia 2004; 59 (4): 374–384. doi: 10.1111/j.1365-2044.2004.03664.x.
12. Drouot X, Roche-Campo F, Thille AW et al. A new classification for sleep analysis in critically ill patients. Sleep Med 2012; 13 (1): 7–14. doi: 10.1016/j.sleep.2011.07.012.
13. Watson PL, Pandharipande P, Gehlbach BK et al. Atypical sleep in ventilated patients: empirical electroencephalography findings and the path toward revised ICU sleep scoring criteria. Crit Care Med 2013; 41 (8): 1958–1967. doi: 10.1097/CCM.0b013e31828a3f75.
14. Nena E, Steiropoulos P, Serasli E et al. The use of Bispectral Index (BIS) values as an indicator for sleep staging. Pneumon 2009; 22 (3): 235–239.
15. Benissa M-R, Khirani S, Hartley S et al. Utility of the bispectral index for assessing natural physiological sleep stages in children and young adults. J Clin Monit Comput 2016; 30 (6): 957–963. doi: 10.1007/ s10877-015-9800-x.
16. Giménez S, Romero S, Alonso JF et al. Monitoring sleep depth: analysis of bispectral index (BIS) based on polysomnographic recordings and sleep deprivation. J Clin Monit Comput 2017; 31 (1): 103–110. doi: 10.1007/s10 877-015-9805-5.
17. Beecroft JM, Ward M, Younes M et al. Sleep monitoring in the intensive care unit: comparison of nurse assessment, actigraphy and polysomnography. Intensive Care Med 2008; 34 (11): 2076–2083. doi: 10.1007/s00134-008-1180-y.
18. van der Kooi AW, Tulen JHM, van Eijk MMJ et al. Sleep monitoring by actigraphy in short-stay ICU patients. Crit Care Nurs Q 2013; 36 (2): 169–173. doi: 10.1097/CNQ. 0b013e318283cff3.
19. Hsu W, Guo S, Chang C. Back massage intervention for improving health and sleep quality among intensive care unit patients. Nurs Crit Care 2019; 24 (5): 313–319. doi: 10.1111/nicc.12428.
20. Sadeh A, Acebo C. The role of actigraphy in sleep medicine. Sleep Med Rev 2002; 6 (2): 113–124. doi: 10.1053/smrv.2001.0182.
21. Madsen MT, Rosenberg J, Gögenur I. Actigraphy for measurement of sleep and sleep-wake rhythms in relation to surgery. J Clin Sleep Med 2013; 9 (4): 387–394. doi: 10.5664/jcsm.2598.
22. Morgenthaler T, Alessi C, Friedman L et al. Practice parameters for the use of actigraphy in the assessment of sleep and sleep disorders: an update for 2007. Sleep 2007; 30 (4): 519–529. doi: 10.1093/sleep/30.4.519.
23. Edwards GB, Schuring LM. Pilot study: validating staff nurses’ observations of sleep and wake states among critically ill patients, using polysomnography. Am J Crit Care 1993; 2 (2): 125–131.
24. Aitken LM, Elliott R, Mitchell M et al. Sleep assessment by patients and nurses in the intensive care: an exploratory descriptive study. Aust Crit Care 2017; 30 (2): 59–66. doi: 10.1016/j.aucc.2016.04.001.
25. Jeffs EL, Darbyshire JL. Measuring sleep in the intensive care unit: a critical appraisal of the use of subjective methods. J Intensive Care Med 2019; 34 (9): 751–760. doi: 10.1177/0885066617712197.
26. Richards KC, O’Sullivan PS, Phillips RL. Measurement of sleep in critically ill patients. J Nurs Meas 2000; 8 (2): 131–144.
27. Devlin JW, Skrobik Y, Gélinas C et al. Clinical practice guidelines for the prevention and management of pain, agitation/sedation, delirium, immobility, and sleep disruption in adult patients in the ICU. Crit Care Med 2018; 46 (9): e825–e873. doi: 10.1097/CCM.0000000000003299.
28. Locihová H, Žiaková K, Šerková D et al. The reliability of the Czech version of the Richards-Campbell Sleep Questionnaire. Kontakt 2019; 21 (3): 128–134. doi: 10.32725/kont.2019.001.
29. Snyder-Halpern R, Verran JA. Instrumentation to describe subjective sleep characteristics in healthy subjects. Res Nurs Health 1987; 10 (3): 155–163. doi: 10.1002/nur.4770100307.
30. Rood P, Frenzel T, Verhage R et al. Development and daily use of a numeric rating score to assess sleep quality in ICU patients. J Crit Care 2019; 52: 68–74. doi: 10.1016/j.jcrc.2019.04.009.
31. Ely EW, Margolin R, Francis J et al. Evaluation of delirium in critically ill patients: validation of the Confusion Assessment Method for the Intensive Care Unit (CAM-ICU). Crit Care Med 2001; 29 (7): 1370–1379. doi: 10.1097/00003246-200107000-00012.
32. Oh ES, Fong TG, Hshieh TT et al. Delirium in older persons: advances in diagnosis and treatment. JAMA 2017; 318 (12): 1161–1174. doi: 10.1001/jama.2017.12067.
33. Mitášová A, Bednařík J, Košťálová M et al. Standardizace české verze The Confusion Assessment Method for the Intensive Care Unit (CAM ICUcz). Cesk Slov Neurol N 2010; 73/106 (3): 258–266.
34. Bergeron N, Dubois M-J, Dumont M et al. Intensive care delirium screening checklist: evaluation of a new screening tool. Intensive Care Med 2001; 27 (5): 859–864. doi: 10.1007/s001340100909.
35. Hrežová L, Musilová T, Bednařík J. Diagnostické testy pro screening deliria v intenzivní/neurointenzivní péči. [online]. Dostupné z: https: //www.czech-neuro.cz/pro-odborniky/doporucene-postupy-2/kognitivni-poruchy/.
36. Andrews L, Silva SG, Kaplan S et al. Delirium monitoring and patient outcomes in a general intensive care unit. Am J Crit Care 2015; 24 (1): 48–56. doi: 10.4037/aj cc2015740.
37. Luetz A, Weiss B, Boettcher S et al. Routine delirium monitoring is independently associated with a reduction of hospital mortality in critically ill surgical patients: a prospective, observational cohort study. J Crit Care 2016; 35: 168–173. doi: 10.1016/j.jcrc.2016.05.028.
38. Trzepacz PT, Mittal D, Torres R et al. Validation of the delirium rating scale-revised-98: comparison with the delirium rating scale and the cognitive test for delirium. J Neuropsychiatry Clin Neurosci 2001; 13 (2): 229–242. doi: 10.1176/jnp.13.2.229.
39. Khan BA, Perkins AJ, Gao S et al. The confusion assessment method for the ICU-7 delirium severity scale: a novel delirium severity instrument for use in the ICU. Crit Care Med 2017; 45 (5): 851–857. doi: 10.1097/CCM.0000000000002368.
40. Egberts A, van der Craats ST, van Wijk MD et al. Anticholinergic drug exposure is associated with delirium and postdischarge institutionalization in acutely ill hospitalized older patients. Pharmacol Res Perspect 2017; 5 (3): e00310. doi: 10.1002/prp2.310.
41. Dillon ST, Vasunilashorn SM, Ngo L et al. Higher C-reactive protein levels predict postoperative delirium in older patients undergoing major elective surgery: a longitudinal nested case-control study. Biol Psychiatry 2017; 81 (2): 145–153. doi: 10.1016/j.biopsych.2016.03. 2098.
42. Bryant KJ. Pediatric delirium in the cardiac intensive care unit: identification and intervention. Crit Care Nurse 2018; 38 (4): e1–e7. doi: 10.4037/ccn2018947.
43. Daoud A, Duff JP, Joffe AR et al. Diagnostic accuracy of delirium diagnosis in pediatric intensive care: a systematic review. Crit Care 2014; 18 (5): 489. doi: 10.1186/s13054-014-0489-x.
44. Smith HAB, Besunder JB, Betters KA et al. 2022 Society of Critical Care Medicine Clinical Practice guidelines on prevention and management of pain, agitation, neuromuscular blockade, and delirium in critically ill pediatric patients with consideration of the ICU environment and early mobility. Pediatr Crit Care Med 2022; 23 (2): e74–e110. doi: 10.1097/PCC.0000000000002 873.
45. Menser C, Smith H. Emergence agitation and delirium: considerations for epidemiology and routine monitoring in pediatric patients. Local Reg Anesth 2020; 13: 73–83. doi: 10.2147/LRA.S181459.
46. Simonsen BY, Lisby M, Traube C et al. The Cornell Assessment of Pediatric Delirium: Translation and inter-rater reliability in a Danish pediatric intensive care unit. Acta Anaesthesiol Scand 2019; 63 (7): 900–904. doi: 10.1111/aas.13369.
47. Boogaard M, Pickkers P, Slooter AJC et al. Development and validation of PRE-DELIRIC (PREdiction of DELIRium in ICu patients) delirium prediction model for intensive care patients: observational multicentre study. BMJ 2012; 344: e420–e420. doi: 10.1136/bmj.e420.
48. van den Boogaard M, Schoonhoven L, Maseda E et al. Recalibration of the delirium prediction model for ICU patients (PRE-DELIRIC): a multinational observational study. Intensive Care Med 2014; 40 (3): 361–369. doi: 10.1007/s00134-013-3202-7.
49. Gong KD, Ryan LU, Bergamaschi TS et al. Predicting intensive care delirium with machine learning: model development and external validation. Anesthesiology 2022; 138 (3): 299–311. doi: 10.1097/ALN.0000000000004 478.
Štítky
Detská neurológia Neurochirurgia NeurológiaČlánok vyšiel v časopise
Česká a slovenská neurologie a neurochirurgie

2023 Číslo 5
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
Najčítanejšie v tomto čísle
- Výběr vhodné operační techniky při léčbě nejčastější kraniosynostózy
- Delirium a spánek v intenzivní péči I – epidemiologie, rizikové faktory a důsledky
- 3D tisk v neurochirurgii – naše zkušenost
- Delirium a spánek v intenzivní péči II – možnosti monitorace a diagnostiky
