-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Ranibizumab (Lucentis) v léčbě věkem podmíněné makulární degenerace
Autori: J. Studnička
Pôsobisko autorov: Oční klinika FN a LF UK Hradec Králové, přednosta prof. MUDr. Pavel Rozsíval, CSc.
Vyšlo v časopise: Čes. a slov. Oftal., 65, 2009, No. 3, p. 107-111
Kategória: Souborný referát
Úvod
Věkem podmíněná makulární degenerace sítnice (VPMD) je degenerativní onemocnění s maximem změn v makule. Je nejčastější příčinou praktické slepoty populace starší 55 let ve vyspělých zemích. Její prevalence stoupá s věkem, ve věku 65–74 let se vyskytuje v 10 %, u osob starších 75 let až v 25 % populace. Podle Evropské oční studie EUREYE má 51 % populace starší 65 let známky věkem podmíněné makulopatie, 3,3 % populace starší 65 let má známky pokročilé, věkem podmíněné makulární degenerace.
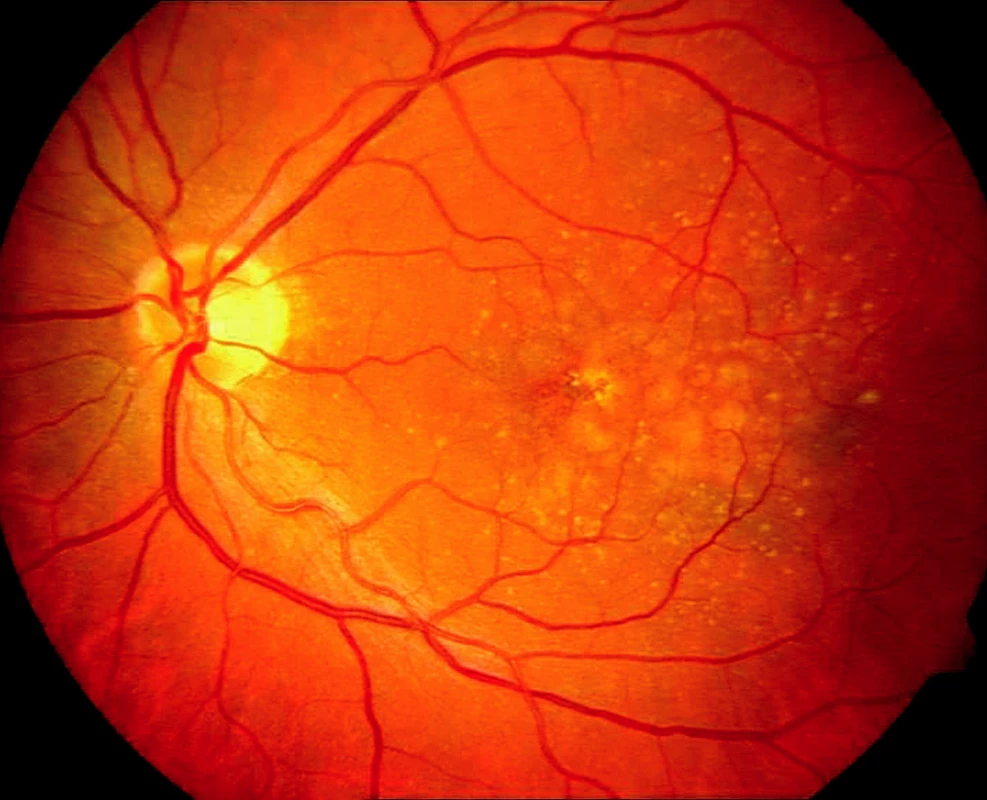
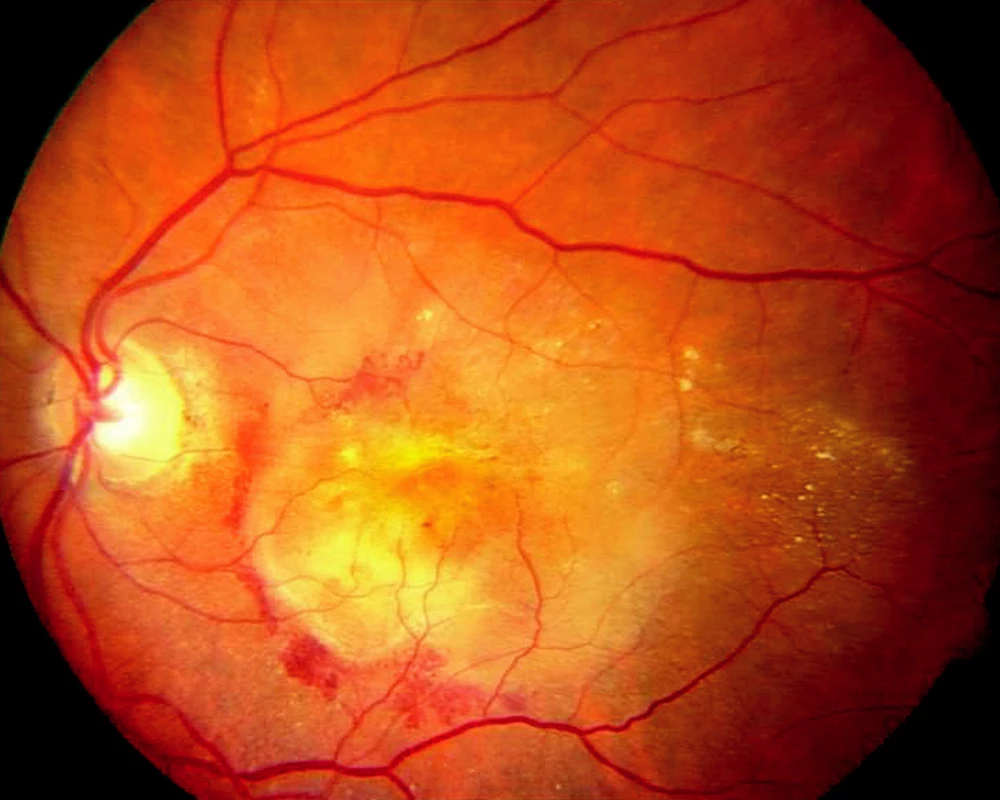
U většiny pacientů nacházíme pomalu se rozvíjející „suchou“ atrofickou formu VPMD (obr. 1), ale asi v 10 % se vyvine rychle progredující „vlhká“ forma s choroidální neovaskulární membránou (CNV), která je v 80–90 % příčinou legální slepoty (obr. 2). Podle výsledků hodnocení klinických studií lze stanovit přirozený průběh neovaskulární formy VPMD a její vliv na pokles NKZO. Průměrná vstupní NKZO byla 0,64 logMAR ( ~ 20/87 Snellenových optotypů), za jeden rok byl pokles o 0,3 logMAR (2,7 řádku optotypů), za 2 roky o 0,4 logMAR (4 řádky optotypů). Počet pacientů s NKZO 1,0 logMAR (20/200 Snellenových optotypů) a horší vzrostl z 19,7 % při vstupní hodnotě na 75,7 % v intervalu 3 let.
Léčba vlhké formy VPMD Lucentisem
2.1 vaskulární endotelový růstový faktor
V současné době se jako nejslibnější léčba vlhké formy VPMD jeví aplikace léků působících proti vaskulárnímu endotelovému růstovému faktoru. VEGF (vascular endothelial growth factor) je homodimerický glykoprotein s proti sobě postavenými monomery. Dosud je známo šest podtypů VEGF: VEGF A, B, C, D, E a P1GF (placenta growth factor). V procesu tvorby CNV se uplatňuje VEGF A, přesná příčina, která spustí tento proces však dosud není známá. Rizikové faktory zvyšující uvolňování VEGF A jsou snížení průtoku choriokapilaris a z toho plynoucí tkáňová hypoxie, akumulace produktů metabolismu lipidů, oxidační stres, porušení Bruchovy membrány a zvýšení koncentrace mediátorů (TNF-á, TGF-á) a prozánětlivých faktorů souvisejících s přítomností drúz. U člověka se vyskytuje v několika isoformách: VEGF 121, VEGF 145,VEGF 165, VEGF 189, VEGF 206. Nejčastější isoformy vyskytující se v lidském oku jsou VEGF 121 a VEGF 165.
VEGF A se váže na povrch endoteliálních buněk přes receptory VEGFR1 a VEGFR2, jeho zvýšená tvorba byla zjištěna v buňkách retinálního pigmentového epitelu (RPE) již v počínajících stadiích VPMD a zvýšená koncentrace byla prokázána také v extrahovaných CNV u pacientů s VPMD a ve sklivci těchto pacientů. Zvýšená vazba VEGF na endoteliální buňky vede k angiogenezi, lymfangiogenezi a produkci cytokinů a proteáz (IL -2, granulocyte macrophage colony stimulating factor). VEGF A hraje roli ve vývoji i udržení funkce cévního řečiště. Zvyšuje vaskulární permeabilitu, účastní se inhibice trombogeneze, zvyšuje produkci cytokinů, inhibuje apoptózu a má prozánětlivý efekt (obr. 3).
Obr. 3. vazba VEGF-A na receptor 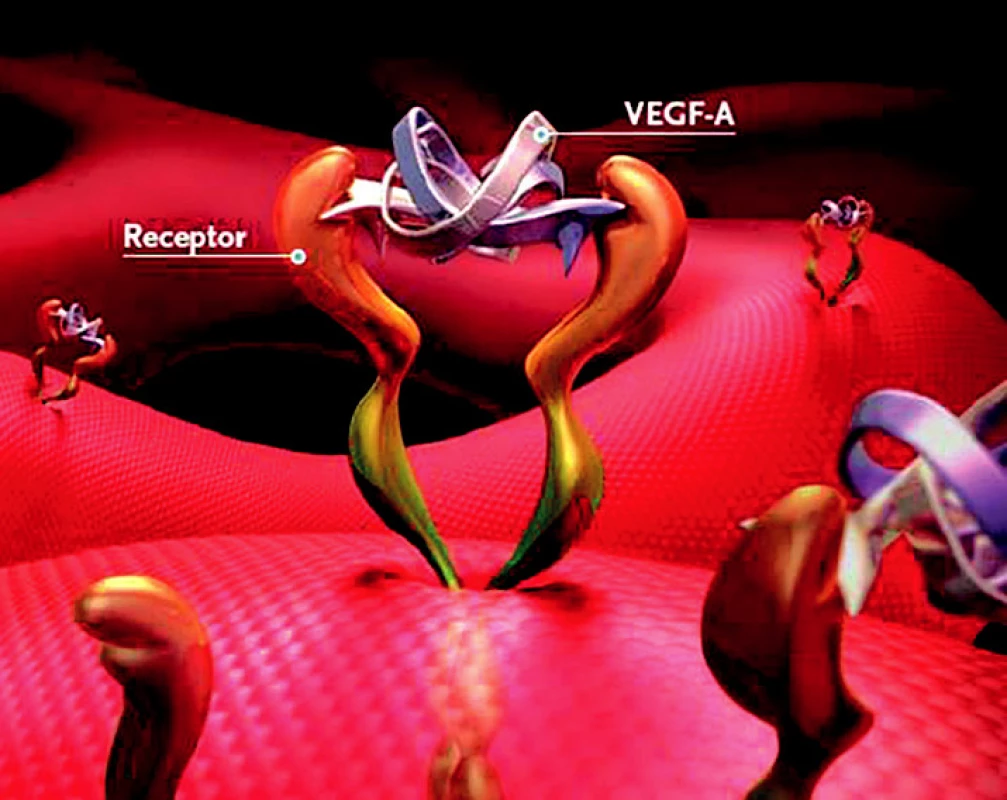
2.2. Lucentis v klinických studiích
Ranibizumab (Lucentis) je rekombinantní, humanizovaná, monoklonální protilátka o velikosti 48 kDa zaměřená proti všem isotopům VEGF A. Svou vazbou na molekulu VEGF A brání účinku vaskulárního endotelového růstového faktoru na své receptory na endotelových buňkách choroidálních neovaskulárních membrán, čímž brání růstu a zvětšování těchto membrán. Malá velikost jeho molekuly umožňuje po intravitreální aplikaci snadnou prostupnost přes sítnici k cílové CNV. Jeho další výhodou je krátký plazmatický poločas, což vede k rychlému odbourávání látky z organismu. Účinnost, bezpečnost a způsoby dávkování Lucentisu jsou ověřeny několikaletým výzkumem. Základními klinickými studiemi ke zjištění účinnosti a bezpečnosti jsou MARINA a ANCHOR. Studie, které ověřují účinnost při různých způsobech dávkování jsou PIER, EXCITE, SUSTAIN, SAILOR a PrONTO. Studie zjišťující efektivitu léčby v kombinaci s PDT jsou FOCUS, PROTECT a program SUMMIT, který zahrnuje studie DENALI a MONT BLANC.
V klinické studii The Minimally Classic/Occult Trial of the Anti-VEGF Antibody Ranibizumab in the Treatment of Neovascular Age-Related Macular Degeneration (MARINA) byl zkoumán účinek ranibizumabu v dávce 0,3 a 0,5 mg aplikovaného intravitreálně měsíčně 716 pacientům s minimálně klasickou CNV nebo okultní CNV u VPMD po dobu 2 let se vstupní NKZO v rozmezí 20/40 až 20/320. Ve sledovací době 12 měsíců byla zjištěna statisticky významná stabilizace NKZO u 95 % očí při ztrátě menší než 15 písmen ETDRS optotypů ve srovnání s 62 % očí neléčených. Ve sledovací době 2 let byla zjištěna ztráta NKZO o méně než 15 písmen ETDRS optotypů u 92 % pacientů léčených Lucentisem v dávce 0,3 mg a u 90 % pacientů léčených Lucentisem v dávce 0,5 mg ve srovnání s 52,9 % neléčených pacientů (graf 1). Při podávání 0,5 mg ranibizumabu bylo zjištěno statisticky významné zlepšení NKZO o 15 a více písmen v 33,8 % za 12 a v 33,3 % za 24 měsíců léčby, při podávání 0,3 mg ranibizumabu v 24,8 % za 12 měsíců a v 26,1 % za 24 měsíců ve srovnání s 5,0 %, resp. 3,8 % u skupiny s placebem (graf 2). Výskyt endoftalmitidy byl zaznamenán ve skupině léčených 0,3 mg ranibizumabu ve dvou případech, u skupiny léčených 0,5 mg ve třech případech. Během 2 let bylo zjištěno 4,6 % arteriálních trombembolických příhod u pacientů léčených Lucentisem ve srovnání s 3,8 % u pacientů neléčených.
Graf 1. Stabilizace NKZO – studie MARINA 
Graf 2. Počet pacientů se zlepšením NKZO – studie MARINA 
V dvouleté klinické studii The Anti-VEGF Antibody for the Treatment of Predominantly Classic Choroidal Neovascularization in Age-Related Macular Degeneration (ANCHOR) byla porovnávána účinnost ranibizumabu v léčbě klasické CNV při VPMD ve srovnání s účinností fotodynamické terapie (PDT) s Visudynem u 423 pacientů se vstupní NKZO v rozmezí 20/40 až 20/320. Ve skupině léčených měsíční intravitreální injekcí 0,5 mg ranibizumabu bylo 96,4 % pacientů se zhoršením NKZO o méně než 15 písmen ETDRS optotypů za 1 rok ve srovnání s 64,3 % pacientů léčených PDT. Tento rozdíl byl statisticky významný (graf 3). NKZO se statisticky významně zlepšila o 15 a více písmen u 40,3 % pacientů léčených 0,5 mg Lucentisu ve srovnání s 5,6 % léčených PDT (graf 4). Ve skupině pacientů léčených ranibizumabem byl zaznamenán výskyt endoftalmitidy ve dvou případech a těžké uveitidy v jednom. V obou studiích bylo po léčbě ranibizumabem prokázáno zmenšení centrální retinální tloušťky, snížení prosakování z CNV prokazatelné na FAG a zabránění růstu CNV.
Graf 3. Stabilizace NKZO rok po léčbě – studie ANCHOR 
Graf 4. Počet pacientů se zlepšením NKZO – studie ANCHOR 
Klinická studie A Phase III, Multicenter, Randomized, Double-Masked, Sham Injection-Controlled Study of the Eficacy and Safety of Ranibizumab in Subjects with Subfoveal Choroidal Neovascularization with or without Classic CNV Secondary to Age-Related Macular Degeneration (PIER) srovnávala účinnost a bezpečnost ranibizumabu v dávce 0,3 mg a 0,5 mg při prvních třech injekcích podávaných měsíčně a dalších injekcích aplikovaných čtvrtletně 184 pacientům se subfoveální CNV při VPMD se vstupní NKZO v rozmezí 20/40–20/320. Do studie nebyli zahrnuti pacienti, kteří měli předchozí léčbu PDT s Visudynem. Pokud však v rámci studie byla zjištěna predominantně klasická CNV, byla tato membrána ošetřena PDT. Většina pacientů (80 %) zahrnutých do studie měla okultní nebo minimálně klasickou CNV. Ztráta méně než 15 písmen ETDRS optotypů byla zjištěna po ročním sledování u 90,2 % pacientů, kterým byla aplikována dávka 0,5 mg a u 83,3 % pacientů s dávkou 0,3 mg ve srovnání s 49,2 % u skupiny s placebem (graf 5).
Graf 5. Stabilizace NKZO po ročním sledování – studie PIER 
Statisticky nevýznamné zlepšení o 15 a více písmen bylo zjištěno u 13,1 %, resp. 11,7 % pacientů ve srovnání s 9,5 % pacientů léčených placebem (graf 6). Po prvních 3 měsíčních dávkách bylo v obou léčených skupinách pozorováno zlepšení NKZO o 10 a více písmen oproti placebu. Po tomto zlepšení následoval pozvolný pokles NKZO o průměrně 4,5 písmene až do 12. měsíce. Nicméně u 40 % pacientů se počáteční zlepšení NKZO udrželo v průběhu celého roku. Tato stabilizace NKZO byla doprovázena statisticky významným zmenšením centrální tloušťky sítnice prokazatelným na optické koherentní tomografii (OCT). Nebyl zjištěn oční ani celkový závažný vedlejší účinek léčby.
Graf 6. Počet pacientů se zlepšením NKZO (%) – studie PIER 
Ve studii Efficacy and Safety of Ranibizumab in Patients With Subfoveal Choroidal Neovascularization (CNV) Secondary to Age-Related Macular Degeneration (EXCITE) je zjišťován účinek a bezpečnost ranibizumabu podávaného v dávce 0,3 a 0,5 mg v 3 měsíčních injekcích a poté čtvrtletně ve srovnání s 0,3 mg ranibizumabu podávaného měsíčně po dobu jednoho roku. Základním hodnotícím parametrem byl kromě NKZO nález na OCT. Cílem je identifikovat morfologické parametry v korelaci se zrakovými funkcemi. Do studie bylo zařazeno 354 pacientů se všemi typy membrán.
Studie Study of Ranibizumab in Patients with Subfoveal Choroidal Neovascularization Secondary to Age-Related Macular Degeneration (SUSTAIN) je nezaslepená, multicentrická studie, která zjišťuje účinnost a bezpečnost intravitreálně podávaného ranibizumabu u 531 pacientů se všemi typy CNV u VPMD. Do studie byli zařazeni i pacienti, kterým byl podáván ranibizumab nebo PDT v rámci studie ANCHOR. Léčba byla zahájena úvodními třemi injekcemi po měsíci (loading phase), další injekce byla dána měsíčně, pokud byl zjištěn pokles NKZO o 5 a více písmen ETDRS optotypů nebo se zvýšila centrální retinální tloušťka o více než 100 μm. Předběžné 12měsíční výsledky ukazují, že při tomto individuálním způsobu dávkování Lucentisu je možné udržet počáteční zlepšení NKZO, které je patrné po tříměsíční úvodní dávce. Ve srovnání se vstupní NKZO byl pozorováno zlepšení o průměrně 7 písmen během 12 měsíců. Toto zlepšení bylo doprovázeno průměrným poklesem centrální retinální tloušťky o 74,4 μm. Celkem bylo každému pacientovi aplikováno během jednoho roku léčby průměrně 5,3 injekce.
Studie Safety Assessment of Intravitreal Lucentis for Age-Related Macular Degeneration (SAILOR) je zaměřená na zjištění bezpečnosti u pacientů, kteří jsou léčeni ranibizumabem s úvodními nasycovacími třemi aplikacemi po měsíci a další aplikací jednou za 3 měsíce podle potřeby. Do studie jsou zařazeni i pacienti s kardiovaskulárními onemocněními. Předběžné výsledky neukazují zvýšený výskyt trombembolických příhod u pacientů léčených ranibizumabem.
Studie Prospective Optical coherence tomography imaging of patients with Neovascular AMD Treated with intra-Ocular ranibizumab (PrONTO) je dvouletá, nezaslepená, prospektivní studie, která zjišťovala účinnost a bezpečnost různého dávkování Lucentisu s důrazem na hodnocení OCT. Studie probíhala v Bascom Palmer Eye Institute v Miami a účastnilo se jí 40 pacientů se všemi typy CNV při VPMD se vstupní NKZO 20/40-20/400. Všem probandům byla aplikována úvodní nasycovací dávka 0,5 mg ranibizumabu každý měsíc v prvních třech měsících léčby, další injekce byla aplikována pokud byla splněna jedna z následujících podmínek: zhoršení NKZO o 5 a více písmen ETDRS optotypů, zvýšení centrální retinální tloušťky o 100 a více μm, rozvoj klasické CNV, nově vzniklá makulární hemoragie nebo přetrvávající tekutina v makule prokazatelná na OCT nejméně měsíc po poslední injekci ranibizumabu. Pacienti měli měsíční kontroly včetně OCT, každé 3 měsíce byla provedena fluorescenční angiografie (FAG). Roční výsledky ukazují zlepšení o 3 a více řádků ETDRS optotypů u 35 % očí, stabilizaci zraku se ztrátou o 3 a méně řádků u 95 % očí. Zlepšení o 3 a více řádků bylo po 2 letech zjištěno u 43 % pacientů. Zlepšení NKZO bylo doprovázeno poklesem centrální retinální tloušťky prokazatelným na OCT, za 2 roky v průměru o 215 μm. K dosažení těchto výsledků bylo potřeba v průměru 5,6 injekce ranibizumabu za rok a 9,9 injekcí za dva roky. Nebyl pozorován žádný oční ani systémový nežádoucí účinek léčby.
Kombinace léčby ranibizumabem a PDT s Visudynem byla sledována v klinické, dvouleté, multicentrické, randomizované studii RhuFab V2 Ocular Treatment Combining the Use of Visudyne to Evaluace Safety (FOCUS). Do studie bylo zařazeno 162 pacientů s převážně klasickou CNV, kteří byli rozděleni do dvou skupin. Většině byl aplikován ranibizumab 0,5 mg měsíčně intravitreálně, menšina dostávala placebo. Všem byla na začátku studie, týden před první injekcí, provedena PDT s Visudynem, která byla čtvrtletně opakována podle výsledku FAG. Dvouleté výsledky ukazují ztrátu méně než 15 písmen ETDRS optotypů u 88 % léčených PDT s ranibizumabem ve srovnání se 75 % léčených pouze PDT (graf 7). Zlepšení o 15 a více písmen bylo zjištěno u 25 % léčených kombinovanou léčbou oproti 7 % léčených PDT (graf 8). Ve skupině léčených pouze PDT byly během 2 let průměrně 3 reaplikace, ve skupině léčených ranibizumabem počet reaplikací klesl na 0,4. Ve skupině s kombinovanou léčbou byl zjištěn výskyt endoftalmitidy u 2,9 % očí a uveitidy u 12,4 % očí. Toto vyšší procento se přikládá počátečnímu krátkému intervalu mezi PDT a injekcí ranibizumabu a použití lyofilizovaného roztoku ranibizumabu. Po prodloužení intervalu z týdne na 28 dní a změně roztoku ranibizumabu se procento nitroočních nežádoucích účinků výrazně snížilo.
Graf 7. Stabilizace NKZO po léčbě – studie FOCUS 
Graf 8. Počet pacientů se zlepšením NKZO – studie FOCUS 
Program SUMMIT zahrnuje dvě studie sledující účinnost a bezpečnost kombinované léčby neovaskulární formy VPMD ranibizumabem a PDT s Visudynem. Studie DENALI je dvouletá studie probíhající v USA a v Kanadě. Cílem této studie je porovnat účinek měsíčně podávaného ranibizumabu s kombinací PDT ve dvou variantách. V první variantě je na začátku studie aplikována standardní dávka laseru 50 J/cm2 následována měsíčními injekcemi ranibizumabu v prvních 3 měsících. Poté je aplikováno PDT a Lucentis podle nálezu na OCT. V druhé variantě je použita redukovaná energie laseru v dávce 25 J/cm2. Ve studii je kromě hodnocení výsledku NKZO, nálezu na OCT a FAG důležité také zjištění doby nutné k další léčbě a počet opakovaných aplikací ke zjištění nejmenšího počtu nutných kontrol a reaplikací při zajištění požadované účinnosti a bezpečnosti. Obdobná, roční studie MONT BLANC prováděná v Evropě, porovnává účinek léčby samotného ranibizumabu podávaného v úvodní tříměsíční dávce oproti Lucentisu kombinovaného s PDT na začátku studie a poté každé 3 měsíce podle klinického nálezu. Ranibizumab je v každé větvi po úvodní dávce podáván podle klinického nálezu.
Diskuse
Lucentis je jedním z anti VEGF preparátů, který prokazatelně blokuje růst a zvětšování choroidální neovaskularizace působením na VEGF A. V současné době je jediným anti VEGF preparátem, který má několika multicentrickými, randomizovanými klinickými studiemi prokázaný efekt na zlepšení NKZO u pacientů s neovaskulární formou věkem podmíněné makulární degenerace. Z výsledků dotazníků pacientů, subjektivně hodnotících kvalitu zrakových funkcí po léčbě ranibizumabem, vyplynulo zlepšení provádění činností závislých na zraku, zlepšení vidění do blízka i do dálky a zvýšení kvality života. Vzhledem k předpokládané dlouhodobé léčbě pacientů jsou hledána léčebná schémata, která by umožnila snížit počet aplikací při zachování účinnosti a bezpečnosti zjištěné studiemi MARINA a ANCHOR. Výsledky těchto studií ukazují největší zlepšení NKZO v prvních třech měsících léčby. V dalších studiích byla tato skutečnost využita a dávkovací režimy začínají touto nasycovací tříměsíční dávkou (loading phase). Výsledky studie PIER ukazují různou odpověď choroidální membrány na pravidelné tříměsíční dávkování po úvodní nasycovací dávce. Vzhledem k tomu bylo vytvořeno individuální dávkovací schéma, které je v současné době i doporučeným léčebným postupem pro praktické využití léčby Lucentisem. Po úvodních měsíčních aplikacích v prvních třech měsících léčby je další aplikace doporučená při poklesu NKZO o 5 a více písmen ETDRS optotypů. Ke zvážení je reaplikace i při zvětšení centrální retinální tloušťky dokumentovaném na OCT, vznik nové makulární hemoragie nebo rozvoj klasické CNV prokazatelné na FAG, tak jak to vyplývá ze závěrů studií PRONTO a SAILOR. Dalším pokrokem v léčbě neovaskulární membrány by měla být kombinace PDT s Visudynem a anti VEGF preparátem. Obě léčebné techniky působí na jiné mechanismy CNV. PDT způsobí okluzi v léčené membráně a aplikace anti VEGF látky potlačí účinek VEGF na růst a zvětšování membrány. Cílem je dosažení inaktivace membrány a zlepšení NKZO s minimálním počtem aplikace PDT a ranibizumabu. Zhodnocení efektivity a stanovení léčebných schémat kombinované léčby poskytují studie FOCUS a probíhající program SUMMIT.
Závěr
V posledních letech s příchodem moderních léčebných technik a preparátů, mezi které Lucentis patří, se zcela změnil pohled na léčbu vlhké formy věkem podmíněné makulární degenerace. Choroba, která byla před několika lety neléčitelná, se stává nejen léčitelnou, ale i vyléčitelnou. Jestliže byla v minulých letech považována za úspěch stabilizace vidění, v současné době je možné ve většině případů zachránit nejen vidění do dálky, ale části pacientům zachovat i dobré vidění do blízka. Tato léčba však s sebou nese i nutnost časné diagnostiky, která je klíčovým momentem úspěšné terapie a dlouhodobé dispenzarizace, což vyžaduje zvýšené nároky na ošetřující lékaře, diagnostická a léčebná centra, ale i na samotné pacienty. Současný vývoj je tedy zaměřen na vytvoření co nejjednoduššího a zároveň nejefektivnějšího léčebného schématu a využití struktury všech stupňů lékařské péče s cílem co nejdříve zjistit výskyt onemocnění a možných recidiv.
MUDr. Jan Studnička, Ph.D.
Oční klinika FN a LF UK
Sokolská 581
500 05 Hradec Králové
tel. 495 833 521
e-mail: studnicka@fnhk.cz
Zdroje
Literatura u autora.
Štítky
Oftalmológia
Článek Chlamydia pneumoniae v etiologii keratoconjunctivitis sicca u dospělých pacientů (pilotní studie)Článek Akutní uzávěr centrální sítnicové arterie (CRAO) v obraze optické koherentní tomografie (OCT3)
Článok vyšiel v časopiseČeská a slovenská oftalmologie
Najčítanejšie tento týždeň
2009 Číslo 3- Dlouhodobé výsledky lokální léčby cyklosporinem A u těžkého syndromu suchého oka s 10letou dobou sledování
- Cyklosporin A v léčbě suchého oka − systematický přehled a metaanalýza
- Účinnost a bezpečnost 0,1% kationtové emulze cyklosporinu A v léčbě těžkého syndromu suchého oka − multicentrická randomizovaná studie
- Pomocné látky v roztoku latanoprostu bez konzervačních látek vyvolávají zánětlivou odpověď a cytotoxicitu u imortalizovaných lidských HCE-2 epitelových buněk rohovky
- Konzervační látka polyquaternium-1 zvyšuje cytotoxicitu a zánět spojený s NF-kappaB u epitelových buněk lidské rohovky
-
Všetky články tohto čísla
- Chlamydia pneumoniae v etiologii keratoconjunctivitis sicca u dospělých pacientů (pilotní studie)
- Ranibizumab (Lucentis) v léčbě věkem podmíněné makulární degenerace
- Akutní uzávěr centrální sítnicové arterie (CRAO) v obraze optické koherentní tomografie (OCT3)
- Drenážní implantáty v chirurgii dětského glaukomu
- Změny v tloušťce nervových vláken u non-arteritické formy AION na OCT
- Analýza prognostických faktorů anatomického a funkčního výsledku operace idiopatické makulární díry
- Informovanost a kvalita života pacientů s glaukomem
- Česká a slovenská oftalmologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Ranibizumab (Lucentis) v léčbě věkem podmíněné makulární degenerace
- Akutní uzávěr centrální sítnicové arterie (CRAO) v obraze optické koherentní tomografie (OCT3)
- Změny v tloušťce nervových vláken u non-arteritické formy AION na OCT
- Informovanost a kvalita života pacientů s glaukomem
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy