-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Diabetická retinopatie – rizikové faktory, prevence a terapie
Autoři: T. Sosna 1,2; R. Švancarová 1; M. Netuková 3
Působiště autorů: Centrum diabetologie IKEM, Praha, přednostka prof. MUDr. Terezie Pelikánová, DrSc. 1; Oční oddělení FTN, Praha, primář MUDr. Karel Sedláček 2; Oční oddělení FNKV, Praha, přednosta prof. MUDr. Pavel Kuchynka, CSc. 3
Vyšlo v časopise: Čes. a slov. Oftal., 66, 2010, No. 5, p. 195-203
Kategorie: Souborný referát
Úvod
Diabetická retinopatie (DR) je závažnou mikroangiopatickou komplikací diabetu (DM). Základem její léčby je především prevence, která vyžaduje těsnou spolupráci diabetologů, endokrinologů, praktických lékařů a edukačních sester s oftalmologem i nemocným.
Diabetická retinopatie může ve svém důsledku vést k úplné slepotě. Z hlediska psychosociálního to přináší diabetikovi, který se již se svým onemocněním naučil žít, nový jen obtížně zvládnutelný problém. Ztráta zraku je zvláště pro mladé pacienty vždy šokující a vede nemocné k psychickým porouchám a anxiózně depresivním stavům. Závažnou komplikací, která na slepotu může navázat, je bolestivá forma glaukomu, jenž i v dnešní době může končit enukleací bulbu. Je proto nezbytně nutné předejít nejenom terminálním stadiím onemocnění, ale především pokusit se zachovat funkčnost tohoto nejdůležitějšího smyslu. Přes všechny pokroky, které byly učiněny v léčbě DR, je toto onemocnění ve vyspělých zemích stále nejčastější příčinou slepoty lidí produktivního věku.
Epidemiologické rizikové faktory
Incidenci a prevalenci DR v diabetické populaci ovlivňuje řada faktorů, např. typ diabetu, věk pacienta v době vzniku diabetu, délka trvání onemocnění, ale i rizikové faktory jako je hypertenze, pohlaví a mnohé další.
U mužů se DR objevuje většinou před dosažením 45 let, u žen o něco později. Známky diabetické retinopatie se při DM 1. typu objeví do dvou let po záchytu jen u 2–7 % nemocných. Po deseti letech počet postižených narůstá na 50 % a po dvaceti letech na 75 % a více. U více než 25 % nemocných se objevuje nejzávažnější forma DR, tedy forma proliferativní (PDR). Jedná-li se o DM 2. typu, jsou změny na sítnici patrné již druhý rok po záchytu u více než 20 % nemocných. Poměrně často se stává, že u těchto pacientů podezření na DM vysloví jako prvý oftalmolog při rutinním vyšetření očního pozadí. Incidence DR po 10 až 12 letech je pak u obou typů diabetu shodná.
Odhadujeme, že v České republice je prevalence DR 12,4%. Prevalence PDR, hodnocená ve vztahu k celkovému počtu nemocných diabetem (r. 2008 : 773 561 nemocných), byla 2,5% a 23,5% byla prevalence PDR hodnocená ve vztahu k nemocným s DR. Prevalence slepoty vzniklé v souvislosti s DR byla 0,3%. V absolutních číslech je postiženo DR kolem 90 000 nemocných diabetem a z tohoto počtu 22 % mělo proliferativní formu DR. Evidováno je 2429 slepých následkem DR, což představuje od roku 1996 nárůst o více než 100 slepých ročně. Výskyt diabetické makulopatie (DMP) není v ČR sledován.
Patofyziologie DR jako základ rizikových faktorů onemocnění
Pro porozumění rizikovým a protektivním faktorům DR je třeba pochopit patofysiologii onemocnění. DR se studuje již mnoho desítek roků, přesto zůstává biochemický a molekulární mechanismus jejího vzniku nejasný. Patogenetickým podkladem DR je totiž množství známých, ale velmi pravděpodobně i dosud zcela neznámých mechanismů. Etiopatogeneticky se DM 1. a 2. typu zřetelně liší. Přesto je zřejmé, že oba typy musí mít společný faktor, který je zodpovědný za vznik a rozvoj DR. Tím společným a nepochybným patologickým agens DR je kolísání hladiny cukru, především však hyperglykémie.
Vliv hyperglykémie na cévní endotel
Zvýšení koncentrace hexózy v krvi diabetika podporuje biochemickou teorii o hyperglykémii jako základním článku vzniku DR. Biochemické hypotézy již dlouho hovoří o polyolové - sorbitolové cestě. Teorií sorbitolové akumulace, resp. přetížení (sorbitol overload) se vysvětluje hyperosmotický efekt v čočce diabetika. Příčinou tohoto stavu je hyperglykémie vedoucí k bobtnání a následné akumulaci sorbitolu a fruktózy v čočce. Škodlivý účinek hyperglykémie je charakteristický pro tkáně, v nichž není vstup glukózy do buněk závislý na inzulinu. Tyto tkáně nejsou schopny tzv. down – regulace, tedy transportu glukózy směrem do buňky, při zvýšené koncentraci krevního cukru extracelulárně. Teorie sorbitolové akumulace je založena na předpokladu, že glukóza se při hyperglykémii metabolizuje na sorbitol aldózo-reduktázovým (AR) enzymatickým mechanismem. Některé práce dokládají přítomnost AR enzymů především v pericytech sítnicových kapilár a v buňkách retinálního pigmentového epitelu (RPE). Tato teorie vysvětluje časný a velmi izolovaný zánik pericytů sítnicových kapilár.
Buněčná membrána je pro sorbitol prakticky neprostupná, což vede k jeho tkáňové akumulaci. Vytvoření dostatečného osmotického gradientu, který by primárně poškodil endotelové buňky sítnicových kapilár, je ale jen málo pravděpodobné.
Nepochybný vliv na vznik chronických komplikací u diabetiků mají pokročilé produkty neenzymatické glykace. Excesivní hromadění pokročilých produktů glykace (AGE – advanced glycation endproducts) přispívá také k mikrovaskulárním změnám sítnicových cév, mění jejich rigiditu a poškozuje pojivovou tkáň. In vitro byla prokázána jejich toxicita na pericyty i mitogenní působení na endotelové buňky.
Oxidační stres, který provází hyperglykémii, má za následek nerovnováhu mezi volnými radikály a buněčným antioxidačním ochranným mechanismem. Vznikající pseudohypoxie může porušit buněčnou membránu denaturací proteinů, poškozením DNA a přeměnou glukózy na toxický peroxid a oxoaldehyd.
Další zajímavá hypotéza se týká pericytů, které jsou na rozdíl od buněk endotelu zvláště citlivé na nedostatek glukózy.
Tak zvané paradoxní glukózové hladovění (starvation) velmi pravděpodobně vede k jejich apoptóze. Tento zdánlivě nelogický jev je způsoben dlouhodobou hyperglykémií vedoucí ke změně imunoreaktivity glukózového transportéru 1 (GLUT 1). Jeho porušená funkce v pericytech způsobí sekundárně snížený přestup glukózy do buňky. Apoptóza následkem dlouhodobé hyperglykémie je také zjištěna u endotelových buněk.
Diacylglycerol(DG) spolu s Ca2+ a dalšími látkami tvoří komplex aktivující proteinkinázu C (PKC). Navíc je DG prekurzorem při syntéze prostaglandinů. Enzymová aktivita PKC a DG je zřetelně vyšší u diabetiků. Je zjištěno, že PKC významně ovlivňuje nejenom cévní permeabilitu, ale i kontraktilitu mezangiálních buněk (zřejmě opět specifickým působením na pericyty), krevní průtok i angiogenezi. Působí také na intracelulární adhesivní molekuly a cytokiny jako transformační růstový faktor-β (transforming growth factor-β, TGF-β). Cévní endotelový růstový faktor (vascular endothelial growth factor, VEGF) je aktivován PKC také u těžké hypoxie, která je průvodním jevem pokročilejších forem DR.
Hemorheologické změny
Dlouhodobá hyperglykémie vede různými mechanismy k poruše mikrocirkulace. Ta je sledována kapilární hyperpermeabilitou. Hyperglykémie zvyšuje krevní viskozitu a mění koncentraci plazmatických proteinů. Současně se zvyšuje trombocytární agregace. Změny rigidity a flexibility erytrocytů vedou k mikrotraumatizaci endotelových buněk kapilár, při které se zvyšuje množství uvolněného von Willebrandova faktoru, jenž má přímý agregační vliv. Mechanické poškození je zřejmě výraznější také díky zrychlenému průtoku krve kapilárami, který provází hyperglykémii. Současně výrazně klesá oxygenace. Negativní vliv na vznik DR má i snížení schopnosti přenosu kyslíku erytrocyty u diabetiků.
Rovněž leukocyty hrají důležitou roli v patogenezi DR. Velikost leukocytů téměř dosahuje průměru kapilár. Díky své pozoruhodné schopnosti deformace jimi ale u zdravého jedince bez problému procházejí. U diabetiků se však zvyšuje jejich adherence k endotelu a mohou tak uvolňovat proteolytické enzymy. Leukocytární adheze také zvyšuje inflamatorní odpověď tkání. S narůstající průtokovou rezistencí se zároveň uvolňují i kyslíkové radikály. Tyto změny také mohou mít za následek kapilární okluzi. Na zvýšenou adhezivitu má zřejmě vliv i Golgiho glykosylovaný enzym.
Hemodynamické změny
V počátcích nekontrolovaného diabetu dochází ke změnám průtoku krve kapilárami. Například experimentálně vyvolaná glykémie kolem 25 mmol/l jej již signifikantně zvyšuje. Některé práce za použití LDV (laser doppler velocimetry) označují jako kritickou hladinu 17 mmol/l. Podobný, i když méně významný jev je však zaznamenán i při hypoglykémii. Změny průtoku bezprostředně snižují vaskulární reaktivitu. Na zvířatech bylo prokázáno, že i tyto změny poškozují endotel cév. Jistě se na tomto poškození podílí mechanicky, změnou své rigidity, i krevní elementy. Jak již bylo řečeno, předpokládá se mikrotraumatizace endotelu kapilár. Paradoxně se při vyšším průtoku krve kapilárami mění laminární proudění na turbulentní.
Ve chvíli, kdy se diabetická retinopatie vyvinula, se snižuje průtok krve ve střední periferii sítnice. Je to ochranný mechanismus, jímž je zachován normální průtok ve funkčně důležitější centrální oblasti. Teprve následkem dalšího poklesu průtoku krve sítnicí a vznikem rozsáhlejších ischemických oblastí je poškozena perifoveolární oblast, v níž dramaticky klesá průtok krve.
Retinální pigmentový epitel sítnice
V patogenezi vzniku DR hraje velmi významnou roli retinální pigmentový epitel (RPE). U diabetika dochází k nárůstu koncentrace sorbitolu v RPE a tím k primárním změnám osmotického gradientu a Na+ - K+ - ATP aktivity. Tímto mechanismem se vysvětluje především porucha metabolismu buněk nervové tkáně, ganglionární i nukleární vrstvy sítnice. Larson s Paulsonem roce 1962 publikovali práci, ve které prokázali, že hyperglykémie u diabetiků vede k poklesu nitrooční tenze. Podobný jev byl pozorován i u hypoglykémie. (Noční hypoglykémie zřejmě na podobném principu vedou u proliferativní DR ke vzniku akutního hemoftalmu.) Tato relativní hypotenze může morfologicky i funkčně měnit strukturu RPE. Hovoří se o vchlípení plazmatické membrány (infolding) na bazální ploše RPE buněk, přilehajících k choriokapilaris. Funkční alterace RPE může být jednou z příčin zhroucení zevní, ale i vnitřní hematookulární bariéry. Abnormální transport přes porušený RPE umožňuje některým proliferačním faktorům snadno pronikat do sklivce a zvyšovat proliferační potenciál oka. Perfuzní tlak sítnicových cév je definován rozdílem mezi intravaskulárním a intraokulárním tlakem. Snížení intraokulární tenze vede k relativnímu zvýšení perfuzního tlaku, k progresi venózní dilatace a později ke zhroucení autoregulačních systémů. Relativní nárůst perfuzního tlaku také vede k výraznější exsudaci a zeslabení stěn kapilár a spolupůsobí při vzniku mikroaneuryzmat (MA), časných známek DR. Tento mechanismus by také vysvětloval vyšší zánik fragilnějších pericytů v sítnici, než jaký je v ostatních orgánech, s výjimkou srdce, kde jsou též rozdílné perfuzní tlaky.
Dynamika patogenetických změn
Dlouhodobá hyperglykémie tedy vede k dalším mikrocirkulačním změnám. Projevují se kapilární dilatací a kapilární hyperpermeabilitou, vaskulární okluzí a konečně formací novotvořených cév, tedy proliferací.
Kapilární dilatace a kapilární hyperpermeabilita
Kapilární dilatace je prvou, klinicky významnou, časnou manifestací DR. Je dobře patrna při fluorescenční angiografii dokonce i v době, kdy ještě nejsou jasné histoanatomické změny na endotelových buňkách a bazální membráně.
Pokračující proces se projevuje na kapilárách vymizením pericytů. Rozvolňuje se kontakt mezi buňkami endotelu a pericyty, které přestanou ovlivňovat průtok krve v kapilárách a tím dochází i k postupné involuci cévního řečiště.
Kapilární hyperpermeabilita je další změnou, která vzniká patrně následkem změn předchozích. Jedná se o histoanatomické změny bazální membrány kapilár. Následná extravazace (prosakování séra) vede ke vzniku edému sítnice a k jejímu závažnému funkčnímu poškození.
Vaskulární okluze
Dalším projevem poškození sítnice u diabetika je vaskulární okluze. Ani příčina tohoto procesu není úplně vysvětlena. Předpokládá se, že podstatou tohoto jevu je aktivní hemostáza a zvýšená agregace trombocytů v krvi diabetických pacientů s retinopatií. Vliv leukocytů na kapilární okluzi byl již popsán. Tvorba mikrotrombů je usnadněna změněnou fibrinolytickou a antitrombotickou aktivitou poškozených buněk endotelu. Na tomto stavu se podílí i zrychlený průtok krve, zvýšená krevní viskozita a další hemorheologické změny (zvýšená koncentrace fibrinogenu, změny plazmatických proteinů apod.). Tyto abnormality byly prokázány jak in vivo, tak in vitro. Přímý vliv na kapilární okluzi mají zřejmě i lipoproteiny nízké denzity (LDL), inzulin, histamin a uvolněné katecholaminy v průběhu reaktivních hypoglykémií. Okluzivní procesy již přímo vedou ke vzniku ischemických oblastí v sítnici a k následné hypoxii až úplné anoxii přilehlých tkání.
Formace novotvořených cév
Poslední z triády diabetických sítnicových abnormalit je formace novotvořených cév.
Opět to není specifický projev DR. Formaci novotvořených cév nacházíme na sítnici u pacientů s venózní okluzí, u vaskulitid, ale i u srpkovité anémie. U všech těchto případů je primární změnou, předcházející vznik novotvořených cév, arteriolární a kapilární okluze.
Za jeden z hlavních patofyziologických podkladů tvorby neovaskularizací je považována hypoxie. Prvním krokem směřujícím k tvorbě novotvořených cév je rozpad extracelulární matrix. Příčinou tohoto rozpadu je sekrece proteoglykanů, hypoxií poškozenými endotelovými buňkami. Po ní následuje buněčná migrace a proliferace. Konečnou fází je formace cévního lumina.
Endokrinní a růstové faktory mohou hrát významnou roli v patogenezi proliferativní formy diabetické retinopatie. K nejvýznamnějším patří růstový hormon (GH). Hladiny růstových hormonů jsou u diabetiků zvýšené. GH působí prostřednictvím insulin (like) growth factor-1, (IGF-1). IGF-1 je produkován především endotelovými buňkami a jeho hladiny u inzulin dependentních pacientů jsou obecně nízké. Hladina tohoto hormonu se významně zvyšuje u progresivních forem DR, ale také při náhlé kompenzaci dlouhodobě dekompenzovaného diabetu. Jeho zvýšenou koncentraci nacházíme ve sklivci u diabetiků s proliferativní DR.
Podle experimentálních studií i podle toho, jaké jsou hladiny IGF-1 po laserové panretinální fotokoagulaci sítnice (PRFK), se předpokládá, že IGF-1 je vytvářen nejenom buňkami endotelu a pericyty, ale i RPE sítnice. Někteří autoři tvrdí, že IGF nemá přímý vliv na DR. Jeho působení závisí na IGF-BP (binding protein), který je produkován v játrech. Vylučování IGF-BP je přímo úměrné přísunu potravy. U pacientů s bulimií vídáme výraznou progresi DR.
Již od roku 1948 je předpokládána existence těchto angiogenních faktorů, které umožňují růst novotvořených cév. Jejich existence byla potvrzena v roce 1956. Tyto faktory jsou za fyziologických podmínek v rovnováze s antagonisticky působícími inhibičními faktory.
Vascular endothelial growth factor – VEGF, jeden z dalších proliferačních faktorů, je velmi úzce spjat s vazoobliterující hypoxickou sítnicí a s PKC a AGE. Basic FGF (fibroblast growth factor) je produkován endotelovými buňkami a při jejich zániku se uvolňuje a ukládá do extracelulární matrix. Specifickým způsobem podporuje proliferaci také poškozený RPE (působením RDGF, retina derivated growth factor). Do tohoto procesu současně vstupuje i mitogenní efekt růstového hormonu, který je opět zprostředkován IGF-l.
Dalšími růstovými faktory, které mohou výrazně ovlivnit proliferaci, jsou basic a acidic fibroblast growth factor (bFGF, aFGF), dále platelet derivated growth factor (PDGF) a transforming growth factor β (TGFβ).
Je známa existence angiogenezi inhibujících faktorů (somatostatin, oktreotid, polypeptid hypotalamu), které inhibují uvolňování GH. Hladina růstového faktoru zřejmě přímo ovlivňuje průběh DR u dětí a dospívajících.
Jak již bylo řečeno, u zdravého jedince se předpokládá rovnováha mezi angiogenezi stimulujícími a inhibujícími faktory. Tyto inhibující faktory jsou také obsaženy v endotelových buňkách, v pigmentovém epitelu sítnice a pravděpodobně i v pericytech. Při poruše této rovnováhy, následkem poškození endotelu či RPE mohou cévy proliferovat. Formování novotvořených cév je zcela specifická, izolovaná vlastnost sítnice, která nemá obdobu v jiných orgánech.
Primární histopatologické změny nacházíme v kapilárním řečišti. Tyto změny se týkají především pericytů, buněk endotelu a bazální membrány.
Klinické projevy DR
Prvou známkou DR jsou mikroaneuryzmata (MA). Jejich dekompenzací či rupturou změněných kapilár sítnice vznikají mikrohemoragie (MH) a větší hemoragie (HM), které jsou uloženy v různých vrstvách sítnice. Inkompetence MA, ale i kapilární stěny, vede k prosakování séra a vzniku exsudátů, které obsahují převážně lipoproteidy. Tyto změny nejsou specifické pro DR. Nacházíme je i u jiných systémových onemocnění. Rozdíl je však v jejich dynamice a distribuci. Pokračující DR vede k převážně venózním změnám, které nazýváme diabetická flebopatie. Vzniku nejzávažnější formy, proliferativní DR (PDR), většinou předchází rozvoj intraretinálních mikrovaskulárních abnormalit (IRMA). Změny jsou charakterizovány dilatovanými a teleangiektatickými, tortuózními kanály mezi diabetem poškozenými arteriolami a venulami. Následná ischémie střední periferie vede k rozvoji neovaskularizací. Podle jejich lokalizace je dělíme na neovaskularizace na papile zrakového nervu (NVD) či na sítnici (NVS). Oba typy může doprovázet fibrózní tkáň. Ta může trakcí vést k dvěma zásadním komplikacím – masivnímu krvácení do sklivce (hemoftalmu) nebo k odchlípení sítnice.
Diabetický retinální edém
Základní dělení diabetického retinálního edému je na fokální a difuzní, extracelulární a intracelulární. Podstatou edému je zhroucení zevní, ale i vnitřní hematookulární bariéry. Pokud edém zasáhne makulární krajinu, hovoříme o diabetické makulopatii, která je příčinou výrazného poklesu zrakové ostrosti.
Klasifikace a stručná klinická charakteristika DR
Na základě dynamických sítnicových změn rozlišujeme následující klinická stadia a formy DR: neproliferativní DR (NPDR), proliferativní DR (PDR) a diabetickou makulopatii (DMP).
Neproliferativní DR (NPDR)
Základními klinickými znaky NPDR jsou mikroaneuryzmata, hemoragie, flebopatie, intraretinální mikrovaskulární abnormality a vatovitá ložiska. Podle pokročilosti změn lze NPDR rozdělit na počínající [4 – 0 – 0], (čísla v závorkách značí počet kvadrantů, ve kterých jsou přítomné klinické progresivní znaky uzávěru kapilár: hemoragie – flebopatie – intraretinální mikrovaskulární abnormality, tzv. Davis Murphyho pravidlo), středně pokročilou [4 – 1 – 0] a pokročilou. Pokročilá NPDR má širokou škálu klinických progresivních znaků sítnicové nonperfuze a ischémie, dynamicky měnící pokročilou formu [4 – 2 – 1] ve velmi pokročilou formu NPDR [4 – 4 – 4]. Obě tyto formy považujeme za rizikový stav (obr. 1)!
Obr. 1. Přechod velmi pokročilé NPDR do PDR 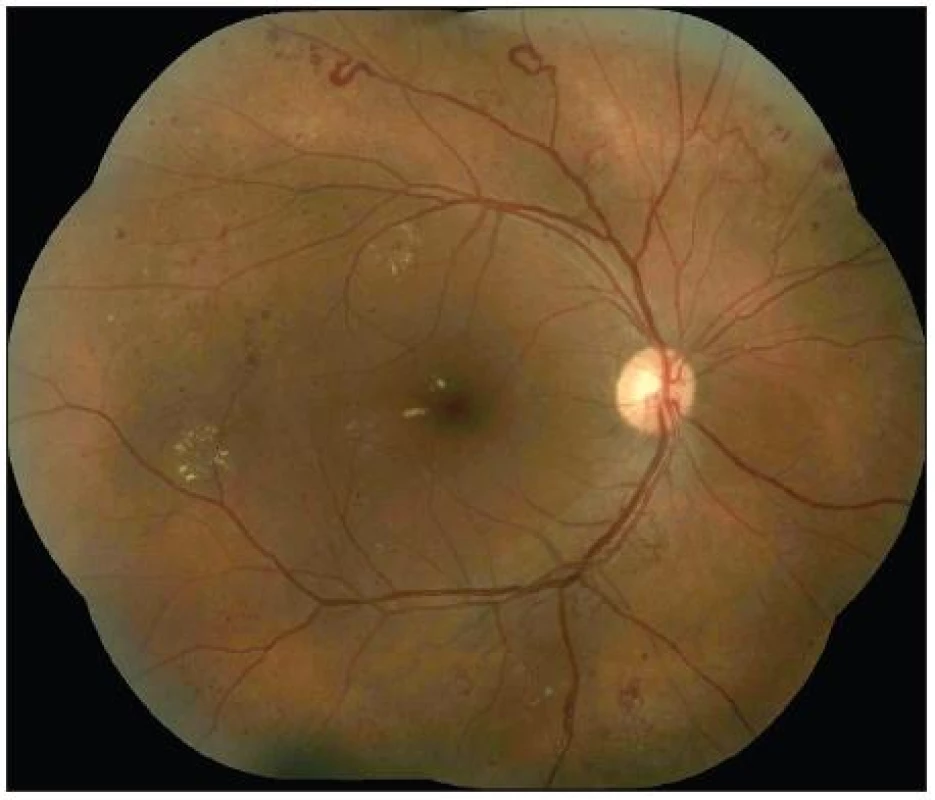
Proliferativní DR
Pro diagnózu PDR je nezbytná přítomnost novotvořených cév kdekoliv na sítnici nebo na disku zrakového nervu bez účasti či s účastí doprovodné fibrózní tkáně. Kromě progresivního nálezu neovaskularizací a fibrózní tkáně se pokročilá PDR projevuje také komplikacemi, jakými jsou větší preretinální a intravitreální krvácení, trakční nebo rhegmatogenní odchlípení sítnice a neovaskularizace na duhovce. Podle dynamiky onemocnění rozlišujeme počínající a vysoce rizikovou PDR. Vysoce riziková PDR je definována přítomností neovaskularizací na disku zrakového nervu v rozsahu 1/4 až 1/3 papily a/nebo novotvorbou cév kdekoliv na sítnici postihující nejméně 1/4 plochy papily, doprovázenou krvácením do sklivce (obr. 4).
Obr. 2. PDR s trakční amocí a parciálním hemoftalmem 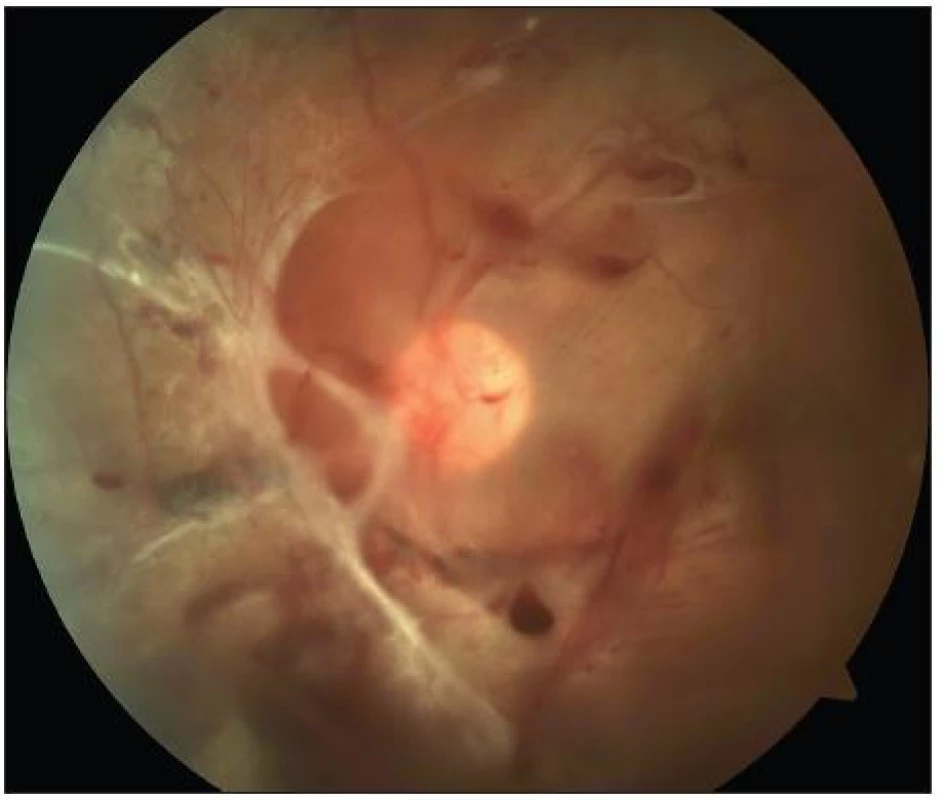
Diabetická makulopatie
DMP vzniká následkem zhroucení hematookulární bariéry a ve svém důsledku vede k akumulaci extracelulární tekutiny, sítnicovému edému a obvykle i k ukládání proteinů a lipidů ve formě tvrdých exsudátů. Makulární edém je definován jako retinální ztluštění či tvrdé exsudáty v dosahu 1 papilárního průměru (1500 mikronů) od centra makuly.
Klinicky signifikantní makulární edém (KSME)
Early Treatment Diabetic Retinopathy Study (ETDRS) používá tento jednoznačně definovaný výraz pro zdůraznění makulárního edému, který bezprostředně ohrožuje foveu a centrální zrakovou ostrost. Stav vyžaduje neprodlenou laserovou koagulaci (obr. 2).
Obr. 3. KSME – stav před zahájením mřížkové fotokoagulace 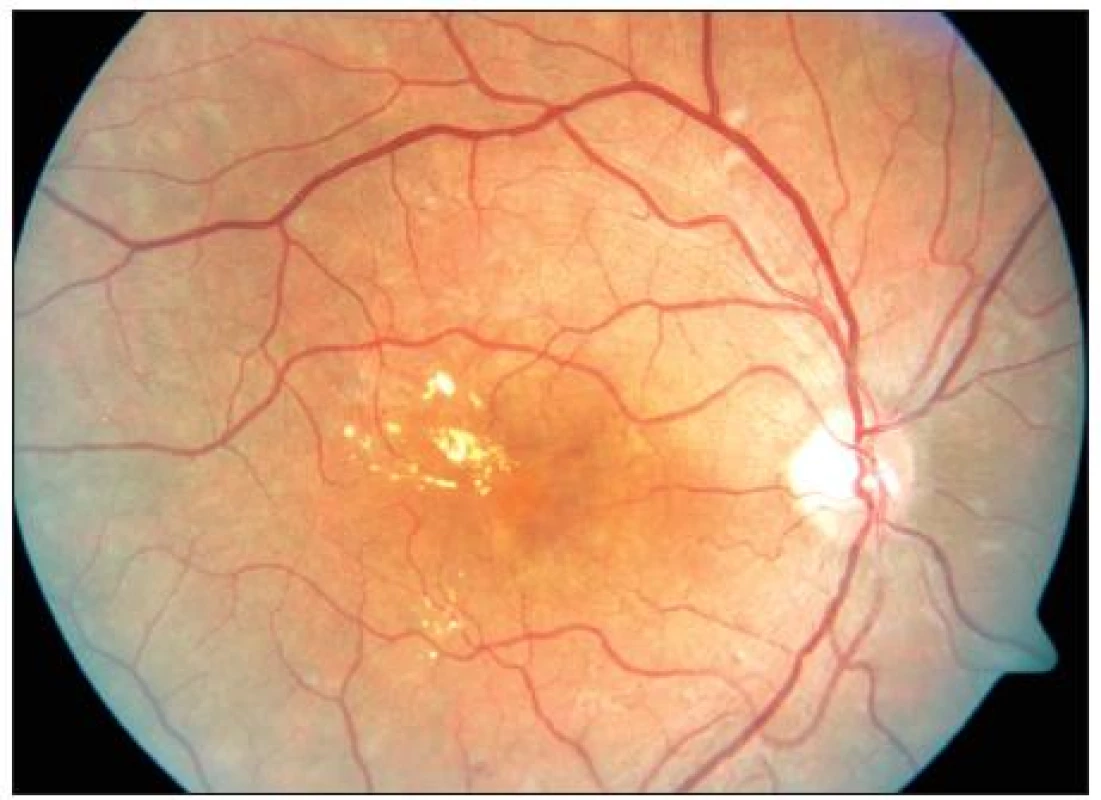
Extraokulární rizikové faktory DR
Kromě již zmíněných nepochybných rizikových faktorů, jako je typ diabetu, obecný časový faktor vzniku i délky trvání DM, kompenzace a četnost hyperglykémií, lze považovat za podstatný rizikový faktor hypertenzi. Důležitost tohoto faktoru podtrhuje skutečnost, že 30 až 50 % diabetiků evropské populace trpí hypertenzí. Neexistuje zatím jasná shoda v tom, jaká je hranice systolického a diastolického TK, ovlivňující negativně diabetickou retinopatii. 130/80 mmHg je doporučená hodnota, která by neměla negativně ovlivnit DR. I když existují pouze nepřímé důkazy o vlivu lipidů na DR, je doporučená hodnota cholesterolu 4,5 mmol/l, triacylglycerolů 1,7 mmol/l. Antikoncepce s vysokými dávkami estrogenů je rovněž vysoce rizikovým faktorem DR. Stejně tak rizikové jsou hematologické poruchy, např. zvýšená spontánní agregace destiček, leukocytóza a zvýšená viskozita krve. Některé zvýšené koncentrace sérových albuminů mohou mít také za následek progresi DR. Otázka genetických faktorů, ač je dlouhodobě zkoumána, je značně kontroverzní. Existuje úzký vztah mezi DR a diabetickou nefropatií (DN) u diabetiků 1. typu. Pokud je jedna z těchto mikroangiopatií přítomna samostatně, pak je to významně častěji DR bez DN. Klinická DN znamená pro diabetiky 1. typu osmkrát vyšší roční incidenci PDR, než jakou nacházíme u diabetiků bez poškození ledvin. Mikroalbuminurii považujeme za známku rizika proliferativních změn na sítnici. Podobný vztah je i u diabetiků 2. typu. Hovoříme o retino-renálním syndromu. Nejasný je dosud přímý vliv inzulinu na diabetickou retinopatii. Někteří se domnívají, že inzulin je i růstovým faktorem pro vývoj pericytů a jeho hladina udržuje pericyt při životě. Z tohoto důvodu by absence inzulinu v krvi mohla vést k jejich zániku. To však nevysvětluje vznik diabetické retinopatie u DM 2. typu, kde mohou být koncentrace inzulinu normální nebo dokonce zvýšené. Zde se zřejmě uplatňují další složité mechanismy.
Okulární faktory
Za okulární rizikový faktor je považována žilní okluze, která zvyšuje hypoxii sítnice. Dalšími pravděpodobnými rizikovými faktory jsou operace katarakty, která může akcelerovat stávající DMP ale i PDR, dále pak radiace, trauma, tumor a uveitida. Naopak za protektivní okulární faktory se považují chorioretinální jizvy, amblyopie a pravděpodobně i vysoká myopie. Ochranným mechanismem zde je zřejmě ztráta retinálních gangliových buněk, a tím i snížená metabolická aktivita sítnice, stejně jako hemomodulační změny při chorioretinálním pnutí cév. (Jeden z principů laserové léčby.) Na podobném principu je zřejmě založena i protektivita úplné zadní ablace sklivce a vyššího nitroočního tlaku (primárního glaukomu).
Extraokulární faktory hrají významnou roli v dispozici oka diabetika k retinopatii. Okulární faktory jsou však zřejmě zodpovědné za to, jak, kdy a do jaké míry se diabetická retinopatie rozvine.
Časté diagnostické chyby a problémy
Z praktického hlediska je nejzávažnějším problémem včasná diagnostika diabetické retinopatie. Je proto důležité, aby byl nemocný pravidelně vyšetřen oftalmologem. Je nutné, aby vyšetření bylo provedeno vždy v uměle navozené mydriáze, nejenom oftalmoskopicky, ale především biomikroskopicky.
Diabetická retinopatie by diferenciálně diagnosticky v zásadě neměla činit potíže. Problémem může být ale hypertonická retinopatie, tím spíše, že je vysoké procento diabetiků nemocných hypertenzí. Zde zůstává důležitá anamnéza, ale často i zkušenost oftalmologa.
Při progresivních změnách očního pozadí může oftalmolog doporučit těsnější kompenzaci diabetu a intenzifikovaný režim. Rychlá kompenzace DM může vést ke vzniku syndromu časného normoglykemického zhoršení
Syndrom časného (přechodného) normoglykemického zhoršení
Zahájení intenzifikovaného inzulinového režimu, přechod na léčbu inzulinovou pumpou (CSII), úspěšná transplantace pankreatu, či jen rychlá těsná kompenzace DM vede někdy paradoxně ke zhoršení stávající DR. Tento děj byl zaznamenán již na počátku 80. let a byl nazván transient worsening (TW). Později s přibývajícími znalostmi tohoto jevu byl používán výraz early worsening syndrom (EW). V současné době je používán název normoglycaemic re-entry phenomenon. Příčinou tohoto fenoménu je prudký pokles glykémie, který vede k nárůstu hladiny růstových faktorů v krvi. Na fundu dochází k rychlé progresi pokročilých forem diabetické retinopatie i makulopatie. Progrese retinopatie je vždy charakterizována těžkou hypoxií, edémem a vznikem měkkých exsudátů. Stav může připomínat panretinální edematózní kapilaropatii. (Podobným způsobem může DR akcelerovat za fyziologických stavů, tj. v pubertě a v těhotenství, kdy dochází také ke zvýšení hladiny IGF-1 – Insulin Growth Factor.) Syndrom nepovažujme za fatální komplikaci. Je jisté, že se toto zhoršení může vyskytnout jak u konvenční léčby, tak i u intenzifikované terapie. Syndrom neprobíhá vždy benigně (proto i změna názvu v studii DCCT z TW na EW). Určujícím rizikovým faktorem EW syndromu je hladina HbA1c na počátku kompenzace stejně jako délka trvání DR. Čím vyšší je hladina glykovaného hemoglobinu a čím déle trvá DM, tím více narůstá riziko. Vliv má ovšem i stupeň DR při počátku kompenzace DM. Čím méně je retinopatie pokročilá, tím je riziko zvratu menší. Prudký pokles hladiny glykovaného hemoglobinu je tedy hlavním rizikovým faktorem pro vznik EW syndromu. Důležité je, že se tento stav může objevit jak u DM 1. typu, tak i u DM 2. typu.
Doporučený postup při předpokládaném rychlém poklesu glykémie
Středně pokročilá neproliferativní DR – oftalmologická kontrola každé 2–3 měsíce.
Pokročilá neproliferativní DR a rozvíjející se proliferativní DR – panretinální fotokoagulace.
Diabetická makulopatie – provést fluorescenční angiografii, event. následně laserovou fotokoagulaci.
Tam, kde je to možné, snažit se těžce dekompenzovaného diabetika kompenzovat pomaleji, zvláště je-li HbA1c vyšší než 10 %. Optimální by bylo snižovat glykémii o 2 mmol/l za měsíc. V žádném případě nesmí být toto riziko příčinou oddalování intenzifikované terapie! Výsledky dlouhodobých diabetologických studií prokázaly, že intenzifikovaná léčba výrazněji snižuje riziko komplikací ve srovnání s konvenční léčbou!
Těhotenství
Pokud se pacientka s DR rozhodne otěhotnět, je třeba ji upozornit na riziko akcelerace očního nálezu. Kontroly jsou nutné před početím a při nálezu DR následně v každém trimestru. Stabilizace DR dostupnými prostředky je nezbytnou nutností. Těhotenství není kontraindikací laserové terapie. Těhotenství spojené s hypertenzní chorobou je u diabetiček 1. typu rizikovým faktorem pro rozvoj stávající DR. Tyto pacientky mají riziko progrese téměř dvojnásobné oproti těhotným diabetičkám bez hypertenze. Je-li ale nález na fundu těhotné diabetičky negativní a nemá-li navíc hypertenzi, je nebezpečí vzniku DR téměř nulové. Těsná a rychlá kompenzace glykémie na začátku těhotenství a v jeho průběhu je opět provázena vysokým rizikem makulárního edému. Indikace a provedení laserové léčby jsou u těhotných diabetiček shodné s ostatními diabetiky. FAG v průběhu těhotenství neprovádíme, teratogenní a mutagenní efekt fluoresceinu nebyl ale zatím prokázán. Gestační diabetes má riziko DR nulové.
Porod
Diabetická retinopatie není kontraindikací spontánního porodu. Větší opatrnosti je zapotřebí při proliferativní DR s recidivujícím hemoftalmem, kdy je vhodná společná konzultace porodníka, diabetologa a oftalmologa.
Kontraceptiva
S otázkou hormonálních změn v průběhu těhotenství bezprostředně souvisí i otázka perorální antikoncepce. Pokud jsou totiž podávány vyšší dávky estrogenu, je riziko akcelerace diabetické retinopatie až třikrát vyšší, než pokud se podává pouze progesteron.
Antikoagulační terapie
Předmětem diskuse je rizikovost antikoagulační léčby, event. fibrinolytické léčby při infarktu myokardu, plicní embolizaci a dalších vitálních indikacích. DR by v těchto vitálních případech neměla představovat kontraindikaci pro podávání výše uvedených preparátů. Je samozřejmé, že ve vitálních indikacích, jako je například heparinizace při hemodialýze nebo při žilních trombózách, postupujeme velmi opatrně za pečlivé kontroly hemokoagulačních parametrů, zejména u vysoce rizikových forem PDR. Pokud nejde o vitální indikaci, nepodáváme antikoagulační léčbu v časném období po čerstvém krvácení do oka.
Komunikační problémy
Dlouhodobě přetrvávajícím a velkým problémem je vzájemná komunikace mezi diabetologem a oftalmologem. Přestože Česká diabetologická společnost (ČDS) doporučila standardizované a již velmi sofistikované průkazy diabetiků, většinou nejsou používány a pokud ano, tak neobsahují všechny předepsané a požadované, recentní informace. Z anamnézy od pacientů se většinou potřebné údaje nedovíme a pokud ano, jsou kusé, nepřesné, někdy záměrně zkreslené a nemusí být pravdivé. Pro úspěšnou léčbu DR musí mít oftalmolog relevantní informace o nemocném, které je nutno vyžadovat. Žádanka na prvé vyšetření, ale i na další kontrolní vyšetření by měla obsahovat všechny informace o nemoci. Typ diabetu i jeho případné překlasifikování je důležité z hlediska léčebného postupu. Velmi důležitou informací je pro oftalmologa hladina glykovaného hemoglobinu, event. preprandiální a postprandiální glykémie, krevní tlak i hladiny lipidů. Nepřímé důkazy v intervenčních studiích ARIC (Atherosclerosis Risk in Communities), FIELD (Feno - fibrate Intervention and Event Lowering in Diabetes) totiž ukazují také důležitost kompenzace hladin lipoproteinů u diabetiků, a to i vzhledem k mikroangiopatii. Proto jsou pro nás významné i tyto hodnoty, především z hlediska léčby makulárního edému. Neměli bychom zapomínat ani na genetické faktory, tedy na rodinnou anamnézu, která může být zdrojem důležitých faktů a při tom mnohdy bývá pacientem záměrně zamlžována. Je nutné sledovat změny terapie či překlasifikování DM. Rozvoj retino-renálního syndromu je pro nás mnohdy indikátorem zahájení laserové léčby diabetické makulopatie. Z tohoto důvodu jsou proto velmi cenné informace o proteinurii, albuminurii a dialýze. Je nutné vyžadovat informace o medikaci, kterou pacient užívá, neboť velká většina pacientů ji není schopna reprodukovat.
Stejně tak jako diabetolog oftalmologa by měl informovat oftalmolog diabetologa. Měl by mu napsat přesný, jednoduchý a výstižný nález. Měl by informovat i o svých léčebných záměrech. Za samozřejmost musíme považovat i doporučení periodických kontrol.
Prognóza, prevence a screening
Prevence vzniku a progrese DR může být realizována za předpokladu odborné spolupráce diabetologů, internistů a oftalmologů. Cílem léčby diabetologa u nemocných diabetem ve vztahu k prevenci a stabilizaci DR je dlouhodobá normoglykémie, kompenzace hypertenze a kontrola dyslipidémie. Cílové hodnoty kompenzace jsou uvedny v tabulce 1. Diabetolog doporučuje nemocného diabetem k vyšetření oftalmologem vždy při záchytu onemocnění a pak minimálně jednou za rok. Oftalmolog pak odpovídá za včasný záchyt DR, eviduje diabetiky s DR, zve je k pravidelným kontrolám a zajišťuje specializovanou oftalmologickou léčbu. Aktivní screening provádí oftalmolog u dětí od 10 let u DM 1. a 2. typu bezprostředně po stanovení diagnózy DM. Četnost kontrol u diabetiků s DR je častější (po 3 až 6 měsících) a závisí především na stupni DR. Častější kontroly jsou nutné také během těhotenství a při předpokládaném rychlém zlepšení kompenzace diabetu. V těchto případech je nutný kontakt diabetologa s oftalmologem. Komplexní léčebně preventivní postupy, které zahrnují intervenci rizikových faktorů (hyperglykémie, hypertenze), aktivní screening DR a specializovanou oftalmologickou léčbu, redukují riziko úplné ztráty zraku o více než 90 %. V léčebných standardech ČDS se již objevuje požadavek na zavedení fotografického screeningu diabetiků non-mydriatickou kamerou, tak jako je tomu již v některých severoevropských státech.
Tab. 1. Cíle léčby DM ve vztahu k prevenci a stabilizaci DR 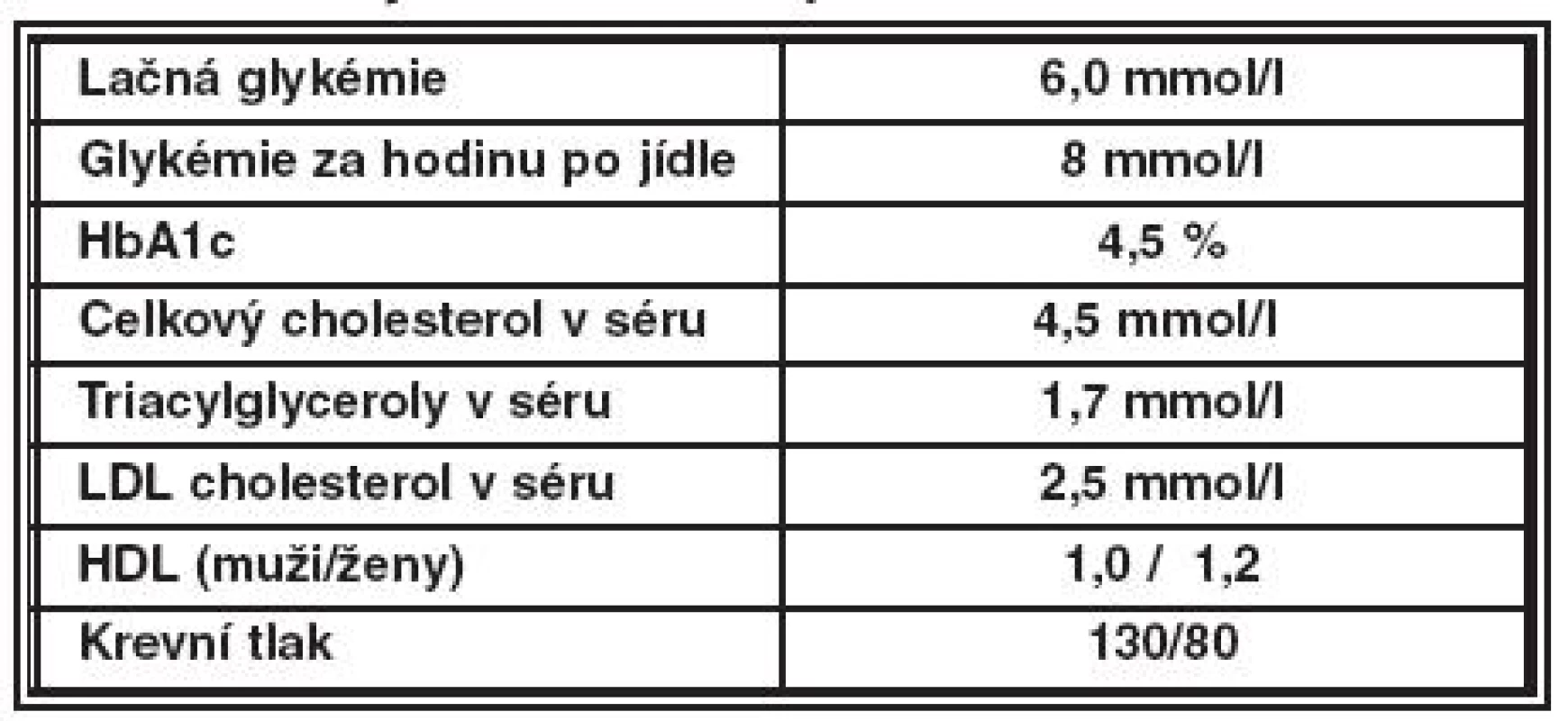
Farmakoterapie DR
Venotonika, venofarmaka
Jedním z prvých používaných a dosud velmi oblíbených léků v léčbě DR je calcií dobesilas (Danium, Dobica, Doxium, Dexium). Kalcium dobesilát má předpokládaný vliv na protokolagen bazální membrány. Je prokázáno i jeho působení na viskozitu krve, rigiditu a agregabilitu erytrocytů a destiček. Je považován za inhibitor PAF (Platelet Activating Factor). Od roku 1971 se objevilo více než šedesát prací dokazujících jeho účinnost při léčbě DR, většinou ale v malých, někdy i dvojitě slepých a randomizovaných studiích s kratším trváním, které však přesvědčivě nevypovídají o jeho klinickém významu.
V letech 1996 až 2005 proběhla multicentrická, randomizovaná, dvojitě slepá, placebem kontrolovaná studie s názvem CALDIRET, jejímž cílem bylo prokázat schopnost kalcium dobesilátu prodloužit interval mezi diagnózou počínající neproliferativní formy DR a středně pokročilé neproliferativní formy DR a zjištěním KSME, tedy edému definovanému k laserové terapii. Zároveň tato studie zhodnotila poměr rizika k užitečnosti při dlouhodobém podávání tohoto preparátu. Studie měla přesně daná kritéria pro zařazení diabetika včetně typu diabetu (DM 2. typ) a maximální hladiny glykovaného hemoglobinu. DR na sítnici byla hodnocena ze standardních stereofotografií sedmi polí, které byly slepě posuzovány v „Retinopathy Grading Center“. Studie neprokázala účinnost tohoto léku na diabetickou retinopatii s malou výjimkou, kdy byl zaznamenán jen mírně pozitivní efekt u hůře kompenzovaných starších diabetiček.
Poměrně oblíbeným lékem, všestranně využívaným oftalmology, je escinum (Aescin Polfa, Reparil), který je používán v terapii edémů, a rutosidum (Ascorutin) s kombinovaným antiedematózním a mírným venoprotektivním účinkem. Neexistuje však žádná relevantní studie o jejich účinku v léčbě DR.
Antiagregancia, antikoagulancia
Používaní malých dávek acidum acetylosalycilicum, jehož antiagregační vliv je dostatečně znám, bylo hodnoceno samostatně v rozsáhlé studii ETDRS (Early Treatment Diabetic Retinopathy Study) a v kombinaci s dipyridamolem ve studii DAMAD (Dipyridamol Aspirin Microangiopathy of Diabetes Study). V obou studiích se ukázalo jako zcela neúčinné v prevenci vzniku a progrese diabetické retinopatie. V poslední době je však kyselina salicylová opět ve středu zájmů pro její předpokládaný antiinflamatorní a antikohezní vliv na DMP.
Dalším používaným antiagregačním lékem je ticlopidinii hydrochloridum (Ticlid). Lék zkoušený v rozsáhlé studii TIMAD (Ticlopidin Microangiopathy of Diabetes Study) měl příznivé účinky na některé počínající formy DR ve skupině inzulinopenických diabetiků. Jeho zásadní nevýhodou je však nutnost velmi pečlivého monitorování krevního obrazu, vzhledem k riziku neutropénie. Proto bylo v praxi od jeho podávání v indikaci léčby neproliferativní DR upuštěno.
Hemorheologika, vazodilatancia
Prostacykliny byly v klinické studii použity jen jednou, ale bez efektu. Jejich použití známé v kombinaci s aspirinem v experimentu na zvířatech přineslo zjištění, že mohou mít vliv na vazodilataci kapilár sítnice.
Oblíbený je u nás sulfatovaný glykosaminoglykan s poměrně dobrým antikoagulačním účinkem, který snižuje viskozitu plazmy, zlepšuje reologické vlastnosti krve a má slabou lipolytickou aktivitu – sulodexidum (Vessel due F). Od plánované multicentrické, randomizované, dvojitě slepé studie s názvem DRESS však bylo upuštěno, takže důkazy o jeho příznivém vlivu na DR chybí. Podobně v USA oblíbený a používaný cyklospasmol, (Cykladelate) nepřinesl ve studiích žádné výsledky.
Klasická vazodilatancia jsou poměrně s oblibou používána jako adjuvantní léčba. Existují ojedinělé otevřené volné studie, ale i menší randomizované a dvojitě zaslepené studie s užíváním naftydrofurilu, praxilenu, DH – ergotoxinu, kofeinu, pentoxfillinu při DR, jejichž výsledky jsou ale nepřesvědčivé.
Hemostatika, hemostyptika, resorbencia
Používání etamysylatu (Dicynone), acidum aminomethylbenzoicum (Pamba, Gumbix) a dalších hemostatik při krvácení na sítnici a do sklivce nebo rezorbencií ve formě trolaminů či jodidů při dlouhotrvajícím hemoftalmu je spíše známkou zoufalého pokusu dělat cokoli, než opravdovou kauzální terapií.
Antioxidanty, scavengery
Bez efektu na průběh DR byly v klinické praxi použity i vysoké dávky α-tocoferoli acetas (vitaminu E), a to až 600 mg denně. Tak vysoké dávky se ukázaly jako neúčinné a dokonce škodlivé. V současné době nabývá mezi lékaři velké obliby extrakt Ginkgo biloba. Lék obsahující flavonoidové glykosidy a terpenické laktony má i vazodilatační a mírné antiagregační účinky, především vlivem na PAF. V experimentálních pracích pouze na modelech zvířat je patrný protektivní vliv těchto látek na buňky endotelu, nicméně klinické studie s tímto preparátem se vztahem k DR neexistují.
Hormony
Poměrně dlouho je věnována pozornost vlivu růstových hormonů na DR. (V roce 1953 byla popsána regrese proliferativní diabetické retinopatie po postpartuální nekróze hypofýzy. V krátkém období byla pak hypofyzektomie a implantace ytriového zářiče léčebnou metodou u pacientů s proliferativní DR.) Použití IGF 1 (iPLEX) jako remedia při poruchách růstu vede sice u diabetiků ke snížení hladiny glykosylovaného hemoglobinu, ale i k výrazné akceleraci DR.
Možnostem léčby DR pomocí inhibitorů těchto hormonů je v posledním desetiletí věnována značná pozornost.
Byla ukončena studie s octreotidem (Sandostatin LAR), syntetickým analogem somatostatinu. Pozitivní výsledky však studie nepřinesla. Optimismus budící jsou studie zabývající se vlivem intravitreálního podávání ranibizumabu (Lucentis), pegaptanibu (Macugen) a bevacizumabu (Avastin), což jsou monoklonální protilátky proti vaskulárnímu endotelovému růstovému faktoru – VEGF (Vascular Endothelial Growth Factor). Většina těchto látek je ve stadiu klinických zkoušek a na odpovědi jak často a především jak dlouho lze tyto látky bez dalších rizik intravitreálně aplikovat si budeme muset ještě nějaký čas počkat. Velký optimismus budí interim analýza studie RESTORE s ranibizumabem v kombinaci s koagulací laserem u DME, kde je prokazatelný pozitivní účinek i na zrakovou ostrost.
Poměrně rozšířené je také použití intravitreálních steroidů triamcinoloni acetonidum(Kenalog, Triam A) při léčbě DR. Aplikace intravitreálních steroidů však s sebou přináší i rizika komplikací jako je glaukom, katarakta, ale i endoftalmitida. Bohužel žádnou z těchto terapií nelze považovat za kauzální.
Inhibitory aldozo-reduktázy
Klinické i experimentální výzkumy poukazují již dlouhou dobu na možnost použití těchto látek (např. Polnarestatu) při léčbě makulárního edému. Výsledky studie s Epalrestatem, však nejsou stále přesvědčivé. Ve studii Sorbinil Retinopathy Trial se však pozitivní efekt sorbinilu na hematookulární barieru diabetiků, s výjimkou velmi počínajících forem DR, nepotvrdil. Použití Fiderstatu v publikované studii u streptozotocinem indukovaného DM krys prokázalo jeho příznivý vliv na DR. Projevilo se to především v oblasti histopatologických změn, tedy pericytů a bazální membrány. Fidarestat zabránil tvorbě mikroaneuryzmat, která jsou považována za prvotní, klinicky prokazatelný příznak DR.
Inhibitory protein-kinázy
Ruboxistaurin mesylate (Arxxant) je bisindolylmaleimide, který je silným a specifickým inhibitorem beta isoformní protein kinázy C. Ve dvojitě slepé, randomizované studii PKC – Diabetic Retinopathy Study (P-DRS) s různými koncentracemi, kde byl sledován efekt a bezpečnost perorálního podávání tohoto remedia, bylo zjištěno, že sice není schopen zabránit vzniku proliferativní formy DR, ale výrazným způsobem snižuje riziko poklesu zrakové ostrosti v důsledku vzniku diabetického makulárního edému. Jeho klinické použití zatím ale nebylo v USA povoleno a FDA požaduje další studie.
Antihypertenziva, hypolipidemika, antidiabetika
Na DR mají vliv konkomitující onemocnění, která velmi obvykle provázejí DM. Je to především hypertenze a dyslipidémie. Pro stabilizaci DR je nutná jejich dobrá kompenzace. Otázkou zůstává, zda jednotlivé skupiny léků používaných k jejich léčbě mohou mít i specifický vliv na průběh DR. V posledních letech probíhají studie se zaměřením na tento problém.
Captoprilbyl jako inhibitor angiotenzin konvertujícího enzymu použit v prospektivní randomizované studii již v roce 1990. Při úpravě TK byl prokázán i pozitivní efekt na hematookulární bariéru. Byla ukončena studie DIRECT (DIabetic REtinopathy Candesartan Trial) s candesartanem, která navázala na studii EUCLID (EUrodiab Controlled trial of Lisinopril in Insulin dependent Diabetes) s lisinoprilem. Studie DIRECT zaznamenala snížení incidence DR a u obou typů DM a regresi DR u DM 2. typu.
Studuje se vliv dalších léků na DR, například perorálních antidiabetik, derivátů sulfonylurey, jako je gliclazid, ale i léků modulujících metabolismus tuků, jako jsou inhibitory HMG-CoA reduktázy – statiny. Intervenční studie FIELD (Fenofibrate Intervention and Event Lowering in Diabetes) prokázala, že dlouhodobé užívání fenofibrátu u pacientů s diabetem 2. typu významnou měrou snížilo potřebu laserové léčby u diabetické retinopatie i zpomalilo její průběh, ačkoliv mechanismus tohoto jevu není patrně přímým korelátem s hodnotami lipidů v krvi nemocných.
Přes mnohé slibné výsledky studií nelze zatím žádnou z výše uvedených medikamentózních terapií považovat za primární. Z hlediska medicíny založené na důkazech tedy nemůže a ani zatím nesmí suplovat laserovou léčbu, jejíž včasné zahájení a správné provedení dle ETDRS snižuje riziko poklesu zraku a přechodu do těžkých, proliferativních forem DR. Při léčbě všech komplikací DM stále totiž platí latinské „Durante causa durat morbus“.
Laserová léčba
Laserová léčba je v své podstatě empirickou, destruktivní, mutilující metodou a její léčebné principy, ale i účinky jsou stále ve sférách předpokladů i dohadů. Principem působení laserové terapie je absorpce intenzivního světelného záření pigmentovými buňkami a přeměna světelné energie v tepelnou. Teplo pak koaguluje cílové buňky a okolní tkáň. Pacienti od fotokoagulační léčby často očekávají rychlé a znatelné zlepšení stavu svých očí, nebývají vždy připraveni na diskomfort s laserovou terapií spojený a na možnou mírnou bolestivost zákroku. Efekt fotokoagulace nemusí být pro pacienta vždy patrný nebo může být dokonce vnímán negativně. Na toto vše je nutno nemocného předem připravit.
Včasná a správně indikovaná léčba laserem může stabilizovat pokročilé formy NPDR a PDR. Je indikována také u diabetické makulopatie, kde sice již sníženou zrakovou ostrost nemůže zlepšit, ale může zabránit dalšímu poklesu vízu. Strategie léčby DR laserem je odlišná u diabetiků 1. a 2. typu.U diabetiků 2. typu postupujeme jiným způsobem u těch, kteří jsou léčeni jen dietou a perorálními antidiabetiky, a jinak u těch, kteří jsou léčeni inzulinem. Velmi obecně lze říci, že u diabetiků 2. typu ošetříme jako prvý makulární edém a pak eventuálně provedeme další zákroky v periferii sítnice, zatímco u diabetiků 1. typu většinou nejprve ošetříme periferii panretinální fotokoagulací. Překlasifikování diabetu může změnit i taktiku již zahájené léčby! Diabetici 2. typu léčení inzulinem obecně hůře reagují na laserové ošetření.
Laserová terapie diabetické makulopatie
Je indikována u očí s tzv. klinicky signifikantním makulárním edémem a difuzním neischemickým edémem makuly. Mezi dvě základní možnosti ošetření makuly patří fokální a mřížková koagulace. Při fokálním laserovém ošetření makuly postupujeme na podkladě angiogramu získaného při vyšetření fluorescenční angiografií. Laserové body aplikujeme cíleně do oblasti edému a prosakujících mikroaneuryzmat ve vzdálenosti 500 až 3000 μm od centra makuly. Cílem je koagulační stopa mírné až střední intenzity, což koreluje s šedavým respektive žlutavým zbarvením bodu. Při tomto typu ošetření používáme obvykle velikost koagulační stopy 50–100 μm, dobu pulzu 0,1 s a počáteční intenzitu záření cca 80 mW, kterou postupně upravujeme podle odezvy cílové tkáně. Kontrolní vyšetření indikujeme za 1 až 3 měsíce, při případném přetrvávání edému můžeme koagulaci doplnit. U cca 1/5 pacientů DME přetrvává i po opakovaných ošetřeních, v těchto případech se již doporučuje v koagulaci nepokračovat, neboť hrozí riziko vytvoření konfluentních laserových stop, které mohou působit subjektivně nepříjemné perifoveolární skotomy. Mřížkovou koagulaci volíme, pokud se u pacienta jedná o difuzní edém makuly, jehož původ je dle FAG v prosakování retinálních cév. V tomto případě ošetřujeme celou oblast prosakování mezi 500–3000 μm od centra makuly. Volíme velikost stopy 50–200 μm, čas pulzu 0,05–0,1 s, intenzitu 100 mW a více a mezi stopami zachováváme rozestup 1–1,5 průměru stopy. Nezapomínáme na čas pro termickou relaxaci tkáně. I zde nám pomůže angiogram, který přesně zobrazí oblast centrální avaskulární zóny, jíž se musíme při laserování vyhnout (obr. 2 a 3). Pokud je v plánu následná panretinální fotokoagulace (viz dále), měla by tato být provedena až 2–3 týdny po ošetření makuly, až budou opět obnoveny oběhové poměry v centrální oblasti.
Obr. 3. KSME – stav před zahájením mřížkové fotokoagulace 
Obr. 5. Týž pacient jako na obr. 2 – stav po mřížkové fotokoagulaci 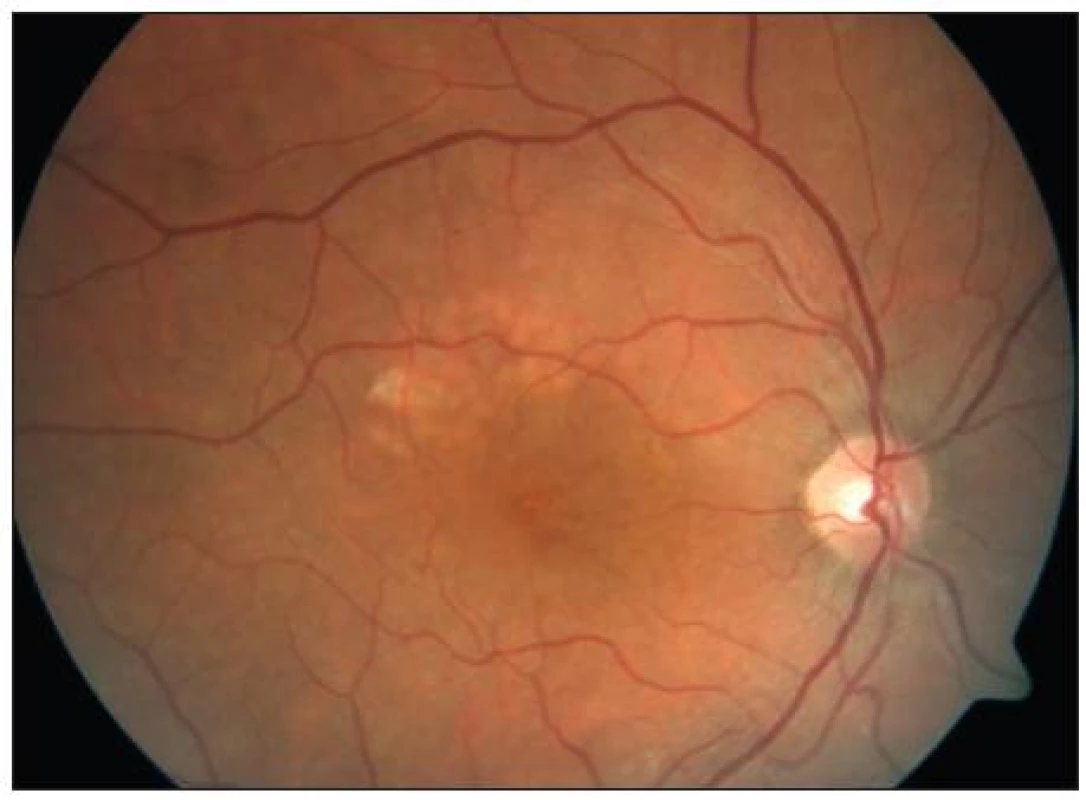
Panretinální fotokoagulace sítnice (PRFK)
Zatímco indikace k ošetření DME jsou poměrně jasně dány, rozhodnutí k přistoupení k PRFK nemusí být vždy jednoznačné. Za absolutní indikaci považujeme vysoce rizikovou proliferativní formu diabetické retinopatie, kdy nacházíme neovaskularizace disku zrakového nervu (NVD) a/nebo neovaskularizace sítnice (NVS) větší než polovina disku současně s preretinální nebo sklivcovou hemoragií. Dále k PRFK přistupujeme vždy při nálezu neovaskularizací v komorovém úhlu a při rubeóze duhovky kombinované s NVS. Ostatní indikace jsou relativní a při rozhodování bereme v úvahu další kritéria jako je věk pacienta, typ diabetu, trvání nemoci, úroveň kompenzace a v neposlední řadě kompliance nemocného. Obvykle tedy přistupujeme k panretinálnímu ošetření sítnice při počínající PDR při nálezu NVS větších než polovina disku nebo NVS menších než polovina disku v kombinaci s preretinální nebo sklivcovou hemoragií. Dále při stadiu velmi pokročilé NPDR s velkým počtem MA a intraretinálních hemoragií ve všech čtyřech kvadrantech, flebopatií nejméně ve dvou kvadrantech a IRMA nejméně v jednom kvadrantu. PRFK provádíme obvykle stopou 200–500 μm, čas pulzu 0,1–0,2 s a výchozí hodnotu nastavujeme na cca 150 mW a upravujeme podle reakce tkáně (obvyklá hodnota energie osciluje mezi 200–600 mW). Cílem je opět šedožlutavá stopa, ne úplné zbělání. Výhodnější je kombinace nižší energie a delšího působení pulzu, bývá ale pro pacienta bolestivější. Měli bychom se vyvarovat nastavení krátkého času a vysoké energie, při kterém hrozí poškození Bruchovy membrány. Panretinální ošetření sítnice v periferii bývá pro pacienta bolestivější než ošetření centrální krajiny sítnice, tento nepříjemný vjem můžeme korigovat použitím menší stopy nebo zkrácením času pulzu. U PRFK se snažíme laserovými stopami pokrýt celou plochu sítnice až k ekvátoru s šetřením makulární oblasti. Mezi jednotlivými body ponecháváme mezery o velikosti poloviny až celého průměru jedné stopy. Obvykle aplikujeme při PRFK 1500–2500 bodů, minimální počet je 1200. Při laserování se vyhýbáme přímému zásahu retinálních cév, fibrotickým oblastem a trakčním odchlípením. Taktéž nelaserujeme měkké exsudáty a intraretinální hemoragie. Terapii provádíme postupně, doporučováno je obvykle 3–5 sezení, v každém z nich aplikujeme maximálně 800 bodů. Mezi jednotlivými laserováními téhož oka je doporučen odstup alespoň jednoho týdne. Dokončení celé PRFK by se mělo uskutečnit do 5 týdnu od indikace terapie. Regresi neovaskularizací můžeme očekávat během jednoho až tří měsíců u cca 70 % pacientů. Při úplné regresi neovaskularizací je možno interval kontrol prodloužit na 3 až 4 měsíce.
V případech, kdy není indikována PRFK, jako je například objevení se prvotních NVS malého rozsahu u diabetiků 1. typu nebo diabetiků 2. typu na inzulinu, postačí obvykle fokální laserové ošetření periferní sítnice. Neovaskularizace o průměru menším než dva průměry disku a jejich bezprostřední okolí lze ošetřit pokrytím splývajícími stopami.
Možné komplikace laserové terapie
Jedním z častějších nežádoucích účinků panretinální laserterapie sítnice je vznik nebo progrese makulárního edému. Menší incidence lze dosáhnout dodržením zásady aplikace maximálně 800 stop v jednom sezení.
Ke vzniku a progresi choroidálních NV může dojít z důvodu poškození Bruchovy membrány při použití krátkých časů a vysoké energie laserového paprsku.
Vznik epiretinální membrány (ERM) je spojován s excesivní laserovou terapií.
Nechtěná aplikace laserových stop do oblasti fovey je závažnou komplikací, která může vzniknout například v důsledku ztráty orientace při laserování a záměny oblasti zadního pólu za oblast periferní při použití Goldmannovy čočky.
Progrese trakčního odchlípení sítnice může nastat v případě přímé koagulace vitreoretinálních trakcí.
Nepříjemnou komplikací v průběhu laserování může být hemoftalmus z důvodu přímého zásahu NVS.
V literatuře je popisováno termické poškození nervových vláken optiku po aplikaci stop těsně vedle papily. Je proto doporučeno neaplikovat stopy v oblasti 1 PD od papily.
Elevace nitroočního tlaku po laserovém ošetření je přechodnou záležitostí. Nitrooční tlak se vrací k fyziologickým hodnotám cca za týden.
Skotomy v periferním zorném poli jsou úměrné hustotě a splývání laserových stop. Častěji je nacházíme po konfluentní PRFK. Poruchy centrálního zorného pole mohou nastat po intenzivní laserové terapii v oblasti papilomakulárního svazku a těsné temporální parafoveolární koagulaci.
Vitrektomie
U části pacientů může dojít k natolik výrazné progresi nálezu na sítnici, že je potřeba přistoupit k chirurgické léčbě. Jedná se o stavy jako je progresivní fibrovaskulární proliferace, trakční odchlípení zasahující oblast makuly, makulární edém způsobený sklivcovou trakcí, výskyt epimakulární membrány způsobující metamorfopsie či dislokaci makuly, neresorbující se hemoragie, ghost cell glaukom aj. V těchto případech indikujeme tzv. pars plana vitrektomii (PPV). Pars plana vitrektomie je metoda vitreoretinálně chirurgická, při které vstupujeme do oka přes oblast pars plana sítnice. PPV provádějí vyšší pracoviště specializovaná na operace zadního segmentu. Operace vyžaduje vitrektom, operační mikroskop s invertorem obrazu, endoiluminační optiku, endolaser a zařízení pro aplikaci plynu nebo silikonového oleje. Operace se provádí buď v celkové a nebo dnes stále častěji v parabulbární lokální anestezii. Nejprve se resekuje sklivec, dále se odstraňují předozadní a pak tangenciální trakce, poté se ošetřují případné trhliny a na své místo se pomocí tekutého perfluorokarbonu přikládá amovaná sítnice. Po přiložení sítnice se na závěr provádí panretinální endolaserová koagulace (obr. 5). Dle potřeby (u těžkých stavů, reoperací) se doplňuje vnitřní tamponáda plynem nebo silikonovým olejem. Po operaci pak musí takový pacient polohovat obličejem dolů až do doby vstřebání plynu nebo alespoň tři týdny v případě instilace silikonového oleje. Silikonový olej se z oka vypouští nejdříve za 3 měsíce.
Obr. 6. Týž pacient jako na obr. 4 – stav po PPV a PRFK, stabilizace nálezu 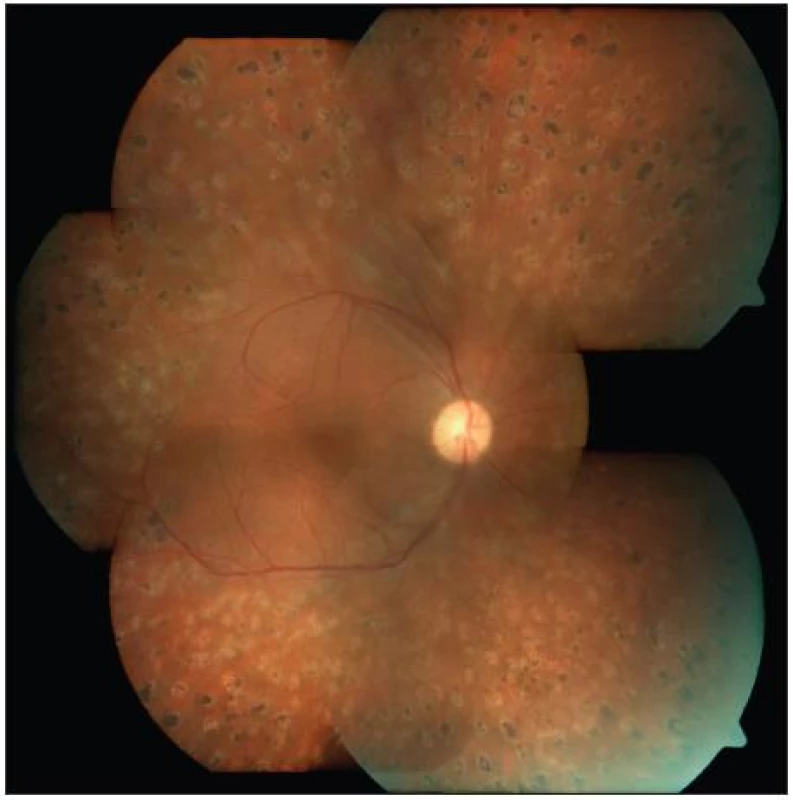
Posudková hlediska u očních komplikací DR
Pokročilá stadia DR, která snižují významně zrakovou ostrost či omezují rozsah zorného pole, jsou indikací k přiznání částečné či plné invalidity s přihlédnutím ke specifickým okolnostem u jednotlivých nemocných podle příslušných vyhlášek.
Definice nevidomosti
Nevidomost je ireverzibilní pokles centrální zrakové ostrosti pod 3/60 – světlocit.
Praktická nevidomost
- a) pokles centrální zrakové ostrosti pod 3/60 do 1/60 včetně,
- b) binokulární zorné pole menší než 10o, ale větší než 5o kolem centrální fixace.
Skutečná nevidomost
- a) pokles centrální zrakové ostrosti pod 1/60 – světlocit,
- b) binokulární zorné pole 5o a méně i bez porušení centrální fixace.
Plná slepota
Světlocit s chybnou světelnou projekcí až do ztráty světlocitu (amauróza).
Adresa: doc. MUDr. Tomáš Sosna, CSc.
Oční oddělení FTN
Oční ambulance CD IKEM
Vídeňská 800
140 00 Praha 4
e-mail: tomas.sosna@ftn.cz
Zdroje
1. Aiello, L.P., Gardner, T.W., King, G.L. et al.: Diabetic Retinopathy. Diabetes Care 1998; 21 : 143–156.
2. Doodson, M. P.: Diabetic Retinopathy. Oxford University Press 2008; 172.
3. Easty, D.L., Sparrow, J.M.: Oxford textbook of ophthalmology. New York: Oxford University Press 1999; 1308.
4. Hamilton, A., Ulbig, M., Polkinghorne, P.: Management of diabetic retinopathy. London BMJ 1996; 294.
5. Chantelau, E., Eggert, H.: Acceleration of diabetic retinopathy following improved glycaemic control: a report on 13 cases. Abstract. Diabetologia 1997;40 (suppl 1): A501.
6. Kuchyňka, P. a kol.: Oční lékařství. Praha: Grada 2007; 768.
7. Murény, R. P.: Management of diabetic retinopathy. Am Fam Physician 1995; 51, 4 : 785–796.
8. Pelikánová, T., Bartoš, V.: Praktická diabetologie 4. vyd. Maxdorf 2010; 738.
9. Pickup, J., Williams, G.: Textbook of diabetes, 2nd ed. volume two. Oxford: Blackwell Science Ltd. 1997; n.p.
10. Ryan, J.: Retina. 3rd ed. volume two. St. Louise: Mosby, Inc. 2001; 1847.
11. Scanlon, P., Aldington, S., Wilkinson, Ch. et al.: Practical Manual of Diabetic Retinopathy Management. Wiley-Blackwel 2009; 232.
12. Sosna, T., Bouček, P., Fišer, I.: Diabetická retinopatie – diagnostika, prevence, léčba. Praha: J. Cendelín 2001; 255.
13. Škrha, J. et al.: Diabetologie. Praha: Galén 2009; 417.
14. Valešová, L, Hycl, J.: Diabetická retinopatie. Triton 2002; 64–95.
Štítky
Oftalmológia
Článek Ako zvládnuť úzku zrenicu?
Článok vyšiel v časopiseČeská a slovenská oftalmologie
Najčítanejšie tento týždeň
2010 Číslo 5- Cyklosporin A v léčbě suchého oka − systematický přehled a metaanalýza
- Dlouhodobé výsledky lokální léčby cyklosporinem A u těžkého syndromu suchého oka s 10letou dobou sledování
- Účinnost a bezpečnost 0,1% kationtové emulze cyklosporinu A v léčbě těžkého syndromu suchého oka − multicentrická randomizovaná studie
- Pomocné látky v roztoku latanoprostu bez konzervačních látek vyvolávají zánětlivou odpověď a cytotoxicitu u imortalizovaných lidských HCE-2 epitelových buněk rohovky
- Konzervační látka polyquaternium-1 zvyšuje cytotoxicitu a zánět spojený s NF-kappaB u epitelových buněk lidské rohovky
-
Všetky články tohto čísla
- Diabetická retinopatie – rizikové faktory, prevence a terapie
- Selektivní laserová trabekuloplastika v léčbě glaukomu – výsledky v tříletém sledování
- Vplyv sférických a asférických umelých vnútroočných šošoviek na kvalitu centrálnej ostrosti zraku a kontrastnej citlivosti
- Subjektivní zrakové vnímání po laserové operaci myopie provedené na dvou typech laserů
- Ako zvládnuť úzku zrenicu?
- Zrakové evokované potenciály v manažmente amblyopie u detí
- Indikace Avastinu v oftalmologii
- Primář MUDr. Karel Vrba zemřel
- Česká a slovenská oftalmologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Indikace Avastinu v oftalmologii
- Diabetická retinopatie – rizikové faktory, prevence a terapie
- Subjektivní zrakové vnímání po laserové operaci myopie provedené na dvou typech laserů
- Selektivní laserová trabekuloplastika v léčbě glaukomu – výsledky v tříletém sledování
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



