-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Choroidálny melanóm v štádiu T1 – porovnanie plánu ožiarenia pri stereotaktickej rádiochirurgii a pri protónovej terapii
Choroidal Melanoma Stage T1 – Comparison of the Planning Protocol for Stereotactic Radiosurgery and Proton Beam Irradiation
Objective:
Comparison of two methods of irradiation of patients with malignant choroidal melanoma – stereotactic radiosurgery and proton beam irradiation. External (non-contact) applied irradiation is used as a source of accelerated protons, respectively helium ions. This method allows applications of ionizing irradiation also despite the low radiosensitivity of cells of malignant melanoma of the uvea (MMU). External source of ionizing radiation is modulated current energy electrons, protons or neutrons, accelerated in linear accelerators. From the external medium voltages resources (4-16 MeV) are irradiated tissues with target dose of 5.0–24.0 Gy. Volume protons permeate straight the structures of the eye to a certain distance. The use of proton radiation density of ionized protons increases in the vicinity of the impact due to energy losses for electrons interacting with the environment. At the end of the track there is a huge increase in the ionization dose (“Bragg spike”). Therefore, the structures surrounding the eye at the point of entry and little affected and increasing the dose at the end of the proton beam is ideal for the desired therapeutic effect. Fractionated application is also possible.Case report:
In December 2011 we performed stereotactic radiosurgery to treat female patient (born 1939) with malignant melanoma of the choroid stage T1 N0 M0. Plan has been drawn up for stereotactic irradiation – model for linear accelerator Clinac, Corvus planning system ver. 6.2, verification and OmniPro IMRT planning system Liebinger ver. 4.3. Patient characteristics were compared with the virtual plan for proton radiation therapy, and we used the scheme in Physical parameters FIAN-technical center in the Russian Federation. We compared both planning protocols and assess in particular the extent of radiation surrounding non-tumor tissue.Results:
When comparing the two planning schemes irradiation levels of surrounding tissues and risk structures (lens, optic nerve, chiasm) in both methods were corresponding to the required standard.Conclusion:
Treatment of uveal melanoma through proton beam irradiation in Slovakia is not available yet, although it has several advantages, such as fractionation and the possibility of achieving a higher dose of irradiation to deposit (more than 50.0 Gy). The fundamental difference between the two methods for an eye is particularly the possibility of proton beam irradiation exposure of tumor of iris and ciliary body, which can not be solved through stereotactic radiosurgery. The dose to the tumor during irradiation can be optimized. The model device allowed us to make OPTMI – Therapy (Proton Treatment with Optimized Modulated Intensity).Key words:
malignant melanoma of the choroid, stereotactic radiosurgery for uveal melanoma, proton beam irradiation
Autoři: A. Furdová 1; J. Růžička 2; M. Šramka 3; G. Králik 3; M. Chorvath 3; P. Kusenda 1
Působiště autorů: Klinika oftalmológie Lekárskej fakulty Univerzity Komenského a Univerzitnej nemocnice, Nemocnica Ružinov, Bratislava, prednosta: doc. MUDr. Vladimír Krásnik, PhD. 1; Katedra jadrovej fyziky a biofyziky, Fakulta matematiky, fyziky a informatiky Univerzity Komenského, Bratislava, vedúci katedry doc. RNDr. Karol Holý, CSc. 2; Klinika stereotaktickej rádiochirurgie OÚSA a Vysokej školy zdravotníctva a sociálnej práce sv. Alžbety, Bratislava, prednosta prof. MUDr. Miron Šramka, DrSc. 3
Vyšlo v časopise: Čes. a slov. Oftal., 68, 2012, No. 4, p. 156-161
Kategorie: Původní práce
Souhrn
Cieľ práce:
Porovnanie dvoch metód, spôsobov ožiarenia pacientov s malígnym melanómom choroidey – stereotaktickej rádiochirurgie uskutočňovanej zväzkom fotónov a protónovej liečby. Externá (bezkontaktná) aplikácia ionizujúceho žiarenia využíva ako zdroj urýchlené protóny, resp. ióny (hélia, uhlíka). Tento spôsob aplikácie umožňuje využívať ionizujúce žiarenie i pri nízkej rádiosenzitivite buniek malígneho melanómu uvey (MMU). Zdrojom externého ionizujúceho žiarenia sú zväzky elektrónov, protónov alebo iónov, urýchlených v lineárnych (respektíve cyklických) urýchľovačoch. Pritom z externých vysokonapäťových (4–16 MeV) zdrojov sa na diaľku ožarujú cieľové štruktúry dávkou 5–24 Gy. Zväzok protónov prestupuje štruktúrami oka do určitej hĺbky podľa ich energie, približne priamočiare. Pri využití protónového žiarenia hustota ionizácie sa zvyšuje v blízkosti miesta dobehu protónov, následkom straty energie pre interakciu s elektrónmi v prostredí. Na konci ich dráhy dôjde k značnému zvýšeniu dávky („Braggov hrot“). Preto sú okolité štruktúry oka pri mieste vstupu protónov málo postihnuté a zvyšovanie dávky na konci dobehu protónového zväzku je ideálne pre žiadaný liečebný efekt. Pritom je možné aj frakcionované aplikovanie.Materiál a metodika:
V decembri 2011 sme indikovali na liečbu stereotaktickou rádiochirurgiou pacientku narodenú v r. 1939 s diagnózou malígneho melanómu choroidey v štádiu T1 N0 M0. Vypracovaný bol plán ožiarenia pre stereotaxiu pre model lineárneho urýchľovača Clinac, plánovací systém Corvus ver. 6.2, verifikácia IMRT OmniPro a plánovací systém Liebinger ver. 4.3. Parametre pacientky sme porovnali s virtuálnym plánom pre liečbu protónovým žiarením, pričom sme použili schému podľa parametrov Fyzikálno-technického centra FIAN, Protvino, Ruská federácia. Porovnali sme obidva plánovacie protokoly a zhodnotili najmä rozsah ožiarenia okolitého nenádorového tkaniva.Výsledky:
Pri porovnaní oboch plánovacích schém boli hladiny ožiarenia štruktúr okolitých tka - nív (šošovky, zrakové nervy, chiazma) v oboch prípadoch zodpovedajúce požadovanej norme.Záver:
Liečba uveálnych melanómov protónovým žiarením na Slovensku ešte nie je dostupná, aj keď má niekoľko výhod, ako možnosť frakcionácie a tým dosiahnutia vyššej dávky žiarenia do ložiska (aj viac ako 50,0 Gy). Zásadný rozdiel medzi týmito dvoma metodikami (stereotaxia a protónové žiarenie) pre oftalmológa spočíva najmä v možnosti ožiarenia protónovým žiarením nádorov dúhovky a corpus ciliare, ktoré nie je možné riešiť stereotaktickou rádiochirurgiou. Dávku do nádoru možno v priebehu ožarovania optimalizovať. Zariadenie umožňuje uskutočňovať tzv. OPTMI – terapiu (Optimalizovaná Protónová Terapia s Modulovanou Intenzitou).Kľúčové slová:
malígny melanóm choroidey, stereotaktická rádiochirurgia uveálneho melanómu, protónové žiarenie
Práca bola prednesená na Vedeckých pracovných dňoch Slovenskej oftalmologickej spoločnosti a sekcie ambulantných lekárov, Košice, 18.–19. máj 2012Úvod
Prvé správy o výsledkoch efektívnej liečebnej aplikácie ionizujúceho žiarenia uveálnych melanómov sa začali predkladať v 80., resp. 90. rokoch minulého storočia. Externe bezkontaktovo aplikované ionizujúce žiarenie využíva ako zdroj urýchlené protóny. Takýto spôsob aplikácie umožní využiť ionizujúce žiarenie aj napriek nízkej rádiosenzitivite buniek malígneho melanómu uvey (MMU). Rádioterapia protónovým zväzkom pri MMU je indikovaná v procesoch, kde iné postupy pre rozsah (objem) MMU nie je možné aplikovať, alebo ide o jediné oko, a vtedy je alternatívou enukleácie bulbu (4, 5).
Vzhľadom na potrebu vysokej presnosti pri aplikácii protónového zväzku je nevyhnutné použiť najnovšie diagnostické a plánovacie techniky s použitím počítača. Pri aplikácii protónového žiarenia sa liečba realizuje počas piatich sedení – návštev v intervale 8–10 dní, liečba protónmi sa však vykonáva iba v niekoľkých veľkých centrách Európy. Pri ožarovaní sa využíva systém fixácie ožarovaného oka pomocou „eye trackingu“, naložením masky (5).
Zdrojom externého ionizujúceho žiarenia je prúd modulovanej energie elektrónov, protónov alebo neutrónov, urýchlených v lineárnych urýchľovačoch, pričom z externých vysokonapäťových (4–16 MeV) zdrojov sa na diaľku ožarujú cieľové štruktúry dávkou 5,0–24,0 Gy. Hustota ionizovaných protónov sa zvyšuje v blízkosti miesta dopadu, následkom straty energie pre interakciu s elektrónmi v prostredí. Na konci ich dráhy dôjde k obrovskému zvýšeniu dávky ionizácie („Braggov hrot“). Preto sú okolité štruktúry oka pri mieste vstupu málo postihnuté a zvyšovanie dávky na konci protónového prúdu je ideálne pre žiadaný liečebný efekt. Pritom je možné aj frakcionované aplikovanie. Z hľadiska terapeutickej efektivity sa uvádza až 97 % deštrukcia tumoru. Zdroje externého žiarenia pri Leksellovom gama noži vyžadujú aj špecifické systémy fixácie ožarovaného bulbu (5). V súčasnosti sa využíva v liečbe MMU aj stereotaktická rádiochirurgická metóda ako modifikácia Leksellovho noža. Princíp je analogický postupu pri aplikácii ionizujúceho žiarenia externým zdrojom cielene ako pri liečbe nádorových ochorení mozgu (3, 7).
Stereotaktická rádiochirurgia (SRCH) je definovaná ako ožiarenie intrakraniálnych lézií resp. iných lokalizácií s použitím jednej frakcie fokusovaných lúčov ionizujúceho žiarenia (X-lúče), čím sa eliminuje potreba konvenčnej invazívnej chirurgie. Využíva sa najmä v liečbe nádorov oblasti hlavy a krku. V oftalmológii indikáciou pre primárnu stereotaktickú rádiochirurgickú terapiu sú MMU lokalizované na zadnom póle, nevhodné na brachyterapiu, alebo na mikrochirurgické postupy v iných úsekoch uvey, tumory s eleváciou do 7 mm. Paliatívne je indikovaná u tumorov s väčšou eleváciou a v prípadoch, keď pacient odmietol enukleáciu. Využíva sa ako prvý krok pri kombinovaných postupoch (po stereotaxii je plánovaná endoresekcia, blok-excízia, možná adjuvantná brachyterapia). Vyžaduje sa spolupráca rádiochirurga, rádioterapeuta, radiačného fyzika aj oftalmológa pri samotnom výkone. Výpočet pre nasmerovanie lúčov a výpočet koordinát je umožnený naložením špeciálneho stereotaktického kruhu pred samotným zameraním a výpočtom dávky.
Na imobilizáciu bulbu sa využívajú rôzne fixačné postupy.
Melanómy uvey sa líšia od melanómov kože nielen rádiosenzitivitou, ale aj biologickými vlastnosťami. Potrebné vysoké dávky žiarenia vedú, vzhľadom na vysokú rádiosenzibilitu štruktúr bulbu, ku komplikáciam z ožiarenia, najmä cievneho systému sietnice, cievovky a terča zrakového nervu, ako aj rohovky a šošovky. Neskoré komplikácie po liečbe žiarením sú popísané pri aplikácii brachyterapie, Leksellovom gama noži, pri technike Cyberknife, pri stereotakticekj rádiochirurgii aj pri protónovom žiarení (6,14).
Externá (bezkontaktná) aplikácia ionizujúceho žiarenia využíva ako zdroj urýchlené protóny, resp. ióny (hélia, uhlíka). Spôsob aplikácie umožňuje využiť ionizujúce žiarenie i pri nízkej rádiosenzitivite buniek malígneho melanómu uvey (MMU). Z externých vysokonapäťových (4–16 MeV) zdrojov sa na diaľku ožarujú cieľové štruktúry dávkou 5,0–24,0 Gy, požadovaná dávka v protónových plánoch liečby je do 60,0 Gy. Zväzok protónov prestupuje štruktúrami oka do určitej hĺbky podľa ich energie, približne priamočiare.
Pri využití protónového žiarenia hustota ionizácie protónmi sa zvyšuje v blízkosti miesta dobehu protónov, následkom straty energie pre interakciu s elektrónmi v prostredí, na konci ich dráhy dôjde k značnému zvýšeniu dávky ionizácie („Braggov hrot“). V dôsledku „Braggovho hrotu“ sú okolité štruktúry oka pri mieste vstupu málo postihnuté a zvyšovanie dávky na konci dobehu protónového zväzku je ideálne pre žiadaný liečebný efekt.
Protónová terapia sa považuje za mimoriadne perspektívnu modalitu liečby nádorov a preto mnohé krajiny sveta sa snažia (bez ohľadu na vysoké investičné náklady) vybudovať si vlastné protónové centrum (respektíve ďalšie protónové centrá ak nejaké už prevádzkujú).
Protónová terapia umožňuje lepšiu kontrolu terapeutickej dávky žiarenia ktorej je vystavený pacient. Ožarovaním nádoru protónmi je možné zničiť viacej nádorových buniek a zároveň minimalizovať poškodenie zdravého tkaniva.
V súčasnej dobe je vo svete v prevádzke 39 zariadení kde možno uskutočňovať protónovú terapiu. Protónový terapeutický komplex s novým, vysoko sofistikovaným zariadením budujeme i u nás na Slovensku – v Ústrednej vojenskej nemocnici v Ružomberku. Projekt je v záverečnej fáze svojej realizácie.
Konvenčná liečba X-lúčmi si vyžaduje aplikáciu dávky do nádoru asi 60,0–70,0 Gy, v priemere počas asi 30 frakcií rozložených do 6 týždňov. Liečba prostredníctvom protónovej terapie si bežne vyžaduje menej než 20 frakcií ožarovania, pričom zároveň umožňuje aplikáciu vyšších dávok do objemu nádoru. Treba poznamenať, že liečba vyššími dávkami je efektívnejšia, nakoľko i neveľké zvýšenie dávky aplikovanej do objemu nádoru vedie ku značnému zvýšeniu pravdepodobnosti lokálnej kontroly nádoru. Napríklad, prechod pri liečbe zo 60,0 Gy na 66,0 Gy (zvýšenie o 10 %), zvýši pravdepodobnosť lokálnej kontroly nádoru z 50 na 60 % (t.j. o 20 %), čo nie je málo. Tento fakt, ktorý je nezávislý od spôsobu uskutočňovania liečby predstavuje silný argument v prospech protónovej terapie. Protóny a elektróny (respektíve gama lúče) majú približne rovnaký biologický efekt na ožarované bunky. Lepšie priestorové rozloženie dávky v prípade protónov však nutne povedie buď ku zníženiu pobočných efektov alebo ku zvýšeniu pravdepodobnosti kontroly nádoru.
Obzvlášť dobré výsledky boli dosiahnuté pri protónovej liečbe melanómu oka. Napríklad výsledok efektívnosti liečby melanómu oka u 2069 pacientov v MGH Massachusets v Spojených štátoch amerických (lokálna kontrola po 15 rokoch) bolo na úrovni 95 % (8). Egger et al. publikovali výsledky protónovej liečby melanómu oka 2435 pacientov v Paul Scherrer Institut-e, Švajčiarsko. Efektívnosť lokálnej kontroly (po 10 rokoch) v tomto prípade dosiahla úroveň 94,8 % (2).
Pred piatimi rokmi bolo vo svete 22 centier, kde mohli uskutočňovať protónovú terapiu a približne 37 000 pacientov absolvovalo túto liečbu. Podľa súčasnej štatistiky publikovanej ku koncu roka 2011 absolvovalo protónovú terapiu 83 667 pacientov, t.j. ich počet sa viac než zdvojnásobil. V roku 2012 sa vo svete prevádzkuje už 39 centier pre protónovú (respektíve iónovú) terapiu a ďalších 24 sa plánuje vybudovať v najbližších 3 rokoch (11).
V súčasnej dobe viacero komerčných firiem ponúka na trhu rozličné varianty protónových terapeutických komplexov formou dodávky „na kľúč“. Uvedené skutočnosti iba potvrdzujú tvrdenia, že vo svete nastáva boom protónovej terapie.
Kazustika
Pacientka, nar. 1939, sledovaná 3 roky pre pigmentové ložisko na zadnom póle ľavého oka, s klinickými známkami progresie v centre, indikovaná stereotaktická rádiochirurgia v dávke 35,0 Gy.
V čase ožiarenia hodnota centrálnej ostrosti zraku v decembri 2011 bola bilaterálne 6/12 (20/40 resp.LogMAR 0,3) bez korekcie, s korekciou nezlepšuje, vnútroočný tlak v norme, na perimetri skotóm v rozsahu do 40 stupňov zodpovedajúci ložisku. Optická koherentná tomografia – OCT vyšetrenie: 367 ± 17 (7,99), foveolárna depresia vymiznutá, epiretinálna membrána s ťahom, difúzny intraretinálny edém.
Ložisko charakteru malígneho melanómu lokalizované hore nazálne medzi hornou nazálnou a temporálnou arkádou veľké belavé šedavé ložisko nepravidelne pigmentované, rozsah 4x5PD.
Ultrazvukové vyšetrenie: elevácia 2,65 mm, báza 9,17 mm (obr. 1a,b).
Obr. 1a, b. Ultrazvukový obraz ložiska (december 2011) 
CT a MRI vyšetrenie potvrdilo rozsah ložiska (obr. 2).
Obr. 1. CT obraz pacientky s naloženým stereotaktickým kruhom - nádorové ložisko označené červenou farbou 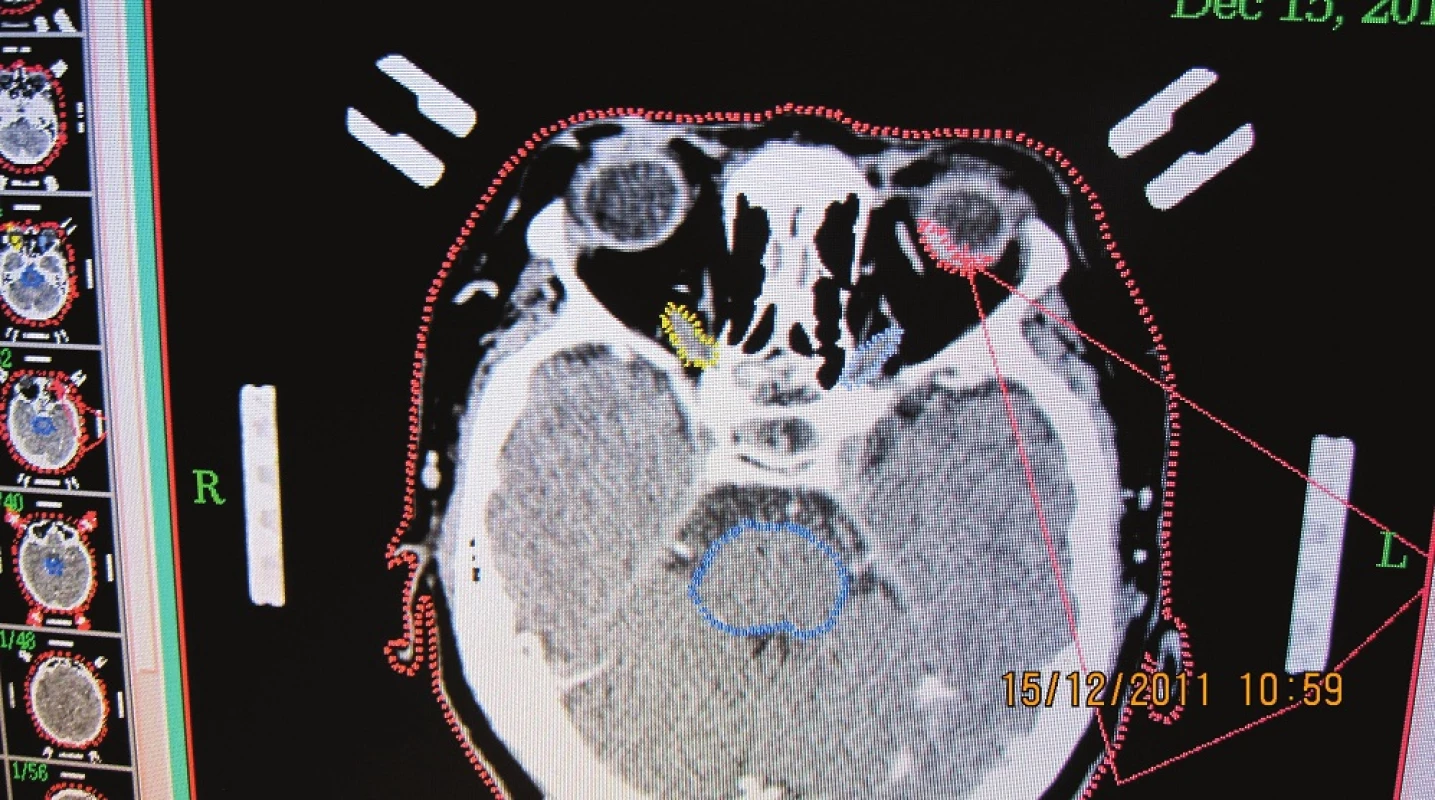
Vypracovali sme plán ožiarenia pre stereotaktickú rádiochirurgickú liečbu pre model lineárneho urýchľovača Clinac, plánovací systém Corvus ver. 6.2, verifikácia IMRT OmniPro a plánovací systém Liebinger ver. 4.3 (obr. 3, 4).
Obr. 2. Izodózový plán pacientky pre stereotaktická rádiochirurgiu v TD 35,0Gy. Schéma ožiarenia pri stereotaktickej rádiochirurgii: označenie nádorového ložiska s TD – terapeutickou dávkou ožiarenia 35,0 Gy je červenou farbou, rozsah ožiarenia okolitých štruktúr dávkou 15,0 Gy zelenou farbou, 10,0 Gy modrou farbou, 2,0 Gy fialovou farbou 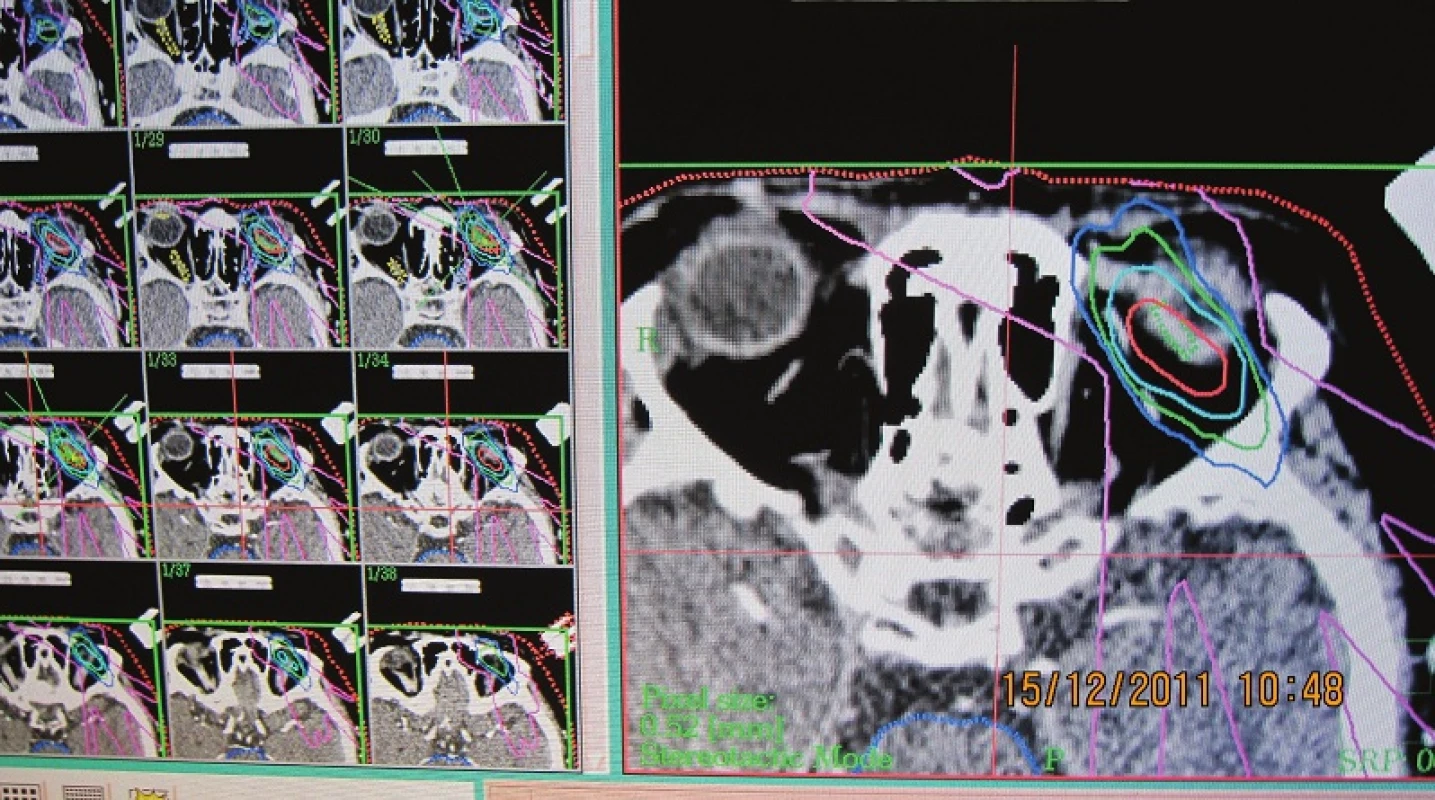
Obr. 3. Detail CT obrazu - dávkové pole pri ožarovaní nádora v oku fotónmi, Tdmax – horná hranica dávky 37,5 Gy, terapeutická dávka TD 35,0 Gy 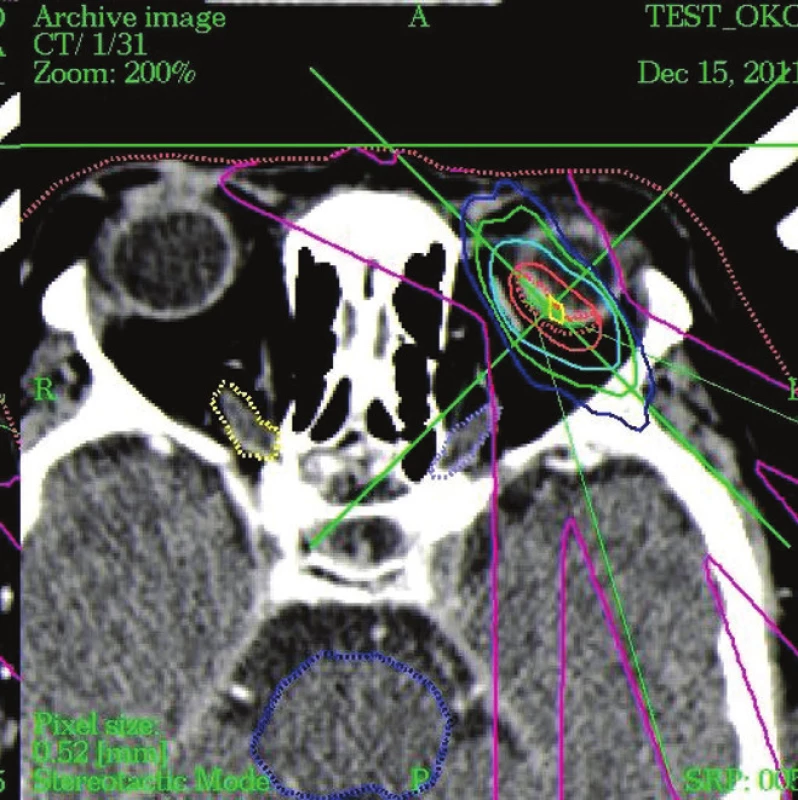
Parametre pacientky sme porovnali s virtuálnym plánom pre liečbu protónovým žiarením, pričom sme použili schému podľa parametrov Fyzikálno-technického centra FIAN, Protvino, Ruská federácia (obr. 5, 6).
Obr. 4. Schéma ožiarenia tej istej pacientky v rámci modelového plánovania pri ožiarení melanómu choroidey protónmi. Na obrázku vlavo je celkové rozloženie dávky v sektore od 0° do 120° pri požadovanej úrovni v nádore 35,0 Gy; vpravo je rozloženie dávky na úrovni ≤10 % (3,5 Gy) 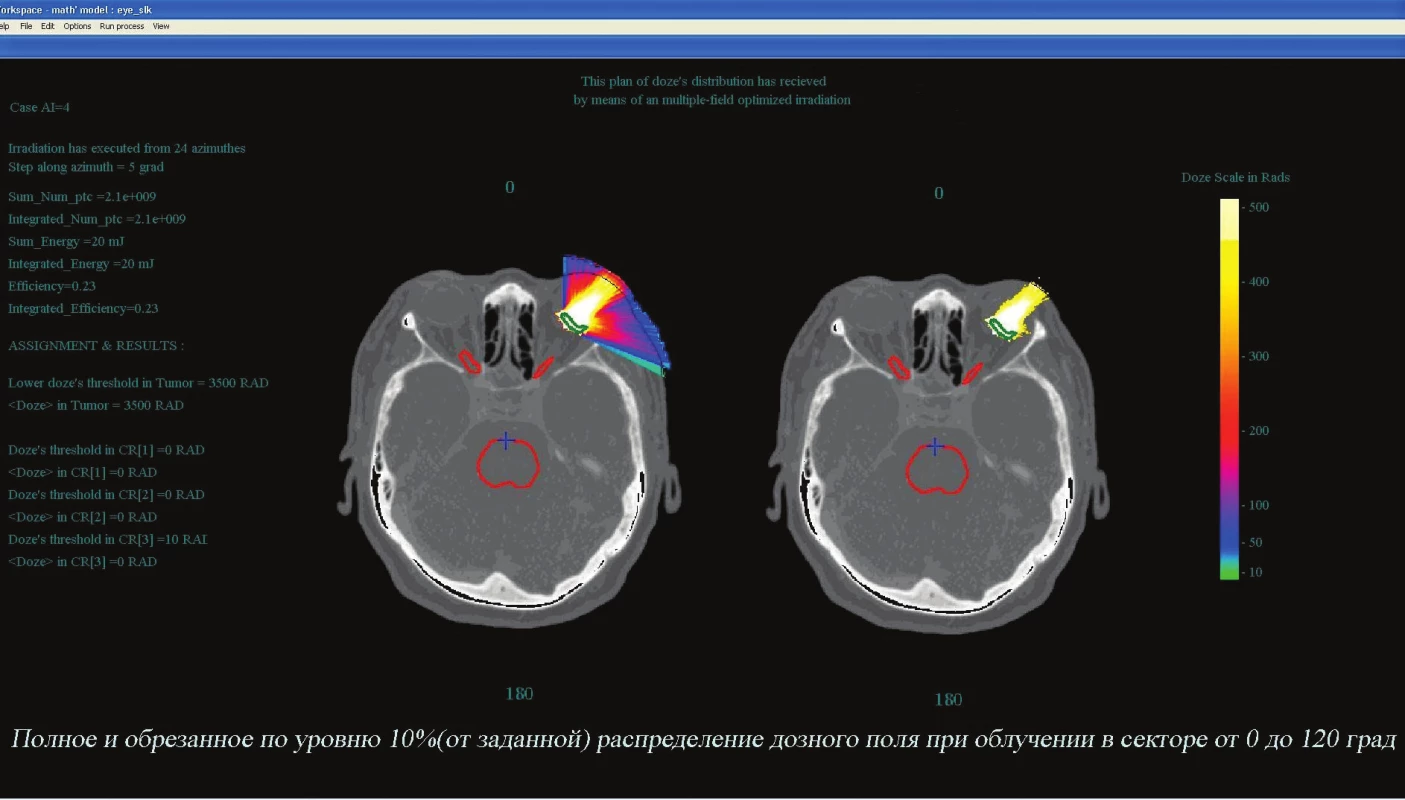
Obr. 5. Dávkové pole protónov v sektore 100–150°. Vlavo celkové maximum 35,0 Gy, v strede ≤ 10 % (3,5 Gy), vpravo ≤ 20 % . Vidiet, že ani mozog, ani ocný nerv prakticky nie sú zasiahnuté 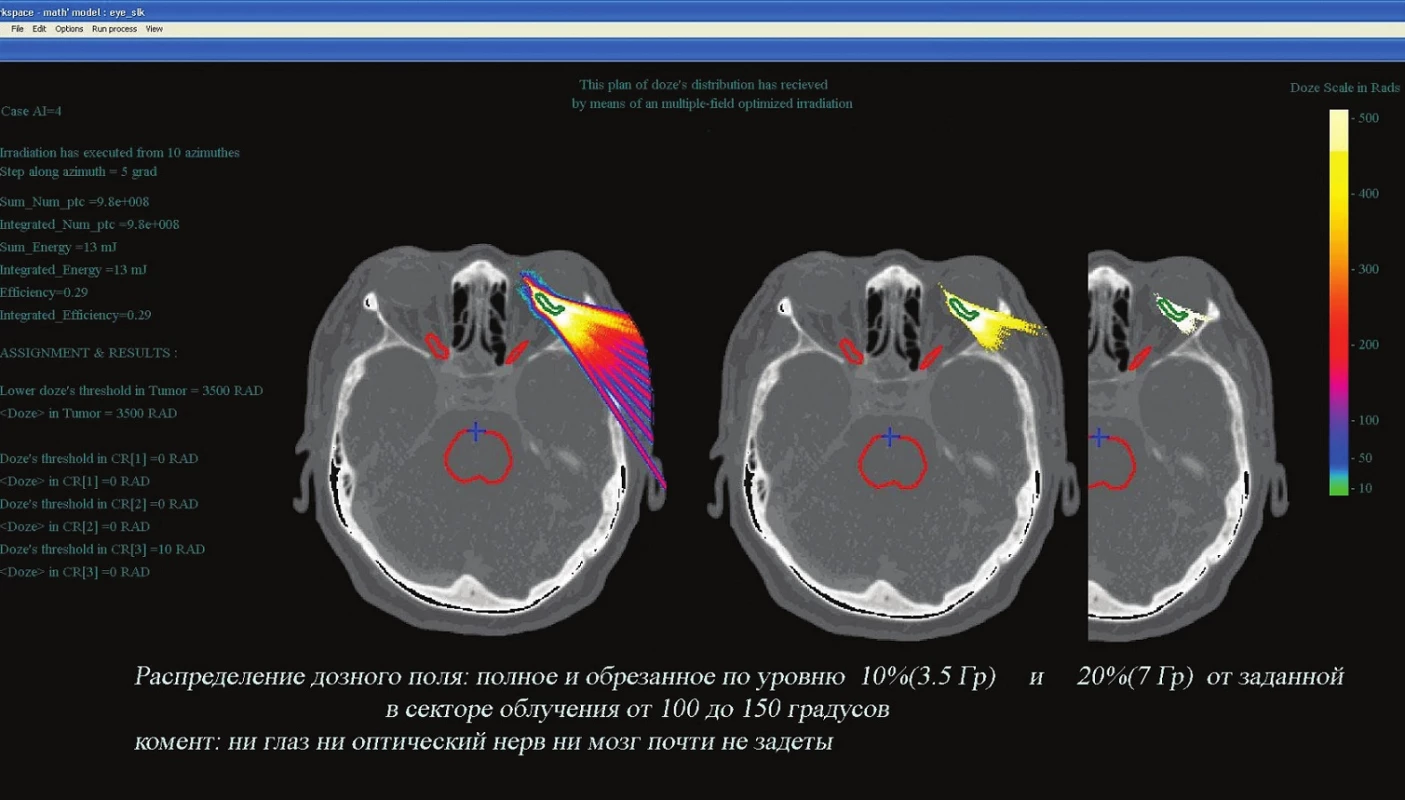
Porovnali sme obidva plánovacie protokoly a zhodnotili najmä rozsah ožiarenia okolitého nenádorového tkaniva. Pri porovnaní oboch plánovacích schém boli hladiny ožiarenia štruktúr okolitých tkanív a rizikových štruktúr (šošovky, zrakového nervu) v oboch prípadoch zodpovedajúce požadovanej norme.
Diskusia
V štúdii Webera a spol. porovnávali plány na protónovú a fotónovú terapiu uveálnych melanómov s použitím systémov plánovania Paul Scherrer Institut a Brainscan, verzia 5.2 (Brain-LAB, Heimstetten, Nemecko). Výsledky: uvádzajú cieľové pokrytie všetkých simulovaných uveálnych melanómov a boli rovnako konformné pri fotónovom a protónovom spôsobe ožiarenia. Stredná CI (95 %) hodnota bola 1,74, 1,86 a 1,83 pre statické, dynamické a IMSRT plány resp. protónové plánovanie, stredné CI (95 %) bol 1,88 pre OPTIS a podstatne zlepšil IMPT (Intensity Modulated Particle Therapy) v niektorých prípadoch (medián CI, 95 %, 1,29). Homogenita dávky v nádore v protónových plánoch bola však vždy lepšia ako stereotaktické plánovanie ožiarenia fotónmi (medián nehomogenity koeficient 0,1 a 0,15 versus 0,46, 0,41 a 0,23 pre OPTIS a IMPT versus statickým, dynamickým a IMSRT plánom, v tomto poradí). V porovnaní s plánmi na liečbu fotónmi, využitie protónov neviedlo k podstatnému zníženiu homolaterality v celkovej integrovanej dávke. Tieto výsledky naznačujú, že používanie techník SRT fotónov, v porovnaní s protónmi, môže vyústiť v podobných úrovniach dávky konformácie. IMPT nezvyšuje mieru konformality pre malé nádory. Nehomogenita dávky v nádore sa však vždy zvyšuje pri fotónovom plánovaní. Dávka pre všetky kontralaterálne tkanivá bola však úplne eliminovaná pri spôsobe plánovania pre protónové ožiarenie (12).
Napriek nesporným výhodám protónovej terapie je vo svete celkový počet centier vybavených protónovými urýchľovačmi (kde možno uskutočňovať liečbu onkologických ochorení priamym ožarovaním nádorov zväzkami urýchlených protónov) v porovnaní s počtom lineárnych elektrónových urýchľovačov určených pre klasickú rádioterapiu (8 000 – 9 000) veľmi malý. Je tomu tak v dôsledku veľmi vysokých počiatočných investícií potrebných na vybudovanie jedného protónového terapeutického centra (viacej než 100 mil. USD) a tiež aj prevádzkových nákladov (13).
Protónová terapia sa však považuje za mimoriadne perspektívnu modalitu liečby nádorov a preto mnohé krajiny sveta sa snažia, bez ohľadu na vysoké investičné a prevádzkové náklady vybudovať si vlastné protónové centrum (respektíve ďalšie protónové centrám ak nejaké už prevádzkujú).
Japonsko už viacero rokov realizuje Národný program, ktorého cieľom je vybavenie hlavných a tiež aj prefektúrnych nemocníc zariadeniami pre uskutočňovanie protónovej (iónovej) terapie (9). Výsledkom tohto programu dnes je, že Japonsko prevádzkuje v súčasnosti už 9 centier (6 protónových a 3 iónové). Celkove sa v Japonsku plánuje vybudovať 22 centier (z nich 5 má byť iónových).
V USA je v súčasnosti v prevádzke 10 protónových centier, pričom v najbližších 3 rokoch sa ich počet viacej než zdvojnásobí, nakoľko vo výstavbe je ešte ďalších 14. Odhaduje sa, že v USA sa vybuduje ešte ďalších 30–40 nových protónových komplexov.
V krajinách EÚ je v súčasnosti v prevádzke 10 protónových a 2 iónové centrá, ďalších 12 protónových (iónových) centier sa buduje; vo Švajčiarsku – 1, v Českej republike – 1, Rakúsku – 1, Taliansku – 1, Nemecku – 2, Slovensku – 2, Švédsku – 1, Poľsku – 1, Maďarsku – 1 a v Anglicku – 1 (11).
Na Slovensku budujeme Protónový terapeutický komplex Cyklotrónového centra SR v Ústrednej vojenskej nemocnici v Ružomberku a protónová terapia oka je plánovaná i v Cyklotrónovom centre SR v Bratislave. Komplex v ÚVN Ružomberku bude vybavený principiálne novou technológiou pre uskutočňovanie protónovej liečby. Táto vysoko-sofistikovaná technológia je vo svete zatiaľ len málo známa. Bola vyvinutá vo Fyzikálno-technickom centre FIAN v Ruskej federácii, za účelom zabezpečenia širokej dostupnosti protónovej liečby. Predpokladá sa, že nová technológia, vzhľadom na nízke investičné a prevádzkové náklady umožní širokú dostupnosť protónovej liečby i v malých krajinách. Slovensko je popri Ruskej Federácii a USA tretia krajina, kde sa táto technológia po prvý krát plánuje uviesť do klinickej praxe. Zodpovednosť za rozširovanie tejto technológie na svetové trhy prevzala ruská firma ZAO PROTOM, so sídlom v meste Protvino, cca. 100 km južne Moskvy (13).
Veľkou výhodou Protónového terapeutického komplexu je, že môže byť umiestnený v areáli ľubovoľnej väčšej nemocnice, alebo dokonca i do niektorých väčších existujúcich priestorov vybudovaných pre umiestnenie a prevádzku lineárneho rádioterapeutického elektrónového urýchľovača. Systém v ÚVN Ružomberok umožňuje prevádzkovať protónovú rádioterapiu v širokom rozsahu energií, od 70 MeV do 250 MeV, t.j. je možná nielen protónová terapia melanómov oka (akú máme zaplánovanú v Cyklotrónovom centre SR v Bratislave), ale aj plnohodnotná hĺbková protónová terapia. Systém využíva spôsob 3D skenovania nádorov úzkym zväzkom protónov a umožňuje protónovú terapiu s modulovanou intenzitou (IMPT). Protónový terapeutický komplex umožňuje uskutočňovať vysoko konformnú protónovú terapiu.
Nemecko má z krajín starej 15 Európskej Únie najväčšie skúsenosti s protónovou, respektíve i iónovou terapiou (10). V súčasnosti sa za najmodernejšiu stratégiu pre radiačnú terapiu považujú koncepty IMRT (Intensity Modulated Radiotherapy) a IMPT (Intensity Modulated Proton Therapy), v prípade ktorých už začalo klinické využívanie. Problémy vyplývajúce z pohybu vnútorných orgánov, alebo problémy ktoré vznikajú v dôsledku anatomických zmien však neustále pretrvávajú. V súčasnej dobe sa ich snažia riešiť uvádzaním do praxe novej modality radiačnej terapie IGRT (Image Gated Radiotherapy – rádioterapia riadená obrazom - s využívaním zobrazovania prostredníctvom CT). Ďalšie zlepšenie tejto modality terapie sa očakáva zahrnutím do procesu funkčného zobrazovania, t.j. využitím informácií z pozitrónového emisného tomografu (PET), alebo tomografu na princípe magnetickej rezonancie s funkčným zobrazovaním (fMRT). Protónová terapia v kombinácii s IGRT, niekedy nazývaná multi-dimenzionálna rádioterapia predstavuje budúcnosť radiačnej terapie v najbližšom desaťročí.
Podľa odhadov spoločnosti Proton Therapy Global Management pre približne 1–2 milióny obyvateľov krajiny je potrebné mať aspoň jedno protónové centrum. V perspektíve sa očakáva, že protónová terapia nahradí v budúcnosti súčasnú fotónovú terapiu.
Záver
Liečba uveálnych melanómov protónovým žiarením na Slovensku ešte nie je dostupná, aj keď má niekoľko výhod, ako možnosť frakcionácie a tým dosiahnutia vyššej dávky žiarenia do ložiska (aj viac ako 50,0 Gy).
Zásadný rozdiel medzi stereotaktickou rádiochirurgiou a protónovou liečbou pre oftalmológa spočíva najmä v možnosti ožiarenia protónovým žiarením nádorov dúhovky a corpus ciliare, ktoré nie je vo väčšine prípadov možné riešiť stereotaktickou rádiochirurgiou. V rámci protónovej terapie dávku do nádoru možno v priebehu ožarovania optimalizovať.
Pri porovnaní oboch plánovacích schém nášho pacienta (schéma plánu ožiarenia fotónmi pri stereotaktickej rádiochirurgii na lineárnom urýchľovači a schéma ožiarenia pre protónové žiarenie) boli hladiny ožiarenia štruktúr okolitých tkanív (šošovky, zrakového nervu) v oboch prípadoch zodpovedajúce požadovanej norme.
Zariadenie na protónovú liečbu ale umožňuje uskutočňovať tzv. OPTMI – terapiu (Optimalizovaná Protónová Terapia s Modulovanou Intenzitou).
Do redakce doručeno dne: 9. 7. 2012
Do tisku přijato dne: 30. 8. 2012
doc. MUDr. Alena Furdová, PhD., MPH
Klinika oftalmológie LFUK a UN,
nemocnica Ružinov
Ružinovská 6, 826 06 Bratislava
e-mail: afrf@mail.t-com.sk,
alikafurdova@gmail.com
tel: pracovisko 421 2 48234 kl.583
Zdroje
1. Damato, B., Kacperek, A., Chopra, M., et al.: Proton beam radiotherapy of choroidal melanoma: the Liverpool-Clatterbridge experience, Int J Radiat Oncol Biol Phys, 2005; 1 : 62, 5, 1405–11.
2. Egger E. et al: Maximizing local tumor control and survival after proton beam radiotherapy of uveal melanoma, Int J Radiat Oncol Biol Phys, 2001; 51 : 1348–47.
3. Furdová, A., Chorváth, M., Waczulíková, I., et al.: No differences in outcome between radical surgical treatment (enucleation) and stereotactic radiosurgery in patients with posterior uveal melanoma, Neoplasma, 2010; 57 (4): 377–381.
4. Furdová, A., Oláh, Z.: Malígny melanóm v uveálnom trakte, Asklepios, Bratislava, 2002, 175 s.
5. Furdová, A., Oláh, Z.: Nádory oka a okolitých štruktúr, CERM, Brno, 2010, 151s.
6. Furdova, A., Strmen, P., Sramka, M.: Complications in patients with uveal melanoma after stereotactic radiosurgery and brachytherapy, Bratislava Medical Journal – BLL, 2005; 106 (12): 401–406.
7. Furdova, A., Strmen, P., Waczulikova, I., et al.: One-day session LINAC-based stereotactic radiosurgery of posterior uveal melanoma, Eur J Ophthalmol, 2012, Mar, 22 (2): 226–35.
8. Gragoudas E. et al.: Evidence-based estimates of outcom in patients irradiated for intraocular melanoma, Arch Ophtalmol, 2002; 120 : 1665–71.
9. Monzulj, G.D., Gladilina, I.A.: Radiacionnaja biologija. Radioekologija, 2005, 6, p. 670–674.
10. Oelfke, U.: Intensity modulated radiotherapy with highenergy photon and hadron beams. Dostupné na internete: http:// www.scribd.com/doc/95017648/Intensity-Modulated-Radiotherapy-With-High
11. PTCOG: Particle Therapy Co.Operative Group, Hadron Therapy Patient Statistics PTCOG50 Dostupné na internete: http://ptcog.web.psi.ch).
12. Weber, D.C., Bogner, J., Verwey, J., et al.: Proton beam radiotherapy versus fractionated stereotactic radiotherapy for uveal melanomas: A comparative study. Int J Radiat Oncol Biol Phys, 2005; 1, 63, 2 : 373–84.
13. ZAO PROTOM, Dostupné na internete: www.protom.ru
14. Zytkovicz, A., Daftari, I., Phillips, T.L. et al.: Peripheral dose in ocular treatment with Cyberknife and Gamma Knife radiosurgery compared to proton radiotherapy, Phys Med Biol, 2007; 52 : 5957–5971.
Štítky
Chirurgia maxilofaciálna Oftalmológia
Článok vyšiel v časopiseČeská a slovenská oftalmologie
Najčítanejšie tento týždeň
2012 Číslo 4- Cyklosporin A v léčbě suchého oka − systematický přehled a metaanalýza
- Dlouhodobé výsledky lokální léčby cyklosporinem A u těžkého syndromu suchého oka s 10letou dobou sledování
- Účinnost a bezpečnost 0,1% kationtové emulze cyklosporinu A v léčbě těžkého syndromu suchého oka − multicentrická randomizovaná studie
- Pomocné látky v roztoku latanoprostu bez konzervačních látek vyvolávají zánětlivou odpověď a cytotoxicitu u imortalizovaných lidských HCE-2 epitelových buněk rohovky
- Konzervační látka polyquaternium-1 zvyšuje cytotoxicitu a zánět spojený s NF-kappaB u epitelových buněk lidské rohovky
-
Všetky články tohto čísla
- Využití fotodynamické terapie v léčbě myopických neovaskulárních membrán
- Krvácania pod vnútornú hraničnú membránu sietnice liečené pars plana vitrektómiou
- Rohovková cizí tělíska u dětí
- Perforované zátky v liečbe stenózy slzných bodov
- Účinnost a snášenlivost tafluprostu 0,0015% bez konzervačních látek v léčbě glaukomu a oční hypertenze
- Choroidálny melanóm v štádiu T1 – porovnanie plánu ožiarenia pri stereotaktickej rádiochirurgii a pri protónovej terapii
- Extrasklerálne prerastanie malígneho melanómu choroidey po endoresekcii
- Česká a slovenská oftalmologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Krvácania pod vnútornú hraničnú membránu sietnice liečené pars plana vitrektómiou
- Perforované zátky v liečbe stenózy slzných bodov
- Účinnost a snášenlivost tafluprostu 0,0015% bez konzervačních látek v léčbě glaukomu a oční hypertenze
- Extrasklerálne prerastanie malígneho melanómu choroidey po endoresekcii
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




