-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
HEMANGIOMY ORBITÁLNÍ KRAJINY U DĚTÍ
Haemangiomas are Common Benign Tumors of the Child
The paper presents summary report which approaching the issue of this affection and includes a retrospective study aims to evaluate the effectiveness and safety of treatment modalitiesinfantilehemangiomasperiorbitalandorbitallocalizationin paediatric patients observed in the period 2009–2014 on the Children’s Eye Clinic.
Key words:
haemangiom, treatment modalities
Autoři: K. Pramuková 1; R. Autrata 1; R. Faberová 2
Působiště autorů: Dětská oční klinika, FN Brno 1; Pediatrická klinika, kožní oddělení, FN Brno 2
Vyšlo v časopise: Čes. a slov. Oftal., 72, 2016, No. 4, p. 138-148
Kategorie: Původní práce
Souhrn
Hemangiomy jsou běžné benigní dětské nádory. Práce představuje souborný referát přibližující problematiku této afekce a zahrnuje retrospektivní studii, jejímž cílem je zhodnocení úspěšnosti a bezpečnosti jednotlivých modalit léčby infantilních hemangiomů periorbitální a orbitální lokalizace u dětských pacientů sledovaných v období 2009–2014 na Dětské oční klinice.
Klíčová slova:
hemangiom, modality léčbyÚVOD
Vaskulární léze orbity zahrnují nádory, jako jsou kapilární a kavernózní hemangiomy a hemangiopericytomy, jakož i malformace jako lymfangiomy, orbitální varixy a arteriovenózní malformace. Infantilní hemangiomy patří k nejčastějším nádorům očnice a očních víček u dětí. Ačkoli poznatky o této vaskulární anomálii byly shromažďovány během předchozích desetiletí, etiologie a patofyziologie nejsou kompletně známy. V posledních několika letech prostřednictvím výzkumných snah a zejména s pokrokem strategie léčby se změnil i přístup k tomuto onemocnění.
Typický pro infantilní hemangiomy je jejích vývoj. Rapidní růst je následován pomalou spontánní involucí. Toto onemocnění periorbitální krajiny i přes svůj benigní charakter může způsobit pokles vizu, strabismus, různé deformity, ba dokonce i ohrozit život dítěte.
Variabilita fenotypu a vlastní projevy onemocnění vyžadují individuální přístup k léčbě. Základem léčby donedávna byly u rizikových hemangiomů glukokortikoidy. Další možnosti jsou interferon alfa a vinkristin, ty ale nesou s sebou rizika závažných nežádoucích účinků. Chirurgická terapie i diodové lasery jsou v terapii nápomocné, jejich použití je ale relativně limitováno u rozsáhlejších problematických hemangiomů. Díky náhodnému objevu účinnosti betablokátorů publikovaného poprvé v r. 2008 (62) se dnes stávají lékem první volby v terapii problematických infantilních hemangiomů (11, 26, 40, 42, 79, 80, 97).
NOMENKLATURA
Ačkoli byly tyto léze známé již řadu staletí, poprvé je formálně charakterizoval Lister (64). Hovorově je označil za „jahodové névy“. Tyto nezhoubné cévní hamartomy dostaly mnoho jmen, včetně kapilárních hemangiomů, juvenilních hemangiomů, hemangioblastózy, benigní hemangioendoteliózy či hypertrofické hemangiomy. Jsou mezenchymového původu a vychází z endotelu krevních cév.
Historická nejednoznačnost v pojmenování a klasifikaci hemangiomů si nakonec vyžádala přísnější kategorizaci, čímž vznikla současná definice infantilního hemangiomu jako jedinečného cévního nádoru, který vzniká po porodu v kojeneckém věku a prochází proliferativní fázi následovanou spontánní involucí (50). Infantilní hemangiomy se ale nesmí zaměňovat za vrozené hemangiomy, které jsou plně vytvořeny při narození.
Histopatologicky je kapilární hemangiom vcelku dobře ohraničený, neopouzdřený útvar tvořený klubkem malých cév vystlaných endotelem. Kavernózní hemangiom je tvořen systémem větších cévních prostorů, oddělených vazivovými septy. Mikroskopická struktura je podobná kavernózním tělesům genitálu (68, 77).
EPIDEMIOLOGIE
Incidence infantilního hemangiomu orbity je v literatuře uváděna mezi 3 až 10 % (55). Nedávné recenze potvrdily, že pravděpodobný výskyt je 4–5 % (55). Velká multicentrická prospektivní studie, která zkoumala demografii infantilního hemangiomu, nalezla ženské pohlaví, Kavkazské etnikum, dále nezralé novorozence s nízkou porodní hmotností, placentární abnormity, vícečetné těhotenství, pokročilý věk matky a preeklampsii jako rizikové faktory (39). Dalším potenciálně rizikovým faktorem je odběr choriových klků.Je zde rasová predilekce bělochů (10–12 %) ve srovnání s černochy (1,4 %) a tchaj-wanské a japonské populace (0,2–1,7 %) (39).
Oblast hlavy a krku je nejčastěji postiženou oblastí (60 %), následuje trup (25 %) a končetiny (15%). Často bývají hemangiomy solitární, nicméně až 20 % dětí má vícečetnou lokalizaci. Mimo kůži se můžou objevit i v mozku a viscerálních orgánech (3, 11, 12, 15, 25, 46).
KLINICKÉ PŘÍZNAKY
Infantilní hemangiomy se mohou objevit kdekoli na kůži, nejčastější jsou ale v oblasti hlavy a krku (63). Kapilární hemangiomy se vyskytují častěji u ženského pohlaví než mužského, a to v poměru 3 : 2 bez zjevné familiární dědičnosti. Jejich výskyt je zvýšený u nedonošených dětí. Přibližně jedna třetina kapilárních hemangiomů je přítomných již od narození a téměř všechny jsou identifikovány do šesti měsíců věku (38). Jejich klinický obraz se může výrazně lišit v lokalizaci, velikosti, hloubce a rychlosti růstu. Léze jsou rozděleny do tří hlavních podtypů na základě hloubky růstu, a to na povrchové (superficiální), hluboké (subkutánní) nebo jejich kombinaci. V oblasti orbity je predilekční lokalizace horní víčko a horní část orbity. Povrchové léze se jeví jako jasně červené papuly nebo uzlíky, které mohou být nebo mají hrbolatý vzhled. Hlubší léze způsobují variabilní změny v barvě kůže v závislosti na vzdálenosti k povrchu. Občas mohou mít modré nebo fialové zabarvení nebo zabarvení nemusí mít žádné.
Třetí podtyp obsahuje prvky jak povrchní, tak hluboké léze. Zatím co jsou léze často klasifikované podle hloubky růstu, bylo prokázáno, že morfologická klasifikace na lokalizované (diskrétní) nebo segmentální (zahrnující široké anatomické oblasti) je indikativní pro klinický průběh (45). Většina lézí je lokalizovaných (72 %) a segmentovaných a multifokálních zahrnuje 18 % a 3 %, v tomto pořadí (46). Velikost bývá v průměru 0,5–5 cm, pohybuje se ale od velikosti špendlíkové hlavičky až po léze větší než 20 cm v průměru.
Infantilní hemangiomy se odlišují od ostatních cévních malformací raného dětství jejich charakteristickým klinickým průběhem. I když každá léze může mít odlišní růstový vzor, většina následuje typický průběh rozdělený do šesti následujících etap: 1. tzv. rodící se fáze, 2. časně proliferativní fáze, 3. pozdní proliferativní fáze, 4. plateau, 5. involuce, 6. zánik (36, 45, 48). Rodící se fáze je stadium před vznikem léze a trvá obvykle 0–3 měsíce. Během dalších 6–10 měsíců šíření léze prochází dvěma stadii, a to časně proliferativní, charakterizovanou rychlým růstem v prvních měsících života, během kterých dosáhnou léze většinu jejich velikosti. Následuje pozdní proliferativní fáze s méně rychlým růstem. Obecně platí, že 80 % infantilních hemangiomů dosáhnou maxima své velikosti do 5 měsíců. Povrchové (lokalizované) léze mají ve srovnání s hlubokými (segmentovanými) lézemi mírně prodlouženou proliferativní fázi, probíhající něco déle než 6 měsíců, ale většina lézí přestane růst v 9 měsících věku (45). Proliferativní fáze je následována plateau, neboli stabilizační fázi s proměnlivou dobou trvání. Předzvěstí involuce je obvykle změna barvy z jasně červené po fialovou nebo šedou, stejně jako zjemnění textury, oploštění nebo zmenšení velikosti. Přibližně polovina infantilních hemangiomů involuje do čtyř let věku a tři čtvrtiny do sedmi let (66).
Ačkoli většina infantilních hemangiomů má nekomplikovaný klinický průběh, některé můžou způsobit značné morbidity vyžadující léčbu. Amblyopie je nejčastější oční komplikací a postihuje 40–60 % pacientů (38, 83). Léze v periokulární oblasti o velikosti větší než 1 cm v největším rozměru bývá prediktivní pro tupozrakost a je potřebné je léčit (88). Afekce v oblasti očních víček indukující astigmatismus, způsobuje jako nejčastější komplikaci anizometropickou amblyopii, pokud dojde k okluzi optické osy, vede k deprivační tupozrakosti.
Orbitální léze jsou méně časté, ale sekundárně, pro jejich velikost, mohou mít za následek šilhání, protruzi, expoziční keratopatii nebo útlakovou neuropatii optického nervu (38). Přítomnost kterékoli z těchto komplikací vyžaduje naléhavý zásah. 40–80 % infantilních hemangiomů může zanechat trvalá rezidua i poté, co nádor involuje (9, 43).
PATOGENEZE
I když přesná patogeneze hemangiomů není zcela zřejmá, dosavadní histopatologické studie zlepšily naše znalosti o této nemoci. Několik oddělených studií zkoumalo genetické faktory, které naznačily, že dědičnost nehraje velkou roli. To je i v souladu s nálezy sporadického výskytu infantilních hemangiomů. Jiné genetické studie ale spekulují o genetické distribuci, o čemž svědčí zdvojnásobení rizika pro člena rodiny probanda (16), zatímco rasová predilekce bělochů ve srovnání s „nebělochy“ také naznačuje určitou genetickou složku. Výzkum molekulárních markerů prezentovaných buňkami hemangiomu, kultivované endotelové buňky (HemEC), a hemangiom získané kmenové buňky (Hem SC) vnesly světlo do možných mechanismů vzniku. Angiogeneze (tj. proliferace nebo migrace z již existující cévy) i vaskulogeneze (tj. de novo tvorba cév z progenitorních buněk) se uplatňují v patogenezi infantilních hemangiomů (92). Další studie exprese vzorků kultivovaných buněk hemangiomu (HemEC) zjistily up-regulaci glukózo transportního proteinu typu 1 (GLUT-1), vaskulárního endoteliálního růstového faktoru (VEGF), mimo jiné i down-regulaci dalších markerů, jako je například CD 146 (16,50). GLUT-1 je zvláště užitečná v diagnostice těchto lézí, které můžeme najít výhradně u infantilního hemangiomu (61). Pozornost se nyní obrací k angioproliferativní signální molekule, jakou je VEGF, jako na klíčovou molekulu pro formaci cév a pravděpodobný základ vzniku infantilního hemangiomu. Zvýšené hladiny VEGF-A v séru byly zaznamenány u pacientů s proliferativním infantilním hemangiomem ve srovnání s hemangiomy v involuci (99).
Podobně i kmenové buňky izolované z lidského infantilního hemangiomu prokázaly expresi VEGF-A v proliferativní fázi, ale ne ve fázi involuce. Toto zjištění bylo dále zkoumáno v nastavení výběru tradičních léčebných prostředků, kortikosteroidů. In vivo studie na myších ukázaly, že dexamethason blokuje sekreci VEGF-A u kmenových buněk odvozených z infantilního hemangiomu (34). Související práce poskytují důkazy o možném mechanismu ve vztahu steroidní inhibice NF - кB, molekuly asociované jak se zánětem, stejně tak i s angiogenezí (33). Kromě toho se ukázalo, že HemEC je schopen tvořit funkční cévy s „hemangioma-like“ fenotypem bez další mezenchymové podpory, která je vyžadována dalšími buněčnými populacemi (54).
Výzkum buněčného původu hematopoetických kmenových buněk infantilního hemangiomu poukazuje na populaci buněk zvaných endotelové progenitorní buňky (EPC). To je doloženo nálezy zvýšených EPC v periferní krvi u pacientů z infantilním hemangiomem, EPC asociovaných markerů lokalizovaných na endotelu proliferujících hemangiomů, a markerů spojených s primitivními hematopoetickými buňkami nacházejících se na formujícím se kapilárním endotelu (47). Nicméně dřívější studie implikují možný placentární původ na základě křížové podobnosti endoteliálních buněk hemangiomu a placentárních buněčných markerů (7, 73). Nakonec je ještě stále třeba brát do úvahy molekulární patogenezi, avšak nedávný pokrok, který je popisován výše, nabízí nové cíle pro budoucí terapie, především VEGF.
HISTOPATOLOGIE
Klinický průběh infantilního hemangiomu je odrazem histopatologických změn. Časně proliferující hemangiomy se skládají z buněčné masy kompaktních nezralých kapilár lemovaných kyprými endoteliálními buňkami s vysokou mitotickou aktivitou (71, 75, 89). V pozdějším stadiu se endotelové buňky zmenšují, léze jsou složené z více formovaných cévních struktur lemované plochými endoteliálními buňkami (99). Ve stromatu nalezneme ve vysokém počtu žírné buňky a ve stěnách cév pericyty. A nakonec, ve fázi involuce se mitotická aktivita buněk postupně snižuje a cévní tkáň je nahrazena tukově fibrotickou tkání, což vede k fibróze a eventuální atrofii (71).
DIAGNOSTIKA
Většina povrchových lézí bývá zjištěna klinicky. Diagnóza bývá zřejmá dle klinického průběhu, barvy a „zběláním“ po impresi. Kromě toho infantilní hemangiom jak se zvětšuje, tak tmavne, zatímco cévní malformace obecně odstín nemění. Pokud se objeví léze neobvyklého vzhledu, růstové tendence, nebo jiného fenotypu, existuje několik diagnostických postupů, které mohou být použity. Zkoumá se přítomnost bFGF (bazický fibroblastový růstový faktor) v moči a VEGF v séru jakožto markery pro infantilní hemangiom (81, 99). U dětí s proliferujícím hemangiomem je zvýšená hladina bFGF, u vaskulárních malformací je normální. U hlubokých lézí se na podporu diagnózy využívají zobrazovací metody, které nám ozřejmí, jak velký mají rozsah. Ultrasonografie vykazuje zvýšenou denzitu cév a zvýšený průtok, avšak tato modalita má omezení zobrazení plného rozsahu léze a dopadu na okolní struktury (18). Dopplerův ultrazvuk vykazuje vysokoprůtokový vzorec.
Magnetická rezonance s nebo bez podání gadolinia zobrazí dobře ohraničený útvar, který je izointenzní s extraokulárními svaly v T1 zobrazení a hyperintenzní v T2. Kontrastem se zvýrazní (70). I když je MR obecně dražší a méně dostupná než počítačová tomografie (CT), doporučuje se diagnostika MRI, aby se zabránilo vystavení záření na děti v této tak zranitelné věkové skupině. Pokud je nutné CT, použitá dávka záření by měla být odpovídající vzhledem k věku. Na CT se hemangiom zobrazí jako homogenní masa s drénujícími cévami, zvýrazňující se kontrastem. V určitých případech může být užitečné využití CT nebo MRI angiografie. Je třeba zdůraznit, že u lézí nejasné etiologie, neobvyklého vzhledu, orbitální lokalizace, nebo jiných atypických projevů by měla být provedena biopsie, která nás dovede ke konečné diagnóze. Využívá se v diferenciální diagnóze zahrnující lymfangiom, rabdomyosarkom a metastázu neuroblastomu v orbitě. GLUT-1 exprimován pouze endotelovými buňkami hemangiomu může potvrdit diagnózu.
Obr. 1. Magnetická rezonance na obr. zobrazuje v T1 poskontrastně axiální (A) a předozadní (B) dobře ohraničenou, jasně svítící lézi levého čela a horního víčka 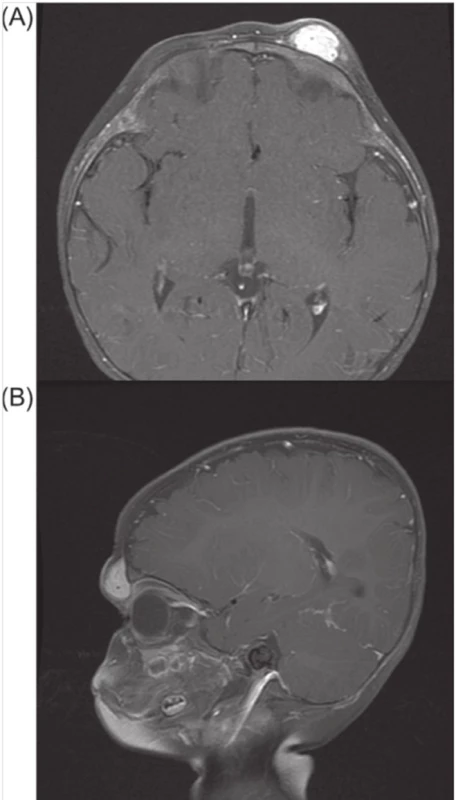
Zdroj: Alison B., Callahan, M.D, Michael K., Yoon, M.D.: Infantile hemangiomas: A review DIFERENCIÁLNÍ DIAGNOSTIKA
Existuje několik cévních nádorů, které mají podobný vzhled jako infantilní hemangiom. Vrozené hemangiomy jsou plně vytvořeny při narození, to je odlišuje od infantilních hemangiomů. Z nejběžnějších vaskulárních malformací v oblasti hlavy a krku v dětském věku je naevus flammeus neboli port-wine stain. Tyto léze mohou být spojeny se Sturge-Weber syndromem. Mají klinický vzhled podobný infantilnímu hemangiomu, ale nezbělají po impresi. Projevuje se jako plochá, ostře ohraničená makulární léze víček, tváře a čela s barvou od růžové přes červenou po tmavě fialovou. Histopatologicky najdeme normální epidermis s abnormálním plexem dilatovaných, tenkostěnných cév v dermis či subkutánně. V dětství je povrch hladký, později vznikají nodulární nerovnosti až hemihypertrofie obličeje. V oblasti hlavy je naevus flammeus obvykle distribuován v inervačních zónách trigeminu, často je však nekopíruje zcela a přesahuje střední čáru.
Sturge-Weberův syndrom (neboli encefalotrigeminová angiomatóza) je fakomatóza postihující oči, obličej a leptomeningy. Névus flammeus je lokalizován v oblasti prvních dvou větví nervus trigeminus. V mozku můžeme najít leptomeningeální malformace, většinou parietookcipitálně ipsilaterálně s névem. S tímto souvisí i epileptické záchvaty, rezistentní na léčbu. Dále se může vyskytovat i kontralaterální hemiparéza a homonymní hemianopsie. K oftalmologickým nálezům patří jednostranný difuzní choroidální hemangiom, méně často hemangiom episkléry, duhovky či řasnatého tělíska. Ve 30 % se vyvine ipsilaterální sekundární glaukom (2, 12, 51, 57, 74).
Kaposiformní hemangioendoteliomy jsou vzácné vaskulární tumory, které mohou být lokálně agresivní vzhledem k jejich rychlé a masivní růstové tendenci. Obvykle jsou vytvořeny již při narození, i když se můžou objevit i krátce poté. Léčba je agresivní k omezení jejich destruktivního charakteru. Angiomy jsou kožní nebo podkožní léze, které jsou obecně benigní a charakterizované pomalým růstem. Kaposiformní hemangioendoteliom i angiomy mohou být spojeny s Kasabach - Meritt sydromem, fenoménem destičkové sekvestrace, který může mít za následek závažné, život ohrožující koagulopatie (52). Vaskulární malformace se liší od tumorů v tom, že jsou podmíněné vadou cévního vývoje, mají neproliferující endotel, a obecně perzistují bez regrese.
Pyogenní granulom patří mezi mezenchymové nádory v periokulární oblasti podobající se infantilnímu hemangiomu. Je to poměrné častá, benigní léze kůže a sliznic. U dětí a mladých dospělých se objevuje jako solitární, červená lesknoucí se papula či nodulus náchylný ke krvácení. Vyvíjí se během několika týdnů nejčastěji na obličeji, ve vlasaté části hlavy a na akrech horních končetin. Vzniká pravděpodobně v souvislosti s drobným traumatem (76).
Získaný chomáčkový hemangiom (tufted hemangioma) je raritnější benigní vaskulární tumor, charakterizovaný trsy cév. Typicky se manifestuje u kojenců nebo v časném dětství jako solidní tumor, nebo jako rozsáhlejší plaky tmavě červené až fialové barvy, citlivé až bolestivé při palpaci (10, 29).
Z afekcí orbity, které stejně jako intrakonálně lokalizované hemangiomy mohou způsobit protruzi bulbu, je nutné vyloučit vrozené anomálie, jakou je kongenitální arteriovenózní malformace, lymfangiom či orbitální cefalokéla. Kongenitální AV malformace je charakterizovaná jako měkká reduktibilní rezistence s pomalou progresí. Lymfangiom se manifestuje u starších dětí mezi 3–5 lety, vykazuje infiltrativní růst pod spojivku a do podkoží víček. Orbitální cefalokéla typicky pulzuje a na RTG a CT je typický kostní defekt. Hematocysta bývá častou příčinou exoftalmu hned po narození. Obvykle vznikne po porodním traumatu se spontánním krvácením a resorbuje se během několika týdnů (4).
Z primárních benigních nádorů, které můžou imitovat hluboký infantilní hemangiom sem patří dermoidní a epidermoidní cysty. Mají palpační nález tuhého vazivového pouzdra.
LÉČBA
Největší problém v řízení léčby infantilního hemangiomu je už samotné rozhodnutí o jejím zahájení. Mnoho z nich může regredovat spontánně a intervence nese riziko, proto potřeba zasáhnout není vždy zřejmá. Hlavní cíle léčby jsou prevence a zvrat ohrožení života nebo funkci ohrožující komplikace, prevence trvalého postižení, snížení psychosociálního stresu pro pacienta a rodinu, a vyhýbání se agresivním nebo škodlivým zásahům u lézí, které můžou mít excelentní prognózu bez léčby (24). Zdravotní důsledky intervence závisí na velikosti, poloze léze, věku pacienta. Všechny tyto faktory by měly být vyhodnoceny a konečné rozhodnutí pro léčbu by mělo záviset na relativním vlivu každého z nich. Většina hemangiomů má benigní průběh a involuje spontánně. Malé léze, které neohrožují vidění nebo další důležité funkce, lze v počátečních fázích jen sledovat. Nicméně i přes samolimitující povahu léze můžou hrozící následky vyžadovat léčbu. Obávanou a častou komplikací u periokulárních hemangiomů je amblyopie. Je nutné zasáhnout, pokud jsou přítomny strabismus, pseudoptóza či anizometropie (38, 83). Některé léze, zejména ty, které jsou velké a těžké, mohou vést k poškození kůže a okolních struktur a zanechávají za sebou jizvu, která zůstává i po vyléčení hemangiomu. Velmi velké nebo neustále se zvětšující léze jsou obvykle výzvou k intervenci.
Steroidy
V roce 1963 byl náhodně při léčbě trombocytopenie prokázán u systémových steroidů (obvyklá dávka 2–5 mg/kg) účinek na zmenšení hemangiomů (53). Představují historický základ léčby. Mechanismus účinků kortikosteroidů není dosud kompletně znám. Inhibice exprese VEGF-A s následnou inhibicí proliferace zárodečných buněk byla prokázána na zvířecích modelech. Zvyšují vaskulární senzitivitu a sekundárně způsobují vazokonstrikci. V rozsáhlejších studiích, byl prednison podáván ve velkých dávkách (20 mg denně po dobu 3–8 týdnů). Ty prokázaly míru odezvy v 84 % po dvou měsících léčby. Jiné potřebovaly až šest měsíců léčby. Nicméně, tato relativně vysoká míra odezvy je doprovázena 35% mírou výskytu nežádoucích účinků, včetně změn chování, cushingoidního vzhledu a opožděného růstu (8).
Kortikosteroidy by měly být podávány v proliferativní fázi, protože na stabilní nebo involující hemangiomy mají jen nepatrný efekt.
Intralezionální steroidy
Ve snaze snížit systémové vedlejší účinky perorálních steroidů se začalo experimentovat s lokálně aplikovanou steroidní terapií. Směs betamethasonu 6 mg/ml a triamcinolonu 40 mg/ml v poměru 1 : 1 o objemu 1 až 2 ml se vstřikuje intralezionálně, v závislosti na velikosti léze. Odpověď může být velice rychlá, se zlepšením řádově pár dní. Nicméně vzhledem k přímé komunikaci mezi lézí a systémovým cévním řečištěm, periokulární intralezionální steroidní injekce s sebou nese sice malé, ale velmi reálné riziko embolizace a. ophtalmica (59, 84, 87). Mezi další lokální komplikace patří kožní hypopigmentace, tuková atrofie, kalcifikace a nekróza očního víčka (13, 17, 90, 95, 98). Ačkoli vzácně, po lokálním použití steroidů se může vyskytnout i dysfunkce nadledvin (98). Intralezionální steroidy jsou nyní obecně druhou linií v léčbě neustupujících lézí.
Obr. 2. Involuce hemangiomu po intralezionální injekci steroidu. (A) před zahájením léčby, (B) týden po injekci, (C) 4 týdny později 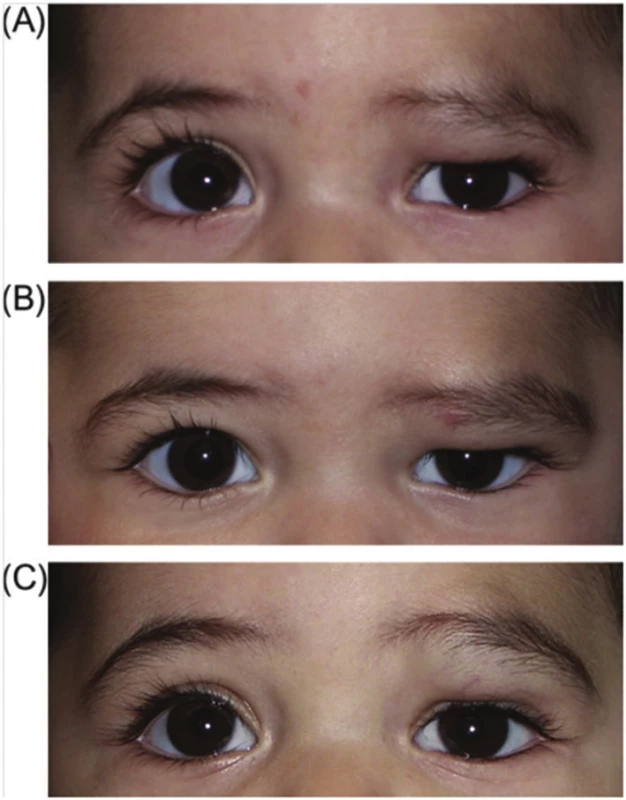
Zdroj: Alison B., Callahan, M.D, Michael K., Yoon, M.D.: Infantile hemangiomas: A review Lokální steroidy
Lokální steroidy se začaly využívat od poloviny 90 let (14, 19). I když tento způsob léčby má mnohem méně závažných vedlejších systémových nežádoucích účinků než intralezionální steroidy, stále s sebou nesou potenciální vedlejší účinky, jako je hypopigmentace, hypertrichóza, glaukom, šedý zákal, pokud se používají delší dobu a jsou účinné pouze pro povrchové léze.
Interferon alfa
Interferony jsou glykované proteiny s antiproliferativní, imunomodulační a protivirovou aktivitou. Interferon alfa se využívá v onkologické léčbě chronické myeloidní leukemie, trichocelulární leukémie, dále u Kaposiho sarkomu u pacientů s AIDS aj.
Jeho výrazný inhibiční účinek angiogeneze se využívá i k léčbě hemangiomů nereagujících na kortikoidy. Většina dnes používaných interferonů se připravuje technologií rekombinantní DNA. Interferon alfa 2a i 2b se užívá v subkutánní injekci v dávce 1–3 milióny jednotek/m2 tělesného povrchu na den. Nežádoucí účinky související s jeho použitím je vedle neutropenie i potenciálně ireverzibilní spastická diplegie. I přes jeho účinnost je riziko neurotoxicity 10–30 %, proto bylo od léčby ním upuštěno (25).
Vinkristin
Vinkristin je chemoterapeutikum, které indukuje apoptózu, a to tak, že se naváže na tubulin a ruší funkci dělícího vřeténka a ukončí tak mitózu. Užívá se v rámci různých kombinací v léčbě hematologických onkologických onemocnění i u solidních tumorů.
Má ale řadu nežádoucích účinků včetně periferní neuropatie, svalové adynamie, atonií močového měchýře, zácpy, bolesti čelisti. Vinkristin je proto vyhrazen pro léčbu život ohrožujících hemangiomů (20).
Laserová terapie
Jednou z dalších modalit v léčbě hemangiomů je laser, který využívá selektivní fototermolýzu. První lasery se začaly k tomuto účelu používat počátkem 80. let minulého století. Dříve využívané typy laserů s kontinuálními režimy jsou ale spojeny s vyšším rizikem jizvení. Bylo vyzkoušeno několik typů laseru, včetně argonového laseru, Nd-YAG laser, CO2 laser, frakční fototermolýza a pulzní barvivový laser (flashlamp-pumped pulsed eye laser, PDL) (1, 6, 12, 16, 28). Z těchto laserů je nejvíce využíván PDL, který emituje světelnou energii, která je absorbována oxyhemoglobinem v cévách. Léčba se provádí obecně ve více sezeních, 8 a více každé 1–2 měsíce (60).
Ve své studii se 617 pacienty, Hohenleutner a spol. zjistil, že PDL zastavil progresi u 97 % infantilních hemangiomů, zcela vyléčil 14 % a částečně regredovalo ještě 15 % (41). Vysoce efektivní je v léčbě ulcerovaných hemangiomů, u kterých navozuje rychlou reepitelizaci. U proliferujících hemangiomů je ale limitován hloubkou penetrace. Proniká do hloubky přibližně 1,2 mm. Tato metoda je proto účinná v léčbě superficiálních hemangiomů. Proto i naevus flammeus a celá škála získaných kožních vaskulárních lézí lze úspěšně léčit pomocí PDL. U IH má využití u ulcerovaných hemangiomů, u kterých snižuje bolestivost a navozuje reepitelizaci, u hemangiomů po involuci zlepšuje residuální teleangiektázie.
Chirurgická léčba
Chirurgická intervence je alternativou pro všechny výše uvedené modality (58). Je obvykle indikována v případech residuálních kosmetických deformit u již regredovaných hemangiomů, nebo pro léze které jsou refrakterní k jiným méně invazivním metodám léčby. Primární excize, navzdory dobrému ohraničení je u proliferujících tumorů problematická, vzhledem k infiltrativní povaze růstu a chybění pouzdra.
Walker a spol. (96) prokázali působivé klinické výsledky po chirurgickém odstranění u 12 vizuálně signifikantních hemangiomů, u nichž v polovině případů selhala předchozí terapie, ale dva z nich si také vyžádaly pooperační transfuze kvůli krvácení. Důležitou součástí předoperační přípravy jsou zobrazovací techniky (MR, angiografie), které nám ozřejmí velikost, umístění i chirurgické riziko pro okolní orbitální struktury, a dále i typizaci krevní skupiny pacienta.
Beta-blokátory (celková a topická aplikace)
Posun v léčbě hemangiomů nastal po objevu účinnosti neselektivního betablokátoru propranololu v roce 2008, a to autorkou Léauté Labrèze a kol. (62). Bylo to díky případu pacienta léčeného pro hypertrofickou obstrukční kardiomyopatii perorálním propranololem, po kterém byl u téhož dítěte zaznamenána i regrese hemangiomu.
Betablokátory působí třemi mechanismy: 1. vazokonstrikcí, 2. snížením exprese VEGF a bFGF genů, 3. aktivací apoptózy endoteliálních buněk. Poslední dva mechanismy jsou pravděpodobně zodpovědné za zastavení proliferace a urychlení involuce hemangiomů.
Účinek byl potvrzen následně i u dalších deseti případů (sedm z nich mělo nějakou periorbitální lokalizaci) po perorálně podaném propranololu (62). Tato systémová léčba ukázala naději pro terapii velkých, hlubokých, či obtížně přístupných lézí. V návaznosti na to prokázaly desítky kazuistik pozitivní výsledky včetně periokulárních případů. Taban a Goldberg (91) publikovali úspěšnou léčbu refrakterního orbitálního a periorbitálního hemangiomu, zatímco Fay a kol. (23) úspěšně použili propranolol jako primární terapii u hlubokého intrakonálního hemangiomu. Haider a kol. (37) publikovali sérii 17 pacientů s periokulárním hemangiomem, u kterých došlo ve 100 % k zastavení progrese, u 10 pacientů pak k více než 50% regresi a k mírné regresi u 6 pacientů. Missoi a kol. (67) prokázali ještě příznivější výsledky s redukcí velikosti (medián 61 %) u každého ze 17 pacientů s periokulárním hemangiomem léčených perorálním propranololem. I když nespecificky pro periorbikulární léze je jedna randomizovaná, dvojitě slepá kontrolovaná studie porovnávající propranolol a placebo. Studie zjistila, že u všech pacientů užívajících propranolol došlo k zastavení růstu za 4 týdny (versus 16 týdnů u placeba) (40). I přes efektivitu této léčebné modality je zde i velké riziko vedlejších nežádoucích účinků. Propranolol může způsobit hypotenzi, bradykardii, bronchospasmus, poruchu glukózové tolerance, městnavé srdeční selhání, podchlazení a poruchy spánku. Proto je nutné pečlivé sledování těchto dětí (87). Ve výše uvedené sérii případů, byla přerušena léčba u jednoho pacienta pro systémovou hypotenzi (13) a jeden pacient prodělal benigní epizodu bradykardie. V ostatních případech byl ale propranolol tolerován jen s menšími nežádoucími účinky, jako gastrointestinální potíže, gastroesofageální reflux a únava (98). Dále betablokátory snižují lipolýzu, glykogenolýzu a glukoneogenezi. Je proto nutná pečlivá monitorace během léčby a postupné vysazování. I když se tato metoda může zdát jako nejlepší dostupná léčba, musí být prováděny další studie, a pacienti a jejich rodiny by měly být náležitě poučeny. Existuje řada probíhajících studií v současné době a další průkazná data budou k dispozici.
Topická léčba
Ve snaze minimalizovat vedlejší účinky systémové léčby byly zkoumány i lokální betablokátory. Guo (35) publikoval první úspěšné případy topické aplikace 0,5% timololu v léčbě hemangiomu, způsobující ale značný astigmatismus. Po 7 týdnech léčby, astigmatismus byl již anizometropický, došlo k podstatnému zlepšení ve velikosti, tloušťce a barvě infantilního hemangiomu. Poté bylo zveřejněno dalších 7 případů, z nichž u všech došlo k odpovědi do 4–8 týdnů se snížením velikosti v rozmezí 55–95% (72). Žádný z těchto případů nebyl spojen s vedlejšími účinky. Větší, multicentrická retrospektivní studie zkoumala 73 pacientů s menšími a povrchovými hemangiomy kdekoliv na těle, které byly léčeny buď 0,1% nebo 0,5% gelem timolol maleolátu aplikovaného dvakrát denně (44). U jednoho pacienta se jako vedlejší účinek vyvinula porucha spánku vyžadující přerušení medikace. Celkově počáteční údaje naznačují, že topické betablokátory mohou být bezpečné a účinné u povrchových lézí s delší dobou trvání léčby, čímž se dosáhne i lepšího efektu.
Intralezionální aplikace
Existuje jediná publikace intralezionální aplikace betablokátorů (5). V této prospektivní, nerandomizované studii dostávalo deset pacientů intralezionálně injekci triamcinolonu 40 mg/ml a následujících 12 pacientů dostalo intralezionálně propranolol 1 mg/ml (až do 1 ml). V této nekontrolované studii byly podobné výsledky s přibližně 40% dosažením „výborné“ odpovědi, 40–45% „dobrou“ odezvou, a 17–20 % bylo bez odpovědi. Nebyly hlášeny žádné nežádoucí účinky. Bylo by ale potřeba další prozkoumání bezpečnosti a účinnosti intralezionální aplikace beta-blokátorů.
Radioterapie
U infantilních hemangiomů refrakterních na medikamentózní léčbu je na některých pracovištích využívanou modalitou i nízko dávkovaná radioterapie s krytím bulbu. Mikroembolizace, která je navozena radiací, urychluje regresi tumorózní masy. Za 1–2 týdny se obvykle objeví involuce. Aby se předešlo radiačním komplikacím, je nutná monitorace kumulace dávky (4,6).
Kryoterapie
Kryoterapie se často využívala pro léčbu superficiálních, event. kombinovaných hemangiomů. V současnosti se pro intenzivnější využívání laserů od kryoterapie ustupuje.
Výzkum
Úvod
Infantilní hemangiomy jsou běžné benigní dětské nádory. Nejvyšší incidence výskytu je v oblasti hlavy a tváře (100). Periorbitální hemangiomy zahrnující hemangiomy na horním víčku, dolním víčku, vnitřním koutku, zevním koutku a orbitálním septu můžou utlačovat bulbus, a mít vliv i na vývoj vidění pro eventuální vznik amblyopie. Proto je zapotřebí včasný zásah, aby se zabránilo těmto negativním důsledkům (82, 100).
Glukokortikoidní terapie má v léčbě hemangiomů již více jak třicetiletou historii (31, 32). Studie ukázaly, že intralezionální injekce glukokortikoidů u periorbitálních hemangiomů má dobré výsledky s menšími vedlejšími účinky (49, 69, 78, 82, 98). První studie z roku 2008 ukázaly na velké výhody systémově užívaného propranololu v léčbě těžších hemangiomů (27, 62, 65, 85). Několik studií ukázalo účinnost propranololu i u periorbitálních hemangiomů (93, 94). Dosud neexistuje randomizovaná kontrolovaná studie k porovnání dvou druhů léčby u periorbitálních hemangiomů.
Cíl
Retrospektivní analýza léčby periorbitálních hemangiomů na Dětské oční klinice. Soubor zahrnoval celkem 54 pacientů, kteří byli sledováni od ledna 2009 do prosince 2014.
Metodika
Sledované parametry zahrnovaly: lokalizace léze, typ použité léčby, věk v době stanovení diagnózy, pohlaví. V kooperaci s kožním oddělením Pediatrické kliniky FN Brno bylo diagnosticko-terapeutické schéma následující: MRI mozku a orbit, dále ultrazvukové vyšetření břicha, kardiologické a hematologické vyšetření. Iniciální dávka propranololu byla 0,5 mg/kg/den p. o. (ve 3 dávkách). V průběhu podávání se monitoroval krevní tlak, pulz a glykémie. Dávka byla postupně navyšována až na konečných 2 mg/kg/den rozdělených ve třech dávkách za stejného monitoringu.
Následně probíhaly jednou týdně kontroly krevního tlaku, glykémie a celkového stavu v ambulanci dětského praktického lékaře. Léčba probíhala průměrně 3 měsíce (rozmezí 3-8 měsíců). V případě regrese nálezu byl lék postupně vysazován, v případě nedostatečného účinku se v léčbě pokračovalo.
Výsledky
U 26 pacientů byla léze lokalizovaná na horním víčku (obr. 5) či v oblasti obočí, u 14 pacientů na dolním víčku (obr. 3 a 4), u 7 pacientů v periorbitální krajině, v oblasti vnitřního koutku u 4 pacientů. Choroidální hemangiom se objevil u 3 pacientů. Tabulka 1 uvádí přehledně rozdělení periorbitálních hemangiomů dle lokalizace léze. Průměrný věk v době zahájení léčby byl 3 měsíce (rozmezí 3–8 měsíců). U 14 pacientů se aplikoval perorální betablokátor propranolol. Kombinace kortikoidu (prednisonu p. o.) a propranololu byla použita u 1 pacienta. U 3 pacientů byla k léčbě hemangiomu použita kombinace prednisonu a intralezionální aplikace DepoMedrolu. U 1 pacienta jsme indikovali monoterapii intralezionálním DepoMedrolem. U 3 pacientů byla provedena chirurgická exstirpace a u 2 případů kauterizace. Monoterapie prednisonem byla použita u 3 pacientů. 27 pacientů bylo pouze sledováno bez nutnosti terapie. V tabulce 2 je přehledně uvedeno početní a procentuální zastoupení jednotlivých léčebných schémat v celém souboru pacientů. Tabulka 3 uvádí rozdělení pacientů s periorbitálním hemangiomem dle pohlaví.
Tab. 1. Rozdělení orbitálních hemangiomů dle lokalizace. Celkem n = 54 pacientů 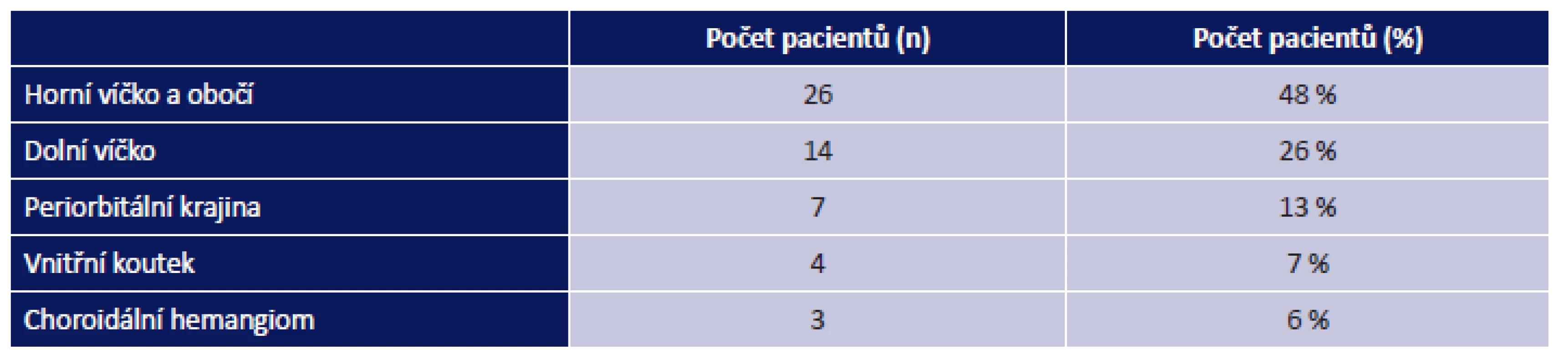
Tab. 2. Početní a procentuální zastoupení jednotlivých terapeutických schémat v léčbě perioritálních hemangiomů ve sledovaném souboru pacientů. Celkem n = 54 pacientů 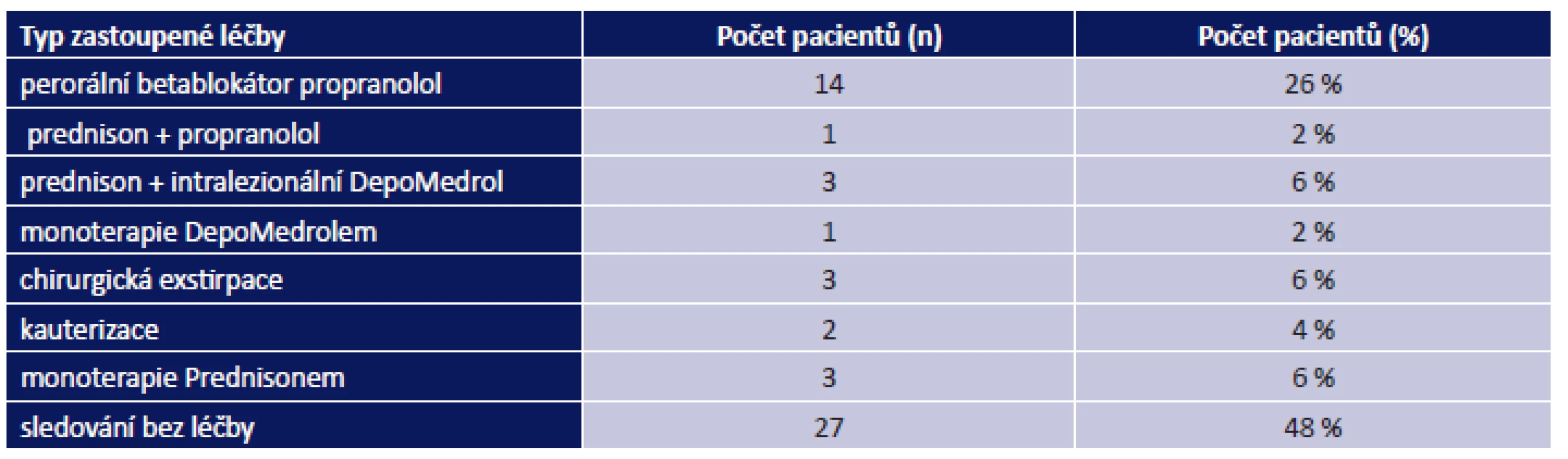
Tab. 3. Rozdělení pacientů s periorbitálním hemangiomem dle pohlaví. Celkem n = 54 pacientů 
Obr. 3. Kapilární hemangiom dolního víčka u šestiměsíčního kojence 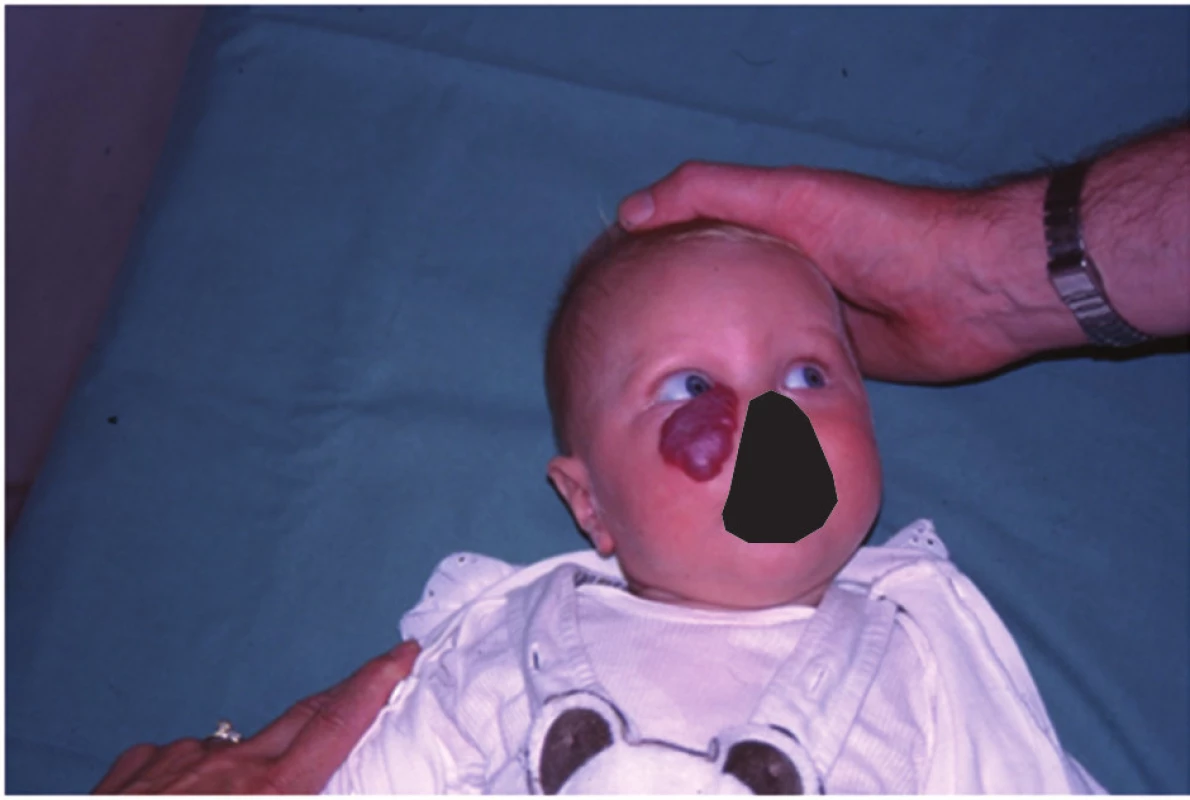
Obr. 4. Kapilární hemangiom dolního víčka u tříměsíčního kojence 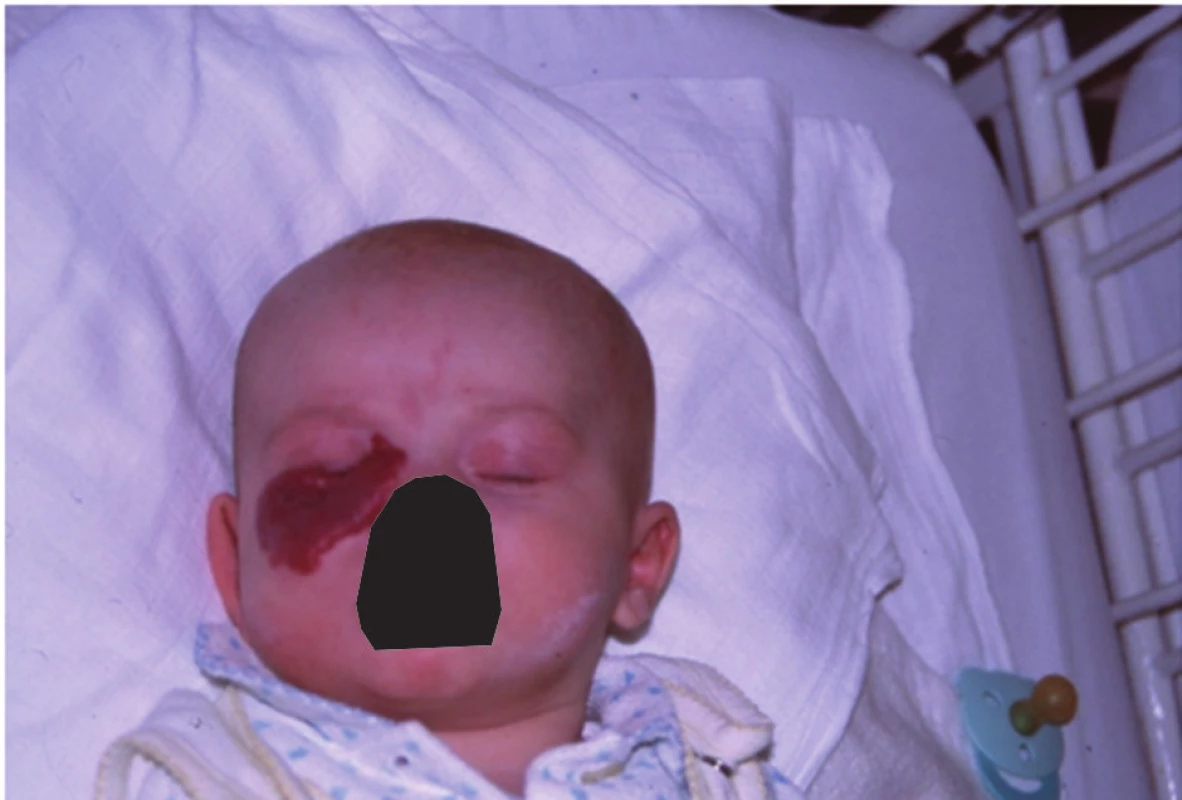
Obr. 5. Superficiální hemangiom pravého horního víčka u dvouměsíčního kojence před terapií 
Obr. 6. Postupná regrese nálezu po intralesionální aplikaci DepoMedrolu 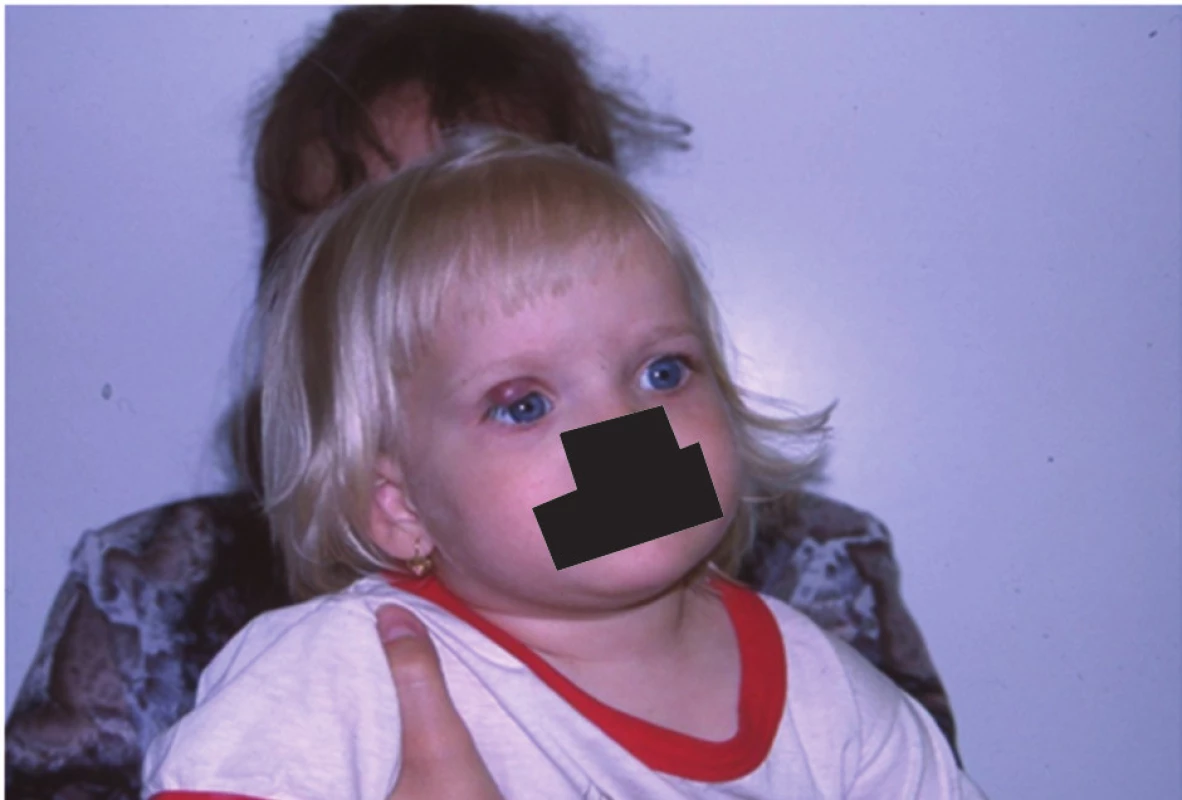
Obr. 7. Dvouletá holčička po ukončení léčby 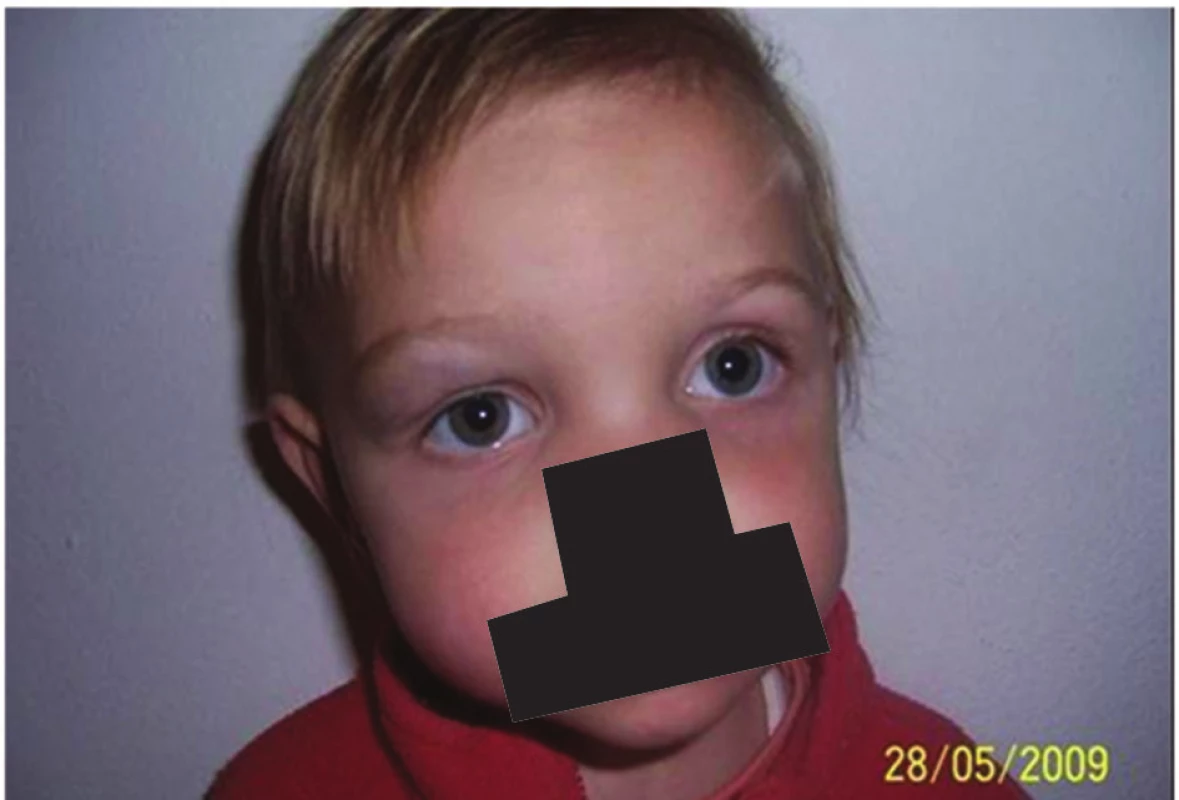
U pacientů po intralezionální aplikaci kortikoidů (v monoterapii nebo v kombinaci s jinou terapií) tedy celkem u 4 pacientů se nádory zmenšily během jednoho týdne po ošetření. Do 4 měsíců nádor involoval. Tkáň se stala měkkou, plošší. V současné době jsou tyto nádory v kompletní involuci.
U 14 pacientů se systémovým užíváním propranololu se nádor začal oplošťovat během jednoho až dvou týdnů. O měsíc později bylo pozorováno již výrazné zmenšení. Během léčby nádor kontinuálně a pomalu involoval. Léčba trvala v průměru 5,5 měsíce. Opakovaný výskyt nádoru jsme nezaznamenali. Nežádoucí účinky v našich případech byly mírné. U pacientů s intralezionální aplikací glukokortikoidů měl jeden pacient lehkou atrofii měkkých tkání, která se vrátila do normálu za 6 měsíců.
Monoterapie prednisonem u tří pacientů byla v průměru po 3 měsících ukončena. U jednoho pacienta se objevil jako nežádoucí účinek Cushingův syndrom, kterého projevy zmizely do 4 měsíců po ukončení léčby. U jednoho pacienta byla terapie prednisonem doplněna o laserové ošetření a u jednoho perorálním užíváním propranololu po dobu 4 měsíců.
Chirurgická exstirpace byla provedena u dvou pacientů bez nutnosti další terapie. Kauterizace u 3 pacientů pro rozsahem malý nádor byla také postačující.
Žádné jiné systémové či lokální komplikace, jako je zpomalení růstu, embolizace retinální arterie, pigmentace, nekrózy kůže víček jsme nezaznamenali.
Diskuse
Periorbitální hemangiomy patří k častým benigním tumorům hlavy a krku. Zvláštní pozornost ale přitahují z důvodu možného nebezpečí zhoršení vývoje zraku. Deformace rohovky a indikovaný astigmatismus způsobené útlakem nádoru je hlavní příčinou tupozrakosti (22, 69). Proto, aby se zabránilo jejímu vzniku, je nutné rychlé zmenšení a uvolnění tlaku na rohovku, jakmile je to možné.
Bylo potvrzeno, že lokální injekcí kortikosteroidů bylo dosaženo dobrých výsledků u velikostně malých hemangiomů (78). Lokální injekce glukokortikoidů do periorbitálních hemangiomů může podpořit zmenšení nádoru a urychlit i zlepšení astigmatismu. Většina našich pacientů byla léčena po dobu 4 měsíců.
Systémově užívaný propranolol byl poprvé v léčbě těžkého hemangiomu použit v červnu 2008 (62, 85). Několik studií prezentovalo uspokojivý efekt systémového propranololu u periorbitálních hemangiomů (93, 94). Autoři zde dokumentovali rychlou a trvalou odezvu u 8 z 8 pacientů (93). Autoři prezentovali i dalšího pacienta, který byl odolný k intralezionální aplikaci glukokortikoidů a také reagoval na systémový propranolol (93). To naznačuje převahu propranololu ve srovnání s účinností intralezionálních kortikoidů (93, 94).
Nežádoucí účinky u našich pacientů jsou vcelku mírné. U pacientů s kortikoidní terapií jsme zaznamenali u jednoho pacienta lokální atrofii měkkých tkání a Cushingoidní projevy u pacienta, kde byl nasazen systémový kortikoid.
Závěr
Podle našich pozorování a výsledků předchozích studií lze dosáhnout dobrých výsledků při léčbě periorbitálních hemangiomů jak intralezionální aplikací glukokortikoidů, tak i systémovým propranololem (48, 69, 82, 93, 94, 98). Systémový propranolol ukázal převahu v účinnosti a bezpečnosti. Propranolol je pro svoje nežádoucí účinky u dětí s astmatem, bronchitidou, či srdeční vadou kontraindikován. V tomto případě je stále volbou intralezionální aplikace glukokortikoidů.
Autoři práce prohlašují, že vznik i téma odborného sdělení a jeho zveřejnění není ve střetu zájmu a není podpořeno žádnou farmaceutickou firmou.
Do redakce doručeno dne 31. 3. 2016
Do tisku přijato dne 26. 7. 2016
MUDr. Katarína Pramuková
Dětská oční klinika FN
Jihlavská 20
625 00 Brno
e-mail: katkasladka@seznam.cz
Zdroje
1. Al Buainian,H., Verhaeghe, E., Dierckxsens, L., Naeyaert, J.M.: Early treatment of hemangiomas with lasers. A review. Dermatology 2003;206(4):370–373.
2. Antaya, R.J.: Capillary malformation /online/./ cit. 25. 9. 2009/ Dostupné z: http://emedicine.medscape.com/article/1084479.
3. Antaya, R.J.: Infantile hemangioma /online/./cit. 29. 12. 2010/ Dostupné z: http://emedicine.medscape.com/article/1083849.
4. Autrata R. a kol.: Dětská oftalmologie. I. část. Sborník prací lékařské fakulty Masarykovy univerzity č. 122. 1. vyd. Masarykova univerzita, Brno, 2008, 137: s. 15-41.
5. Awadein, A., Fakhry, M.A.: Evaluation of intralesional propranolol for periocular capillary hemangioma. Clin Ophthalmol, 2011; 5 : 000-000.DOPLNIT!
6. Bang, G.M., Setabutr, P: Periocular capillary hemangiomas: Indications and options for treatment. Middle East Afr J Ophtalmol,17, 2010; 2 : 121–128.
7. Barnés, C.M., Huang, S., Kaipainen A., Sanoudou, D., Chen, E.J., Eichler, G.S, et al.: Evidence bz molecular profiling for a placental origin of infantile hemangioma. Proc Natl Acad Sci USA, 2005; 102 : 19097–19102.
8. Bennet, M.L, Fleischer Jr, A.B., Champlin, S.L., Frieden, I.J.: Oral corticosteroid use is effective for cutaneous hemangiomas: an evidence-based evaluation: Arch Dermatol, 2001; 137 : 1208–1213.
9. Boscolo, E., Bischoff, J.: Vasculogenesis in infantile hemangioma. Angiogenesis, 2009;12 : 197–207.
10. Browning,, J., Frieden , I., Baselga, E. et al.: Congenital, Self - regressing Tufted Angioma. Arch Dermatol, 142, 2006; 6 : 749–751.
11. Buckmiller, L.M, Munson, P.D:, Dyamenahalli, U., Dai, Y, Richter, G.T.: Propranolol for infantile hemangiomas: Early experience at tertiary vascular anomalies centre. The Laryngoskope, 120, 2010; 4 : 676–681.
12. Burns,A.J., Navarro, J.A., Cooner, R.D.: Classification of vascular anomalies and the comprehensive treatment of hemangiomas. Plastic and Reconstructive Surgery, 124, 2009; 1S: 69–81.
13. Cogen, M., Elsas F.: Eyelid depigmentation following corticosteroid injection for infantile ocular adnexal hemangioma. J Pediatr Ophthalmol Strabismus, 1989; 26 : 35–8.
14. Cruz ,O.A., Zarnegan ,S.R., Myers ,S.E.: Treatment of periocular capillary haemangioma with topical clobetasol proprionate. Ophthalmology, 1995; 102 : 2012–2015.
15. Drolet, B.A, Esterly, N.B., Frieden, I.J.: Hemangiomas in children. N Engl J Med, 341, 1999; 3; 173–181.
16. Drolet, B.A, Swanson, E.A.: Hemangioma investigator group. Infantile hemangiomas: an emerging health issue link end to an increased rate of low birth weight infants. J Pediatr, 2008; 153 : 712–715.
17. Droste, P., Ellis, F., Sondhi, N., Helveston, E.: Linear subcutaneous fat atrophy after corticosteroid injection of periocular hemangiomas. Am J Ophthalmol, 1988; 105 : 65–69.
18. Dubois J, Garel L, David M, Powell J.: Vascular soft tissue tumors in infancy: distinguishing features on Doppler sonography. AJR Am J Roentgenol, 2002; 178 : 1541–1545.
19. Elsas, F.J., Lewis, A.R.: Topical treatment of periocular capillary haemangioma. J Pediatr Ophthalmol Strabismus, 1994; 31 : 153–156.
20. Enjolras, O., Brevière, G.M., Roger, G., Tovi, M., Pellegrino , B., Varotti, E. et al.: Vincristine treatment for function - and life-threatening infancy hemangioma. Arch Pediatr 2004;11(2):99–107.
21. Faberová, R., Bučková, H., Procházka, J. a kol.: Nové poznatky léčby hemangiomů u dětí, jejich diferenciální diagnostika. Dermatologie pro praxi, 3, 2009, 2 : 75–77.
22. Fabian, I.D, Ben-Zion, I., Samuel. C., Spierer, A.: Reduction in astigmatism using propranolol as first-line therapy for periocular capillary hemangioma. Am J Ophthalmol, 2011; 151(1): 53–58.
23. Fay, A., Nguyen, J., Jakobiec, F.A, Meyer-Junghaenel,L., Waner M.: Propranolol for isolated orbital infantile hemangioma. Arch Ophthalmol, 2010; 128(2): 256–258.
24. Frieden, I.J., Eichenfield, L.F:, Esterly, N.B., Geronemus, R., Mallory, S.B.: Guidelines of care for hemangiomas of infancy: American Academy of Dermatology guidelines/outcomes committee. J Am Acad Dermatol, 1997; 37 : 631–637.
25. Frieden, I.J., Haggstrom, A.N, Drolet, B.A, Mancini, A.J., Friedlander S.F, Boon, L. et al.: Infantile hemangiomas: current knowledge, future directions. Proceedings of a research workshop on infantile hemangiomas, April 7.-9. 2005, Bethesda, Maryland, USA, Pediatric Dermatology, 22,2005; 5 : 383–406.
26. Fuchsmann, C., Quintal, M.C., Ginguere, CH. et al.: Propranolol as First-line Treatment of Head and Neck Hemangiomas. Arch Otolaryngol Head Neck Surg, 137, 2011; 5 : 471–478.
27. Gan, L.Q., Ni, S.L, Tan, Q., Wang, H.: A retrospective study of propranolol therapy in 109 infants with infantile hemangioma. Pediatr Dermatol, 2013; 30 : 270–272.
28. Gladstone, G.J., Beckman, H.: Argon laser treatment of an eyelid margin capillary hemangioma. Ophthalmic Surg, 1983;14(11): 944–946.
29. Goldman, M.P: Tufted Angioma/online/./cit. 2. 10. 2009/ Dostupné z: http://emedicine.medscape.com/article/1086612.
30. Good, W.V., Hou, CH., Frieden, I.J: et al.: Evidence for Visual Compromise in Preverbal Children with Orbital Vascular Birthmarks. Am J Ophtalmol, 147, 2009; 4 : 679–682.
31. Greene, A.K., Couto, R.A.: Oral prednisolone for infantile hemangioma: efficacy and safety using a standardized treatment protocol. Plast Reconstr Surg, 2011; 128 : 743–752.
32. Greene, A.K.: Systemic corticosteroid is effective and safe treatment for problematic infantile hemangioma. Pediatr Dermatol 2010; 27 : 322–323.
33. Greenberger, S., Adini, I., Boscolo, E., Mulliken, J.B., Bischoff, J.: Targeting NF-kB in infantile hemangioma-derived cells reduced VEGF-A expression. Angiogenesis 2010; 13 : 327–335.
34. Greenberger, S., Boscolo, E., Adini, I., Mulliken, J.B., Bischoff, J.: Corticosteroid suppression of VEGF-A in infantile hemangioma-derived stem cells. N Engl J Med, 2010; 362 : 1005–1013.
35. Guo, S., Ni N.: Topical treatment for capillary hemangioma of the eyelid using beta-blocker solution. Arch Ophthalmol, 2010; 128(2): 255–256.
36. Haggstrom, A.N., Drolet ,B.A., Baselga, E., Champlin, S.L., Garyon , M.C., Horii, K.A., et al.: Prospective study of infantile hemangiomas: clinical characteristics predicting complications and treatment. Pediatrics, 2006; 118 : 882–887.
37. Haider, K.M., Plager, D.A, Neely, D.E, Eikenberry, J., Haggstrom A.: Outpatient treatment of periocular infantile hemangiomas with oral propranolol. J AAPOS 2010;14(3): 251–256.
38. Haik, B.G., Jakobiec, F.A., Ellsworth, R.M., Jones, I.S.: Capillary hemangioma of the lids and orbit: an analysis of the clinical features and therapeutic results in 101 cases. Ophtalmology, 1979; 86 : 760–792.
39. Hemangioma investigator group Haggstrom, A.N., Drolet, B.A, Baselga, S.L., Chamli, S.L., Garzon, M.C. et al.: Prospective study of infantile hemangiomas: demographic, prenatal, and perinatal characteristics. J Pediatr, 2007;150 : 291–294.
40. Hogeling, M., Adams, S., Wargon, O.: A Randomized Controlled Trial of Propranolol for Infantile Hemangiomas. Pediatrics, 128, 2011; 2 : 259–266.
41. Hohenleutner, S., Badur-Ganter, E., Landthaler, M., Hohenleutner, U.: Long-term results in the treatment of childhood hemangioma with the flash lamp-pumped pulsed dye laser: an evaluation of 617 cases. Lasers Surg Med, 2001; 28(3): 273–277.
42. Holmes, W. J. M., Mishra, A., Gorst, C., Liew, S.H.: Propranolol as first-line treatment for infantile hemangiomas. Plastic and Reconstructive Surgery, 125, 2010; 1 : 420–421.
43. Holland, K.E., Drolet, B.A.: Infantile hemangioma. Pediatr Clin North Am 2010; 57 : 1069–1083.
44. Chakkittakandiyil, A., Phillips, R., Frieden, I.J. et al.: Timolol maleate 0.5% or 0.1% gel-forming solution for infantile hemangiomas: a retrospective, multicenter cohort study. Pediatr Dermatol, 2012; 29 : 28–31.
45. Chang, L.C., Heggstrom, A.N., Drolet, B.A., Baselga, E., Champlin, S.L. et al.: Hemangioma investigator group. Growth Characteristics of infantile hemangiomas: implications for management. Pediatrics, 2008; 122 : 360–367.
46. Chiller, K.G., Pasaro, D., Frieden, I.J.: Hemangiomas of infancy: clinical characteristics, morphologic subtypes, and relationship to race, ethnity, and sex. Arch Dermatol, 2002; 138 : 1567–1576.
47. Itinteang, T., Tan, S.T., Brasch, H., Day, D.J.: Haemagenic endothelium in infantile haemangioma. J Clin Pathol, 2010; 63 : 982–986.
48. Jacobs, AH.: Strawberry hemangiomas: the natural history of the untreated lesion. Calif Med, 1957; 86 : 8–10.
49. Janmohamed SR, Madern GC, Nieuwenhuis K, de Laat PC, Oranje AP.: Evaluation of intra-lesional corticosteroids in the treatment of peri-ocular haemangioma of infancy: still an alternative besides propranolol. Pediatr Surg Int, 2012; 28 : 393–398.
50. Jinnin., M, Ishihara, T., Boye, E., Olsen, BR.: Recent progress in studies of infantile hemangioma. J Dermatol, 2010; 37 : 939–955.
51. Kanski, J.J. et al.: Clinical Ophthalmology a Systematic Approach. Fifth edition. Butterworth-Heinemann International Edition, London, 2003, 733 p.
52. Kasabach, H.H, Merritt, K.K.: Capillary hemangioma with extensive purpura report of a case. Am J Dis Child, 1940; 59 : 1063.
53. Katz, H.P.: Thrombocytopenia associated with hemangioma: critical analysis of steroid therapy. In XI international congress of pediatrics, Tokyo;1965, p. 336–337.
54. Khan, Z.A., Boscolo, E., Picard, A., Psutka, S., Melero-Martin, J.M., Bartch, T.C. et al.: Multipotencial stem cells recapitulate human infantile hemangioma in immunodeficient mice. J Clin Invest, 2008; 118 : 2592–2599.
55. Kilcline, C., Frieden, IJ.: Infantile hemangiomas: how common are they? A systematic review of the medical literature. Pediatr Dermatol, 2008; 25 : 168–173.
56. Krafchik, B.R.: Kasabach-Meritt Syndrome /online/-/cit. 22. 2. 2010/ Dostupné z: http://emedicine.medscape.com/article/202455.
57. Kuchyňka, P. a kol.: Oční lékařství. 1. vydání. Grada, Praha, 2007, 768 s.
58. Kullbersh, J., Hochman, M.: Serial excision of facial hemangiomas. Arch Facial Plast Surg, 2011; 13(3): 199–202.
59. Kushner B, Lemke B.: Bilateral retinal embolization associated with intralesional corticosteroid injection for capillary hemangioma of infancy. J Pediatr Ophthalmol Strabismus, 1993; 30 : 397–399.
60. Laubach, H.J., Anderson, R.R, Luger, T., Manstein, D.: Fractional photothermolysis for involuted infantile hemangioma. Arch Dermatol, 2009;145(7):748–750.
61. Leon-Villapalos, J., Wolfe, K., Kangesu, L.: GLUT-1.: an extra diagnostic tool to differentiate between haemangiomas and vascular malfomations. Br J Plast Surg, 2005; 58 : 348–352.
62. Léauté - Labrèze, C., Dumas de la Roque, E., Hubiche, T., Borolevi, F., Thambo, J-B, Taïeb, A.: Propranolol for severe hemangiomas of infancy. N Engl J MED, 358, 2008; 24 : 2649–2651.
63. Léuté-Labrèze, C., Taïeb, A.: Efficacy of beta-blockers in infantile capillary haemangiomas: the physiopathological significance and therapeutic consequences. Ann Dermatol Venereol, 2008; 135 : 860–862.
64. Lister, WA.: The natural history of strawberry naevi. Lancet, 1938; 1 : 1429–1434.
65. Marqueling, A.L., Oza, V., Frieden, I.J., Puttgen, K.B.: Propranolol and infantile hemangiomas four years later: a systematic review. Pediatr Dermatol, 2013; 30 : 182–91.
66. Margileth, A.M., Museles, M.: Cutaneus hemangiomas in children. Diagnosis and conservative managment. JAMA 1965; 194 : 523–526
67. Missoi, T.G, Lueder, G.T, Gilbertson, K., Bayliss, S.J.: Oral propranolol for treatment of periocular infantile hemangiomas. Arch Ophthalmol, 2011; 129(7): 899–903.
68. Miřejovský, P., Bednář, B. a kol.: Obecná patologie. Karolinum, Praha, 2002, 83 s.
69. Morrell, A.J., Willshaw, H.E.: Normalisation of refractive error after steroid injection for adnexal haemangiomas. Br J Ophthalmol, 1991; 75 : 301–305.
70. Moukaddam, H., Pollak, J., Haims, A.H.: MRI characteristics and classification of peripheral vascular malformations and tumors. Skeletal Radio, 2009; 38 : 535–547.
71. Mulliken, J.B., Glowacki J.: Hemangiomas and vascular malformations in infants and children: a classification based on endothelial characteristics. Plast Reconstr Surg, 1982; 69 : 412–422.
72. Ni, N., Langer, P., Wagner, R., Guo S.: Topical timolol for periocular hemangioma: report of further study. Arch Ophthalmol, 2011; 129(3): 377–379.
73. North, P.E., Waner, M., Mizeracki, A., Mrak, R.E, Nicholas, R., Kincannon, J., et al.: A unique microvascular phenotype shared by juvenile hemangiomas and human placenta. Arch Dermatol, 2001; 137 : 559–570.
74. Otradovec, J: a kol.: Klinická neurooftalmologie. 1. vydání. Grada, Praha, 2003, 487 s.
75. Pasyk KA, Grabb WC, Cherry GW.: Cellular haemangioma. Light and electron microscopic studies of two cases. Virchows Arch A Pathol Anat Histol, 1982; 396 : 103–126.
76. Pierson, J.C.: Dermatologic Manifestations of Pyogenic Granuloma (Lobular Capillary hemangioma)/online/./cit. 29. 04. 2010/ Dostupnéz:http://emedicine medscape.com/article/1084701.
77. Povýšil, C. a kol.: Speciální patologie I. díl. Karolinum, Praha, 2001, 98 s.
78. Prasetyono, T.O., Djoenaedi, I.: Efficacy of intralesional steroid injection in head and neck hemangioma: a systematic review. Ann Plast Surg, 2011; 66 : 98–106.
79. Press, U.P.: Sensationelle Zufallsentdeckung. Ophtalmologische nachrichten. Sonderteil zum 23. DOC – kongress, 2010; 10 : 41–42.
80. Price, C. J., Latttouf, C., Baum, B. et al.: Propranolol vs Corticosteroids for Infantile Hemangiomas /online/./ cit. 15. 8. 2011/ Dostupné z http://archderm.ama-assn.org/cgi/content/full/archdermatol.2011.203.
81. Przewratil, P., Sitkiewicz, A., Wyka, K., Andrzejewska, E.: Serum levels of vascular endothelial growth factor and basic fibroblastic growth factor in children with hemangiomas and vascular malformations – preliminary report. Pediatr Dermatol, 2009; 26 : 399–404.
82. Ranchod, T.M., Frieden, I.J., Fredrick D.R.: Corticosteroid treatment of periorbital haemangioma of infancy: a review of the evidence. Br J Ophthalmol 2005; 89 : 1134-1138.
83. Robb, R.M.: Refractive errors associated with hemangiomas of the eyelids and orbit in infancy.Am j Ophtalmol 1977; 83 : 52-58.
84. Ruttum, M.S., Abrams, G.W., Harris, G.J., Ellis, M.K.: Bilateral retinal embolization associated with intralesional corticosteroid injection for capillary hemangioma of infancy. J Pediatr Ophthalmol Strabismus 1993; 30 : 4–7.
85. Sans V, de la Roque ED, Berge J, Grenier N, Boralevi F, Mazereeuw-Hautier J, Lipsker D, Dupuis E, Ezzedine K, Vergnes P, Taïeb A, Léauté-Labrèze C.: Propranolol for severe infantile hemangiomas: follow-up report. Pediatrics 2009; 124: e423–431.
86. Seiff, S.: Capillary Hemangioma/online/./ cit.29. 6. 2011/ Dostupné z: http://emedicine.medscape.com/article/1218805.
87. Shorr, N., Seiff, S.R.: Central retinal artery occlusion associated with periocular corticosteroid injection for juvenile hemangioma. Ophthalmic Surg, 1986; 17(4): 229–231.
88. Schwartz, SR., Blei., F., Ceisler, E., et al.: Risk factors for amblyopia in children with capillary hemangiomas of the eyelid and orbit. JAAPOS, 2006; 10 : 262–268.
89. Smoller, B.R., Apfelberg, D.B.: Infantile (juvenile) capillary hemangioma: a tumor of heterogeneous cellular elements. J Cutan Pathol, 1993; 20 : 330–6.
90. Sutula FC, Glover AT.: Eyelid necrosis following intralesional corticosteroid injection for capillary hemangioma. Ophthalmic Surg, 1987; 18 : 103–105.
91. Taban, M., Goldberg, R.A.: Propranolol for orbital hemangioma. Ophthalmology, 2010;117(1): 195.
92. Takahashi, K., Mulliken, J.B., Kozakewich, H.P., Rogers, R.A., Folkman, J., Eyekowitz, R.A: Cellular markers taht distinguish the phases of hemangioma during infancy and childhood. J Clin Invest, 1994; 93 : 2357–2364.
93. Thoumazet, F., Léauté-Labrèze, C., Colin, J., Mortemousque, B.: Efficacy of systemic propranolol for severe infantile haemangioma of the orbit and eyelid: a case study of eight patients. Br J Ophthalmol, 2012; 96 : 370–374.
94. Vassallo, P., Forte, R., Di Mezza, A., Magli, A.: Treatment of infantile capillary hemangioma of the eyelid with systemic propranolol. Am J Ophthalmol, 2013; 155 : 165–170.
95. Vasquez-Botet, R., Reyes, B.A., Vazquez-Botet, M.: Sclerodermiform linear atrophy after the use of intralesional steroids for periorbital hemangiomas: a review of complications. J Pediatr Ophthalmol Strabismus, 1989; 26 : 124–127.
96. Walker, R.S, Custer, P.L, Nerad, J.A.: Surgical excision of periorbital capillary hemangiomas. Ophthalmology, 1994; 101(8): 1333–1340.
97. Weibel, L.: Propranolol – eine neue Therapie für infantile Hämangiome. Paediatrica, 20, 2009; 2 : 27–29.
98. Weiss, A.H, Kelly, J.P.: Reappraisal of astigmatism induced by periocular capillary hemangioma and treatment with intralesional corticosteroids injection. Ophthalmology, 2008; 115(2): 390–397.
99. Zhang, L, Lin, X., Wang, W, Zhuang, X, Dong., J., Qi, Z. et al.: Circulating level of vascular endothelial growth factor in differentiating hemangioma from vascular malformation patients. Plast Reconst Surg, 2005; 116 : 200–204.
100. Zheng, J.W., Zhang., L., Zhou, Q., Mai, H.M., Wang, Y.A., Fan, X.D., Qin, Z.P., Wang, X.K., Zhao, Y.F.: A practical guide to treatment of infantile hemangiomas of the haed and neck. Int J Clin Exp Med. 2013;6 : 851–860.
Štítky
Oftalmológia
Článok vyšiel v časopiseČeská a slovenská oftalmologie
Najčítanejšie tento týždeň
2016 Číslo 4- Dlouhodobé výsledky lokální léčby cyklosporinem A u těžkého syndromu suchého oka s 10letou dobou sledování
- Cyklosporin A v léčbě suchého oka − systematický přehled a metaanalýza
- Účinnost a bezpečnost 0,1% kationtové emulze cyklosporinu A v léčbě těžkého syndromu suchého oka − multicentrická randomizovaná studie
- Pomocné látky v roztoku latanoprostu bez konzervačních látek vyvolávají zánětlivou odpověď a cytotoxicitu u imortalizovaných lidských HCE-2 epitelových buněk rohovky
- Konzervační látka polyquaternium-1 zvyšuje cytotoxicitu a zánět spojený s NF-kappaB u epitelových buněk lidské rohovky
-
Všetky články tohto čísla
- Nová diagnostická zobrazovací metoda – shear waves elastografie
- Historický přehled technik zadní lamelární keratoplastiky
- Hodnocení očního povrchu u pacientů léčených analogy prostaglandinů s ohledem na obsaženou konzervační látku
- Genová terapie dědičných onemocnění SÍTNICE A ZRAKOVÉHO NERVU: současný stav poznání
- HEMANGIOMY ORBITÁLNÍ KRAJINY U DĚTÍ
- MUTÁCIA BRAF A MOŽNOSTI IDENTIFIKÁCIE PROGNOSTICKÝCH MARKEROV METASTÁZOVANIA UVEÁLNEHO MELANÓMU
- Porucha motility bulbu s diplopií jako první příznak tumoru prorůstajícího do orbity z vedlejších dutin nosních
- Česká a slovenská oftalmologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Genová terapie dědičných onemocnění SÍTNICE A ZRAKOVÉHO NERVU: současný stav poznání
- Nová diagnostická zobrazovací metoda – shear waves elastografie
- HEMANGIOMY ORBITÁLNÍ KRAJINY U DĚTÍ
- MUTÁCIA BRAF A MOŽNOSTI IDENTIFIKÁCIE PROGNOSTICKÝCH MARKEROV METASTÁZOVANIA UVEÁLNEHO MELANÓMU
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



