-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Stomatologická péče u pacientů s myasthenia gravis
Dental Care in Patients with Myasthenia Gravis
Myasthenia gravis is an autoimmune disease in the neuromuscular transmission, causing muscular weakness and fatique especially in the facial and pharyngeal muscles. The stomatology care provided to these patients should consider specificities of this disease. Some patients are afflicted by from residual disorders of muscles in the oral cavity, and others suffer from side effects of drugs which inhibit autoimmune inflammation. Various drugs can even deteriorate symptoms of the disease. Anesthesiology should also acquire specific approaches. Stomatologists should be aware of all risks associated with taking care of these patients, but their approach to the patients should not be accompanied by useless worries.
Key words:
myasthenia gravis - stomatology care - oropharyngeal weakness - drug intolerance - anaesthesia
Autoři: J. Piťha
Působiště autorů: Centrum myasthenia gravis, Praha ; Neurologická klinika 1. LF UK a VFN, Praha
Vyšlo v časopise: Česká stomatologie / Praktické zubní lékařství, ročník 110, 2010, 2, s. 26-31
Kategorie: Články
Souhrn
Myasthenia gravis je autoimunitní onemocnění v oblasti nervosvalového přenosu, způsobující svalovou slabost a unavitelnost zejména faciofaryngeálních svalů. Stomatologická péče, poskytovaná těmto nemocným, by měla respektovat specifika této choroby. Někteří nemocní mají reziduální postižení svalstva v oblasti ústní dutiny, jiní trpí nežádoucími účinky léků, které tlumí autoimunitní zánět. Řada léčiv může dokonce příznaky onemocnění zhoršit. Specifické jsou i anesteziologické postupy. Stomatologové by si měli být vědomi všech rizik, spojených s ošetřováním těchto nemocných, na druhou stranu by měli přistupovat k těmto pacientům bez zbytečných obav.
Klíčová slova:
myasthenia gravis - stomatologická péče - orofaryngeální slabost - lékové intolerance - anestezieÚVOD
Myasthenia gravis (MG) je autoimunitní onemocnění v oblasti nervosvalové ploténky, zprostředkované protilátkami proti acetylcholinovému receptoru, modulované T buňkami. Přesto, že se jedná o ne příliš časté onemocnění (incidence je kolem 250 pacientů/1 milion obyvatel), některé specifické projevy této choroby, zejména svalová slabost v oblasti krku, hlavy a ústní dutiny, může být komplikací nebo překážkou zubního ošetření. Dříve, než se provede zubní zákrok, je u nestabilního pacienta vhodná konzultace s ošetřujícím neurologem s cílem zjistit rozsah svalové slabosti a zvážení potřeby lékařského ošetření k optimalizaci léčebného postupu. Dentální péče u pacienta s MG je ve stomatologii považována za problematickou [32].
Ačkoliv zubní péče může být v soukromých ordinacích zvládnuta efektivně, stomatologický tým by si měl být u těchto pacientů vědom preventivních zdravotních opatření a přizpůsobit péči aktuálnímu klinickému stavu, užívaným lékům, a být připraven zvládnout akutní komplikace.
Jelikož orofaryngeální příznaky jsou přítomny až u 56 % pacientů s MG a mohou být jedinou známkou onemocnění u 19 % pacientů, zubní lékaři by si měli byt vědomi těchto příznaků a měli by být poslat pacienta neurologovi k odborné konzultaci. [10] (tab. 1).
Tab. 1. Obličejové příznaky u 3 skupin pacientů s MG. 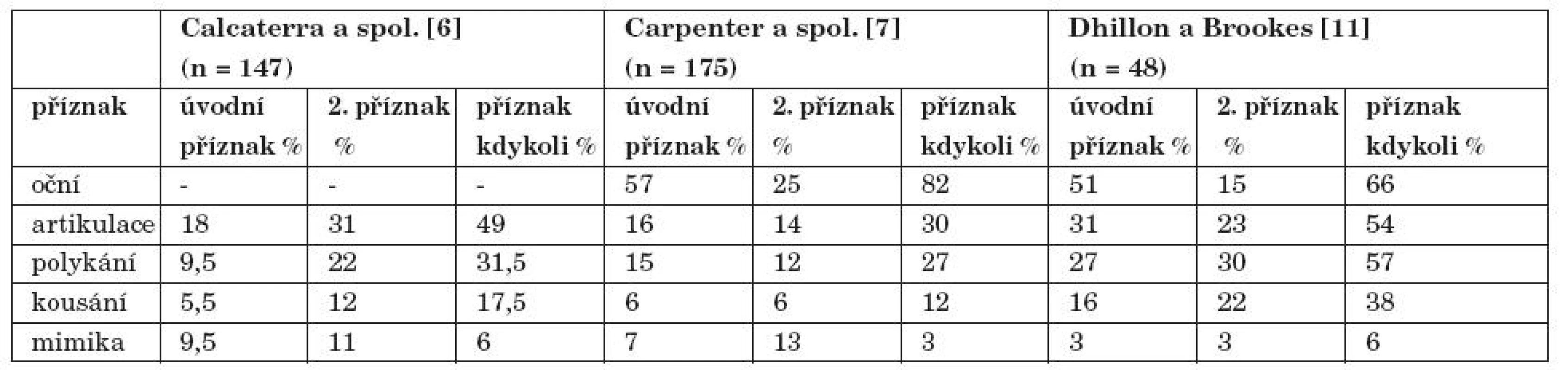
Intraorální nálezy
Lipomatózní atrofie jazyka se u MG může klinicky projevit ochablostí a zřasením jazyka [2]. U mužů v pokročilejším věku byla zaznamenána atrofie jazyka, spojená s fascikulací [4]. Případ prvního přijetí 56letého pacienta na pohotovost s oteklým jazykem, majícím za následek subjektivní dýchací potíže u pětiměsíční anamnézy opětovného otékáni jazyka, s dušností, dysartrií, dysfagií, dokumentuje problémy s diagnostikou MG [9]. Diagnosticky složitými jsou i nálezy atrofií jazyka u tzv. MuSK pozitivní MG [12]. Dávivý reflex je v naprosté většině případů zachován.
Hypomimie
Kromě základních příznaků, jako je ptóza a diplopie, mohou být známkou MG i ostatní příznaky slabosti v oblasti obličejového svalstva (tab. 1). Mimika myastenika je charakterizována jako ospalá, bez výrazu, s apatickým vzhledem, což je výsledkem slabosti mimických svalů a oboustranného poklesu víček [13, 17, 28]. Schopnost usmát se a schopnost našpulit rty je velmi ztížena.
Míra deficitu v indexu délky rtu (stupeň, do kterého mohou být ústa roztažena) a nosního indexu (stupeň, do kterého mohou byt ústa zkrácena aktivitou musculus orbicularis oris) je u pacienta s faciobulbární MG významně větší, než u pacienta s okulární či pletencovou formou MG [31]. Pokusy o úsměv často vyústí v plochý usměv, či v tzv. úsměv na „půl úst“.
Dysfagie
Nedostatek svalové síly ve žvýkacích svalech, obzvláště po delším žvýkání, může způsobit, že čelist zůstane otevřená, pokud není dolní čelist přidržována rukou [17, 28]. Bylo zjištěno, že pacienti s orofaryngeálními příznaky mají podstatně nižší hodnoty maximální EMG aktivity svalů otevírajících a uzavírajících čelist a nižší hodnoty maximální síly skusu, než kontrolní skupina pacientů [31]. Nedostatek síly ve svalech při žvýkání může zabránit úplnému rozžvýkání potravy. Žvýkací schopnosti byly např. hodnoceny měřením dělení testovaného jídla na jednotlivá sousta, přičemž výsledek v průměru velikosti sousta byl větší po 15 soustech ve skupině lidí s MG v porovnání se zdravými subjekty [31].
Příjem potravy může byt zkomplikován i dysfagií, a to v případě, že jsou postiženy svaly jazyka a další polykací svaly. V případě, že jsou postiženy patrové a faryngeální svaly, směřují sousta jídla či tekutin z nosohltanu do nosních dutin [17, 28].
Experimentálně byla maximální síla jazyka u pacientů s MG výrazně nižší než u zdravých lidí, v případě, že byl jazyk tlačen buď nahoru nebo do stran proti odporu [31]. Aktivita polykacích svalů, spojená se zaznamenáváním pohybu brady a hrtanu u jedinců, kteří polykali 10 ml vody, ukázala, že pacienti s bulbárními příznaky polykali pomaleji a vícekrát, aby mohli přijmout 10 ml vody, než zdraví jedinci [31]. Přístup v péči záleží na žvýkacím výkonu a závažnosti dysfagie [8, 16, 22, 29, 30]. Pacienti s dlouhotrvající slabostí při žvýkáni a polykáni mohou trpět podvýživou, dehydratací, hypokalemií, což může nepříznivě ovlivňovat svalovou sílu nezávisle na MG a může být provokujícím faktorem k vývoji myastenické krize [19]. Žvýkací a polykací funkce se mohou zlepšit podáním inhibitoru cholinesterázy hodinu před jídlem a častým odpočinkem během jídla, konzumací hlavního jídla dopoledne, když jsou svaly silnější, a konzumaci měkkého jídla v malých porcích [19]. Riziko aspirace u starších jedinců s těžkou faryngeální dysfunkcí, způsobenou MG, může dokonce vést k preventivnímu zavedení žaludeční sondy, nebo k perkutánní gastrostomii [15].
Dysfonie a dysartrie
Postižení patrových a hrtanových svalů může vyústit v dysfonii, s hlubší, nezřetelnou a hypernazální řečí. Postižení jedinci mohou mít progresivní nepřetržitou neznělost a rostoucí potíže při déletrvajícím mluvení. Zhoršená artikulace a fonace, kombinovaná s postižením lícních svalů, ztěžuje verbální a nonverbální komunikaci [17]. Ve studiích, hodnotících specifické symptomy nebo znaky u pacientů s MG a bez MG, bylo zjištěno, že řeč, stávající se nesrozumitelnou během dlouhodobé artikulace, zvyšuje pravděpodobnost MG čtyřnásobně [24].
Péče o zuby
Zajištění zubního ošetření pacientů s MG vyžaduje zvláštní péči. Ta zahrnuje identifikaci a zvládnutí myastenické slabosti nebo krize, vyvarování se potenciální škodlivé lékové interakce, monitorování vedlejších účinků léků, užívaných pro léčbu MG a přizpůsobení stomatologického výkonu měnící se svalové síle. Patton a Howard [20] referovali o reakcích na zubní ošetření mezi 16 pacienty středního věku. Doba, po kterou trpěli pacienti myasthenií, se různila od méně než jednoho roku do 38 let trvání MG. Každý pacient byl zařazen dle modifikované Ossermanovy klasifikace MG, založené na kvantitativní stupnici Americké Nadace Myasthenia Gravis, dle závažnosti onemocnění. Terapeutické schéma pro léčbu MG u těchto pacientů zahrnovalo inhibitory cholinesterázy, kortikosteroidy a ostatní imunosupresiva, plazmaferézu, thymektomii, IVIG a přístroje na podporu dýchání při myastenické krizi u 5 pacientů. U těchto 16 pacientů bylo uskutečněno 44 návštěv u stomatologa, zahrnující jeden případ zubní extrakce u každého pacienta s intravenózní nebo celkovou anestezií na operačním sále. Pět ošetření u čtyř různých pacientů mělo známky klinického zhoršení. Pacienti s nekompletní remisí měli nejnižší poměr zhoršení (0/10, 0,0%), zatímco ti s mírně pokročilou slabostí měli nejvyšší počet nervosvalových problémů, spojených se zubním ošetřením (2/7, 29%). Pacienti s mírně generalizovanou slabostí měli nízký, ale znatelný stupeň svalové slabosti (3/27, 11%). Tyto předběžné nálezy naznačily, že svalová slabost u pacienta s MG, identifikována klinickou klasifikací, se může vázat k risku zhoršení nervosvalové dysfunkce, spojené se zubním vyšetřením. V této retrospektivní studii autoři [20] zjistili, že se spektrum svalové slabosti po zubním ošetření mění od izolované přechodné čelistní slabosti nebo ptózy, nevyžadující žádné ošetření, po kombinované příznaky opožděné slabosti s dysatrií či dysfagii, ptózou, diplopií a slabostí v končetinách, vyžadující ošetření s intravenózním podáním Syntostigminu, event. s další následnou léčebnou intervencí.
Identifikace a zvládnutí myastenické slabosti v zubní ordinaci
Je důležité si uvědomit, že infekce v ústní dutině a psychologický stres z návštěvy zubního lékaře může vést k výraznému zhoršení myastenické slabosti. Krátkodobé ranní prohlídky minimalizují únavu a využívají lepší svalovou sílu v dopoledních hodinách. Prohlídky je nejlépe plánovat přibližně jednu či dvě hodiny po užití inhibitoru cholinesterázy, čímž se využívá maximální účinek léku. Zatímco stabilní pacient s omezeným nebo mírným neuromuskulárním postižením může být bezpečně ošetřen v normální zubní ordinaci, pacienta s častou nebo závažnou orofaryngeální, respirační nebo generalizovanou slabostí je nutné ošetřit na klinickém pracovišti či v zařízeni s možností intubace a zajištěním umělé plicní ventilace [25]. V rámci přípravy na závažný ústní chirurgický zákrok může být u pacienta s častými závažnými myastenickými exacerbacemi nebo krizemi indikována předoperační výměna plazmy. Pokud dojde k náhlému zhoršeni stavu, pacient by měl být vyšetřen svým neurologem k posouzení závažnosti nervosvalového postižení a měla by být podána iv. injekce inhibitoru cholinesterázy s rychlým nástupem účinku (Syntostigmin). V případě, že pacient ani lékař nepozorují žádné zlepšení či dokonce dojde ke zhoršení stavu spolu se sliněním, hleněním apod., měla by být zvážena možnost cholinergní krize v důsledku předávkování inhibitorem cholinesterázy.
Pokud nastane respirační insuficience, musí být urgentně zpřístupněny dýchací cesty a provedena alespoň provizorní mechanická ventilace. Důležitou prevencí aspirace a mechanicke blokády dýchacích cest je odsátí sekretu z oblasti úst a hrtanu. Manuální retrakce oslabeného jazyka zabrání obstrukci dýchacích cest. Urychlená intubace a napojení na umělou plicní ventilací předejde dalším komplikacím [11].
Vyvarování se škodlivé lékové intoleranci
Určité léky ovlivňují nervosvalový přenos, uvolnění acetylcholinu a jeho metabolismus. Pacienti s MG by se jim měli vyhnout, či je užívat se zvýšenou opatrností (tab. 2). Ve stomatologické praxi je nutné se vyvarovat užíváni lokálních anestetik esterového typu, jako např. Prokain (Novokain), protože jsou hydrolizovány cholinesterázami v plazmě. Zredukovaná aktivita cholinesterázy u myastenika, užívajícího inhibitory cholinesterázy, vede ke zvýšenému riziku systémové prokainové toxicity [27]. Široce užívané lokální anestetikum amidoveho typu, jako např. Lidokain (Xylokain) a Mepivakain (carbokain), by se mělo užívat s opatrnosti [13, 27]. Zvýšená opatrnost by se měla věnovat užití vazokonstriktiv. Pro snížení celkové anestetické dávky je výhodné podání 1 : 100 000 epinefrinu v kombinaci s lidokainem při zvýšeném působení anestetika per os. Pečlivě zváženy by měly být intraligamenoární injekce a intrapulpální injekční techniky, pokud si zubní procedura vyžaduje jejich užití. Aminoglykosidy a erytromycin způsobují nervosvalovou blokádu a jsou kontraindikovány, neboť mohou zvýšit myastenicky deficit [13].
Tab. 2. Běžně užívané léky v zubní ordinaci s potenciálními komplikacemi pro pacienty s MG [13, 20]. ![Běžně užívané léky v zubní ordinaci s potenciálními komplikacemi pro pacienty s MG [13, 20].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/7dc9a9b7d39f621a2f2657f9a12e6d51.jpeg)
Monitorováni orálních nežádoucích účinků léků určených k léčbě MG
Cyklosporin, o němž je známé, že způsobuje hyperplazii dásní u některých pacientů, kteří podstupují imunosupresivní terapii, byl také zodpovědný za spuštění fibroplastické reakce u myastenika [23]. Patogeneze lékově navozené hyperplazie dásní je nejistá [26]. Reakce dásně na léky, která se může objevit už v prvním měsíci užívání léku, se zdá být závislá na přítomnosti zubního plaku či ostatních lokálních faktorů zapříčiňujících gingivitidu, individuální genetické vlohy u fibroplastickych faktorů, dále i užité dávky cyklosporinu [5, 26]. Několik v zubní praxi běžně užívaných léků je kontraindikováno u pacientů užívajících cyklosporin. Léky, které se projevují nefrotoxicitou spolu s cyklosporinem, jsou gentamicin,vankomycin, ketoconazol a nesteroidni antirevmatika.
Prednison a azathioprin jsou imunosupresiva, která mohou u pacienta zvýšit náchylnost k orálním infekcím, zejména myotickým, a zkomplikovat hojeni rány [1]. Pečlivě sterilní chirurgické techniky, důkladná observace po výkonu a zvážení antibiotické léčby amoxicilinem či cefalosporiny, je nezbytné. Navíc pacienti odkázaní na dlouhodobé podávání prednisonu mohou mít potlačenu funkci nadledvinek. U těchto nemocných je možné zvážit podání Hydrocortisonu 100–200 mg před komplikovaným a stresujícím zubním ošetřením, jako např. před vícečetnou extrakcí či výkonem v celkové anestezii [1, 18]. Tento postup obvykle není nutný u pacienta s vysokými dávkami prednisonu (více než 30 mg/d), dávkách prednisonu obden, nebo u nekomplikovaných, psychicky nezatěžujících návštěvách u zubního lékaře. Inhibitory acetylcholinesterázy mohou způsobovat nadměrné slinění. Účinné vysokorychlostní odsátí, použití gumové hráze pro obnovující výkony a nepřetržité odčerpáváni slin může zmenšit riziko aspirace přebytkem slin, vody nebo zubního materiálu [32]. U pacientů, kteří podstupují výměnnou plazmaferézu, mohou protokoly výměny plazmy zahrnovat užití antikoagulancií, včetně heparinu. Zubní ošetření pro tyto pacienty by mělo být naplánováno na „nevýměnný” den v návaznosti na léčbu.
Modifikovaná zubní péče přizpůsobená měnící se svalové síle
Zubní hygiena si může vyžádat úpravu životosprávy a návyků u pacienta, u kterého není nemoc plně pod kontrolou. Snaha o zubní hygienu může selhat kvůli slabosti v pletencových svalech a oslabení úchopu ruky. Elektrické kartáčky nebo manuální kartáčky s uzpůsobeným držákem mohou snížit námahu svalů, vyžadovanou pro dosažení efektivní ústní hygieny. Užití ústní opěrky během operativního zubního zákroku může zmírnit svalové napětí a vyčerpanost. Schopnost zvládnout dokončení zubní protézy může být komplikována neschopností ochablých svalů asistovat, udržet mandibulární protézu a zachovat periferní těsnění pro maxilární protézu. Přetížená a převrstvená maxilární protéza se silnými obrubami, které zasahují do svalu a okolního vaziva, může vést ke svalovému vyčerpání a zhoršit slinění. Špatně padnoucí zubní protéza může zhoršit myastenické příznaky, např. potíže se zavíráním úst, únavu svalů jazyka, ztuhlý horní ret, sucho v ústech, zhoršenou fonaci, dysfagii a žvýkací problémy [3]. Protézou způsobené potlačení slinění je nejspíše následkem buď fyzické obstrukce odtokového kanálku, stimulace žvýkacích svalů ke kontrakci nebo interference s normálním vyprazdňováním slinných žláz v souvislosti s oslabením žvýkacích svalů a svalů tváře [3].
Zvládnutí stresu a úzkosti
Snaha o zvládnutí emocionálního stresu je v prevenci myastenické krize důležitá a pro fobického a úzkostlivého pacienta může být potřebná. Měl by být navázán důvěryhodný, podporující vztah k pacientovi a zajištěna efektivní kontrola bolesti [32]. Kysličník dusný nebo oxygenová sedativa mohou pomoci ovládnout strach a zmírnit stres spojený se zubním ošetřením. V našich podmínkách je ověřená medikace Grandaxinem nebo Ataraxem. Pokud je potřeba podání intravenózních sedativ, měly by být podány s podporou kyslíku, za účelem zajištění adekvátní respirační podpory a kontroly dávky léku, z důvodu vyvarováni se respirační krizi [13].
Zubní péče u celkové anestezie
Celková anestezie může být nezbytná v indikaci určitých maxilofaciálních a zubních ošetření. Standardní techniky celkové anestezie obyčejně vyžadují užití nervosvalových blokátorů, jako např. atracurium, pancuronium a succinylcholin, k usnadnění ovládání dýchacích cest a umožnění provedení zákroku na nehybném pacientovi. Standardní anestetika a (pokud je potřeba) uvážlivě titrované nervosvalové blokátory většinou poskytnou bezpečné vedení anestezie s okamžitou extubací u většiny málo rizikových myasteniků [11]. Je li to nezbytné, je prováděna pooperační mechanická ventilace s užitím specializovaných monitorovacích zařízení, která mohou sledovat stav vitálních funkcí, vědomí a hladinu sedativ. V současné době užívaná intravenózní sedativa umožňují titrovat jejich hladinu a docilují rychlý nástup a pokles jejich hladin v případě, že je potřebná extubace [11]. Pokud je k provedení zubního ošetření vyžadována celková anestezie, měla by být zvážena předoperační plazmaferéza, nebo podání vysokých dávek intravenózních imunoglobulinů u rizikových pacientů s bulbárními symptomy, nebo nedostatečnou plicní funkcí [14].
ZÁVĚR
V posledních letech jsme svědky pokroku v léčbě MG se zaváděním moderních imunosupresiv, u refraktorních forem onemocnění dokonce i monoklonálních protilátek. Pacienti s MG však zůstávají specifičtí, vzhledem k jejich reziduálním projevům choroby a riziku exacerbace onemocnění nevhodným terapeutickým a ošetřovatelským přístupem. Znalosti o této chorobě by měly zlepšit systém stomatologické péče o pacienty s MG v našich podmínkách.
MUDr. Jiří Piťha
Neurologická klinika 1. LF UK a VFN
Kateřinská 30
120 00 Praha 2
e-mail: myadisp@seznam.cz
Zdroje
1. Bahn, S. L.: Glucococrticoids in dentistry. J. Am. Dent. Assoc., roč. 105, 1982, č. 3, s. 476-481.
2. Bassler, R.: Histopathology of different types of atrophy of the human tongue. Path. Res. Pract., roč. 182, 1987, č. 1, s. 87-89.
3. Bottomley, W. K., Terezhalmy, G. T.: Mangement of patients with myasthenia gravis who require maxillary dentures. J. J. Prosthget. Dent., roč. 38, 1977, č. 6, s. 609-614.
4. Burch, J., Waren-Gash, C., Ingham, V., Patel, M., Bennett, D., Chaudhuri, K. R.: Myasthenia gravis - a rare presentation with tongue atrophy and fasciculation. Age Ageing, roč. 35, 2006, č. 1, s. 87-88.
5. Butler, R. T., Kalwarf, K. L., Kaldahl, W. B.: Drug-induced gingival hyperplasia: phenytoin, cyclosporine and nifedipine. J. Am. Dent. Assoc., roč. 114, 1987, č. 1, s. 56-60.
6. Calcaterra, T. C., Stern, F., Herman, C. Jr., Mudler, D. G.: The otolarylgologist´s role in myasthenia gravis. Trans. Am. Ac. Optal. Otolaryngol., roč. 72, 1972, č. 2, s. 308-312.
7. Carpanter, R. J., Macdonald, T. J., Howard, F. M. Jr.: The otolaryngoligic presentation of myasthenia gravis. Laryngoscope, roč. 89, 1979, č. 6, s. 992-998.
8. Colton-Hudson, A., Koopman, W. J., Moosa, T., Smith, D., Bach, D., Nicolle, M.: A prospective assessment of the characteristics of dysphagia in myasthenia gravis. Dysphagia, roč. 17, 2002, č. 2, s. 147-151.
9. Davison, S. P., Macdonald, T. J., Wolfe, M. E.: Swollen tongue: a presentation of myasthenia gravis. Otolaryngol Head Neck Surg., roč. 116, 1997, č. 2, s. 224-226.
10. Dhillon, R. S., Brookes, G. B.: Myasthenia gravis in otolaryngologiocal practice. Clin. Otolaryngol Allen. Sci., roč. 9, 1984, č. 1, s. 27-34.
11. Dillon, F. X.: Anesthesia issues in the perioperative management of children with myasthenia gravis. J. Dent. Children, roč. 45, 1978, č. 2, s. 47-50.
12. Farrugia, M. E., Rondon, M. D., Clover, L., Anslow, P., Newsom-Davis, J., Kennett, R., Hilton-Jones, D., Matthews, P. M., Vincent, A.: MRI and clinical studies of facial and bulbar muscle involvement in MuSK antibody-associated myasthenia gravis. Brain, roč. 129, 2006, č. 6, s. 1481-1492.
13. Howard, J. F. Jr.: Adverse drug interactions in disorders of neuromuscular transmission. J. Neurol. Orthop. Med. Surg., roč. 12, 1991, č. 3, s. 26-34.
14. Kernstine, K. H.: Preoperative preparation of the patient with myasthenia gravis. Thorac Surg. Clin., roč. 15, 2005, č. 2, s. 287-296.
15. Klein, K. J., Bromberg, M. B., Feldman, E. L., Simmons, Z.: Dysphagia in elderly men with myasthenia gravis. J. Neurol. Sci., roč. 138, 1996, č. 1-2, s. 49-52.
16. Llabres, M., Molina-Martinez, F. J., Mirrales, F.: Dysphafia at sole manifestation of myasthenia gravis. J. Neurol. Neurosurg. Psychiatry, roč. 79, 2005, č. 9, s. 1297-1300.
17. Mason, D. K.: Oral aspects of myasthenia gravis. Dent. Practic., roč. 15, 1964, č. 2, s. 23-25.
18. Miller, C. S., Little, J. W., Falace, D. A.: Supplemental corticosteroids for dental patients with adrenal insufficiency: reconsideration of the problem. J. Am. Dent. Assoc., roč. 132, 2001, č. 11, s. 1570-1579.
19. Norman, E. L.: Myasthenia gravis: a nursing perspective. J. Neurosci. Nurs, roč. 18, 1986, č. 2, s. 74-80.
20. Patron, L. L., Howarrd, Jr. J. F.: Myasthenia gravis: dental treatment considerations. Spec. Care Dent., roč. 17, 1997, č. 1, s. 25-32.
21. Sanders, D. B., Howard, Jr. J. F., Johns, T. R., Campa, J. F.: High-dose daily prednisone in treatment of myasthenia gravis. In: Plasmapheresis and the Immunobiology of Myasthenia Gravis. Ed Dau PC. Boston, Houghton-Mifflin Publishers, 1979, s. 289-306.
22. Sasakura, Y., Kumasaka, S., Takahashi, T., Shindo, J.:Myasthenia gravis associated with reduced masticatory function. Int. J. Oral. Maxillofac. Surg., roč. 29, 2000, č. 5, s. 381-383.
23. Sabate, N. W., Seymour, G. J., Robinson, M. F.: Cyclosporin-A – inducend gingival enlargement. A case report. J. Periodontol, roč. 58, 1987, č. 7, s. 475-480.
24. Scherer, K., Bedlack, R. S., Simel, D. L.: Does this patient have myasthenia gravis? JAMA, roč. 293, 2005, č. 15, s. 1906-1914.
25. Schneider, P. E.: Dental management of a child with severe myasthenia gravis. Spec. Care Dent., roč. 3, 1993, č. 3, s. 266-270.
26. Seymour, R. A., Thomason, J. M., Ellis, J. S.: The pathogenesis of drug-induced gingival overgrowth. J. Clin. Periodontol, roč. 23, 1996, č. 3, s. 165-175.
27. Shaw, D. H., Cohen, D. M., Hoffman, M.: Dental treatment of patients with myasthenia gravis. J. Oral. Med., roč. 37, 1982, č. 4, s. 118-120.
28. Spicer, G. H.: Dental clues to myasthenia gravis. Dental Survey, roč. 41, 1965, č.4, 56-58.
29. Van der Blit, A., Weijnen, F. G., Bosman, F., van der Glas, H. W., Kuks, J. B. M.: Conroled study od EMG activity of jaw closers and openers masticationin patients with myasthenia gravis. Eur. J. Oral. Sci., roč. 109, 2001, č. 3, s. 60-164.
30. Weijnen, F. G., van der Blit, A., Kuks, J. B., van der Glas, H. W., Oudenaarde, I., Bosman, F.: Masticatory performance in patients with myasthenia gravis. Arch. Oral. Biol, roč. 47, 2002, č. 5, s. 393-398.
31. Weijnen, F. G., van der Blit, A., Sokle, J. H. J., Eassenberg, M. W. M., Oudenaarde, I.: Oral funkcions of patients with myasthenia gravis. Ann. NY Acad. Sci., roč. 41, 1998, č. 5, s. 773-776.
32. Yarom, N., Bornea, E., Nissan, J., Gorsky, M.: Dental management of patients with myasthenia gravis: a literature rewiew. Oral. Surg. Oral. Med. Oral. Pathol. Oral. Radiol. Endod., roč. 100, 2005, č. 2, s. 158-163.
Štítky
Chirurgia maxilofaciálna Ortodoncia Stomatológia
Článok vyšiel v časopiseČeská stomatologie / Praktické zubní lékařství
Najčítanejšie tento týždeň
2010 Číslo 2
-
Všetky články tohto čísla
- Vzpomínáme na MUDr. Karla Veverku
- Následky úrazů dočasných zubů
- Prof. MUDr. Josefa Bohutová, DrSc., zemřela
- Permeabilita kořenového dentinu u stálých zubů
- Stomatologická péče u pacientů s myasthenia gravis
- Ortodontická léčba pacienta s obličejovým rozštěpem (2. část - Kazuistika)
- Kostní piezochirurgie v orální a maxilofaciální oblasti
- Česká stomatologie / Praktické zubní lékařství
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Kostní piezochirurgie v orální a maxilofaciální oblasti
- Následky úrazů dočasných zubů
- Stomatologická péče u pacientů s myasthenia gravis
- Ortodontická léčba pacienta s obličejovým rozštěpem (2. část - Kazuistika)
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



