-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Cytotoxicita keramických materiálů
Cytotoxicity of Ceramic Materials
Paper presents cytotoxicity testing procedure in vitro of preselected dental ceramics. Direct contact test and extract test were monitored. A population of mouse fibroblasts NIH 3T3 was used for both tests. Results show all tested dental ceramics can be considered non-cytotoxic, except the lithium disilicate material.
Key words:
cytotoxicity, dental ceramics
Autoři: L. Vavřičková 1; T. Dostálová 2; J. Ulrichová 3
Působiště autorů: Stomatologická klinika LF UK a FN, Hradec Králové 1; Dětská stomatologická klinika 2. LF UK a FN Motol, Praha 2; Laboratoř buněčných kultur LF UP, Olomouc 3
Vyšlo v časopise: Česká stomatologie / Praktické zubní lékařství, ročník 111, 2011, 2, s. 46-52
Kategorie: Původní práce – experimentální studie
Souhrn
Práce se zabývá testováním cytototoxicity in vitro vybraných vzorků dentálních celokeramických materiálů. Materiály byly podrobeny testu přímého kontaktu a testu extraktu. Testy byly prováděny na populaci buněčné linie myších fibroblastů NIH 3T3 v buněčné kultuře. Z výsledků je patrné, že všechny materiály mohou být považovány za netoxické kromě lithium disilikátové keramiky.
Klíčová slova:
cytotoxicita, keramické dentální materiályÚVOD
Keramické materiály jsou v současné době považovány ve stomatologii za materiál první volby pro kvalitní protetické fixní rekonstrukce chrupu. Nejenže mají dokonalé estetické vlastnosti, ale i jejich vlastnosti mechanické jsou nyní srovnatelné s kovokeramickými náhradami [8, 10]. Mezi jejich další výhody patří i biologická netečnost keramiky. Na rozdíl od kovových náhrad neuvolňují v prostředí ústní dutiny ionty kovů, které mohou pak cytototoxicky [14] nebo alergogenně působit na okolní tkáně. Keramické materiály můžeme rozdělit podle chemického složení nebo podle technologie výroby [15]. Klasifikace keramiky podle chemického složení je pro zhodnocení vlastností materiálu vhodnější. V současné době keramiku dělíme na křemičitou skelnou, oxidovou sklem infiltrovanou a oxidovou či polykrystalickou [7]. Keramika křemičitá vyniká estetickými vlastnostmi, ovšem její vlastnosti mechanické poněkud zaostávají za keramikou oxidovou. Keramika oxidová je dnes v popředí zájmu, zvláště keramika obsahující oxid zirkoničitý. Ten lze stabilizovat přidáním oxidů: CaO, MgO, Y2O3 nebo CeO2. Vzniká slitina, která má tetragonální strukturu i při pokojové teplotě [3, 11]. Tento materiál dobře odolává ohybu a málo mění své vlastnosti vlivem stárnutí [4, 12]. Nejvíce je dnes používán oxid zirkoničitý v podobě 3Y-TZP (yttrium cation-doped tetragonal zirconia polycrystals) s obsahem 3 mol % Y2O3, který slouží jako stabilizátor (např. Cercon®, Noritake atd.) [6] (obr. 1).
Obr. 1. Keramická jádra Procera<sup>®</sup> Al<sub>2</sub>O<sub>3</sub> 
TOXICKÉ A CYTOTOXICKÉ ÚČINKY
Přestože je keramika považována za bioinertní materiál, je však nutné podotknout, že i mezi keramickými materiály existují rozdíly v jejich cytotoxickém působení na buňky gingivy a jiných tkání. Rozdílná cytotoxicita je podmíněná rozdílným chemickým složením jednotlivých materiálů.
Podle Bracketta a kol. [1] není možné považovat lithium disilikátovou keramiku za biologicky inertní. Stejný poznatek uvádějí též Messer a kol. [9]. Dle nich lithium disilikátová keramika, konkrétně Empres II, má horší biologické vlastnosti než většina dentálních slitin a kompozitních materiálů. Ovšem většina keramických materiálů je z hlediska cytotoxicity akceptovatelná stejně dobře jako dentální slitiny nebo kompozitní materiály. Uo a kol. [13] ve své práci publikovali cytotoxické působení některých 3Y-TZP materiálů (oxid zirkoničitý s obsahem 3 mol % Y2O3) na fibroblasty gingivy. Tyto materiály lze považovat za biologicky inertní.
Elshahawy a kol. [5] ve své práci uvádějí téměř nulové cytotoxické působení oxidové keramiky ve srovnání s vysoce ušlechtilými slitinami chromniklovými a slitinami obsahujícími ušlechtilou ocel. Covacci a kol. [2] vyloučili jakékoliv mutagenní a onkogenní účinky 3Y-TZP materiálů na fibroblasty.
CÍL STUDIE
Naším cílem bylo ověřit, zda dochází k cytotoxickému působení námi vybraných keramických materiálů na buněčnou kulturu.
MATERIÁL A METODIKA
Bylo vybráno jedenáct nejvíce používaných druhů keramických materiálů (tab. 1, tab. 2). Z každého druhu keramiky jsme vyrobili přesně definovaná jádra (10 kusů). Jednalo se o horní střední řezák, síla jádra byla 0,4 mm, hmotnost byla 0,22 g. Většina vzorků byla připravena CAD/CAM technologií, resp. technologií (MAD/MAM).
Tab. 1. Testované skelné nebo oxidové infiltrované keramické materiály 
Tab. 2. Testované polykrystalické keramické materiály 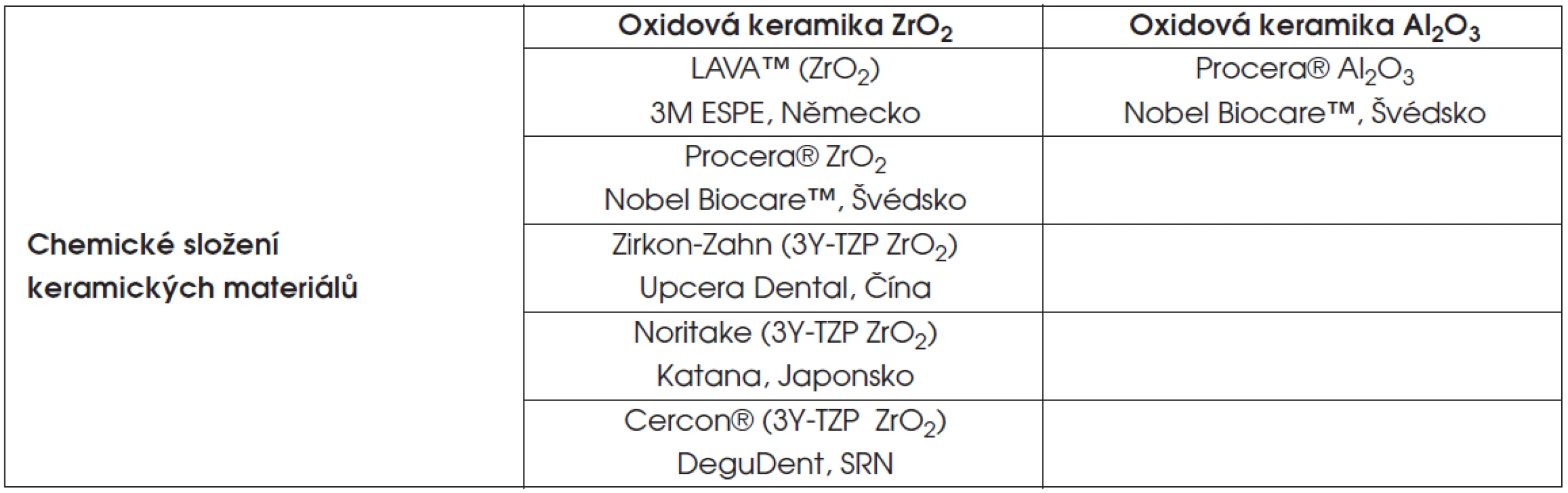
Zkouška sledovala cytotoxické působení pevného vzorku – jádra vybrané dentální keramiky na buněčnou linii myších fibroblastů NIH 3T3 v buněčné kultuře (European Collection of Cell Cultures (ECACC), CAMR, Salisbury, Wiltshire SPG OJG United Kingdom (free from mycoplasma)). Testování cytotoxicity bylo založeno na aplikaci normy ČSN EN ISO 10993 část 5 (1999) – Biologické hodnocení prostředků zdravotnické techniky; dále pak dle ČSN EN ISO 7405 (1998) Stomatologie – Preklinické hodnocení biologické snášenlivosti prostředků zdravotnické techniky používaných ve stomatologii.
Pro zkoušení cytotoxicity in vitro byl sledován test přímého kontaktu a test extraktu.
TEST PŘÍMÉHO KONTAKTU
Princip:
Zdravé buňky NIH 3T3 se v kultuře dělí, množí a adherují k vhodným kultivačním povrchům. Cytotoxická látka narušuje tyto procesy, což vede k poškození buněk, jejich odlučování z kultivačního povrchu a snížení jejich počtu v kultuře. Hodnocení cytotoxicity je při této metodě založeno na vizuálním – makroskopickém sledování inkorporace barviva krystalové violeti do živých buněk a mikroskopickém posouzení změn morfologie buněčné vrstvy (vakuolizace, odlučování buněk, cytolýza). Pokud se cytotoxický materiál uvede do kontaktu s buněčnou vrstvou, vytváří ve svém okolí zónu poškozených buněk, do které se barvivo neinkorporuje. Základem pro určení stupně cytotoxicity jsou šířka zóny – vzdálenost hranice nezbarvené zóny od okraje vzorku, popis změn stavu buněčné vrstvy a numerický odhad podílu poškozených buněk.
Pracovní postup:
Vzorky jsme před zahájením každého testu sterilizovali buď ponořením do 96% ethanolu, nebo v autoklávu po dobu 60 min. a analyzovali je v duplikátech. Test byl třikrát nezávisle opakován. Fibroblasty (7 ml suspenze, 105 buněk/ ml), které byly naneseny na Petriho misky, poté jsme do středu misky umístili sterilizovaný vzorek tak, aby nedošlo k porušení buněčné vrstvy. Po 24 hodinách v inkubátoru jsme kulturu hodnotili pomocí inverzního mikroskopu. Poté jsme vzorky kultury obarvili a změny jsme sledovali opět v inverzním mikroskopu. Pozorování jsme současně vyfotografovali.
Hodnocení:
- Plochu misky jsme dle šablony rozdělili na čtyři kvadranty.
- Posuvným měřidlem bylo možné změřit vzdálenost hranice živých obarvených buněk od okraje testovaného vzorku.
- S použitím inverzního mikroskopu při zvětšení 200x jsme posuzovali stav buněčné vrstvy (tab. 3).
Tab. 3. Hodnocení cytotoxicity vzorku v testu přímého kontaktu 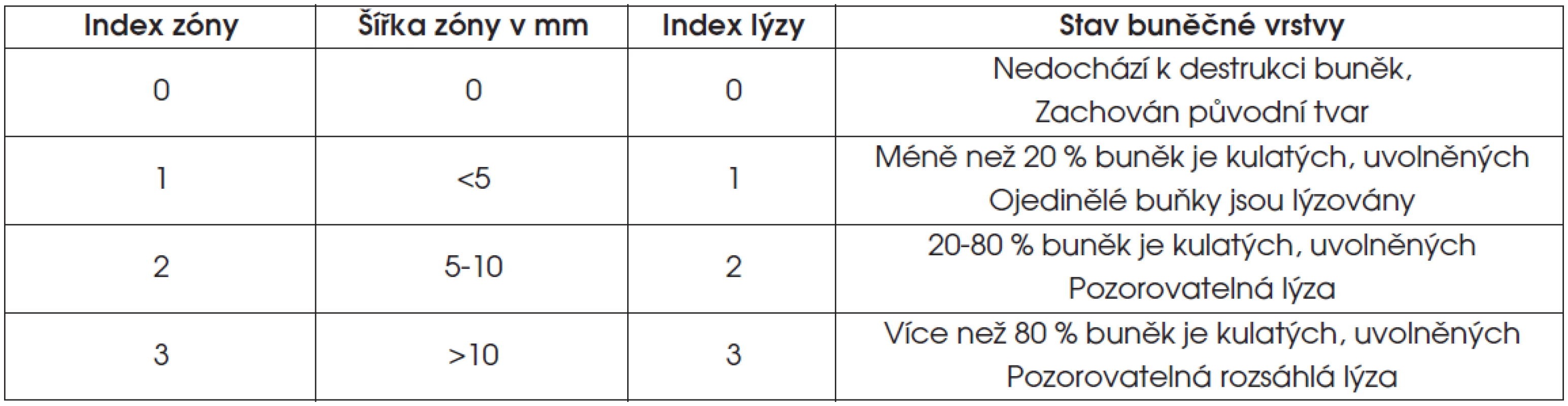
Hodnocení stupně cytotoxicity:
Cytotoxicita vzorku je charakterizována poměrem Index zóny/Index lýzy (tab. 4).
Tab. 4. Hodnocení stupně cytotoxicity vzorku v testu přímého kontaktu 
TEST EXTRAKTU
Princip:
K přesnému zjištění množství živých buněk v kultuře se používá fotometrická metoda – MTT test. Tento test je založen na schopnosti živých buněk redukovat tetrazoliové soli na barevné formazanové produkty. Množství vytvořeného barviva, stanovené fotometricky při vlnové délce 540 nm a vyjádřené absorbancí, je přímo úměrné metabolické aktivitě a počtu buněk v analyzovaném vzorku. Stupeň cytotoxicity je vyhodnocen na základě životnosti buněk, která je vyjadřována v % absorbance naměřené v kultuře v přítomnosti testované látky, vůči kontrolní kultuře bez daného vzorku.
Pracovní postup:
Vzorky jsme před zahájením každého testu sterilizovali buď ponořením do 96% ethanolu nebo v autoklávu po dobu 60 min. a analyzovali je opět v duplikátech. Extrakt jsme připravili v poměru 0,1 g vzorku na 1 ml extrakčního činidla. Extrakce probíhala za aseptických podmínek v kultivační láhvi v inkubátoru. Po ukončení extrakce byl extrakt pipetou přenesen do sterilní centrifugační zkumavky a centrigugován. Poté jsme testování cytotoxicity prováděli pro extrakt neředěný – 100% a při ředění 1 : 1 a 1 : 3. Test byl prováděn minimálně ve dvou nezávislých opakovacích cyklech.
Výpočet životnosti kultury:
Životnost kultury se stanovila výpočtem z průměru hodnot absorbance nalezených pro vzorek a pro kulturu buněk (kultura v nepřítomnosti vzorku):
Hodnocení stupně cytotoxicity ukazuje tabulka 5.
Tab. 5. Hodnocení stupně cytotoxicity vzorku v testu extraktu 
Výsledky:
Test přímého kontaktu byl ve všech případech negativní. Na obrázku 2 je zachycen mikroskopický obraz kultury fibroblastů při testování s keramickým materiálem LAVA™.
Obr. 2. Test přímého kontaktu - LAVA<sup>TM</sup> 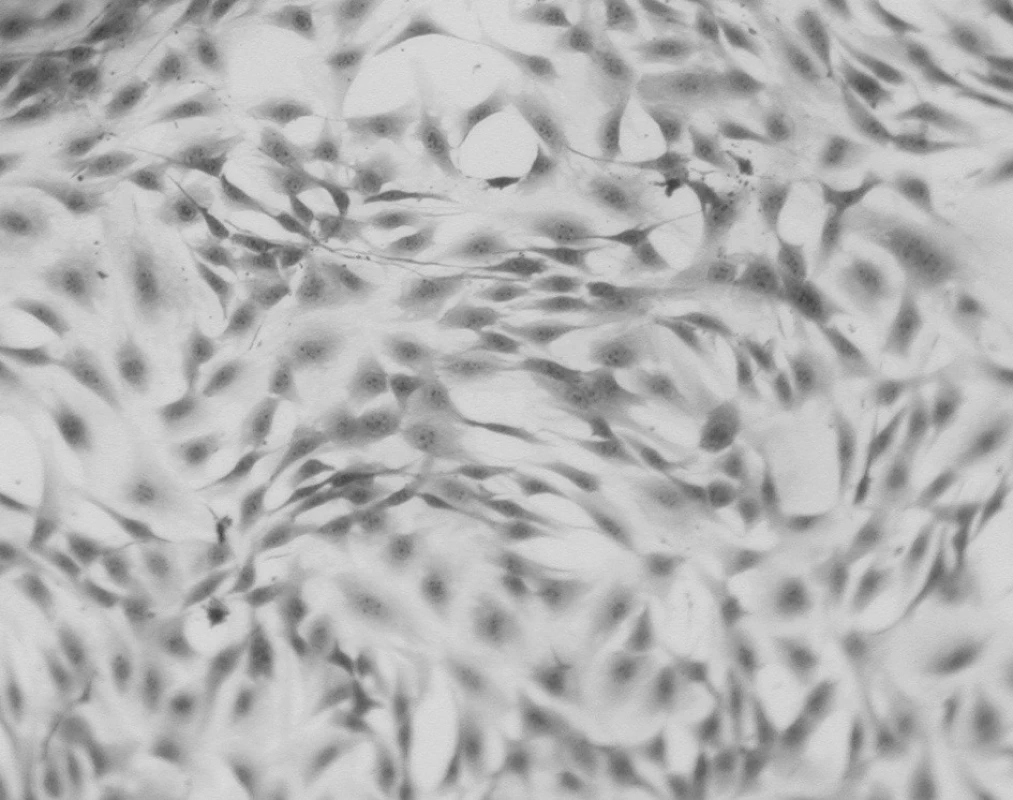
Životnost buněk v testu extraktu ukazují tabulky 6 a 7 a graf 1.
Tab. 6. Výsledky testu extraktu skelné nebo oxidové infiltrované keramiky 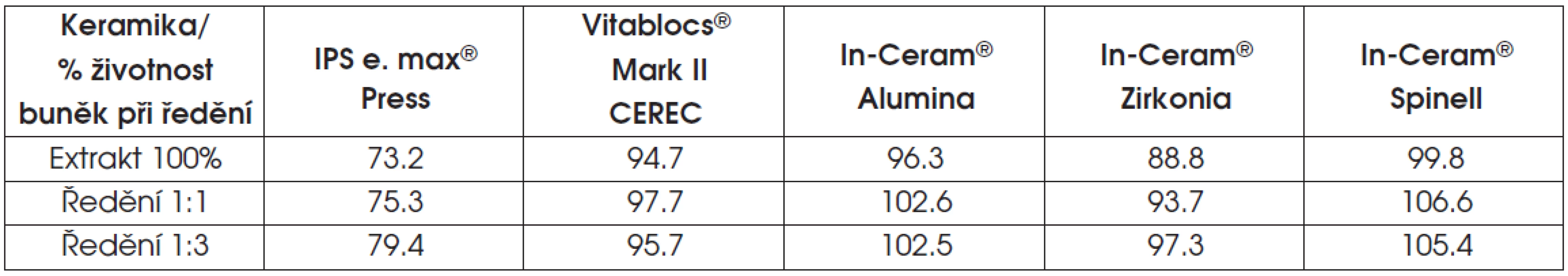
Tab. 7. Výsledky testu extraktu polykrystalické keramiky 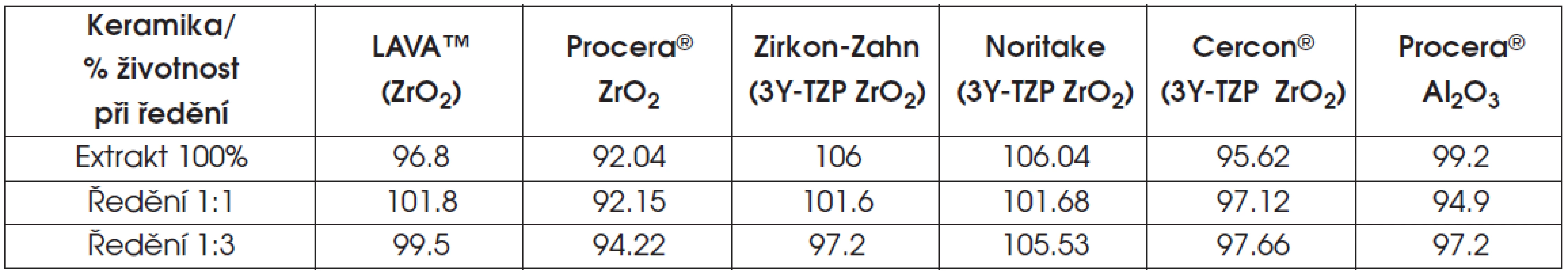
Graf 1. Životnost buněk v testu extraktu 
V případě lithium disilikátové keramiky a v několika případech u oxidové keramiky infiltrované sklem (ZrO2), klesla v testu extraktu životnost pod osmdesát procent.
V průběhu testování došlo u některých vzorků ke změně barvy.
DISKUSE
Výsledky ukazují, že všechny testované dentální materiály je možné považovat v testu přímého kontaktu za netoxické, s nulovým výsledkem cytotoxicity a Indexem zóny/ Indexu lýzy 0/0. V testu extraktu je stupeň cytotoxicity různý. Lithium disilikátová keramika IPS e. max® Press se jevila jako lehce toxická. Výsledky této studie jsou podpořeny i výsledky výzkumu zahraničních autorů [1, 9], z nichž plyne, že lithium disilikátovou keramiku není možné považovat za biologicky inertní. Cytotoxicita této keramiky byla dokonce větší než cytotoxicita chromniklových slitin testovaných v předchozí studii [14]. U dvou vzorků keramiky In-Ceram® Zirconia byla životnost buněk nižší než 80 %. Při statistické analýze všech testovaných vzorků této keramiky je však životnost buněk celkově vyšší než 80 %.
U keramiky LAVA™, IPS e. max® Press, In-Ceram® Alumina, In-Ceram® Zirconia a Cerec® došlo při testování u všech vzorků ke změně odstínu testovaného jádra, přičemž nejvýraznější změna byla u keramiky In-Ceram® Zirkonia (obr. 3, obr. 4, obr. 5).
Obr. 3. Povrch keramického jádra Cercon<sup>®</sup> 
Obr. 4. Povrch keramického jádra IPS e. max<sup>®</sup> Press 
Obr. 5. Povrch keramického jádra In-Ceram<sup>®</sup> Alumina 
Závěr
Všechny námi testované dentální materiály lze považovat za netoxické v testu přímého kontaktu. V testu extraktu se keramika lithium disilikátová - IPS e. max® Press jevila jako lehce cytotoxická a za určitých podmínek i keramika In-Ceram® Zirconia. V některých případech došlo při testu extraktu ke změně barvy jádra (vznik tmavšího odstínu), nejvíce u keramiky In-Ceram® Zirconia.
Studie byla podporována projektem GAUK č. 81508 a projektem IGA MZČR 9744-3.
MUDr. Lenka Vavřičková
Stomatologická klinika LF UK a FN
Sokolská 581
500 05 Hradec Králové
e-mail: vavrickova.l@seznam.cz
Zdroje
1. Brackett, M. G., Lockwood, P. E. et al.: In vitro cytotoxicity response to lithium disilicate dental ceramics. Dent. Mater., 24, 2008, 4, s. 450-456.
2. Covacci, V., Bruzzese, N. et al.: In vitro evaluation of mutagenic and cancerogenic power of high purity zirconia ceramic. Biomaterials, 20, 1999, 4, s. 371-376.
3. Denry, I, Kelly, J. R.: State of the art of zirconia for dental applications. Dent. Mater., 24, 2008, s. 299-307.
4. Deville, S., Chevalier, J., Gremillard, L.: Influence of surface finish and residual stresses on the ageing sensitivity of biomedical grade zirconia. Biomaterials, 27, 2006, s. 2186-2192.
5. Elshahawy, W. M., Watanabe, I. a kol.: In vitro cytotoxicity evaluation of elemental ions released from different prosthodontic materials. Dent. Mater., 25, 2009, 12, s. 1551-1555.
6. Garvie, R. C., Nicholson, P. S.: Phase analysis in zirconia systems. J. Am. Ceram. Soc., 55, 1972, s. 303-305.
7. Hammerle, Ch., Sailer, I. et al: Dental ceramics. Quintessence Publishing, ISBN 987-1-85097-181-8.
8. Chong, K. H., Chai, J., Takahashi, Y., Wozniak, W.: Flexural strength of In-Ceram alumina and In-Ceram zirconia core materials. Int. J. Prosthodont, 15, 2002, s. 183-188.
9. Messer, R. L., Lockwood, P. E. et al.: In vitro cytotoxicity of traditional versus contemporary dental ceramics. J. Prosthet. Dent., 90, 2003, 5, s. 452-458.
10. Ryge, G., Cvar, J. F.: Criteria for clinical evaluation of dental restorative materials. US Dental health Center, Publication No.7902244, San Francisco, USA.
11. Sato, T., Ohtaki, S., Shimada, M.: Transformation of yttria-partially-stabilized zirconia by low-temperature annealing in air. J. Mater. Sci., 20, 1985, s. 1466-470.
12. Sato, T., Shimada, M.: Crystalline phase-change in yttria-partially-stabilized zirconia by low-temperature annealing. J. Am. Ceram Soc., 67, 1984, s. 212-213.
13. Uo, M., Sjogren, G. et al.: Cytotoxicity and boxing property of dental ceramics. Dent. Mater., 19, 2003, 6, s. 487-492.
14. Vavřičková, L., Dostálová, T., Vahalová, D., Šrámková, J., Ulrichová, J.: Cytotoxicita dentálních slitin, Čes. Stomat., 107, 2007, 6, s. 138-143.
15. Vavřičková, L., Pilathadka, S., Dostálová, T.: Celokeramické systémy v klinické praxi. LKS., 18, 2008, 10 (Suppl.), s. A5-A11.
Štítky
Chirurgia maxilofaciálna Ortodoncia Stomatológia
Článok vyšiel v časopiseČeská stomatologie / Praktické zubní lékařství
Najčítanejšie tento týždeň
2011 Číslo 2
-
Všetky články tohto čísla
- Gutaperča v zubnom lekárstve
- Výskyt Angleových tříd u pacientů s poruchou prořezávání horního stálého špičáku
- Halitóza - současný pohled na etiologii, diagnózu a léčbu
- OMLUVA
- Maligní lymfomy nehodgkinova typu v dokumentaci Stomatologické kliniky v Hradci Králové 1998–2008
- Cytotoxicita keramických materiálů
- Česká stomatologie / Praktické zubní lékařství
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Halitóza - současný pohled na etiologii, diagnózu a léčbu
- Gutaperča v zubnom lekárstve
- Maligní lymfomy nehodgkinova typu v dokumentaci Stomatologické kliniky v Hradci Králové 1998–2008
- Cytotoxicita keramických materiálů
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




