-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vliv kyseliny hyaluronové o nízké, střední a vysoké molekulární hmotnosti na lidské kmenové buňky zubní dřeně
EFFECT OF LOW, MEDIUM AND HIGH MOLECULAR WEIGHT HYALURONIC ACID ON HUMAN DENTAL PULP STEM CELLS
Introduction: Dental pulp stem cells (DPSCs) express naturally high positivity for surface receptor glycoprotein CD 44 which is involved in the induction of odontoblast mineralization with hyaluronic acid (HA) being its major ligand. The aim of this experiment was to assess the effect of HA in low (LMW-HA), medium (MMW-HA) and high (HMW-HA) molecular weights on the phenotypic profile, proliferation activity and differentiation potential of human DPSCs.
Methods: The experiment was conducted in vitro on two lines of human DPSCs from different donors (third molar – male, 25 years and first premolar – male, 9 years). These lines were cultured in standard medium and from the second passage also in three experimental culture media containing 0.1% HA in three molecular weights: LMW-HA (116 kDa), MMW-HA (540 kDa) and HMW-HA (1500 kDa). The phenotypic analysis was performed in the seventh passage using a Vi-Cell XR flow cytometer, viability was evaluated by the Vi-Cell Analyzer in the seventh passage and proliferation activity measured by the Z2 Counter Analyzer in every passage. Osteo - and chondro - differentiation were inducted by commercially supplied cultivation media and demonstrated by histological staining with alcian blue and alizarin red.
Results: DPSCs used in our experiment expressed phenotype typical for human DPSCs (high positivity for CD 13, CD 29, CD 44, CD 90 and OCT 3/4), they were able to exceed Hayflick limit and differentiate in the osteogenic as well as the chondrogenic extracellular matrix. During the experiment, DPSCs line 1 cultivated in control medium / medium 1 (116 kDa HA) / medium 2 (540 kDa HA) / medium 3 (1500 kDa HA) achieved in this order in total 14.1/15.3/15.4/14.8 population doublings. The median of doubling time with the minimal and maximal values in the same order was 31.6 (29.2; 36.8) / 29.6 (28.5; 30.6) / 30.3 (26.7; 31.3) / 30.5 (29.7; 33.8) hours. The viability of the DPSCs obtained from the seventh passage was in the same order 92.3/93.1/91.8/92.6%. DPSC line 2 cultivated in control medium / medium 1 (116 kDa HA) / medium 2 (540 kDa HA) / medium 3 (1500 kDa HA) achieved in this order in total 16.7/17.2/16.7/16.8 population doublings. The median of doubling time with the minimal and maximal values in the same order was 28.9 (24.5; 35.2) / 27.4 (24.5; 32.6) / 28.3 (24.0; 38.4) / 27.1 (25.3; 33.9) hours. The viability of the DPSCs obtained from the seventh passage was in the same order 80.1/82.5/81.8/80.9%.
Conclusion: We verified that DPSCs in the presence of hyaluronic acid at a concentration of 0.1% and molecular weights of 116, 540 and 1500 kDa survive, proliferate and maintain the ability to differentiate in mature cellular elements. We also verified the original assumption that the low molecular weight form of hyaluronic acid has a different impact on the DPSCs‘ phenotype than the high molecular weight form of hyaluronic acid.
Keywords:
Stem cells – dental pulp – hyaluronic acid – scaffold
Autori: J. Schmidt 1; N. Pilbauerová 1; T. Soukup 2; J. Suchánek 1
Pôsobisko autorov: Stomatologická klinika, Lékařská fakulta Univerzity Karlovy a Fakultní nemocnice, Hradec Králové 1; Ústav histologie a embryologie, Lékařská fakulta Univerzity Karlovy, Hradec Králové 2
Vyšlo v časopise: Česká stomatologie / Praktické zubní lékařství, ročník 120, 2020, 3, s. 67-77
Kategória: Původní práce
Súhrn
Úvod a cíl práce: Kmenové buňky zubní dřeně (KBZD) vykazují přirozeně vysokou pozitivitu na povrchový receptor glykoprotein CD44 podílející se mimo jiné na indukci mineralizace odontoblastů, přičemž kyselina hyaluronová (KH) je jeho hlavní ligandou. Cílem experimentu bylo posoudit vliv KH o nízké (NMH-KH), střední (SHM-KH) a vysoké (VMH-KH) molekulární hmotnosti na fenotypový profil, proliferační aktivitu a diferenciační potenciál lidských KBZD.
Metodika: Experiment byl proveden v in vitro podmínkách na dvou liniích lidských KBZD odlišných dárců (třetí molár – muž, 25 let, a první premolár – muž, 9 let). Tyto linie byly kultivovány ve standardním médiu a od druhé pasáže také ve třech experimentálních kultivačních médiích obsahujících 0,1 % kyseliny hyaluronové (KH) ve třech molekulárních hmotnostech: NMH-KH (116 kDa), SHM-KH (540 kDa) a VHM-KH (1500 kDa). Analýza fenotypu byla provedena v sedmé pasáži pomocí průtokového cytometru Vi-Cell XR, viabilita byla měřena analyzátorem Vi-Cell v sedmé pasáži a počet buněk analyzátorem Z2 Coulter ve všech pasážích. Osteodiferenciace a chondrodiferenciace byly indukovány komerčně dodávanými diferenciačními médii a prokazovány histologickým barvením s alciánovou modří a alizarinovou červení.
Výsledky: Linie KBZD využité v našem experimentu vykazovaly fenotyp typický pro lidské KBZD (vysoká pozitivita pro CD 13, CD 29, CD 44, CD 90 a OCT3/4), byly schopny překročit Hayflickův limit a diferencovat v buňky produkující osteogenní a chondrogenní extracelulární matrix. Během experimentu dosáhly KBZD linie 1 kultivované v kontrolním médiu / médiu 1 (116 kDa KH) / médiu 2 (540 kDa KH) / médiu 3 (1500 kDa KH) v tomto pořadí celkem 14,1 / 15,3 / 15,4 / 14,8 populačních zdvojení. Medián doubling time s minimální a maximální hodnotou ve stejném pořadí byl 31,6 (29,2; 36,8) / 29,6 (28,5; 30,6) / 30,3 (26,7; 31,3) / 30,5 (29,7; 33,8) hodin. Viabilita KBZD získaných ze sedmé pasáže byla ve stejném pořadí 92,3 / 93,1 / 91,8 / 92,6 %. KBZD linie 2 kultivované v kontrolním médiu / médiu 1 (116 kDa KH) / médiu 2 (540 kDa KH) / médiu 3 (1500 kDa KH) dosáhly v tomto pořadí celkem 16,7 / 17,2 / 16,7 / 16,8 populačních zdvojení. Medián doubling time s minimální a maximální hodnotou ve stejném pořadí byl 28,9 (24,5; 35,2) / 27,4 (24,5; 32,6) / 28,3 (24,0; 38,4) / 27,1 (25,3; 33,9) hodin. Viabilita KBZD získaných ze sedmé pasáže byla ve stejném pořadí 80,1 / 82,5 / 81,8 / 80,9 %.
Závěr: Ověřili jsme, že KBZD v přítomnosti kyseliny hyaluronové o molekulárních hmotnostech 116, 540 a 1500 kDa v koncentraci 0,1 % přežívají, proliferují a udržují si schopnost diferencovat ve zralé buněčné elementy. Dále jsme ověřili původní předpoklad, že nízkomolekulární forma kyseliny hyaluronové bude mít rozdílný dopad na fenotyp KBZD než forma vysokomolekulární.
Klíčová slova:
kmenové buňky – zubní dřeň – kyselina hyaluronová – scaffold
ÚVOD
Kmenové buňky (KB) jsou eukaryotní buňky, které se vyznačují dvěma specifickými vlastnostmi. Jsou nadány vysokou schopností proliferace umožňující překročení Hayflickova limitu a zároveň mohou diferencovat ve zralé buněčné linie. Jako totipotentní označujeme KB, které mohou bez omezení diferencovat na jakýkoliv jiný typ buněk embryonálních i extraembryonálních tkání. Řadíme sem zygotu a první generaci KB z ní odvozenou. Dále rozeznáváme pluripotentní KB, které mohou diferencovat do buněk všech tří zárodečných listů – entoderm, ektoderm a mezoderm – čili do jakékoliv tkáně mnohobuněčného organismu. Poslední linií KB jsou multipotentní KB, které mohou produkovat pouze buňky odvozené ze zárodečného listu, z jehož tkání jsou samy izolovány. Během života organismu zajišťují KB vývoj orgánů příslušného zárodečného listu, jeho buněčnou obnovu, a udržují tak tkáňovou homeostázu. KB dále dělíme na embryonální kmenové buňky (EKB) a adultní kmenové buňky (AKB). EKB jsou pluripotentní kmenové buňky s širokým diferenciačním potenciálem. Jsou ale získávány z embrya v období blastocysty a jejich odběr je tak spojen s etickými problémy (zánik embrya, definice života aj.), což limituje jejich využití. AKB jsou multipotentní kmenové buňky, jejichž diferenciace je omezena příslušností k jednomu ze tří zárodečných listů. Izolace AKB probíhá postnatálně a jejich využití není spojeno s tolika etickými otázkami.
Kmenové buňky zubní dřeně (KBZD) patří mezi adultní kmenové buňky, které mají schopnost diferencovat ve zralé mezenchymální a neuroektodermální buněčné typy. Jsou odebírány ze zubní dřeně stálých zubů a výhodou oproti jiným zdrojům KB v lidském těle je tak jejich relativně snadná dostupnost. KBZD je možné získávat z extrahovaných zubů, nejčastěji třetích dolních molárů, v rámci plánovaného léčebného zákroku. Tyto zuby jsou po extrakci považovány za biologický odpad a likvidovány. Izolace zubní dřeně tak nepředstavuje pro pacienta žádný zákrok nad rámec běžného ošetření, který by byl proveden pouze za účelem izolace buněk.
Kyselina hyaluronová (KH) je glykosaminoglykan složený z disacharidových jednotek obsahujících kyselinu D-glukuronovou a N-acetylglukosamin. Tento biopolymer je jednou z hlavních složek extracelulární matrix a je hojně zastoupen ve většině pojivových tkání. Nejvyšších koncentrací dosahuje v synoviální tekutině, kůži, pupečníkové šňůře či očním sklivci. Dále je významnou složkou extracelulární matrix zubní dřeně, a tudíž i přirozeným prostředím pro KBZD [1].
Za běžných podmínek se KH v těle vyskytuje ve své vysokomolekulární formě (VMH-KH). VMH-KH se podílí díky svým hygroskopickým vlastnostem na hydrataci, lubrikaci a udržování osmotické rovnováhy tkání, redukuje aktivitu a produkci prozánětlivých mediátorů a metaloproteináz, inhibuje angiogenezi, snižuje výskyt volných kyslíkových radikálů a inhibuje schopnost makrofágů fagocytovat [2, 3, 4, 5]. Nitrokloubní aplikace exogenní VMH-KH stimuluje synovialocyty k vyšší produkci endogenní VMH-KH, stimuluje proliferaci chondrocytů a inhibuje degradaci kloubní chrupavky [6]. Při reparaci tkání brání KH ukládání kolagenu, a tím napomáhá bezjizevnatému hojení [7]. Při zánětu dochází ke štěpení VMH-KH na středně dlouhé (SMH-KH) a krátké (NMH-KH) fragmenty. Tyto fragmenty vykazují odlišnou biologickou aktivitu než VMH-KH. Jejich přítomnost zvyšuje imunitní odpověď a produkci prozánětlivých cytokinů a růstových faktorů [8]. Zvýšená přítomnost NMH-KH byla pozorována v postižených tkáních, např. při revmatoidní artritidě a mnoha neinfekčních onemocněních plic (sarkoidóza, plicní fibróza, astma, plicní hypertenze, CHOPN) [9, 10]. NMH-KH může indukovat progresi některých tumorů [11–13]. NMH-KH je také schopna indukovat angiogenezi [14, 15]. Mezi receptory KH patří povrchový znak 44 (CD 44), což je transmembránový glykoprotein přítomný ve většině lidských buněk a ovlivňující jejich migraci, uptake a degradaci KH, adhezi, orientaci, aktivaci a homing lymfocytů. V posledních letech se výzkum zaměřuje na přítomnost tohoto povrchového znaku u buněk tumorů a metastáz, kde by KH mohla být díky vazbě KH-CD44 využita v rámci tzv. targeted drug delivery (cílená distribuce léčiva) [16].
Důsledky vazby KH na CD 44 se však liší v závislosti na molekulární hmotnosti KH. Tento jev byl popsán např. u fibroblastů, které reagují při navázání VMH-KH na jejich CD 44 zvýšenou diferenciací, naopak při vazbě NMH-HA dochází k inhibici diferenciace [17]. U makrofágů vazba NMH-KH-CD 44 indukuje jejich klasickou aktivaci a expresi prozánětlivých genů, při vazbě VMH-KH dochází naopak k aktivaci alternativní cestou a indukci reparativních procesů [18]. CD 44 je hojně exprimován také na povrchu KBZD. Doposud publikovaná data naznačují vliv VMH-KH na diferenciaci KBZD v odontoblasty, avšak neexistují další studie, které by tyto informace potvrdily [19]. Zároveň neexistují studie, které by se věnovaly vlivu různých molekulárních hmotností kyseliny hyaluronové na KBZD.
Vzhledem k relativně snadné dostupnosti, diferenciačnímu potenciálu a vysoké proliferační aktivitě se KBZD dostávají do popředí zájmu výzkumu kmenových buněk, tkáňového inženýrství a regenerativní medicíny. K takové aplikaci je však buňky nutné na místo použití přenést a na místě je udržet. Využitím vhodného materiálu utvářejícího trojrozměrnou strukturu získáme nosič, tzv. scaffold, který umožňuje aplikaci a udržení buněk na předem určeném místě. Scaffoldy jsou tedy dočasné podpůrné struktury pro růst buněk a tkání [20]. Jedním z potenciálních materiálů pro tvorbu scaffoldů je kyselina hyaluronová (KH). Jako látka tělu vlastní má KH pro implantaci do organismu výhodné vlastnosti, neboť je biokompatibilní, biodegradabilní, resorbovatelná a je přirozenou součástí extracelulární matrix. Technologické zpracování KH umožňuje její produkci ve formě prášku či tvarově libovolných porézních i monolitických struktur a její funkční skupiny (karboxylové kyseliny a alkoholy) mohou být využity k síťování do podoby hydrogelu [20]. Mezi hlavní nevýhody nemodifikované KH patří rychlost její degradace, a tedy i horší mechanické a bariérové vlastnosti in vivo; tento nedostatek je ale možno kompenzovat dalšími biochemickými úpravami [21, 22].
Scaffold jako dočasná podpůrná struktura buněk je při in vivo použití postupně degradován. Degradace KH probíhá za postupného štěpení vysokomolekulárních řetězců na řetězce střední až nízké molekulární hmotnosti. Vzhledem k odlišným signálním vlastnostem různých molekulárních hmotností KH je proto důležité znát vliv různě dlouhých řetězců KH na buňky, pro které je budoucí využití scaffoldu z KH zamýšleno.
Cílem experimentu bylo posoudit in vitro vliv KH o nízké, střední a vysoké molekulární hmotnosti na základní biologické vlastnosti lidských KBZD (proliferační aktivita, viabilita, fenotypový profil, jejich schopnost diferencovat v buňky produkující kostní a chrupavčitou extracelulární matrix).
MATERIÁL A METODY
Protokol izolace a metodika experimentu byly schváleny Etickou komisí Fakultní nemocnice Hradec Králové (souhlasy č. j. 200612 S0lP, 201011 S14P, 201812 S07P). Dárci zubů či jejich zákonní zástupci byli před samotnou extrakcí informováni o povaze experimentu a podepsali informovaný souhlas s využitím KBZD pro výzkumné účely.
Extrakce zubů dvou dárců (linie 1: třetí molár – muž, 25 let, linie 2: první premolár – muž, devět let) proběhla za standardních podmínek v lokální anestezii. Extrahované zuby byly ošetřeny dezinfekčním roztokem a transportovány v Hankově balancovaném solném roztoku (HBSS, Invitrogen, USA) do laboratoře tkáňových kultur. Zubní dřeň byla izolována za sterilních podmínek v laminárním boxu. Korunková část byla od kořenů oddělena Luerovými kleštěmi a zubní dřeň vyjmuta ostrým exkavátorem. Ta byla následně kompletně rozrušena působením enzymů kolagenáza typ I (3 mg/ml, Sevapharma, ČR) a dispáza (4 mg/ml, Invitrogen, USA) po dobu 50 minut, centrifugována na 600 g (2000 rpm) po dobu pěti minut.
KBZD byly kultivovány v atmosféře s 5 % CO2 za teploty 37 °C. Po 24 hodinách od izolace bylo z kultivační nádoby odstraněno kultivační médium a za užití PBS vymyty zbytky tkání zubní dřeně a neadherující buňky (erytrocyty, fibroblasty, zbytky cév). Následně byly pozorovány jednotlivé buňky či kolonie KBZD. Všechny buňky byly kultivovány do druhé pasáže v totožném médiu. Toto médium sestávalo z alfa-MEM (Gibco, UK), 2% fetálního telecího séra (FCS) (PAA, USA), 10 ng/ml EGF (PeproTech, USA), 10 ng/ml PDGF (PeproTech, USA), 0,2 mM L-askorbové kyseliny (Sigma, USA), 2 % glutaminu (Gibco, UK), 100 U/ml penicilinu (Gibco, UK), 100 µg/ml streptomycinu (Gibco, UK), 20 µg/ml gentamicinu (Gibco, UK) a 50 mM dexametazonu (Sigma, USA) podle standardního protokolu naší laboratoře [23]. Po sedmi dnech kultivace byly KB z povrchu kultivační nádoby uvolněny pomocí 0,05 % trypsin-EDTA (Gibco, UK) a nasazeny do nové kultivační nádoby. Každá další pasáž proběhla po dosažení 70 % konfluence. Část KBZD získaná z druhé pasáže byla kryokonzervována a zbylá část byla využita k prokázání vlastností typických pro KB (dosažení Hayflickova limitu, ověření schopnosti diferenciace a vyšetření fenotypu). Po jejich ověření byly KB rozmrazeny a všechny následující experimenty probíhaly dvojitě k ověření reprodukovatelnosti. KBZD obou linií byly rozděleny a kultivovány ve třech testovaných médiích a jako negativní kontrola byla užita kultivace ve standardním kultivačním médiu. Testovaná média se skládala ze standardního kultivačního média obohaceného o 0,1 % rozpuštěné KH (Contipro, a.s., ČR) o molekulové hmotnosti: médium 1 : 116 kDa, médium 2 : 540 kDa, médium 3 : 1500 kDa. Buněčná viabilita a počet populačních zdvojení byly měřeny za užití Vi-Cell analyzer (Beckman Coulter, USA) a Z2 Coulter (Beckman Coulter, USA). Pro analýzu fenotypu byly využity KBZD získané ze sedmé pasáže (kultivované pět pasáží v médiu s KH), pozitivita znaků CD29 (BD Biosciences Pharmingen, Belgium), CD34 (Dako, Denmark), CD44 (BD Biosciences Pharmingen, Belgium), CD45 (Dako, Denmark), CD71 (Dako, Denmark), CD90 (BD Biosciences Pharmingen, Belgium), HLA I (Dako, Denmark), HLA II (Dako, Denmark) byla měřena průtokovým cytometrem Cell Lab Quanta (Beckman Coulter, USA). Viabilita byla hodnocena pomocí Vi-Cell analyzer (Beckman Coulter, USA) podle protokolu dodavatele.
Pro průkaz schopnosti KBZD kultivovaných v médiu s KH diferencovat ve zralé buněčné linie byla zvolena diferenciace v kostní a chrupavčitou tkáň. Za účelem chondrogenní diferenciace byly KBZD kultivovány po 21 dní v médiu v tomto složení: alfa-MEM (Gibco, UK), kyselina askorbová 1 % (Sigma, USA), dexametazon 0,02 % (Sigma, USA), penicilin/streptomycin 1,2 % (Gibco, UK), glutamin 1,9 % (Gibco, UK), 50 ng/ml TGF-β1 (R&D Systems, Minneapolis, MN, USA). Následně byly buňky a extracelulární matrix fixovány 4% paraformaldehydem, zality do parafínu a pro prokázání kyselých mukopolysacharidů, které se hojně vyskytují v chondrogenní matrix, obarveny alcianovou modří pro histologické vyšetření.
Za účelem osteogenní diferenciace byly KBZD kultivovány po 21 dní v kultivačním médiu složeném z alfa-MEM (Gibco, UK), FCS 19 % (PAA, USA), kyseliny askorbové 1 % (Sigma, USA), Beta glycerolfosfátu 2 % (Sigma, USA), glutaminu 1,9 % (Gibco, UK), penicilinu/streptomycinu 1,2 % (Gibco, UK), dexametazonu 37 µl/l (Sigma, USA). Následně byly buňky a vyprodukovaná extracelulární matrix fixovány 4% paraformaldehydem, zality do parafínu a pro demonstraci přítomnosti osteogenní matrix a kalciových depozit obarveny aliziarinovou červení pro histologické vyšetření.
VÝSLEDKY
Během experimentu dosáhly KBZD linie 1 kultivované v kontrolním médiu / médiu 1 / médiu 2 / médiu 3 v tomto pořadí celkem 14,1 / 15,3 / 15,4 / 14,8 populačních zdvojení (graf 1). Medián doubling time s minimální a maximální hodnotou ve stejném pořadí byl 31,6 (29,2; 36,8) / 29,6 (28,5; 30,6) / 30,3 (26,7; 31,3) / 30,5 (29,7; 33,8) hodin. průběžné hodnoty jsou uvedeny v grafu 2. Viabilita KBZD získaných ze sedmé pasáže byla ve stejném pořadí 92,3 / 93,1 / 91,8 / 92,6 %. KBZD linie 2 kultivované v kontrolním médiu / médiu 1 / médiu 2 / médiu 3 v tomto pořadí celkem 16,7 / 17,2 / 16,7 / 16,8 populačních zdvojení (graf 3). Medián doubling time s minimální a maximální hodnotou ve stejném pořadí byl 28,9 (24,5; 35,2) / 27,4 (24,5; 32,6 ) / 28,3 (24,0; 38,4) / 27,1 (25,3; 33,9) hodin. průběžné hodnoty jsou uvedeny v grafu (graf 4). Viabilita KBZD získaných ze sedmé pasáže byla ve stejném pořadí 80,1 / 82,5 / 81,8 / 80,9 %.
Graf 1. Kumulovaný počet populačních zdvojení KBZD linie 1 v 2.–7. pasáži kultivovaných v kontrolním médiu (Kontrola), médiu 1 (KH 116), médiu 2 (KH 540) a médiu 3 (KH 1500)
Graph 1 Cumulative population doublings of the DPSC line 1 in the 2nd–7th passage. DPSCs were cultivated in control medium (Control), medium 1 (HA 116), medium 2 (HA 540) and medium 3 (HA 1500)
Graf 2. Zdvojnásobení času v hodinách KBZD linie 1 v 2.–7. pasáži kultivovaných v kontrolním médiu (Kontrola), médiu 1 (KH 116), médiu 2 (KH 540) a médiu 3 (KH 1500)
Graph 2 Doubling time in hours of the DPSC line 1 in the 2nd–7th passage. DPSCs were cultivated in control medium (Control), medium 1 (HA 116), medium 2 (HA 540) and medium 3 (HA 1500)
Graf 3. Kumulovaný počet populačních zdvojení KBZD linie 2 v 2.–7. pasáži kultivovaných v kontrolním médiu (Kontrola), médiu 1 (KH 116), médiu 2 (KH 540) a médiu 3 (KH 1500)
Graph 3 Cumulative population doublings of the DPSC line 2 in the 2nd–7th passage. DPSCs were cultivated in control medium (Control), medium 1 (HA 116), medium 2 (HA 540) and medium 3 (HA 1500)
Graf 4. Zdvojnásobení času v hodinách KBZD linie 2 v 2.–7. pasáži kultivovaných v kontrolním médiu (Kontrola), médiu 1 (KH 116), médiu 2 (KH 540) a médiu 3 (KH 1500)
Graph 4 Doubling time in hours of the DPSC line 2 in the 2nd–7th passage. DPSCs were cultivated in control medium (Control), medium 1 (HA 116), medium 2 (HA 540) and medium 3 (HA 1500)
U KBZD kultivovaných v médiu s přídavkem NMH-KH jsme zaznamenali oproti KBZD kultivovaných v ostatních médiích a negativní kontrole pokles znaků CD 105 a OCT 3/4 u linie 1 a u KBZD linie 2 došlo k poklesu znaků CD 105, CD 117 a CD 146. Pozitivita ostatních sledovaných znaků byla srovnatelná (tab. 1, tab. 2) (graf 5, graf 6).
Tab. 1. CD pozitivní KBZD v procentech v rámci populace linie 1; KBZD kultivovány v kontrolním médiu (Kontrola), médiu 1 (KH 116), médiu 2 (KH 540) a médiu 3 (KH 1500)
Tab. 1 Percentage of CD positive DPSCs within the population of the DPSC line 1; DPSCs were cultivated in control medium (Control), medium 1 (HA 116), medium 2 (HA 540) and medium 3 (HA 1500)
Tab. 2. CD pozitivní KBZD v procentech v rámci populace linie 2; KBZD kultivovány v kontrolním médiu (Kontrola), médiu 1 (KH 116), médiu 2 (KH 540) a médiu 3 (KH 1500)
Tab. 2 Percentage of CD positive DPSCs within the population of the DPSC line 2; DPSCs were cultivated in control medium (Control), medium 1 (HA 116), medium 2 (HA 540) and medium 3 (HA 1500)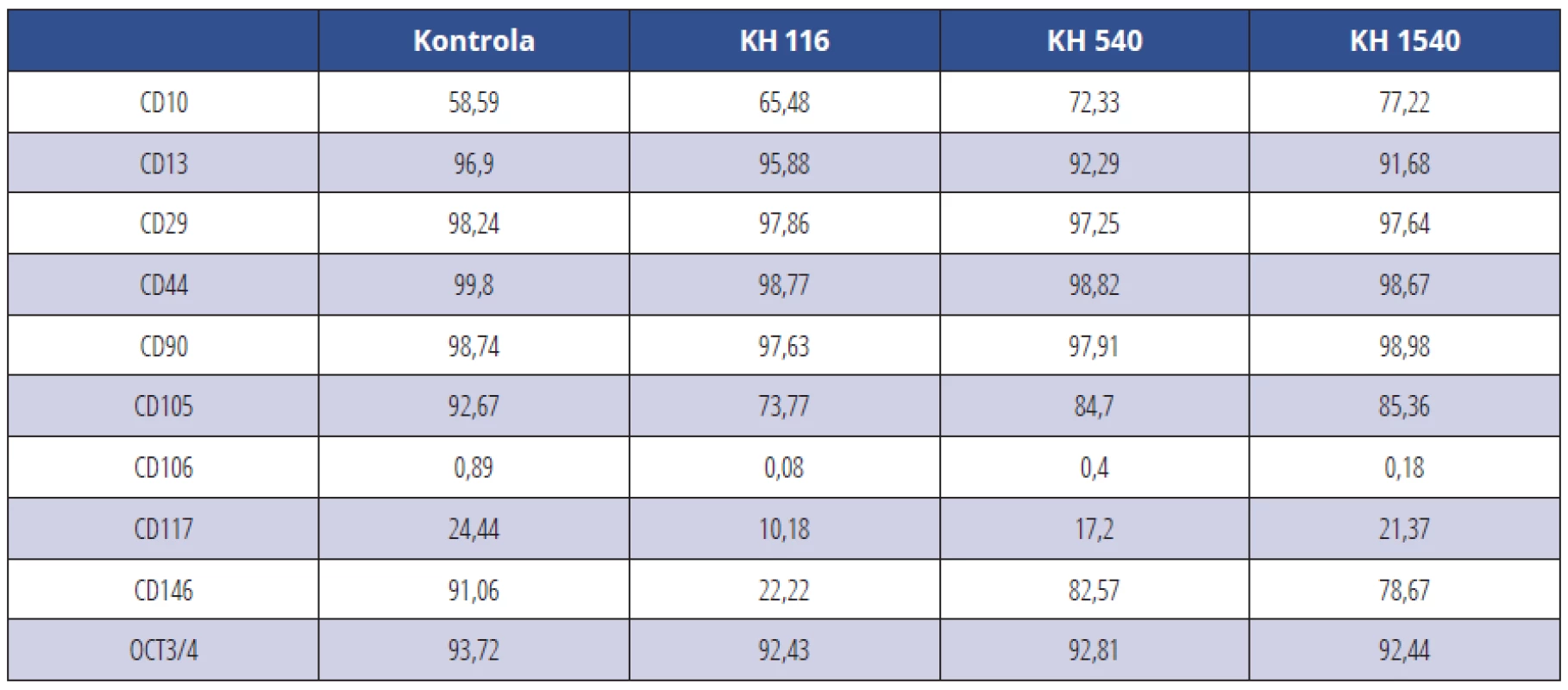
Graf 5. CD pozitivní KBZD v procentech v rámci populace linie 1; KBZD kultivovány v kontrolním médiu (Kontrola), médiu 1 (KH 116), médiu 2 (KH 540) a médiu 3 (KH 1500)
Graph 5 Percentage of CD positive DPSCs within the population of the DPSC line 1; DPSCs were cultivated in control medium (Control), medium 1 (HA 116), medium 2 (HA 540) and medium 3 (HA 1500)
Graf 6. CD pozitivní KBZD v procentech v rámci populace linie 2; KBZD kultivovány v kontrolním médiu (Kontrola), médiu 1 (KH 116), médiu 2 (KH 540) a médiu 3 (KH 1500)
Graph 6 Percentage of CD positive DPSCs within the population of the DPSC line 2; DPSCs were cultivated in control medium (Control), medium 1 (HA 116), medium 2 (HA 540) and medium 3 (HA 1500)
U obou testovaných linií dlouhodobě kultivovaných v kontrolním médiu, médiu 1, 2 a 3 jsme byli schopni indukovat diferenciaci v osteoblasty a prokázat přítomnost vápníkových depozit v extracelulární matrix (obr. 1). Chondrogenní diferenciaci jsme prokázali u obou testovaných linií kultivovaných pouze v kontrolním médiu, médiu 1 a 3 (obr. 2). V médiu 2 došlo během diferenciačního experimentu ke kontaminaci kultivačních nádob plísní, a proto byly z experimentu vyřazeny.
Obr. 1. Barvení depozit vápníku v extracelulární matrix KBZD aliziarinovou červení; KBZD linie 1: kontrola (a), médium 1 (b), médium 2 (c), médium 3 (d), KBZD linie 2: kontrola (e), médium 1 (f), médium 2 (g), médium 3 (h)
Fig. 2
Alizarin red staining of calcium deposites in the extracellular matrix of DPSCs; DPSC line 1: control (a), medium 1 (b), medium 2 (c), medium 3 (d), DPSC line 2: control (e), medium 1 (f), medium 2 (g), medium 3 (h)
Obr. 2. Barvení kyselých mukopolysacharidů v extracelulární matrix KBZD alciánovou modří; KBZD linie 1: kontrola (a), médium 1 (b), médium 3 (c), KBZD linie 2: kontrola (d), médium 1 (e), médium 3 (f)
Fig. 2
Alzian blue staining of acid mucopolysaccharides in the extracellular matrix of DPSCs; DPSC line 1: control (a), medium 1 (b), medium 3 (c), DPSC line 2: control (d), medium 1 (e), medium 3 (f)
DISKUSE
KBZD jsou snadno dostupným zdrojem mezenchymálních KB. Jejich využití v regenerační medicíně a tkáňovém inženýrství nabízí širokou škálu aplikací, a to nejen ve stomatognátní oblasti. KBZD byly In vitro diferencovány v buňky podobné Langerhansovým ostrůvkům pankreatu schopné sekrece inzulinu či v hepatocyty. in vivo byla prokázána jejich schopnost indukovat regeneraci buněk rohovky, periferních nervů, cév a dalších [24–29]. Pokud se omezíme pouze na oblast orální, in vivo studie na zvířecích modelech ukazují, že aplikace KBZD do čelistních kostních defektů podporuje jejich hojení [30–33] a aplikace do nevitálního zubu indukuje regeneraci zubní dřeně [34–36]. Omezený počet studií se věnuje vlivu KBZD na integraci implantátů do čelistních kostí, avšak jejich pozitivní vliv zatím nelze interpretovat jako statisticky významný [37–39].
KH je glykosaminoglykan, který má pro své protizánětlivé, hydratační, regenerační, osteokonduktivní a biokompatibilní vlastnosti potenciál využití i ve stomatologii [40, 41]. Díky variabilním možnostem jeho technologického zpracování je k dispozici ve formě spongiózní, tuhé, gelu či prášku, a dovoluje tak zvolit ideální provedení podle místa aplikace [42]. Zároveň je KH dobře kombinovatelná s jinými látkami, ať už chemickými úpravami, či prostou absorpcí [42]. V důsledku těchto úprav lze kombinovat výhody zvolených materiálů podle zamýšleného použití. KH je tak široce využitelným materiálem pro celou řadu indikací. Na našem pracovišti jsme úspěšně otestovali aplikaci spongiózního materiálu vzniklého lyofilizací roztoku KH s oktenidin dihydrochloridem pro léčbu alveolární ostitis [40]. Při autologní transplantaci fibroblastů kolonizujících nosič z KH byl tento materiál použit jako štěp pro krytí gingiválních recesů [43, 44]. Kopolymer kyseliny hyaluronové, mléčné a glykolové lze díky jeho pomalé degradaci použít ve formě membrány jako bariéru pro krytí kostěných defektů s lepšími výsledky než při použití prosté membrány z polymeru kyseliny mléčné a glykolové [41]. Protizánětlivé působení KH bylo demonstrováno snížením zánětlivých projevů dásní při dlouhodobé aplikaci 0,2% gelu KH [45].
K použití KBZD in vivo je nutné buňky na místo přenést a v místě je udržet. K tomuto účelu slouží scaffoldy, které podle zvoleného materiálu mohou nejen plnit funkci podpůrnou, ale mohou samy buňky ovlivňovat [46]. Mezi materiály využívané pro tvorbu scaffoldů patří i KH, která je ve vysokomolekulární formě přirozenou součástí pojivových tkání. Je biokompatibilní, biodegradabilní snadno resorbovatelná a díky svému vysokému zastoupení v těle je i součástí přirozeného prostředí buněk. Mezi ostatními materiály pro tvorbu scaffoldů je specifická svým funkčním působením na kultivované buňky. Mezenchymální KB kultivované ve scaffoldech z KH produkují výrazně větší množství kolagenu II než při kultivaci ve scaffoldech z polyethylenglykolu [47]. Stejný efekt mělo i přidání KH do scaffoldů z kolagenu při kultivaci chondrocytů [46]. KBZD vykazují přirozeně vysokou pozitivitu na povrchový receptor glykoprotein CD44 podílející se mimo jiné na indukci mineralizace odontoblastů [19]. KH indukuje vazbou na CD 44 in vivo mineralizaci KBZD a in vitro jejich diferenciaci v odontoblasty [19, 48]. Její snadnou in vivo degradaci, a tedy krátký čas, po který plní funkci scaffoldu či bariéry, lze zpomalit biochemickými úpravami [21, 22] či mísením s kolagenem, které kombinuje výhody obou materiálů [46].
I přes zpomalení degradace je nutné, aby postupné odbourávání scaffoldu probíhalo až do jeho plného vymizení. Při degradaci KH dochází k jejímu štěpení na kratší řetězce, a tedy ke snižování molekulární hmotnosti řetězců KH. Bioaktivní vlastnosti KH jsou podmíněny právě délkou řetězců [5, 9, 17, 18], a proto je nutné znát vliv různých molekulárních hmotností KH na buňky, které jsou s ní v kontaktu. Této problematice se doposud věnuje jen velmi omezené množství publikací a při literární rešerši jsme nenalezli publikaci, která by se věnovala porovnání vlivu různých molekulárních hmotností KH na lidské KBZD.
Cílem experimentu proto bylo posoudit vliv KH o nízké, střední a vysoké molekulární hmotnosti rozpuštěné v kultivačním médiu na fenotypový profil, proliferační aktivitu a diferenciační potenciál lidských KBZD. U KBZD kultivovaných v médiu s přídavkem VMH-KH jsme podle očekávání nepozorovali významné odchylky ve fenotypu oproti negativní kontrole, naopak u KBZD kultivovaných v médiu s přídavkem NMH-KH jsme zaznamenali u některých znaků odchylky výrazné.
U KBZD kultivovaných v médiu s přídavkem NMH-KH byl oproti KBZD kultivovaných v ostatních médiích a negativní kontrole patrný pokles znaků CD 105 a OCT 3/4 u linie 1. U linie 2 došlo k poklesu znaků CD 105, CD 117 a CD 146. Pozitivita ostatních sledovaných znaků byla srovnatelná. OCT 3/4 je znak typický pro KB a je asociován s nízce diferencovaným fenotypem [49]. Snížení OCT 3/4 může ukazovat na indukci diferenciace KBZD. I přes tento výsledek, který naznačuje sníženou schopnost KBZD kultivovaných v médiu s nízkomolekulární KH diferencovat ve zralé buněčné elementy, jsme byli schopni i u těchto buněk indukovat diferenciaci ve zralé buněčné linie. CD 105 a CD 146 jsou znaky asociované s angiogenezí [50, 51]. Vzhledem k tomu, že angiogeneze je podle některých publikací indukována NMH-KH [14, 15], je pro nás tento výsledek překvapující. Exprese CD 44 nebyla výrazně ovlivněna, byť se jedná o znak, který obvykle bývá přítomností KH ovlivněn [19, 48]. Tento výsledek si vysvětlujeme nízkou koncentrací KH v kultivačních médiích a tuto hypotézu by bylo vhodné v dalších experimentech ověřit kultivací KBZD v médiích s vyšší příměsí KH a analyzovat transkriptom buněk metodou qPCR pro kvantitativní analýzu exprese genů se zaměřením na DSPP a DMP-1 (markery odontogenní diferenciace), jež jsou vazbou KH-CD 44 ovlivněny [19]. Ověření získaných poznatků by bylo vhodné experimentálně potvrdit na více liniích.
ZÁVĚR
Experimentem jsme ověřili, že lidské KBZD v přítomnosti KH o molekulárních hmotnostech 116, 540 a 1500 kDa přežívají, proliferují a udržují si schopnost diferencovat ve zralé buněčné elementy. Dále jsme ověřili původní předpoklad, že NMH-KH bude mít rozdílný dopad na fenotyp KBZD než VMH-KH.
Podpořeno programem PROGRES Q40/06.
MDDr. Jan Schmidt
Stomatologická klinika LF UK a FN
Sokolská 581
500 05 Hradec Králové
e-mail: jan.schmidt@lfhk.cuni.cz
Zdroje
1. Goldberg M, Hirata A. The dental pulp: composition, properties and functions. JSM Dent. 2017; 5(1): 1079.
2. Dahiya P, Kamal R. Hyaluronic acid: a boon in periodontal therapy. N Am J Med Sci. 2013; 5(5): 309–315.
3. Bauer C, Niculescu-Morzsa E, Jeyakumar V, Kern D, Spath SS, Nehrer S. Chondroprotective effect of high-molecular-weight hyaluronic acid on osteoarthritic chondrocytes in a co-cultivation inflammation model with M1 macrophages. J Inflamm (Lond). 2016; 13(1): 31.
4. Petrey AC, de la Motte CA. Hyaluronan, a crucial regulator of inflammation. Front Immunol. 2014; 5 : 101.
5. Albano GD, Bonanno A, Cavalieri L, Ingrassia E, Di Sano C, Siena L, Riccobono L, Gagliardo R, Profita M. Effect of high, medium, and low molecular weight hyaluronan on inflammation and oxidative stress in an in vitro model of human nasal epithelial cells. Mediators Inflamm. 2016; 2016 : 8727289.
6. Altman RD, Manjoo A, Fierlinger A, Niazi F, Nicholls M. The mechanism of action for hyaluronic acid treatment in the osteoarthritic knee: a systematic review. BMC Musculoskelet Disord. 2015; 16(1): 321.
7. Rahimnejad M, Derakhshanfar S, Zhong W. Biomaterials and tissue engineering for scar management in wound care. Burns Trauma. 2017; 5(1): 4.
8. Furnari ML, Termini L, Traverso G, Barrale S, Bonaccorso MR, Damiani G, Piparo CL, Collura M. Nebulized hypertonic saline containing hyaluronic acid improves tolerability in patients with cystic fibrosis and lung disease compared with nebulized hypertonic saline alone: a prospective, randomized, double-blind, controlled study. Ther Adv Respir Dis. 2012; 6(6): 315–322.
9. Cyphert JM, Trempus CS, Garantziotis S. Size matters: molecular weight specificity of hyaluronan effects in cell biology. Int J Cell Biol. 2015; 2015 : 563818.
10. Lauer ME, Dweik RA, Garantziotis S, Aronica MA. The rise and fall of hyaluronan in respiratory diseases. Int J Cell Biol. 2015; 2015 : 712507.
11. Naor D. Interaction between hyaluronic acid and its receptors (CD44, RHAMM) regulates the activity of inflammation and cancer. J Frontiers Immunol. 2016; 7 : 39.
12. Gritsenko P, Ilina O, Friedl P. Interstitial guidance of cancer invasion. J Pathol. 2012; 226(2): 185–199.
13. Wu M, Cao M, He Y, Liu Y, Yang C, Du Y, Wang W, Gao F. A novel role of low molecular weight hyaluronan in breast cancer metastasis. FASEB J. 2015; 29(4): 1290–1298.
14. Fuchs K, Hippe A, Schmaus A, Homey B, Sleeman JP, Orian-Rousseau V. Opposing effects of high - and low-molecular weight hyaluronan on CXCL12-induced CXCR4 signaling depend on CD44. Cell Death Dis. 2013; 4(10): e819.
15. Lennon FE, Mirzapoiazova T, Mambetsariev N, Mambetsariev B, Salgia R, Singleton PA. Transactivation of the receptor-tyrosine kinase ephrin receptor A2 is required for the low molecular weight hyaluronan-mediated angiogenesis that is implicated in tumor progression. J Biol Chem. 2014; 289(35): 24043–24058.
16. Mattheolabakis G, Milane L, Singh A, Amiji MM. Hyaluronic acid targeting of CD44 for cancer therapy: from receptor biology to nanomedicine. J Drug Target. 2015; 23(7–8): 605–618.
17. Maharjan AS, Pilling D, Gomer RH. High and low molecular weight hyaluronic acid differentially regulate human fibrocyte differentiation. PLoS One. 2011; 6(10): e26078.
18. Rayahin JE, Buhrman JS, Zhang Y, Koh TJ, Gemeinhart RA. High and low molecular weight hyaluronic acid differentially influence macrophage activation. ACS Biomater Sci Eng. 2015; 1(7): 481–493.
19. Umemura N, Ohkoshi E, Tajima M,Kikuchi H, Katayama T, Sakagami H.Hyaluronan induces odontoblastic differentiation of dental pulp stem cells via CD44. Stem Cell Res Ther. 2016; 7(1): 135.
20. Collins MN, Birkinshaw C. Hyaluronic acid based scaffolds for tissue engineering – A review. Carbohyd Polym. 2013; 92(2): 1262–1279.
21. Chircov C, Grumezescu AM, Bejenaru LE. Hyaluronic acid-based scaffolds for tissue engineering. Rom J Morphol Embryol. 2018; 59(1): 71–76.
22. Khunmanee S, Jeong Y, Park H. Crosslinking method of hyaluronic-based hydrogel for biomedical applications. J Tissue Eng. 2017; 8 : 2041731417726464.
23. Suchanek J, Soukup T, Visek B, Ivancakova R, Kucerova L, Mokry J. Dental pulp stem cells and their characterization. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2009; 153(1).
24. Kabir R, Gupta M, Aggarwal A, Sharma D, Sarin A, Kola MZ. Imperative role of dental pulp stem cells in regenerative therapies: a systematic review. Niger J Surg. 2014; 20(1): 1–8.
25. Carnevale G, Riccio M, Pisciotta A, Beretti F, Maraldi T, Zavatti M, Cavallini GM, La Sala GB, Ferrari A, De Pol AJD, Disease L. In vitro differentiation into insulin-producing β-cells of stem cells isolated from human amniotic fluid and dental pulp. 2013; 45(8): 669–676.
26. Gomes JA, Geraldes Monteiro B, Melo GB, Smith RL, Cavenaghi Pereira da Silva M, Lizier NF, Kerkis A, Cerruti H, Kerkis I. Corneal reconstruction with tissue-engineered cell sheets composed of human immature dental pulp stem cells. Invest Ophthalmol Vis Sci. 2010; 51(3): 1408–1414.
27. Omi M, Hata M, Nakamura N, Miyabe M, Ozawa S, Nukada H, Tsukamoto M, Sango K, Himeno T, Kamiya H, Nakamura J, Takebe J, Matsubara T, Naruse K. Transplantation of dental pulp stem cells improves long-term diabetic polyneuropathy together with improvement of nerve morphometrical evaluation. Stem Cell Res Ther. 2017; 8(1): 279.
28. Martínez-Sarrà E, Montori S, Gil-Recio C, Núñez-Toldrà R, Costamagna D, Rotini A, Atari M, Luttun A, Sampaolesi M. Human dental pulp pluripotent-like stem cells promote wound healing and muscle regeneration. J Stem Cell Res. 2017; 8(1): 175.
29. Sakai K, Yamamoto A, Matsubara K, Nakamura S, Naruse M, Yamagata M, Sakamoto K, Tauchi R, Wakao N, Imagama S, Hibi H, Kadomatsu K, Ishiguro N, Ueda M. Human dental pulp-derived stem cells promote locomotor recovery after complete transection of the rat spinal cord by multiple neuro-regenerative mechanisms. J Clin Invest. 2012; 122(1): 80–90.
30. Chamieh F, Collignon AM, Coyac BR, Lesieur J, Ribes S, Sadoine J, Llorens A, Nicoletti A, Letourneur D, Colombier ML. Accelerated craniofacial bone regeneration through dense collagen gel scaffolds seeded with dental pulp stem cells. J Sci Reports. 2016; 6 : 38814.
31. Manimaran K, Sharma R, Sankaranarayanan S, Perumal SM. Regeneration of mandibular ameloblastoma defect with the help of autologous dental pulp stem cells and buccal pad of fat stromal vascular fraction. Ann Maxillofac Surg. 2016; 6(1): 97–100.
32. Yamada Y, Ito K, Nakamura S, Ueda M, Nagasaka T. Promising cell-based therapy for bone regeneration using stem cells from deciduous teeth, dental pulp, and bone marrow. J Cell Transplant. 2011; 20(7): 1003–1013.
33. Amghar-Maach S, Gay-Escoda C, Sanchez-Garces MA. Regeneration of periodontal bone defects with dental pulp stem cells grafting: Systematic review. J Clin Exp Dent. 2019; 11(4): e373–e81.
34. Itoh Y, Sasaki JI, Hashimoto M, Katata C, Hayashi M, Imazato S. Pulp regeneration by 3-dimensional dental pulp stem cell constructs. J Dent Res. 2018; 97(10): 1137–1143.
35. Zhu X, Zhang C, Huang GT, Cheung GS, Dissanayaka WL, Zhu W. Transplantation of dental pulp stem cells and platelet-rich plasma for pulp regeneration. J Endod. 2012; 38(12): 1604–1609.
36. Dissanayaka WL, Hargreaves KM, Jin L, Samaranayake LP, Zhang C. The interplay of dental pulp stem cells and endothelial cells in an injectable peptide hydrogel on angiogenesis and pulp regeneration in vivo. Tissue Eng Part A. 2015; 21(3–4): 550–563.
37. Ito K, Yamada Y, Nakamura S, Ueda M. Osteogenic potential of effective bone engineering using dental pulp stem cells, bone marrow stem cells, and periosteal cells for osseointegration of dental implants. Int J Oral Maxillofac Implants. 2011; 26(5).
38. Palanisamy S, Kurkalli BGS. Interaction of dental pulp stem cells in bone regeneration on titanium implant. An in vitro study. J Osseointegration. 2019; 11(4).
39. Guzalinuer A, Muhetaer H, Wu H, Paerhati A. Experimental study on the transforming growth factor β3 combined with dental pulp stem cells in early bone integration of implant. Chinese J Stomatol. 2018; 53(4): 259–263.
40. Suchánek J, Ivančaková RK, Mottl R, Browne KZ, Pilneyová KC, Pilbauerová N, Schmidt J, Suchánková Kleplová T. Hyaluronic acid-based medical device for treatment of alveolar osteitis – clinical study. Int J Environ Res Public Health. 2019; 16(19): 3698.
41. Park JK, Yeom J, Oh EJ, Reddy M, Kim JY, Cho DW, Lim HP, Kim NS, Park SW, Shin HI, Yang DJ, Park KB, Hahn SK. Guided bone regeneration by poly(lactic-co-glycolic acid) grafted hyaluronic acid bi-layer films for periodontal barrier applications. Acta Biomater. 2009; 5(9): 3394–3403.
42. Collins MN, Birkinshaw C. Hyaluronic acid based scaffolds for tissue engineering – A review. J Carbohydrate Polymers. 2013; 92(2): 1262–1279.
43. Prato GP, Rotundo R, Magnani C, Soranzo C, Muzzi L, Cairo F. An autologous cell hyaluronic acid graft technique for gingival augmentation: a case series. J Periodontol. 2003; 74(2): 262–267.
44. Çankaya ZT, Gürbüz S, Bakirarar B, Kurtiş B. Evaluation of the effect of hyaluronic acid application on the vascularization of free gingival graft for both donor and recipient sites with laser doppler flowmetry: A randomized, examiner-blinded, controlled clinical Trial. Int J Periodont Restorat Dent. 2020; 40(2).
45. Sahayata V, Bhavsar N, Brahmbhatt N. An evaluation of 0.2% hyaluronic acid gel (Gengigel®) in the treatment of gingivitis: a clinical & microbiological study. Oral Health Dent Manag. 2014; 13(3): 779–785.
46. Matsiko A, Levingstone TJ, O'Brien FJ, Gleeson JP. Addition of hyaluronic acid improves cellular infiltration and promotes early-stage chondrogenesis in a collagen-based scaffold for cartilage tissue engineering. J Mech Behav Biomed Mater. 2012; 11 : 41–52.
47. Chung C, Burdick JA. Influence of three-dimensional hyaluronic acid microenvironments on mesenchymal stem cell chondrogenesis. Tissue Eng Part A. 2009; 15(2): 243–254.
48. Chen KL, Huang YY, Lung J, Yeh YY, Yuan K. CD44 is involved in mineralization of dental pulp cells. J Endodont. 2013; (3): 351–356.
49. Pan GJ, Chang ZY, Scholer HR, Pei D. Stem cell pluripotency and transcription factor Oct4. Cell Res. 2002; 12(5–6): 321–329.
50. Nassiri F, Cusimano MD, Scheithauer BW, Rotondo F, Fazio A, Yousef GM, Syro LV, Kovacs K, Lloyd RV. Endoglin (CD105): a review of its role in angiogenesis and tumor diagnosis, progression and therapy. Anticancer Res. 2011; 31(6): 2283–2290.
51. Espagnolle N, Guilloton F, Deschaseaux F, Gadelorge M, Sensébé L, Bourin P. CD 146 expression on mesenchymal stem cells is associated with their vascular smooth muscle commitment. J Cell Mol Med. 2014; 18(1): 104–114.
Štítky
Chirurgia maxilofaciálna Ortodoncia Stomatológia
Článok vyšiel v časopiseČeská stomatologie / Praktické zubní lékařství
Najčítanejšie tento týždeň
2020 Číslo 3
-
Všetky články tohto čísla
- Sto let od úmrtí Eduarda Nessela
- Vliv kyseliny hyaluronové o nízké, střední a vysoké molekulární hmotnosti na lidské kmenové buňky zubní dřeně
- Přesnost okrajového a vnitřního dosedu chrom-kobaltových korunek s různými typy preparace včetně pomocných prvků; CAD/CAM vs. konvenční technika
- Editorial
- Unicone plus vs. unicone – in vitro studie cyklické únavy při různých teplotách okolního prostředí
- Vzpomínka na profesora Eduarda Nessela
- Česká stomatologie / Praktické zubní lékařství
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Přesnost okrajového a vnitřního dosedu chrom-kobaltových korunek s různými typy preparace včetně pomocných prvků; CAD/CAM vs. konvenční technika
- Vliv kyseliny hyaluronové o nízké, střední a vysoké molekulární hmotnosti na lidské kmenové buňky zubní dřeně
- Unicone plus vs. unicone – in vitro studie cyklické únavy při různých teplotách okolního prostředí
- Vzpomínka na profesora Eduarda Nessela
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



