-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Monitorace ztráty botulinumtoxinu při aplikaci do detruzoru – výsledky pilotní fáze studie
Monitoring the loss of botulinum toxin during intradetrusor administration – pilot study results
Aim:
The aim of this study was to examine the possible loss of the onabotulinumtoxinA (onaBTA) in the course of endoscopic injection into the detrusor muscle in patients with neurogenic detrusor overactivity.Methods:
The study group included 11 patients with neurogenic detrusor overactivity who failed standard treatment with anticholinergics. Patients were treated with endoscopic injection of 200 U onaBTA divided into 30 injection sites using a 23 G flexible endoscopic needle. In order to determine the content of onaBTA lost during endoscopic administration, methylene blue dye was added to the solution of the drug. The concentration of methylene blue was quantified using spectrofotometry in the bladder irrigant collected immediately after the final intradetrusor injection. The volume of onaBTA that was lost in the course of each procedure was subsequently calculated based the concentration of methylene blue in the solution.Results:
In the first patient, the method for monitoring the loss of onaBTA was performed using a known loss of 13 U of onaBTA. In the following 10 patients there was a loss of 2.6 ± 1.67 U onaBTA during endoscopic administration onaBTA to detrusor.Conclusions:
In this pilot study, we demonstrated that compared to the total injected volume, the loss onaBTA during endoscopic injection in the detrusor was negligible.Key words:
botulinum neurotoxin, onabotulinumtoxinA, neurogenic detrusor overactivity, endoscopic administration, detrusor injection.
Autori: Vladimír Šámal 1,2; Jana Műllerová 3; Vít Paldus 1; Jan Mečl 1
Pôsobisko autorov: Urologické oddělení, Krajská nemocnice Liberec, a. s. 1; Urologická klinika Fakultní nemocnice a Lékařské fakulty UK, Hradec Králové 2; Katedra chemie, Fakulta přírodovědně humanitní a pedagogická, Technická univerzita Liberec 3
Vyšlo v časopise: Ces Urol 2014; 18(1): 33-39
Kategória: Původní práce
Súhrn
Cíl:
Cílem práce je dokumentovat možnou ztrátu onabotulinumtoxinu A (onaBTA), která vzniká při endoskopické aplikaci do detruzoru močového měchýře v léčbě neurogenní hyperaktivity detruzoru.Metoda:
Soubor byl tvořen jedenácti pacienty s neurogenní hyperaktivitou detruzoru, u kterých nebyla standardní léčba anticholinergiky úspěšná. Pacienti byli léčeni endoskopickou aplikací 200 U onaBTA do 30 míst detruzoru 23 G flexibilní endoskopickou jehlou. K monitoraci ztráty onaBTA při endoskopické aplikaci jsme použili barvení roztoku léku metylenovou modří. Po vyšetření jsme spektrofotometricky stanovili koncentraci metylenové modři v lavážním roztoku po endoskopické aplikaci, ze které byla vypočítána výsledná ztráta onaBTA.Výsledky:
U prvního pacienta jsme provedli ověření metody monitorace ztráty onaBTA s prokázanou ztrátou U onaBTA 13 U. V souboru dalších deseti pacientů jsme prokázali při endoskopické aplikaci onaBTA do detruzoru ztrátu 2,6 ± 1,67 U onaBTA.Závěr:
V pilotní fázi studie jsme prokázali, že ztráta onaBTA při endoskopické aplikaci do detruzoru je z hlediska podané dávky zanedbatelná.Klíčová slova:
botulinum toxin, onabotulinumtoxin A, ne-urogenní močový měchýř, endoskopická aplikace, ztráta léku.ÚVOD
Aplikace botulinum neurotoxinu A (BTA) se stala metodou volby u pacientů s neurogenní hyperaktivitou detruzoru (NDO) refrakterních na standardní terapii anticholinergiky a rychle narůstá i počet léčených pacientů s idiopatickou hyperaktivitou detruzoru.
Výsledky výzkumu posledních let ukazují, že mechanismus účinku BTA na močový měchýř je komplexní a ovlivňuje jak eferentní, tak i aferentní nervový přenos. Je zřejmé, že kromě přímého vlivu na eferentní dráhy blokádou uvolnění acetylcholinu je modulován také celou řadou multimodálních efektů na senzorické aferentní dráhy (1). Jedná se zejména o snížené uvolňování ATP, substance P a sníženou axonální expresi vaniloidních a purinergních receptorů. Kombinací uvedených mechanismů dochází k dlouhodobé inhibici eferentního i aferentního nervového přenosu, které se využívá k léčbě NDO (2, 3). Právě ovlivnění aferentního nervového přenosu je pravděpodobně příčinou dlouhodobého účinku BTA na detruzor.
Z dosavadních výzkumů je zřejmé, že existuje korelace mezi dávkou BTA a intenzitou účinku, jak prokázal Dressler (4). Korelační vztah funguje pouze pro nízké dávky BTA, křivka má polynomický charakter. Stejně tak existuje vztah mezi dávkou a délkou trvání efektu léčby, pro který platí obdobná zjištění jako pro intenzitu účinku (4, 5).
Endoskopickou aplikaci BTA si zkušený urolog rychle osvojí. Doposud není přesně známo, jak velkou ztrátou léku je aplikace zatížena. Existují pouze dílčí informace o tom, kolik BTA se dostává mimo cílový distribuční prostor – detruzor – do perivezikální tukové tkáně (6). Metylenová modř je látka se silnou barvící schopností i v nízkých koncentracích. Při průchodu světla roztokem se část světla pohltí v roztoku – dochází k jeho absorpci. Absorbance je součinem extenčního koeficientu (ε), délky kyvety použité pro měření (l) a koncentrace roztoku (c). Extenční koeficient není v praxi často známý, a proto se před měřením provádí sestrojení kalibračního grafu, kdy se změří absorbance série roztoků o známé koncentraci. Pro metylenovou modř má křivka v základní části prakticky lineární charakter (R2 = 0,9999). Při změření absorbance roztoku o neznámé koncentraci lze koncentraci metylenové modři odečíst z grafu při použití rovnice křivky.
METODIKA
Do pilotní fáze sledování jsme zařadili jedenáct pacientů s NDO v důsledku spinálního poranění nebo roztroušené sklerózy refrakterních na standardní terapii anticholinergiky. Jednalo se o deset mužů a jednu ženu, průměrný věk byl 36,7 roků.
K léčbě jsme použili onabotulinumtoxin A (onaBTA) v dávce 200 U, který jsme aplikovali do 30 míst močového měchýře (6,7 U/ml). K ředění onaBTA jsme použili zásobní roztok 2 ml 2,5% metylenové modři ve 100 ml fyziologického roztoku. Dávku 200 U onaBTA jsme naředili do 12 ml fyziologického roztoku a rozdělili do tří 10 ml stříkaček po 4 ml. Do každé stříkačky jsme doplnili 6 ml zásobního roztoku metylenové modři.
Výkon jsme prováděli v celkové nebo re-gionální anestezii při standardní náplni močového měchýře 150–200 ml. K cystoskopii jsme použili rigidní 21 FR cystoskop a k aplikaci flexibilní endoskopickou jehlu 23 G. Provedli jsme aplikaci onaBTA mimo oblast trigona tak, aby byla vytvořena rovnoměrně rozprostřená síť míst, kam byl onaBTA aplikován. Aplikaci jsme provedli formou intramurální injekce do detruzoru. Při této technice jsme zaváděli jehlu kolmo ke stěně močového měchýře v radiálním směru do hloubky 4 mm, bez možnosti opticky kontrolovat místo aplikace.
Při vlastním výkonu jsme po provedené cystoskopii před začátkem aplikace zcela vyprázdnili močový měchýř. Během následné aplikace jsme již všechnu tekutinu vypuštěnou cystoskopem z močového měchýře měřili, na konci výkonu jsme provedli výplach močového měchýře 200 ml lavážního roztoku (fyziologický roztok). Po skončení výkonu jsme změřili objem lavážní tekutiny použitý při aplikaci onaBTA. Koncentrace metylenové modři ve vzorku lavážní tekutiny byla stanovena UV-VIS spektrofotometrií na přístroji UV-VIS Cintra 202 v 1 cm dlouhé křemenné kyvetě. Při nízké koncentraci metylenové modři ve vzorku jsme použili 5 cm dlouhou kyvetu a výsledná koncentrace byla přepočítána dle Lambert-Beerova zákona. Při znalosti absorbance se koncentrace roztoku odečte z kalibračního grafu (graf 1). Rovnice křivky kalibračního grafu byla v našem případě y = 0,1788x + 0,0211.
Graf 1. Kalibrační graf metylenové modři Graph 1. Calibration graph of methylen blue 
Permanentní močový katétr jsme ponechali po výkonu zavedený po dobu 24 hodin a po jeho odstranění se pacienti vraceli k technice intermitentní autokatetrizace.
Studie byla schválena Etickou komisí Krajské nemocnice Liberec, a.s.
Výsledky jsou uváděny jako naměřené hodnoty, jejich průměr a SD. K ověření hypotézy byl použit t-test.
Stanovili jsme si ztrátu do 2 % podané dávky jako úspěšnou aplikaci.
VÝSLEDKY
Zhodnotili jsme vzorky lavážní tekutiny po provedené endoskopické aplikaci onaBTA do detruzoru u jedenácti pacientů. U prvního pacienta jsme při ověření metody měření měli ztrátu 13 U onaBTA. U dalších deseti provedených aplikací byla průměrná ztráta 2,6 ± 1,67 U onaBTA. Výsledné hodnoty jsou uvedeny v tabulce 1 a grafu 2. Během studie jsme nezaznamenali žádné komplikace. Na 5% hladině významnosti (p-value = 0,012) nepřesahuje ztráta onaBTA při endoskopické aplikaci 2 % podané dávky.
Tab. 1. Výsledky Table 1. Results 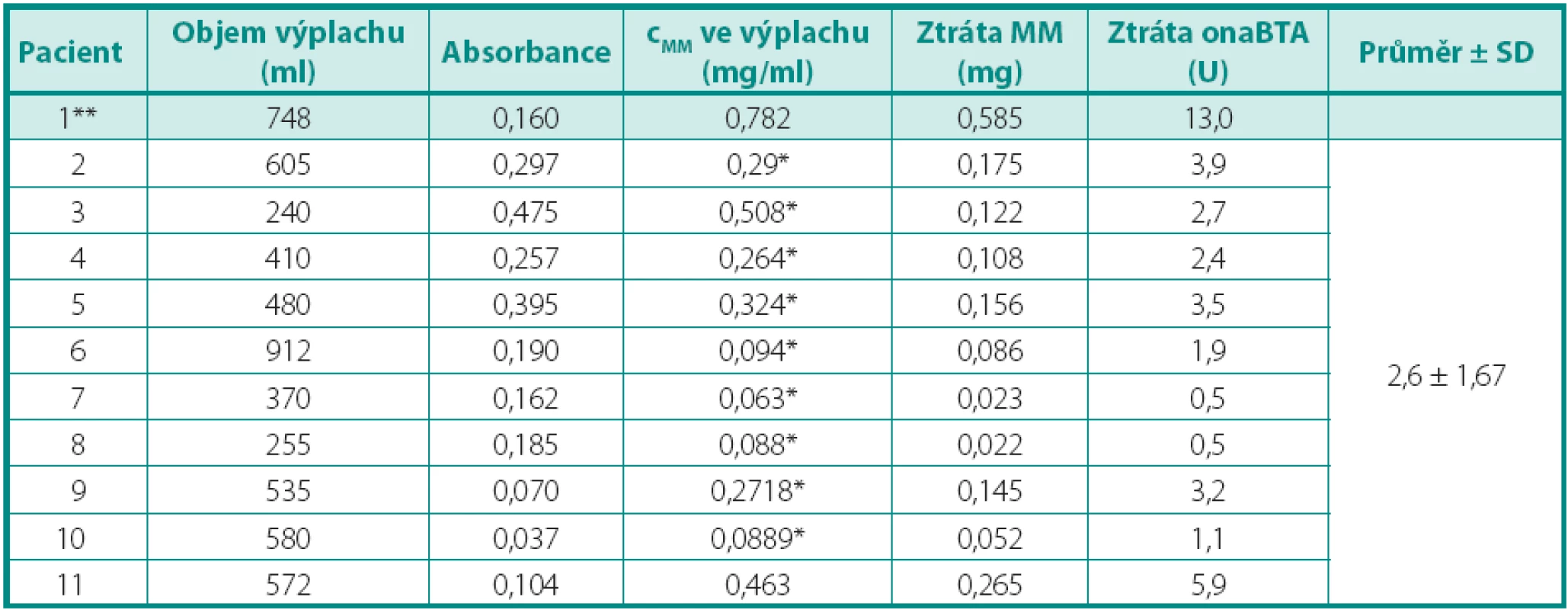
cMM – koncentrace metylenové modři * – přepočítáno z 5 cm kyvety ** – u 1. pacienta jsme ověřovali metodu Graf 2. Rozložení ztráty onaBTA (U) Graph 2. The distribution of loss of onaBTA 
* u 1. pacienta jsme ověřovali metodu DISKUSE
Aplikace BTA do detruzoru formou intramurální injekce je standardní metodou aplikace BTA a naprostá většina autorů referuje své zkušenosti a výsledky právě s touto formou aplikace BTA (7–10). Aplikace do detruzoru močového měchýře při jeho variabilní síle s sebou přináší riziko podání BTA mimo detruzor močového měchýře nebo riziko systémového podání v případě aplikace do cévy ve svalovině (významně zvyšuje možný systémový nežádoucí účinek léku). Variabilita síly detruzoru je závislá především na pohlaví, věku, náplni močového měchýře a přítomnosti neurogenní léze či obstrukce.
Morfologickým zhodnocením distribuce BTA v detruzoru se zabývali Mehnert et al., kteří ve své pilotní práci hodnotili u šesti pacientů distribuci BTA v detruzoru (6). K léčbě použili standardně cystoskopicky aplikovaný BTA s přidáním magnetické kontrastní látky gadopentátu. Ihned po aplikaci provedli magnetickou rezonanci. Prokázali, že pouze 82,4 % podané látky je v detruzoru, zbylá část byla v perivezikální tukové tkáni. Zajímavé je, že i při značném úniku BTA mimo cílový distribuční prostor nezaznamenali žádné nežádoucí účinky.
K určitému úniku BTA může po aplikaci dojít také místem vpichu po odstranění jehly. Předpokládá se, že toto množství je velice malé a odpovídá malému průměru jehly. Při použití barviva methylen blue k obarvení roztoku léku a fotometrickém hodnocení lavážní tekutiny po cystoskopické aplikaci udával Madersbacher po aplikaci onaBTA v dávce 170–400 U průměrnou ztrátu 1,96–19,2 U (medián 5,5 U), což bylo vzhledem k aplikované dávce zanedbatelné. Výsledky tohoto pozorování nebyly samostatně publikovány.
Dalším faktorem, který významně ovlivňuje ztrátu, je doba, po kterou je injekce prováděna a po kterou je ponechána jehla v detruzoru. Pokud je injekce provedena rychle a jehla poté ihned odstraněna, odchází otvorem po vpichu velké množství modře zbarveného léku. Toto pozorování bylo patrné zejména u prvního pacienta, kde jsme ověřovali metodu. Pokud byla jehla u dalších pacientů po vpichu několik sekund ponechána v místě aplikace, aby mohlo dojít k difuzi léku do svaloviny, byl únik léku již minimální. Problematická je aplikace BTA do detruzoru zejména u pacientů s výraznou trabekulární hypertrofií svaloviny detruzoru, kde jsou vytvořeny hypertrofické svalové trámce s množstvím pseudodivertiklů s tenkou stěnou mezi nimi. Právě v těchto případech je riziko podání BTA mimo stěnu detruzoru vysoké.
Subslizniční aplikace onaBTA je alternativou ke klasickému podání onaBTA do detruzoru. Podání do subslizničního prostoru lze endoskopicky vizuálně dobře kontrolovat, protože se při něm vytváří typický „bulking“ sliznice. Tato metoda se jeví také bezpečnější, protože odpadá riziko náhodného podání do drobných cév v detruzoru s rizikem systémových nežádoucích účinků. Dosavadní zkušenosti ukazují na stejnou efektivitu léčby při aplikaci onaBTA subslizničně nebo do detruzoru (11, 12). Zatím nejsou zkušenosti s monitorací ztráty onaBTA při subslizničním podání.
V naší práci jsme použili koncentraci BTA a počet injekcí původně popsanou Schurchem (7). Je prokázáno, že při vyšším ředěním se může zvýšit difuze BTA, a tím zvýšit tera-peutický efekt. Může to mít také vliv na vyšší výskyt nežádoucích účinků. K prokázání optimální koncentrace BTA neexistují validní studie a je značná variabilita aplikačních protokolů, tj. v množství roztoku, do kterého se ředí BTA, počtu injekcí a objemu jednotlivé injekce (13). Účinná dávka BTA by měla být podávána v co nejmenším objemu, tkáňová difuze BTA roste s klesající koncentrací. Při běžné koncentraci 10 U onaBTA/1 ml dochází k difuzi léku v průměru 1–3 cm kolem místa vpichu. Důležité je dosáhnout vysoké koncentrace v místě aplikace s poklesem gradientu směrem od místa vpichu (14).
Důkaz o tom, jakou roli hraje objem jednotlivé injekce, tj. koncentrace BTA, přinesli recentně Coelho et al. (15). V experimentu na prasatech testovali dávku 2 U onaBTA/2 µl vs. dávku 2 U onaBTA/20 µl. Distribuční prostor onaBTA po aplikaci jedné injekce měřili pomocí značené protilátky proti SNAP-25. Prokázali signifikantně větší imunoreaktivitu po injekci aplikované ve 20 µl. Imunoreaktivitu po injekci v tomto objemu prokázali dokonce i na protilehlé stěně močového měchýře a dominantně byla v 85 % reaktivní cholinergní vlákna. Při instilační léčbě použili dávku 50 U onaBTA/2 ml vs. placebo. Při hodnocení nenalezli imunoreaktivitu vláken v detruzoru ani subslizničním prostoru, ačkoliv v jiných studiích vykazovala instilační léčba jistou míru efektivity (16). Z této studie vyplývá, že stejná dávka ředěná do většího objemu obsadí více SNAP 25 ve větším distribučním prostoru (15).
Objem roztoku, do kterého se ředí BTA, je v rozpětí od 3 ml do nejčastěji 30 ml. Koncentrace 10U onaBTA na 1 ml pro jednu jednotlivou injekci je nejčastější, ale existují zkušenosti s menším aplikačním objemem 10 U/0,5 ml (17), 10 U/0,2 ml (18) nebo s objemem 10 U/0,1 ml (19). Poslední velké studie pracují s koncentrací onaBTA 6,7 U/ ml (9, 10).
Počet injekcí při aplikaci BTA také není ustálený a pohybuje se mezi 10–40 injekcemi. Nejčastější je aplikace do 30 míst detruzoru, jak ve své původní práci popsali Stöhrer a Schurch (7), Del Popolo et al. popisují výsledky s aplikací do 20 míst detruzoru (20). Pouze jedna studie porovnává na malém počtu pacientů výsledky při aplikaci do 10 nebo 30 míst detruzoru bez prokazatelného rozdílu (21). V současné době lze považovat za zlatý standard aplikaci roztoku 30 ml BTA do 30 míst detruzoru s 1 ml na jednotlivou aplikaci. Při současně schválené dávce 200 U onaBTA pro léčbu NDO je potom koncentrace jednotlivé injekce 6,7 U onaBTA/1 ml (při předpokládaném počtu 30 aplikací).
ZÁVĚR
V pilotní fázi studie jsme prokázali, že ztráta onaBTA při endoskopické aplikaci do detruzoru je minimální. U našeho souboru nepřekročila 2 % podávané dávky.
Poděkování
autoři děkují za pomoc se statistickým zpracováním dat Mgr. Haně Kolářové, Ph.D.
Došlo: 3. 9. 2013.
Přijato: 2. 10. 2013.
Práce vznikla s finanční podporou Vědecké rady Krajské nemocnice Liberec, a.s.
Střet zájmů: žádný.
Kontaktní adresa
MUDr. Vladimír Šámal, Ph.D.
Urologické oddělení, Krajská nemocnice Liberec, a.s.
Husova 10, 460 63 Liberec
e-mail: vladimir.samal@nemlib.cz
Zdroje
1. Apostolidis A, Dasgupta P, Fowler CJ. Proposed mechanism for the efficacy of injected botulinum toxin in the treatment of human detrusor overactivity. Eur Urol 2006; 49(4): 644–650.
2. Apostolidis A, Popat R, Yiangou Y, et al. Decreased sensory receptors P2X3 and TRPV1 in suburothelial nerve fibers following intradetrusor injections of botulinum toxin for human detrusor overactivity. J Urol 2005; 174(3): 977–982; discussion 982–983.
3. Chancellor MB, Fowler CJ, Apostolidis A, et al. Drug Insight: biological effects of botulinum toxin A in the lower urinary tract. Nat Clin Pract Urol 2008; 5(6): 319–328.
4. Dressler D, Benecke R. Pharmacology of therapeutic botulinum toxin preparations. Disabil Rehabil 2007; 29(23): 1761–1768.
5. Dressler, D. Botulinum toxin mechanisms of action. Suppl Clin Neurophysiol 2004; 57 : 159–166.
6. Mehnert U, Boy S, Schmid M, et al. A morphological evaluation of botulinum neurotoxin A injections into the detrusor muscle using magnetic resonance imaging. World J Urol 2009; 27(3): 397–403.
7. Schurch B, Stohrer M, Kramer G, et al. Botulinum-A toxin for treating detrusor hyperreflexia in spinal cord injured patients: a new alternative to anticholinergic drugs? Preliminary results. J Urol 2000; 164(3): 692–697.
8. Schurch B, De Seze M, Denys P, et al. Botulinum toxin type a is a safe and effective treatment for neurogenic urinary incontinence: results of a single treatment, randomized, placebo controlled 6-month study. J Urol 2005; 174(1): 196–200.
9. Cruz F, Herschorn S, Aliotta P, et al. Efficacy and safety of onabotulinumtoxinA in patients with urinary incontinence due to neurogenic detrusor overactivity: a randomised, double-blind, placebo-controlled trial. Eur Urol 2011; 60(4): 742–750.
10. Ginsberg D, Gousse A, Keppenne V, et al. Phase 3 efficacy and tolerability study of onabotulinumtoxinA for urinary incontinence from neurogenic detrusor overactivity. J Urol 2012; 187(6): 2131–2139.
11. Kuo HC. Therapeutic effects of suburothelial injection of botulinum a toxin for neurogenic detrusor overactivity due to chronic cerebrovascular accident and spinal cord lesions. Urology 2006; 67(2): 232–236.
12. Krhut J, Samal V, Nemec D, Zvara P. Intradetrusor versus suburothelial onabotulinumtoxinA injections for neurogenic detrusor overactivity: a pilot study. Spinal Cord 2012; 50(12): 904–907.
13. Mangera A, Andersson KE, Apostolidis A, et al. Contemporary management of lower urinary tract disease with botulinum toxin A: a systematic review of botox (onabotulinumtoxinA) and dysport (abobotulinumtoxinA). Eur Urol 2011; 60(4): 784–795.
14. Klein AW. Dilution and storage of botulinum toxin. Dermatol Surg 1998; 24(11): 1179–1180.
15. Coelho A, Cruz F, Cruz CD, Avelino A. Spread of onabotulinumtoxinA after bladder injection. Experimental study using the distribution of cleaved SNAP-25 as the marker of the toxin action. Eur Urol 2012; 61(6): 1178–1184.
16. Krhut J, Zvara P. Intravesical instillation of botulinum toxin A: an in vivo murine study and pilot clinical trial. Int Urol Nephrol 2011; 43(2): 337–343.
17. Grosse J, Kramer G, Stohrer M. Success of repeat detrusor injections of botulinum a toxin in patients with severe neurogenic detrusor overactivity and incontinence. Eur Urol 2005; 47(5): 653–659.
18. Kuo HC. Urodynamic evidence of effectiveness of botulinum A toxin injection in treatment of detrusor overactivity refractory to anticholinergic agents. Urology 2004; 63(5): 868–872.
19. Rapp DE, Lucioni A, Katz EE, et al. Use of botulinum-A toxin for the treatment of refractory overactive bladder symptoms: an initial experience. Urology 2004; 63(6): 1071–1075.
20. Del Popolo G, Filocamo MT, Li Marzi V, et al. Neurogenic detrusor overactivity treated with english botulinum toxin a: 8-year experience of one single centre. Eur Urol 2008; 53(5): 1013–1019.
21. Karsenty, G, Boy, S, Reitz A. Botulinum toxin A (BTA) in the treatment of neurogenic detrusor overactivity incontinence (NDOI): a prospective randomized study to compare 30 vs. 10 injections sites [abstract 93]. Neurourol Urodyn 2005; 24 : 547–548.
Štítky
Detská urológia Nefrológia Urológia
Článok vyšiel v časopiseČeská urologie
Najčítanejšie tento týždeň
2014 Číslo 1- Aktuálne európske odporúčania pre liečbu renálnej koliky v dôsledku urolitiázy
- MUDr. Šimon Kozák: V algeziológii nič nefunguje zázračne cez noc! Je dôležité nechať si poradiť od špecialistov
- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Přínos stanovení [-2]proPSA v diferenciální diagnostice karcinomu prostaty
- Radikální prostatektomie – analýza 191 případů vyšetřovaných metodikou celoplošných řezů (whole-mount section)
- Monitorace ztráty botulinumtoxinu při aplikaci do detruzoru – výsledky pilotní fáze studie
- Benigní schwannom retroperitonea
- Synchronní triplicita urologických malignit
- Solitární metastáza uroteliálního karcinomu do parenchymu ledviny napodobující primární nádor ledviny
- Dlaždicobuněčný karcinom ledvinné pánvičky
- Embolus krevního koagula renální tepny jako příčina infarktu ledviny
- Tumor z Leydigových buněk
- Nádor varlete z Leydigových buněk
- Zahraniční stáž ve švýcarském Luzernu (Clinical Visit)
- Editorial
- Stáž na Urologické klinice Univerzitní nemocnice v Leuvenu
- ESOU 2014
- Soutěž České urologické společnosti ČLS JEP za nejlepší vědecké publikace publikované v roce 2013
- Novelizovaná klasifikace nádorů ledvin 2013 (International Society of Urological Pathology Vancouver Classification of Renal Neoplasia)
- Česká urologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Tumor z Leydigových buněk
- Benigní schwannom retroperitonea
- Nádor varlete z Leydigových buněk
- Embolus krevního koagula renální tepny jako příčina infarktu ledviny
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



