-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Využití multiparametrické magnetické rezonance a srovnání s ostatními moderními zobrazovacími metodami v předoperační diagnostice karcinomu prostaty
Use of multiparametric magnetic resonance imaging and comparison with other modern imaging methods in the preoperative diagnosis of prostate cancer
Magnetic resonance (MR) has long been considered a promising imaging method to assess the localization and local staging of prostate cancer (CP). The aim of this study is to present modern multiparametic MR and other imaging modalities that could lead to improvement in detection and localization of CP. MR of the prostate was introduced into clinical practice in the mid - 1980s. Since then, there have been significant developments to the present multiparametric MR, which includes a combination of anatomical and functional displays as well as metabolic information. MR is helpful in the diagnosis of prostate cancer, particularly in the cases of suspected clinical or laboratory finding which have not been confirmed by prostate biopsies. The other modern imaging methods include prostate transrectal power Doppler sonography with 3D reconstruction (3D-PDS ), transrectal sonography with echocontrast substances (Contrast – Enhanced Ultrasound, CEUS) HistoScanningTM or elastography. Currently, multiparametric MR is considered to be the optimal preoperative imaging method for evaluating localization and local staging of prostate cancer.
Key words:
prostate cancer, magnetic resonance imaging, positron emission tomography, scintigraphy, ultrasonography.
Autori: Olga Dolejšová 1; Viktor Eret 1; Alžběta Šobrová 1; Jiří Ferda 2; Ondřej Hes 3; Milan Hora 1; Jiří Baxa 2
Pôsobisko autorov: Urologická klinika LF UK a FN, Plzeň 1; Klinika zobrazovacích metod FN, Plzeň 2; Šiklův patologicko-anatomický ústav LF UK a FN, Plzeň 3
Vyšlo v časopise: Ces Urol 2014; 18(4): 300-309
Kategória: Přehledový článek
Súhrn
Magnetická rezonance (MR) je dlouho považována za slibnou zobrazovací metodu k posouzení lokalizace a lokálního stagingu karcinomu prostaty (KP). Cílem práce je prezentovat moderní multiparametickou MR a ostatní zobrazovací metody, které by mohli zlepšit detekci a lokalizaci KP. MR prostaty byla zavedena do klinické praxe v polovině osmdesátých let 20. století. Od té doby prošla značným vývojem až k nynější multiparametické MR prostaty, která zahrnuje kombinaci anatomického zobrazení a funkčních a metabolických informací. MR je přínosem v diagnostice karcinomu prostaty zejména v případě suspektního klinického či laboratorního nálezu, který není potvrzen předchozí biopsií prostaty. K ostatní moderním zobrazovacím metodám prostaty patří transrektální powerDoppler sonografie s 3D rekonstrukcí (3D-PDS), transrektální sonografie s podáním echokontrastní látky (Contrast-Enhanced Ultrasound – CEUS), HistoScanningTM či elastografie.
Klíčová slova:
karcinom prostaty, magnetická rezonance, pozitronová emisní tomografie, scintigrafie, ultrasonografie.ÚVOD
Karcinom prostaty (KP) je celosvětově druhým nejčastějším maligním onemocněním mužské populace. V České republice je karcinom prostaty (incidence v roce 2010 : 131/100 000, www.uzis.cz) nejčastějším nádorem u mužů od roku 2005 (s výjimkou dia-gnózy. C44 – „jiný zhoubný novotvar kůže“) a druhou nejčastější nádorovou příčinou úmrtí (v roce 2010 26,1/100 000, www.uzis.cz). Zatímco incidence zaznamenává trvalý vzestup, mortalita zůstává dlouhodobě na stejné úrovni. Karcinom prostaty není biologicky jednotné onemocnění, ale představuje řadu variant od agresivních po pomalu rostoucí tumory. Pouze histologická verifikace je jednoznačným potvrzením karcinomu prostaty, na jejím základě lze pacienta indikovat k léčbě. Rozhodnutí o způsobu léčby je souhrnem více faktorů (pravděpodobná délka života nemocného na základě jeho věku a zdravotního stavu, predikce biologické agresivity karcinomu, rozsah onemocnění v době diagnózy).
Diagnostické algoritmy u karcinomu prostaty se zaměřují na detekci přítomnosti nádoru, ohodnocení agresivity nádorového onemocnění, ale také na lokalizaci nádoru v prostatě a hodnocení vývoje onemocnění a odpovědi na léčbu. Největší pozornost je v současné době zaměřena na možnosti využití zobrazovacích metod a zejména multiparametické magnetické rezonance (mpMR) k posouzení lokalizace a lokálního stagingu KP i k odlišení lokalizovaného od lokálně pokročilého onemocnění. Multiparametrická magnetická rezonance je grafické vyšetření, které v sobě zahrnuje informace jak o anatomickém zobrazení tkáně, tak informace funkční a metabolické. Anatomii prostaty nejlépe posoudí T1a T2 vážené zobrazení, funkční informace přináší dynamické kontrastní zobrazení (Dynamic Contrast-Enhanced – DCE) a difuzně vážené zobrazení (Diffusion Weighted Imagining – DWI). MR spektroskopie pak hodnotí metabolismus prostatické tkáně.
METODY
Multiparametrická magnetická rezonance (mpMR)
Magnetická rezonance (MR) k vyšetření prostaty byla zavedena do klinické praxe v roce 1984, na počátku se jednalo pouze anatomické zobrazení tkáně. Postupně prošla magnetická rezonance značným vývojem až k nynější multiparametické MR prostaty, která zahrnuje jak anatomické zobrazení (T1a T2 vážený obraz), tak funkční a metabolické informace (dynamické kontrastní zobrazení, difuzně vážené zobrazení, spektroskopické zobrazení).
Jednotlivé části multiparametrického vyšetření budou rozvedeny níže. Absolutní kontraindikací MR vyšetření je kardiostimulátor, kochleární implantát nebo přítomnost kovových svorek intrakraniálně. Mezi relativní kontraindikace patří klaustrofobie a přítomnost kovových kloubních náhrad, nejmodernější náhrady však již nejsou absolutní kontraindikací k provedení MR, individuální riziko musí vždy posoudit vyšetřující lékař – radiolog (1). V současné době je mpMR považována za nejpřínosnější metodu k posouzení lokálního rozsahu karcinomu prostaty (2, 3). V České republice je zatím šířeji dostupné vyšetření silou pole 1,5T. Nověji je již k dispozici MR s intenzitou pole 3T, která umožňuje rychlejší vyšetření nemocného, dosahuje lepšího poměru signál/šum, a tedy i lepší rozlišovací schopnosti zlepšující kvalitu zobrazení. Výhodou magnetické rezonance ve srovnání s ostatními zobrazovacími metodami je její schopnost zobrazit zonální anatomii prostaty. Zavedení endorektálních cívek do vyšetřovacích postupů zvýšilo invazivitu vyšetření, ale umožnilo provedení MR vyšetření s vysokým rozlišením a konstrukci 3D protonového MR spektroskopického obrazu a možnost zkrácení vyšetřovací doby. Se zvýšením kvality rozlišení byly postupně vyzkoušeny povrchové cívky a byla dokázána shodná endorektálními cívkami. Někteří autoři však doporučují použití povrchové cívky pro detekci a lokalizaci KP, ale endorektální cívky pro staging KP. Díky svému prostorovému a kontrastnímu rozlišení se magnetická rezonance může uplatnit při lokálním stagingu karcinomu prostaty. PI-RADS (Prostate Imagining-Reporting and Data Systém) je skórovací systém vyjadřující pravděpodobnost postižení prostaty klinicky signifikantním tumorem. PI-RADS 1 a 2 znamená velmi málo a málo pravděpodobný klinicky signifikantní karcinom prostaty, PI-RADS 3 suspektní klinicky signifikantní karcinom prostaty a PI-RADS 4 a 5 pravděpodobný a velmi pravděpodobný klinicky signifikantní karcinom prostaty. Každý parametr z multiparametrického hodnocení (T2WI tranzitorní a periferní zóny, DWI a DCE) má skóre 1–5, maximálně tedy 20 bodů. Jedná se konsen-zuální klasifikaci společností American College of Radiology a European Society of Urogenital Radiology (4). Výhodou mpMR v porovnání se standardní systematickou biopsií prostaty je vyšší četnost pozitivních biopsií a vyšší záchyt klinicky signifikantních karcinomů prostaty (5–7).
Anatomické zobrazení (T 1 a T2 vážený obraz)
Při T1 vážených obrazech vykazují prostata, semenné váčky a periprostatické vény nízký signál a vypadají uniformě. Vnitřní architektonika žlázy není patrná. Na rozdíl od těchto struktur je intenzita periprostatického tuku vysoká. Tuk kromě prostaty rovněž ostře lemuje měkké tkáně pánve – nervy, svaly, cévy a lymfatika. V T1 vážených obrazech jsou zpravidla dobře patrné neurovaskulární posterolaterální svazky. Zobrazení nervově cévních svazků je významné pro předoperační rozhodování v případě nervy šetřícího výkonu. V T1 vážených obrazech jsou rovněž dobře patrné jednotlivé fasciální vrstvy obklopující prostatu. V T2 vážených obrazech je nejlépe patrná normální zonální anatomie prostaty a semenných váčků. Periferní zóna a semenné váčky vykazují vysokou intenzitu signálu, proti tomu centrální a přechodná zóna mají nízkou intenzitu. Karcinom prostaty se obvykle zobrazuje jako abnormální oblast o nízké signální intenzitě uvnitř homogenní hypersignální periferní zóny (8) (obr. 1). Sníženi signálu v T2 vážených obrazech je nespecifické, v diferenciální diagnóze přichází v úvahu zánětlivá infiltrace, fibrózní přestavba, postbioptická hemoragie, změny po radioterapii a hormonální léčbě (9). MR zobrazení zejména v kombinaci s MR spektroskopií lze využít i k detekci tumorů v tranzitorní zóně prostaty, a to zvláště u nemocných po opakovaných mnohočetných biopsiích s narůstající hodnotou PSA. Mezi nálezy podporující diagnózu karcinomu tranzitorní zóny patří nález homogenní oblasti o nízké signální intenzitě v přechodné zóně, špatně ohraničené okraje léze, ztráta nízkosignálního prstence, který je spojen s benigním hyperplastickým uzlem, přerušení chirurgického pouzdra prostaty, lentikulární tvar léze. Postbioptická hemoragie v prostatě může výrazně ovlivnit, a to jak nadhodnotit, tak i podhodnotit, detekci tumoru prostaty i extrakapsulární propagaci při MR vyšetření. Minimální doporučená doba mezi biopsií prostaty a MR vyšetřením je kolem 3–4 týdnů, pokud byl odebrán větší počet bioptických vzorků, je doporučený interval prodloužen až na 6–8 týdnů. Dle MR doporučení evropské společnosti pro urogenitální radiologii European Society for Urogenital Radiology (ESUR by měla být časová prodleva mezi biopsií a vlastním vyšetřením alespoň 4–6 týdnů (10).
Obr. 1. T2 vážené zobrazení – hypointenzivní ložiska tumoru (bílé šipky) Fig. 1. Hypo-intense tumor regions of the both lobes of the prostate (white arrows) in T2 weighted MRI 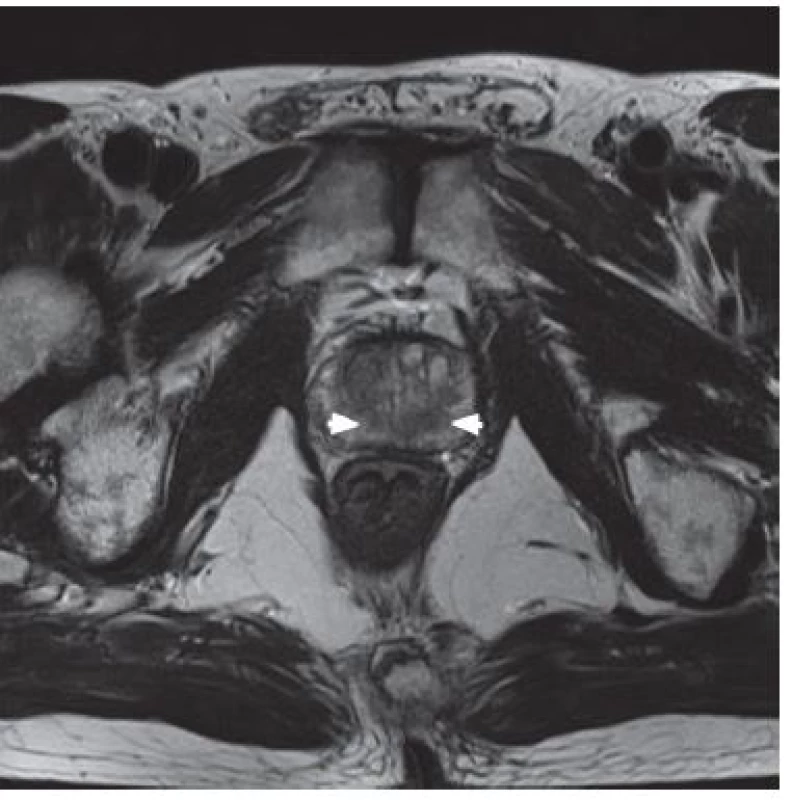
MR zobrazení je rovněž využíváno k posouzení extrakapsulární propagace tumoru a posouzení invaze do semenných váčků (1, 8, 11, 12). Kritéria pro extrakapsulární propagaci zahrnují asymetrii posterolaterálních nervově cévních svazků, nepravidelnou konturu okraje prostaty, obliteraci rektoprostatického úhlu, retrakci kapsuly. Při infiltraci fibrózní kapsuly na povrchu prostaty dochází ke zvýšení jejího jinak normálně nízkého signálu. K posouzení extrakapsulární propagace jsou nezbytné transverzální řezy a ideální je jejich kombinace s koronárními řezy, sagitální zobrazení usnadňuje identifikaci ložisek v apexu a bázi prostaty. Podezření na invazi do semenných váčků podporuje nález ztráty normální architektoniky semenných váčků, nález ložisek o nízké signální intenzitě v semenných váčcích, nález rozšířených, zvětšených ejakulatorních duktů a rozšíření semenných váčků o nízké signální intenzitě, obliteraci úhlu mezi prostatou a semennými váčky, nález přímé propagace tumoru z báze přímo do či podél semenných váčků. Dobré zobrazení semenných váčků poskytují sekvence s potlačením tuku. Kombinace transverzálních, koronálních a sagitálních řezů usnadňuje zhodnocení invaze do semenných váčků a hrdla močového měchýře. Senzitivita MR pro detekci extrakapsulárního šíření je uváděna mezi 13–95 %, specificita 49–97 %, pro detekci invaze do semenných váčků senzitivita 23–80 %, specificita 81–99 % (13). Velké rozpětí specificity a senzitivity je ovlivněno zkušenostmi popisujících radiologů a rovněž postupným zdokonalováním technologie magnetické rezonance a počítačového zpracování. Přesnost (accuracy) u MR je uváděna mezi 54–93 % (14). Při posouzení lymfatických uzlin nepřináší klasické MR zobrazení žádné výhody oproti CT vyšetření.
MR spektroskopie (MRS)
Rozdíl mezi protonovou MRS a konvenční magnetickou rezonancí (MR) spočívá v tom, že zatímco v případě MRI se detailní anatomické zobrazení tkáně získává především zpracováním signálu vody a lipidů, MRS tyto signály naopak potlačuje. MRS využívá silné magnetické pole k získání informací o metabolismu (spektru), které určuje relativní koncentrace různých metabolitů v buňce, cytoplazmě a mezibuněčném prostoru. Tato technika může identifikovat rozdíly v metabolismu tkáně prostaty při benigní hyperplazii prostaty, normální tkáni prostaty nebo karcinomu prostaty. V normální tkáni prostaty dochází k syntéze a hromadění citrátu. U karcinomu se množství citrátu snižuje a u špatně diferencovaných nádorů citrát prakticky chybí (15). Současně v nádorech dochází k elevaci cholinu, který je normální součástí fosfolipidů buněčných membrán a jeho hladina se zvyšuje v jakékoliv proliferující tkáni. U nádorů prostaty se zvyšuje poměr cholin/citrát (resp. cholin + kreatin/citrát) (9, 14) (obr. 2). Přidání MR spektroskopie ke konvenční MR signifikantně zvyšuje možnost záchytu karcinomu mimo periferní zónu. Magnetická rezonance a MR spektroskopie mohou zlepšit detekci nádorů prostaty u pacientů po biopsii prostaty s opakovaným negativním histologickým nálezem při přetrvávající elevaci PSA. U rizikových nemocných s prokázaným karcinomem prostaty může kombinace MR a MRS zpřesnit staging onemocnění s ohledem na rozlišení kategorie T2 a T3 a stanovit přesný terapeutický postup (1, 8, 16). V diagnostice extrakapsulárního šíření kombinace MR a MRS vykazuje i u méně zkušených radiologů větší přesnost při popisu snímků. Při srovnávacích studiích MRS zobrazení s histologickým vyšetřením preparátů prostaty bylo zjištěno, že MRS zobrazení koresponduje s hodnocením Gleasonova gradu, MRS tedy do určité míry koresponduje s agresivitou tumoru (1, 3, 9, 17). Kombinace MR a MRS je využívána ke zhodnocení high-risk karcinomů, ale je rovněž užitečná k potvrzení low-risk karcinomů, a umožňuje tak zvážení méně agresivních terapeutických postupů u nízce rizikového karcinomu. Kombinace obou metod (MR a MRS) umožňuje vytipování podezřelých ložisek před cílenou biopsií u pacientů s negativním nálezem předchozí systematické biopsie prostaty, kteří mají elevaci PSA, eventuálně současně s nepříznivým index free/total PSA (11, 12, 18–20).
Obr. 2. MR spektroskopie – elevace hladiny cholinu a pokles citrátu v levém laloku prostaty Fig. 2. MRI spectroscopy – elevation of choline level with a decrease in citrate level is the spectral signature of prostate cancer in the left lobe 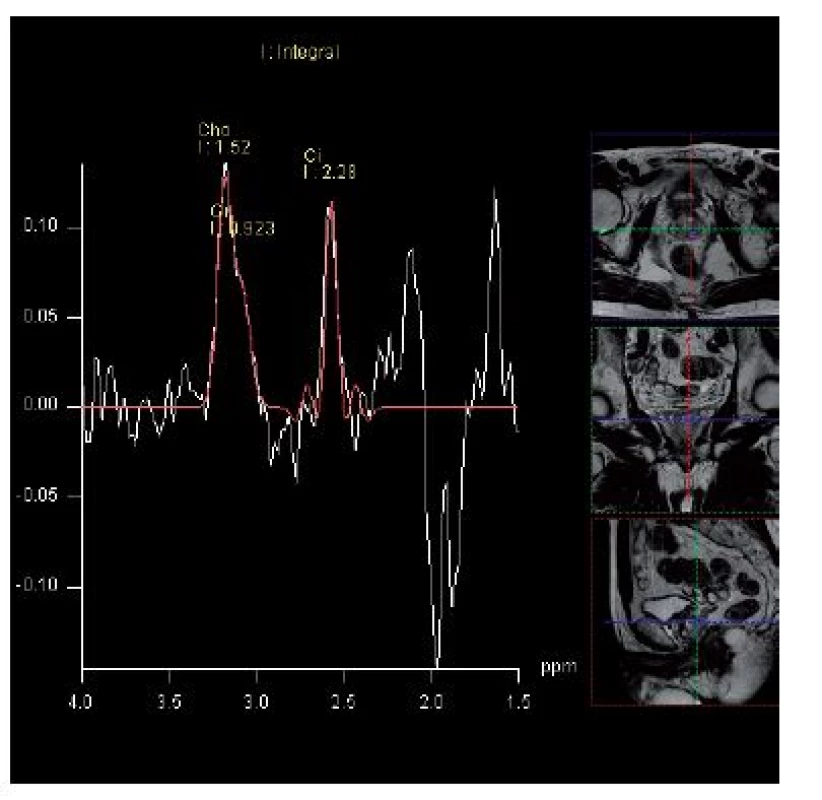
Dynamické kontrastní MR zobrazení (Dynamic Contrast-Enhanced MR Imagining – DCE-MRI)
Podobně jako většina ostatních tumorů i prostatický karcinom indukuje angiogenezi a toho lze využít k případné detekci ložiska karcinomu. Normální prostata je vaskularizovaný orgán a k zobrazení neovaskularizace v prostatě je nutná rychlá aplikace kontrastní látky ve formě bolusu a i rychlá sekvence zobrazení. Jako kontrastní látka se při MR používá gadolinium. Karcinom se zobrazuje jako kontrastní zesílení (enhancement) zobrazující se časněji oproti zbytku žlázy a rovněž časným snížením intenzity signálu oproti zdravé tkáni. Mapy farmakodynamických parametrů pomáhají identifikovat v prostatické tkáni oblasti hypervaskularizace. Ty, ve kterých je rychlejší přestup kontrastní látky do intersticia (tzv. wash-in) a kde je její rychlejší eliminace zpět do krevního oběhu (tzv. wash-out). Tyto mapy jsou tedy dobrým vodítkem k tomu, aby bylo možné hodnotit křivku sycení tkáně v oblasti zájmu. Samotné hodnocení charakteru křivky má význačné postavení v odlišení hypervaskularizace z neovaskularizace u karcinomu od uzlovitých vaskularizovaných ložisek adenomyomatózní hyperplazie. Senzitivita dynamického kontrastního vyšetření je uváděna kolem 73 % a specificita kolem 81 %. Kombinace dynamického kontrastního vyšetření a MRS může být nápomocná v detekci karcinomu prostaty, kde zobrazení v T2 vážených obrazech není jednoznačné (9, 11, 12, 21) (obr. 3).
Obr. 3. Dynamické kontrastní zobrazení – hypervaskularizace v periferní zóně (bílé šipky) Fig. 3. Dynamic contrast enhancement – colour map of the flow volume shows areas of a higher wash-in rate (hypervascularization) in the dorsal peripheral zone (white arrows) than in other areas 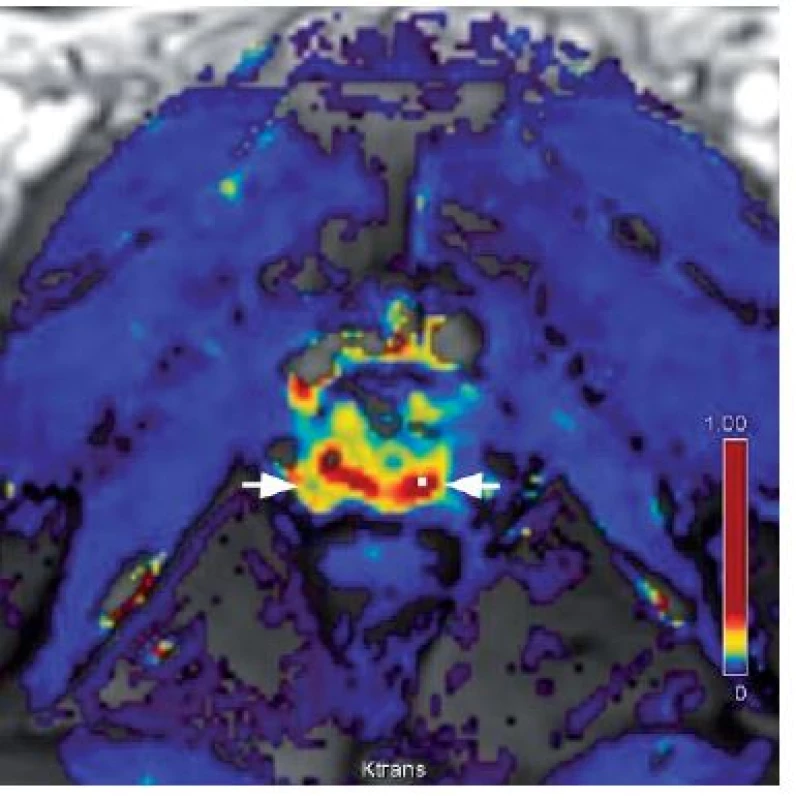
Difuzně vážené zobrazení (Diffusion Weighted Imagining – DWI)
Difuzně vážené zobrazení (DWI) je založeno na zachycení difuze vody ve zkoumané tkáni. U tumorózní infiltrace dochází k restrikci difuze extracelulární vody v porovnání s normální tkání. Výhodou difuzně váženého zobrazení je krátká akvizice (cca 1,5 minuty) a vysoký kontrast mezi normální tkání a nádorem (1, 8). V důsledku restrikce difuze extracelulární vody při infiltraci žlázy hypercelulárním nádorem dochází ke snížení normálně vysokého signálu v ADC (Apparent Diffusion Coeficient) mapách (18). Přidáním DWI k T2 váženým obrazům a MRS vede ke zvýšení specificity a senzitivity záchytu karcinomu prostaty, rovněž kombinace T2 vážených obrazů a DWI vede ke zvýšení specificity v predikci rekurence po kurativní radioterapii. Dostupné studie ukazují zvýšení specificity a senzitivity DWI s využitím moderních 3T přístrojů jak u tumorů periferní, tak i tranzitorní zóny dosažením lepšího poměru signál – šum (9, 11, 12, 16).
Ultrasonografické vyšetřovací metody
Většina karcinomů prostaty se zobrazuje jako hypoechogenní ložisko ve srovnání s normální prostatickou tkání (13, 23). Lze zde více či méně dohledat i fokální zvýšení perfuze barevným dopplerovským vyšetřením. Zvýšená perfuze je projevem neovaskularizace u rychle rostoucí tkáně. Snížená echogenita ložisek karcinomu je způsobena vysoce buněčnou hmotou nádoru s malými mezibuněčnými prostory, které tvoří malé vnitřní echo. Kolem 30 % karcinomů není sonograficky identifikovatelných, protože jsou tzv. izoechogenní, nejčastěji se jedná o malé a často roztroušené karcinomy v centrální a přechodné zóně. Hypoechogenní ložiskové léze prostaty nejsou specifické pouze pro obraz karcinomu prostaty. Pozitivní histologický nález karcinomu u hypoechogenních ložisek se pohybuje v rozmezí 60–97 %. Benigní hypoechogenní ložiska mohou být způsobena atypickými uzly hyperplastické tkáně prostaty, akutní i chronickou prostatitidou, atrofií, jizvou nebo infarktem prostaty, ale i organizovaným koagulem po předchozí biopsii (13, 24). K moderním sonografickým zobrazovacím metodám prostaty patří transrektální powerDoppler sonografie s 3D rekonstrukcí (3D-PDS), transrektální sonografie s podáním echokontrastní látky (Contrast-Enhanced Ultrasound, CEUS), Elastografie a HistoScanningTM.
K diagnostice extraprostatického rozsahu onemocnění lze použít dopplerovskou sonografii a zejména powerDoppler sonografii s 3D rekonstrukcí (3D-PDS). Využití powerDopplerovského mapování, které je citlivé na zobrazení pomalých toků při absenci orien-tace toku, se zdá být největším přínosem při posouzení extraprostatického šíření (Extracapsular Extension – ECE). 3D rekonstrukce nám dává možnost snadnějšího vyhodnocení ECE v jinak hůře dostupných rovinách, ve studiích bylo dosaženo pomocí vyšetření 3D-PDS senzitivity stanovení ECE 59,3 %, specificity 94,4 % (15, 25).
Další možností jak zlepšit sonografické zobrazení prostaty je použití echokontrastních látek (Contrast-Enhanced Ultrasound – CEUS). Amplitudu dopplerovského signálu, a tím i poměr signál/šum lze zvýšit intravenózně aplikovanými ultrazvukovými kontrastními látkami, které zvyšují echogenitu proudící krve. Jedná se o plynové mikrobubliny vpravené do krevního oběhu. Podmínkou je, aby velikost těchto mikrobublin (1–10 µm) umožňovala jejich průchod plicními kapilárami a byly v krevním oběhu dostatečně stabilní. Růst prostatického karcinomu indukuje neovaskularizaci a CEUS metoda využívá zobrazení zvýšené vaskularizace nádorové tkáně (9, 13, 25). Senzitivita ani specificita vyšetření nedosahuje takových hodnot, aby mohla jednoznačně nahradit systematickou biopsii prostaty. Použití CEUS v cílené biopsii prostaty detekuje signifikantně více karcinomů při menším počtu vzorků než cílená biopsie vedená pod klasickou sonografickou kontrolou (9, 13).
Elastografie vychází ze skutečnosti, že patologické změny tkáně se projeví změněnými mechanickými vlastnostmi, především změnou tuhosti. Používají se dvě elastografické metody: kvazistatická (quasi-static) a s tzv. příčnou vlnou (shear-wave elastografie – SWE). První vyžaduje transrektální kompresi a dekompresi prostaty s následným vyhodnocením tuhosti tkáně, druhá nevyžaduje kompresi prostaty a je založena na měření rychlosti příčné vlny šířící se prostatickou tkání a umožňuje přesnější kvantifikaci stupně elasticity/odporu pomocí zobrazení vypočtených tlaků. Maligní ložiska vykazují ve většině případů větší tuhost než ložiska benigní nebo zdravé tkáně. Metoda poskytuje rekonstrukci vnitřní struktury měkkých tkání na základě měření odpovědi na silové působení (komprese) vykonávané na povrch těla. Tyto vlastnosti závisejí na molekulových vazbách jednotlivých součástí tkání (tuk, kolagen) a na jejich mikroskopické i makroskopické organizaci. Tkáně navíc vykazují vedle základních vlastností – pevnosti a pružnosti – též viskoelastické a poroelastické vlastnosti. Zobrazení elastických vlastností tkání probíhá ve dvou krocích: V prvém kroku je rozsah posunu tkání zjišťován pomocí ultrazvukových signálů odražených z vyšetřované oblasti před a po kompresi, ve druhém kroku je rekonstruováno zobrazení uskutečněného posunu jednotlivých tkáňových struktur podle jejich mechanických vlastností a kódováno barevně. Prostata je transrektálně komprimována a odlišnosti v odporu tkáně jsou využívány k lokalizaci intraprostatických lézí (9, 25). Pozitivní elastografické nálezy lze zaznamenat u všech stupňů (grade) karcinomu, senzitivita vyšetření se pohybuje mezi 75–87 %, specificita mezi 75–92 % (9, 11). Specificita vyšetření se zvyšuje s velikostí ložiska karcinomu, vyšší specificita je dosahována u tumorů větších než 5 mm (9). MR elastografie je zatím méně rozšířenou variantou zobrazení elasticity tkání, podobně jako u ultrazvukové elastografie se zde hodnotí rychlost šíření mechanické vlny.
HistoScanningTM je sonografickou metodou využívající matematické počítačem řízené metody k vyhodnocení tkáně prostaty. Umožňuje mapování prostatické tkáně a identifikaci maligních ložisek. Vychází z předpokladu, že malignita indukuje dezorganizaci tkáně (9, 26). Matematické zpracování ultrazvukového signálu nabízí podrobnou 3D analýzu celého objemu prostaty. Senzitivita u ložisek velikosti 0,5 cm3 a větších byla uváděna v úvodních pracích až 100%, ve větších souborech pacientů je uváděna kolem 70 %. V současnosti je již možné provedení histoscanningu a biopsie prostaty v reálném čase (25, 27, 28).
Využití počítačové tomografie a hybridních metod
Výpočetní tomografie (CT) není schopna zobrazit zonální anatomii prostaty a pro svou nízkou senzitivitu a specificitu není indikována pro staging karcinomu prostaty. Na CT nelze tumor rostoucí v prostatické žláze diferencovat. CT umožňuje zobrazení pánevní lymfadenopatie a vzdálených uzlinových metastáz, tedy detekci až pokročilého nádorového onemocnění. Uváděná senzitivita CT pro detekci uzlinových metastáz je velmi variabilní, ale v průměru kolísá kolem 36 % (9, 13, 22).
PET /CT vyšetření využívá kombinace metody PET (pozitronová emisní tomografie) a počítačové tomografie. Vyšetření s použitím 18-FDG není obecně u vyšetření prostaty indikováno pro nízký uptake v tumoru, použitelná jsou radiofarmaka (RF) jako 11C acetát či ostatní RF spojená s lipidovým metabolismem (11C - a 18F-cholin, 11C-methionin) či 18F fluorid (NaF), fluorodihydrotestosteron (9, 13, 29, 30). PET s 11C-cholinem nebo acetátem se zdá slibná pro zhodnocení postižení lymfatických uzlin v rámci iniciálního stagingu (31). U intraprostatického tumoru je v literatuře srovnávána PET/CT, MR a MRS (spektroskopie) senzitivita je 55%, resp. 54%, resp. 81%, specificita 86%, resp. 75%, resp. 67%. Výhodou PET a PET/CT je oproti MR/MRS celotělové snímání. Nevýhodou použití 11C je krátký poločas rozpadu – kolem 20 minut, který vyžaduje rychlou aplikaci a tedy dostupnost cyklotronu v blízkosti vyšetřujícího pracoviště (3, 32, 33). Z fúzních vyšetření je možné v diagnostice karcinomu prostaty rovněž využít k zpřesnění cílené biopsie fúzi US/MR.
Diagnostika kostních metastáz u KP
Standardně prováděná scintigrafie skeletu s 99mTc MDP je základním vyšetřením s širokou dostupností. Dle současných doporučení není indikována u asymptomatických nemocných s hladinou PSA pod 20 ng/ml. V porovnání s konvenčními RTG snímky je kostní scintigrafie o 28 % citlivější v záchytu kostních metastáz. Nejčastějším nálezem je zvýšené vychytávání traceru v místě osteoblastické odpovědi kosti na tumorózní invazi, méně častým nálezem je naopak snížené vychytávání v místech extenzivní destrukce kosti s malou osteoblastickou odpovědí. Alternativou scintigrafie je vyšetření PET, resp. PET/CT s užitím 18NaF. PETs NaF vykazuje ve srovnání s klasickou scintigrafií skeletu vyšší senzitivitu, ale obdobně jako scintigrafie skeletu nízkou specificitu. Specificita metody se zvyšuje při duálním zobrazení PET/CT. Problémem je jak vysoká ra-diační zátěž, tak vyšší cena vyšetření (14, 30, 34). Proto je vyšetření doporučováno jen u vysoce rizikových pacientů, zejména po prostatektomii se zvýšenou hladinou PSA nad 10 ng/ml a negativní scintigrafií. MR zobrazení vykazuje jak větší specificitu, tak senzitivitu v diagnostice kostních metastáz. Malá metastatická ložiska v kostech a kostní metastázy nezasahující do cortikalis jsou dříve detekovatelná při MR než při scintigrafickém vyšetření skeletu, ale ani MR zobrazení není zcela specifické. Podobnou intenzitu signálu mohou vykazovat ložiska zánětu, infarktu a posttraumatické kostní změny. Přestože celotělové MR zobrazení dosahuje lepší senzitivity a specificity, celotělová scintigrafie zatím zůstává i dle posledních EAU guidelines zlatým standardem.
ZÁVĚR
Využití zobrazovacích metod přináší zpřesnění jak při stanovení diagnózy karcinomu prostaty, tak i v určení rozsahu onemocnění, který má zásadní význam pro vhodnou strategii léčby konkrétního nemocného. Základním vyšetřením zůstává digitální rektální vyšetření (DRE), hladina PSA a bioptická verifikace karcinomu. Nevýhodou bránící rutinnímu použití multiparametrické magnetické rezonance v diagnostice karcinomu prostaty je stále relativně vysoká cena vyšetření a omezená dostupnost zejména 3T MR vyšetření. V současné době nalézá multiparametrická magnetická retence uplatnění zejména tam, kde standardní biopsií prostaty nebyl karcinom prostaty zastižen a na základě laboratorních a klinických nálezů trvá podezření na jeho přítomnost. U Gleasonova skóre 7 a ložisek větších jak 0,5 ml může magnetická rezonance detekovat až 97 % tumorů, v případě Gleasonova skóre vyššího než 7 je dektekce 93–100% (35). Z dalších modernějších zobrazovacích metod lze uvážit cholin PET/CT, které je využíváno především pro posouzení metastatického postižení a sledování nemocných po primární léčbě, ale žádná zobrazovací metoda zatím není schopna nahradit extenzivní pánevní lymfadenektomii. Celotělová magnetická rezonance vykazuje větší senzitivitu a specificitu než celotělová scintigrafie skeletu, která ale zůstává standardem. Širšímu rozšíření celotělové magnetické rezonance brání její dostupnost a cena vyšetření.
Došlo: 16. 9. 2014.
Přijato: 22. 10. 2014.
Kontaktní adresa
MUDr. Olga Dolejšová
Urologická klinika FN
Dr. E. Beneše 13, 305 99 Plzeň
e-mail: dolejsovao@fnplzen.cz
Střet zájmů: žádný.
Podpořeno MZ ČR – RVO (Fakultní nemocnice Plzeň – FNPl, 00669806).
Zdroje
1. Bárta J, Ryznarová Z, Klezl P, Záťura F, Adamová M, Kašpar M, Novák J. Postavení magnetické rezonance a magnetické rezonanční spektroskopie při detekci karcinomu prostaty. Čes Urol 2010; 14(3): 186–196.
2. Dvořáček J, Babjuk M, et al. Uroonkologie, 1. vydání. Praha: Galén 2005; 285–294.
3. Hersh MR, Knapp EL, Choi J. Newer Imaging Modalities to Assess Tumor in the Prostate. Cancer Control 2004; 11(6): 353–357.
4. Barentsz JO, Ruchenberg J, Clements R., Choyke P, Verma S, et al. ESUR prostate MR guidelines 2012. Eur Radiol 2012; 22 : 746–757.
5. Hoeks CM, Schouten MG, Bomers JG, et al. Three-Tesla magnetic resonance-guided prostate biopsy in men with increased prostate-specific antigen and repeated, negative, random, systematic, transrectal ultrasound biopsies: detection of clinically significant prostate cancers. Eur Urol 2012; 62(5): 902–909.
6. Habchi H, Bratan F, Paye A, et al. Value of prostate multiparametric magnetic resonance imaging for predicting biopsy results in first or repeat biopsy. Clin Radiol 2014; 69(3): 120–128.
7. Portalez D, Rollin G, Leandri P, et al. Prospective comparison of T2w-MRI and dynamic-contrastenhanced MRI, 3D-MR spectroscopic imaging or diffusion-weighted MRI in repeat TRUS-guided biopsies. Eur Radiol 2010; 20(12): 2781–2790.
8. Verma S, Rajesh A. A Clinically Relevant Approach to Imaging Prostate Cancer. AJR 2011; 196(3 Suppl): S1–S10.
9. Hou H, Swanson D, Barqawi AB. Modalities for Imaging of Prostate Cancer. Advances in Urology 2009; 1–12 Article ID 818065.
10. Barentsz JO, et al. ESUR prostate MR guidelines 2012. Eur Radiol 2012; 22 : 746–757.
11. Pinto F, Totaro A, Calarco A, Sacco E, et al. Imagining in Prostate cancer Diagnosis: Present Role and Future Perspectives. Urol Int 2011; 86 : 373–382.
12. Ferda J, Hora M, Hes O, Kastner J, Ferdova E, Mírka H, Baxa J, Heidenreich F, Fínek J, Kreuzberg B. Zobrazení prostaty na 3T MRI u nemocných se zvýšenou hladinou PSA. Ces Radiol 2012; 66(1): 9–17.
13. Hricak H, Choyke PL, Eberhardt SC, Leibel SA, Scardino PT. Imaging Prostate Cancer: A Multidisciplinary Perspective. Radiology 2007; 243(1): 28–53.
14. Ferda J, Kastner J, Ferdová E, Mírka H, Hora M, Hes O, Fínek J, Kreuzberg B. Zobrazení karcinomu prostaty na molekulární úrovni – naše zkušenosti. Ces Radiol 2012; 66(3): 289–295.
15. Záleský M, Urban M, Šmerhovský Z, Zachoval R, Lukeš M, Heráček J. Význam powerdoppler sonografie s 3D rekonstrukcí v předoperační diagnostice extraprostatického rozsahu tumoru u klinicky lokalizovaného karcinomu prostaty. Ces Urol 2006; 10(3): 10–17.
16. Naiki T, Okamura T, Nagata D, Mori Y, Kawai N, Ogawa K, Akita H, Hashimoto Y, Tozawa K, Khori K. Preoparative prediction of neurovacular bundle ivolevement of localized prostate cancer by combined T2 and diffusion – weighted omaginong of magnetic resonance imagining, number of positive bopsy cores, and Gleason score, Asian Pac J Canecr Prev 2011; 12(4): 909–913.
17. Turkbey B, Mani H, Aras O, Rastinehad AR, et al. Correlation of Magnetic Resonance Imaging Tumor Volume with Histopathology. J Urol 2012; 188 : 1157–1163.
18. Matějková M, Frydrych J, Všetička J. Role magnetické rezonanční spektroskopie v algoritmu vyšetření rebiopsie prostaty. Urol pro praxi 2012; 13(2): 85–87.
19. Moore CM, Robertson NL, Arsanious N, Middleton T, Villers A, Klotz L, Taneja SS, Emberton M. Omage-guided prostate biopsy usong magnetic resonance imagining-derived tergets: a systematic review. Eur Urol 2013; 63(1): 125–140.
20. Ouzzane A, Puech P, Lemaitre L, Leroy X, Nevoux P, Betrouni N, Haber GP, Villers A. Combined multiparametric MRI and targeted biopsies improve anterior prostate cancer detection, staging, and grading. Urology 2011; 78(6): 1356–1362.
21. Hara N, Okuizumi M, Koike H, Kawaguchi M, Bilim V. Dynamic Contrast-Enhanced Magnetic Rseonance Imagining (DCE-MRI) is a useful modality for the precise detection and staging of early prostate cancer. The Prostate 2005; 62 : 140–147.
22. Ryznarová Z, Horák M, Dvořák J, Mašek M, Adamová M, Kašpar M. Význam magnetické rezonance v diagnostice karcinomu prostaty a první zkušenosti s využitím MR spektroskopie. Ces Radiol 2009; 63(1): 80–88.
23. Kotulánová E. Ultrasonografie prostaty, semenných váčků a močového měchýře. Urol List 2006; 4(2): 18–21.
24. Čermák A, Pacík D. Diagnostika karcinomu prostaty – současné možnosti a limitace transrektální ultrazvukem vedené biopsie prostaty. Urol pro praxi 2002; 4 : 142–149.
25. Kaplan O, Belej K, Kőhler O. Současné trendy diagnostiky karcinomu prostaty. Onkologie 2010; 4(2): 68–71.
26. Braeckman J, Autier P, Garbar Ch, Pipeleers M, et al. Computer-aided ultrasonography (HistoScanning): a novel technology for locating and characterizing prostate cancer. BJU International 2007; 101 : 293–298.
27. Simmons LAM, Autier, P, Záťura, Braeckman J, Peltier A, Romic I, Stenzl A, Treurnicht K, Walker T, Nir, D, Moore CM, Emberton M. Detection, localisation and characterisation of prostate cancer by Prostate HistoScanning™. BJU International 2012; 110 : 28–35.
28. Ferrari FS, Scorzelli A, Megliola A, Drudi FM, Trovarelli S, Ponchietti R. Real time elastography in the diagnosis of prostate tumor. Journal of Ultrasound 2009; 12 : 22–31.
29. Jadvar H. Prostate cancer: PET with 18F-FDG, 18F - or 11C-acetate, and 18F - or 11C-choline. J Nucl Med 2011; 52(1): 81–89.
30. Schöder H, Larson SM. Positron emission tomography for prostate, bladder, and renal cancer. Semin Nucl Med 2004; 34(4): 274–292.
31. Umbehr MH, Muntener M, Hany T, Sulser T, Bachmann LM. The role of 11C-choline and 18F-fluorocholine positron emission tomography (pet) and pet/ct in prostate cancer: A Systematic Review and Meta-analysis. Eur Urol 2013; 64 : 106–117.
32. Gutman F, Aflalo-Hazan V, Kerrou K, Montravers F, Grahek D, Talbot JN. 18F-choline PET/CT for initial staging of advanced prostate cancer. AJR 2006; 187(6): 618–621.
33. Schwarzenböck S, Souvatzoglou M, Krause BJ. Choline PET and PET/CT in primary diagnosisi and staging of prostate cancer. Theranostics 2012; 2(3): 318–330.
34. Ferdová E, Ferda J, Matějka MV, Fínek J. Zobrazení kostních metastáz pomocí 18F-NaF-PET/CT. Ces Radiol 2011; 65(1): 51–60.
35. Bratan F, et al. Influence of imaging and histological factors on prostate cancer detection and localisation on multiparametric MRI: a prospective study. Eur Radiol 2013; 23(7): 2019–2029.
Štítky
Detská urológia Nefrológia Urológia
Článek EditorialČlánek Primární amyloidóza ureteru
Článok vyšiel v časopiseČeská urologie
Najčítanejšie tento týždeň
2014 Číslo 4- Aktuálne európske odporúčania pre liečbu renálnej koliky v dôsledku urolitiázy
- MUDr. Šimon Kozák: V algeziológii nič nefunguje zázračne cez noc! Je dôležité nechať si poradiť od špecialistov
- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Editorial
- Imunoterapie a karcinom prostaty
- Autonomní dysreflexie u pacientů po spinálním poranění
- Extrakorporální litotrypse rázovou vlnou v současné urologické praxi
- Využití multiparametrické magnetické rezonance a srovnání s ostatními moderními zobrazovacími metodami v předoperační diagnostice karcinomu prostaty
- Hodnocení absolutní indikace operační léčby BPH u pacientů s prokázanou cystolitiázou
- Zhodnocení účinnosti extrakorporální litotrypse elektromagnetického generátoru EMSE 140f Dornier Compact Sigma a stanovení efektivní energetické dávky
- Hodnocení erektilní dysfunkce po roboticky asistované radikální prostatektomii
- Primární amyloidóza ureteru
- Deset tipů pro začínající kongresové řečníky
- Soutěž ČUS o nejlepší vědeckou publikaci za rok 2013
- Central European Meeting v Krakově – vybrané přednášky
- Česká urologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Extrakorporální litotrypse rázovou vlnou v současné urologické praxi
- Využití multiparametrické magnetické rezonance a srovnání s ostatními moderními zobrazovacími metodami v předoperační diagnostice karcinomu prostaty
- Autonomní dysreflexie u pacientů po spinálním poranění
- Hodnocení erektilní dysfunkce po roboticky asistované radikální prostatektomii
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



