RADIAČNÍ ZÁTĚŽ PACIENTŮ PODSTUPUJÍCÍCH PERKUTÁNNÍ NEFROLITOTRYPSI NA UROLOGICKÉM ODDĚLENÍ NEMOCNICE ČESKÉ BUDĚJOVICE
PATIENTS’ RADIATION DOSES DURING PERCUTANEOUS NEPHROLITHOTOMY FOR URINARY STONES IN THE UROLOGICAL DEPARTMENT, ČESKÉ BUDĚJOVICE HOSPITAL
X-ray examinations are common in urological practice, especially in diagnosis and treatment of urinary stones. Although radiation doses of diagnostic methods are generally well known, only a few articles related to radiation doses during therapy have been published.
The aim of this work is to calculate radiation exposure, absorbed doses and dose rates of fluoroscopy during percutaneous nephrolitotomy (PNL).
In retrospective group of 250 patients who underwent PNL in our department from September 2011 to February 2015 we analyse data and calculate superficial air kerma and effective doses during surgery.
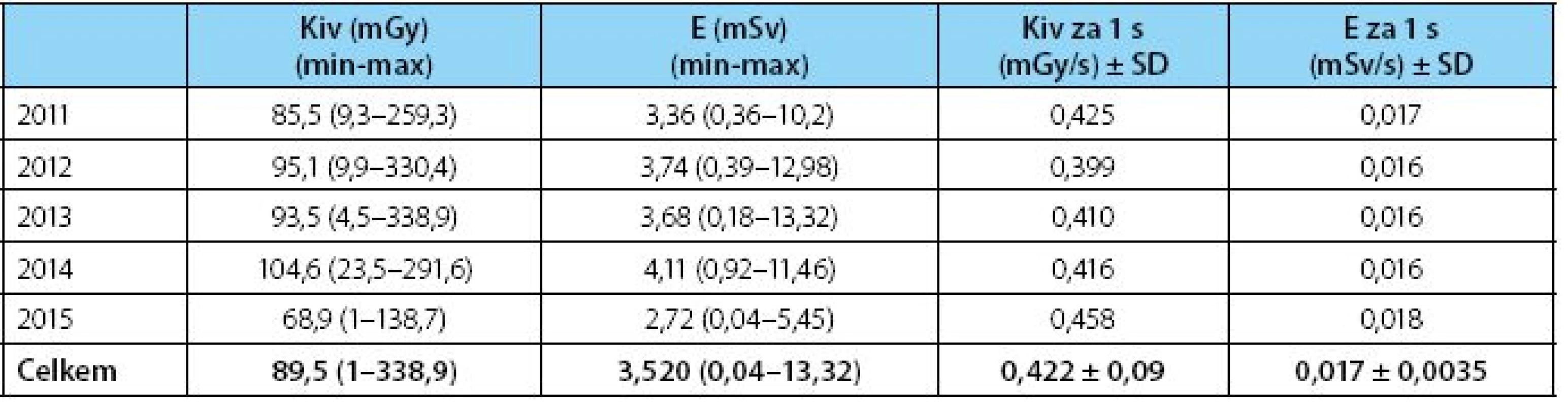
There are no statistically significant differences between single year data. Median fluoroscopy time was 214 seconds (range 2 to 750) with exposure of 89.5 mGy and effective dose 3.52mSv (range 0.04 to 13.2 mSv). The mean effective dose rate is 0.017 ± 0.0035 mSv per second.
Fluoroscopy is safe and we don´t exceed local dose limit references. Patients are exposed to an average 3.16 mSv during PNL, similar to noncontrast CT or intravenous urogram. Although radiation exposure for surgeon and operating theatre staff doesn´t exceed safe limits, urologists must be aware and decrease radiation exposure to as low as possible.
KEY WORDS:
Percutaneous nephrolitotomy, urinary stones, radiation doses.
Autoři:
Pavel Tolinger 1; Aleš Petřík 1; Petr Berkovský 2
Působiště autorů:
Urologické oddělení Nemocnice České Budějovice, a. s.
1; Onkologické oddělení Nemocnice České Budějovice, a. s.
2
Vyšlo v časopise:
Ces Urol 2015; 19(4): 291-295
Kategorie:
Originální práce
Souhrn
Cíl:
Užívání radiologických metod patří neodmyslitelně k diagnostice a terapii urolitiázy. Zatímco radiační zátěž vyšetřovacích metod je obecně známá, nalezli jsme pouze malé množství článků, které se věnují problematice radiační zátěže spojené s terapií samotnou. Cílem práce bylo stanovit efektivní dávku absorbovanou pacientem v průběhu vyšetření.
Materiál a metody:
V retrospektivním souboru 250 pacientů ošetřených v období srpen 2011–únor 2015 perkutánní nefrolitotrypsí (PNL) na našem pracovišti jsme dohledali potřebné údaje a vypočítali povrchovou kermu pro pacienta a efektivní dávku absorbovanou v průběhu vyšetření.
Výsledky:
V průběhu jednotlivých let se naměřené hodnoty statisticky významně nemění, v celém souboru při průměrném čase skiaskopie 214 s (rozmezí 2–750 s) nabývá průměrná povrchová kerma hodnot 89,5 mGy a absorbovaná dávka 3,52 mSv (rozmezí 0,04–13,2 mSv). Celková absorbovaná dávka za sekundu je 0,017±0,0035 mSv/s.
Závěr:
Zjištěné hodnoty nepřesahují stanovenou místní referenční úroveň. Z hlediska radiační hygieny průměrné výkony dosahují řádově dávky pro běžně užívané vyšetřovací metody (CT břicha nativně, vylučovací urografie). Míra expozice operatéra a personálu operačních sálů není nadlimitní s ohledem na radiační hygienické normy. Cílem každého urologa musí být snižování radiační zátěže na nejnižší možnou úroveň.
KLÍČOVÁ SLOVA:
PNL, urolitiáza, radiační zátěž.
ÚVOD
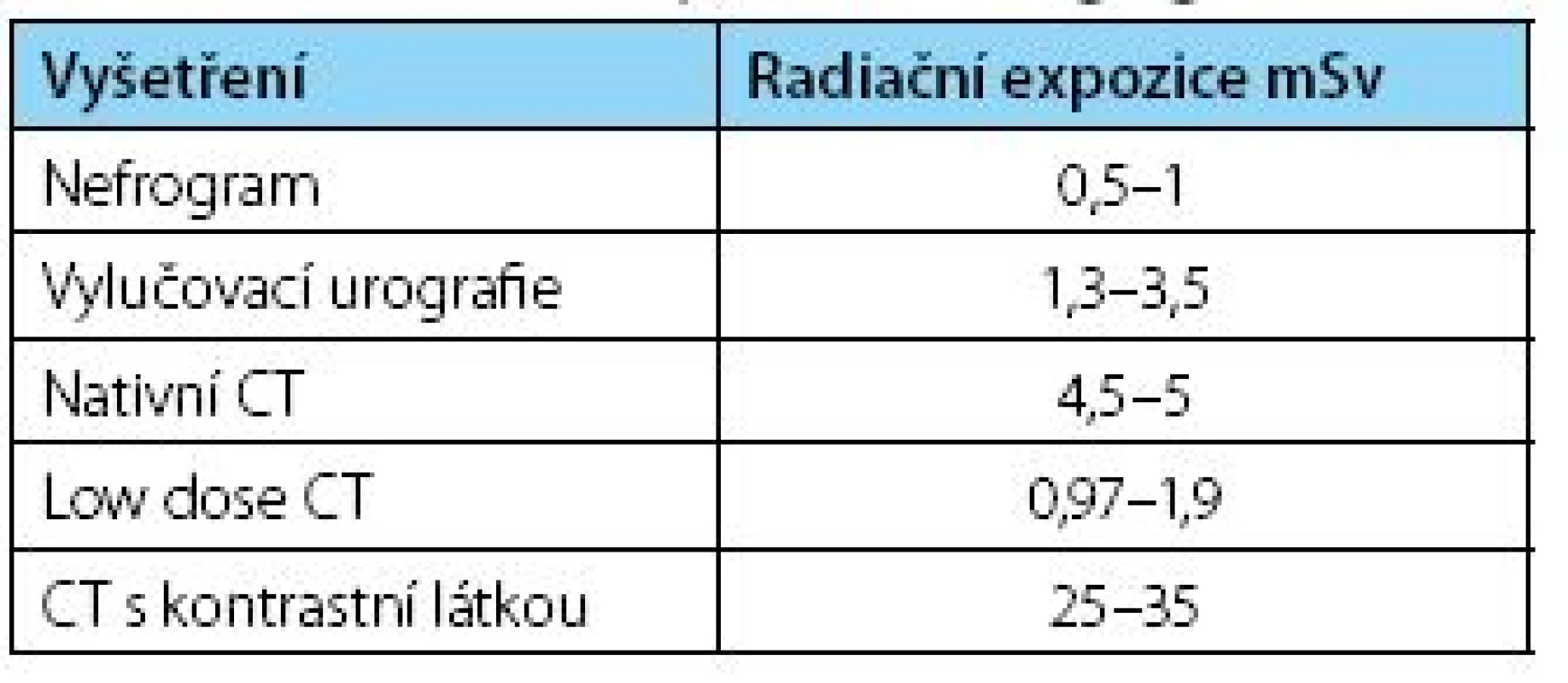
Rentgenové záření slouží medicíně neodmyslitelně již po více než celé století a tento vynález z roku 1895 zaznamenal mnoho pozdějších vylepšení a vývoj sofistikovaných přístrojů a vyšetření. S rozvojem jednotlivých vyšetřovacích postupů však zároveň vzniká i problematika radiační zátěže a jejích nežádoucích účinků na pacienta a v případě některých metod či peroperačního použití i radiační zátěže zdravotnického personálu. Nejinak je tomu i v diagnostice a terapii urolitiázy, kde je užití rentgenového záření časté nejen v části diagnostické, ale i při terapii samé, ať již skiaskopické zaměření při extrakorporální litotrypsi rázovou vlnou (ESWL), či v průběhu endoskopických metod. Je zjevné, že se metodám užívajícím ionizační záření nebude v nejbližší budoucnosti možné vyhnout, či je jinak nahradit, a proto je třeba znát užívané dávky a zefektivnit ochranu jak pacientů, tak personálu. Zatímco radiační expozice pacienta u běžně užívaných vyšetřovacích metod je obecně známá (tabulka 1) (5), nalezli jsme pouze malé množství publikací, zabývajících se radiační zátěží spojenou se skiaskopií v průběhu operačních zákroků (2, 3, 6).
Záměrem této práce je posouzení retrospektivního souboru 250 pacientů ošetřených na urologickém oddělení Nemocnice České Budějovice, a. s. operačním výkonem perkutánní nefrolitotrypse (PNL) právě se zaměřením na radiační zátěž tohoto výkonu pro pacienta.
MATERIÁL A METODY
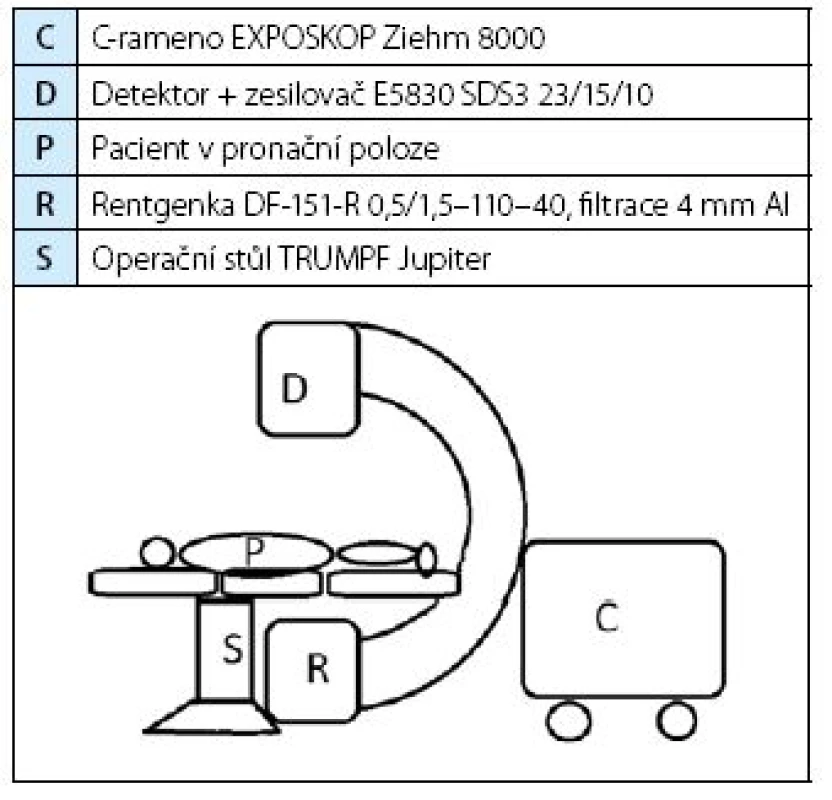
Z nemocničního informačního systému jsme retrospektivně vybrali soubor 302 pacientů, kteří podstoupili PNL v období srpen 2011–únor 2015. Z nich pouze u 250 byla dostupná potřebná anamnestická data, která jsme spárovali s údaji o provedeném skiaskopickém vyšetření, které povinně podle vyhlášky vede oddělení radiologické. Vycházeli jsme ze standardního uspořádání (tabulka 2) vyšetřovacího stolu, rentgenky a pacienta při PNL na našem pracovišti, užití stejného C ramene v módu skiaskopie 1/2 dose, operačního stolu, pronační poloha pacienta, 244 výkonů (97,6 %) bylo provedeno jedním operatérem.
Pro stanovení standardních hodnot jsme použili data z oficiální zkoušky dlouhodobé stability (ZDS) C-ramene na fantomu pro potřeby SÚJB (Státní úřad pro jadernou bezpečnost) z ledna 2014. Jako základní hodnotu výpočtu jsme vybrali dopadající kermu (Kiv), tedy energii přímo předanou ionizujícím zářením vzduchu v místě vstupu do fantomu, potažmo pacienta udávanou v jednotce Gray (Gy). Z polohy pacienta vůči C ramenu a po započtení faktoru rozptylu, absorpčního koeficientu operačního stolu a konverzních faktorů pro jednotlivé tkáně, jsme pak vypočetli absorbovanou dávku pro pacienta (E) udávanou v jednotce Sievert (Sv).
Kde:
Kiv = dopadající kerma (mGy)
KemZDS = vstupní povrchový kermový příkon na povrchu fantomu při skiaskopii (mGy/s)
texp = celkový skiaskopický čas (s)
Uv = napětí na rentgence při vyšetření (kV)
UZDS = napětí na rentgence při ZDS (kV)
FSDZDS = vzdálenost fantomu při ZDS (cm)
FSDv = vzdálenost pacienta při expozici (cm)
B = faktor rozptylu, použili jsme střední hodnoty 1,2
IndexZDS vztažen k údajům ze zkoušky dlouhodobé stability, indexV vztažen k vyšetření.
Hodnoty texp a Uv ve vzorci jsou našimi proměnnými, z nichž jsme vypočítali dopadající kermu pro jednotlivá vyšetření. Problematickým se ukázalo stanovení FSDv, protože byť je tato hodnota také proměnná, je zpětně těžko zjistitelná. Její hodnota je individuálně závislá na anteroposteriorní vzdálenosti ležícího pacienta a není jednoznačně závislá na váze ani body mass indexu, které jsme měli k dispozici. Zde jsme museli přistoupit k aproximaci a pro všechny pacienty jsme stanovili stejnou hodnotu povrchu stolu 50 cm od ohniska rentgenky. Posledním zvažovaným faktorem je absorpce záření operačním stolem K. Desku stolu lze v uspořádání s rentgenkou pod pacientem považovat za další clonu vloženou pod pacienta. Z technické dokumentace operačního stolu TRUMPF Jupiter se nepodařilo daný údaj dohledat. Tedy vycházeli jsme z dokumentace konstrukčně podobných operačních stolů, kde je absorpce udávána jako ekvivalent 0,75–1,5 mm Al. Pro výpočet jsme uvažovali hodnotu nejnižší a průměrné napětí na rentgence 74 kV, dopadající kermu jsme krátili koeficientem absorpce stolu K = 0,96. Vycházeli jsme ze vztahu (8):
Kde:
I0 = dopadající svazek
I(x) = svazek zeslabený materiálem
x = tloušťka materiálu
μ = koeficient zeslabení materiálu
Pro následný převod na efektivní dávku jsme vycházeli ze vztahu:
Kde:
E = efektivní dávka (mSv)
Kiv = dopadající kerma (mGy)
F = konverzní faktor tkáně (mSv/mGy)
Konverzní faktor F je semiempirická tabelární hodnota převzatá z literatury (1), použili jsme hodnoty pro vyšetření břicha při známém stínění 4 mm Al a užitém průměrném napětí na rentgence 74 kV. Hodnota ozářené plochy, která je ke stanovení faktoru potřebná vychází pak ze známého stínění primárního svazku rentgenky, kdy průměr kruhového detektoru je 27 cm ve vzdálenosti 90 cm a pacient se nachází v průměrné vzdálenosti 50 cm od rentgenky. Primární svazek tak prochází pacientem v kruhovém poli o ploše 177 cm2. Pro výpočet jsme tedy užili hodnotu konverzního faktoru pro efektivní dávku AP projekce břicha F = 22,2*10–5 mSv/mGy cm2 * 177 cm2 = 0,039 mSv/mGy. Pro stanovení orgánově specifické dávky pro kůži na vstupu je třeba hodnotu povrchové kermy násobit tkáňovým váhovým faktorem wT, který pro kůži nabývá hodnoty 0,01 mSv/mGy.
VÝSLEDKY
V meziročním porovnání údajů nenacházíme statisticky významné rozdíly jak v délce skiaskopie, tak vypočtených hodnot radiační zátěže.
Kožní kryt pacienta přivrácený k rentgence (v našem případě při pronační poloze ventrálně) je vystaven expozici 0,422±0,09 mGy/s, což při průměrném času skiaskopie 214 s (tabulka 3) přestavuje expozici Kiv = 89,5 mGy. Absorbovaná dávka pro vyšetřovanou oblast břicha při zvažovaném konverzním faktoru dosahuje hodnot E = 3,52 mSv (rozmezí 0,04–13,2 mSv). Vystavujeme tak pacienta dávce 0,017 ± 0,0035 mSv za každou vteřinu skiaskopie.

DISKUZE
Zjištěná povrchová kerma při skiaskopickém vyšetření v průběhu PNL (Kiv=0,42 mGy/s) nepřesahuje stanovenou místní diagnostickou referenční úroveň (MDRÚ = 0,42 mGy/s)
Hodnota průměrné efektivní dávky pro pacienta při PNL je 3,52 mSv a odpovídá tak téměř průměrné hodnotě dávky nativního CT vyšetření, ovšem pouze v rozsahu vyšetřovaného pole.
Závažnou otázkou nadále zůstává absorbovaná dávka pro operatéra a pro personál operačních sálů, kteří se nacházejí mimo primární svazek rentgenky. Sledovanému operatérovi v uvedeném období podle pravidelných povinných měsíčních kontrol osobních dozimetrů byla naměřena průměrná roční dávka 1,52 mSv (v rozmezí 1,46–1,64 mSv) a pro ostatní personál operačních sálů dávky nižší. Mimo primární svazek je tedy zatížení osob významně nižší. Řádné užívání osobních dozimetrů by přesto nemělo být opomíjeno.
Přes veškerou snahu o co nejpřesnější výpočet jsme byli nuceni přistoupit k celé řadě ústupků a aproximací. Pro vyřazení C ramene z provozu navíc nebylo možné provedení nového kontrolního měření na fantomu. Nebrali jsme například v potaz použití sekundárních clon, které se standardně užívají ke stínění ozařovaného pole, dále odhlížíme od biometrických dat jednotlivých pacientů, pro zjednodušení výpočtu jsme pominuli sílu desky stolu. Výsledky je tedy nutno interpretovat spíše jako řádové hodnoty efektivních dávek pro pacienta v ozařovaném poli.
Do budoucna plánujeme zopakovat podobné měření jako prospektivní studii za standardních podmínek na novém C-rameni SIEMENS Cios Alpha, které je již vybaveno detektorem DAP a umožňuje tak měření absorbované dávky u každého jednotlivého pacienta v průběhu každého vyšetření. Zajímá nás zejména to, zda modernější vybavení s přímou digitalizací umožní zkrácení průměrného času skiaskopie a sníží radiační zátěž pacienta i personálu.
ZÁVĚR
Radiační zátěž, se kterou urolog pracuje v průběhu výkonů, není jistě zanedbatelná a snahou každého operatéra musí být použití skiaskopie po nejkratší možný čas, a to i ve vlastním zájmu, například náhradou skiaskopie sonografickou kontrolou výkonu. Snahou operatéra by měla být eliminace ozáření vlastních rukou primárním svazkem. Pro zkrácení času a lepší kooperaci s průběhem výkonu je vhodné spouštění skiaskopie přímo operatérem a ne laborantem. Samozřejmostí je přítomnost pouze nejnutnějšího personálu na operačním sále s adekvátní osobní ochranou a stíněním celého sálu.
Došlo: 9. 9. 2015
Přijato: 25. 11. 2015
Kontaktní adresa:
MUDr. Pavel Tolinger
Urologické oddělení
Nemocnice České Budějovice, a.s.
B. Němcové 585/54,
370 01 České Budějovice
e-mail: tolinger.pavel@seznam.cz
Střet zájmů: žádný
Prohlášení o podpoře:
Autor prohlašuje, že zpracování článku nebylo podpořeno žádnou společností.
Zdroje
1. Murphy MJ, et al. The management of imaging dose during image-guided radiotherapy: Report of the AAPM Task Group 75. Med. Phys. 34, 404154061 (2007).
2. Nechvíl K, Mynařík J, Doležel M, Minaříková I. Odhad radiační zátěže pacientů ze zobrazovacích metod používaných při IGRT http://www.iaea.org/inis/collection/NCLCollectionStore/_Public/40/059/40059816.pdf
3. Michael E, Lipkin, Agnes J, et al. Determination of Patient Radiation Dose During Ureteroscopic Treatment
of Urolithiasis Using a Validated Model. The Journal of Urology Published Online: January 19, 2012.
4. Vyhláška Státního úřadu pro jadernou bezpečnost č. 307/2002 Sb. O radiační ochraně + Přílohy v novelizovaném znění platném od 1. 12. 2012.
5. Petřík A. Diagnostika a terapie urolitiázy. Urol. praxi, 2011; 12(3): 173–179.
6. Zöller G, Virsik-Köpp P, Vowinkel C. Patient radiation exposure during ureteroscopic stone extraction. Der Urologe. Ausg. A 2013, 52(1): 60–64.
7. EAU Guidelines 2015. http://www.europeanurology.com/article/S0302-2838(15)00699-5/abstract/eau-
guidelines-on-diagnosis-and-conservative-management-of-urolithiasis
8. Bushberg JT, et al. The Essential Physics of Medical Imaging, ISBN-13: 978-0-683-30118-2, ISBN-10: 0-683-30118-2.
Štítky
Detská urológia Nefrológia UrológiaČlánok vyšiel v časopise
Česká urologie

2015 Číslo 4
- Aktuálne európske odporúčania pre liečbu renálnej koliky v dôsledku urolitiázy
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
- MUDr. Šimon Kozák: V algeziológii nič nefunguje zázračne cez noc! Je dôležité nechať si poradiť od špecialistov
- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
Najčítanejšie v tomto čísle
- SEDMILETÉ ZKUŠENOSTI S APLIKACÍ RÁZOVÝCH VLN U MUŽŮ S INDURATIO PENIS PLASTICA (IPP)
- SYNCHRONNÍ BILATERÁLNÍ SEMINOM VARLETE
- INFIKOVANÁ CYSTA ZPŮSOBUJÍCÍ MECHANICKÝ SYNDROM JAKO KOMPLIKACE RENÁLNÍHO KARCINOMU
- LÉČBA LOKALIZOVANÉHO A LOKÁLNĚ POKROČILÉHO KARCINOMU PROSTATY Z POHLEDU UROLOGA A RADIAČNÍHO ONKOLOGA



