-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Využití indocyaninové zeleně při robotických výkonech v urologii
Usage of indocyanine green in urological robotic surgery
Indocyanine green (ICG) is a fluorescent dye with a wide spectrum of usage in minimally invasive urological surgery, where intravenous application of ICG can be used for identificaton of perfusion and tissue density. This review summarizes development, contemporary trends and also the future possibilities of ICG usage in robotic urology. During robotic kidney resection application of ICG is used for differentiation between tumorous tissue and healthy renal parenchyma. Administration of ICG during robotic radical prostatectomy can improve identification of the neurovascular bundle in nerve‑sparing procedures and detect the sentinel lymph node in pelvic lymph node dissection. The principle of ICG application can be used also in the effort to reduce post‑operative complications during robotic varicocelectomy. Future controlled trials are needed to evaluate if the use of ICG combined with the robotic surgical system will affect medical procedures and functional and oncological outcomes.
KEY WORDS
Indocyanine green, robotic surgical procedures, robotic kidney resection, robotic radical prostatectomy, robotic varicocelectomy.
Autori: Darina Pacigová 1; Lukáš Gaduš 1; Jiří Heráček 1,2; Milan Čermák 1; Jiří Kočárek 1,2
Pôsobisko autorov: Urologické oddělení, Ústřední vojenská nemocnice – Vojenská fakultní nemocnice, Praha 1; Urologická klinika, 1. lékařská fakulta, Univerzita Karlova, Praha 2
Vyšlo v časopise: Ces Urol 2018; 22(2): 99-105
Kategória: Přehledový článek
Súhrn
Indocyaninová zeleň (ICG) je fluorescenční barvivo se širokým využitím v minimálně invazivní urologické operativě, kdy intravenózní aplikací ICG lze identifikovat perfuzi a denzitu tkání. Přehledový článek shrnuje postupný vývoj, současné trendy i budoucí možnosti využití ICG v robotické urologii. Při robotické resekci ledviny lze aplikací ICG rozlišit tumorózní a nenádorovou tkáň. Doplnění robotické radikální prostatektomie o ICG může zlepšit identifikaci nervově cévního svazku při šetřících operačních postupech a detekci sentinelové uzliny při pánevní lymfadenektomii. Princip aplikace ICG lze využít i při robotické varikokélektomii při snaze o snížení pooperačních komplikací. Další studie budou nutné k posouzení, zda využití ICG v kombinaci s robotickým systémem reálně ovlivní léčebné postupy a funkční a onkologické výsledky.
KLÍČOVÁ SLOVA
Indocyaninová zeleň, robotické chirurgické výkony, robotická resekce ledviny, robotická radikální prostatektomie, robotická varikokélektomie.
ROBOTICKÁ MEDICÍNA
Robotická chirurgie je v současnosti nejsofistikovanější technologií používanou v chirurgické medicíně. Integrace počítačových, digitálních a robotických technologií přinesla možnost zlepšení výsledků náročných chirurgických výkonů. Benefit pro pacienta i plátce zdravotní péče představuje omezení traumatizace tkání v průběhu operace, snížený výskyt komplikací, snížení krevních ztrát a potřeby transfuzí, snížení pooperační bolesti a dyskomfortu a kratší doba hospitalizace s rychlejší rekonvalescencí a návratem do běžných aktivit života pacienta. Onkologické a funkční výsledky u robotických výkonů jsou srovnatelné s laparoskopickými přístupy a nadřazeny otevřeným technikám (1, 2).
INDOCYANINOVÁ ZELEŇ
Indocyaninová zeleň (indocyanine green, ICG) je fluorescenční barvivo. Světlo vlnové délky 803 nm vyvolává při dopadu na molekulu ICG detekovatelnou emisi fotonů s vlnovou délkou 820–830 nm. Podstatou klinických aplikací je využití principu fluorescence, kdy v látce, schopné fluorescence netermálním světelným zářením, vyvoláme excitaci molekul. V průběhu vlastní excitace se aktivují volné elektrony, které přecházejí do excitované pozice. Tento stav je ovšem nestabilní a během krátké doby dochází k návratu excitovaných elektronů do výchozí pozice. Návrat je doprovázen emisí světelné energie o vyšší vlnové délce, než je vlnová délka světla, která fluorescenci vyvolala. Vyzářenou světelnou energii zachycujeme pomocí digitálních zobrazovacích systémů s vysokým rozlišením (3) (obrázek 1). Pomocí kamery s vysokým rozlišením a softwarem vynucené pseudobarvy můžeme intravenózně aplikovanou ICG využít k identifikaci perfuze a k rozlišení denzity tkání (4, 5). ICG vyvinula v roce 1955 firma Kodak Photography, FDA schválení získala v roce 1959 (6). Látka má příznivý bezpečnostní profil. Výskyt nežádoucích účinků se popisuje v 0,34 % případů, počítaje v to nauzeu, zvracení a zřídka anafylaktický šok (1 : 300 000) (7). Zeleň je široce používána např. v oftalmologii, dermatologii a kardiologii, především k identifikaci cévních struktur (8). V urologii využíváme ICG při otevřených, laparoskopických i robotických výkonech. Tento článek je shrnutím současného využití a možných budoucích aplikací ICG da Vinci robotickým systémem (dVS, Intuitive Surgical System) s důrazem na možnosti peroperační identifikace vaskulární a tumorózní tkáně v urologické operativě. Důležité je, že ICG není drahou medicínskou komoditou a zároveň to, že endoskopická technika, umožňující zobrazení v infračerveném módu, je v současných robotických systémech standardně dostupná.
Obr. 1. Princip fluorescence s využitím ICG
Fig. 1. Concept of fluorescence with usage of ICG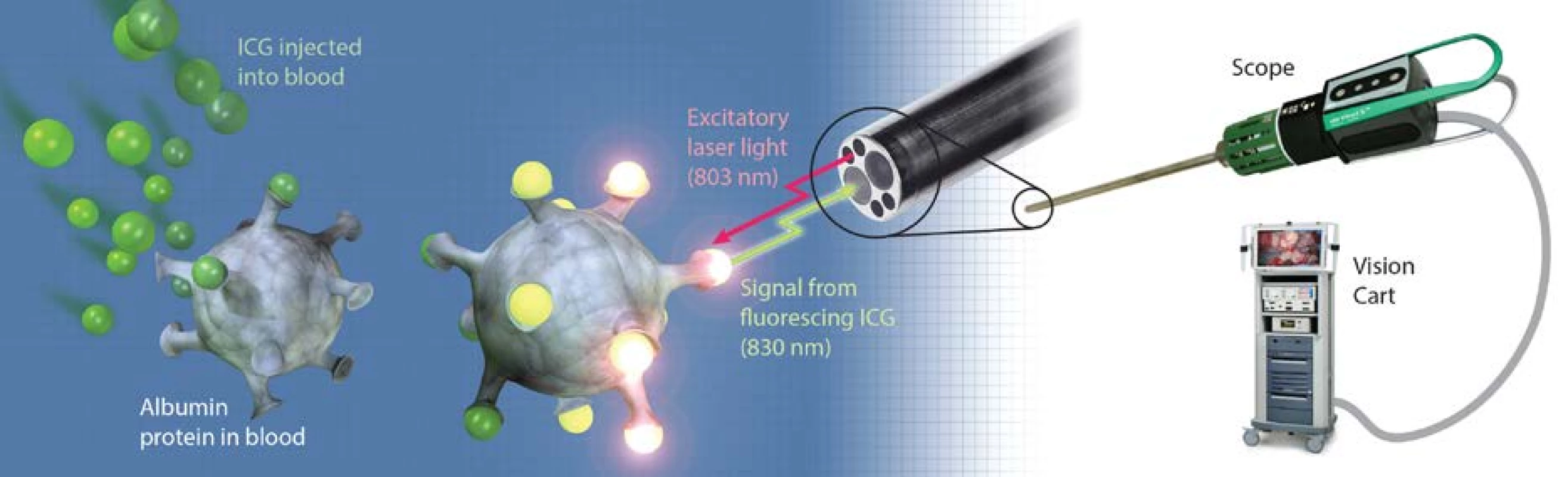
HISTORIE A SOUČASNOST
Historický pohled na intraoperační zobrazení fluorescenčním barvivem je nepostradatelný k popisu pokroků v moderní robotické chirurgii. V roce 1947 poprvé popsal neurochirurg George Moore v časopise Science použití fluoresceinu a fluoroforu k identifikaci nádorové tkáně v mozku (9). V roce 1948 pak Moore publikoval výsledky 46 pacientů se smíšenými intrakraniálními nádory, kterým intraoperačně injikoval do tumoru barvivo a správně tak identifikoval 44 maligních tumorů (96 %). Moore zašel tak daleko, že popsal resekci zbylé tkáně na základě fluorescenční aktivity, a tím intraoperační resekci pozitivních chirurgických okrajů. Iodinovým isotopem 131 radioaktivně označil dijodofluorescein, aby detekoval gama záření z barviva akumulovaného v maligních tkáních (10). Použití fluorescenčního zobrazení a robotické chirurgie je logickým postupem v peroperační vizualizaci tkáně. Fúze minimálně invazivní chirurgie a lokalizovaného zobrazení je použitelná při identifikaci sentinelových uzlin (11), renálního karcinomu (12), při superselektivním arteriálním klampingu u nefron šetřících postupů (13) a pro precizní disekci neurovaskulárního svazku při radikální prostatektomii (14).
ROBOTICKÁ RESEKCE LEDVINY
V renálním parenchymu váže ICG transportér bilitranslokáza a zdravá tkáň se zobrazuje jako isofluorescentní, pokud je perfundována krví nasycenou ICG (15). Renální tumory obsahují nízké množství bilitranslokázy, a proto je jejich tkáň hypofluorescentní. Tobis a kol. jako první zaznamenali hypofluorescentní renální tumory při robotické resekci ledviny s využitím ICG (12). Manny a kol. publikovali senzitivitu 84 % a pozitivní prediktivní hodnotu 87 % pro hypofluorescentní tkáň u 100 pacientů s nádorem ledviny. Senzitivita a pozitivní prediktivní hodnota se vztahuje ke schopnosti hypofluorescence odlišit maligní a benigní tkáň (16). Borofsky a kol. pak popsali superselektivní renální arteriální klampování u 27 pacientů, jež podstoupili resekci ledviny s ICG, a tím se vyvarovali klampování „zdravého“ renálního parenchymu. Maximální ztráta glomerulární filtrace tři měsíce po výkonu byla 1,6 % proti 14 % v non‑ICG části studie (17). Bjurlin a kol. publikovali při užití superselektivního arteriálního klampování s ICG 6,2% pokles v hodnotách glomerulární filtrace v průběhu dvou týdnů po operaci (13). Kočárek a kol. publikovali výsledky použití ICG u 52 pacientů při resekci ledviny, k identifikaci tumorózní tkáně aplikovali intravenózně bolus 1,5 ml roztoku ICG při jeho koncentraci 2,5 mg/ml roztoku (18) (obrázek 2a, b).
Obr. 2. a, b. Resekční linie tumoru ledviny (a), hypofluorescentní tumorózní tkáň po aplikaci ICG (b)
Fig. 2a, b. Resection line of a kidney tumour (a), the hypofluorescent tumorous tissue after the application of ICG (b)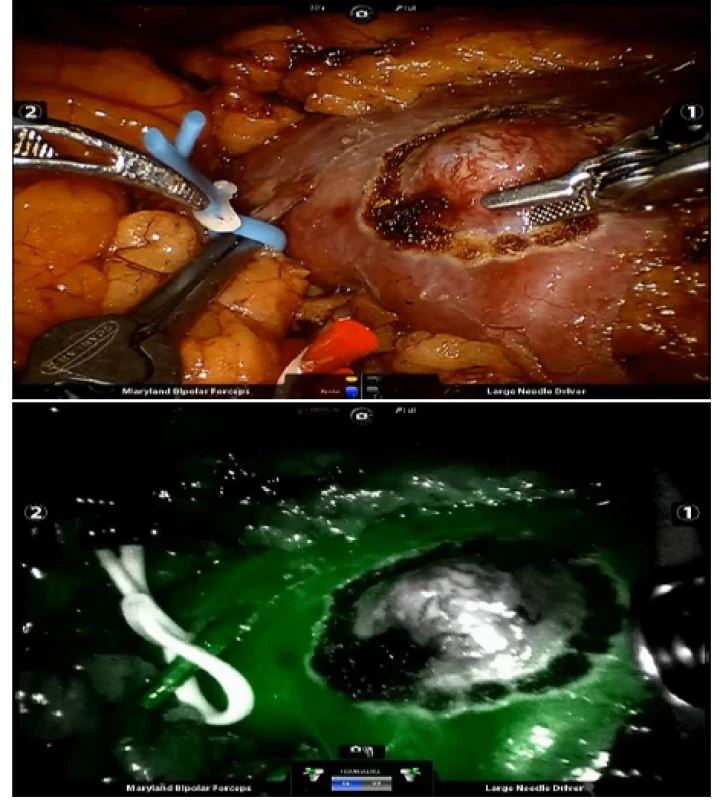
ROBOTICKÁ RADIKÁLNÍ PROSTATEKTOMIE
Radikální prostatektomii můžeme doplnit ICG zobrazením ke zlepšení identifikace neurovaskulárního svazku. Kumar a kol. popsali 30 % neurovaskulárních svazků, které byly lépe identifikovatelné během nervy šetřícího výkonu při použití ICG (14). Stupeň šetření nervů během výkonu koreluje s funkčními výsledky, ICG je tak slibnou metodou ke zlepšení postoperační kontinence a erektilní funkce. Klein Jan a kol. popsali hybridní fluorescentní ICG radiodetektor, který byl optimalizován k lokalizaci sentinelové lymfatické uzliny v průběhu pánevní lymfadenektomie a zlepšil in vivo identifikaci fluorescencí na 93,5 % ve srovnání s 50 % u neoptimalizovaných vzorků (11). Manny a kol. v další studii v roce 2014 popsali při ICG asistované lokalizaci sentinelové uzliny senzitivitu 100 % a negativní prediktivní hodnotu 100 % (n = 50), avšak tato metoda je nespecifická. Ve větších vyšetřovaných skupinách je pravděpodobné, že diagnostické koeficienty klesnou pod 100 % (19). Navzdory tomu zůstává potenciální užitečnost ICG pro detekci uzlin, postižených metastázami a diferenciaci onkologické tkáně povzbudivá.
ROBOTICKÁ VARIKOKÉLEKTOMIE
Mikrochirurgická varikokélektomie je standardní operace k léčbě mužské poruchy plodnosti a skrotální bolesti. Průnikem dVS do andrologické operativy došlo k dalšímu rozvoji miniinvazivní chirurgie v podobě robotické varikokélektomie. Použitím ICG v kombinaci s dVS v režimu flurescenčního zobrazení je možné provedení tzv. ICG angiografie, která pomáhá identifikovat artérie a po naplnění žil i lymfatické cévy s možností jejich precizního šetření. Ve venózní fázi pozorujeme fluorescenční signál i nejmenších žilních větví, což umožnuje jejich přesnější a rozsáhlejší ligaci (20). ICG tak může přispět ke snížení četnosti pooperačních recidiv varikokély (obrázek 3a, b). Robotická varikokélektomie nicméně zůstává alternativním výkonem mimo úhradu veřejného zdravotního pojištění.
Obr. 3. a, b. Zobrazení artérie při mikroskopické varikokélektomii před (a) a po aplikaci ICG (b)
Fig. 3a, b. Imaging of artery before (a) and after the application of ICG (b) during microvaricocelectomy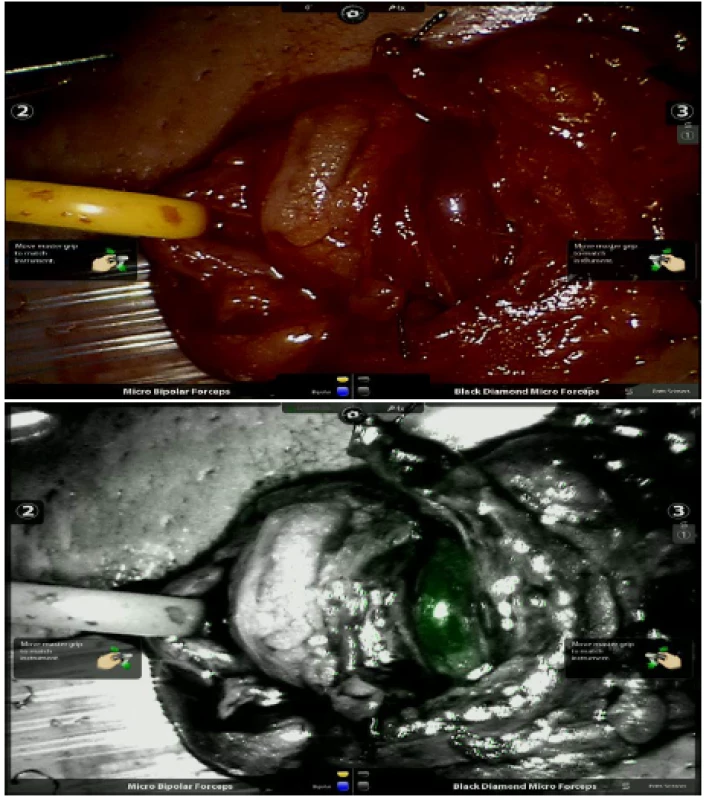
BUDOUCNOST
Nedávné technologické pokroky v nádorových biomarkerech a imunologii vedly k hybridizaci ICG s tumorselektivními ligandy a tím k možnosti lokalizace tumoru fluorescencí. Hodnota prostatického specifického membránového antigenu (PSMA) se zvyšuje při karcinomech prostaty 100–1 000 x (21). Nakajima a kol. použili ICG, navázanou na PSMA‑ligand, při detekci PSMA pozitivních prostatických tumorů u myší. Využití PSMA v kombinaci s ICG se ukazuje jako zajímavá možnost zlepšení detekce karcinomu prostaty (22). Přesná identifikace dříve nerozeznatelné nádorové tkáně může změnit četnost pozitivních chirurgických okrajů a oddálit biochemickou recidivu karcinomu prostaty. Podobný postup můžeme prostřednictvím imunologických markerů využít v diagnostice i léčbě renálních karcinomů a karcinomů močového měchýře. Pro vyhodnocení senzitivity, specificity, funkčních i onkologických výsledků, výhod a nevýhod při praktickém využití ICG v klinické praxi jsou potřeba další klinické studie.
ZÁVĚR
Spojení dVS a ICG bylo popsáno jako metoda, jenž „uhodila hřebíček na hlavičku“ (23). ICG může být užitečná v mnoha oblastech robotické operativy, největší výhodu však v současnosti poskytuje při selektivním arteriálním klampování při resekci ledviny (24). Standardizované randomizované studie jsou nutné ke kvantifikaci výsledků. Není jasné, zda ICG přináší klinicky významné postup‑specifické výhody v souvislosti s celkovým přežitím a rekonvalescencí pacientů. Revoluční krok v operačním zobrazování prostřednictvím značení fluorescenčními molekulami (ke zvýšení úspěšné „en bloc“ resekce tumoru) přinesl již před 70 lety neurochirurg Dr. George Moore. Ačkoliv je vývoj v preklinickém stadiu, je pouhou otázkou času, než Moorova pionýrská práce bude rutinní urologickou robotickou praxí.
Došlo: 19. 2. 2018
Přijato: 25. 4. 2018
Kontaktní adresa:
MUDr. Darina Pacigová
Urologické oddělení, ÚVN – VFN Praha
U Vojenské nemocnice 1200, 169 02 Praha 6
e‑mail: uro@uvn.cz
Střet zájmů: žádný
Prohlášení o podpoře: Autor prohlašuje, že zpracování článku nebylo podpořeno farmaceutickou firmou.
Zdroje
1. Novara G, Ficarra V, Mocellin S, et al. Systematic review and meta‑analysis of studies reporting oncologic outcome after robot‑assisted radical prostatectomy. Eur Urol 2012; 62(3): 382–404.
2. Ficarra V, Novara G, Rosen RC, et al. Systematic review and meta‑analysis of studies reporting urinary continence recovery after robot‑assisted radical prostatectomy. Eur Urol 2012; 62(3): 405–417.
3. Landsman ML, Kwant G, Mook GA, Zijlstra WG. Lightabsorbing properties, stability, and spectral stabilization of indocyanine green. J Appl Physiol 1976; 40(4): 575–583.
4. Choi M, Choi K, Ryu SW, Lee J, Choi C. Dynamic fluorescence imaging for multiparametric measurement of tumor vasculature. J Biomed Opt 2011; 16(4): 046008.
5. Schaafsma BE, Mieog JD, Hutteman M, et al. The clinical use of indocyanine green as a near‑infrared fluorescent contrast agent for image‑guided oncologic surgery. J Surg Oncol 2011; 104(3): 323–332.
6. Brooker LGS, Heseltine DW, Inventors. Eastman Kodak Co, assignee. Tricarbocyanine infrared absorbing dyes. United States Patent 2895955 A; 1959.
7. Obana A, Miki T, Hayashi K, et al. Survey of complications of indocyanine green angiography in Japan. Am J Ophthalmol 1994; 118(6): 749–753.
8. Alander JT, Kaartinen I, Laakso A, et al. A review of indocyanine green fluorescent imaging in surgery. Int J Biomed Imaging 2012; 2012 : 940585.
9. Moore GE. Fluorescein as an agent in the differentiation of normal and malignant tissues. Science 1947; 106(2745): 130–131.
10. Moore GE, Peyton WT, French LA, Walker WW. The clinical use of fluorescein in neurosurgery. J Neurosurg 1948; 5(4): 392–398.
11. KleinJan GH, van den Berg NS, Brouwer OR, et al. Optimisation of fluorescence guidance during robot‑assisted laparoscopic sentinel node biopsy for prostate cancer. Eur Urol 2014; 66(6): 991–998.
12. Tobis S, Knopf J, Silvers C, et al. Near infrared fluorescence imaging with robotic assisted laparoscopic partial nephrectomy: initial clinical experience for renal cortical tumors. J Urol 2011; 186(1): 47–52.
13. Bjurlin MA, Gan M, McClintock TR, et al. Near‑infrared fluorescence imaging: emerging applications in robotic upper urinary tract surgery. Eur Urol 2014; 65(4): 793–801.
14. Kumar A, Samavedi S, Bates A, et al. Use of intra‑operative indocyanine green and Firefly technology to visualize the „landmark artery“ for nerve sparing robot assisted radical prostatectomy. Eur Urol Suppl 2015; 2(14): eV36.
15. Golijanin DJ, Marshall J, Cardin A, et al. Bilitranslocase (BTL) is immunolocalised in proximal and distal renal tubules and absent in renal cortical tumors accurately corresponding to intraoperative near infrared fluorescence (NIRF) expression of renal cortical tumors using intravenous indocyanine green (ICG). J Urol 2008; 179(suppl): (abs. 386) 137.
16. Manny TB, Krane LS, Hemal AK. Indocyanine green cannot predict malignancy in partial nephrectomy: histopathologic correlation with fluorescence pattern in 100 patients. J Endourol 2013; 27(7): 918–921.
17. Borofsky MS, Gill IS, Hemal AK, et al. Near‑infrared fluorescence imaging to facilitate super‑selective arterial clamping during zero‑ischaemia robotic partial nephrectomy. BJU Int 2013; 111(4): 604–610.
18. Kočárek J, Chmelík F, Heráček J, Matějková M, Čermák M. Selektivní klamping při roboticky asistované resekci ledviny. Ces Urol 2016; 20(4): 257–258.
19. Manny TB, Patel M, Hemal AK. Fluorescence‑enhanced robotic radical prostatectomy using real‑time lymphangiography and tissue marking with percutaneous injection of unconjugated indocyanine green: the initial clinical experience in 50 patients. Eur Urol 2014; 65(6): 1162–1168.
20. Tomita K, Kageyama S, Hanada E, et al. Indocyanine green angiography‑assisted laparoendoscopic single‑site varicocelectomy. Urology 2017; 106 : 221–225.
21. Ghosh A, Heston WDW. Tumor target prostate specific membrane antigen (PSMA) and its regulation in prostate cancer. J Cell Biochem 2004; 91(3): 528–539.
22. Nakajima T, Mitsunaga M, Bander NH, et al. Targeted, activatable, in vivo fluorescence imaging of prostate‑specific membrane antigen (PSMA) positive tumors using the quenched humanized J591 antibody – indocyanine green (ICG) conjugate. Bioconjug Chem 2011; 22(8): 1700–1705.
23. Krane LS, Hemal AK. Surgery: is indocyanine green dye useful in robotic surgery? Nat Rev Urol 2014; 11(1): 12–14.
24. Bates AS, Patel VR. Applications of indocyanine green in robotic urology. J Robot Surg 2016; 10 : 357–359.
Štítky
Detská urológia Nefrológia Urológia
Článok vyšiel v časopiseČeská urologie
Najčítanejšie tento týždeň
2018 Číslo 2- Aktuálne európske odporúčania pre liečbu renálnej koliky v dôsledku urolitiázy
- MUDr. Šimon Kozák: V algeziológii nič nefunguje zázračne cez noc! Je dôležité nechať si poradiť od špecialistov
- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Dopady změny antimuskarinika na kvalitu života u pacientů s hyperaktivním měchýřem - výsledky studie VEST
- Porovnání detekce signifikantního a nesignifikantního karcinomu pomocí systematické a cílené fúzní MRI/TRUS biopsie prostaty
- Mondorova choroba penisu - naše zkušenosti
- Vzácný případ eosinofilní funikulitidy
- Jarní edukační urologické sympózium 13.-14. duben 2018, Seč
- 3. ročník KNOU, opět po roce na pražském Andělu
- EAU Kodaň aneb výchova rezidentů v Čechách
- A report from the 5th workshop on advances in urogynaecology and urinary incontinence treatment
- Editorial
- Extraperitoneální robotická radikální prostatektomie s bilaterálním šetřením nervově‑cévních svazků
- Diagnostika karcinomu prostaty pomocí fúzní biopsie
- Využití indocyaninové zeleně při robotických výkonech v urologii
- Česká urologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Mondorova choroba penisu - naše zkušenosti
- Diagnostika karcinomu prostaty pomocí fúzní biopsie
- Využití indocyaninové zeleně při robotických výkonech v urologii
- Vzácný případ eosinofilní funikulitidy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



