-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Efektivní léčebná modulace poškozujícího zánětu u nemocných s psoriázou guselkumabem cílícím na specifickou podjednotku p19 IL-23 regulační osy IL-23/Th17
Effective Therapeutical Modulation of the Inflammation in Patients with Psoriasis Using Guselkumab Targeting the Specific Subunit p19 IL-23 of the Regulatory Axis of IL-23/Th17
The special role in the pathogenesis of psoriasis is given to keratinocytes which are releasing damage associated molecular patterns (DAMP) as a consequence of the exposure to the various noxious stimuli. The identification of DAMP by PRR receptor is followed by the both local and systemic release of proinflammatory cytokines. Some DAMP pattern, so called alarmins, are processed in dendritic cells and are presented as antigenic fragments in optimal cytokine and costimulatory microenvironment to T cells. The abnormal functional polarisation of proliferating T cells in to Th17, Th1, and Th22 subsets is the consequence of this presentation. The critical role into the polarisation to the Th1 and Th17 subsets is given to IL-12 and IL-23 cytokines which share in their unique dimeric structures the common subunit p40. IL-23 is irreplaceable for the whole activity of Th17 subset. This concept is evidenced by the excellent results of several clinical studies in which the neutralisation of p19 subunit specific for IL-23 by guselkumab is substantially alleviating clinical activity of psoriasis. The clinical efficacy and excellent safety profil of guselkumab is superior to other biologicals used in the treatment of psoriasis.
Keywords:
IL – p – guselkumab – biological therapy
Autoři: J. Krejsek
Působiště autorů: Ústav klinické imunologie a alergologie, LF UK a FN Hradec Králové, přednosta prof. RNDr. Jan Krejsek, CSc.
Vyšlo v časopise: Čes-slov Derm, 93, 2018, No. 6, p. 244-249
Kategorie: Inzertní článek
Souhrn
V patogenezi psoriázy zaujímají zvláštní postavení keratinocyty, které vlivem různých nox, včetně infekčních, uvolňují vzory vnitřního poškození DAMP. Rozpoznání vzorů DAMP prostřednictvím receptorů PRR vede k lokální i systémové tvorbě prozánětlivých cytokinů. Některé vzory DAMP, tzv. alarminy, jsou zpracovány dendritickými buňkami a v podobě antigenních peptidů v optimálním cytokinovém a kostimulačním mikroprostředí předloženy T lymfocytům. Výsledkem je abnormální polarizace proliferujících T lymfocytů preferenčně do subsetů Th17, Th1 a Th22. Nutnou podmínkou polarizace do subsetů Th1 a Th17 jsou IL-12 a IL-23, které ve své unikátní dimerické struktuře sdílejí podjednotku p40. IL-23 poskytuje T lymfocytům subsetu Th17 podněty nutné pro jejich plné funkční rozvinutí. Oprávněnost tohoto konceptu je doložena výsledky klinických studií, kde neutralizace specifické podjednotky p19 IL-23 biologikem guselkumabem vede k významnému zlepšení klinického stavu nemocných s psoriázou. Efektivita a bezpečnostní profil biologika guselkumabu předčí terapeutické účinky jiných biologik užívaných k léčbě psoriázy.
Klíčová slova:
IL – p – guselkumab – biological therapy
Úvod
Psoriáza je systémové zánětlivé onemocnění s převládajícími projevy na kůži. Její prevalence je v lidské populaci poměrně vysoká a dosahuje odhadem 3 % až 5 %. Mimo jiné i proto, že kožní projevy psoriázy nemocného značně stigmatizují a jsou příčinou nepříjemných pocitů, představuje psoriáza závažný zdravotní problém. Většina pacientů trpí přidruženými komorbiditami, např. obezitou, metabolickým syndromem a nemocemi oběhové soustavy. V příčinné souvislosti s psoriázou jsou sdruženy psoriatická artritida, entezitida, daktylitida. Léčba psoriázy i omezení pracovní schopnosti jsou spojeny se značnými náklady. Dlouhodobě je studována patogeneze psoriázy právě s cílem nalézt efektivnější léčebné nástroje. Lze právem říci, že patří mezi nejlépe prozkoumané imunopatologické nemoci člověka (7).
Stejně jako tomu je u jiných zánětlivých imunopatologických onemocnění, je i patogeneze psoriázy komplexní (8). Můžeme zhruba definovat tři vzájemně se překrývající oblasti, které vedou ke ztrátě homeostatických regulací zánětu a jsou příčinou rozvoje poškozujícího zánětu. Jedná se o genetickou predispozici, abnormální individuální reaktivitu a ovlivnění epigenetickými faktory vnějšího světa, mikrobiotou kůže a škodlivinami. Především nové nálezy získané z genomických studií ukázaly, že pro rozvoj psoriázy predisponují, vedle vybraných alel HLA I. třídy polymorfismy SNP v genech, kódujících antimikrobiální peptidy tvořených keratinocyty, které jsou odpovědny za první obranné bariéry kůže. Rizikové faktory představují také polymorfismy v promotorové oblasti v genu pro TNFα, genech kódujících některé transkripční faktory (Rel, Tyk2, STAT-3). Nalezeny byly významné predispozice v genech, které určují polarizaci T lymfocytů do subsetů Th1, Th17, Th22 a regulační ose IL-23/Th17. Právě abnormální zapojení a ztráta regulací zmíněných subsetů T lymfocytů je považována za klíčovou v patogenezi psoriázy. Samotná genová predispozice nestačí a rozvoj poškozujícího zánětu u nemocných s psoriázou je iniciován zatím ne zcela popsanými precipitujícími faktory vnějšího světa. Epidemiologické studie jasně dokládají, že významným rizikovým faktorem rozvoje psoriázy jsou škodliviny, především chemické noxy přítomné v životním prostředí a tabákovém kouři. Noxy, ale i oxidační stres a další podněty jsou schopny v buňkách kůže vytvořit nebo uvolnit „vzory vnitřního poškození“ DAMP (Damage Associated Molecular Patterns). Ty jsou následně, stejně jako mikrobiální vzory PAMP (Pathogen Associated Molecular Patterns), identifikovány keratinocyty a především buňkami vrozené imunity přítomnými v kůži. Odpovědí na jejich přítomnost je rozvoj zánětlivé reakce. Na všechny tyto okolnosti musí být pamatováno při rozhodování, jak léčebně zasáhnout. Léčebný plán by měl být co nejvíce individualizovaný a měl by přinést jasné benefity pro nemocného daleko převažující nežádoucí vedlejší účinky, které provázejí každý léčebný zásah do poškozujícího zánětu (4, 9, 17).
Poškozující zánět v patofyziologii psoriázy
Kůže představuje za normálních okolností bariéru, která efektivně chrání před rozmanitými škodlivými působky vnějšího světa. Její role není pasivní. Naopak je vybavena schopností pružně reagovat na podněty a zapojit se do komplexní obranné reakce, tj. do obranného zánětu. Velmi podstatnou součástí přirozených bariér je normální kožní mikrobiota. Obranný komplex na povrchu kůže je představován do značné míry antimikrobiálními peptidy. Ty jsou tvořeny keratinocyty a vykazují vysokou účinnost vůči celému spektru mikroorganismů. U nemocných s psoriázou jsou prokázány defekty v tvorbě antimikrobiálních peptidů. Výsledkem je ztráta kontroly kožní mikrobioty a její přesmyknutí k patologickým osídlovacím vzorům. Jejich působením jsou potom poškozovány keratinocyty a jsou uvolňovány prozánětlivé působky charakteru DAMP. V obraně povrchů kůže jsou zapojeny defenziny z rodin β i α-defenzinů. Zcela unikátní postavení zaujímá katelicidin a jeho štěpný produkt, konkrétně LL-37. Jako další antimikrobiální peptid, který vybíráme z široké palety antimikrobiálních peptidů kůže, zmíníme ještě tzv. psoriasin (S100A7). Ten je součástí velké rodiny bílkovin S100 vázajících kalcium. Antibakteriální peptidy ve své podstatě vykonávají duální funkci. Jsou schopny působit také jako alarminy. Tím rozumíme jejich schopnost aktivovat dendritické buňky lokalizované v kůži, vyvolat jejich cílenou migraci do sekundárních lymfatických orgánů, kde uplatní svůj potenciál jako buňky prezentující antigenní peptidy T lymfocytům. Představují tedy most mezi vrozenou imunitou a imunitou specifickou (1).
Vzory DAMP i PAMP jsou identifikovány prostřednictvím receptorů PRR (Pattern Recognition Receptors) vyjádřených na buňkách vrozené imunity, především dendritických buňkách. Populace dendritických buněk v kůži je mimořádně komplexní a heterogenní. V epidermis se nacházejí Langerhansovy buňky. V hlubších strukturách kůže jsou přítomny dermální dendritické buňky a také plazmocytoidní dendritické buňky (pDC). Tyto buňky reagují na přítomnost vzorů PAMP a DAMP, především virů nebo nukleových kyselin uvolněných z narušených buněk kůže tvorbou interferonů (INF) I. třídy, tj. INFα a β. Jejich obranný potenciál je značný. V případě imunopatologických onemocnění však přispívají k dynamice poškozujícího zánětu natolik významně, že hovoříme o interferonovém podpisu. K jejich tvorbě dochází i vlivem katelicidinu LL-37 a psoriasinu. Produkované cytokiny se mimo jiné podílejí na aktivaci a diferenciaci myeloidních dendritických buněk (mDC). Ty jsou zcela mimořádně vybaveny celou paletou receptorů PRR z rodin TLR (Toll Like Receptors), NLR (Nod Like Receptors), RLR (Rig Like Receptors), CLR (C-Lectine Receptors) a také RAGE (Receptors for Advanced Glycation End products) a vychytávacích receptorů. Velmi zjednodušeně konstatujeme, že těmito senzory jsou schopny mDC identifikovat širokou paletu vzorů DAMP i PAMP v kožní lézi. Následuje sestavení nitrobuněčného signálního komplexu, signalisomu, který prostřednictvím aktivace transkripčního faktoru NFκB a MAPK kináz stimuluje přepis několika set genů kódujících prozánětlivé působky. Patří mezi ně TNFα, IL-12, IL-23, IL-17, IL-22, chemokinů a inducibilní NO syntáza (iNOS). Prostřednictvím cytoplazmatických receptorů NLR, např. NLRP3, je sestaven inflamasom, který aktivuje kaspázu-1. Ta je nezbytná pro proteolytické štěpení latentních forem cytokinů proIL-1β a proIL-18 za vzniku plně funkčních pluripotentních prozánětlivých cytokinů. Myeloidní dendritické buňky jednak lokálně tvoří prozánětlivé cytokiny, jednak cíleně migrují do regionálních sekundárních lymfatických orgánů, kde vytvářejí cytokinový kontext pro prezentaci antigenních peptidů T lymfocytům, jehož výsledkem je v případě psoriázy rozvoj poškozujícího zánětu (22).
Vzory DAMP a PAMP, které byly identifikovány dendritickými buňkami v iniciačním místě kůže, jsou internalizovány a v dendritických buňkách zpracovány do podoby antigenních peptidů. Ty jsou navázány na molekuly HLA II. třídy a těmito komplexy je stimulována subpopulace pomocných CD4+ T lymfocytů. Samotné rozpoznání antigenních peptidů prostřednictvím TcR nestačí k aktivaci, klonální expanzi a funkční polarizaci T lymfocytů. Musí být doplněno o kontext rozpoznávání, který představují kostimulační a koinhibiční interakce a spektrum cytokinů, tvořené dendritickými buňkami. Klonální expanze T lymfocytů je podmínkou pro jejich funkční polarizaci. Ta nastává fyziologicky podle momentálních potřeb člověka. V případě poškozujícího zánětu u nemocných s psoriázou jsou vytvořeny podmínky pro preferenční funkční vyzrávání Th0 T lymfocytů do subsetů Th1, Th17 a Th22. To je zajištěno kostimulačními interakcemi, cytokinovým mikroprostředím (5). Jsou důkazy o snížené aktivitě regulačního subsetu Treg a subsetu Th2 T lymfocytů. Pro vyzrávání do subsetu Th1 je nezbytná dostatečná produkce IL-12, která je lokálně zajišťována především myeloidními dendritickými buňkami a také INFγ, kde zdrojem mohou být NK buňky. Spolu s kostimulačními interakcemi dochází k aktivaci transkripčních faktorů STAT-1 a STAT-4 (Signal Transducers and Activators of Transcription). Výsledkem je plná funkční polarizace do subsetu Th1. Aktivitu subsetu Th1 fyziologicky tlumí subset Th2 T lymfocytů. K vyzrávání z Th0 do Th2 je zapotřebí IL-4, jehož zdrojem mohou být mastocyty nebo eosinofilní granulocyty. Uplatňují se transkripční faktory STAT-6 a GATA-3. T lymfocyty subsetu Th2 tvoří především IL-4 a jsou ve funkčně antagonistickém vztahu k subsetu Th1. Komplikovanější je funkční polarizace Th0 T lymfocytů do subsetu Th17. Složitější je i interpretace úlohy Th17 T lymfocytů v regulacích imunitní odpovědi. Původně byly Th17 T lymfocyty považovány pouze za součást poškozujícího zánětu. Tato představa byla vyvrácena rozsáhlými experimenty, které ukazují, že T lymfocyty subsetu Th17 jsou přirozenou součástí obranného zánětu, který je namířen především k ochraně proti invadujícím patogenům, především bakteriím a fungálním agens. K funkční polarizaci do subsetu Th17 dochází u aktivovaných T lymfocytů Th0 v přítomnosti převažujících prozánětlivých cytokinů tvořených myeloidními dendritickými buňkami. Mezi nimi zdůrazníme zásadní úlohu IL-6 a IL-1β. V jejich přítomnosti jsou aktivovány unikátní signální dráhy, vedoucí k aktivaci transkripčního faktoru RORγt a STAT-3. Obranný, ale i poškozující potenciál subsetu Th17 je tak velký, že vyžaduje další regulační krok. Ten je zprostředkován IL-23. Interleukin-23 je nezbytný k plné funkční aktivitě a k přežívání T lymfocytů, které jsou zadány ve vývoj Th17 T lymfocytů. Dalším imunoregulačním subsetem s mimořádnými funkcemi v regulacích imunitní odpovědi jsou T lymfocyty subsetu Treg. Pro jejich vyzrávání je typické využití transkripčního faktoru FoxP3. T regulační T lymfocyty tvorbou IL-10 a dalších působků představují zásadní homeostatický mechanismus, který kontroluje především aktivity subsetu Th17 T lymfocytů (10, 19).
Regulační osa IL-23/Th17 v patogenezi psoriázy
V procesech funkční polarizace a rovněž v efektorových funkcích T lymfocytů sehrávají podstatnou úlohu IL-23.
Interleukin IL-23 je výjimečný svou heterodimerickou strukturou. Sestává se z proteinové podjednotky p40 sdílené s IL-12 a unikátní podjednotky p19. Je funkční po vazbě na heterodimerický receptor, který opět sdílí jeden z řetězců s receptorem pro IL-12. Konkrétně je IL-23R tvořen sdíleným řetězcem IL-12Rβ1 a unikátním řetězcem IL-23R. Receptor IL-23R je exprimován na řadě buněčných typů, např. T lymfocytů Th17, naivních i paměťových T lymfocytů, NK buňkách, ILC buňkách (Innate Lymphoid Cells), dendritických buňkách, makrofázích, epitelových buňkách, keratinocytech. To určuje značný dopad regulací zprostředkovaných IL-23. Jak již bylo řečeno, IL-23 je nezbytný pro plnou funkční aktivitu a přežívání T lymfocytů subsetu Th17. To je přirozenou součástí obranného zánětu odpovědného za kontrolu bakteriálních a fungálních infekcí. Bohužel, v rámci poškozujícího zánětu jsou T lymfocyty podporované působením IL-23 nejvýznamnějším zdrojem cytokinů IL-17A a IL-17F. Kromě toho tvoří i další prozánětlivé cytokiny, např. IL-1β, TNFα, IL-6, IL-22. Mají vysokou schopnost vytvářet matrixové metaloproteinázy a také je v nich zvyšována aktivita inducibilní NO syntázy. Všechny tyto aktivity T lymfocytů Th17 zajištěné funkčním působením IL-23 jsou zásadní pro poškozující zánět v řadě imunopatologických onemocnění. Vedle již zmíněné psoriázy se jedná o Crohnovu nemoc, roztroušenou sklerózu mozkomíšní, revmatoidní artritidu a další (6) (obr. 1).
Obr. 1. Struktura cytokinů IL-12 a IL-23 a jejich receptorů 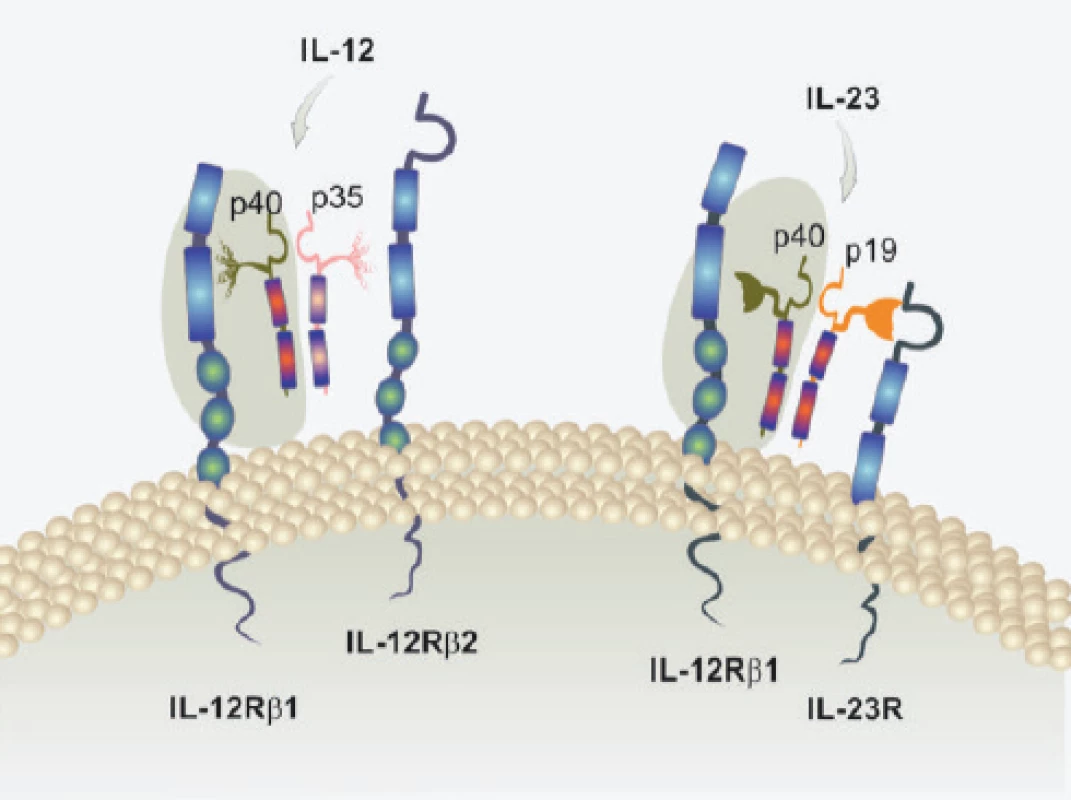
Cytokiny IL-12 a IL-23 jsou unikátní svou dimerickou strukturou. Sdílí společnou podjednotku p40. Rovněž sdílí společnou podjednotku IL-12Rβ1 receptoru. Unikátní podjednotka p19 IL-23 je cílem klinicky ověřené biologické léčby nemocných s psoriázou. Vedle IL-23 je součástí poškozujícího zánětu u nemocných s psoriázou také IL-22 tvořený subsetem Th22. T lymfocyty polarizované do subsetu Th22 jsou lokalizovány především v kůži. Pro polarizaci do subsetu IL-22 je nutná přítomnost prozánětlivých cytokinů, mezi kterými zaujímá výlučné postavení znovu IL-23, spolu s IL-6. Využit je unikátní transkripční faktor označovaný jako AHR (Aryl Hydrocarbon Receptor). Subset Th22 je odpovědný za abnormální proliferaci keratinocytů. Ta je příčinou jejich hyperplázie u nemocných s psoriázou. Subset Th22 tvoří IL-22 a také IL-26. IL-22 stimuluje keratinocyty k uvolnění antimikrobiálních peptidů, které jsme již zmiňovali. Jejich tvorba již nemá bezprostředně obranný charakter, ale působí zde i jako zesilující faktor poškozujícího zánětu s funkcí alarminů. IL-22 brání terminální diferenciaci keratinocytů a stimuluje v nich tvorbu TNFα. U nemocných s psoriázou působí synergisticky s hlavními poškozujícími cytokiny, tj. IL-17, TNFα a INFγ. V kožních lézích dochází vlivem angiogenních faktorů tvořených buněčným substrátem poškozujícího zánětu k neoangiogenezi. Zcela nově je dokládána úloha IL-36, receptoru pro tento cytokin a jeho přirozeného inhibitoru, v patogenezi pustulární psoriázy (3, 11) (obr. 2).
Obr. 2. Cytokinová regulační osa IL-12/IL-23/IL-22 v imunopatogenezi psoriázy 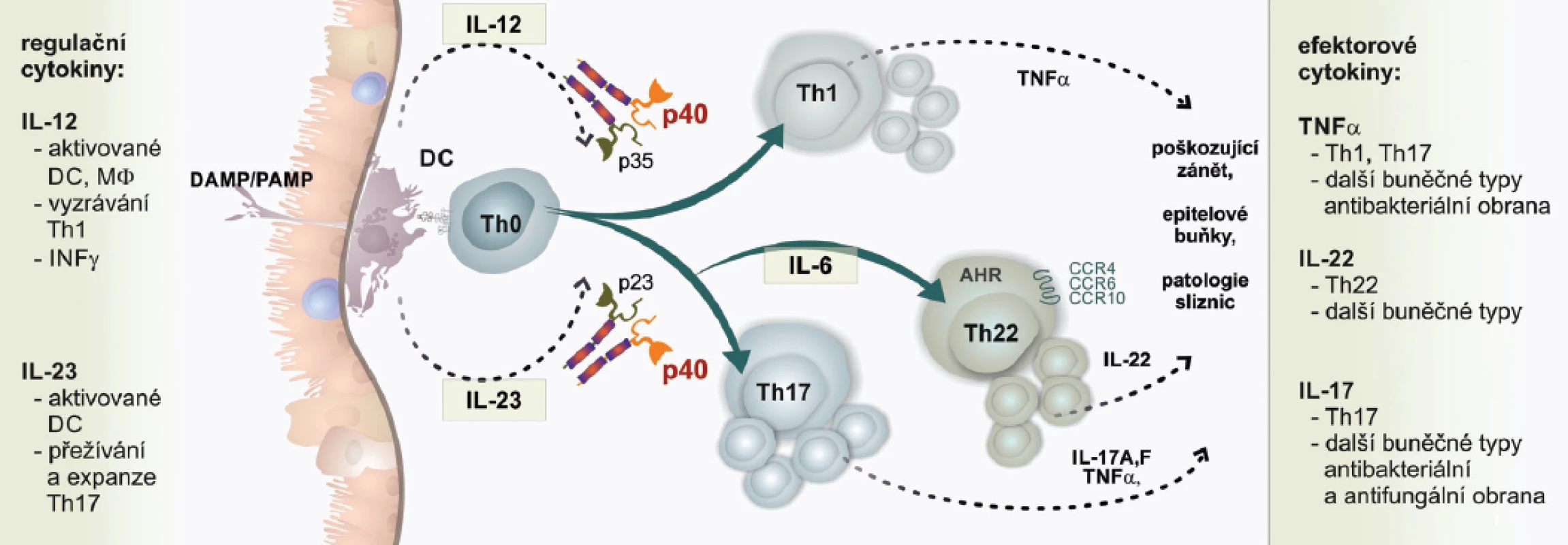
Cytokiny IL-12/IL-23 jsou klíčové regulační cytokiny, které jsou nezastupitelné ve funkční polarizaci T lymfocytů aktivovaných antigenem do subsetů Th1 a Th17. Abnormální aktivita subsetů Th1 a Th17 je charakteristickým rysem poškozujícího zánětu u nemocných s psoriázou. V rámci poškozujícího zánětu se tvoří efektorové cytokiny, především TNFα. Je výhodnější cílit léčebný zásah na regulační cytokiny IL-12/IL-23, než na efektorové cytokiny. Abnormálně regulované subsety Th1, Th17 a Th22 se stávají zdrojem efektorových cytokinů, které jsou součástí poškozujícího zánětu u nemocných s psoriázou. Všechny zmiňované subsety T lymfocytů spojuje abnormální tvorba pluripotentního prozánětlivého cytokinu TNFα, který lze pro psoriázu považovat za klíčový efektorový cytokin. Jednotlivé subsety se liší v tvorbě specifických cytokinů. T lymfocyty Th1 tvoří především INFγ s obrovskými modulačními účinky v poškozujícím zánětu. T lymfocyty Th17 tvoří skupinu cytokinů rodiny IL-17, především IL-17A. Tvoří však také další prozánětlivé cytokiny, např. IL-6. Podstatná je tvorba chemokinu IL-8, který je odpovědný za cílenou migraci neutrofilních granulocytů z dermis do stratum corneum, jež je pro psoriatickou lézi kůže typická. Zde jsou neutrofily součástí tzv. Munroových mikroabscesů charakterizujících aktivní psoriázu. Aktivované neutrofilní granulocyty vytvářejí prostřednictvím NADPH oxidázy reaktivní produkty kyslíku, které oxidačně poškozují struktury kůže za vzniku vzorů vnitřního poškození DAMP. Uvolňují také antibakte-riální peptidy, např. defenzíny, které slouží jako alarmi-ny (23).
V poškozujícím zánětu u nemocných s psoriázou zaujímá významné postavení abnormální smrt buněk, ať již keratinocytů nebo imunocytů. Při nekrotické smrti dochází po ruptuře biomembrány k uvolnění buněčného obsahu, který představuje silné prozánětlivé vzory DAMP. Apoptóza byla až donedávna považována za neimunogenní smrt buňky. Není tomu tak. Apoptotická tělíska se následně rozvolňují a obsažené nukleové kyseliny jsou identifikovány nitrobuněčnými receptory NLR. Především plazmatické dendritické buňky na tyto podněty odpovídají tvorbou interferonů I. třídy s rozsáhlými modulačními účinky na poškozující zánět. Jako zcela prozánětlivou buněčnou smrt můžeme hodnotit pyroptózu. Při ní se do okolí uvolňují prozánětlivé cytokiny, především IL-1β. Za do značné míry unikátní buněčnou smrt můžeme považovat netózu. Je specifická pro neutrofilní granulocyty. Netóza granulocytů je stimulována např. patogenními bakteriemi, ale také některými cytokiny, chemokiny (IL-8). Typické pro netózu je narušení biomembrán, včetně jaderné. DNA granulocytů je na histonech hypercitrulinována. Tento proces je katalyzován peptidylarginin deiminasou-4. Výsledkem je „rozvolnění“ jaderných struktur granulocytu. Vlákna jaderných nukleoproteinů jsou následně vymrštěna z buňky a vytvářejí tzv. extracelulární pasti. Jsou schopny zachytit patogenní mikroorganismy, případně vlastní struktury. Nesou s sebou antibakteriální peptidy, které mikroorganismy usmrcují. Bohužel, v případě poškozujícího zánětu u nemocných s psoriázou je netóza negativním jevem, protože např. DNA extracelulární pasti vytváří komplexy s kathelicidinem LL-37, které jsou stabilní a efektivně stimulují dendritické buňky. Podobně působí po vazbě na vystřelené nukleoproteiny i další antibakteriální peptidy neutrofilů. Netóza je běžně popisována při histopatologickém vyšetření psoriatické léze (20).
Léčebné zásahy do poškozujícího zánětu u nemocných s psoriázou
Pokusy léčebně ovlivnit průběh psoriázy mají dlouhou historii. Bohužel, poškozující zánět zatím umíme pouze tlumit. Nejsou k dispozici léky, jejichž použití by vedlo k vyléčení nemoci. Pro porovnání účinku jednotlivých léčiv je velmi výhodné, že máme k dispozici objektivní možnosti jak zhodnotit intenzitu onemocnění. Jedná se o tzv. PASI index (Psoriasis Activity Severity Index). Je velmi užitečné sledovat pocity jednotlivých pacientů, které je možné kvantifikovat v tzv. QoL indexu (Quality of Life). Léčba nemocných s psoriázou musí být individualizovaná. Není našim cílem přinést shrnutí současných možností, jak léčebně ovlivnit poškozující zánět u nemocných s psoriázou. Zaměříme se na léčebné zásahy zprostředkované tzv. biologiky (15).
Jako biologika v užším slova smyslu označujeme velké molekuly, především monoklonální protilátky a fúzní proteiny, které specificky váží solubilní složky poškozujícího zánětu, cytokiny nebo cílí na specifické membránové struktury buněk zánětu. Největší klinická zkušenost v léčbě psoriázy je s použitím biologik, které neutralizují pluripotentní prozánětlivý cytokin TNFα. Různé formy biologik, které neutralizují TNFα, jsou k ovlivnění poškozujícího zánětu v řadě indikací využívány s velkým úspěchem již cca 30 let. I u pacientů s psoriázou indikovaných k biologické léčbě, představují stále hlavní léčebnou modalitu (16, 18).
I přes dobrou klinickou odpověď u většiny nemocných s psoriázou zůstává tato terapie problematická. Část nemocných na ni totiž vůbec neodpovídá. U části nemocných se v průběhu léčby tvoří neutralizující protilátky, které účinnost této terapie snižují. Na bezprostřední nežádoucí účinky terapie při aplikaci léku a dlouhodobé omezení obranných funkcí až s fatálními důsledky, jsme již poukázali. Proto se principiálně jeví užitečnějším, aby biologická terapie necílila na efektorové mechanismy poškozujícího zánětu (TNFα), ale byla soustředěna na indukční fáze poškozujícího zánětu. V tomto ohledu byly získány klinické zkušenosti s řadou biologik. U některých z nich byla ve velkých klinických studiích prokázána jejich účinnost v léčbě nemocných s psoriázou. Jde například o ustekinumab, který neutralizuje podjednotku p40 sdílenou IL-12 a IL-23. Regulační osa IL-23/Th17 je klíčová v poškozujícím zánětu u nemocných s psoriázou. Vede, jak již bylo popsáno výše, k abnormální polarizaci do subsetů Th1 a Th17. Subset Th17 může být cíleně modulován buď biologiky blokujícími receptor IL-17R (brodalumab) nebo biologiky neutralizujícími samotný IL-17 (secukinumab, ixekizumab) (13, 21).
Při podrobné analýze imunobiologických funkcí IL-23 bylo prokázáno, že specifická podjednotka p19 IL-23 sehrává srovnatelnou, ne-li významnější úlohu v regulacích poškozujícího zánětu u nemocných s psoriázou, než podjednotka p40 sdílená IL-12/IL-23. Receptor pro IL-23 (popsaný výše), je vyjádřen na mnoha buněčných typech imunitní soustavy, např. NK buňkách, dendritických buňkách, makrofázích, paměťových T lymfocytech. Je vyjádřen i na keratinocytech. O zapojení IL-23R vyjádřeného na naivních T lymfocytech, které se po antigenní stimulaci v přítomnosti IL-6 a TGFβ funkčně polarizují do subsetu Th17, jsme již také pojednali. V psoriatických kožních lézích byla prokázána zvýšená přítomnost mRNA pro podjednotku p19 IL-23. Tyto a další nálezy, např. s použitím experimentálních zvířecích modelů, vedly k oprávněným úvahám, že biologická terapie cílící specificky na podjednotku p19 IL-23, bude účinně tlumit poškozující zánět u nemocných s psoriázou. Navíc, při porovnání s biologiky neutralizujícími sdílenou podjednotku p40 IL-12/IL-23 lze očekávat, že obranné antiinfekční aktivity imunitního systému budou ovlivněny v menší míře. To bylo ostatně prokázáno v experimentálních zvířecích modelech, kde bylo doloženo, že neutralizace p19 IL-23 nesnižuje obranyschopnost vůči mykobakteriím, protože osa IL-12, vedoucí k polarizaci do subsetu Th1 a produkci INFγ zůstává nedotčena (12, 14).
V klinických studiích označených jako VOYAGE 1, VOYAGE 2 a NAVIGATE byly získány údaje, že neutralizace p19 IL-23 protilátkou guselkumab je u nemocných s psoriázou klinicky účinná s příznivým bezpečnostním profilem (2).
Závěr
Studium poškozujícího zánětu, který je významnou součástí patogeneze psoriázy, vedlo k odhalení zásadní regulační úlohy osy IL-23/Th17. Jejím prostřednictvím je regulována polarizace T lymfocytů do subsetů Th17. Tyto subsety, spolu s podílem dendritických buněk, keratinocytů a dalších buněčných elementů poškozujícího zánětu, jsou odpovědné za aktivitu onemocnění. Tu je možno ovlivnit různými léčebnými modalitami. Biologická terapie, která cílí na společnou podjednotku p40 IL-12/IL-23 prokázala účinnost v rozsáhlých klinických pokusech. Srovnatelných či dokonce lepších výsledků, se zachováním bezpečnostního profilu, bylo dosaženo při použití biologika guselkumabu neutralizujícího specifickou podjednotku p19 IL-23.
Tento článek vznikl s podporou společnosti
Janssen-Cilag, s.r.o.
Kontaktní adresa:
prof. RNDr. Jan Krejsek, CSc.
Ústav klinické imunologie a alergologie
Fakultní nemocnice
Sokolská tř. 581
500 05 Hradec Králové
e-mail: jan.krejsek@fnhk.cz
Zdroje
1. Albanesi, C., Madonna, S., Gisondi, P., et al. The interplay between keratinocytes and immune cells in the pathogenesis of psoriasis. Front Immunol, 2018, 9 (1549), p. 1-7.
2. Blauvelt, A., Papp, KA., Griffiths, ChEM., et al. Efficacy and safety of guselkumab, an anti-interleukin-23 monoclonal antibody, compared with adalimumab for the continuous treatment of patients with moderate to severe psoriasis. Results from the phase III, double-blinded, placebo - and active comparator-controlled VOYAGE 1 trial. J Am Acad Dermatol, 2016, http://dx.doi.org/10.1016/j.jaad.2016.11.041.
3. Bridgewood, Ch., Fearnley, GW., Berekmeri, A., et al. IL-36γ is a strong inducer of IL-23 in psoriatic cells and activates angiogenesis. Front Immunol, 2018, 9 (200), p. 1-12.
4. Coates, LC., FitzGerald, O., Helliwell, PS., et al. Psoriasis, psoriatic arthritis, and rheumatoid arthritis: is all inflammation the same? Semin Arthrit Rheumatism, 2016, 46, p. 291-304.
5. Diani, M., Altomare, G., Reali, E. T cell responses in psoriasis and psoriatic arthritis. Autoimmun Rev, 2015, 14 (4), p. 286-92.
6. Fotiadou, Ch., Lazaridou, E., Sotiriou, E., et al. Targeting IL-23 in psoriasis: current perspectives. Psoriasis: Targets Ther, 2018, 8, p. 1-5.
7. Hawkes, JE., Chan, TC., Krueger, JG. Psoriasis pathogenesis and the development of novel targeted immune therapies. J Allergy Clin Immunol, 2017, 140 (3), p. 645-653.
8. Kim, J., Krueger, JG. The immunopathogenesis of psoriasis. Dermatol Clin, 2015 33 (1), p. 13-23.
9. Krejsek, J., Andrýs, C., Krčmová, I. Imunologie člověka. 1. vyd. Hradec Králové: Garamon, 2016. 496 s. ISBN: 978-80-86472-74-4. http://www.imunologie-cloveka-krejsek.cz
10. Kuwabara, T., Ishikawa, F., Kondo, M., et al. The role of IL-17 and related cytokines in inflammatory autoimmune diseases. Med Inflam, 2017, http://dx.doi.org/ 10.1155/2017/3908061.
11. Lanfranca, MP., Lin, Y., Fang, J., et al. Biological and pathological activities of interleukin-22. J Mol Med, 2016, 94, p. 523-534.
12. Machado, Á., Torres, T. Guselkumab for the treatment of psoriasis. BioDrugs, 2018, https://doi.org/10.1007/s40259-018-0265-6.
13. Mylle, S., Grine, L., Speeckaert, R., et al. Targeting the IL-23/IL-17 pathway in psoriasis: the search for the good, the bad and the ugly. Am J Clin Dermatol, 2018, doi: 10.1007/s40257-018-0366-5.
14. Puig, L. The role of IL-23 in the treatment of psoriasis. Expert Rev Clin Immunol, 2017, 13 (6), p. 525-534.
15. Rapalli, VK., Singhvi, G., Dubey, SK., et al. Emerging landscape in psoriasis management: From topical application to targeting biomolecules. Biomed Pharmacother, 2018, 106, p. 707-713.
16. Saeterdal, I., Mork, NJ., Dalaker, M., et al. TNF–α inhibitors and efalizumab for the treatment of skin diseases. Oslo, Norway: Knowledge Centre for the Health Services at The Norwegian Institute of Public Health (NIPH); 2007 May. Report from Norwegian Knowledge Centre for the Health Services (NOKC) No. 15-2007.
17. Salem, I., Ramser, A., Isham, N., et al. The gut microbiome as a major regulator of the gut-skin axis. Frontiers Microbiol, 2018, 9 (1459), p. 1-14.
18. Sator, P. Safety and tolerability of adalimumab for the treatment of psoriasis: a review summarizing 15 years of real-life experience. Ther Adv Chronic Dis, 2018, 9 (8), 147-158.
19. Schön, MP., Erpenbeck, L. The interleukin-23/Interleukin-17 axis links adaptive and innate immunity in psoriasis. Front Immunol, 2018, 9 (1323), p. 1-11.
20. Sil, P., Wong, SW., Martinez, J. More than skin deep: autophagy is vital for skin barrier function. Front Immunol, 2018, 9 (1376), p. 1-14.
21. Sud, V., Abboud, A., Tohme, S., et al. IL-17A – A regulator in acute inflammation: Insights from in vitro, in vivo and in silico studies. Cytokine, 2018, S1043-4666 (18), p. 30116-9.
22. Tai, Y., Wang, Q., Korner, H., et al. Molecular mechanisms of T cells activation by dendritic cells in autoimmune diseases. Front Pharmacol, 2018, 9 (642), p. 1-10.
23. Taylor, PR., Roy, S., Leal, SM., et al. Activation of neutrophils by autocrine IL-17A-IL-17RC interactions during fungal infection is regulated by IL-6, IL-23, RORγt and dectin-2. Nature Immunol, 2014, 15 (2), p. 143-151.
Štítky
Dermatológia Detská dermatológia
Článok vyšiel v časopiseČesko-slovenská dermatologie
Najčítanejšie tento týždeň
2018 Číslo 6- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
- První a jediná schválená imunoterapie vzácného agresivního karcinomu kůže
-
Všetky články tohto čísla
- Zoonotické dermatofytózy: klinický obraz, diagnostika, etiologie, léčba, epidemiologická situace u nás
- Kontrolní test
- Pět případů lidských dermatofytóz vyvolaných zoofilním druhem Trichophyton erinacei přeneseným z ježků
- Efektivní léčebná modulace poškozujícího zánětu u nemocných s psoriázou guselkumabem cílícím na specifickou podjednotku p19 IL-23 regulační osy IL-23/Th17
- Identifikace dermatofytů pomocí MALDI-TOF hmotnostní spektrometrie
- Využití PCR-HRMA při přímé detekci a identifikaci původců dermatofytóz z klinických vzorků
- Možnosti terapie onychomykózy nízkoteplotním plazmatem
- Klinický případ: Shluk žlutavých papul u kojence – stručný přehled
- Mykózy nohou a nehtů
- Zápisnica zo zasadania výboru Slovenskej dermatovenerologickej spoločnosti SLS Bratislava 7. 4. 2018
- Zápis ze schůze výboru ČDS Praha 27. 9. 2018
- 12. KONFERENCE AKNÉ A OBLIČEJOVÉ DERMATÓZY
- Odborné akce 2019
- Česko-slovenská dermatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Zoonotické dermatofytózy: klinický obraz, diagnostika, etiologie, léčba, epidemiologická situace u nás
- Klinický případ: Shluk žlutavých papul u kojence – stručný přehled
- Pět případů lidských dermatofytóz vyvolaných zoofilním druhem Trichophyton erinacei přeneseným z ježků
- Mykózy nohou a nehtů
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



