-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Imunohistochemický průkaz TTF-1 v peroperačních bioptických vzorcích plicních adenokarcinomů: roční zkušenosti
Immunohistochemical Detection of TTF-1 in Intraoperative Bioptic Samples of Adenocarcinoma of the Lung: a Year-Long Experience
The thyroid transcription factor 1 (TTF-1) is a highly sensitive and specific marker of adenocarcinomas of pulmonary origin in differential diagnosis of solitary pulmonary nodules. Positivity of TTF-1 as a marker of primary pulmonary tumor could have a very high impact on surgical treatment strategy. From known protocols we developed the method of immunohistochemical investigation of intraoperative bioptic samples from frozen section lasting about 15 minutes. During last year, we applied this method on 30 cases of intraoperative bioptic samples. All investigated cases were verified by immunohistochemical examination from formalin-fixed and paraffin-embedded definite tissue samples. With the exception of two samples in which the result was inconclusive from both frozen and fixed tissue, all other samples revealed the same result. Our experience demonstrates that intraoperative immunohistochemical investigation of TTF-1 in proper consequences could be a very useful tool for routine practice.
Key words:
thyroid transcription factor 1 (TTF-1) – intraoperative biopsy – immunohistochemistry – lung adenocarcinoma
Autori: R. Matěj; J. Vedralová; F. Koukolík
Pôsobisko autorov: Oddělení patologie a molekulární medicíny, Fakultní Thomayerova nemocnice s poliklinikou, Praha
Vyšlo v časopise: Čes.-slov. Patol., 44, 2008, No. 2, p. 41-44
Kategória: Původní práce
Súhrn
Tyreoidní transkripční faktor 1 (TTF-1) je vysoce specifický a senzitivní marker nádorových lézí plicního původu. Imunohistochemická detekce jeho exprese má velký význam při určování primárního původu plicních adenokarcinomů v diferenciálně diagnostické rozvaze oproti metastatickému postižení plicního parenchymu adenokarcinomy jiných primárních lokalizací či při určení primárního plicního původu extratorakálních nádorových lézí. Pozitivita peroperačního imunohistochemického průkazu markeru TTF-1 může mít významný vliv na strategii operačního řešení, nicméně v případě peroperačních biopsií je velmi důležitý časový faktor. Na našem pracovišti jsme zavedli metodiku imunohistochemického stanovení exprese TTF-1 v peroperačních vzorcích plicních adenokarcinomů. Po optimalizaci nám známých a dostupných protokolů jsme dosáhli času 15 minut. Z celkového počtu 290 provedených peroperačních vyšetření byla metodika imunohistochemického průkazu aplikována ve 30 případech. Imunohistochemická exprese TTF-1 byla poté ověřena i vyšetřením definitivních parafinových bloků. Z celkového počtu pouze ve dvou případech nebylo peroperační imunohistochemické vyšetření jednoznačně interpretovatelné, sporný výsledek však byl zaznamenán i v definitivním průkazu. Naše roční zkušenost tedy potvrzuje vysokou užitnou hodnotu peroperačního stanovení markeru TTF-1 ve vzorcích nádorů plic s vysokou mírou senzitivity a specificity a s nevýrazným časovým zatížením.
Klíčová slova:
tyreoidní transkripční faktor 1 (TTF-1) – peroperační biopsie – imunohistochemie – plicní adenokarcinomÚvod
Primární plicní nádory jsou jednou z nejčastějších malignit dospělého věku. Jejich vysoká četnost souvisí s mnoha faktory, z nichž nejvíce epidemiologicky závažným je kouření. Z hlediska prognózy i terapeutických důsledků jsou primární plicní karcinomy děleny na malobuněčné a nemalobuněčné. Častým nemalobuněčným plicním karcinomem jsou různé typy adenokarcinomu (10). Zároveň však je plicní parenchym i jednou z nejčastějších lokalizací metastatického postižení karcinomy různých primárních lokalizací, z nichž tvoří adenokarcinomy největší skupinu. Jedná se zejména o primární adenokarcinomy zažívacího a močového traktu a pohlavních orgánů (10). Diferenciálně diagnostická rozvaha mezi postižením plicního parenchymu primárním bronchopulmonálním karcinomem a metastatickým postižením je klíčová z hlediska prognózy pacienta a léčebných modalit. Zejména chirurgické přístupy k léčbě solitárních plicních lézí jsou vysoce odlišné v případě primárního postižení a metastáz. K určování diferenciálně diagnostické rozvahy primárních plicních lézí často dochází během peroperačního hodnocení vzorků nádorů ze zmrazeného materiálu, které se opírá o morfologické vlastnosti nádorové tkáně, o anamnestická a klinická data a o výsledky radiologických vyšetření (9). V případě adenokarcinomů je mnohdy jednoznačné určení primární lokalizace nádoru nemožné a závisí na širokém imunohistochemickém profilu nádorové tkáně, který však může být proveden až z definitivního parafinového materiálu (10, 11).
Jedním z klíčových diagnostických markerů je TTF-1. TTF-1 je tkáňově specifický transkripční faktor, který je za fyziologických podmínek exprimován zejména alveolárními pneumonocyty II. typu a ve tkáni štítné žlázy; kromě toho byl identifikován v průběhu embryonálního vývoje některých oblastí mozku (5, 6). Pozitivita TTF-1 tedy (při vyloučení karcinomu štítné žlázy) s vysokou mírou senzitivity a specificity svědčí pro primární lokalizaci karcinomu v plicním parenchymu (7, 9). Navíc pozitivita tohoto markeru vysoce koreluje s délkou přežití pacientů s primárním plicním adenokarcinomem (2).
Metodika peroperačního imunohistochemického vyšetřování materiálu ze zmrazených řezů je s výhodou užívána jako doplňující vyšetření pro zpřesnění diagnózy. Jejími hlavními nevýhodami jsou pracnost, vysoké náklady a prodloužení doby trvání peroperačního vyšetření. Cílem různých úprav metodik je dosáhnout co nejvýtěžnějšího diagnostického výsledku za co nejnižších provozních nákladů a při zachování co nejkratšího časového intervalu provedení peroperačního vyšetření. Analýzou a úpravami nám dostupných protokolů a porovnáním dostupných chemikálií jsme zavedli metodiku vyšetření exprese markeru TTF-1 na zmrazených řezech z peroperačních vzorků nádorových lézí plicního parenchymu do rutinní diagnostické praxe. Předkládáme výsledky našich ročních zkušeností.
Materiál a metodika
K dispozici jsme měli tři různé metodické protokoly pro imunohistochemickou detekci různých markerů na zmrazených řezech z peroperačních vyšetření. Jednalo se o dva různé protokoly pro detekci antigenu TTF-1 (3, 1 a Nicholson AG, Royal Brompton Hospital, London, UK – osobní sdělení) a protokol pro detekci širokospektrého cytokeratinu (Knudsen H, Hospital Herlev, Denmark – osobní sdělení). Metodickou úpravou stávajících protokolů jsme vytvořili protokol nový, jehož celková doba trvání nepřesahuje 15 minut. Detail protokolu je shrnut v tabulce 1.
Tab. 1. Použitá metodika pro peroperační imunohistochemické vyšetření zmrazeného materiálu 
Jako pozitivní kontrolu jsme užívali vzorky pozitivních zmrazených nádorů, které byly dlouhodobě skladovány při teplotě -70 °C a -20 °C a části okolní nepostižené plicní tkáně.
Testovali jsme dvě různé primární myší monoklonální protilátky klonu 8G7G3/1 proti TTF-1 od výrobce Dako (Dako, Glostrup, Dánsko) v ředění 1 : 200 a LabVision při ředění 1 : 100 (Lab Vision Corporation, Fremont, CA, USA) a dva různé detekční kity EnVision™+ od výrobce Dako (Dako, Glostrup, Dánsko) a Histofine® od výrobce Nichirei (Nichirei Biosciences, Tokyo, Japonsko) dle instrukcí od výrobce.
Jako negativní kontrola byly užity vzorky nádorové tkáně, na něž byl aplikován pouze sekundární detekční kit.
Za sledované období bylo na Oddělení patologie a molekulární medicíny Fakultní Thomayerovy nemocnice v Praze provedeno celkem 290 všech peroperačních vyšetření. Z toho bylo peroperační imunohistochemické vyšetření provedeno u 30 případů nádorových lézí plicního parenchymu. Peroperační imunohistochemické vyšetření bylo ověřeno imunohistochemickým průkazem z definitivních řezů z parafinových bloků formolem fixovaných vzorků materiálu.
Výsledky
K aplikaci peroperačního imunohistochemického průkazu exprese antigenu TTF-1 byly užity vzorky nádorových lézí, které měly v peroperačním vyšetření histologické charakteristiky adenokarcinomu (obr.1). K aplikaci peroperačního imunohistochemického průkazu exprese antigenu TTF-1 jsme přistoupili ve 30 případech; počet vyšetření tedy jen mírně překročil 10 % z celkového počtu provedených peroperačních biopsií.
Obr. 1. Obraz invazivního adenokarcinomu v peroperačním vyšetření ze zmrazeného materiálu (a) a z definitivního fixovaného vzorku (b) jako typický příklad, kdy zvážit indikaci peroperačního imunohistochemického průkazu TTF-1. Standardní barvení toluidinovou modří a hematoxylinem-eozinem. Původní zvětšení 200krát 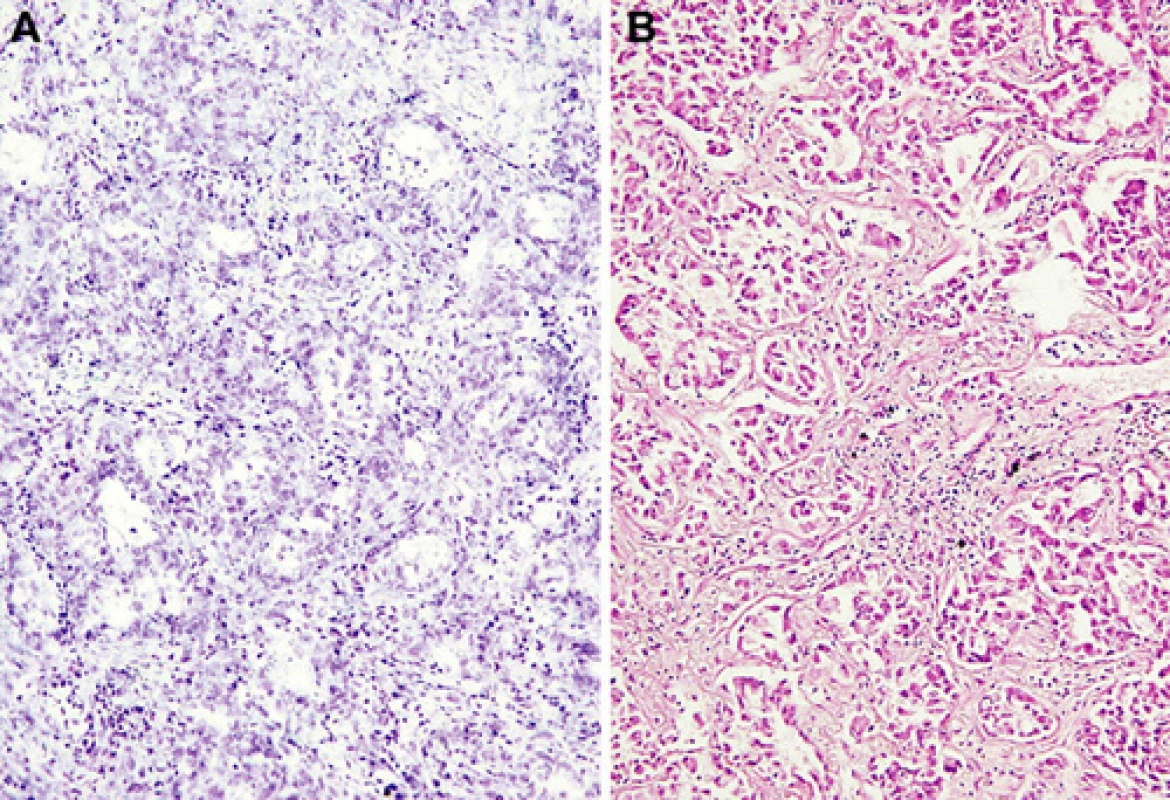
Ve všech případech provedených imunohistochemických vyšetření peroperačních biopsií byly výsledky z definitivních řezů z parafinových bloků fixovaného materiálu identické (obr. 2). Ve dvou případech nebyla interpretace výsledného nálezu z peroperačního vyšetření jednoznačná, avšak obdobné diagnostické rozpaky byly zaznamenány i ve vyšetření definitivního materiálu. Kompatibilita vyšetření peroperačního a definitivního materiálu tedy byla absolutní i při vědomí nepříliš velkého souboru vyšetření.
Obr. 2. Jaderná pozitivita nádorových elementů v imunohistochemické reakci s monoklonální protilátkou proti TTF-1 ve zmrazeném materiálu peroperačního vyšetření (a) a v definitivním parafinovém materiálu formalínem fixovaného vzorku (b). Původní zvětšení 200krát 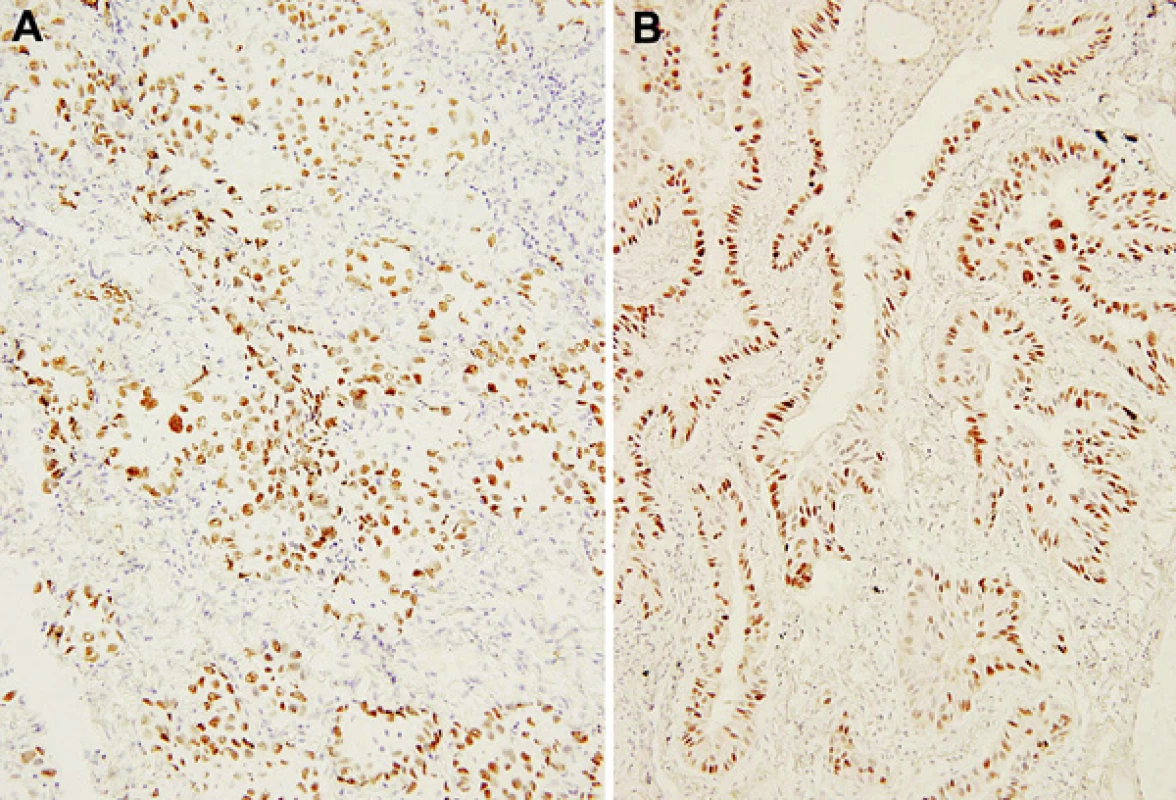
Při sledování pozitivních kontrol byl zaznamenán významný úbytek imunoreaktivity antigenu TTF-1 u vzorků skladovaných při teplotě -20 °C během několika týdnů; u vzorků skladovaných v hlubokomrazících boxech při -70 °C kvalitativní ani kvantitativní pokles imunoreaktivity zaznamenán nebyl. Přiřazením malého úseku okolní plicní tkáně při makroskopickém zpracování peroperačních vzorků je v řezu přítomna tkáň, jež slouží jako ideální autokontrola.
K testování jsme zvolili klon 8G7G3/1 monoklonálních protilátek proti TTF-1 vzhledem k jeho nižší falešné pozitivitě (4, 8). Porovnáním obou primárních myších monoklonálních protilátek a sekundárních detekčních kitů byly dosaženy prakticky identické výsledky. Při daných ředěních však ekonomicky nejvýhodnější variantou je kombinace primární monoklonální protilátky od firmy Dako se sekundárním detekčním kitem Histofine®.
Diskuse
Předložený soubor dokládá předchozí písemné poznatky i nepublikované zkušenosti o vysoké míře citlivosti imunohistochemické detekce markeru TTF-1 v peroperačním materiálu tkáně nádorových lézí v plicním parenchymu. Jedná se o relativně pracnou a nákladnou metodiku, která však v případě pozitivního výsledku (a vyloučení primárního nádorového postižení štítné žlázy) významně zvyšuje míru diagnostické jistoty prováděného vyšetření a může se významně podílet na volbě způsobu adekvátní chirurgické léčebné terapie. Námi upravený protokol zkracuje dobu potřebnou pro provedení vyšetření z původních cca 40 minut (3) na 15 minut a tím se stává prakticky užitečnější v běžném rutinním provozu. Také ekonomický aspekt prováděného vyšetření může být při správné volbě primární protilátky a sekundárního detekčního kitu významně modifikován při zachování vysoké míry citlivosti (1). Navíc při vysoce cílené indikaci (počet vyšetření v našem souboru nepřekročil 11 %) nejsou celkové ekonomické náklady extrémně vysoké.
Z našich zkušeností také plyne, že skladování pozitivních kontrol v běžném mrazicím boxu (-20 °C) je možné jen po nepříliš dlouhé časové období a pro užití tohoto typu kontroly je nutné vybavení laboratorního provozu hlubokomrazícím boxem (-70 °C). Tento typ drahého přístrojového vybavení nebývá vždy jednoduše dostupný. Vhodnou volbou materiálu k vyšetření, kdy je součástí vzorku i část nepostiženého plicního parenchymu coby autokontrola, lze tuto jinak nezbytnou nákladnou materiálovou položku prakticky zcela pominout.
Námi prezentovaný protokol lze použít i v dalších indikacích, kdy může výsledek peroperačního imunohistochemického vyšetření významně ovlivnit pacientovu prognózu, eventuálně může být výsledkem tohoto vyšetření modifikována volba chirurgického operačního zákroku. V první řadě se aplikace tohoto typu vyšetření bude týkat možností zpřesnění detekce nepřítomnosti nádorových buněk v resekčních liniích či přítomnosti metastatického postižení lymfatických uzlin (karcinomy gastrointestinálního traktu, močopohlavního ústrojí, ORL oblastí či dýchacího traktu), diferenciálně-diagnostické rozvahy uzlinového syndromu (metastatické postižení proti hematologickým malignitám) a v neposlední řadě při detekci postižení sentinelových lymfatických uzlin v případě zhoubných nádorů mléčné žlázy či maligního melanomu.
Závěr
Peroperační imunohistochemický průkaz exprese markeru TTF-1 může významnou měrou přispět ke zkvalitnění diagnostického procesu a tím se může podílet na správnější volbě adekvátní chirurgické terapie. Optimalizací protokolu a racionalizací indikace užití této metodiky lze dosáhnout ekonomicky i časově uspokojivých výsledků peroperačních vyšetření i v rutinním provozu běžné bioptické laboratoře. Metodiku peroperační imunohistochemie lze aplikovat i na další oblasti diferenciálně-diagnosticky obtížných bioptických vyšetření při vědomí pracnosti a ekonomických aspektů.
Poděkování:
Autoři děkují prof. A.G. Nicholsonovi z Royal Brompton Hospital v Londýně a dr. H. Knudsenové za poskytnutí jejich protokolů. Dále děkují kolektivu laborantek Oddělení patologie a molekulární medicíny FTNsP za výbornou technickou práci při zavádění i rutinní aplikaci popisované metodiky.
MUDr. Radoslav Matěj, Ph.D.
Oddělení patologie a molekulární medicíny FTNsP
Vídeňská 800
140 59 Praha 4-Krč
tel.: 261083741
fax.: 234333742
e-mail: radoslav.matej@ftn.cz
Zdroje
1. Butcher D.N., Goldstraw P., Ladas G., Dusmet M.E., Sheppard M.N., Nicholson A.G.: Thyroid transcription factor 1 immunohistochemistry as an intraoperative diagnostic tool at frozen section for distinction between primary and secondary lung tumors. Arch. Pathol. Lab. Med., 131, 2007, s. 582-587.
2. Barlési F., Pinot D., Legoffic A., et al.: Positive thyroid transcription factor 1 staining strongly correlates with survival of patients with adenocarcinoma of the lung. Br. J. Cancer, 22, 2005, s. 450-452
3. Camilleri-Broet S., Alifano M., Morcos M., et al.: Peroperative frozen section analysis of TTF-1 antigen expression. J. Clin. Pathol., 57, 2004, s. 98–100.
4. Compérat E., Zhang F., Perrotin C., et al.: Variable sensitivity and specificity of TTF-1 antibodies in lung metastatic adenocarcinoma of colorectal origin. Mod. Pathol., 18, 2005, s. 1371-1376.
5. Ikeda K., Clark J.C., Shaw-White J.R., et al.: Gene structure and expression of human thyroid transcription factor-1 in respiratory epithelial cells. J. Biol. Chem., 270, 1995, s. 8108-8114.
6. Lazzaro D., Price M., de Felice M., et al.: The transcription factor TTF-1 is expressed at the onset of thyroid and lung morphogenesis and in restricted regions of the foetal brain. Development., 113, 1991, s.1093-1104.
7. Moldvay J., Jackel M., Bogos K., et al.: The role of TTF-1 in differentiating primary and metastatic lung adenocarcinomas. Pathol. Oncol. Res., 10, 2004, s. 85-88.
8. Penman D., Downie I., Roberts F.: Positive immunostaining for thyroid transcription factor-1 in primary and metastatic colonic adenocarcinoma: a note of caution. J. Clin. Pathol., 59, 2006, s. 663-664.
9. Sienko A., Allen T.C., Zander D.S., Cagle P.T.: Frozen section of lung specimens. Arch. Pathol. Lab. Med., 129, 2005, s. 1602-1609.
10. Travis W.T., Brambilla E., Müller-Hermelink H.K., Harris C.C.: Pathology and Genetics of Tumours of the Lung, Pleura, Thymus and Heart. IARC Press, Lyon, 2004, s. 9-122.
11. Zamecnik J., Kodet R.: Value of thyroid transcription factor-1 and surfactant apoprotein A in the differential diagnosis of pulmonary carcinomas: a study of 109 cases. Virchows Arch., 440, 2002, s. 353-361
Štítky
Patológia Súdne lekárstvo Toxikológia
Článok vyšiel v časopiseČesko-slovenská patologie

2008 Číslo 2-
Všetky články tohto čísla
- Problémy v rutinní diagnostice uroteliálních lézí
- WHO klasifikácia tumorov centrálneho nervového systému 2007: porovnanie s klasifikáciou z roku 2000
- Dvojité imunohistochemické barvení CD1a a CD68 pro fenotypickou charakteristiku histiocytózy z neurčených buněk
- JAKÁ JE VAŠE DIAGNÓZA?
- Imunohistochemický průkaz TTF-1 v peroperačních bioptických vzorcích plicních adenokarcinomů: roční zkušenosti
- Tubulo-squamous Polyp of the Vagina
- Prof. MUDr. Karel Dvořák, DrSc., již není mezi námi
- OSOBNÍ ZPRÁVY
- JAKÁ JE VAŠE DIAGNÓZA?
- JAK SE VÁM LÍBÍ?
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Imunohistochemický průkaz TTF-1 v peroperačních bioptických vzorcích plicních adenokarcinomů: roční zkušenosti
- Prof. MUDr. Karel Dvořák, DrSc., již není mezi námi
- Problémy v rutinní diagnostice uroteliálních lézí
- Dvojité imunohistochemické barvení CD1a a CD68 pro fenotypickou charakteristiku histiocytózy z neurčených buněk
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



