-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Problémy v rutinní diagnostice uroteliálních lézí
Difficulties in Routine Diagnostics of Urothelium Lesions
Background:
Facing the increasing frequency of urothelial neoplasms and stratified therapeutic strategy pathologists have to meet the demands of urologists for constantly increasing preciseness of the histopathology reports influencing the application of tailored therapeutic schemes. The WHO/ISUP consensus conference in 1998 (5) resulted into adoption of a new classification of the urothelial lesions (11). Its employment requires considering of features that can be difficult to find in the material provided.Material and methods:
parallel typing of more than 200 urothelial neoplasms from the daily routine biopsy samples provided by the faculty of medicine urology clinic according to the previous Mostofi 1973 and the new WHO/ISUP 1998 classification.Results:
Realizing the consultation demands we have identified some repetitive problems in the urothelium lesions diagnostics considering typing, grading, and staging of the lesions.
Typing was a less frequent source of problems. It appeared in classifying lesions with inverted growth, and mucin producing urothelial neoplasms vs. adenocarcinomas. Less important typing problems are represented by uncommon rare diagnoses, as they manifest from the beginning as a specialty solvable mostly with the help of immunohistochemistry.Grading was experienced as troublesome in the following items:
papillary hyperplasia vs. LG papillary ca, PUNLMP vs. LG papillary ca, HG papillary ca with a majority of LG material, monotonous types of HG flat lesions, and combined lesions.
Staging difficulties applied mostly in identification of the initial unequivocal invasion and the substaging of pT1 into pT1a and pT1b with learning to find the decisive mucosa structures described in detail as late as 1983 (2). We have implemented reporting the presence/absence of the detrusor muscle in the material as a marker describing the representativness of the sample provided; we consider this approach less confusing than introduction of clinical staging terminology Ta, T1 instead of pTa, pT1. To help the practising pathologists accustomed to the previous classification system we have organized postgraduate courses dealing with the application of the new diagnostic criteria adopted by the new version WHO 2004 urothelial neoplasms classification. A slide collection from the routine biopsy material comparing the previous and the new classification and a reference image database with commented reference images are being developed in the LUCIA Net image archiving system. Free access for study is available at http://www.laboratory-imaging.com. Recently, it includes over 80 images.Conclusion:
adopting the new system of urothelial lesions classification requires consideration of formerly not employed features. The learning can be simplified with both classical slide collection & e-learning image database.Key words:
urothelial pathology – urothelial carcinoma – WHO/ISUP consensus of urothelial lesions classification
Autoři: J. Dušková 1; M. Babjuk 2; V. Soukup 2
Působiště autorů: Ústav patologie 1. LF UK a VFN, Katedra patologie IPVZ a Vysoká škola zdravotní, Praha 1; Urologická klinika 1. LF UK a VFN a Katedra urologie IPVZ, Praha 2
Vyšlo v časopise: Čes.-slov. Patol., 44, 2008, No. 2, p. 29-34
Kategorie: Přehledový článek
Souhrn
Narůstající incidence uroteliálních neoplazií a individualizované terapeutické postupy vyžadují od patologů stále přesnější diagnostiku uroteliálních lézí. Konsensus WHO/ISUP z r. 1998 (5) vyústil v přijetí nové klasifikace uroteliálních lézí (11). Její použití vyžaduje hodnocení znaků, jež jsou někdy v rutinním materiálu obtížně zjistitelné.
Materiál a metody:
paralelní hodnocení více než 200 uroteliálních nádorů z denní bioptické diagnostiky vzorků dodaných univerzitní urologickou klinikou, podle Mostofiho klasifikace z r. 1973 a nové WHO/ISUP z r. 1998 přijaté jako základ pro WHO klasifikaci 2004.Výsledky:
V souvislosti s konzultačními dotazy jsme identifikovali některé problémové okruhy v diagnostice uroteliálních lézí, týkající se méně často typizace, častěji pak stupně a stadia (grading, staging).
Typing – problémy určení dignity se týkaly afekcí s invertovaným růstem a uroteliálních karcinomů produkujících hlen versus adenokarcinomů. Menší význam mají problémy s určením neobvyklých nádorů, protože se zpravidla jeví jako zvláštnost od počátku a jsou dořešeny pomocí imunohistochemie.Grading byl někdy obtížný v následujících položkách:
papilární hyperplazie vs. LG (Low grade) papilární karcinom, PUNLMP (Papillary urothelial neoplasia of low malignant potential) vs. LG papilární karcinom, HG (High grade) papilární karcinom s převahou LG struktur, monotónní typy HG plochých lézí a kombinované léze.
Staging přinášel často problém s identifikací jednoznačné iniciální invaze a subklasifikace pT1 na pT1a a pT1b s nácvikem rozpoznání slizničních struktur popsaných podrobně až v práci z r. 1983 (2). Zvykli jsme si popisovat přítomnost /absenci svaloviny detruzoru jakožto znaku určujícího hloubku resekce; považujeme tento postup za vhodnější, než užití klinických kategorií stagingu Ta, T1 místo pTa, pT1. Na pomoc patologům zvyklým předchozímu způsobu klasifikace jsme zorganizovali postgraduální kurzy o aplikaci nových diagnostických kriterií přijatých novou verzí klasifikace uroteliálních nádorů WHO 2004. Byla vytvořena sbírka preparátů z rutinního materiálu s paralelním uvedením původní i nové klasifikace a obrazová databáze komentovaných histopatologických obrazů uroteliálních lézí v obrazově archivačním systému LUCIA Net. Volný přístup je na adrese http://www.laboratory-imaging.com. Obsahuje v současné době přes 80 komentovaných obrazů.Závěr:
zavedení nového systému klasifikace uroteliálních nádorů vyžaduje vyhodnocení některých dříve nepoužívaných znaků. Jejich osvojení lze usnadnit vedle klasické preparátové sbírky také užitím referenční elektronické obrazové databáze.Klíčová slova:
uroteliální patologie – WHO/ISUP konsensus klasifikace uroteliálních lézí – WHO klasifikace uroteliálních nádorůUroteliální nádory vykazují v ČR incidenci blízkou západoevropské (v roce 2000 dle Národního onkologického registru činila u mužů 28/105, u žen 9,8/105). Jejich výskyt trvale narůstá. Etiologicky je nejvýznamnějším rizikovým faktorem kouření cigaret, jenž zvyšuje riziko 4–5krát. Mortalita zůstává v posledních letech poměrně stabilní (v r. 2000 10,8/105 u mužů a 3,6/105 u žen) (1). Tato skutečnost do jisté míry odráží zlepšující se diagnostické a terapeutické možnosti specializovaných pracovišť, nicméně odhad biologického potenciálu čerstvě diagnostikovaného uroteliálního karcinomu zůstává stále nedořešenou záležitostí. Zasahuje nepochybně do oblasti genetické, avšak i na úrovni klasické bioptické diagnostiky dochází v průběhu posledních let k upřesňování vyšetřovacích postupů a změnám klasifikace. Od roku 1974, kdy byla publikována první WHO klasifikace uroteliálních nádorů (9) vzrostla incidence uroteliálních karcinomů dvojnásobně. V průběhu třiceti let se ovšem rovněž ukázalo, že tato z hlediska patologů dobře reprodukovatelná klasifikace neposkytuje klinikům dostatečnou prognostickou informaci zejména v kategorii G2 papilokarcinomů, v níž se ocitala většina papilokarcinomů, často s velmi odlišným biologickým chováním. Proto byla ustavena pracovní skupina a následně zorganizována konference, jež vyústila ve formulaci nové klasifikace (5). V roce 2004 byla tato klasifikace bez podstatných změn přijata jako nová verze WHO (11).
Při zavádění nově formulované klasifikace do denní bioptické praxe s převahou cystoskopicky získaných vzorků čerstvě zjištěných i recidivujících nádorů močového měchýře jsme zaznamenali některá úskalí související s přechodem z předchozího systému hodnocení na současně přijatý. Proto byla tato problematika zařazena do programu postgraduálního doškolování obou kateder IPVZ, se vzájemnou účastí spolupracujících specialistů. Vedle prezentace současně přijatých jednotek nové klasifikace byla pozornost zaměřena zejména na otázky, jež se ukázaly být v denní praxi zdrojem diagnostických obtíží nebo rozpaků. Jimi se zabýváme v následujícím textu.
Materiál a metody
Pro účely postgraduálního kurzu bylo průběžně hodnoceno dle předchozí i současně přijaté klasifikace více než 200 uroteliálních nádorů z běžného bioptického materiálu dodávaného Urologickou klinikou 1. LF UK. (V tomto paralelním hodnocení pokračujeme na přání kliniky a v souladu s doporučením konference ESP a ESU z Palerma 2005 (12) dosud). V naprosté většině se jednalo o preparáty barvené HE, výběrově byla užita jiné barvení (průkaz hlenu alc. modří pH 2,5), popř. imunohistochemické metody. Vyšetřované preparáty se staly ilustrační sbírkou a zdrojem obrazů počítačové databáze.
Výsledky
Zjištěná úskalí, spolu s našimi přístupy k diagnostickým obtížím jež vznikaly v rutinním vyšetřovacím procesu, jsou pro přehlednost v následujícím textu zařazeny do těchto okruhů:
- kvantita a kvalita materiálu
- typing
- grading
- staging
Kvantita a kvalita materiálu
V naprosté většině je vyšetřován elektroresekční materiál z cystoskopie. Sestává se z odřezků, jež by měly obsahovat celý odstraněný nádor a svalovinu detruzoru, ve zvláštní nádobce je pak dodáván materiál ze spodiny nádoru. S ohledem na požadovaný staging je nutno zablokovat veškerý materiál a toto doplnit v případech susp. iniciální invaze prokrajováním, popř. imunohistochemickým došetřením. Nezřídka jsou spolu s nádorem a spodinou dodány i další vzorky pocházející z cystoskopie doplněné o vizualizaci dysplastické sliznice pomocí kyseliny 5-aminolevulové a následné cílené biopsie (1). Tento postup odpovídá „mapování“ doporučenému pracovní skupinou konference v Palermu 2005 (12).
Kvantita dodaného materiálu vzhledem k záměru odstranění celého nádoru zpravidla problém nepředstavuje. Elektroresekce je však zdrojem termických a někdy kombinovaně i mechanických artefaktů, jež mohou hodnocení uroteliálních změn zcela znemožnit (obr. 1). U drobných částek cílených biopsií může představovat problém ztráta povrchové uroteliální vrstvy, pozornost je však nutno zaměřit na zbytkové struktury dyskohezivního plošného CIS, který může být reprezentován pouze nesouvislou bazální vrstvou silně dysplatických buněk s hyperchromními jádry – tzv. clinging carcinoma (8). Méně zkušenému patologovi zde hrozí podhodnocení nálezu (obr. 2).
Obr. 1. Termické artefakty. Vyznačují se významným protažením buněk i jader, pro bližší hodnocení jsou tyto části materiálu ztraceny (HE, 100krát) 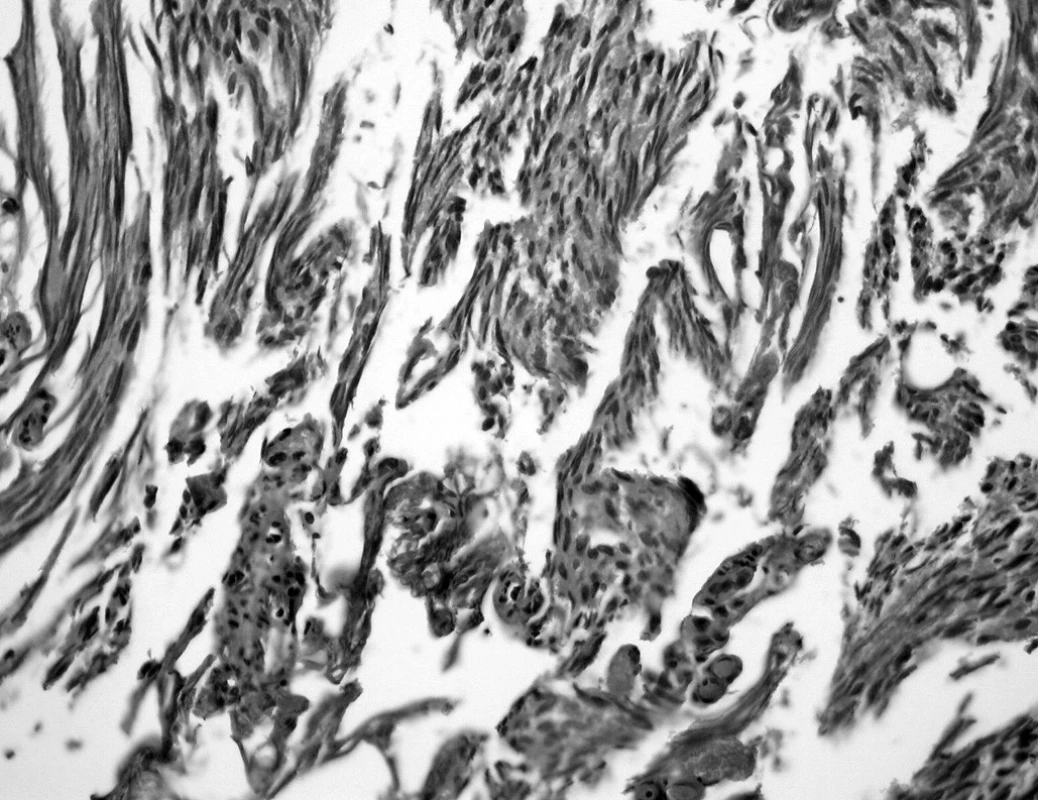
Obr. 2. Nesouvislá bazální vrstva HG IUN jako důsledek dyskoheze. Pro porovnání (zejména velikosti, denzity a tvaru jader) v záběru pravidelný urotel Brunnova čepu (HE, 200krát) 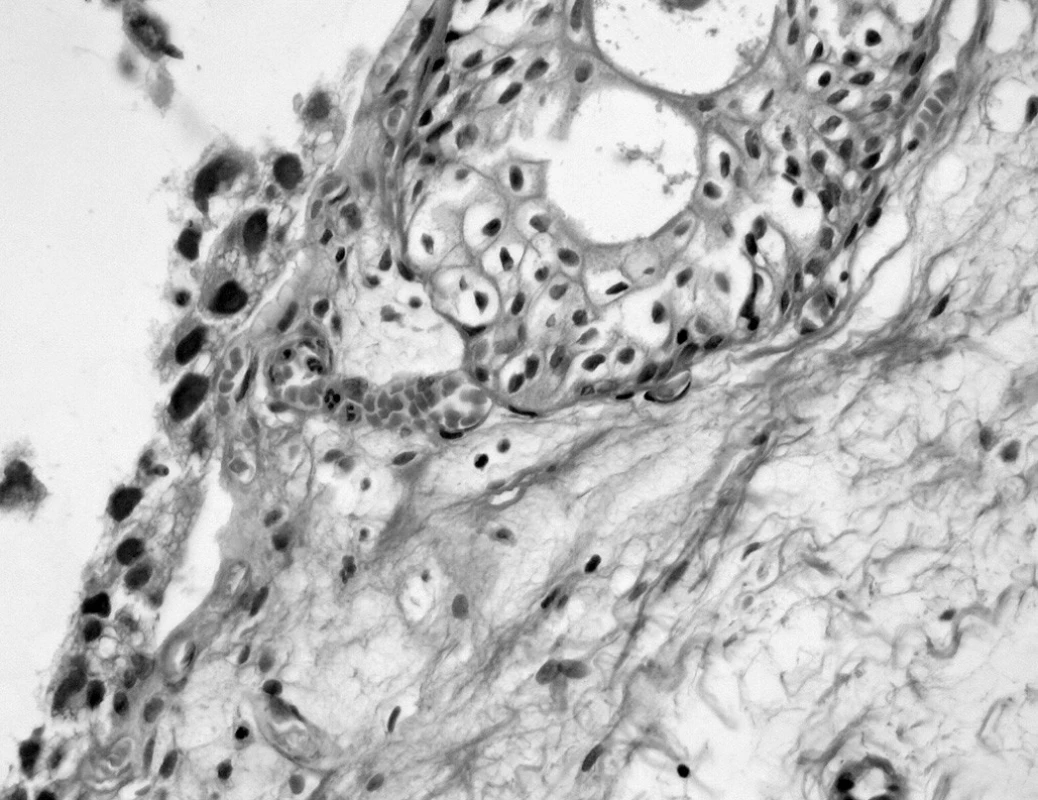
Podrobný popis zpracování urologického bioptického materiálu včetně cystektomie je k dispozici jak v americké (10), tak v evropské (7) verzi. Oba texty jsou velmi podobné. Pozdější přináší navíc pokyny pro zpracování nádorů urachu (kolmo vedené excize až k pupku), pokyny pro zpracování nefroureterektomie a pokyny pro zpracování ureterektomie (vše s důrazem na staging a okraje).
Typing
Rozpoznání uroteliálních nádorů v typické lokalizaci zpravidla nepůsobí rozpaky. Při této diferenciaci jsme je výjimečně pocítili jen v hodnocení invertovaných tumorů. Klinicky asymptomatický invertovaný papilom (obr. 3), zachycený náhodně v pahýlu ureteru při nefrektomii pro ca ledviny, jsme od diferenciálně diagnosticky zvažovaných Brunnových čepů odlišili rozsahem pravidelné invertované papilární proliferace, absencí mitóz a zánětlivých změn v okolí a od invertovaného papilokarcinomu absencí atypií v námi vyšetřovaném nádoru. Bazální membrána byla intaktní. Mírné atypie invertovaných struktur jsou však i v papilomu přípustné. Druhý invertovaný papilární nádor, který jsme krátce poté vyšetřovali v měchýřové lokalizaci, představoval makroskopicky kulovitou prominenci hladkého povrchu, v níž i při extenzivním vyšetření byly pouze invertované struktury, zčásti velmi dobře diferencované, připouštějící dg. invertovaného papilomu; v části nádoru však byla diferenciace zřetelně nižší. Pro tyto úseky byl tumor hodnocen jako invertovaný papilokarcinom bez invaze (obr. 4). Jako různě rozsáhlá příměs mohou být invertované struktury přítomny i u jinak typických papilokarcinomů.
Obr. 3. Invertovaný papilom ureteru. Náhodný nález v nefrektomii pro světlobuněčný karcinom ledviny. Absence mitóz a atypií (HE, 200krát) 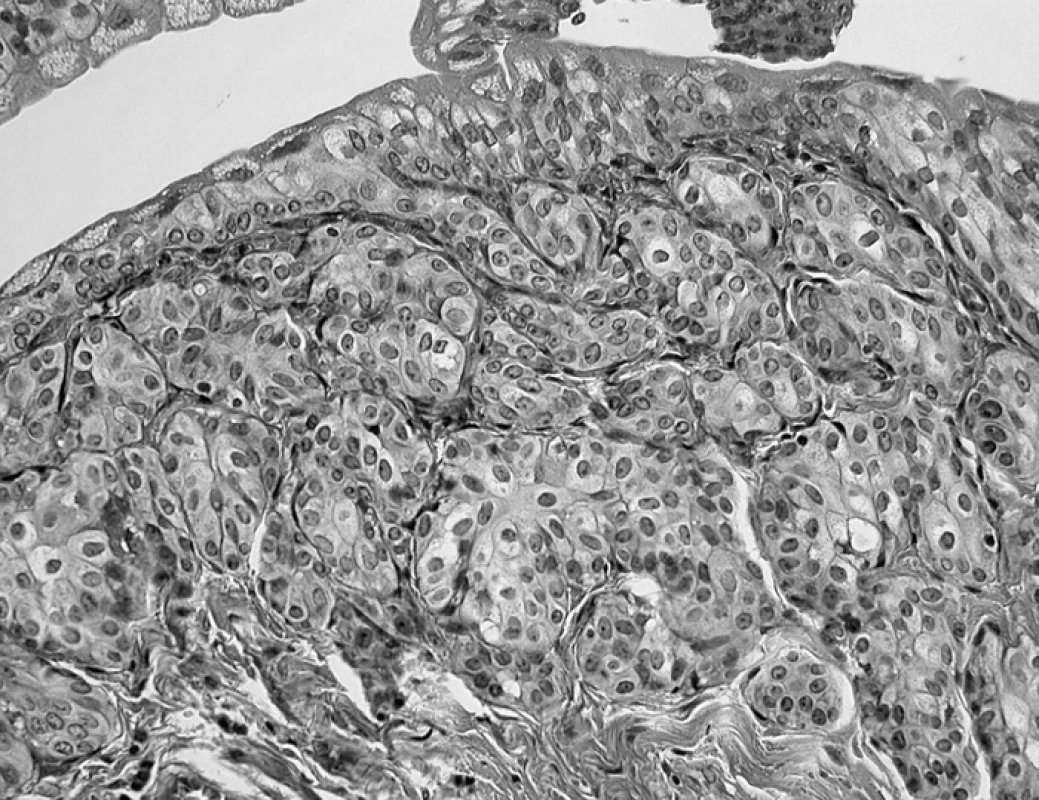
Obr. 4. Invertovaný papilokarcinom bez invaze. Urotel charakteru LG papilokarcinomu (HE, 100krát) 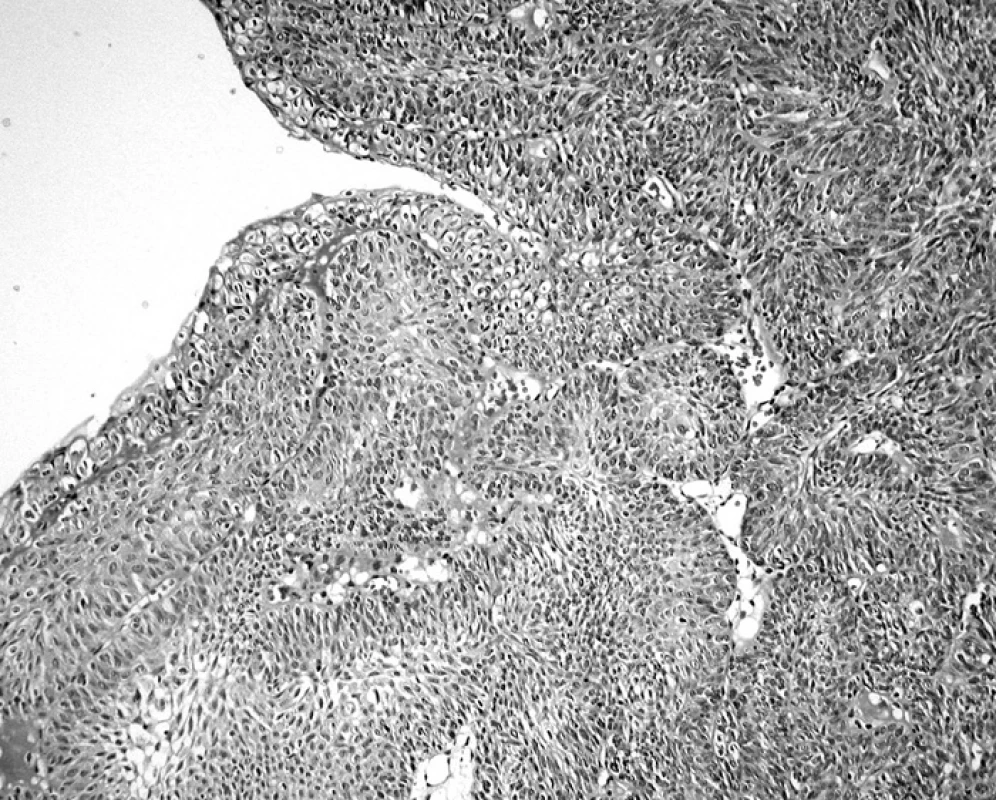
Pohotovost urotelu vytvářet hlenotvorné buňky je vcelku obecně známa. Méně nápadná příměs hlenotvorných buněk v jinak typickém uroteliálním nádoru je někdy i opomíjena. Při výrazném zastoupení hlenotvorných struktur vzniká otázka dg. adenokarcinomu, a to jak primárního, tak prorůstajícího z okolí, či metastatického. Podmínkou diagnózy adenokarcinomu je výlučné zastoupení těchto struktur při dostatečně extenzivním vyšetření (obr. 5). Při absenci podrobných klinických dat je nutno vylučovat adenokarcinomy vnitřního genitálu, prostaty a tlustého střeva. Mimo relativně spolehlivého markeru, jakým je PSA, jsou kombinace cytokeratinů a dalších markerů pro zmíněná východiska pouze orientační. Zjištění sekundární povahy adenokarcinomu měchýře tak při absenci jiných než urologických příznaků může být překvapením pro klinika i patologa (obr. 6).
Obr. 5. Adenokarcinom vycházející z vrcholu měchýře (HE, 200krát) 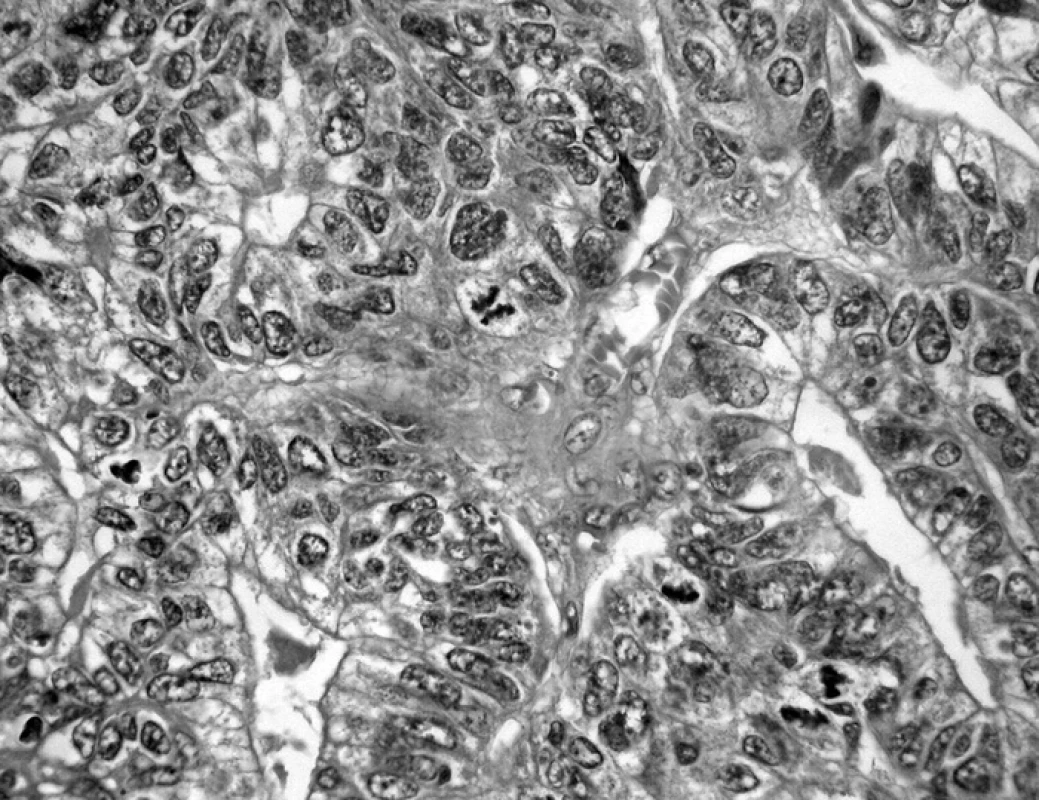
Obr. 6. Hlenotvorný adenokarcinom, klinicky se manifestující výlučně urologickými příznaky. Intraoperačně zjištěna souvislost s tlustým střevem, v němž byl zdroj nádorového procesu (HE, 200krát) 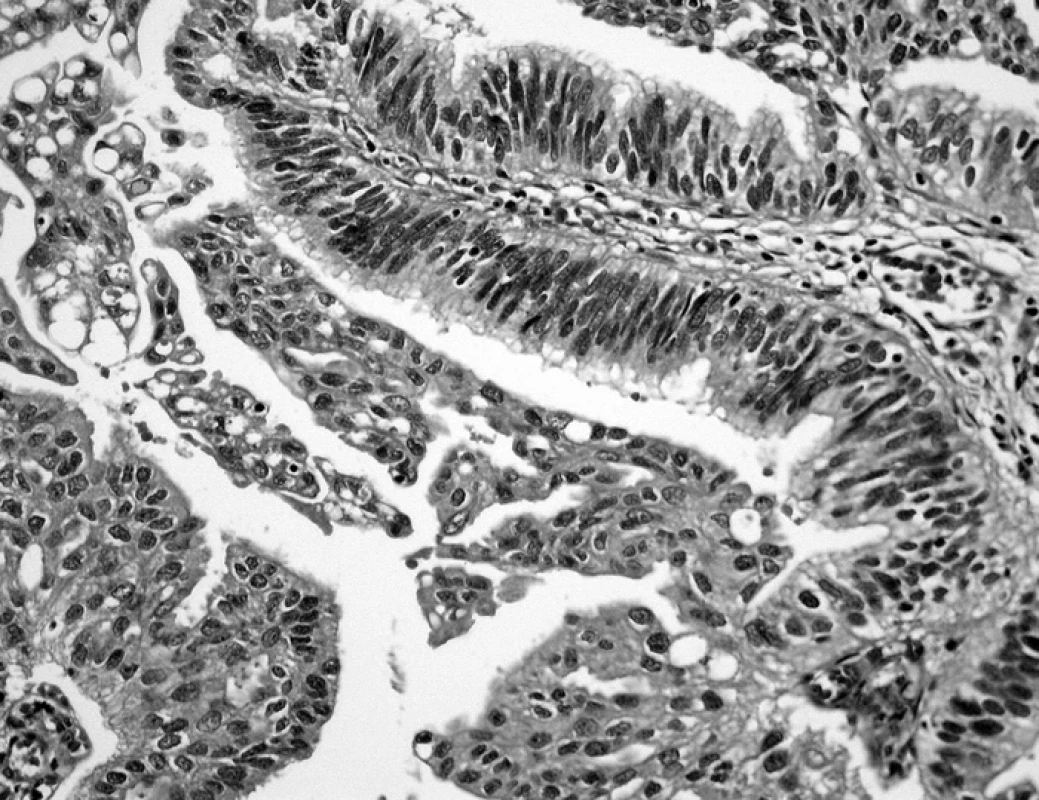
Vzácné neobvyklé nádory nejrůznější histogeneze ve vývodných cestách močových jsou zpravidla vnímány z úrovně široké diferenciálně diagnostické úvahy a dořešeny pomocí speciálních technik, zejm. imunohistochemie. Současné WHO klasifikace nádorů narostly v objemu dat mimo jiné i proto, že vesměs zahrnují i tyto vzácné publikované afekce. Příklady z této kategorie jsme zaznamenali i na našem pracovišti (3, 4).
Grading
Upřesnění gradingu ve vztahu ke klinickému chování uroteliálních nádorů bylo jedním ze silných motivů nové klasifikace. Papilární nádory v iniciálním stadiu je žádoucí odlišit od papilární hyperplazie – definovaným rozdílem je absence kapilár ve stromatu hyperplastických hřebínků – spikes (obr. 7) (6). Dobře diferencované papilární novotvary sestávající z jemných izolovaných papil a kryté pravidelným hyperplastickým urotelem bez cytologických variací jsou nově vymezeny akronymem PUNLMP (Papillary Urothelial Neoplasia of Low Malignant Potential). Motivem pro použití tohoto nepohodlně dlouhého pojmenování je vynechání pojmu karcinom s ohledem na minimální tendenci nádorů této skladby k recidivám, jež (pokud vůbec vzniknou) si podržují neprogredující histologický obraz (obr. 8). Diferenciálně diagnostické vymezení oproti uroteliálnímu papilokarcinomu nízkého stupně malignity spočívá v jemné architektonice papil a absenci cytologických variací pravidelně hyperplastického urotelu, reprodukovatelnost uvedených znaků však není zcela jednoduchá. Pomáhá zde opakované porovnání s normativními srovnávacími obrázky nové WHO klasifikace. Na opačném pólu diagnostického spektra papilárních uroteliálních neoplazií má nesporný prognostický význam odhalení ložisek HG papilokarcinomu v terénu převažujících LG struktur.
Obr. 7. Papilární hyperplazie přecházející v LG papilokarcinom. V jednom místě ve vrcholu papily drobná céva (HE, 100krát) 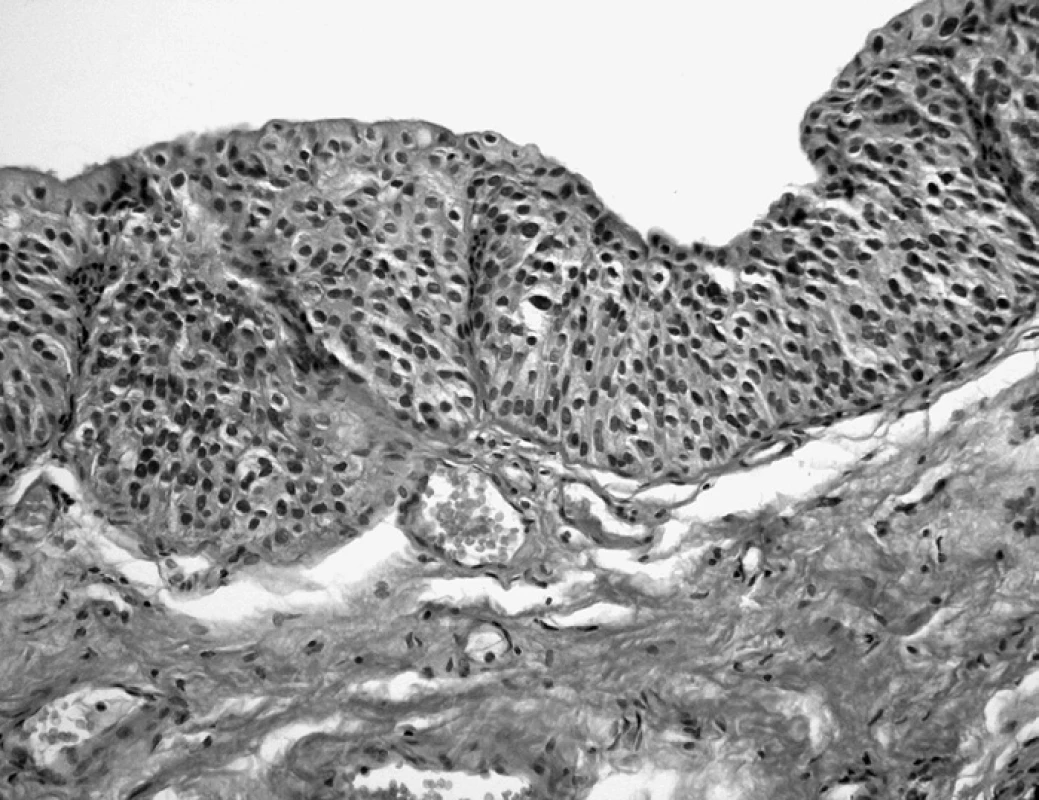
Obr. 8. PUNLMP. Pravidelný urotel na jemných papilách vykazuje pouze mírně vyšší počet vrstev. Diferenciace do povrchových buněk (HE, 100krát) 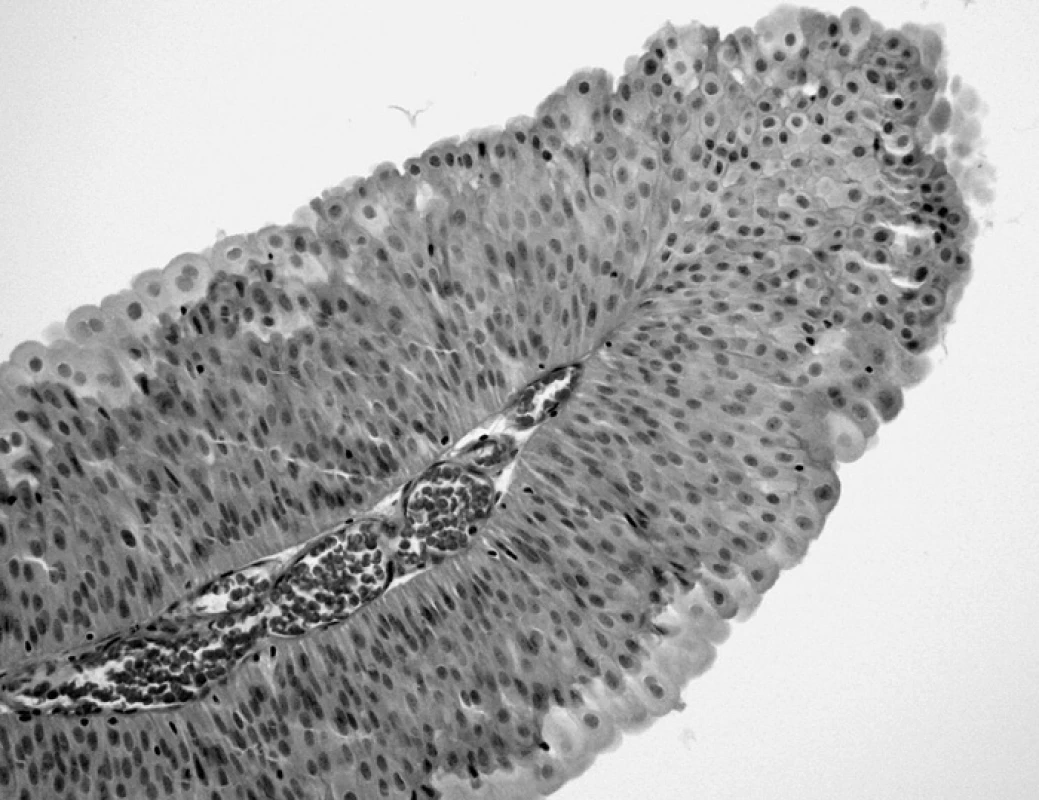
U plošných karcinomů (jež jsou logicky všechny G3-HG) může diagnostické obtíže vyvolávat dyskohezivita nádorového urotelu, při níž zbylé parabazální dysplastické buňky mohou uniknout pozornosti, protože při hodnocení interferují s často přítomnými arteficiálně alterovanými částkami materiálu, u nichž je tendence vyloučit je z hodnocení. Může tak (zejména při absenci invaze) dojít až k neshodě mezi pozitivním cytologickým nálezem v moči a negativním bioptickým nálezem (viz obr. 2). Diagnostickým úskalím high grade intrauroteliálních neoplazií HG IUN je skladba z monotónních nezralých buněk imitujících plošnou hyperplazii. Důležitými znaky ke správné diagnóze jsou výrazně zvětšená jádra se vcelku mírnou anizokaryózou (výrazné jaderné atypie a ztráty polarity indikují CIS) a redukovaná cytoplazma buněk – vysoký nukleoplazmatický poměr (obr. 9).
Obr. 9. a, b. Plošná hyperplazie (a) v porovnání s monomorfním typem HG IUN (b) ve stejném zvětšení (HE, 200krát) Přestože hyperplastický urotel má více vrstev, buňky jsou v něm pravidelné, nukleoplazmový poměr nízký. V dysplastickém urotelu i při monotónním vhledu jsou jádra zvětšená, vykazují mírnou anizokaryózu, neokrouhlost, různou denzitu chromatinu a vysoký nukleoplazmový poměr buněk, který vede k dotýkání se, místy až překrývání jader 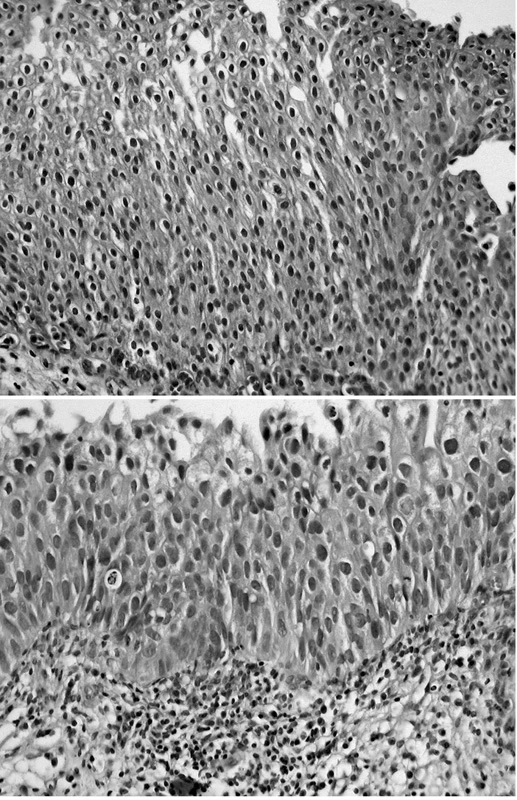
Poměrně extenzivní zpracování bioptického materiálu z měchýře, doporučené americkými i evropskými standardizujícími publikacemi (7, 10), vychází z přijaté skutečnosti, že urotel každého pacienta s karcinomem je postižen jako celek a vykazuje často současnou přítomnost různých typů lézí (obr. 10) . Na morfologické diagnostické hladině je zjistí právě zmíněné extenzivní vyšetření; teoretickým podkladem této skutečnosti je doložená přítomnost stejného typu mutací v morfologicky různě postiženém urotelu (6).
Obr. 10. LG papilokarcinom a HG intrauroteliální neoplazie (HE, 100krát) 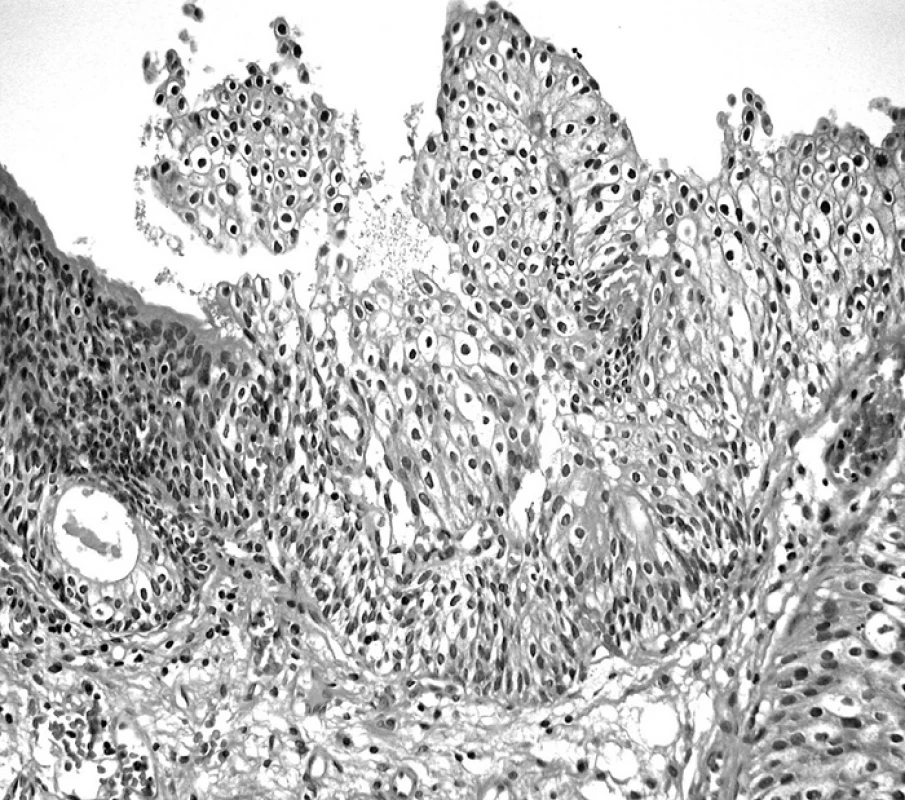
Staging
Většina (až 80 %) uroteliálních karcinomů se klinicky manifestuje v neinvazivním stadiu. Nicméně pohotovost těchto novotvarů recidivovat po odstranění je podkladem stanovených dispenzárních i terapeutických postupů a odůvodněním naléhavého požadavku na přesný staging. I současně přijatý TNM systém (11) je předmětem pozměňujících návrhů, z nichž některé se výrazně prosazují jako klinicky relevantní a lze předpokládat, že v další verzi TNM systému budou do něho včleněny. Týká se to zejména subklasifikace stadia pT1 podle hloubky invaze v lamina propria mucosae. Protože tato dobře koreluje s klinickým vývojem onemocnění, provádíme ji nad rámec WHO TNM schématu. Vyžaduje při zjištěné invazi cílené pátrání po referenčních strukturách, jimiž je zpravidla lamina propria mucosae – nesouvislá vrstvička hladké svaloviny orientované rovnoběžně se slizničním povrchem, nebo ve stejné hloubce se nacházející vrstva středně velkých cév (obr. 11). Lamina propria mucosae byla v měchýři popsána teprve v r. 1983 (2); její význam je, mimo staging uroteliálních invazivních karcinomů, kde je využívána od r. 1990 (14), minimální. Nověji je zdůrazňován význam extenzivní povrchové invaze (14), uvažující vícečetnost ložisek nebo šíři (> 5mm), poněkud obdobný stagingu karcinomu děložního hrdla (obr. 12). V praxi činí poměrně často obtíže hodnocení zcela iniciální invaze charakterizované ztrátou ostrosti kontury bazální membrány. Je nepochybně důsledkem aktivity metaloproteináz degradujících extracelulární matrix. Pokud však nenalezneme jednoznačné přerušení a nádorové epitelie v lamina propria ani po prokrájení susp. ložisek, ponecháváme v kategorii pTa.
Obr. 11. Muscularis mucosae v měchýři obklopená cévami středního kalibru. Sliznice kryta normálním urotelem (HE, 40krát) 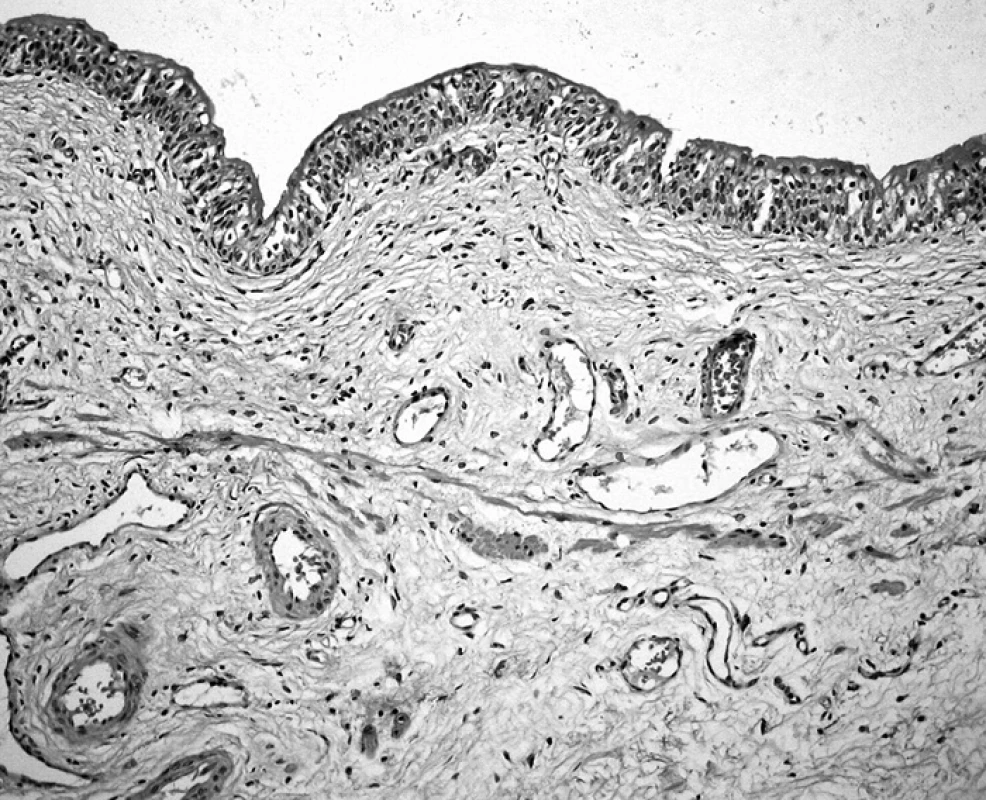
Obr. 12. Vícečetná invaze papilokarcinomu do povrchových (pT1a) i hlubších (pT1b) úseků lamina propria (HE, 100krát) 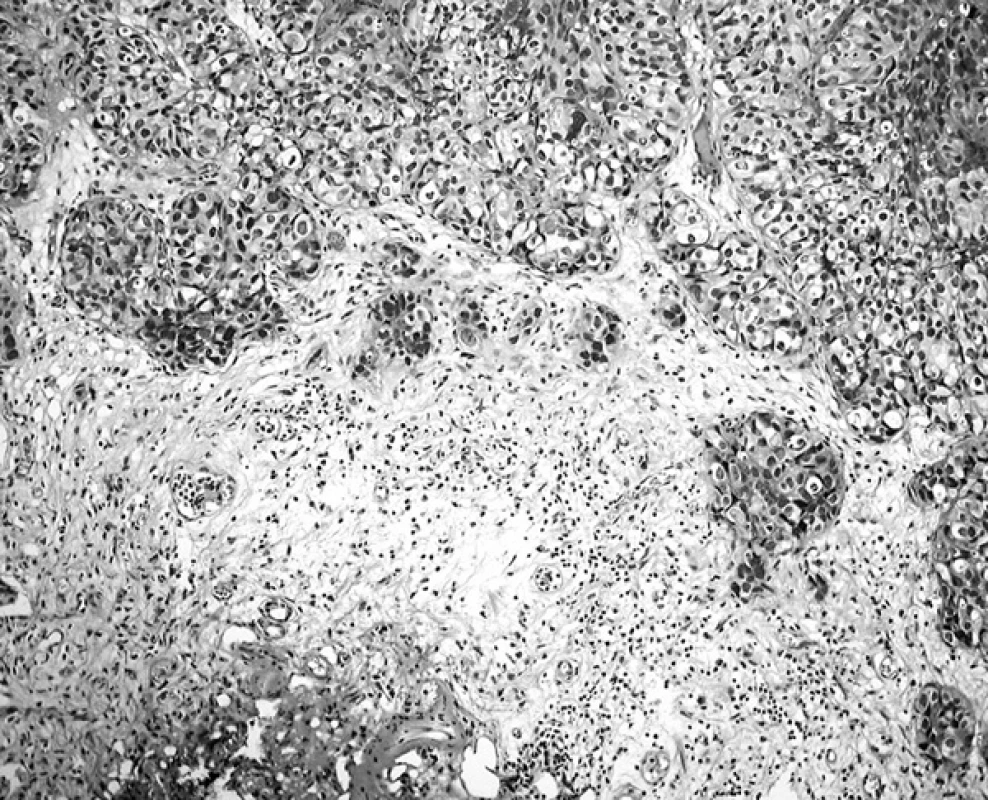
Důležitou a kliniky požadovanou informací z bioptického vzorku endoresekátu měchýře je přítomnost nebo absence svaloviny detruzoru, a to i v případě, že jde o neinvazivní stadium nádorového onemocnění. Je pro klinika dokladem dostatečné radikality resekce. Pokud není ve vzorku zastoupena, následuje zpravidla kontrolní endoskopie a opakovaný výkon. Doporučení pracovní konference v Palermu 2005 (12) používat klinickou terminologii stagingu Ta, T1 místo pTa, pT1 považujeme, vzhledem k nedostatečné reprezentativnosti vzorku z povrchové transuretrální resekce pro stanovení max. pT, za méně vhodné, než užití pT s vyhodnocením rozsahu materiálu. Ani cystektomie vyšetřená podle standardů a nikoli extenzivně nemusí max. pT nutně zastihnout ve všech případech. Navrhované užití klinické terminologie pro bioptické vyšetření vnáší do názvosloví zmatek a stírá hranici mezi endoskopickým a bioptickým (byť limitovaně reprezentativním) vyšetřením. Lze očekávat, že tyto terminologické otázky budou ještě předmětem diskuze, podobně jako kategorie PUNLMP v oblasti gradingu papilárních uroteliálních nádorů.
Na pomoc patologům zvyklým předchozímu způsobu klasifikace jsme zorganizovali postgraduální kurzy o aplikaci nových diagnostických kritérií přijatých novou verzí klasifikace uroteliálních nádorů WHO 2004. Byla vytvořena sbírka preparátů z rutinního materiálu s paralelním uvedením původní i nové klasifikace a obrazová databáze komentovaných histopatologických obrazů uroteliálních lézí v obrazově archivačním systému LUCIA Net. Volný přístup je na adrese http://www.laboratory-imaging.com. Obsahuje v současné době přes 80 komentovaných obrazů.
Závěr
Nároky na přesnou rutinní diagnostiku uroteliálních lézí (zejm. karcinomů) v posledních letech výrazně vzrostly. I při striktním uplatnění pravidel formulovaných v nové WHO klasifikaci přináší denní praxe někdy problémy. V uvedeném přehledu jsme chtěli zmínit některé z nich a zároveň zdůvodnit námi preferovaný přístup k jejich řešení.
Seznam použitých zkratek
ISUP – International Society of Urological Pathology
ESP – European Society of Pathology
ESU – European Society of Urology
HG IUN – high grade intraurothelial neoplasia
LG IUN – low grade intraurothelial neoplasia
PUNLMP – papillary urothelial neoplasia of low malignant potential
Doc. MUDr. Jaroslava Dušková, CSc., FIAC,
Ústav patologie 1. LF UK,
Studničkova 2,
128 00 Praha 2
email: jaroslava.duskova@lf1.cuni.cz
Zdroje
1. Babjuk, M., Matoušková, M., Novák, J.: Doporučené diagnostické a léčebné postupy u uroteliálních nádorů. Galén, Praha, 2003, ISBN80-7262-233-1, s. 51-60.
2. Dixon J.S., Gosling J.A.: Histology and fine structure of the muscularis mucosae of the human urinary bladder. J. Anat., 1983, 136, s. 265-271.
3. Dundr, P., Dudorkinová, D., Povýšil, C., Pešl, M., Babjuk, M., Dvořáček, J., Zelinka T.: Pigmented composite paraganglioma-ganglioneuroma of the urinary bladder. Path. Res. Pract.,199, 2003, 765-769.
4. Dundr, P., Pešl, M., Povýšil, C., Vítková, I., Dvořáček, J.: Large cell neuroendocrine carcinoma of the urinary bladder with lymphoepithelioma-like features. Path. Res. Pract.,199, 2003, 559-563.
5. Epstein, J.I., Amin, M.B., Reuter, V. R., Mostofi, F.K. & the Bladder Consensus Conference Committee: The WHO/ISUP consensus classification of urothelial neoplasms of the urinary bladder. Am. J. Surg. Pathol., 22, 1998, 1435-1448.
6. Hartmann, A., Moser, K. Kriegmair, et al.: Frequent genetic alterations in simple urothelial hyperplasias of the bladder in patients with papillary urothelial carcinoma. Am. J. Pathol., 154, 1999, s. 721-727.
7. Lopez-Beltran, A., Bassi, F. P., Pavone-Macaluso, M., Montironi, R.: Handling and pathology reporting of specimens with carcinoma of the urinary bladder, ureter and renal pelvis. A joint proposal of the European Society of Uropathology and the Uropathology Working Group. Virchows Arch., 2004, 445, 103-110.
8. Mc Kenney, J. K., Gomez, J. A., Desai, S., Lee, M. W., Amin, M. B.: Morphologic expressions of urothelial carcinoma in situ. Am. J. Surg. Pathol., 2001, 25, 356-362.
9. Mostofi, F.K., Sobin, L.H., Torloni H.: Types histologiques des tumeurs de la vessie. Classification histologique internationale des tumeurs No10. OMS, Genéve, 1974.
10. Murphy, M. W.: ASCP survey on anatomic pathology examination of the urinary bladder. Am.J.Clin. Pathol., 1994, 102, 715-723.
11. Pathology and genetics of the urinary system and male genital organs. Chapter 2, Tumours of the urinary system, pp. 90 - 157. WHO classification of tumours, IARC Press, Lyon 2004.
12. Pavone-Macaluso, M., Lopez-Beltran, A., Aragona, F., Bassi, P., Fitzpatrick, J.M.: The pathology of bladder cancer: an update on selected issues. BJU Int., 2006, 98, 1161-1165.
13. van der Aa, M. N. M., van Leenders, G .J. L. H., Steyerberg, E. W. et al.: A new system for substaging pT1 papillary bladder cancer: a prognostic evaluation. Hum. Pathol., 36, 2005, 981-986.
14. Younes, M., Sussman, J., True, L. D.: The usefulness of the level of the muscularis mucosae in the staging of invasive transitional cell carcinoma of the urinary bladder. Cancer, 66, 1990, 543-548.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článok vyšiel v časopiseČesko-slovenská patologie

2008 Číslo 2-
Všetky články tohto čísla
- Problémy v rutinní diagnostice uroteliálních lézí
- WHO klasifikácia tumorov centrálneho nervového systému 2007: porovnanie s klasifikáciou z roku 2000
- Dvojité imunohistochemické barvení CD1a a CD68 pro fenotypickou charakteristiku histiocytózy z neurčených buněk
- JAKÁ JE VAŠE DIAGNÓZA?
- Imunohistochemický průkaz TTF-1 v peroperačních bioptických vzorcích plicních adenokarcinomů: roční zkušenosti
- Tubulo-squamous Polyp of the Vagina
- Prof. MUDr. Karel Dvořák, DrSc., již není mezi námi
- OSOBNÍ ZPRÁVY
- JAKÁ JE VAŠE DIAGNÓZA?
- JAK SE VÁM LÍBÍ?
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Imunohistochemický průkaz TTF-1 v peroperačních bioptických vzorcích plicních adenokarcinomů: roční zkušenosti
- Prof. MUDr. Karel Dvořák, DrSc., již není mezi námi
- Problémy v rutinní diagnostice uroteliálních lézí
- Dvojité imunohistochemické barvení CD1a a CD68 pro fenotypickou charakteristiku histiocytózy z neurčených buněk
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



