-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Exprese S-100 proteinu v osteogenních nádorech a tumoriformních osteoplastických lézích
S-100 Protein Positivity in Osteogenic Tumours and Tumour-like Bone Forming Lesions
Various osteogenic tumours and bone producing tumour-like lesions of bone were examined for S-100 protein using the immunostaining methods. The positive reaction for S-100 protein of some bone cells was detected not only in osteoblastic osteosarcomas and osteoblastomas, but also in osteoplastic reactive lesions, fibrous dysplasia, Paget’s disease and in the tissue of the bony callus. The positive reaction for osteocalcin in these cells showed, that they may be of osteoblastic and osteocytic lineage. The S-100 protein positive bone cells have to be differentiated from chondrocytes persisting in new-formed bone trabecullae. On the one hand S-100 protein positive osteocytes and osteoblasts may represent transient form of osteocytes histogenetically related to chondrocytes , but we were not able to prove such suggestion. Therefore, S-100 protein positivity can be caused by polyclonal character of the used antibody, that is a mixture of three antibodies, S-100 A1, A6 and anti B2. The specificity of these three components differs depending on the histogenesis of cells and their functional status. Such explanation is supported by the results of our study, because we also observed intense positivity of bone cells in the reaction with monoclonal antibody against S-100A6. In contrast, no staining of bone cells was detected with monoclonal antibodies against S-100 A1 and B2.
Key words:
bone cells – osteogenic tumours – tumour-like lesions – S-100 protein – immunohistochemistry
Autori: C. Povýšil; R. Kaňa; M. Horák
Pôsobisko autorov: Oddělení otorinolaryngologie VFN, Praha ; Oddělení zobrazovacích metod Nemocnice Na Bulovce, Praha ; Ústav patologie 1. LF UK a VFN a Katedra patologické anatomie IPVZ, Praha
Vyšlo v časopise: Čes.-slov. Patol., 44, 2008, No. 3, p. 59-61
Kategória: Původní práce
Súhrn
Imunohistochemické vyšetření souboru nádorových a nenádorových patologických afekcí kostí potvrdilo výskyt nečetných S-100 protein pozitivních kostních buněk uvnitř kostních trámců i na jejich povrchu u reaktivních osteoplastických procesů, fibrózní dysplazie, Pagetovy choroby, ve svalku i u osteoblastomu a osteosarkomu. Tyto buňky, jak bylo ověřeno pozitivní reakcí s protilátkou proti osteokalcinu, jsou nepochybně osteocyty a osteoblasty. Je třeba je však odlišit od S-100 protein pozitivních chondrocytů, které jsou nejen běžnou součástí osteoplastických kostních nádorů, ale vyskytují se poměrně často v nově vytvořených trámcích kostní tkáně v rámci různých reaktivních osteoplastických procesů jako neosifikovaná rezidua chrupavkové tkáně.
S-100 protein pozitivní osteocyty a osteoblasty mohou na jedné straně představovat přechodnou formu blízkou chrupavkovým buňkám, což zatím nelze současnými prostředky spolehlivě doložit. Na druhé straně může tento fenomén souviset s polyklonálním charakterem rutinně používané protilátky, která je směsí S-100 A1 a A6 a S-100 B, jejichž exprese se v různých tkáních mění nejen v závislosti na histogenetickém původu buněk, ale také v souvislosti s jejich měnícím se funkčním stavem. Svědčily by pro to naše pozitivní nálezy v reakci k průkazu S-100 A6, kdy jsme zjistili intenzivní reakci kostních buněk při současné pozitivitě chondrocytů. Naproti tomu kostní buňky nereagovaly s protilátkami proti S-100 A1 a B2.Klíčová slova:
kostní buňky – osteogenní nádory – tumoriformní léze – S-100 protein – immunohistochemiePolyklonální protilátka proti S-100 proteinu je, kromě melanocytárních lézí, neuroektodermových nádorů a myoepitelií, většinou využívána při identifikaci chondrocytů, ať už nádorového nebo nenádorového původu. Jak uvádí i sám výrobce, S-100 protein navíc reaguje s lipocyty, s retikulárními buňkami lymfatických uzlin a s buňkami gliovými.
Při identifikaci kostních buněk, tj. osteocytů a osteoblastů, přitom v dnešní době pomáhá do značné míry specifický osteokalcin. Naproti tomu specifický marker chondrocytů zatím není znám, a tak S-100 protein stále zůstává jedinou metodou volby.
Při vyšetřování různých osteoplastických procesů převážně reaktivního původu, ale i u vzorků normální kostní tkáně jsme se však opakovaně setkali s osteocyty vykazujícími více či méně zřetelnou pozitivitu S-100 proteinu. Tato skutečnost nás vedla k bližšímu studiu této problematiky, neboť pozitivita osteocytů v reakci k průkazu S-100 proteinu byla zatím studována pouze okrajově, takže je tento fenomén zahalen určitým tajemstvím. Naše zkušenosti s touto problematikou jsou předmětem tohoto předběžného sdělení, ve kterém shrnujeme zatím jen první poznatky, které jsou určitým způsobem užitečné pro potřeby diagnostické patologie a zároveň ukazují na některé dosud neřešené otázky související s imunofenotypem kostních buněk.
Materiál a metodika
Kromě nádorových afekcí typu osteosarkomu (6 případů), osteoblastomu (4 případy) a fibrózní dysplazie (4 případy) jsme vyšetřili 6 případů reaktivní osifikující periostitidy, 5 případů osifikující myozitidy, 4 případy metaplastické osifikace a vzorky z 10 resekovaných hlavic femuru pro frakturu krčku. Dále byly vyšetřeny biopsie od 2 pacientů s Pagetovou chorobou.
Materiál byl zpracován obvyklým způsobem po předchozí fixaci v 10% formalinu, odvápnění v EDTA a zalití do parafinu.
Pro potřeby imunohistochemického vyšetření jsme použili metodu ABC s polyklonální králičí protilátkou proti S-100 proteinu od firmy DAKO (kód Z0311) v ředění 1 : 400 a proti osteokalcinu (Abcam, Cambridge) v ředění 1 : 100. Obě protilátky byly použity samostatně ve dvou různých histologických řezech nebo současně ve formě tzv. dvojího barvení v jednom řezu.
Zároveň jsme v 10 vybraných případech různých patologických lézí v předběžné studii použili protilátky proti komponentám, které jsou součástí rutinně používaného polyklonálního anti-S-100. Konkrétně se jednalo o protilátku anti S-100-A1 v ředění 1 : 25, anti S100 A6 v ředění 1 : 200 a anti S-100-B2 v ředění 1 : 10. Všechny tři protilátky byly od firmy Lab Vision corp. Neomarkers.
Za pozitivní nález jsme považovali pouze situaci, kdy se vedle cytoplazmy pozitivně obarvila i jádra buněk.
Výsledky
U osteosarkomu bylo obtížné spolehlivě odlišit chondrogenní nádorovou komponentu smíšenou s nádorovou složkou osteoblastickou, a tak nebylo vždy možné učinit jednoznačný závěr, pokud se jedná o identifikaci nádorových S-100 protein pozitivních osteoblastů. Některé nádorové buňky však byly nepochybně pozitivní. Naproti tomu v případě osteoblastomu jsme mohli ve třech případech ze čtyř potvrdit výskyt zcela ojedinělých S-100 protein pozitivních osteocytů.
S-100 pozitivní kostní buňky typu osteocytů jsme nacházeli většinou jen v malých skupinách po dvou či po třech, nebo zcela samostatně v nově vytvořených kostních trámcích, především u lézí reaktivního původu, tj. u reaktivní osifikující periostitidy, v místech metaplastické osifikace, u osifikující myozitidy a v místech svalku. V dvojitě barvených preparátech bylo možno ověřit, že tyto buňky reagují též s osteokalcinem. Tím se lišily, kromě odlišného tvaru, od S-100 pozitivních chondrocytů nacházejících se v ostrůvcích chrupavkové tkáně, které někdy tvořily součást nově vzniklých kostních trámců představujících rezidua neosifikované tkáně chrupavky (obr. 1). Ke správné identifikaci chondrocytů perzistujících v kostních trámcích do značné míry přispěla i přítomnost mezibuněčné chrupavkové hmoty.
Obr. 1. Ojedinělé S-100 protein pozitivní osteoblasty na povrchu trámečku nově vytvořené nelamelární kosti. Naproti tomu uvnitř trámečku se pozitivně znázornily perzistující oválné chondrocyty a vřetenité osteocyty (120krát) 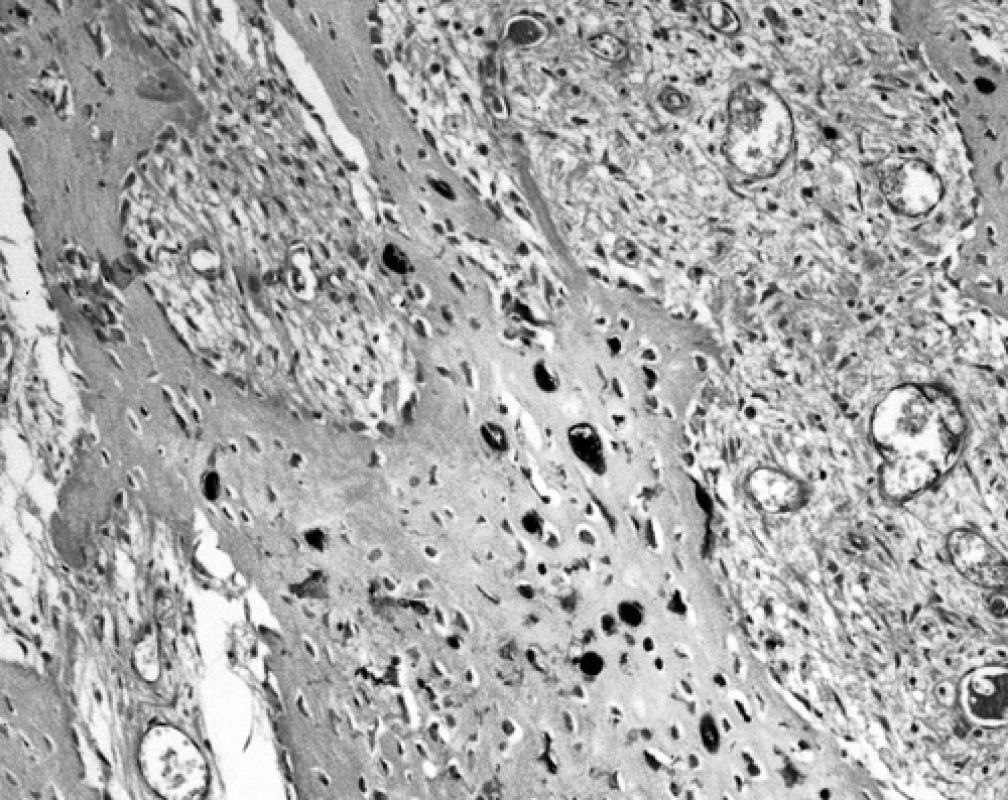
Podstatně méně často jsme zaznamenali přítomnost S-100 protein pozitivních osteoblastů na povrchu nově vytvořených kostních trámců většinou nelamelární nebo jen částečně lamelárně uspořádané kosti.
Ve třech případech z 10 jsme zaznamenali pozitivitu ojedinělých osteocytů a zcela výjimečně i povrchově se nacházejících osteoblastů kostních trámců odlomených hlavic femuru odebraných při implantaci endoprotéz. Většinou se jednalo o nálezy v sousedství probíhajících přestavbových změn v místě infrakcí (obr. 2).
Obr. 2. S-100 protein pozitivní osteocyty v trámečku lamelární kosti (210krát) 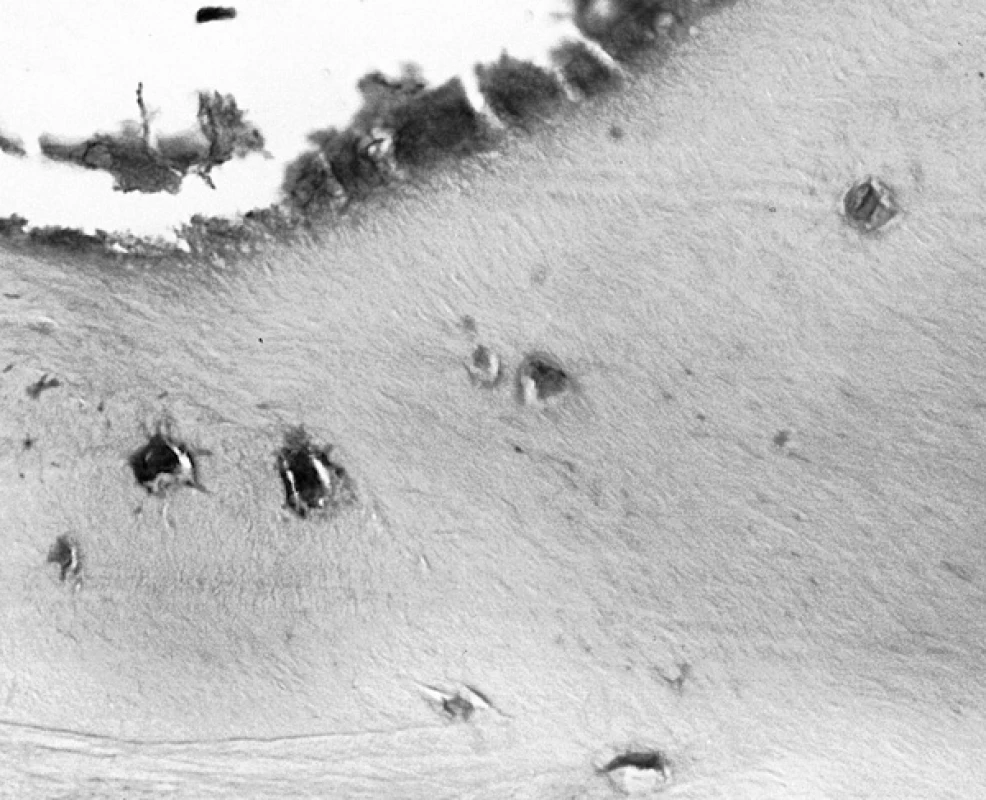
S tím do určité míry kontrastoval nález zřetelné S-100 protein pozitivity většiny kostních buněk ve vzorcích od pacientů s fibrózní dysplazií. U Pagetovy choroby se jednalo o zcela výjimečný nález.
V preparátech barvených za použití protilátek anti S-100 A1, A6 a B2 jsme mohli ověřit, že kostní buňky, především osteoblasty, reagovaly pozitivně pouze při použití protilátky proti S-100 A6 (obr. 3). Současně však byla pozitivní reakce s chondrocyty. Protilátky proti S-100 A1 a B2 s kostními buňkami nereagovaly.
Obr. 3. Pozitivní osteoblasty na povrchu trámečku a perzistující chondrocyty uvnitř trámce v reakci k průkazu S-100 A6 (120krát) 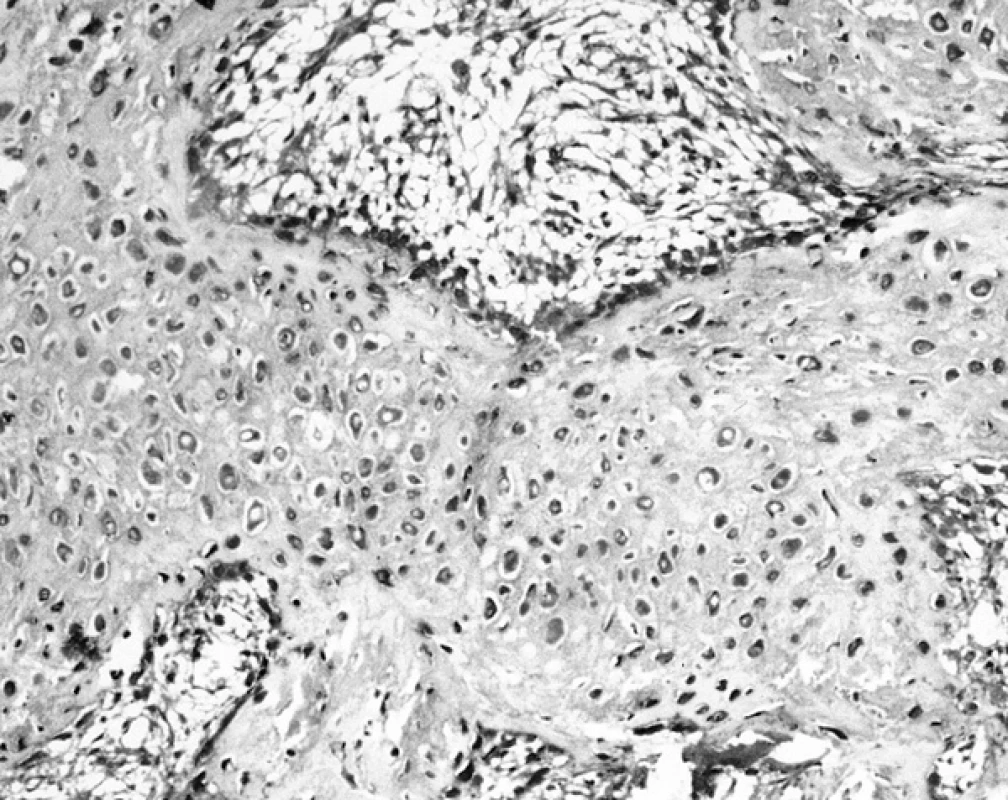
Diskuse
Výskyt S-100 protein pozitivních kostních buněk zmínili u osteosarkomu Okajima a spol. (4) a později v diskusním přípěvku i Ishida a Dorfman (3). Nebylo přitom pátráno, zda se skutečně jedná o nádorové osteocyty či nikoliv. U osteosarkomu, který obvykle obsahuje osteoblastickou i chondroblastickou komponentu promíšenou zcela nepravidelně, je identifikace jednotlivých buněčných typů obzvláště obtížná bez použití protilátky proti osteokalcinu. Je nutné se orientovat pouze podle charakteru mezibuněčné hmoty, ve které se nádorové buňky nacházejí. U našich pozorování jsme se s tímto fenoménem setkali i v případě osteoblastomu, na rozdíl od negativních výsledků pozorování Ishidy a Dorfmana (3). Domníváme se, že značnou roli kromě skutečností níže uvedených může hrát i délka fixace a způsob odvápnění.
V nenádorové kostní tkáni se touto problematikou pravděpodobně zatím zabývali pouze Weissová a Dorfman (5), kteří si povšimli S-100 protein pozitivních osteoblastů v místech probíhající enchondrální osifikace epifýz. Sami jsme tyto buňky zaznamenali rovněž v trámcích diafýzy.
Pokud vyloučíme, že tyto S-100 protein pozitivní buňky uložené uvnitř kostní hmoty nejsou perzistující chondrocyty v oblastech, kde nedoběhla osifikace chrupavkové komponenty, potom je možné připustit dvojí výklad tohoto fenoménu. Za prvé by se mohlo jednat o osteocyty a osteoblasty s imunofenotypem blízkým chondrocytům a buňky by mohly představovat jakousi přechodnou formu mezi chrupavkovou a kostní buňkou. Pozitivita osteokalcinu však spíše svědčí o příslušnosti ke kostním buňkám. Je však nutné připustit, že dvojí barvení demineralizovaných vzorků kosti je do značné míry problematické a jejich vyhodnocení může být zatíženo značnou chybou.
Za této situace je proto třeba rovněž vzít v úvahu otázku specificity protilátky proti S-100 proteinu. Polyklonální protilátka je totiž směsí protilátek proti třem podjednotkám S-100 proteinu bovinního mozku, a sice proti proteinům S-100 A1, A6 a S100 B (viz leták firmy DAKO). Takže specificita běžně používané protilátky proti S-100 proteinu je svým způsobem omezená a s tím je třeba počítat nejen v diagnostice, ale i při interpretaci nálezů, o které jsme se v naší studii zajímali. Podle našich zkušeností protilátka proti S-100 A6 silně reaguje s kostními buňkami v určité fázi jejich proliferační aktivity. Současně však dává pozitivní reakci i s dalšími mezenchymovými buňkami, především s chondrocyty. Dále je třeba říci, že exprese jednotlivých komponent obsažených v protilátce dodávané na trh se bude měnit v závislosti na funkčním stavu zachycených kostních buněk, což samozřejmě nepochybně ovlivní výsledek imunohistochemické reakce.
S-100 protein představuje skupinu 19 nízkomolekulárních proteinů vážících Ca2+, které jsou exprimovány řadou různých buněčných typů. Podílejí se na regulaci intracelulárních procesů jako je fosforylace proteinů, aktivita enzymů, buněčná proliferace a diferenciace, strukturální organizace cytoskeletu a buněčných membrán či intracelulární homeostáza kalcia. Navíc některé typy S-100 jsou secernovány do extracelulárních prostorů a uplatňují se jako chemoatraktanty leukocytů, modulují proliferaci buněk a regulují aktivaci makrofágů (2). Bylo doloženo, že některé S-100 proteiny ovlivňují progresi nádorového růstu, například ve formě tumor supresorického genu. U některých nádorů je možno se setkat s overexpresí některých forem S-100 a jsou pokusy využít této skutečnosti při určování prognózy nádorových onemocnění (1).
Za této situace je pravděpodobné, že pozitivita S-100 proteinu je vlastně v mnohých případech výrazem určité buněčné aktivity kostních buněk a nemůže být proto považována za dostatečně specifickou součást jejich buněčného imunofenotypu. Toto zjištění otevírá nové cesty ke studiu možností využití skupiny S-100 proteinů, především v oblasti určování biologické povahy nádorových onemocnění kostí. Teprve po prozkoumání této problematiky bude možno zaujmout jednoznačnější stanovisko k otázce specificity jednotlivých forem S-100 proteinu z hlediska imunofenotypizace mezenchymových buněk. Podle našich prvních zkušeností s jednotlivými formami S-100 proteinu nelze zatím počítat s tím, že by některý člen této skupiny byl specifickým markerem chondrocytů nebo dokonce kostních buněk. Na druhé straně však zatím nelze vyloučit existenci přechodných buněčných forem mezi chondrocytem a kostními elementy, neboť oba typy mají společnou progenitorovou mezenchymovou buňku.
Práce byla podpořena z finančních prostředků GA MZ ČR – grant NR 8150-4
Prof. MUDr. Ctibor Povýšil, DrSc.
Ústav patologie 1. LF. UK a VFN v Praze,
Studničkova 2, 128 50 Praha 2
tel.: 224 968 660
e-mail: ctibor.povysil@lf1.cuni.cz
Zdroje
1. Cross, S.S., Hamdy, F.C., Deloulme, J. C. et al.: Expression of S-100 proteins in normal human tissues and common cancers using tissue microarrays: S100A6, S100A8, S100A9 and S100A11 are all overexpressed in common cancers. Histopathology, 46, 2005, s. 256-269.
2. Donato, R.: Functional roles of S100 proteins, calcium-binding proteins of the EF-hand type. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 1450, 1999, s. 191-231.
3. Ishida, T., Dorfman, H.D.: S-100 protein in osteogenic tumors. Am. J. Surg. Pathol., 18, 1994, s. 857-858.
4. Okajima K., Honda, I., Kitagawa, T.: Immunohistochemical distribution of S-100 protein in tumors and tumor-like lesions of bone and cartilage. Cancer, 61, 1988, s. 792-799.
5. Weiss A. P. C., Dorfman H. D.: S-100 protein in human cartilage lesions. J. Bone Joint Surg., 68A, 1986, s. 521-526.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článok vyšiel v časopiseČesko-slovenská patologie

2008 Číslo 3-
Všetky články tohto čísla
- Úvodník
- Trombotické mikroangiopatie: trombotická trombocytopenická purpura (TTP) a hemolyticko-uremický syndrom (HUS). Morfologie, diferenciální diagnóza a patogeneze
- Exprese S-100 proteinu v osteogenních nádorech a tumoriformních osteoplastických lézích
- Výskyt myelofibrózy a jej význam pri bioptickej diagnostike esenciálnej trombocytémie
- Molekulární diagnostika Ewingova sarkomu: porovnání RT-PCR a FISH metod pro tkáně zalité do parafinu
- Listeria monocytogenes jako příčina spontánního abortu – popis tří případů
- Obrovskobunkový fibroblastóm u 62-ročného muža. Kazuistika
- Jaká je vaše diagnóza?
- Exprese CD34 a CD117 v nádoru z juxtaglomerulárních buněk ledviny
- Prof. MUDr. Jaroslav HLAVA (1855–1924)
- Jaká je vaše diagnóza?
- JAK SE VÁM LÍBÍ?
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Trombotické mikroangiopatie: trombotická trombocytopenická purpura (TTP) a hemolyticko-uremický syndrom (HUS). Morfologie, diferenciální diagnóza a patogeneze
- Listeria monocytogenes jako příčina spontánního abortu – popis tří případů
- Exprese CD34 a CD117 v nádoru z juxtaglomerulárních buněk ledviny
- Jaká je vaše diagnóza?
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



