-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Fibroblasty – buňky známé či neznámé?
Fibroblasts – Known or Unknown Cells
Fibroblasts form the main component of the cell tissue microenvironment, and their basic function is to maintain cell integrity and tissue homeostasis. Fibroblasts essentially participate in wound repair. Recently, increased interest has been focused on the role of fibroblasts in cancers, where they are involved in the ransformation of a tumour stroma, and via production of numbers of cytokines and growth factors participate in tumour progression. With regard to their impact in cancerogenesis, fibroblasts become a new target of cancer therapy.
Key words:
fibroblasts – stromal microenvironment – tumor progression
Autori: S. Brychtová 1; M. Bezděková 1; T. Brychta 2
Pôsobisko autorov: Laboratoř molekulární patologie a Ústav patologie LF UP, Olomouc 1; Centrum klinických studií. Agentura Science Pro, spol. s r. o., Nestátní zdravotnické zařízení, Olomouc 2
Vyšlo v časopise: Čes.-slov. Patol., 46, 2010, No. 2, p. 29-32
Kategória: Přehledový článek
Súhrn
Fibroblasty jsou jednou z hlavních složek buněčného tkáňového mikroprostředí, přičemž jejich základní funkcí je udržení tkáňové homeostázy a celistvosti zdravých tkání. Fibroblasty se významně uplatňují v procesech tkáňové reparace. V poslední době se stále více zájmu soustřeďuje na roli fibroblastů u nádorových onemocnění, kde se tyto buňky podílejí na transformaci nádorového stromatu a tvorbou řady cytokinů a růstových faktorů přispívají k progresi nádoru. Vzhledem ke svému významu v tumorigenezi se fibroblasty stávají novým terapeutickým cílem protinádorové léčby.
Klíčová slova:
fibroblasty – stromální mikroprostředí – progrese nádoruFibroblasty, štíhlé vřetenité buňky s uniformními jádry a jemným chromatinem jsou jednou z hlavních složek buněčného tkáňového mikroprostředí. Jedná se o buňky, které jsou známy již dlouho, poprvé byly popsány na konci 19. století na základě svého typického mikroskopického vzhledu (12, 45). Základní funkcí fibroblastů je udržení tkáňové homeostázy a celistvosti zdravých tkání. Řídí diferenciaci tkání nejen během fetálního období, ale uplatňují se v řízení fyziologických funkcí a buněčné integrity i postnatálně. Struktura tkání je podmíněna dynamickými interakcemi mezi buňkami a extracelulární matrix (ECM) prostřednictvím buněčných adhezivních molekul a složení tkáňového prostředí ovlivňuje tvar a organizaci buněk. Hlavní vlastností fibroblastů je syntéza fibrilární ECM zahrnující kolageny typu I, III a V a fibronektin; podstatným způsobem se podílí i na stavbě bazálních membrán tvorbou kolagenu IV a lamininu (22, 35, 43). Fibroblasty jsou však také důležitým zdrojem proteáz, které řídí degradaci ECM a vzájemné interakce mezi epitelovými a mezenchymálními buňkami (47). Tvorbou škály růstových faktorů se fibroblasty dále účastní regulace buněčné proliferace, diferenciace a apoptózy (46). Nezanedbatelná je i jejich role jako buněk prezentujících antigen, přičemž mohou stimulovat imunitní odpověď tvorbou cytokinů jako IL-1 nebo chemokinů jako např. MCP1 (chemotaktický protein monocytů) (36, 41). Zajímavým zjištěním je, že fibroblasty jsou vysoce heterogenní buněčný typ v závislosti na jejich topografické distribuci. Rozdíly se projevují různou schopností tvorby ECM a růstových faktorů. Například fetální kožní fibroblasty tvoří vysoké hladiny kolagenu I a V, zatímco fetální plicní fibroblasty nikoli. Naopak tyto fibroblasty tvoří transkripční faktory FOXF1 a FOXP1 typické pro plicní parenchym (22). Za normálních podmínek mají buňky nízkou proliferační aktivitu a rovněž tvoří faktory nezbytné k udržení normální funkce tkání (44).
Úloha fibroblastů u reparačních procesů
Fibroblasty se významně podílejí na procesech hojení, kdy jsou hlavním mediátorem vzniku fibrózy a jizvení tkáně. Reparace tkáně je komplexní proces, který zahrnuje všechny buňky stromálního kompartmentu. Bývá zahájen porušením celistvosti cévní stěny, kdy se krev dostává do intersticia a dochází k vytvoření krevní sraženiny. Právě tento stav se pokládá za stěžejní stimul vedoucí k proliferaci fibroblastů a cév, chemotaxi zánětlivých elementů a vzniku dobře známé granulační tkáně. Bylo prokázáno, že fibroblasty, které byly izolovány z oblastí hojení, vykazovaly vyšší proliferační a sekreční aktivitu. Takovou zvýšenou aktivitu označujeme jako „aktivaci“ (6). Důležitým poznatkem je, že aktivované fibroblasty mění kromě funkčních vlastností podstatně i svůj fenotyp. Neaktivované fibroblasty jsou charakteristické expresí CD34 proteinu a vimentinu, u aktivovaných fibroblastů dochází ke ztrátě exprese CD34 a dochází k expresi ASMA (hladkosvalový aktin alfa). Z tohoto důvodu bývají aktivované fibroblasty označovány rovněž jako myofibroblasty. Jedná se o buňky charakterizované tvorbou kontraktilních filament, pomocí nichž mohou vytvářet cytoplazmatické výběžky, které usnadňují kontakt s okolními buňkami. Myofibroblasty mají dále dobře vyvinuté hrubé endoplazmatické retikulum a Golgiho aparát (27). Myofibroblasty se mohou dále měnit na buňky hladké svaloviny; je však i popsána výrazná plasticita stromálních buněk, přičemž buňky hladké svaloviny se mohou zpět transformovat v myofibroblasty a dále i v normální fibroblasty (44). Experimentálně bylo prokázáno, že aktivaci fibroblastů regulují některé proteiny, např. TGFß (transformační růstový faktor beta). U fibroblastů z oblasti granulační tkáně bylo prokázáno zvýšení tvorby růstových faktorů, z nichž nejvýznamnější jsou bFGF (bazický fibroblastový růstový faktor), PDGF (destičkový růstový faktor), EGF (epidermální růstový faktor), VEGF (vaskulární růstový faktor), HGF (hepatocytární růstový faktor), IGF („insulin-like“ růstový faktor) a TGFß. Byla popsána indukce transkripce některých genů stimulujících buněčný cyklus, jako jsou c-myc a c-fos (17). Expresí faktorů a tvorbou remodelujících enzymů dochází ke zvýšení angiogeneze, tvorbě extracelulární matrix a stimulaci proliferace migrace epiteliálních buněk s cílem, co možná nejdříve obnovit porušenou homeostázu tkáně. Jakmile je tkáň zhojená, aktivita fibroblastů klesá. Doposud není jasné, zda se aktivované fibroblasty vracejí do klidového stavu a dále vyzrávají ve fibrocyty, nebo zda podléhají apoptóze, přičemž stroma je následně osídleno populací fibroblastů z okolí (43).
Úloha fibroblastů u nádorů
I když morfologické změny „reaktivního“ nádorového stromatu jsou již dlouho známy pod názvem desmoplazie nebo desmoplastické stroma, nebyl znám význam těchto změn pro nádorovou progresi. Teprve nedávno získané poznatky vedly k závěrům, že tkáňové mikroprostředí se podstatnou měrou účastní i kancerogeneze a nádorová progrese je vlastně výsledkem rozsáhlých interakcí mezi různými buněčnými typy, zahrnujícími samotné nádorové buňky i okolní stromální tkáň (18, 19, 30). Geneticky abnormální nádorové buňky tvořící vlastní nádorový parenchym jsou silně závislé na okolních podnětech, přičemž okolní stroma vytváří ideální podmínky, v podstatě jakousi stavební konstrukci, která podporuje růst nádoru a kromě toho se podílí i na výživě nádorových buněk. Změny probíhající v nádorové tkáni se připodobňují ke granulační tkáni tvořené během reparace tkání nebo fetální tkáni. Interaktivní signalizace mezi nádorem a jeho stromatem vytváří ve své podstatě komplexní „mnohobuněčný orgán“, kde podobně jako při vývoji zdravých tkání je výsledný fenotyp podmíněn vzájemnou mezibuněčnou komunikací (1). Jedním ze zájmů současného výzkumu je rozpoznání rozdílů mezi normálním a reaktivním nádorovým stromatem. Normální stroma obsahuje minimální počty fibroblastů a složení ECM je fyziologické. Naproti tomu stroma nádorové se liší jednak svým buněčným složením, kde se zvyšují počty fibroblastů a zánětlivých elementů a dále abnormální cévní sítí, zvýšeným množstvím proteinů jako fibrinu, tenascinu a fibronektinu a abnormálními proteoglykany; rovněž se zvyšuje aktivita proteolytických enzymů a tvorba růstových faktorů. Stroma nádoru se v podstatě připodobňuje k nehojící se ráně, kde růstové faktory a proteázy jsou přítomny v deregulovaných množstvích (5, 13). Množství stromatu a jeho složení se významně liší od nádoru k nádoru a nemusí korelovat se stupněm malignity.
Tzv. „nádorové“ fibroblasty se pokládají za hlavní buněčnou složku nádorového stromatu. U některých tumorů počty nádorových fibroblastů dokonce převyšují samotný nádorový parenchym. Nádorové fibroblasty (CAF, carcinoma-associated fibroblasts, myofibroblasty) jsou genotypicky i fenotypicky odlišné od fibroblastů normálních. Jedná se o proliferující buňky se sníženým apoptotickým potenciálem a zvýšenou schopností migrace. Přesný zdroj nádorových fibroblastů není zcela jasný. Všeobecně se předpokládá, že se vytvářejí z místních fibroblastů, které fenotypicky získávají charakteristiku fibroblastů aktivovaných. Například v diferenciální diagnostice trichoepiteliomu a bazocelulárního karcinomu svědčí nepřítomnost CD34 ve fibroblastech spíše pro bazaliom (28). Podobné výsledky jsou popisovány i ve stromatu kolorektálních karcinomů. Na rozdíl od normálního stromatu tlustého střeva obsahujícího množství CD34 pozitivních fibroblastů, tyto buňky naopak chybí v desmoplastickém stromatu invazivních adenokarcinomů. Není však jasné, zda tyto aktivované fibroblasty mají ostatní charakteristiky nádorových fibroblastů a zda nově získaný fenotyp je stálý nebo časově omezený a buňky se po čase zpět navracejí do původního klidového stavu. Některé novější teorie odvozují nádorové fibroblasty z místních nenádorových nebo nádorových epitelových buněk v rámci tzv. epitelo-mezenchymového přechodu (EMT – epithelial-mesenchymal transition) (20). Pokud by zdrojem nádorových fibroblastů byly nádorové buňky, měly by buňky sdílet stejné nebo podobné genetické poruchy. To však bylo prokázáno jen v malém procentu případů. Pravděpodobnějším zdrojem těchto fibroblastů se tak zdají být okolní normální epitelové buňky. Jejich zdrojem však mohou být i nenádorové zralé mezenchymové buňky, zejména buňky hladké svaloviny a pericyty (21). Zcela nedávno byl objeven další možný zdroj nádorových fibroblastů – mezenchymové kmenové buňky. Normální tkáňové kmenové buňky, které jsou charakterizované vysokou plasticitou, vyžadují pro zachování svého fenotypu vysoce specializované mikroprostředí. Kromě toho, že se samy mohou transformovat v buňky nádorové, se z nich mohou vytvářet i stromální elementy (38). Není jasné, zda jsou tyto buňky přitahovány a následně aktivovány vlivem tkáňového prostředí, nebo zda samy představují buněčnou populaci s již změněným fenotypem, která následně místně expanduje. Není vyloučena ani vzájemná kombinace jednotlivých možností. Je rovněž možné, že mechanismus aktivace se může u jednotlivých typů tkání významně lišit.
Přítomnost nádorových fibroblastů v aktivovaném stromatu a jejich podstatný význam pro růst nádorových buněk byly prokázány u řady solidních tumorů, jako jsou karcinomy prostaty, mléčné žlázy, tlustého střeva nebo kůže (23, 31, 39). Fibroblasty se uplatňují již v časných stadiích kancerogeneze. Byl prokázán jejich přímý mutagenní potenciál, kdy byly potvrzeny změny benigního fenotypu epitelových buněk v maligní, přičemž aktivace fibroblastů předcházela invazivnímu stadiu karcinomů (42). Například myofibroblasty jsou častou složkou stromatu u familiární polypózy nebo u větších vilózních adenomů, přičemž u obou je známo vysoké riziko vzniku karcinomu. Naproti tomu jsou poměrně řídce přítomny u tubulárních adenomů (44). Dále řada in vitro studií prokázala transformaci nenádorového epitelu v nádorový, pokud byly buňky kultivovány s nádorovými fibroblasty. Kultivace prostatických epitelových buněk s nádorovými fibroblasty je provázena zvýšenou proliferační aktivitou epitelu a jeho maligní transformací, naopak normální fibroblasty, tyto změny nevyvolají. Zajímavé závěry byly získány po ozáření fibroblastů subletálními dávkami (25). Pokud byly benigní epitelové buňky kultivovány s takto ozářenými fibroblasty, docházelo k jejich maligní transformaci; pokud byly kultivovány maligní buněčné linie, buňky se chovaly agresivněji a měly vyšší schopnost invaze. Podobné vlastnosti jako nádorové fibroblasty vykazují i lidské senescentní fibroblasty. Ke zvýšení proliferace a transformace epitelových buněk stačila přítomnost 10 % těchto buněk. Předpokládá se, že zvýšená tvorba růstových faktorů senescentními fibroblasty je jednou z příčin častějšího výskytu nádorů u starších lidí (26). Ve fibroblastech mohou stejně jako u epitelových buněk vznikat různé mutace, jako např. ztráta heterozygozity nebo mutace p53. Ke genetické nestabilitě fibroblastů provázené poškozením DNA a zvýšeným počtem mutací významně přispívají kromě záření i hypoxie, oxidativní stres a acidóza tkání (4).
Aktivované fibroblasty podporují progresi tumoru několika cestami (3, 9, 14, 15, 29, 34):
- a) Zvyšují migraci buněk sekrecí promigračních složek ECM, jako např. tenascinu. Dále zvyšují expresi serinových proteáz a matrixových metaloproteináz (MMP).
- b) Zvyšují proliferaci buněk. Produkují řadu růstových faktorů, které byly popsány výše, z nichž nejvýznamnější jsou IGF, HGF, TGFß a EGF.
- c) Stimulují angiogenezi prostřednictvím rodiny VEGF, přičemž kromě zvýšení množství novotvořených kapilár se mění i jejich morfologický vzhled a funkce, kdy dochází k významnému zvyšování permeability cévní stěny.
- d) Zvyšují metastatický potenciál buněk. Zde se kromě výše popsaných faktorů stimulujících buněčnou proliferaci a vaskularizaci významně uplatňuje i N-cadherin, který podporuje perineurální propagaci nádorových buněk.
- e) Mají mutagenní a transformační schopnost.
- f) Řídí obnovu a diferenciaci kmenových buněk, zejména prostřednictvím sekrece FGF.
- g) Modulují imunitní odpověď. Byla již popsána stimulační funkce na imunitní systém, kdy dochází ke zvyšování chemotaxe zánětlivých buněk. Pro nádor může však zvýšená přítomnost imunokompetentních buněk znamenat i zvýšenou produkci CSF („faktory stimulující kolonie“, colony stimulating factors) a MMP, a tak stimulaci jeho růstu.
Obr. 1. Schematické znázornění rozdílů mezi klidovým a aktivovaným fibroblastem (převzato podle Kalluri a kol., 2006) 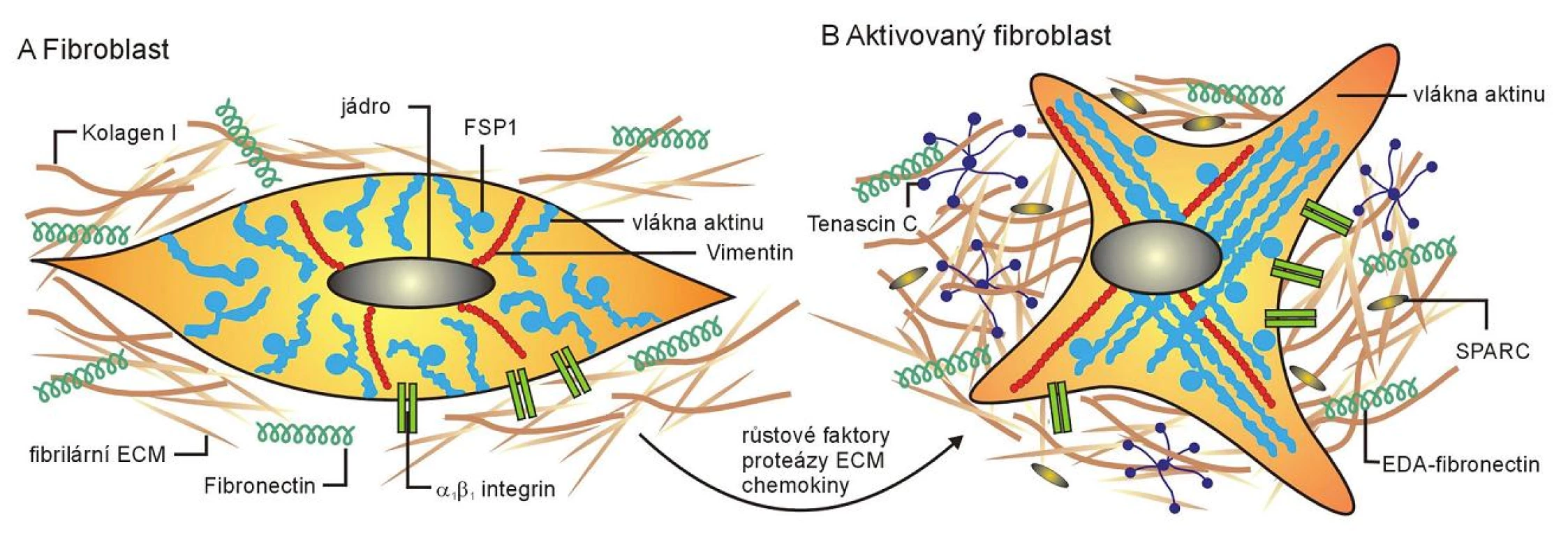
Aktivované fibroblasty mají však i imunosupresivní účinky; mohou negativně měnit funkci NK buněk („přirozený zabíječ“, natural killer), a to snížením jejich cytotoxicity a tvorby cytokinů. Myofibroblasty, které tvoří početné cytoplazmatické výběžky, mohou dále zabraňovat přímému kontaktu mezi nádorovými a imunitními buňkami, a takto nemůže dojít k efektorové odpovědi imunitního systému.
Fibroblasty se uplatňují i u nádorové bolesti. A to přímým působením na nocireceptory prostřednictvím IL-1 a 6, EGF, TGFß a PDGF. K excitaci receptorů může docházet i remodelací ECM tvořené proteázami (9).
Nelze však opomenout některé výsledky in vivo a in vitro modelů, které prokázaly supresivní působení fibroblastů na růst tumorů (1). Normální fibroblasty mohou mít antiproliferační efekt na nádorové buňky (2, 11, 32). Nicméně stále zůstává nejasné, jakým mechanismem normální fibroblasty tumorigenezi inhibují. K řešení této otázky je zapotřebí speciálních myších modelů umožňujících přežití normálních fibroblastů, což je metodicky složité, protože fibroblasty často nepřežívají transplantaci nebo se po přenesení stávají aktivovanými (16). Například práce zabývající se studiem růstu melanomu prokázala inhibici vertikální i radiální fáze růstu působením dermálních fibroblastů. Tento efekt nádorové suprese však nebyl potvrzen u pokročilých melanomů; je pravděpodobné, že jejich suprimující schopnost stromatu je omezená (7). Jednou z pozorovaných změn bylo snížení exprese TGFß (10). Další možností je aktivace imunitního systému, s mobilizaci T lymfocytů, makrofágů a NK buněk (40).
Vzhledem ke svému významu v tumorigenezi se fibroblasty stávají novým terapeutickým cílem (37). Jedním ze slibných kandidátů je serinová proteáza FAP (faktor aktivace fibroblastů). Ve fázi klinických studií je monoklonální protilátka proti FAP – sibrotuzamab. Dále je testována možnost blokády některých růstových faktorů a hormonů, např. monoklonální protilátky proti HGF, TGFß a FGF, jako Tranilast, Toremifene či PD173074; inhibiční působení vykazuje i INF-g (interferon gama) (8, 33). Nevýhodou těchto četných látek je přímá stimulace nádorových buněk (24). Ideální terapeutickou molekulou by byla látka, která by byla zaměřená proti nádorovým fibroblastům a neovlivňovala by současně pozitivním způsobem růst nádoru. Přesto inhibice nádorového stromatu se jeví jako slibná cesta protinádorové terapie.
Závěrem lze konstatovat, že role fibroblastů je velmi široká. I přes zřejmý obrovský rozmach poznatků v této oblasti jsou tyto buňky stále předmětem intenzivního výzkumu, přičemž můžeme předpokládat, že budoucnost přinese další informace, které povedou ke zlepšení léčby nádorových onemocnění.
Poděkování
Práce byla podpořena granty GAČR P304/10/1070 a MSM 6198959216
Korespondující autor
MUDr. Svetlana Brychtová, PhD.
Ústav patologie, LF UP Olomouc
Hněvotínská 3
775 15 Olomouc
telefon: 585639547
e-mail: Svetlana.Brychtova@seznam.cz
Zdroje
1. Angeli, F., Koumakis, G., Chen, M.C., Kumar, S., Delinassios, J.G.: Role of stromal fibroblasts in cancer: promoting or impeding? Tumour Biol., 30, 2009, s. 109–120.
2. Arnold, J.T., Lessey, B.A., Seppälä, M., Kaufman, D.G.: Effect of normal endometrial stroma on growth and differentiation in Ishikawa endometrial adenocarcinoma cells. Cancer Res., 62, 2002, s. 79–88.
3. Balsamo, M., Scordamaglia, F., Pietra G., et al.: Melanoma-associated fibroblasts modulate NK cell phenotype and antitumor cytotoxicity. Proc. Natl. Acad. Sci. U S A, 2009 Nov 23. [Epub ahead of print]
4. Barcellos–Hoff, M.H., Ravani, S.A.: Irradiated mammary gland stroma promotes the expression of tumorigenic potential by unirradiated epithelial cells. Cancer Res., 60, 2000, s. 1254–1260.
5. BorgoĖo, C.A., Diamandis, E.P.: The emerging roles of human tissue kallikreins in cancer. Nat. Rev. Cancer, 4, 2004, s. 876–890.
6. Castor, C.W., Wilson, S.M., Heiss, P.R., Seidman, J.C.: Activation of lung connective tissue cells in vitro. Am. Rev. Respir. Dis., 120, 1979, s. 101–106.
7. Cornil, I., Theodorescu, D., Man, S., Herlyn, M., Jambrosic, J., Kerbel, R.S.: Fibroblast cell interactions with human melanoma cells affect tumor cell growth as a function of tumor progression. Proc. Natl. Acad. Sci. U S A, 88, 1991, s. 6028–6032.
8. De Wever, O., Demetter, P., Mareel, M., Bracke, M.: Stromal myofibroblasts are drivers of invasive cancer growth. Int. J. Cancer, 123, 2008, s. 2229–2238.
9. De Wever, O., Mareel M.: Role of tissue stroma in cancer cell invasion, J. Pathol., 200, 2003, s. 429–447.
10. Denys, H., Derycke, L., Hendrix, A., et al.: Differential impact of TGF-beta and EGF on fibroblast differentiation and invasion reciprocally promotes colon cancer cell invasion. Cancer Lett., 266, 2008, s. 263–274.
11. Dong-Le Bourhis, X., Berthois, Y., Millot, G., et al.: Effect of stromal and epithelial cells derived from normal and tumorous breast tissue on the proliferation of human breast cancer cell lines in co–culture. Int. J. Cancer, 71 1997, s. 42–48.
12. Duvall, M.: Atlas d’Embryologie. Paris: Masson, 1879.
13. Dvorak, HF.: Rous-Whipple Award Lecture. How tumors make bad blood vessels and stroma. Am. J. Pathol., 162, 2003, s. 1747–1757.
14. Dvorak, P., Dvorakova, D., Hampl, A.: Fibroblast growth factor signaling in embryonic and cancer stem cells. FEBS Lett., 580, 2006, s. 2869–2874.
15. Gotoh, N.: Control of stemness by fibroblast growth factor signaling in stem cells and cancer stem cells. Curr. Stem Cell Res. Ther., 4, 2009. s. 9–15.
16. Grupp, C., Troche, I., Klass, C., Köhler, M., Müller, G.A.: A novel model to study renal myofibroblast formation in vitro. Kidney Int., 59, 2001, s. 543–553.
17. Gu, X., Fu, X., Yang, Y., Sun, T.: Expression characteristics of c-fos, c-myc and bFGB in early burn tissue. Chinese Medical J., 114, 2001, s. 925–928.
18. Hendrix, M.J., Seftor, E.A., Kirschmann, D.A., Quaranta, V., Seftor, R.E.: Remodeling of the microenvironment by aggressive melanoma tumor cells. Ann. N. Y. Acad. Sci., 995, 2003, s. 151–161.
19. Hofmeister, V., Schrama, D., Becker, J.C.: Anti-cancer therapies targeting the tumor stroma. Cancer Immunol. Immunother., 57, 2008, s. 1–17.
20. Hotz, B., Arndt, M., Dullat, S., Bhargava, S., Buhr, H.J., Hotz, H.G.: Epithelial to mesenchymal transition: expression of the regulators snail, slug, and twist in pancreatic cancer. Clin. Cancer Res., 13, 2007, s. 4769–4776.
21. Huber, M.A., Kraut, N., Beug, H.: Molecular requirements for epithelial-mesenchymal transition during tumor progression. Curr. Opin. Cell Biol., 17, 2005, s. 548–558.
22. Chang, H.Y., Chi, J.T., Dudoit, S., et al.: Proc. Natl. Acad. Sci. U S A, 99, 2002, s. 12877–12882.
23. Jedeszko, C., Victor, B.C., Podgorski, I., Sloane, B.F.: Fibroblast hepatocyte growth factor promotes invasion of human mammary ductal carcinoma in situ. Cancer Res., 2009 Nov 17. [Epub ahead of print]
24. Kalluri, R., Zeisberg, M.: Nat. Rev. Cancer, 6, 2006, s. 392–401.
25. Kamochi, N., Nakashima, M., Aoki, S., et al.: Irradiated fibroblast-induced bystander effects on invasive growth of squamous cell carcinoma under cancer-stromal cell interaction. Cancer Sci., 99, 2008, s. 2417–2427.
26. Krtolica, A., Parrinello, S., Lockett, S., Desprez, P.Y., Campisi, J.: Senescent fibroblasts promote epithelial cell growth and tumorigenesis: a link between cancer and aging. Proc. Natl. Acad. Sci. U S A, 98, 2001, s. 12072–12077.
27. Kuroda, N., Shimasaki, N., Miyazaki, E., et al.: The distribution of myofibroblasts and CD34-positive stromal cells in normal renal pelvis and ureter and their cancers. Histol. Histopatol., 21, 2006, s. 1303–1307.
28. Lepique, A.P., Moraes, M.S., Rocha, K.M., et al.: c–Myc protein is stabilized by fibroblast growth factor 2 and destabilized by ACTH to control cell cycle in mouse Y1 adrenocortical cells. J. Mol. Endocrinol., 33, 2004, s. 623–638.
29. Löffek, S., Zigrino, P., Mauch, C.: Tumor-stroma interactions: their role in the control of tumor cell invasion and metastasis. J. Dtsch. Dermatol. Ges., 4, 2006, s. 496–502.
30. Mueller, M.M., Fusenig, N.E.: Friends or foes – bipolar effects of the tumour stroma in cancer. Nat. Rev. Cancer, 4, 2004, s. 839–849.
31. Mueller, M.M., Fusenig, N.E.: Tumor-stroma interactions directing phenotype and progression of epithelial skin tumor cells. Differentiation, 70, 2002, s. 486–497.
32. Paraguassú-Braga, F.H., Borojevic, R., Bouzas, L.F., Barcinski, M.A., Bonomo, A.: Bone marrow stroma inhibits proliferation and apoptosis in leukemic cells through gap junction–mediated cell communication. Cell Death Differ., 10, 2003, s. 1101–1108.
33. Pardo, O.E., Latigo, J., Jeffery, R.E., et al.: The fibroblast growth factor receptor inhibitor PD173074 blocks small cell lung cancer growth in vitro and in vivo. Cancer Res. 69, 2009, s. 8645–8651.
34. Proia, D.A., Kuperwasser, C.: Stroma: tumor agonist or antagonist. Cell Cycle, 4, 2005, s. 1022–1025.
35. Rodemann, H.P., Müller, G.A.: Characterization of human renal fibroblasts in health and disease: II. In vitro growth, differentiation, and collagen synthesis of fibroblasts from kidneys with interstitial fibrosis. Am. J. Kidney Dis., 17, 1991, s. 684–686.
36. Rollins, B.J., Stier, P., Ernst, T., Wong, G.G.: The human homolog of the JE gene encodes a monocyte secretory protein. Mol. Cell. Biol., 9, 1989, s. 4687–4695.
37. Santos, A.M., Jung, J., Aziz, N., Kissil, J.L., Puré, E.: Targeting fibroblast activation protein inhibits tumor stromagenesis and growth in mice. J. Clin. Invest., 2009 Nov 16. [Epub ahead of print]
38. Seeberger, K.L., Dufour, J.M., Shapiro, A.M., Lakey, J.R., Rajotte, R.V., Korbutt, G.S.: Expansion of mesenchymal stem cells from human pancreatic ductal epithelium. Lab. Invest., 86, 2006, s. 141–153.
39. Schmid, S.A., Dietrich, A., Schulte, S., Gaumann, A., Kunz–Schughart, L.A.: Fibroblastic reaction and vascular maturation in human colon cancers. Int. J. Radiat. Biol., 85, 2009, s. 1013–1025.
40. Silzle, T., Randolph, G.J., Kreutz, M., Kunz-Schughart, L.A.: The fibroblast: sentinel cell and local immune modulator in tumor tissue. Int. J. Cancer, 108, 2004, s. 173–180.
41. Strieter, R.M., Wiggins, R., Phan, S.H., et al.: Monocyte chemotactic protein gene expression by cytokine–treated human fibroblasts and endothelial cells. Biochem. Biophys. Res. Commun., 162, 1989, s. 694–700.
42. Strnad, H., Lacina, L., Kolář, M., et al.: Head and neck squamous cancer stromal fibroblasts produce growth factors influencing phenotype of normal human keratinocytes. Histochem. Cell Biol., 2009 Nov 19. [Epub ahead of print]
43. Tomasek, J.J., Gabbiani, G., Hinz, B., Chaponnier, C., Brown, R.A.: Myofibroblasts and mechano–regulation of connective tissue remodelling. Nat. Rev. Mol. Cell Biol., 3, 2002, s. 349–363.
44. Tuxhorn, J.A., Ayala, G.E., Rowley, D.R.: Reactive stroma in J. Urol. 2001 Dec; 166 (6): 2472–2483.
45. Virchow, R.: Die Cellularpathologie in Ihrer Begruendung auf Physiologische und Pathologische Gewebelehre, Hirschwald A, Berlin, Germany, 1858.
46. Weaver, V.M., Fischer, AH, Peterson, O.W., Bissell, M.J.: The importance of the microenvironment in breast cancer progression: recapitulation of mammary tumorigenesis using a unique human mammary epithelial cell model and a three-dimensional culture assay. Biochem. Cell Biol., 74, 1996, s. 833–851.
47. Wiseman B.S., Werb Z.: Stromal effects on mammary gland development and breast cancer. Science, 296, 2002, s. 1046–1049.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článek Plán akcí IPVZČlánek Jaká je vaše diagnóza?
Článok vyšiel v časopiseČesko-slovenská patologie

2010 Číslo 2-
Všetky články tohto čísla
- Fibroblasty – buňky známé či neznámé?
- Krevní a lymfatické cévy v kalcifikované aortální stenóze. Příspěvek k teorii o její zánětlivé patogenezi
- Prof. MUDr. Jozef Babala, CSc. – k nedožitým osemdesiatinám
- Nálezy ve sliznici tlustého střeva po orálním podání fosforečnanu sodného v přípravě před kolonoskopií. Morfologické změny napodobující kolitidu
- Plán akcí IPVZ
- Jaká je vaše diagnóza?
- Guidelines for autopsy investigation of sudden cardiac death
- U. von Streitberg, G. Seitz, Bamberg: Dobrý let
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Fibroblasty – buňky známé či neznámé?
- Nálezy ve sliznici tlustého střeva po orálním podání fosforečnanu sodného v přípravě před kolonoskopií. Morfologické změny napodobující kolitidu
- Jaká je vaše diagnóza?
- Prof. MUDr. Jozef Babala, CSc. – k nedožitým osemdesiatinám
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



