Současný staging zhoubných nádorů děložního těla a jeho význam pro klinickou praxi
The current staging for uterine body malignancies and its importance for clinical practice
Reliable staging system should facilitate prognosis assessment, decision on treatments, and evaluation of their outcomes. A good staging system must meet three basic characteristics: validity, reliability, and practicality. The purpose of such system is to offer classification of the extent and progress of gynaecological cancer that will allow the comparison of different treatment methods and the choice of optimal treatment for individual patients. The previously developed staging of gynaecological cancers has become outdated because it has not considered results of current medical research that allow refinement of prognostic subgroupings. Changes based on new findings were proposed for staging of uterine malignancies by the FIGO (The International Federation of Gynecology and Obstetrics) Committee on Gynecologic Oncology and approved by the FIGO Executive Board in 2008, and were published in 2009. Stage 0 was deleted, since it did not represent any stage of invasive tumor. Four fundamental changes were made in the staging system of endometrium carcinoma. The revised staging system for endometrium carcinoma divides patients to groups with similar prognosis; carcinosarcoma is staged identically. The novel system will facilitate exchange of relevant information between diverse oncological centers and thereby promote knowledge dissemination and stimulate research around the globe. A different staging system was proposed for adenosarcomas, leiomyosarcomas and endometrial stromal sarcomas. It is based on features used for the sarcomas of other soft tissues. The purpose of the text is to review current knowledge in this area.
Keywords:
staging – endometroid carcinoma – uterine sarcoma – FIGO – TNM
Autoři:
Borek Sehnal 1; Kamila Benková 2; Emanuela Kmoníčková 3; Daniel Driák 1; Zuzana Špůrková 2; Kateřina Maxová 1
; Jiří Sláma 4
Působiště autorů:
Gynekologicko-porodnická klinika, 1. LF UK a Nemocnice Na Bulovce, Praha
1; Patologicko-anatomické oddělení, Nemocnice Na Bulovce, Praha
2; Ústav radiační onkologie, Komplexní onkologické centrum, 1. LF UK a Nemocnice Na Bulovce, Praha
3; Onkogynekologické centrum, Gynekologicko-porodnická klinika Všeobecné fakultní nemocnice a 1. LF UK, Praha
4
Vyšlo v časopise:
Čes.-slov. Patol., 50, 2014, No. 2, p. 100-105
Kategorie:
Z klinického pohledu
Souhrn
Spolehlivý stagingový systém by měl umožnit odhad prognózy onemocnění, plánování léčby a informovat o jejím výsledku. Dobrý stagingový systém musí mít tři základní charakteristiky – odůvodněnost na základě poznatků medicíny založené na důkazech, důvěryhodnost a praktičnost. Účelem dobrého stagingového systému je poskytnout klasifikaci šíření zhoubného nádoru vycházející z klinické zkušenosti tak, aby bylo možno srovnat účinnost různých modalit léčby. Výsledkem lékařského výzkumu bylo zastarání některých klasifikačních systémů v onkogynekologii, které přestaly shrnovat skupiny onemocnění se stejnou prognózou. Na základě nových poznatků byly výborem FIGO (The International Federation of Gynecology and Obstetrics Committee on Gynecologic Oncology) v roce 2008 navrženy, následně FIGO Executive Board odsouhlaseny některé změny ve stagingu zhoubných nádorů dělohy a v roce 2009 publikovány. Stadium 0 odpovídající prekanceróze bylo zrušeno, protože se nejedná o invazivní nádor. U přepracovaného stagingového systému karcinomu endometria nastaly čtyři zásadní změny. Stejně jako karcinom endometria je klasifikován i karcinosarkom. Přepracovaný staging karcinomu endometria rozděluje pacienty do skupin s podobnou prognózou. Tím umožňuje relevantní výměnu informací mezi onkologickými centry a přispívá k poznávání a výzkumu malignit v rozlišných částech světa. Zcela nově byl vytvořen stagingový systém pro adenosarkomy, leiomyosarkomy a endometriální stromální sarkomy založený na pravidlech platných pro sarkomy jiných měkkých tkání. Cílem tohoto textu je shrnutí současných znalostí v této oblasti.
Klíčová slova:
staging – karcinom endometria – sarkom dělohy – FIGO – TNM
Již ve 30. letech minulého století onkologové, chirurgové a patologové usilovali o společnou řeč při stanovení správné diagnózy včetně určení přesného rozsahu zhoubného onemocnění. Cílem bylo dosáhnout jednotné terminologie, protože bezchybné určení stadia maligního onemocnění má zásadní význam pro prognózu a léčbu malignity (1). Stagingový systém proto musí být snadno aplikovatelný i v zemích s rozdílnou úrovní zdravotní péče, aby identickým případům byla vždy přiřazena stejná stadia onemocnění (2) a mohl být tak srovnáván účinek různých modalit terapie (3,4).
Kvalitní stagingový systém je vypracován a pravidelně revidován na základě nejnovějších poznatků vědy (1,5). Při vytváření stagingových systémů v onkogynekologii hraje dominantní úlohu Mezinárodní federace gynekologie a porodnictví (FIGO, Fédération Internationale de Gynécologie et d´Obstétrique, The International Federation of Gynecology and Obstetrics), která v současnosti shromažďuje odborné gynekologicko-porodnické společnosti ze 124 zemí pěti kontinentů (6). Organizace FIGO věnovala v letech 2006 – 2008 mnoho času a pozornosti revizi stagingu zhoubných onemocnění vulvy, hrdla a těla dělohy. V závěrečné fázi procesu přizval předseda Výboru FIGO pro onkogynekologii (FIGO Committee on Gynecologic Oncology) prof. Sergio Pecorelli další mezinárodní vědecké společnosti a instituce zabývajících se výzkumem a léčbou ženských malignit (7,8). Na začátku září 2008 byl dokument obsahující zrevidované stagingové systémy pro karcinom vulvy, děložního hrdla a endometria a nový stagingový systém pro děložní sarkomy podstoupen Výkonnému výboru FIGO (FIGO Executive Board), který ho oficiálně přijal. Změny ve stagingovém systému FIGO byly převzaty v modifikované formě i do stagingového systému TNM podporovaného organizacemi UICC (International Union Against Cancer) a AJCC (The American Joint Committe for Cancer Staging) tak (9), aby oba systémy byly co nejvíce identické (10). V následujícím textu je probrána problematika současného stagingového systému zhoubných onemocnění děložního těla včetně důvodů jeho změn s dopadem na klinickou praxi.
PŘEPRACOVANÝ STAGING PRO KARCINOM ENDOMETRIA
Histologicky jsou nejčastějšími maligními nádory těla děložního karcinomy endometria. Jejich incidence se v ČR dlouhodobě pohybuje kolem 30 - 35 případů na 100 tisíc žen a rok. Jedná se tedy o nejčastější genitální malignitu. Prognóza onemocnění je ale celkově poměrně příznivá, protože téměř 75 % pacientek je diagnostikováno ve stadiu I (11). V roce 2010 bylo v ČR hlášeno 1870 případů a 468 pacientek zemřelo (12).
Karcinomy endometria se podle dualistického modelu dělí na 2 odlišné typy. Prognosticky příznivějším hormonálně dependentním karcinomům I. typu předchází atypická hyperplázie endometria, hormonálně non-dependentní karcinomy endometria II. typu s neznámou etiologií vznikají většinou v terénu atrofického či inaktivního endometria. Podle současné koncepce jsou prvním krokem v karcinogenezi nádorů II. typu tzv. p53 signatury, které jsou detekovatelné pouze imunohistochemicky (13). Pro klinickou praxi je nicméně zásadní rozlišení hyperplázie nevykazující atypie a hyperplázie s atypiemi (14).
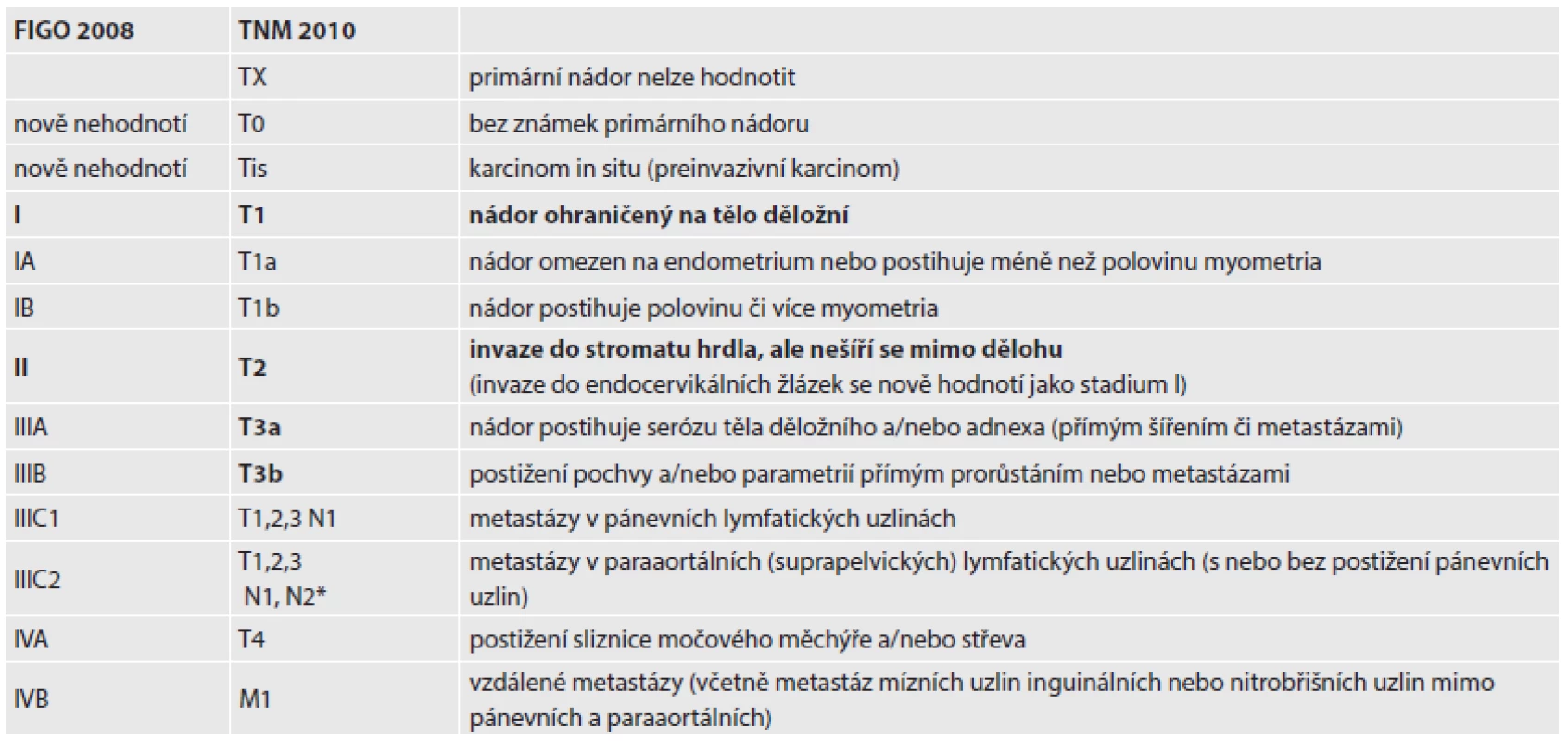
První stagingový systém pro karcinom endometria byl čistě klinický a obsahoval subkategorii pro pacientky, které nemohly být operovány pro nepříznivý performance status. Další klasifikace z roku 1971 zahrnula do stagingu grade tumoru. Na základě publikací o vyšším riziku šíření karcinomu endometria mimo dělohu v závislosti na hloubce invaze do myometria a grade tumoru Výbor FIGO pro onkogynekologii v roce 1988 rozhodl, že staging karcinomu endometria bude čistě chirurgický (patologicko-anatomický) a rozdělil stadium I na tři stupně - IA bez invaze, IB invaze maximálně do ½ myometria a IC invaze více než do ½ myometria. Pro metastázy do lymfatických uzlin bylo určeno stadium IIIC. Práce, které používaly tento typ stagingu a zároveň zohledňovaly i grade (G) nádoru, zjistily pětileté přežití ve stadiu IA G1 u 93,4 % pacientek, ve stadiu IB G1 u 91,6 % pacientek, ve stadiu IA G2 u 91,3 % nemocných a ve stadiu IB G2 u 93,4 % pacientek (15). Protože délka přežití v těchto skupinách nevykazovala statisticky významné odchylky, navrhl Výbor tato stadia sloučit.
V nově vytvořeném stagingu se proto stadia IA a IB spojila do stadia IA (invaze nejvíce do ½ myometria), nové stadium IB (invaze nad ½ síly myometria včetně) odpovídá dřívějšímu stadiu IC, které nyní zaniklo. Stadium II (invaze do stromatu děložního hrdla, dříve stadium IIB) zůstává bez dalších substadií, invaze do glandulárních buněk hrdla (dříve stadium IIA) patří do stadia I.
Vzhledem k tomu, že při postižení suprapelvických lymfatických uzlin je prognóza signifikantně horší než při samostatném postižení pánevních uzlin, bylo stadium IIIC rozčleněno na dvě substadia. Stadium IIIC1 je vyhrazeno pro postižení pouze pánevních lymfatických uzlin a stadium IIIC2 zahrnuje postižení suprapelvických lymfatických uzlin (v kombinaci s infitrací pánevních uzlin nebo izolovaně). Pozitivní cytologie laváže z peritoneální dutiny se uvádí samostatně, ale již není součástí stagingu (15).
V časných stadiích je nejdůležitějším prognostickým faktorem postižení lymfatických uzlin. Jedinou spolehlivou metodou zjištění postižení lymfatických uzlin je chirurgický staging neboli provedení systematické lymfadenektomie. Hlavním cílem lymfadenektomie je identifikovat poskupinu pacientek s vyšším rizikem recidivy, které by měly podstoupit adjuvantní terapii. Ve velkých souborech dosahuje pětileté přežití ve stadiích I a II přibližně 90 % v případě nepostižených lymfatických uzlin, při metastatickém postižením pánevních lymfatických uzlin 75 % a jen 38 % pacientek s postiženými paraaortálními lymfatickými uzlinami přežije pět let (16,17).
Prognostický význam systematické lymfadenektomie ve smyslu delšího přežití nebyl prokázán u nádorů s gradingem 1 a 2, zatímco u nádorů vysokého rizika (grade 3) má systematická lymfadenektomie (zvláště paraaortální) významný příznivý vliv na pětileté přežití (18-20). Pokud je lymfadenektomie indikována, měla by se provést systematická pánevní a paraaortální lymfadenetomie z definovaných lokalit, protože u více než 50 % pacientek s pozitivními pánevními uzlinami jsou postiženy i paraaortální uzliny. Navíc až v 6 - 17 % bylo zjištěno izolované postižení paraaortálních lymfatických uzlin (21,22). Podle současných guidelines Onkogynekologické sekce ČGPS JEP (Česká gynekologicko-porodnická společnost Jana Evangelisty Purkyně) se pacientky s karcinomem endometria dělí do skupiny nízkého rizika (low-risk) a skupiny vysokého rizika (high-risk). U pacientek s nízkým rizikem (histologický typ endometroidní nebo mucinozní; grade 1 stadium IA a IB; grade 2 stadium IA) je dostatečným výkonem lavage peritoneální dutiny, extrafasciální hysterektomie s bilaterální adnexektomií laparotomickým nebo laparoskopickým přístupem. U pacientek s vysokým rizikem (nesplňují kritéria low-risk pacientek) je doporučen kompletní chirurgický staging lymfatických uzlin až do úrovně odstupu levostranné renální žíly. Vysocerizikové histologické typy karcinomu endometria (clear cell, serózní papilární karcinom) vyžadují operační přístup jako v případě karcinomu ovaria, k vyše uvedenému se připojuje navíc appedektomie a omentektomie (23).
Důležitým kritériem rozhodujícím o rozsahu operačního výkonu je hloubka myometrální invaze nádoru. Přestože předoperační stagingová vyšetření zobrazovacími metodami dosahují relativě vysoké přesnosti (v případě myometrální invaze pomocí transvaginální sonografie 84 % a pomocí magnetické rezonance 81 %; v případě šíření nádoru do děložního hrdla pomocí transvaginální sonografie 92 % a pomocí magnetické rezonance 85 %), je přesnější odeslat preparát dělohy na peroperační rychlé histologické zpracování a podle výsledku určit strategii operačního zákroku (24-26).
Přestože změny u stagingu karcinomu endometria nejsou rozsáhlé, jsou mimořádně významné. Nová klasifikace vznikla pod vedením dr. Williama Creasmana, změny vychází z dat poskytnutých FIGO za posledních 20 let, navíc byly potvrzeny dalšími publikacemi (15). Nová stadia a substadia zobrazená v tabulce 1 lépe definují prognózu pacientek a umožňují naplánovat adekvátní terapii.
STAGING DĚLOŽNÍCH SARKOMŮ
Děložní sarkomy jsou vzácné tumory, které tvoří přibližně 1 % ženských malignit a 5 - 8 % zhoubných tumorů dělohy (11). Incidence se v České republice pohybuje kolem 1,7 na 100 tis. žen starších 20 let (12). Představují kontroverzní kapitolu hlavně s ohledem na svoji histogenezi, klasifikaci a chování. Histologicky se navíc jednotlivé typy výrazně liší (27). Ačkoliv je agresivní růst většiny děložních sarkomů velmi dobře prostudován, jejich vzácný výskyt a zcela odlišná biologická povaha neumožňuje nalézt úplnou shodu v přesné definici rizikových faktorů a jednoznačně určit optimální terapii (28,29). Publikované práce většinou retrospektivně analyzují malé soubory pacientek z jednotlivých pracovišť (30). Z těchto důvodů neexistoval pro sarkomy dělohy specifický stagingový systém. Sarkomy byly klasifikovány podle modifikovaného systému pro karcinom endometria z roku 1988, přestože oba nádory jsou zcela rozdílné. Při poslední revizi stagingových systémů v roce 2009 byl proto na základě poznatků o chování sarkomů jiných lokalizací vytvořen zcela nový stagingový systém, který lépe odráží jejich odlišné biologické chování (Tab. 2).
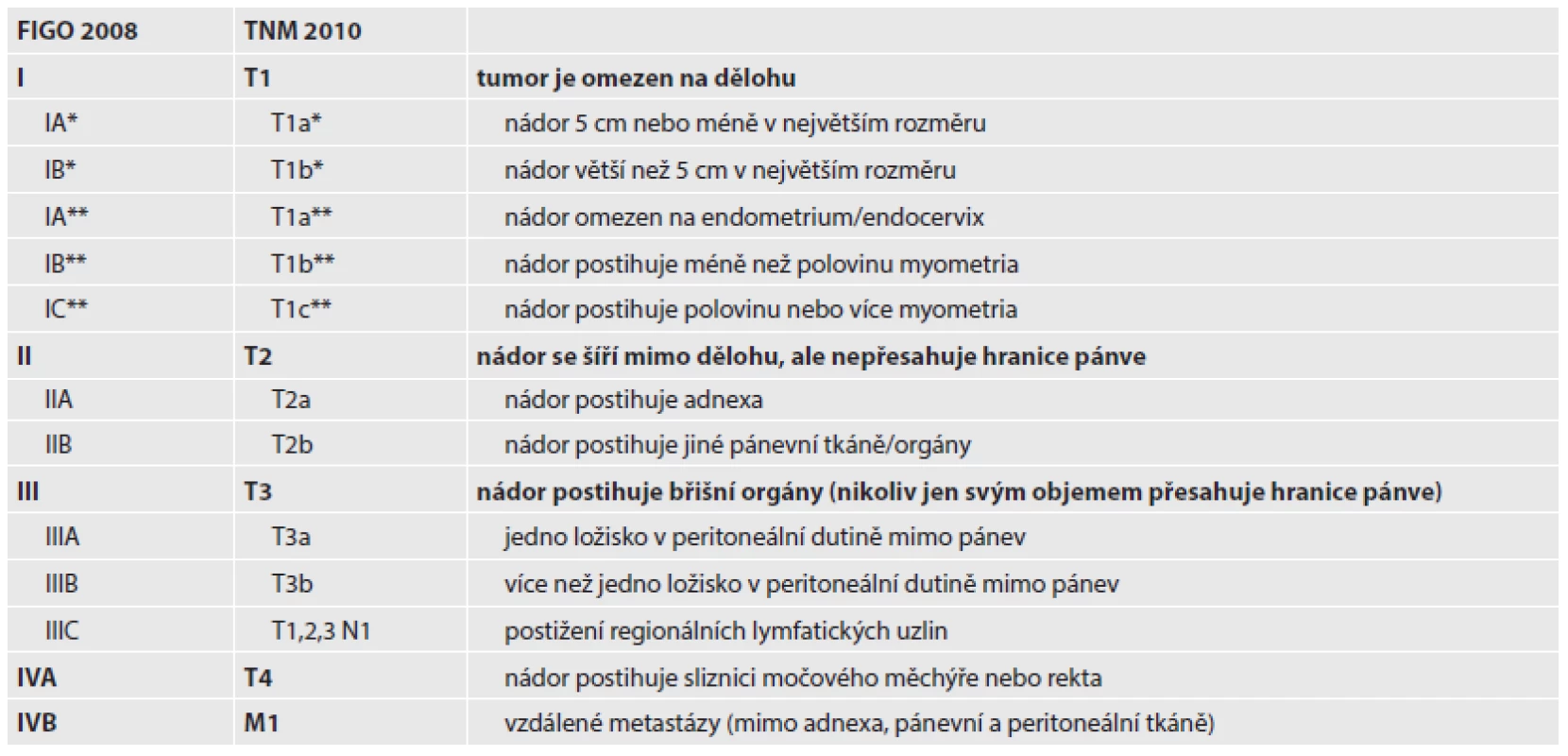
Děložní sarkomy se dělí podle místa vzniku na stromální sarkomy (15 - 25 %) z endometria a leiomyosarkomy (30 - 40 %) z myometria. Kromě čistých forem se vyskytují i nádory smíšené. Nejčastější karcinosarkomy (30 - 40 %) obsahují také epiteliální elementy. V 5 - 15 % případů jsou diagnostikovány přesněji neurčené nediferencované sarkomy (31). Byla popsána např. i smíšená myxoidní varianta low-grade endometriálního stromálního sarkomu a hladkosvalového nádoru dělohy (32).
Mezi čistě mezenchymálními děložními sarkomy jsou nejvíce zastoupeny leiomyosarkomy (LMS), roční incidence v Evropě se pohybuje okolo 0,4 – 0,6 případů na 100 tis. žen (11,33). Průměrný věk pacientek s leiomyosarkomem je 45 - 50 let, tedy o 10 let méně než u pacientek s endometriálním stromálním sarkomem. V naprosté většině případů jsou diagnostikovány retrospektivně po hysterektomii indikované pro myom (11). Podle WHO jsou leiomysarkomy charakterizovány dediferenciací buněk hladké svaloviny. K potvrzení jejich diagnózy je nutná přítomnosti dvou ze tří následujících charakteristik - střední až výrazné jaderné atypie, mitotický index větší nebo roven deseti mitóz na deset zorných polí a/nebo nález koagulačních nekróz (34,35).
Doporučení pro léčbu leiomysarkomů nejsou jednoznačná, např. dotazníková studie mezi členy dvou odborných gynekologických společností v Německu zjistila naprostou rozdílnost názorů na radikalitu operace (adnexektomie, lymfadenektomie), podání adjuvantní radioterapie a chemoterapie (36). Standardní léčbou je extrafasciální hysterektomie (29,37). Ve dvou souborech pacientek s leiomyosarkomem, které podstoupily lymfadenektomii, byly nalezeny metastázy v lymfatických uzlinách v 6,6 % (348 pacientek) a v 11 % (208 pacientek) případů (28, 38). V prvním souboru pět let přežilo 26 % u pacientek s pozitivními lymfatickými uzlinami ve srovnání s 64,2 % pacientkami bez pozitivních uzlin (p < 0.001). Provedení adnexektomie nemělo na pětileté přežití žádný vliv (38), adnexa jsou ale často odstraněna vzhledem k věku pacientky (39). Recentní přehledové práce a metaanalýzy uvádí u časných stadiích postižení adnex nebo lymfatických uzlin jen okolo 3 % (29,40). Provedení adnexektomie a lymfadenektomie tedy pravděpodobně není nezávislým prognostickým faktorem (41) a nemá žádný klinický význam (29,37).
Ve stadiích I a II je nejdůležitějším prognostickým faktorem velikost primárního tumoru, v pokročilých stadiích je přisuzován statisticky signifikantní význam pouze velikosti mitotického indexu (42,43). Studuje se prognostický význam molekulárních biomarkerů; průkaz survivinu a β-cateninu byl spojen s častějším výskytem intraperitoneálních recidiv, vysoká exprese bcl-2 predikovala delší DSS (disease-specific survival) (44). Adjuvantní chemoterapie i radioterapie prodlužuje PFI (progression-free interval) i DSS (45,46), nicméně u malých primárních tumorů nízkého gradingu nemá adjuvantní terapie na prognózu onemocnění nejspíše zásadní vliv (47). U 20 - 80 % LMS se vyskytují estrogenové a progesteronové receptory, které mohou být využity k cílené hormonální léčbě, zvláště při recidivách onemocnění (29,48).
V případech hladkosvalových tumorů, které jednoznačně nesplňují všechna kritéria malignity, se používá označení tumor z hladké svaloviny nejasného maligního potenciálu (STUMP – smooth muscle tumor of uncertain malignant potential) (34,35). Léčba těchto nádorů je stejná jako u leiomyomů, pouze se doporučuje přísnější dispenzarizace.
V endometriálním stromatu mohou vznikat tumory, které se dělí podle stupně diferenciace a dalších znaků (buněčné atypie, přítomnost nekróz, absence progesteronových receptorů, charakter invaze do myometria). Pro tuto skupinu je vyhrazen termín endometriální stromální sarkom (ESS) (34). V Evropě je jeho incidence udávána kolem 0,2 - 0,3 onemocnění na 100 tis. žen za rok (11,33). Benigní varianta je označována názvem endometrální stromální nodulus. I když počet mitóz u těchto tumorů nemá velký význam pro predikci prognózy, klasicky byly maligní formy děleny v závislosti na počtu mitóz na low-grade (LGSS) a high-grade stromální sarkomy (HGSS).
Klasifikace a terminologie HGSS je však kontroverzní, dnes toto označení nahradil název nediferencovaný sarkom (NDS). Histologicky jde o pleomorfní anaplastický nádor obvykle s výraznými jadernými atypiemi, nekrózami a četnými mitózami. Důležité je důkladné vyšetření k vyloučení přítomnosti epitelové komponenty (11). Histologický vzhled tohoto nádoru může být podobný více mesenchymálním elementům karcinosarkomu než typickému endometriálnímu stromálnímu tumoru (34).
LGSS jsou pomalu rostoucí nádory s tendencí ke vzniku pozdních recidiv a s dlouhým intervalem bez známek onemocnění (DFS, disease-free interval). Jedná se o málo aktivní nádory s velmi dobrou prognózou dlouhodobého přežití. Recidivy a metastázy nejsou příliš časté (49). Histologicky jsou tvořeny dobře diferencovanými stromálními buňkami s hojnou kapilární vaskularizací. Invadují do myometria a do lymfatických cév, což je jediný odlišující znak od benigních stromálních nodulů, protože cytologicky jsou neodlišitelné. Z toho také vyplývá, že přesné stanovení LGSS z probatorní kyretáže dutiny děložní je velmi obtížné a často nemožné.
Nezbytnou součástí operační léčby ESS je extrafasciální hysterektomie. Dříve striktně doporučována oboustranná adnexektomie nemusí být u mladých žen s LGSS iniciálního stadia v individuálních případech po domluvě s pacientkou provedena. Vlivem nízké incidence tohoto nádoru neexistují jednoznačná data o efektu lymfadenektomie na prognózu pacientek, ale některé studie naznačují, že provedení systematické pánevní lymfadenektomie má snad nevelký klinický význam (29).
Karcinosarkom, nazývaný též maligní smíšený mülleriánský nádor (MMMT – malignant mixed müllerian tumor), je bifázický tumor složený ze zřetelně oddělených maligních epiteliálních a mesenchymálních struktur s incidencí 0,82 případů na 100 tis. žen a rok (11). Nemocné s karcinosarkomy mají řadu společných charakteristik s populací pacientek s karcinomem endometria. V současné době byl proto karcinosarkom reklasifikován na metaplastickou formu endometriálního adenokarcinomu, přestože se chová výrazně agresivněji než běžný endometriální karcinom. Pod tímto názvem je uveden v naprosté většině retrospektivních studiích o karcinosarkomech, v klasifikaci nemocí WHO z roku 2003 (34) a takto je nazván v Blausteinově Patologii ženského pohlavního traktu (50). Nejdůležitějším prognostickým faktorem u karcinosarkomu je přítomnost lymfovaskulární invaze a zachycené chirurgické stadium onemocnění, prognózu zhoršuje převážně extrauterinní šíření a hluboká invaze do myometria. Multivariační analýza v GOG studii zahrnující 301 pacientek potvrdila jako statisticky signifikantní prognostické faktory postižení adnex, postižení lymfatických uzlin, histologický typ tumoru (heterologní vs. homologní) a grade. V léčbě karcinosarkomu je indikována lavage peritoneální dutiny, extrafasciální hysterektomie, bilaterální adnexektomie a systematická pánevní a paraaortální lymfadenektomie, protože až třetina pacientek je na základě chirurgického stagingu přesunuta do vyššího stadia (51). Systematická pánevní a paraaortální lymfadenektomie je nedílnou součástí rozsahu operačního řešení zvláště v případech s myometrální invazí nad 1/2 myometria nebo s přítomností lymfangioinvaze. Mnoho studií také vypovídá o pozitivním vlivu lymfadenektomie na DFS (bezpříznakové období) i OS (overall survival, celkové přežití) pravděpodobně odstraněním mikrometastatických ložisek (52). I z těchto důvodů zůstává stagingový systém pro karcinosarkom identický se stagingovým systémem pro karcinom endometria.
Mülleriánský adenosarkom (AS) se vyskytuje méně často, ale má významně lepší prognózu než karcinosarkom. Jedná se o smíšený tumor nízkého maligního potenciálu se složkou benigního žlázového epitelu a nízce diferencovaného sarkomu, nejčastěji stromálního typu (53). Heterologní mesenchymální součásti, obvykle typu rhabdomyosarkomu, se nachází v 10 - 15 % případů. Typicky se stroma soustřeďuje kolem žlázek tvořící periglandulární manžety, histologický obraz připomíná phylloidní tumor prsu. Dobře diferencované nádory mohou vykazovat ve stromální složce jen nízkou atypii jader a velmi málo mitóz, popřípadě se mitózy nezastihnou žádné. V takových případech přítomnost hypercelulárních periglandulárních manžet pomůže odlišit adenosarkom od jeho vzácnější benigní varianty, adenofibromu (54). Adenosarkomy s velkým objemem sarkomatózní složky a s myometrální invazí recidivují ve 25 - 30 % případech během pěti let od stanovení diagnózy, nejvíce v pochvě a v pánvi (53). Velký objem sarkomatózní složky (čistý sarkom bez žlázové komponenty) je definován jako alespoň 25 % postižení objemu nádoru, tento nález se vyskytuje u 8 - 54 % děložních adenosarkomů (53). Přestože invaze do myometria není příliš častá, částečně vyjadřuje prognózu pacientky. Proto její hloubka na rozdíl od ostatních sarkomů dělohy rozčleňuje u adenosarkomů stadium I do tří substadií. Povrchová invaze se vyskytuje přibližně v 15 % případů, hluboká invaze byla pozorována dokonce jenom u 5 % nemocných (53).
Prognóza pacientek s děložními sarkomy se v poslední době nemění. Pětileté přežití se pohybuje podle různých studií od 17,5 % do 54,7 % (28,39,55). Retrospektivní práce z Finska uvádí, že ze sta pacientek s děložním sarkomem přežilo dva roky 62 %, pět let 51 % a deset let 38 % pacientek (55). Hlavní prognostická kritéria ovlivňující celkové přežití jsou stadium nemoci v době stanovení diagnózy a největší rozměr primárního tumoru (28,55). Z hlediska prognózy se sarkomy dělohy dělí na prognosticky nepříznivé (LMS, NDS) a nádory s příznivější prognózou (LGSS, AS) (56).
Ani sebelepší zhodnocení histologických preparátů barvených hematoxylinem - eozinem neumožňuje zlepšit předpověď chování děložních sarkomů a přesnost prognózy. Imunohistochemické studie vybraných onkoproteinů stejně jako molekulární analýza nerandomizovaných translokací, které se často objevují u LGSS, nepochybně povede k přesnější klasifikaci děložních sarkomů spojenou s přesnějším stanovení prognózy (47). Na druhou stranu u LMS jsou zatím jedinými definovanými prognostickými faktory mitotický index a velikost primárního tumoru nad 9 - 11 cm. Ani jedno z těchto kriterií není v novém stagingovém systému zohledněno, proto také práce srovnávající prognózu pacientek podle původního a nového stagingového systému pro sarkomy dělohy uvádí nejednotné závěry. Některé nenašly signifikatní rozdíly v OS podle příslušného stadia (57), jiné přisuzují jednotlivým stadiím nového systému určení přesnější prognózy pacientek (45).
ZÁVĚR
Každý stagingový systém by měl splňovat tři základní charakteristiky – měl by být odůvodněný, důvěryhodný a praktický. Hlavní cíle dobrého stagingového systému poskytují odhad prognózy onemocnění a vypovídají o úspěchu aplikované léčby a tím umožňují výzkum a výměnu relevantních informací mezí onkologickými centry napříč světadíly. K dosažení tohoto cíle musí být stagingový systém vytvořený na základě “evidence-based“ znalostí a snadno aplikovatelný v praxi (user-friendly) (2). Vzhledem k vývoji diagnostických i terapeutických možností ve všech oblastí medicíny je nutné v průběhu doby stagingové systémy upřesňovat. Na základě nových poznatků byly v roce 2008 FIGO navrženy a odsouhlaseny některé změny, které byly následně zahrnuty i do systému TNM. Přepracované FIGO a TNM stagingové systémy lépe vyjadřují prognózu pacientek v konkrétním stadiu malignity. Zdravotnická péče navíc profituje z široce používaného uniformního stagingu, který z podobných skupin pacientů generuje nová data usnadňující další výzkum (58).
Zdravotníci na všech úrovních diagnosticko-léčebného procesu by měli celosvětově používat nový stagingový systém, protože jedním z hlavních účelů klasifikačních systémů zhoubných nádorů je zprostředkovat klinické zkušenosti léčby v závislosti na stadiu onemocnění napříč světadíly bez ohledu na rozvinutost a bohatství regionu.
Práce byla podpořena grantem IGA NT14079-3/2013 a projektem PRVOUK-P27/LF1/1.
SEZNAM ZKRATEK
AJCC The American Joint Committe for Cancer Staging, Spojená americká komise pro staging malignit
AS adenosarkom
ČGPS JEP Česká gynekologicko-porodnická společnost Jana Evangelisty Purkyně
DFS disease-free survival (bezpříznakové období)
DSS disease-specific survival (specifické přežití vázáno na konkrétní onemocnění)
ESS endometriální stromální sarkom
FIGO Fédération Internationale de Gynécologie et d´Obstétrique, The International Federation of Gynecology and Obstetrics, Mezinárodní federace gynekologie a porodnictví
G grade
HGSS high-grade endometriální stromální sarkom
LGSS low-grade endometriální stromální sarkom
LMS leiomyosarkom
MMMT malignant mixed mullerian tumor, maligní smíšený mülleriánský nádor, karcinosarkom
NCCN National Comprehensive Cancer Network, aliance sdružující 21 komplexních onkologických center v USA
NDS nediferencovaný sarkom
OS overall survival, celkové přežité
PFI progression-free interval, období bez progrese (od zahájení léčby do manifestace nového projevu)
STUMP smooth muscle tumor of uncertain malignant potential, tumor z hladké svaloviny nejasného maligního potenciálu
TNM tumor-noduli-metastasis
UICC International Union Against Cancer, Mezinárodní výbor proti rakovině
WHO World Health Organization, Světová zdravotnická organizace
Adresa pro korespondenci:
MUDr. Borek Sehnal
Gynekologicko-porodnická klinika
1. LF UK a Nemocnice Na Bulovce
Budínova 2, 180 81 Praha 8
tel.: 266 083 229
e-mail: boreksehnal@seznam.cz
Zdroje
1. Benedet JL, Pecorelli S. Why cancer staging? Int J Gynecol Obstet 2006; 95(Suppl l): 3.
2. Odicino F, Pecorelli S, Zigliani L, Creasman WT. History of the FIGO cancer staging system. Int J Gynecol Obstet 2008; 101(2): 205-210.
3. Pettersson F. Annual Report on the Results of Treatment in Gynecological Cancer. FIGO 1985; 19th volume.
4. Raspagliesi F, Hanozet F, Ditto A, et al. Clinical and pathologic prognostic factors in squamosus cell carcinoma of the vulva. Gynecol Oncol 2006; 102(2), 333-337.
5. Benedet JL. Indroduction. CME J Gynecol Oncol 2001; 6: 229.
6. www.figo.org
7. Pettersson F. Annual Report on the Results of Treatment in Gynecological Cancer. FIGO 1988; Twentieth volume.
8. Pecorelli S. Revised FIGO staging for carcinoma of the vulva, cervix, and endometrium. Int J Gynaecol Obstet 2009; 105: 103–104.
9. Sobin LH, Gospodarowicz MK, Wittekind C. TNM klasifikace zhoubných novotvarů (7.vyd). Chichester: John Wiley & Sons, Inc.; 2011: 172-179.
10. Gospodarowicz MK, Miller D, Groome PA, Greene FL, Logan PA, Sobin LH. The proces for continuous improvement of the TMN classification. Cancer 2004; 100: 1-5.
11. Cibula D, Petruželka L. Onkogynekologie (1.vyd.). Praha: Grada; 2009: 489-494.
12. Systém pro vizualizaci onkologických dat. Institut biostatistiky a analýz Lékařské a Přírodovědecké fakulty Masarykovy univerzity (IBA MU). www.svod.cz
13. Dundr P. Prekancerózy endometria, děložní tuby a ovaria: přehled současné problematiky. Cesk Patol 2012; 48(1): 30–34.
14. Rob L, Robová H, Chmel R, Škapa P. Gynekologické prekancerózy z pohledu klinika dnes a zítra. Česk Patol 2012; 48(1): 9-14.
15. Creasman W. Revised FIGO staging for carcinoma of the endometrium. Int J Gynaecol Obstet 2009; 105: 109.
16. Morrow CP, Bundy BN, Kurman RJ, et al. Relationship between surgical-pathological risk factors and outcome in clinical stage I and II carcinoma of the endometrium: a Gynecologic Oncology Group study. Gynecol Oncol 1991; 40(1): 55–65.
17. Lurain JR, Rice BL, Rademaker AW, Poggensee LE, Schink JC, Miller DS. Prognostic factors associated with recurrence in clinical stage I adenocarcinoma. Obstetr Gynecol 1991; 78(1), 63–69.
18. Kitchener H, Redman CW, Swart AM, et al. A study in the treatment of endometrial cancer. A randomised trial of lymphadenectomy in the treatment of endometrial cancer. Gynecol Oncol 2006; 101(Suppl 1): S21-S22.
19. Chan JK, Kapp DS. Role of complete lymphadenectomy in endometroid uterine cancer. Lancet Oncol 2007; 8: 831-841.
20. Todo Y, Kato H, Kaneuchi M, Watari H, Takeda M, Sakuragi N. Survival effect of para-aortic lymphadenectomy in endometrial cancer (SEPAL study): a retrospective cohort analysis. Lancet 2010; 375(9721): 1165–1172.
21. Mariani A, Keeney GL, Aletti G, Webb MJ, Haddock GM, Podratz KC. Endometrial carcinoma: paraaortic dissemination.Gynecologic Oncology 2004; 92(3): 833–838.
22. Alhilli MM, Mariani A. The role of para-aortic lymphadenectomy in endometrial cancer. Inter J Clin Oncol 2013; 18(2): 193–199.
23. www.onkogynekologie.com
24. Fischerova D. Ultrasound scanning of the pelvis and abomen for staging of gynecological tumors: a review. Ultrasound Obstet Gynecol 2011; 38: 246–266.
25. Savelli L, Ceccarini M, Ludovisi M, et al. Preoperative local staging of endometrial cancer: transvaginal sonography vs. magnetic resonance imaging. Ultrasound Obstet Gynecol 2008; 31: 560–566.
26. Weber G, Merz E, Bahlmann F, Mitze M, Weikel W, Knapstein PG. Assessment of myometrial infiltration and preoperative staging by transvaginal ultrasound in patients with endometrial carcinoma. Ultrasound Obstet Gynecol 1995; 6: 362–367.
27. Zámečník M. Mezenchymálne tumory adnex a tela maternice. Selektovaný prehľad. Cesk Patol 2007; 43(4): 121-134.
28. Giuntoli RL 2nd, Metzinger DS, DiMarco CS, et al. Retrospective review of 208 patients eith leiomyosarcoma of the uterus: prognostic indicators, surgical management, and adjuvant therapy. Gynecol Oncol 2003; 89(3): 460-469.
29. Amant F, Coosemans A, Debiec-Rychter M, Timmerman D, Vergote I. Clinical management of uterine sarcomas. Lancet Oncol 2009; 10(12): 1188-1198.
30. Klačko M, Babala P, Mikloš P, et al. Sarkómy maternice – prehľad. Klin Onkol 2012; 25(5): 340-345.
31. Prat J. FIGO staging for uterine sarcomas. Int J Gynaecol Obstet 2009; 104(3): 177-178.
32. Dundr P, Fischerova D, Povýšil C, Cibula D, Zikan M. Smišený myxoidní low grade endometriální stromální sarkom a hladkosvalový nádor dělohy. Popis případu. Cesk Patol 2012; 48(2): 103–106.
33. Koivisto-Korander R, Martisen JI, Weiderpass E, Leminen A, Pukkala E. Incidence of uterine leiomyosarcoma and endometrial stromal sarcoma in Nordic countries: results from NORDCAN and NOCCA databases. Maturitas 2012; 72(1): 56-60.
34. Tavassoli FA, Devilee P, editors. World Health Organization Classification of Tumours. Pathology and genetics of tumours of the breast and female genital organs. IARC Press: Lyon: 2003.
35. Bell SW, Kempson RL, Hendricson MR. Problematic uterine smooth muscle neoplasms. A clinicopathologic study of 213 cases. Am J Surg Pathol 1994; 18(6): 535-558.
36. Chen FC, David M, Richter R, Muallem MZ, Chekerov R, Sehouli J. Survey among German Gynecologists on the Clinical Management of Patients with Sarcomas of the Uterus. Anticancer Res 2013; 25(5): 546-552.
37. Reichardt P. The treatment of uterine sarcomas. Ann Oncol 2012; 23(Suppl 10): 151-157.
38. Kapp DS, Shin JY, Chan JK. Prognostic factor and survival in 1396 patients with uterine leiomyosarcomas: emphasis on impact of lymphadenectomy and oophorextony. Cancer 2008; 112(4): 820-830.
39. Gadducci A, Cosio S, Romanini A, Genazzani A. The management of patients with uterine sarcoma: a debated clinical challenge. Crit Rev Oncol Hematol 2008; 65: 129–142.
40. Leitao M, Sonoda Y, Brennan M, et al. Incidence of lymph node and ovarian metastases in leiomyosarcoma of the uterus. Gynecol Oncol 2003; 91: 209–212.
41. Kapp DS, Shin JY, Chan JK. Prognostic factors and survival in 1396 patients with uterine leiomyosarcomas: emphasis on impact of lymphadenectomy and oophorectomy. Cancer 2008; 112: 820–830.
42. Major FJ, Blessing JA, Silverberg SG, et al. Prognostic factors in early stage uterine sarcoma: A Gynecologic Oncology Group study. Cancer 1993; 71(Suppl 4): 1702-1709.
43. Rauh-Hain JA, Oduyebo T, Diver EJ, et al. Uterine leiomyosarcomas: an updated series. Int J Gynecol Cancer 2013; 23(6): 1036-1043.
44. Lusby K, Savannah KB, Demicco EG, et al. Uterine leiomyosarcoma management, outcome, and associated molecular biomarkers: a single institution‘s experience. Am Surg Oncol 2013; 20(7): 2364-2372.
45. Wong P, Han K, Sykes J, et al. Postoperative radiotherapy improves local control and survival in patients with uterine leiomyosarcoma. Radiat Oncol 2013; 24(8): 128.
46. Hensley ML, Wathen JK, Maki RG, et al. Adjuvant therapy for high-grade, uterus-limited leiomyosarcoma: results of a phase 2 trial (SARC 005). Cancer 2013; 118(8): 1555-1561
47. Giuntoli RL 2nd, Lessard-Anderson CR, Gerardi MA, et al. Comparison of current staging systems and a novel staging system for uterine leiomyosarcoma. Int J Gynecol Cancer 2013; 23(5): 869-876.
48. Koivisto-Korander R, Leminen A, Heikinheimo O. Mifepristone as treatment of recurrent progesterone receptor-positive uterine leiomyosarcoma. Obstet Gynecol 2007; 109: 512–514.
49. Chang KL, Crabtree GS, Lim-Tan SK, Kempson RL, Hendricson MR. Primary uterine endometrial stromal neoplasms. A clinicalpathologic study of 117 cases. Am J Surg Pathol 1990; 14(5): 415-438.
50. Kurman RJ. Blaustein´s Pathology of the Female Genital Tract (5th edn.) New York: Springer Verlag; 2002: 1391.
51. Park JY, Kim DY, Kim JH, Kim YM, Kim YT, Nam JH. The role of pelvic and/or para-aortic lymphadenectomy in surgical management of apparently early carcinosarcoma of uterus. Ann Surg Oncol 2010; 17(3): 861-868.
52. Vorgias G, Fotiou S. The role of lymphadenectomy in uterine carcinosarcomas (malignant mixed mullerian tumours): a critical literature review. Arch Gynecol Obstet 2010; 282(6): 659-664.
53. Clement PB, Scully RE. Mullerian adenosarcoma of the uterus: a clinicopathologic analysis of 100 cases with a review of the literature. Hum Pathol 1990; 21(4): 363-381.
54. Gallardo A, Prat J. Mullerian adenosarcoma of the uterus: A clinicopathologic and immunohistochemical study of 55 cases challenging the existence of adenofibroma. Am J Surg Pathol 2009; 33(2): 278-288.
55. Koivisto-Korander R, Butzow R, Koivisto AM, Leminen A. Clinical outcome and prognostic factors in 100 cases of uterine sarcomas: experience in Helsinki University Central Hospital 1990-2001. Gynecol Oncol 2008; 111(1): 74-81.
56. Dafapoulos A, Tsikouras P, Dimitraki M, et al. The role of lymphadenectomy in uterine leiomyosarcoma: review of the literature and recommendations for the standard surgical procedure. Arch Gynecol Obstet 2010; 282(3): 293-300.
57. Lim D, Wang WL, Lee CH, Dodge T, Gilks B, Oliva E. Old versus new FIGO staging systems in predicting overall survival in patients with uterine leiomyosarcoma: a study of 86 cases. Gynecol Oncol 2013; 128(2): 322-326.
58. Mackillop WJ, O’Sullivan B, Gospodarowicz M. The role of cancer staging in evidence-based medicine. Cancer Prev Control 1998; 2(6): 269-277.
Štítky
Patológia Súdne lekárstvo ToxikológiaČlánok vyšiel v časopise
Česko-slovenská patologie

2014 Číslo 2
Najčítanejšie v tomto čísle
- WHO classification of tumours of soft tissue and bone 2013: the main changes compared to the 3rd edition
- Kde končí a začíná diagnóza Ewingova sarkomu - popis dvou neobvyklých kostních nádorů s translokací t(20;22)(EWSR1-NFATc2)
- Současný staging zhoubných nádorů děložního těla a jeho význam pro klinickou praxi
- Epidermolytická hyperkeratóza vulvy asociovaná s bazocelulárním karcinomem u pacientky s vaginálním condyloma acuminatum a vaginální intraepiteliální neoplazií infikovanými HPV typu 42
