-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Využití archivovaných parafínových bločků s formalinem fixovanou tkání (FFPE) pro molekulárně genetickou analýzu u difuzního velkobuněčného lymfomu (DLBCL)
Use of archival formalin-fixed, paraffin-embedded (FFPE) tissue samples for molecular genetic analysis in diffuse large B-cell lymphoma (DLBCL)
The currently valid molecular genetic subclassification of patients with diffuse large B-cell lymphoma (DLBCL) into three prognostic subgroups based on expression profiling has been the objective of numerous genetic studies. In routine clinical practice, however, expression profiling technology remains unavailable for the most of centers. Apart from the technology, in some cases molecular genetic laboratories have problems obtaining high-quality material, i.e. fresh tissues, for RNA isolation to determine gene expression. One possibility is to determine the gene expression from RNA obtained by isolation from formalin-fixed, paraffin-embedded (FFPE) tissue. This pilot study aimed at isolating RNA from FFPE in patients diagnosed with DLBCL and verifying the potential use of such RNA for the expression analysis of 7 selected genes. Although the study showed that it is possible to isolate RNA and determine the expression of the selected genes from archival material, the values of relative expression of some genes in the set were too variable to be used for unambiguous prognostic classification. It was confirmed that retrospective analyses of selected genes may be performed with sufficient material obtained, and that properly archived blocks may be used for molecular biology analyses even after 8 years.
Keywords:
DLBCL – FFPE – gene expression – qRT-PCR – genetic changes
Autoři: Marie Jarošová; Jana Kučerová; Patrik Flodr; Michaela Mikešová; Vít Procházka; Tomáš Papajík
Působiště autorů: Hemato-onkologická klinika FN a LF UP Olomouc 1; Ústav biologie LF UP Olomouc 2; Ústav klinické a molekulární patologie FN a LF UP Olomouc 3
Vyšlo v časopise: Čes.-slov. Patol., 50, 2014, No. 2, p. 95-99
Kategorie: Původní práce
Souhrn
Současně platná molekulárně genetická subklasifikace pacientů s diagnózou difuzního velkobuněčného B lymfom (DLBCL) do tří prognostických podskupin na základě expresního profilu je cílem mnoha genetických studií. V rutinní klinické praxi je však použití expresní čipové technologie pro většinu pracovišť nedostupné. Včetně potřebné technologie, je v některých případech pro molekulárně genetické laboratoře problémem získat kvalitní materiál, např. čerstvou tkáň, pro izolaci RNA k určení exprese genů. Jednou z možností je určovat expresi genů z RNA získané izolací z parafínových bločků. Cílem pilotní studie bylo provést izolaci RNA z archivovaných parafínových bločků z formalinem fixované tkáně (FFPE) nemocných s diagnózou DLBCL a ověřit možnost využití této RNA pro expresní analýzu 7 vybraných genů. Práce ukázala, že izolace RNA a určení exprese vybraných genů z archivovaného materiálu je možná, avšak naměřená relativní exprese některých genů vykazovala v našem souboru značně variabilní hodnoty pro využití pro jednoznačnou prognostickou klasifikaci. Potvrdili jsme, že při získání dostatečného množství materiálu je možné provést retrospektivní analýzy exprese vybraných genů, a že správná archivace i po 8 letech dovoluje molekulárně biologické analýzy.
Klíčová slova:
DLBCL – parafínové bločky – exprese genů – qRT-PCR – genetické změnyRevidovaná druhá verze WHO klasifikace (2008) považuje difúzní velkobuněčný B lymfom (DLBCL) za heterogenní skupinu lymfomů a rámcově tento typ lymfomu rozděluje do čtyř hlavních skupin: DLBCL nespecifikovaný (Diffuse large B-cell lymphoma, NOS), podtypy DLBCL (Diffuse large B-cell lymphoma subtypes), jiné velkobuněčné lymfomy (Other lymphomas of large B cells) a hraniční případy (Borderline cases) (1). Členění je založeno na empirických znalostech klinických a morfologických s přihlédnutím k novým poznatkům z oblasti molekulární biologie. Pokroky v porozumění biologie DLBCL ukazují, že existuje několik odlišných podskupin, které jsou odrazem samotného vývojového stádia diferenciace B lymfocytu, ve kterém vznikají. Na základě expresních profilů je možné odlišit celkem tři prognostické podskupiny DLBCL nemocných (2). Podskupina nemocných označená GCB-DLBCL (germinal-center B-cell-like) vykazuje expresi genů charakteristickou pro buňky germinálního centra, podskupina nemocných s expresí genů charakteristických pro aktivované B lymfocyty je označena jako ABC-DLBCL (activated B-cell-like) a podskupina primárních mediastinálních B buněčných lymfomů - PMLBCL, která má expresi genů odlišnou od obou předchozích podskupin a více podobnou profilu nodulární sklerózy Hodgkinova lymfomu (2,3). Hodnocení celkového přežití na základě této klasifikace ukázalo, že 5-leté přežití dosahuje 64 % nemocných s PMLBCL, 59 % nemocných s GCB-DLBCL, avšak pouze 35 % pacientů stratifikovaných do podskupiny ABC-DLBCL (2). Toto rozdělení a určení genetických změn naznačuje, že v patogenezi DLBCL mohou být zahrnuty odlišné onkogenní regulační mechanismy (3).
Kromě molekulárně genetické klasifikace a stratifikace existuje i imunohistochemická (IHC) klasifikace DLBCL, opírající se o hodnocení výsledků imunohistochemického vyšetření protilátkami CD10, Bcl-6, MUM1/IRF4. Nejznámějším algoritmem je tzv. „algoritmus dle Hansové“ (Hans classifier)“ (4), který využívá kombinaci pozitivity respektive negativity znaků CD10, Bcl-6 a MUM1/IRF4 a rozděluje DLBCL na dvě prognostické skupiny GCB-like a nonGCB-like s přibližně 80% shodou s genovým expresním profilem (GEP). Novým imunohistochemickým algoritmem je klasifikace dle Choi (5), která rozděluje DLBCL na tři podskupiny a to GCB-like, nonGCB-like a skupinu označenou neklasifikované. Tento klasifikační postup dosahuje přibližně 93% shody i s GEP (5) a využívá IHC detekci exprese proteinů GCET1, CD10, Bcl-6, MUM1/IRF4 a FOXP1. Tento algoritmus není součástí klasifikace WHO 2008 a lze předpokládat jeho inkorporaci v následující třetí revizi. S ohledem na molekulárně genetickou subklasifikaci odlišující prognostické podskupiny, byla prokázána souvislost prognostické subklasifikace s genovými a chromozomovými změnami (6). Bylo potvrzeno, že translokace BCL2 (7), mutace BCL6 (8, 9) a mutace EZH2 (10) jsou spojené s GCB podskupinou, zatímco BCL6 translokace, amplifikace BCL2 lokusu na 18q24 (11) a mutace v NF-κB (CARD11, TNFAIP3/A20) (12) umožňuje odlišit ABC podskupinu. Hlavními rozdíly mezi těmito dvěma podskupinami jsou genetické změny, vedoucí ke konstitutivní aktivaci signální dráhy NF-κB a narušení terminální B-buněčné diferenciace cestou inaktivace genu BLIMP1, což je popsáno u ABC podskupiny, zatím co u GCB podskupiny tato inaktivace pozorována není.
BLIMP1/PRDM1 (B lymphocyte–induced maturation protein 1/PR domain containing 1 with zinc finger domain) je tumor supresorový gen s funkcí transkripčního represoru, který je lokalizovaný na dlouhých ramenech chromozomu 6 v pruhu q21 a tato oblast je často deletována u agresivních lymfomů. Objevuje se někdy jako samostatná aberace v době stanovení diagnózy a je spojován s nepříznivou prognózou (13). BLIMP1 je specificky exprimován u plazmatických buněk a v subsetu GC buněk, vývojově intermediárních mezi centrocytem a plazmatickou buňkou (14) a je nezbytný pro terminální diferenciaci GC buněk do plazmocytů, což je podporováno blokováním exprese genů zapojených do B buněčné proliferace a signální dráhy B buněčného receptoru (BCR). Genetické změny, mutace a delece BLIMP1 jsou pozorovány asi u 24% nemocných s ABC subtypem (15). Studie exprese genu BLIPM1 u ABC-DLBCL ukázaly, že až 77 % případů neexprimuje BLIMP1 protein, a že tento stav může být způsoben jiným mechanismem než jsou mutace (16). Ani detailní analýzy BLIMP1 nebo IRF4 genu nepřinesly jednoznačné vysvětlení, jakým mechanismem tyto změny přispívají k lymfomagenezi (16).
Se současným pokrokem v léčbě DLBCL je stále více významné určení, kteří pacienti budou profitovat ze standardní terapie, a které je nutné zařadit do nové léčby nebo klinických studií.
Lossos a spolupracovníci (18) ukázali, že složitý model čipové technologie (2) pro prognostickou stratifikaci lze nahradit určením exprese vybraných genů i nezávisle na ABC, GCB a PMBCL klasifikaci. Autoři potvrdili, že určení exprese celkem 6 genů (LMO2, BCL6, FN1, CCND2, SCYA3 a BCL2) je dostačující pro stratifikaci a rozdělení nemocných do nízce nebo vysoce rizikové podskupiny. Pro tyto geny určil pomocí Coxova modelu proporcionálních rizik tzv. „prediktivní skóre“. Malumbres se spolupracovníky (19) později prokázali částečnou využitelnost tohoto prediktivního skóre i pro RNA izolovanou z formalinem fixovaných parafínových bločků (FFPE).
Cílem naší pilotní práce bylo ověření možnosti izolace RNA z archivovaných FFPE bločků a její využití pro stanovení exprese vybraných genů a nálezy pozorované relativní exprese doplnit klinickými a molekulárně cytogenetickými výsledky.
MATERIÁL A METODY
Soubor pacientů
Pro analýzu bylo retrospektivně vybráno 10 nemocných (4 ženy a 6 mužů) s diagnózou DLBCL, z nichž dva byli následně vyřazeni pro nedostatečné množství vstupního materiálu nebo nepoužitelná data. Ve zbylém souboru 8 nemocných (4 ženy a 4 muži) byla diagnóza DLBCL určena u 7 z nich, jeden nemocný měl Burkittův lymfom (BL) a zůstal zařazen v souboru jako kontrola reprodukovatelnosti, protože od něj byly k dispozici dva rozdílné FFPE bločky. Medián věku 7 nemocných v souboru byl 37 roků. Medián celkového přežití (OS) nemocných byl 30 měsíců (rozmezí 3 - 109 měsíců). Dva nemocní zemřeli za 3 a 5 měsíců od diagnózy.
Pro analýzu byl použit archivovaný materiál z doby diagnózy nemocných, délka archivace byla 2 - 8 let. Klasifikace DLBCL NOS byla provedena dle WHO (2001, 2008). Na základě IHC vyšetření dle „Hans classifier“ (4 nemocní), byli nemocní rozděleni do podskupin: GCB-like, nonGCB-like a primární mediastinální lymfom (PMBCL) na základě imunohistochemického profilu, topografických a typických morfologických rysů dle WHO (2001, 2008) (tab.1). Všichni pacienti podepsali informovaný souhlas schválený etickou komisí FN Olomouc a vyšetření materiálu nemocných probíhala v souladu s Helsinskou deklarací z roku 1975, ve znění revize z roku 1983.
Expresní analýza pomocí qRT-PCR
Z jedenácti retrospektivně získaných formalínem-fixovaných parafínových tkáňových bločků (od jednoho pacienta byly k dispozici dva různé bločky) byla izolována RNA pomocí pomocí kitu RecoverAll Total Nucleic Acid Isolation Kit for FFPE (Life Technologies). Podle plochy tkáně bylo použito 3 – 8 řezů o síle 10 µm. Původní objem eluátu byl zkoncentrován na 15 µl na vakuové odparce (37 °C/85 min). RNA byla následně ošetřena kitem TURBO DNA-free (Life Technologies). Jako kalibrační kontrola pro qRT-PCR sloužily dvě standardizované lidské RNA, QPCR Human Reference Total RNA a MVP Total RNA, Human Raji Cells (Stratagene). Jeden mikrogram RNA z FFPE bločků (u dvou vzorků s nedostatečnou koncentrací pouze 500 a 680 ng) a kontrolní RNA byly následně přepsány do cDNA pomocí Transcriptor First Strand cDNA Synthesis Kit (Roche) využitím protokolu používajícím random hexamer primery, cDNA byla následně dvakrát naředěna pro získání dostatečného objemu. Pro subtypizaci bylo využito šest expresních assayí podle článku Lossose a spolupracovníků (17), geny LMO2 (Assay ID: Hs00153473_m1), BCL6 (Assay ID: Hs00277037_m1), FN1 (Assay ID: Hs01549976_m1), CCND2 (Assay ID: Hs00277041_m1), SCYA3 (Assay ID: Hs00234142_m1) a BCL2 (Assay ID: Hs00608023_m1) a referenční gen PGK1 (Assay ID: Hs00943178_g1), všechny TaqMan Gene Expression Assays (Life Technologies). Prediktivní skóre bylo vypočítáno podle publikovaného vzorce: „prediktivní skóre“ = (-0,0273 x LMO2) + (-0,2103 x BCL6) + (-0,1878 x FN1) + (0,0346 x CCND2) + (0,1888 x SCYA3) + (0,5527 x BCL2). U všech genů byly dosazeny hodnoty relativní exprese vůči kalibrační kontrole, kterou byla MVP Total RNA, Human Raji Cells pro geny LMO2, BCL6, SCYA3 a BCL2 a QPCR Human Reference Total RNA pro geny FN1 a CCND2 (17). Na základě doporučení Malumbrese a spolupracovníků (18) bylo naměřené prediktivní skóre pro vzorky z FFPE rozděleno podle mediánu pouze na „nízké“ a „vysoké“ riziko. Dále byla sledována exprese genu BLIMP1 (Assay ID: Hs00153357_m1, TaqMan Gene Expression Assays, Life Technologies), který byl rovněž normalizován k PGK1, u nějž byla jako kalibrační kontrola použita QPCR Human Reference Total RNA. qRT-PCR byla provedena na přístroji LightCycler 480 s použitím kitu LightCycler 480 Probes Master (Roche) podle doporučeného postupu.
Imunohistochemické barvení
Z retrospektivně získaných tkáňových FFPE bločků byly provedeny tkáňové řezy s tloušťkou 5 µm a zamontovány po aplikaci níže uvedených imunohistochemických metod na skla s pozitivním nábojem. Po obnovení antigenicity byla provedena metoda nepřímé imunohistochemie s použitím komerčně dostupných primárních protilátek: anti-CD20, anti-CD30, anti-Bcl-2, anti-Bcl-6, anti-MUM1/IRF4, anti-Ki67 (Dako, Glostrup, Denmark), anti-CD10 (Novocastra Laboratories, Newcastle, UK), anti-p50, anti-p52 (Cell Signaling, Danvers, USA) a anti-p65 (Santa Cruz Biotechnology, Dallas, USA). Sekundární protilátky byly použity pro vizualizaci standardní technikou avidin-biotin (ABC). Diagnostické IHC znaky byly stanoveny dle WHO (2008). Sledovaná pozitivita v procentech dle „Hans classifier“ (5) byla použita pro stanovení GCB a nonGCB-like podskupiny příslušného DLBCL, pro diagnostiku PMBCL byl použit známý IHC profil dle WHO (2001, 2008) (tab. 1).
Tab. 1. Výsledky relativní exprese, IHC subtypizace a nálezy FISH. 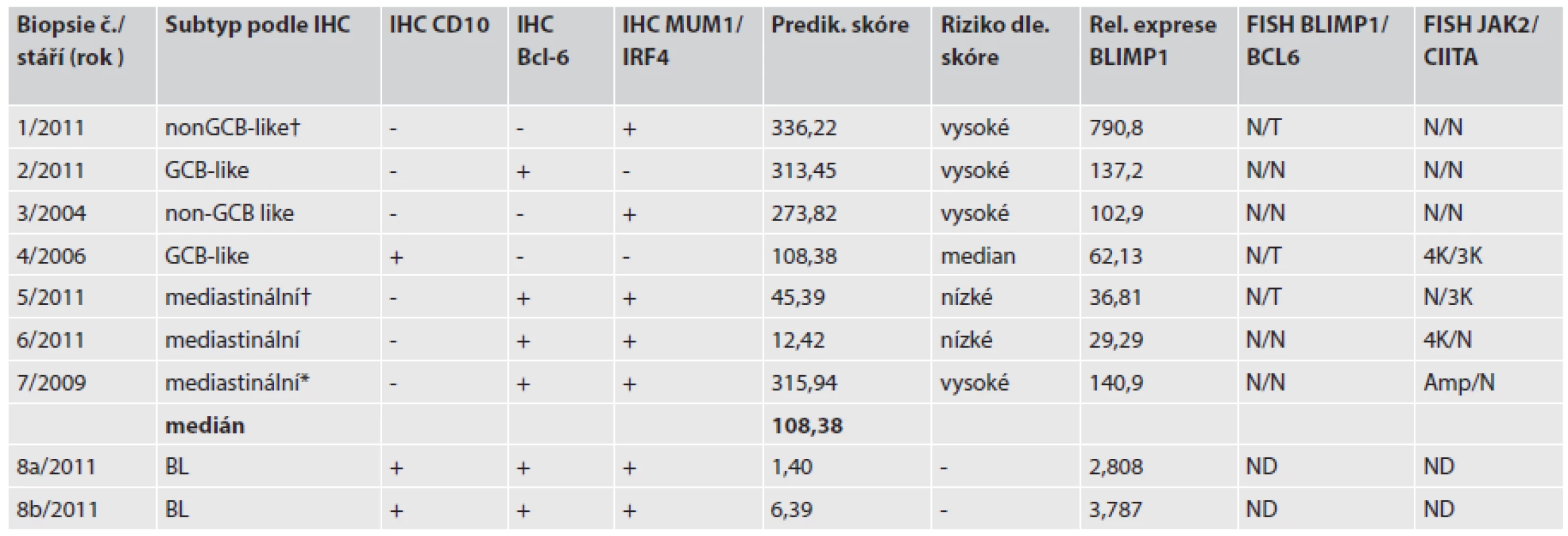
† úmrtí pacienta , * pacient po autologní transplantaci periferních krvetvorných buněk IHC, imunohistochenické barvení FISH, fluorescenční in situ hybridizace N, normální nález; T,translokace; ND,vyšetření neprovedeno; Amp, amplifikace genu; K, kopie genu Fluorescenční in situ hybridizace (FISH)
Všichni nemocní byli vyšetřeni metodou FISH s lokus specifickými sondami pro detekci změn genů BCL6, BCL2, CIITA, BLIMP1 a JAK2 (Abbott Molecular, Illinois, USA; Kreatech Diagnostics, Amsterdam, Netherlands; BlueGnome, Cambridge, UK). Hybridizace byla provedena standardním způsobem podle doporučení výrobce sond. Na parafínových řezech bylo hodnoceno nejméně 50 jader, a sledován byl normální nález nebo změny počtu kopií sledovaných genů (tab. 1).
VÝSLEDKY
Expresní analýzu bylo možné provést u 9 vzorků u 8 nemocných (jeden vzorek byl před analýzou vyřazen pro nepoužitelná data). U nemocného s BL byly vyšetřeny dva různé FFPE bločky a byly použity jako kontrola reprodukovatelnosti (vzorek 8a, 8b/2011). Výsledky relativní exprese, IHC subtypizace a nálezy ve FISH jsou uvedeny v tabulce č.1.
Po izolaci RNA se naměřená koncentrace pohybovala v rozsahu 5,7 až 778 ng/µl (v objemu 60 µl). Pro další analýzu mělo význam použít pouze vzorky s celkovým výtěžkem nad 500 ng, proto jsme vyřadili vzorek s nejnižší koncentrací (č. 10). Po zakoncentrování na 15 µl a ošetření DNázou byla koncentrace RNA opět změřena a pohybovala se v rozmezí 49,6 až 775 ng/µl. Při použití maximálního možného objemu pro reverzní transkripci (RT) (10 µl) bylo možné použít 1 µg RNA u většiny vzorků, pouze u dvou bylo množství použité pro RT 500 ng (vzorek č. 9, následně vyřazen pro nepoužitelná data) a 680 ng (vzorek č. 4)(tab.2).
Ze šesti genů dle Lossose a spolupracovníků (17) bylo vypočítáno „prediktivní skóre“ a následně rozdělením podle mediánu souboru byly naměřené hodnoty zařazeny do skupiny vysokého nebo nízkého rizika. U nemocného č. 8 tyto hodnoty nebyly aplikovatelné. Samostatně jsou uvedeny hodnoty relativní exprese BLIMP1 ve srovnání s referenční lidskou RNA (tab. 1).
Celkem 4 nemocní byli podle prediktivního skóre zařazeni do vysoce rizikové podskupiny. Z této podskupiny zemřel jeden pacient za 3 měsíce od diagnózy. Ostatní 3 nemocní žijí 27, 50 a 109 měsíců od diagnózy. Všichni byli léčeni chemoterapií, ve které byla zařazena MabThera, pacientka s PMBCL s nejdelším přežitím 109 měsíců podstoupila vysocedávkovanou chemoterapii s transplantací autologních periferních krvetvorných buněk. Nízké riziko bylo vypočítáno pro 2 nemocné s diagnózou PMBCL, tedy kategorii s celkovým lepším přežíváním. Jeden pacient však zemřel s celkovou dobou přežívání 5 měsíců. Hodnocení vypočítaného prediktivního skóre neukazuje vztah k celkovému přežívání ani k IPI pacientů.
Výsledky exprese genu BLIMP1 byly velmi variabilní, ve vysoce rizikové skupině v hodnotách stovek násobků, zatímco u nízce rizikové skupiny byly hodnoty desítkové. U žádného z analyzovaných vzorků pacientů nebyla určena přestavba nebo početní změny genu BLIMP1 metodou FISH. Metoda FISH pro vybrané geny odhalila amplifikace a zmnožení genu JAK2 u celkem 3 pacientů, u dvou s potvrzenou diagnosou PMBCL.
DISKUZE
DLBCL je heterogenní typ nehodgkinského lymfomu (NHL) s velkou biologickou i klinickou variabilitou. Existuje celá řada experimentálních modelů molekulární stratifikace DLBCL s tím, že vykazují rozdíly v užitých technologiích i algoritmem konstrukce prediktivního modelu. Proto každý experimentální model takovéto stratifikace musí být validován na nezávislé kohortě pacientů k průkazu obecné platnosti a použitelnosti v praxi. Genové expresní čipové technologie, doporučené pro prognostickou stratifikaci nemocných s DLBCL, nejsou v současné době běžně dostupné v praxi klinického molekulárního biologa, proto jsou hledány dostupnější metody stanovení exprese jednotlivých klíčových genů, jejich použití ve stratifikaci skupin pacientů, kteří mohou profitovat z cílenějších postupů prognosticky a terapeuticky. Cílem naší pilotní studie bylo provést izolaci RNA z archivovaných bločků a ověřit její kvalitu i na expresní analýze šesti cílených genů, uváděných v literatuře jako prognosticky prediktivní geny. Lossos a spolupracovníci na základě měření kvantity exprese šesti genů určili prediktivní skóre a podle něj nemocné rozdělili do skupiny s nízkým rizikem, středním a vysokým rizikem (18). Cílem naší pilotní studie nebylo určit vlastní prediktivní hodnotu relativní exprese, ale zjistit, zda lze vůbec pro tyto účely využít archivovaný materiál z FFPE. V důsledku formalínové fixace tkáně a způsobu následné izolace totiž dochází k fragmentaci nukleových kyselin na úseky cca 100 - 200 bp. Výběrem expresních assayí, jejichž délka je menší než 100 bp je teoreticky možné měřit reprodukovatelně expresi i z tohoto typu materiálu. Naše výsledky ukázaly, že prvním problémem může být nedostatečné množství tkáně v bločku. V jednom případě byl zalitý objem tkáně tak malý, že ani větší množství řezů nezajistilo dostatečnou koncentraci RNA pro přepis do cDNA. Vzhledem k omezením použitého RT kitu (možnost použít maximálně 10 µl RNA) a toho, že kolonkové metody izolace z FFPE bločků používají pro nejvyšší výtěžek velký eluční objem (v našem případě 60 µl) a tedy je výsledná koncentrace velmi nízká, RNA bylo nutné zakoncentrovat tak, aby se co nejvíce z celkového výtěžku dalo použít pro přepis. RNA pocházející z FFPE je však více fragmentovaná než bývá RNA izolovaná z čerstvých tkání, a její kvalita proto nemusí být dostatečná pro qRT‑PCR analýzu. Při srovnání s prahovými cykly (Ct) referenčních RNA, vycházely u vzorků z FFPE obecně výrazně vyšší hodnoty (data neuvedena). U dvou vzorků jsme snížili množství RNA použité pro přepis na 500 a 680 ng, protože nebylo možné získat z izolace alespoň 1 µg. První ze zmíněných vzorků bylo nutné z následujících analýz vyřadit, protože u některých z šesti sledovaných genů nebylo možné získat měřitelné hodnoty relativní exprese (tab 2). Z výsledků vyplývá, že použití množství menšího než 1 µg snižuje šanci na získání použitelných dat.
Tab. 2. Tabulka koncentrací RNA před zakoncentrováním, jednotlivé hodnoty relativní exprese šesti sledovaných genů. 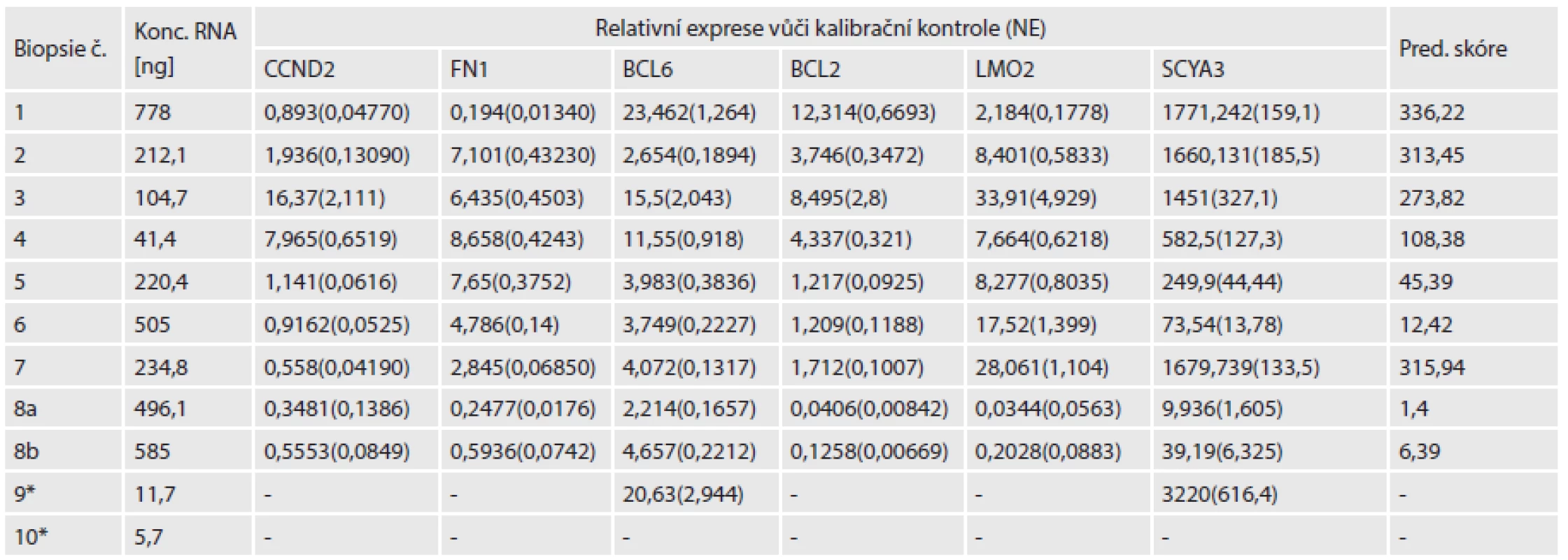
* - Vzorek byl následně vyřazen. NE - normalizovaná chyba Do analýzy jsme zařadili i měření relativní exprese genu BLIMP1, ale ani u exprese tohoto genu se nám korelace s klinickými daty nebo výsledky IHC nebo FISH nepodařilo určit. Určením exprese jsme pouze ověřili, že i stanovení relativní abundance tohoto genu z FFPE bločků je možné, při použití krátké detekční assaye.
Dva různé bločky jednoho a téhož pacienta s BL sloužily jako interní kontrola reprodukovatelnosti assayí. Hodnoty jak prediktivního skóre, tak relativní exprese genu BLIMP1 byly u obou těchto dvou vzorků poměrně blízké, pokud vezmeme v úvahu, že šlo o rozdílný primární materiál (tab 1).
Variabilita prediktivního skóre byla u celého souboru podle očekávání velmi vysoká. Lossos a spolupracovníci prokázali (18), že při použití čerstvě zamražené tkáně, je možné rozdělit pacienty do tří rizikových skupin na základě číselného rozmezí prediktivního skóre. Naše výsledky z PPFE byly stejně jako v následné studii využívající stejný materiál (19), rozděleny pouze podle mediánu měřené sady. Dá se předpokládat, že skóre vypočítané z FFPE vzorků bude silně záviset na konkrétní použité izolační metodě, proto se dají vzorky porovnávat pouze vzájemně v rámci sady (tedy pomocí mediánu). U našeho malého souboru je toto rozdělení značně nepřesné, mezi prediktivním skóre obou skupin však byly relativně velké rozdíly, takže se dá předpokládat, že rozdělení do rizikových skupin by se příliš nezměnilo ani v případě většího souboru. Přestože do pilotního souboru byly vybrány bločky z rozmezí osmi let (rok 2004 až 2011) nebyly pozorovány rozdíly v kvalitě v závislosti na stáří vzorku, hlavním omezením tak zůstává získání dostatečného množství RNA (které je vzhledem k její kvalitě potřeba více, než u čerstvě izolované RNA), aby bylo možné pro přepis do cDNA použít alespoň 1 µg. Problémy při získání dostatečně koncentrované a kvalitní RNA by bylo možné obejít rozšířením čerstvého zamražování nebo stabilizace (RNAlater, QIAGEN) tkání odebíraných při biopsiích, i hodnoty prediktivního skóre podle Lossose a spolupracovníků, se pak dají mnohem přesněji zařadit do tří rizikových skupin, podle číselné hodnoty a nejen podle mediánu (18).
ZÁVĚR
Naše pilotní studie ukázala, že izolace RNA z většiny vzorků fixovaného v FFPE bločcích bylo možné úspěšně provést i pro potřeby měření expresního profilu, i když tato data vykazují značnou variabilitu ve srovnání s čerstvě zamraženými vzorky. Pro přesnější určení prediktivního skóre, ale bude jednoznačně lepší variantou použít vzorky biopsií zamražené ihned v tekutém dusíku nebo stabilizované v RNAlater, protože kvalita RNA je klíčovým faktorem pro jakákoliv měření exprese genů. V naší malé studii nebylo cílem určit zda naměřené hodnoty prediktivního skóre mají prognostický význam, protože se jednalo o pilotní studii s limitovaným počtem vzorků. Potvrdili jsme, že je možné úspěšně naměřit expresní profil i u FFPE vzorku starého až 8 let.
PODĚKOVÁNÍ
Práce byla podpořena grantem Interní grantové agentury Ministerstva zdravotnictví České republiky č. IGA NT 11103-4 a grantem LF UP 2013-004.
Adresa pro korespondenci:
Prof. RNDr. Mgr. Jarošová Marie, CSc.,
Hemato-onkologická klinika FN a LF UP Olomouc
Hněvotínská 3, 77515 Olomouc
Tel: +420585632876 / Fax:+420588442517
marie.jarosova@fnol.cz
Zdroje
1. Jaffe ES, Harris NL, Stein H, Vardiman JW, eds. Pathology and Genetics of Tumours Haematopoietic and Lymphoid Tissues. World Health Organization Classification of Tumours. Lyon, France: IARC Press; 2008.
2. Alizadeh AA, Eisen MB, Davis RE, et al. Distinct types of diffuse large B-cell lymphoma identified by gene expression profiling. Nature 2000; 403 : 503-511.
3. Rosenwald A, et al. The use of molecular profiling to predict survival after chemotherapy for difuse large-B-cell lymphoma. N Engl J Med. 2002; 346 : 1937–1947.
4. Hans CP, Weisenburger DD, Greiner TC, et al. Confirmation of the molecular classification of diffuse large B-cell lymphoma by immunohistochemistry using a tissue microarray. Blood 2004; 103 : 275-282.
5. Choi WW, Weisenburger DD, Greiner TC, et al. A new immunostain algorithm classifies diffuse large B-cell lymphoma into molecular subtypes with high accuracy. Clin Cancer Res. 2009; 15 : 5494-502.
6. Lenz G, et al. Molecular subtypes of diffuse large B-cell lymphoma arise by distinct genetic pathways. Proc Natl Acad Sci U S A. 2008; 105 : 13520–13525.
7. Huang JZ, Sanger GW, Greiner TC, et al. The t(14;18) defines a unique subset of diffuse large B-cell lymphoma with a germinal center B-cell gene expression profile. Blood 2002; 99 : 2285-2290.
8. Iqbal J, Greiner TC, Patel K, et al. Distinctive patterns of BCL6 molecular alterations and their functional consequences in different subgroups of diffuse large B-cell lymphoma. Leukemia 2007; 21 : 2332-2343.
9. Pasqualucci L, Migliazza A, Basso K, et al. Mutations of the BCL6 proto-oncogene disrupt its negative autoregulation in diffuse large B-cell lymphoma. Blood. 2003; 101 : 2914-23.
10. Morin RD, Johnson NA, Severson TM, et al. Somatic mutations altering EZH2 (Tyr641) in follicular and diffuse large B cell lymphomas of germinal-center origin. Nat Genet 2010; 42 : 181–185.
11. Ye BH., Lista F, Lo Coco F, et al. Alterations of a zinc finger-encoding gene, BCL-6, in diffuse large-cell lymphoma. Science 1993; 262 : 747-750.
12. Iqbal J, Sanger WG, Horsman DE, et al. BCL2 translocation defines a unique tumor subset within the germinal center B cell-like diffuse large B cell lymphoma. Am J Pathol 2004; 165 : 159–166.
13. Compagno M, Lim WK, Grunn A, et al. Mutations of multiple genes cause deregulation of NF-kappaB in diffuse large B cell lymphoma. Nature 2009; 459 : 717–721.
14. Cattoretti G, Angelin-Duclos C, Shaknovich R, et al. PRDM1/Blimp-1 is expressed in human B-lymphocytes committed to the plasma cell lineage. J Pathol 2000; 5206 : 76–86.
15. Angelin-Duclos C, Cattoretti G, Lin KI, Calame K. Commitment of B lymphocytes to a plasma cell fate is associated with Blimp-1 expression in vivo. J Immunol 2000; 165 : 5462-71.
16. Maldelbraum J, Bhagat G, Tang H, et al. BLIMP1 is a tumor suppressor gene frequently disrupted inactivated B cell like diffuse large B cell lymphoma. Cancer Cell 2010; 18 : 568–579.
17. Pasqualucci L, Compagno M, Houldsworth J, et al. Inactivation of the PRDM1/BLIMP1 gene in diffuse large B cell lymphoma. JEM 2006; 203 : 311-317.
18. Lossos IS, Czerwinski DK, Alizadeh AA, et al. Prediction of survival in diffuse large-B-cell lymphoma based on the expression of six genes. NEJM 2004; 350 : 1828-37
19. Malumbres R, Chen J, Tibshirani R. et al. Paraffin-based 6-gene model predicts outcome in diffuse large B-cell lymphoma patients treated with R-CHOP. Blood 2008; 111 : 5509-14.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článok vyšiel v časopiseČesko-slovenská patologie

2014 Číslo 2-
Všetky články tohto čísla
- Současný staging zhoubných nádorů děložního těla a jeho význam pro klinickou praxi
- Pokroky v aplikované molekulární patologii a prediktivní diagnostice (1.)
- Je třeba hájit zájmy patologie!
- MONITOR aneb nemělo by vám uniknout, že...
- WHO classification of tumours of soft tissue and bone 2013: the main changes compared to the 3rd edition
- Molekulární patologie plicních karcinomů
- Gastrointestinální stromální tumor (GIST): pokroky do roku 2013
- Doc. MUDr. Ľudovít Lauko, CSc. sedemdesiatročný.
- Hereditární karcinomy štítné žlázy a jejich molekulární diagnostika
- Kde končí a začíná diagnóza Ewingova sarkomu - popis dvou neobvyklých kostních nádorů s translokací t(20;22)(EWSR1-NFATc2)
- Epidermolytická hyperkeratóza vulvy asociovaná s bazocelulárním karcinomem u pacientky s vaginálním condyloma acuminatum a vaginální intraepiteliální neoplazií infikovanými HPV typu 42
- Využití archivovaných parafínových bločků s formalinem fixovanou tkání (FFPE) pro molekulárně genetickou analýzu u difuzního velkobuněčného lymfomu (DLBCL)
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- WHO classification of tumours of soft tissue and bone 2013: the main changes compared to the 3rd edition
- Kde končí a začíná diagnóza Ewingova sarkomu - popis dvou neobvyklých kostních nádorů s translokací t(20;22)(EWSR1-NFATc2)
- Současný staging zhoubných nádorů děložního těla a jeho význam pro klinickou praxi
- Epidermolytická hyperkeratóza vulvy asociovaná s bazocelulárním karcinomem u pacientky s vaginálním condyloma acuminatum a vaginální intraepiteliální neoplazií infikovanými HPV typu 42
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



