-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Humorální rejekce a aktualizace Banffské klasifikace 2013
Antibody-mediated rejection of renal allograft and the update Banff classification 2013
The view on the role of donor-specific antibodies in organ transplantation has been changed during the last several decades. Today, it is considered that the majority of cases of the late renal allograft dysfunction and loss are caused by the presence of donor-specific antibodies to HLA antigens. The real breakthrough in the diagnosis of antibody-mediated rejection was represented by the discovery of C4d, which enabled the determination of the diagnostic criteria of acute and later chronic antibody-mediated rejection. Although detection of C4d has been the cornerstone in the diagnosis of antibody-mediated rejection for over 10 years, it has become clear that some cases with similar morphological and clinical features do not have detectable C4d.
Outcomes of key studies concerning presence of donor specific antibodies and morphological features in the graft biopsy samples resulted in the modification of Banff classification of 2013, which includes integrating C4d negative antibody-mediated rejection and also that acute vascular rejection (v1, v2) can be a part of the antibody-mediated rejection.Keywords:
kidney allograft – antibody-mediated rejection – T-cell mediated rejection
Autori: Eva Honsová
Pôsobisko autorov: Pracoviště klinické a transplantační patologie, Transplantcentrum IKEM
Vyšlo v časopise: Čes.-slov. Patol., 51, 2015, No. 3, p. 116-119
Kategória: Přehledový článek
Súhrn
V posledních dekádách se změnil pohled na roli protilátek v oblasti orgánových transplantací. Dnes je obecný souhlas s tím, že přítomnost protilátek proti antigenům dárce představuje nejdůležitější příčinu dysfunkce a ztráty štěpů ledvin. Skutečným přelomem v diagnostice protilátkami zprostředkované rejekce byl objev C4d, který umožnil stanovení diagnostických kritérií akutní a posléze i chronické protilátkami zprostředkované rejekce. Ačkoli detekce C4d byla základem diagnostiky protilátkami zprostředkované rejekce po více než 10 let, v poslední době bylo stále jasnější, že některé případy s podobnou morfologií i klinikou nemají detekovatelné C4d.
Výsledky experimentálních prací a studií v humánní transplantologii vyústily v modifikaci Banffské klasifikace z roku 2013, která zahrnuje začlenění C4d negativní protilátkami zprostředkované rejekce a také to, že akutní vaskulární rejekce (v1,v2) může být součástí protilátkami zprostředkované rejekce.Klíčová slova:
štěp ledviny – tubulo-intersticiální rejekce – T-buňkami zprostředkovaná rejekce
Rozvoj znalostí a kroky, podle kterých se postupně tvořila diagnostická kriteria rejekce, zahrnují historii více než 50 let. Celý příběh začíná během 2. světové války v Anglii, kde mezi obyvateli bombardovaných měst a také mezi posádkami bojových letadel bylo velké množství lidí s popáleninami kůže. Proto britská vláda hledala nějaký způsob jak pomoci obětem těchto mutilujících zranění a Komise pro válečná poranění a British Medical Council pověřili mladého zoologa Petera Medawara, aby se pokusil vyřešit problém špatného přežívání kožních štěpů. Peter Medawar začal pracovat spolu Dr. Thomasem Gibsonem na popáleninové jednotce v Glasgow. Posléze se vrátil na universitu do Oxfordu, kde v experimentu potvrdil, že rejekce/odmítnutí kožního štěpu je způsobeno imunitní reakcí. Aby verifikoval poškození tkáně, používal stejně jako my histopatologii. V preparátech pokusných zvířat snadno identifikoval buňky, které poškozovaly struktury původní tkáně. Na těchto základech formuloval tzv. buněčnou teorii rejekce. Je obdivuhodné, že v době, kdy se neznaly typy lymfocytů, nevědělo se, na co je thymus, ani se neznaly protilátky, dokázal někdo postavit teorii, podle které se na problém rejekce mnoho patologů a kliniků dívá dodnes. Protilátky nejsou na sklech vidět a ani současnými technikami nejsou v histopatologii detekovány. To je důvod, proč celulární teorie dominovala transplantační medicíně po více než 40 let. Nejde jen o akademickou otázku, ale především o pohled na léčbu, která se po celou tuto dobu koncentrovala na potlačení celulární části imunitní odpovědi. Naštěstí pro pacienty, potlačení T lymfocytů naruší spolupráci s dalšími složkami imunitní odpovědi, především diferenciaci a proliferaci B buněk a tím dojde sekundárně (a musíme říct, že z počátku i nevědomky) k omezení protilátkové odpovědi.
Od počátků transplantační medicíny byla známá varianta humorální (protilátkami zprostředkované) rejekce ve své hyperakutní podobě. Jde o stav, kdy protilátky proti dárci existují v séru příjemce ještě před transplantací a po obnovení krevního proudu, obvykle ještě před očima chirurga dojde k dramatické destrukci štěpu. Prvním místem setkání antigenů dárce a séra příjemce s protilátkami je endotel a endotel se svými antigeny představuje také cílovou strukturu, proti které je vedena protilátkami zprostředkovaná reakce. Rozvoj těžkého poškození endotelu je následován vznikem trombóz. Trombózy jsou v arteriích, protože tam teče krev nejdřív a vzhledem k tomu, že ledvina nemá kolaterály, dojde za trombózami k rozsáhlým nekrózám tkáně. Díky rozvoji v oblasti imunologických/imunogenetických metod detekce protilátek, tento katastrofický typ rejekce z praxe téměř vymizel a byl vyřazen z Banffské klasifikace (1).
Jiné fenotypy humorální rejekce nebyly až do konce 90. let minulého století definované, protože nebyl znám žádný jednoduchý marker průkazu protilátkami zprostředkovaného poškození. Vzhledem k tomu, že protilátky nejsou v histopatologických preparátech vidět, je diagnostika protilátkami zprostředkované rejekce mnohem komplikovanější než buněčné poškození. Vyžaduje komplexní pohled a interpretaci výsledků mnoha technik, včetně laboratorních a klinických dat. Vedle toho interpretace humorální rejekce vyžaduje také znalosti z různých oborů, zvl. imunologie a patofyziologie.
To, čím byl pro teorii celulární rejekce Peter Medawar, je pro humorální rejekci Paul Terasaki. Po 40 let publikoval prof. Terasaki data, která ukazovala, že příjemci s donor specifickými protilátkami (DSA) mají horší přežívání štěpů, než příjemci bez protilátek. Kromě toho, že neexistoval žádný marker, který by umožňoval prokazatelnou diagnostiku humorální rejekce, existoval další velký problém. Tím bylo to, že protilátky (DSA) měli totiž i příjemci s dobrou funkcí štěpu a proto přesvědčit kliniky, že nejde o epifenomém, ale o důvod pozdější dysfunkce, bylo prakticky nemožné. K rozhodujícímu zlomu došlo v 90. letech, kdy Helmut Feucht během studií komplementu přišel na to, že příjemci s pozitivním průkazem C4d v peritubulárních kapilárách mají významně horší funkci a častější ztrátu štěpu (2). To představovalo skutečný přelom v diagnostice humorální rejekce.
Význam C4d v diagnostice humorální rejekce je dán jeho postavením v komplementové kaskádě. C4d je koncovým produktem štěpení C4, který se dále neštěpí a zůstává po nějakou dobu kovalentně navázán ve tkáni. Ke štěpení C4 dochází při aktivaci klasické cesty komplementu a ta je aktivovaná protilátkami (schéma 1). Proto je pozitivní průkaz C4d znakem protilátkami-zprostředkované rejekce a představuje něco jako otisk palce, že reakce proběhla v místě pozitivního barvení. Detekce C4d může být imunofluorescenční nebo imunohistochemická (obr. 1, 2). Imunofluorescenční detekce má vyšší senzitivitu a je proto preferovaná. Protože humorální rejekce nemusí mít žádné jiné diagnostické morfologické charakteristiky, je od r. 2003 součástí diagnostického schématu doporučení, aby byl průkaz C4d proveden z každé biopsie štěpu ledviny.
Obr. 1. Imunofluorescenční detekce C4d, pozitivní průkaz v peritubulárních kapilárách (objektiv 20x). 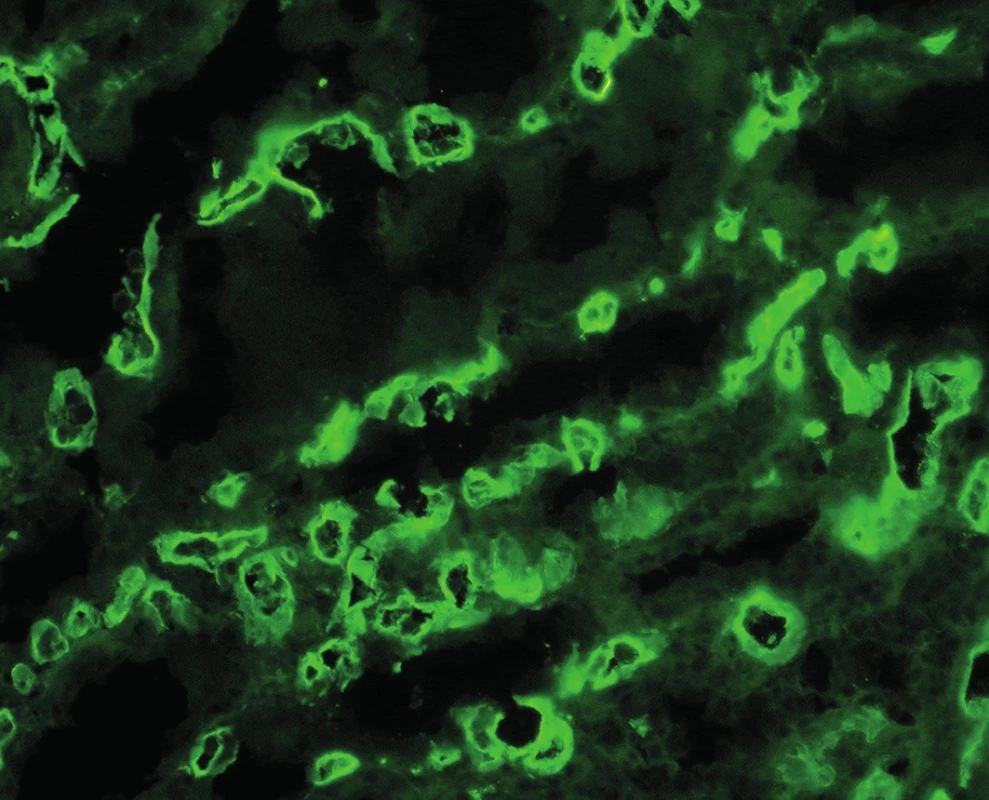
Obr. 2. Imunohistochemický průkaz C4d má nižší senzitivitu a detekce, která je v tomto průkazu fokální bývá v IF difúzní. Tomu jsou přizpůsobena i hodnotící kriteria (objektiv 20x). 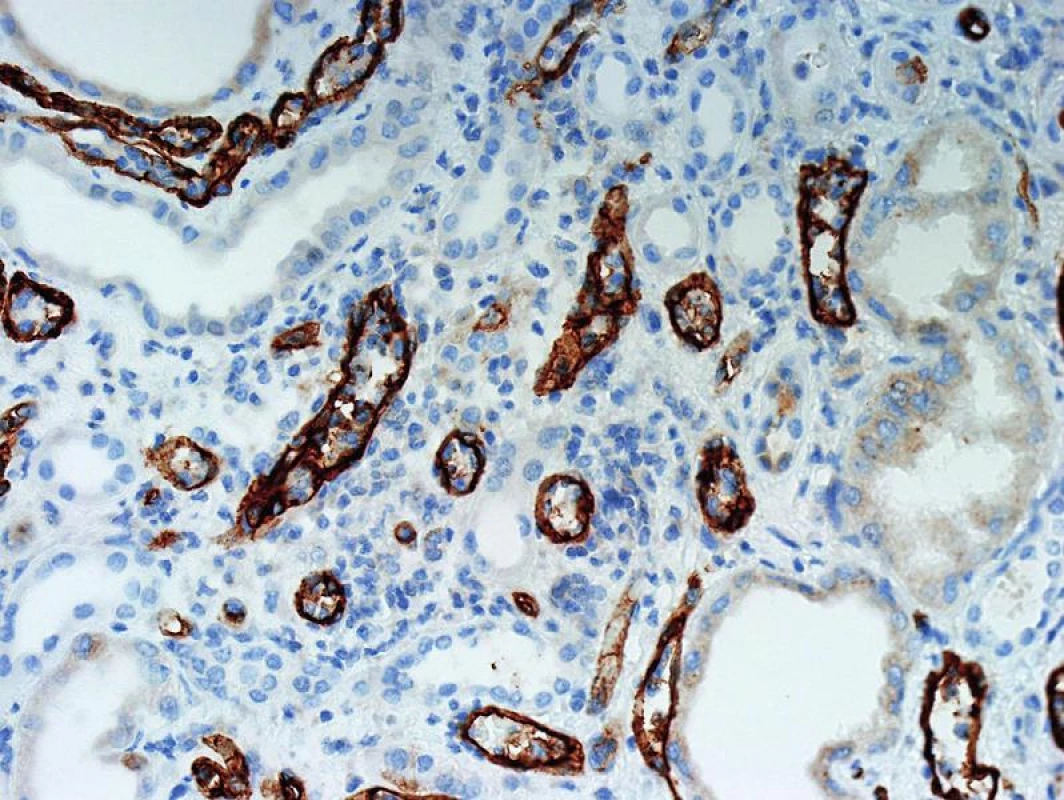
Identifikace C4d změnila pohled na klasifikaci rejekčních změn a vedle celulární T-buňkami zprostředkované rejekce, byly pozvolna vydefinovány i charakteristiky akutní a chronické humorální rejekce a tyto kategorie jsou dosud v Banffské klasifikaci. Na rozpoznání a definici chronického protilátkami způsobeného postižení se výraznou měrou podílel tým B. Colvina. Nejprve v experimentu prokázali, že v průběhu chronického poškození se nejdříve objeví protilátky v séru, pak dojde k depozici C4d ve tkáni, poté se teprve objeví morfologické znaky poškození tkáně (transplantační glomerulopatie, lamelace bazálních membrán peritubulárních kapilár i fibróza intimy arterií). Teprve na konci tohoto procesu je klinicky detekovatelná dysfunkce (3). Tyto experimenty přesvědčily většinu transplantační komunity a vedle akutní humorální rejekce, byla stanovena i kritéria pro chronickou aktivní protilátkami zprostředkovanou rejekci. Kriteria zahrnují morfologické charakteristiky dlouhodobého nebo opakovaného poškození endotelu. Jde o následující trias: transplantační glomerulopatii s dvojkonturami GBM, pozitivní průkaz C4d v peritubulárních kapilárách a současně přítomnost DSA v séru (obr. 3). V následujícím období začalo být zřejmé, že pro část příjemců se zřetelným poškozením endotelu a morfologickými znaky humorální rejekce tato kriteria nevyhovují. Již bylo známo, že depozice C4d ve tkáni má svoji dynamiku a není trvalá. Současně také protilátky v séru mají fluktuující hodnoty s významnými poklesy a nárůsty. Proto v jakémkoli období po transplantaci, C4d a protilátky mohou, ale nemusí být detekovatelné, i když tkáň poškozuje nebo poškodila humorální rejekce. Množily se tedy důkazy o tom, že C4d má v diagnostice humorální rejekce významnou, ale limitovovanou hodnotu. Jednou z průlomových prací, byla studie kanadské skupiny, která vybrala C4d negativní pacienty s morfologií transplantační glomerulopatie a molekulárně genetickými metodami prokázali, že tito příjemci mají pozitivní endotelový transkript (odpovídající poškození a aktivaci endotelu) a mají tedy C4d negativní protilátkami zprostředkovanou rejekci (4). Důvodů, proč jsou některé případy humorální rejekce C4d negativní, je mnoho. Víme, že některé protilátky komplement neaktivují (IgG2, IgG4), protilátky mohou být také deponovány ve tkáni v takovém množství, že pak mohou být pod detekčními možnostmi současných metod nebo mohou reagovat přes Fc fragment a aktivovat NK buňky a makrofágy bez aktivace komplementu. Navíc v posledních letech se ukazuje významná role non-HLA protilátek, které při reakci využívají Th17 složku imunitní odpovědi a reagují proti orgánově specifickým antigenům (jako je perclan, kolagen IV a VI nebo např. argin). Teoreticky se předpokládá, že primární inzult je jakékoli poškození tkáně se zánětem, při následné reparaci a remodelaci tkáně se odkryjí antigeny, které jsou normálně skryté. Následná tvorba protilátek fixuje zánětlivé milieu ve tkáni s přetrvávajícím poškozením.
Obr. 3. Transplantační glomerulopatie, která je výsledkem dlouhodobého poškození endotelu, na které mesangium reaguje formací druhé vnitřní bazální membrány a morfologicky se vytvoří tzv. dvojkontury GBM (šipka, PAS, objektiv 40x). 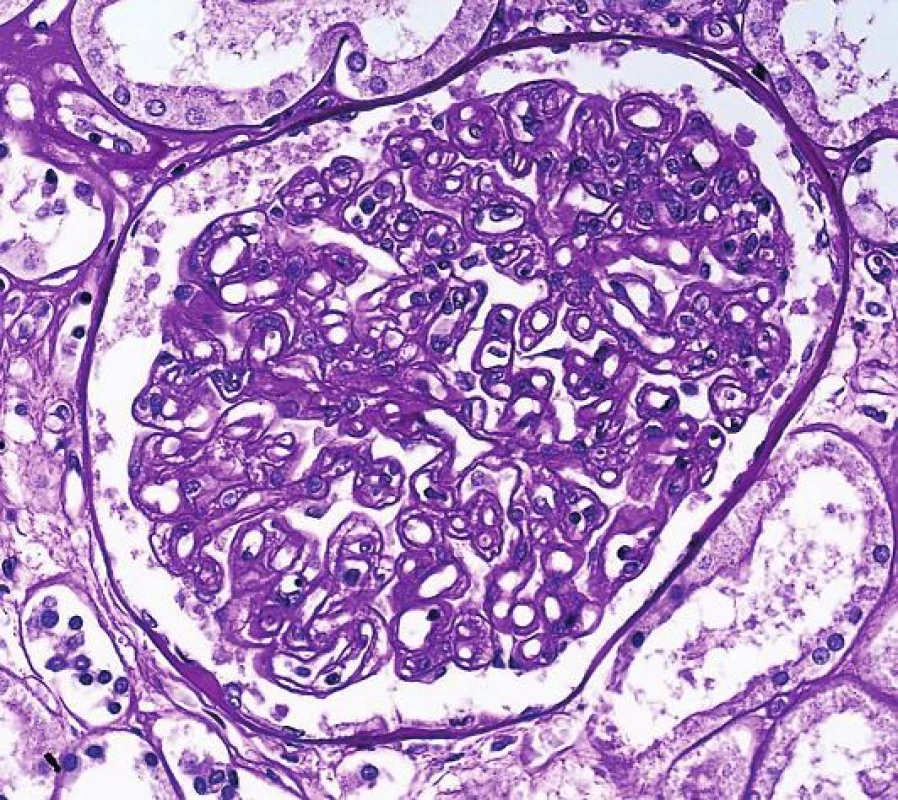
Patologové měli také problém s diagnózou chronické humorální rejekce s postižením arterií. Stejná patologie s fibrózou intimy se jednou klasifikovala jako T-buňkami zprostředkovaná rejekce, pokud byl průkaz C4d v peritubuláních kapilárách negativní (obr. 4). Anebo se stejná léze klasifikovala jako protilátkami zprostředkovaná rejekce, pokud byla detekce C4d pozitivní. Současně bylo již z 90. let minulého století dobře známo, že zvíře bez protilátek transplantační vaskulopatii není schopno vyvinout (5). Vedle toho se z praxe vědělo, že v humánní patologii část případů s akutní vaskulární/arteriální rejekcí měla pouze izolované postižení cév (bez intersticiálního zánětu). Proto se část patologů domnívala, že vaskulární rejekce bude mít humorální komponentu. V experimentu to v r. 2010 prokázal tým B. Colvina. Dokázali navodit rejekční vaskulární patologii s tzv. endotelialitidou u T deficientních myší po injikování protilátek (6). Pak už se jenom čekalo na potvrzení téhož v humánní patologii. První tým, který v r. 2013 publikoval výsledky na toto téma, byl z Francie (7). Tým D. Glotze retrospektivně analyzoval více, než 2000 biopsií od kterých měly uschovaná séra a mohli detekovat protilátky. Ukázalo se, že 71% případů s akutní vaskulární rejekcí mělo současně DSA v séru. Ve stejné skupině bylo 45% z nich C4d negativních a tyto případy byly původně klasifikovány jako celulární rejekce a podle toho byli také léčeni. Tato práce byla poslední kapkou, po které následovala téhož roku dosud poslední modifikace Banffské klasifikace (8).
Obr. 4. Transplantační vaskulopatie s fibrózou intimy a se zánětlivou celulizací tamtéž, jako součást chronické humorální rejekce (HE s elastikou, objektiv 40x). 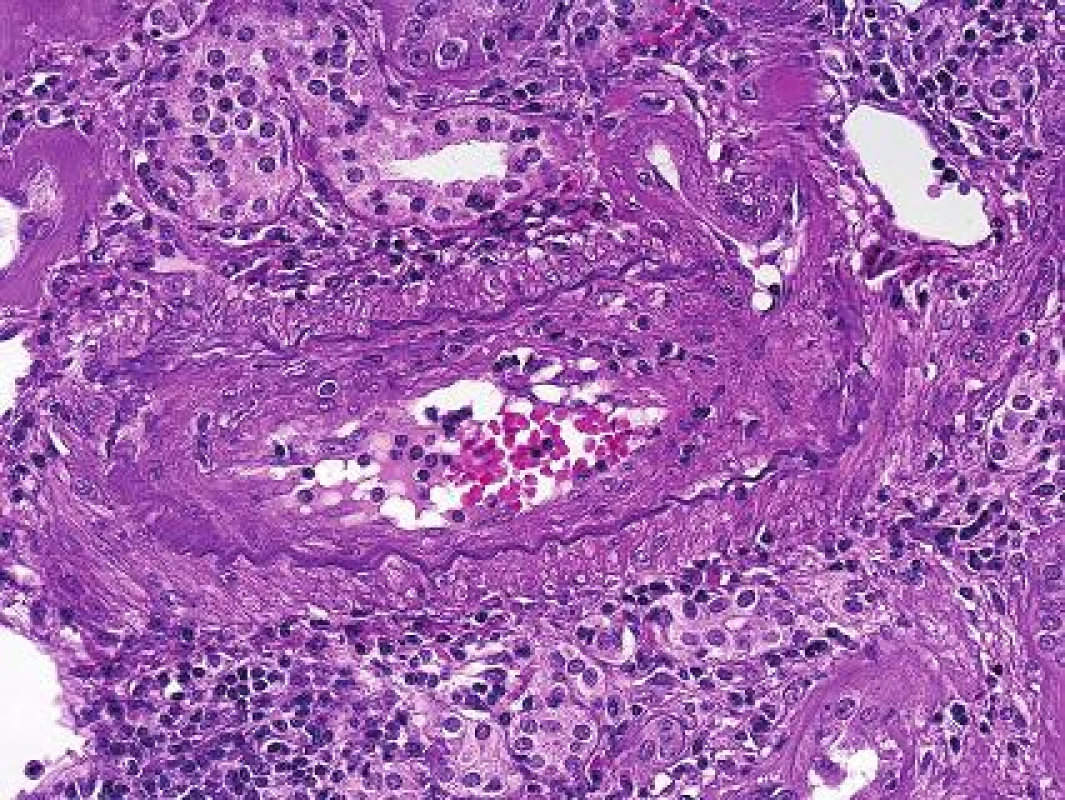
Modifikace Banffské klasifikace z roku 2013 zahrnuje začlenění C4d negativní protilátkami zprostředkované rejekce a také to, že akutní vaskulární rejekce (v1,v2) může být součástí protilátkami zprostředkované rejekce.
V popisu diagnostického postupu je uvedeno, že podle současně platné Banffské klasifikace může být akutní a chronická protilátkami zprostředkovaná rejekce diagnostikovaná i v nepřítomnosti C4d depozit. Ale v případě, že nejsou přítomna depozita C4d v peritubulárních kapilárách, musí být jasné důkazy o protilátkami způsobeném poškození. Takové důkazy mohou být buď morfologické/histopatologické nebo mohou být na molekulární úrovni. Současně bylo odsouhlaseno, že vaskulární/arteriální rejekce se zánětem pod endotelem (v1, v2) může být součástí protilátkami zprostředkované rejekce a proto by všechny případy s tímto typem patologie měly být testovány na přítomnost protilátek.
Pokud se zamyslíme nad posledními 15 lety v transplantační patologii a pokud dokážeme přemýšlet mimo dlouhou dobu definované kategorie, můžeme se vymanit z pohledu na rejekční změny, který máme od dob Petera Medawara. Všichni známe autoimunní onemocnění např. autoimunní hepatitidu (AIH). Jsme patologové a víme, že při pohledu na sklo s AIH vidíme poškození, které způsobují buňky (především T lymfocyty), přesto si jistě nikdo z nás nemyslí, že protilátky zde nehrají roli, už proto, že jejich identifikace patří mezi diagnostická kriteria. Je nepochopitelné, proč je tak obtížné dívat se stejným pohledem i na rejekci. To, že vidím na skle efektorové lymfocyty, rozhodně neznamená, že za procesem poškození nejsou protilátky.
ZÁVĚR
Chronická protilátkami zprostředkovaná rejekce stále představuje diagnostickou výzvu, protože se jednak vyvíjí pomalu a skrytě (roky), má různorodé morfologické charakteristiky (včetně C4d pozitivního nebo negativního průkazu) a také má velmi variabilní průběh. Ne všechny případy mají detekovatelné protilátky (DSA) v séru nebo C4d v biopsii v danou dobu, i když jde o protilátkami zprostředkovanou rejekci. Přes všechny tyto limity je jasné, že „de novo“ detekované DSA mohou být prvním příznakem následného poškození; a mohou se objevit podobně jako špička ledovce, kdy pod hladinou dochází ke skrytému poškození štěpu, který má dosud stabilní funkci. Výběr optimální terapie v takové situaci se specifikací protilátek podle podtříd a schopnosti aktivovat komplement bude hlavním cílem v nejbližší budoucnosti.
PODĚKOVÁNÍ
Práce byla podpořena: MZ ČR – RVO („Institut klinické a experimentální medicíny – IKEM, IČ 00023001“)
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
Doc. MUDr. Eva Honsová, Ph.D.
Pracoviště klinické a transplantační patologie
Transplantcentrum IKEM
Vídeňská 1958/9, 140 21 Praha 4
e-mail: eva.honsova@ikem.cz
Zdroje
1. Solez K, Colvin RB, Racusen LC, Haas M, et al. Banff 07 classification of renal allograft pathology: updates and future directions. Am J Transplant 2008; 8 : 753-760.
2. Feucht HE, Schneeberger H, Hillebrand G, et al. Capillary deposition of C4d comlement fragment and early renal graft loss. Kidney Int 1993; 43 : 1333-1338.
3. Nadazdin O, Boskovic S, Colvin RB, et al. Contributions of direct and indirect alloresponses to chronic rejection of kidney allografts in nonhuman primates. J Immunol 2011; 187 : 4589-4597.
4. Sis B, Halloran PF. Endothelial transcripts uncover a previously unknown phenotype: C4d-negative antibody-mediated rejection. Curr Opin Organ Transplant 2010; 15 : 42-48.
5. Russell PS, Chase CM, Winn HJ, et al. Coronary atherosclerosis in transplanted mouse hearts. II. Importance of humoral immunity. J Immunol 1994, 152 : 1535-1541.
6. Hirohashi T, Uehara S, Colvin RB, et al. Complement independent antibody-mediated endarteritis and transplant arteriopathy in mice. Am J Transplant 2010; 10(3): 510-517.
7. Lefaucheur C, Loupy A, Vernerey D, et al. Antibody-mediated vascular rejection of kidney allografts: a population-based study. Lancet 2013; 381 : 313-319.
8. Haas M, Sis B, Racusen LC, et al. Banff 2013 meeting report: inclusion of C4d-negative antibody-mediated rejection and antibody-associated arterial lesions. Am J Transplant 2014; 14 : 272-283.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článek Jaká je Vaše diagnóza?
Článok vyšiel v časopiseČesko-slovenská patologie

2015 Číslo 3-
Všetky články tohto čísla
- Transplantační patologie - I. díl
- Aby mohl patolog morfologii interpretovat, musí nejdříve tkáni rozumět
- MONITOR aneb nemělo by vám uniknout, že
- Úvod do problematiky transplantační patologie
- Specializační kurz v patologii
- Transplantace ledviny z pohledu nefrologa
- MONITOR aneb nemělo by vám uniknout, že
- Tubulo-intersticiální rejekce štěpů ledviny
- Humorální rejekce a aktualizace Banffské klasifikace 2013
- MONITOR aneb nemělo by vám uniknout, že
- Infekce po transplantaci ledviny
- “Shadow cell” diferenciácia v endometrioidných karcinómoch tela maternice. Jej častý výskyt a pozitivita na beta-katenín
- Jaká je Vaše diagnóza?
- Neuroendokrinní nádor prsu – metastáza či primární karcinom prsu? Kazuistika
- MONITOR aneb nemělo by vám uniknout, že
- Jaká je Vaše diagnóza? Odpověď
- Melanocytární matrikom - kazuistika
- Adenom pylorických žlázek: histologické, imunohistochemické a molekulárně genetické zhodnocení 23 nádorů
- MONITOR aneb nemělo by vám uniknout, že
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Adenom pylorických žlázek: histologické, imunohistochemické a molekulárně genetické zhodnocení 23 nádorů
- Infekce po transplantaci ledviny
- Úvod do problematiky transplantační patologie
- Neuroendokrinní nádor prsu – metastáza či primární karcinom prsu? Kazuistika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




