-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Novinky v molekulární diagnostice karcinomů slinných žláz: „translokační karcinomy“
New developments in molecular diagnostics of carcinomas of the salivary glands: “translocation carcinomas”
In recent years the discovery of translocations and the fusion oncogenes that they result in has changed the way diagnoses are made in salivary gland pathology. These genetic aberrations are recurrent; and at the very least serve as powerful diagnostic tools in salivary gland tumors diagnosis and classification. They also show promise as prognostic markers and hopefully as targets of therapy. In this review the 4 carcinomas currently known to harbor translocations will be discussed, namely mucoepidermoid carcinoma, adenoid cystic carcinoma, mammary analogue secretory carcinoma, and hyalinizing clear cell carcinoma. The discovery and implications of each fusion will be highlighted and how they have helped to reshape the current classification of salivary gland tumors.
Keywords:
salivary gland carcinoma – fusion oncogenes – CRTC1/3-MAML2 – MYB-NFIB – ETV6-NTRK3 – EWSR1-ATF1
Autori: Alena Skálová 1,2; Petr Šteiner 1,2; Tomáš Vaneček 2
Pôsobisko autorov: Šiklův ústav patologie, Univerzita Karlova v Praze, Lékařská fakulta v Plzni, Plzeň 1; Bioptická laboratoř, s. r. o., Plzeň 2
Vyšlo v časopise: Čes.-slov. Patol., 52, 2016, No. 3, p. 139-145
Kategória: Přehledový článek
Súhrn
Objevy translokací a fúzních onkogenů, které jsou jejich produktem, změnily přístup ke klasifikaci salivárních karcinomů a do značné míry i diagnostické a interpretační postupy. Metody molekulární diagnostiky mají v patologii slinných žláz jak diferenciálně diagnostický význam, tak slouží v klasifikaci některých karcinomů, protože mnohé translokace jsou specifické pro určitou nádorovou jednotku. Průkaz fúzního transkriptu může mít také prognostický význam. V tomto přehledovém článku budou představeny 4 salivární karcinomy, u nichž byly dosud identifikovány onkogenní translokace, a to mukoepidermoidní karcinom, adenoidně cystický karcinom, sekreční karcinom mamárního typu, a hyalinizující světlobuněčný karcinom malých slinných žláz.
Klíčová slova:
salivární karcinomy – fúzní onkogeny – CRTC1/3-MAML2 – MYB-NFIB – ETV6-NTRK3 – EWSR1-ATF1
Chromozomální aberace ve formě translokací mají ve většině případů za následek vznik fúzních genů, které mohou vykazovat onkogenní transformační a aktivační vlivy v různých buněčných liniích. V lidských nádorech bylo dosud identifikováno více než 800 fúzních onkogenů a mnohé z nich slouží jako vhodné diagnostické a prognostické biomarkery a potenciální cíle biologické léčby (1-3). Většina fúzních onkogenů byla nalezena v hematologických malignitách a sarkomech, naproti tomu v karcinomech jde o jev relativně vzácný (1,4).
Molekulární diagnostika pronikla v posledních několika letech i do onkopatologie slinných žláz (5-8). Objevy translokací a fúzních onkogenů, které jsou jejich produktem, změnily následně přístup ke klasifikaci salivárních karcinomů a do značné míry i diagnostické a interpretační postupy. Metody molekulární diagnostiky mají v patologii slinných žláz jak diferenciálně diagnostický význam, tak slouží v klasifikaci některých karcinomů, protože mnohé translokace jsou specifické pro určitou nádorovou jednotku. Nově popsaný sekreční karcinom slinných žláz mamárního typu (mammary analogue secretory carcinoma) (MASC) byl definován na základě detekce translokace t(12;15)(p13;q25) rezultující v genovou fúzi ETV6-NTRK3 (9). Identický fúzní transkript ETV6-NTRK3 byl sice již dávno před objevem MASC identifikován v řadě mesenchymálních (10-14), hematologických (15) a epiteliálních malignit (16-17), ale v onkologii slinných žláz je specifický pro MASC a nebyl nalezen v žádné jiné nádorové jednotce slinných žláz. Průkaz fúzního transkriptu může mít také prognostický význam. Příkladem je mukoepidermoidní karcinom malých a velkých slinných žláz. Přítomnost fúzního onkogenu CRTC1-MAML2 který vzniká translokací t(11;19)(q14-21;p12-13) je spojena jednoznačně s příznivou prognózou (18).
V tomto přehledovém článku budou představeny 4 salivární karcinomy, u nichž byly dosud identifikovány onkogenní translokace, a to mukoepidermoidní karcinom s translokací t(11;19)(q21;p13) CRTC1-MAML2 nebo translokací t(11;15) (q21;q26) CRTC3-MAML2, adenoidně cystický karcinom s translokací t(6;9)(q22-23;p23-24) generující fúzní transkript MYB-NFIB, sekreční karcinom mamárního typu s translokací t(12;15)(p13;q25) ETV6-NTRK3 a hyalinizující světlobuněčný karcinom malých slinných žláz vykazující charakteristickou translokaci t(12;22)(q13;q12) s fúzním onkogenem EWSR1-ATF1.
Metody detekce zlomů a translokací
Pro detekci nádorově specifických fúzních onkogenů u salivárních karcinomů se využívají především hybridizační techniky, zejména tzv. hybridizace in situ. Hybridizace in situ je metoda DNA analýzy, která je založena na specifickém spojení komplementárních nukleotidových sekvencí pocházejících z vyšetřované jednořetězcové denaturované DNA a uměle připravené jednořetězcové DNA nebo oligo/poly - nukleotidového řetězce se známou sekvencí, tzv. sondy (próby), to vše přímo v jádrech buněk histologických řezů. Z důvodu vizualizace hybridizačního signálu je nutné, aby sonda byla značena a to buď přímo, zejména fluorescenčním barvivem - fluorochromem, nebo nepřímo, např. haptenem s následnou detekcí flourochromem značenou protilátkou nebo pomocí protilátek spřažených s enzymatickou reakcí. V současné době se k vyšetření specifických translokací u salivárních karcinomů používá v drtivé většině případů fluorescenční in situ hybridizace (FISH) s lokus specifickými sondami. Jedná se buď o sondy fúzní, kdy dochází po translokaci k fyzickému přiblížení dvou různobarevných sond komplementárních k dvěma konkrétním fúzním partnerům a tím vzniku signálu jiné barvy (obr. 1), nebo tzv. “break-apart” sondy, u kterých se různobarevné sondy komplementární k 5` a 3` konci jednoho konkrétního fúzního partnera po zlomu tohoto genu fyzicky oddělí za vzniku dvou různobarevných signálů (obr. 2). Detekce sond je pak provedena ve fluorescenčním mikroskopu s excitačním a emisním filtrem odpovídající vlnové délky.
Obr. 1. Schematické zobrazení fúzní FISH sondy, principu detekce translokace mezi dvěma geny (Gen1 a Gen 2) a jejich projev v jádře buňky po FISH analýze. 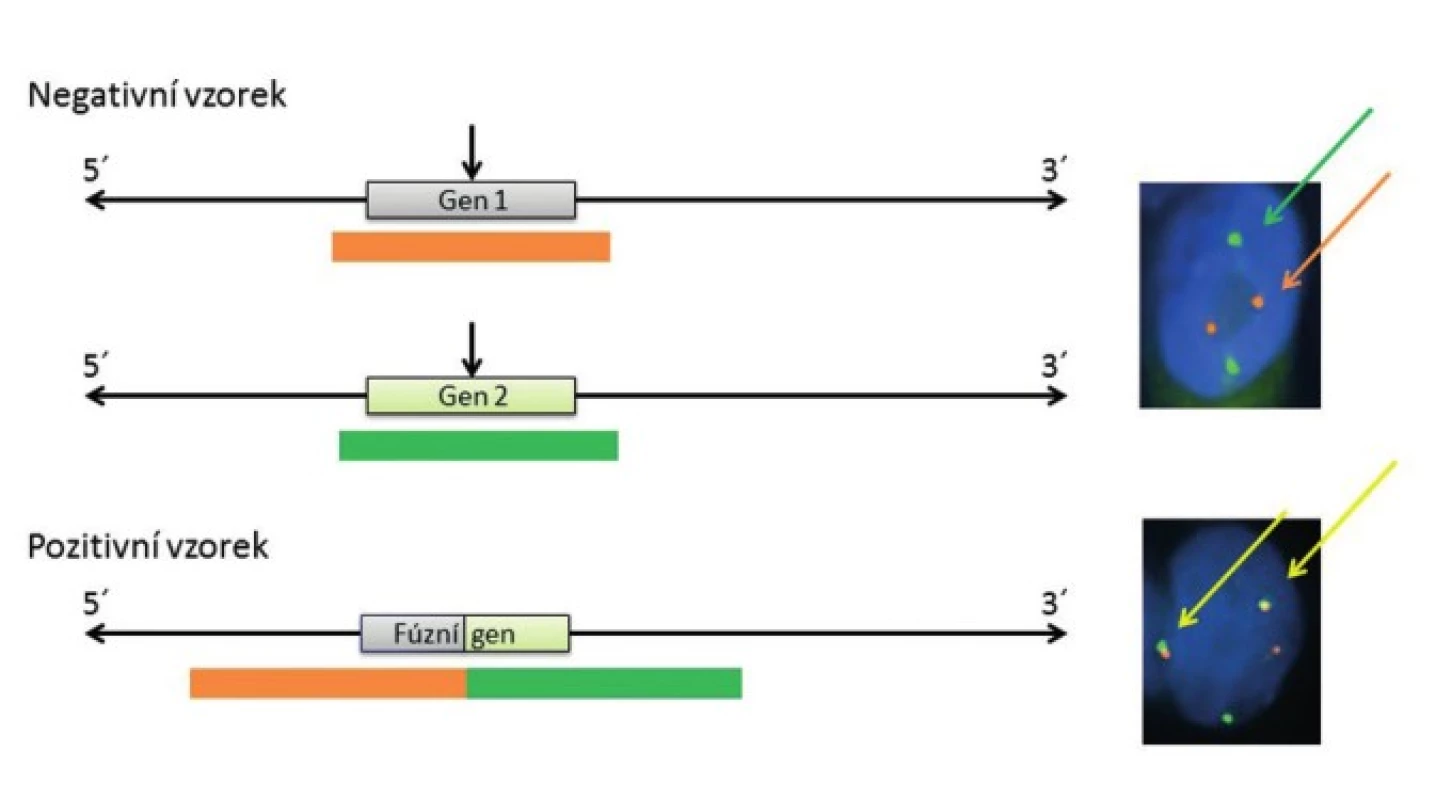
Obr. 2. Schematické zobrazení „break-apart“ sondy, principu detekce zlomu určitého genu (Gen 1) a jejich projev v jádře buňky po FISH analýze. 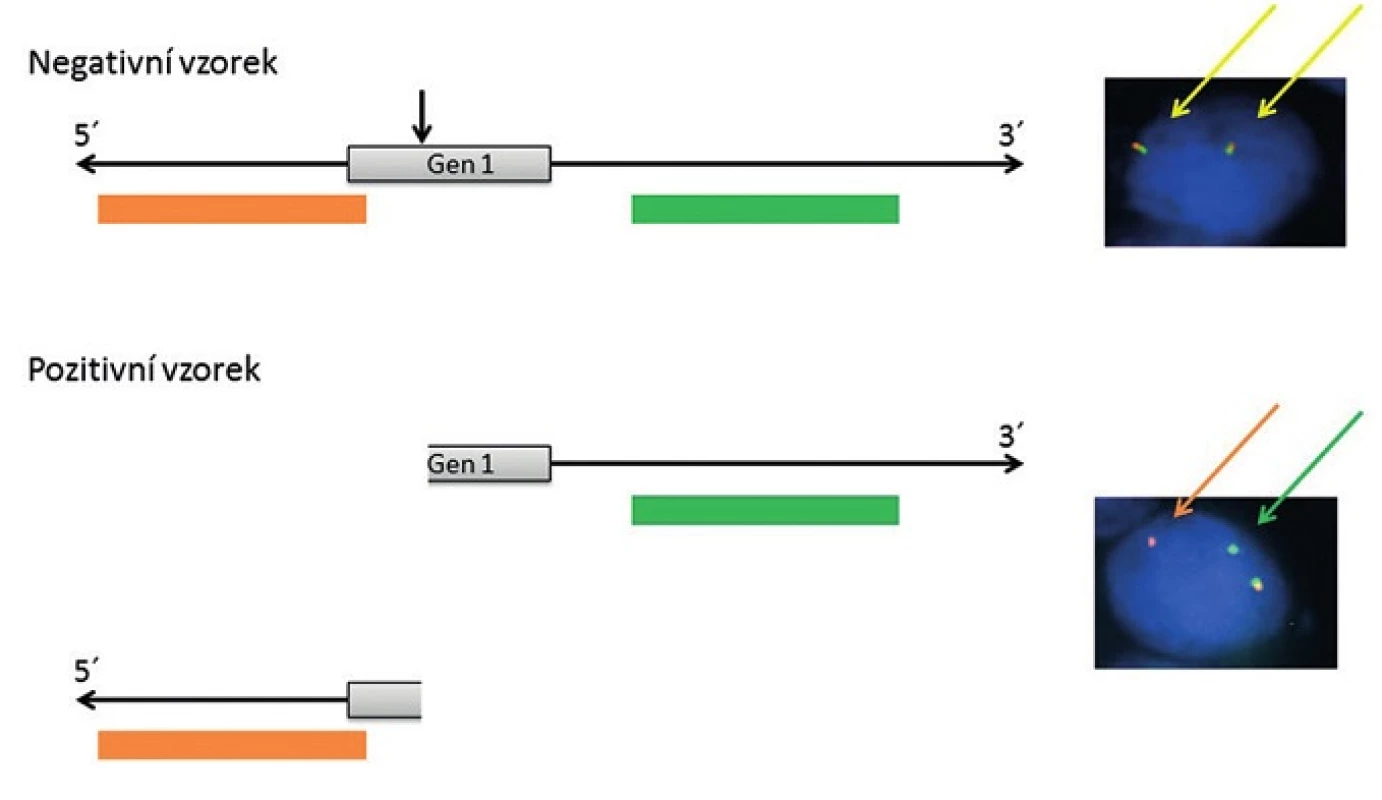
V molekulárně biologické diagnostice salivárních karcinomů se dále využívají amplifikační techniky, zejména polymerázová řetězová reakce (PCR), v těchto případech často spřažená s reverzní transkripcí (RT). PCR je metoda enzymatické syntézy specifických sekvencí DNA, kdy je díky mnohonásobné replikaci vytvořen dostatek materiálu pro další molekulárně genetické analýzy. RT-PCR pak umožňuje amplifikaci cDNA z výchozího RNA templátu, kdy se využívá reverzní transkripce RNA do prvního vlákna cDNA pomocí enzymu reverzní transkriptázy. RT – PCR slouží jako metoda k prokazování transkriptů fúzních onkogenů (obr. 3).
Obr. 3. Schematické zobrazení principu detekce fúzního transkriptu genů 1 a 2 pomocí RT-PCR. Zobrazena fúze mezi exonem 4 Genu 1 a exonem 14 Genu 2. 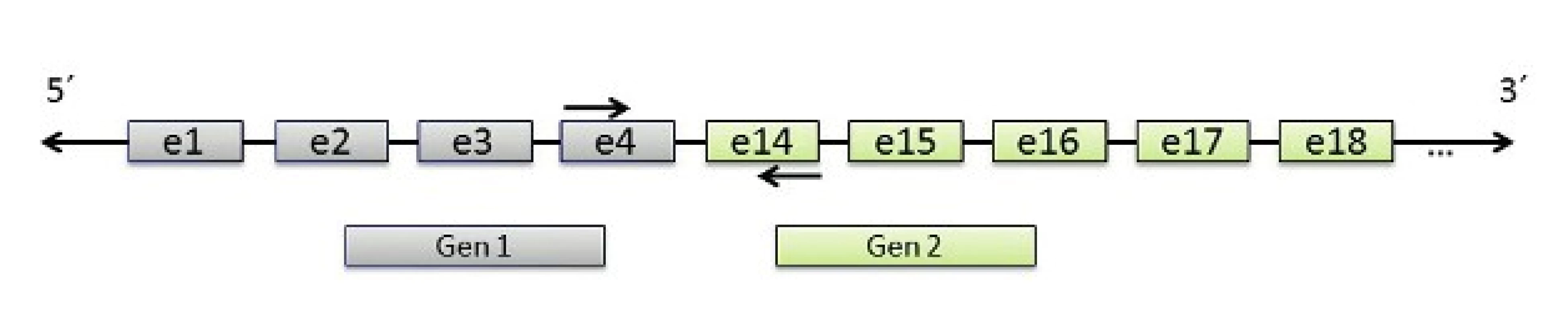
Aplikace těchto metodik pak tvoří silný nástroj pomáhající patologovi při vlastní diferenciální diagnostice. Detekce příslušných translokací a fúzních transkriptů v mnoha případech definuje příslušnost k určitým nádorovým jednotkám (obr. 4A, B)
Obr. 4. A. Příklad agarózové elektroforézy a sekvenční analýzy fúzního transkriptu ETV6-NTRK3 u vzorku MASC. 1 – vzorek (v duplikátu), PK – pozitivní kontrola, NK – negativní kontrola, NTK – non-templátová kontrola. B. Příklad analýzy metodou fluorescenční <i>in situ</i> hybridizace s komerčně dostupnou break-apart sondou Vysis <i>ETV6</i> Break Apart FISH Probe (Vysis/Abbott Molecular) u vzorku MASC. Intaktní gen dává žlutý, zlomený pak červený a zelený signál. 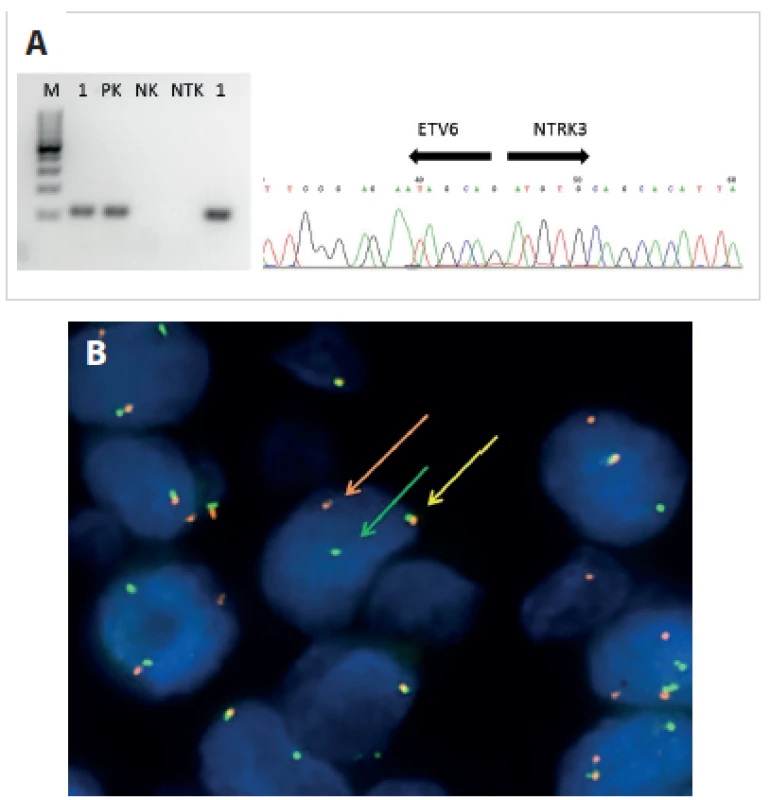
Fúzní onkogeny v karcinomech slinných žláz
CRTC1-MAML2 a CRTC3-MAML2 fúzní geny v mukoepidermoidním karcinomu
Mukoepidermoidní karcinom (MEC) patří k nejčastějším karcinomům slinných žláz; představuje asi 20% všech salivárních malignit (19). Mikroskopická struktura MEC je značně variabilní a diagnóza není vždy jednoduchá. MEC je většinou histologicky low-grade karcinom sestávající ze tří typů nádorových buněk, a to pohárkových buněk produkujících hlen (mucinozních), epidermoidních nekeratinizujících buněk a buněk intermediálního typu, zastoupených v různých proporcích (obr. 5). Onkocytární a světlobuněčná varianta MEC mohou být diagnosticky velmi obtížné, protože nádorové buňky s onkocytární metaplázií nebo vodojasnou cytoplasmou mohou tvořit většinu nádoru (obr. 6). MEC mohou být převážně solidní, nebo mohou sestávat především z cystických ložisek vystlaných cylindrickými nebo kubickými mucinózními (pohárkovými) buňkami, které mají vodojasnou, eosinofilní nebo pěnitou cytoplasmu. V typických případech není diagnóza MEC problematická, ale vzhledem k variabilitě morfologie má MEC velký rozptyl diferenciálně diagnostických možností (20). Na low-grade straně histomorfologického spektra jsou multicystické nádory sestávající v převaze z mucinózních a intermediálních buněk s velkým množstvím hlenu. Tyto nádory je třeba odlišit od benigního mucinozního cystadenomu a duktektázií. MEC se středním (intermediálním) stupněm diferenciace (grade 2) může napodobovat MASC, acinický karcinom, celulární pleomorfní adenom nebo hyalinizující světlobuněčný karcinom malých slinných žláz. High-grade MEC je naopak třeba odlišit od metastatického squamozního (dlaždicového), salivárního duktálního karcinomu nebo vzácného adenosquamozního karcinomu slinných žláz (20).
Obr. 5. Mukoepidermoidní karcinom (low-grade) konvenční struktury sestávající ze tří typů nádorových buněk, mucinózních, epidermoidních a buněk intermediálního typu (hematoxylin-eozin). 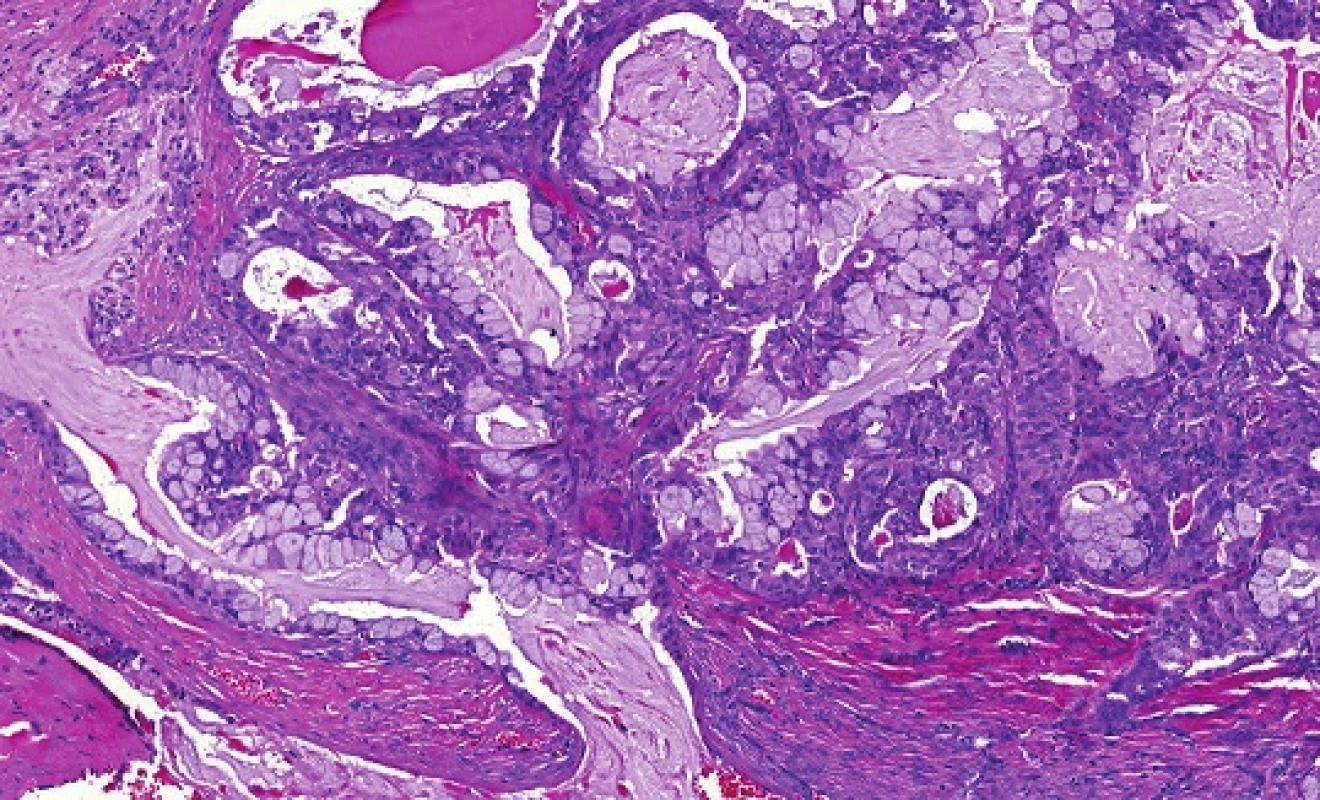
Obr. 6. Světlobuněčná varianta mukoepidermoidního karcinomu: nádorové buňky s vodojasnou cytoplasmou tvoří většinu nádoru (Hematoxylin-eosin). 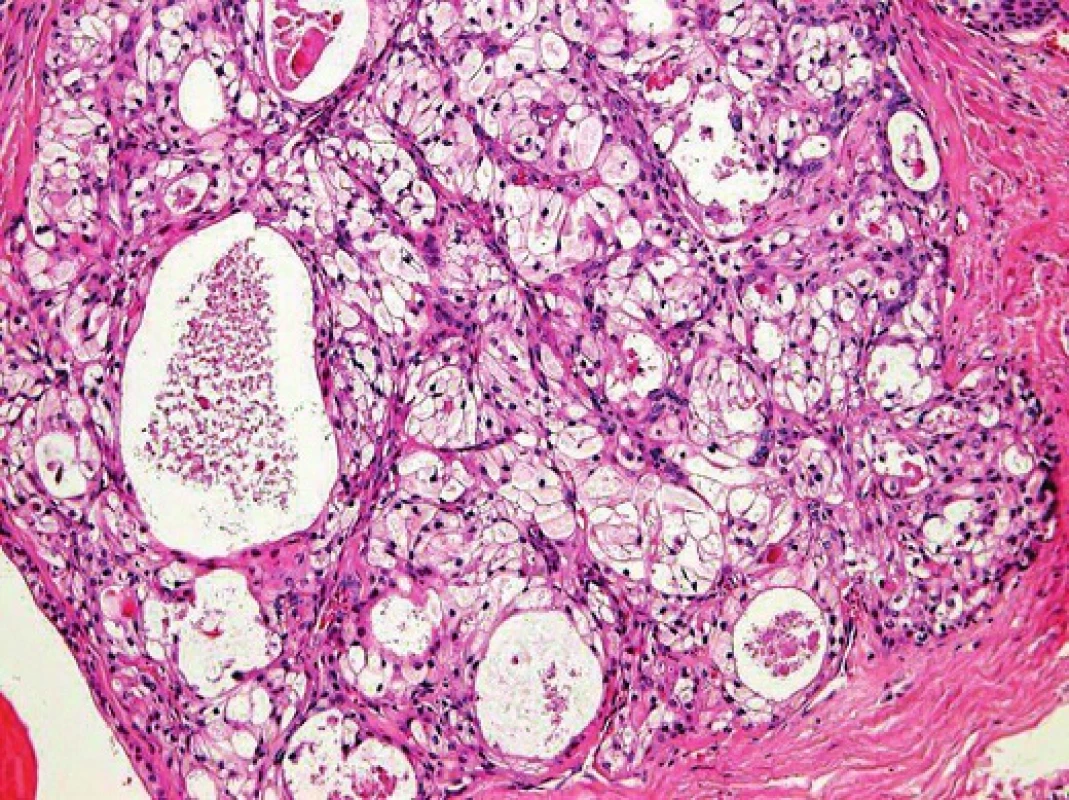
Predikce prognozy pacientů s MEC je obtížná, neboť není dosud shoda na přesných kriteriích pro grading. Pro mukoepidermoidní karcinom bylo navrženo několik odlišných schémat a systémů, které nebudou v detailu diskutovány, ale všechny využívají procentuální zastoupení cystické komponenty, anaplázie, mitotické aktivity, přítomnosti nekroz, perineurální a lymfovaskulární invaze a některých dalších znaků (19), ale jejich použití je předmětem diskuzí. Teprve objev translokací t(11;19)(q21;p13) CRTC1-MAML2 a t(11;15) (q21;q26) CRTC3-MAML2 ve většině případů MEC představuje slibný diferenciálně diagnostický a prognostický indikátor. Fúzní transkript CRTC1-MAML2 byl prvně popsán po mnoha letech cytogenetických studií, kdy Tonon et al. jako první identifikovali rekurentní translokaci t(11;19)(q14-21;p12-13) CRTC1-MAML2 (syn. MECT1-MAML2) (obr. 7) ve skupině mukoepidermoidních karcinomů (21). Skutečným přelomem se staly následující publikace, v nichž byla prokázána nečekaně příznivá prognoza u pacientů s MEC s pozitivním fúzním transkriptem (18). Klinicko-patologické retrospektivní studie, prokázaly, že MEC s pozitivní fúzí mají nižší riziko recidiv a metastáz než MEC bez fúze (18, 22-23). Seethala et al. prokázali přítomnost CRTC1-MAML2 translokace v 75 % všech MEC s nízkým a středně vysokým gradem, zatímco high-grade MEC byly pozitivní pouze ve 46 % (23). Důležité je však připomenout, že příznivou prognózu mají všechny translokované MEC, včetně pokročilých karcinomů s high-grade morfologií (23-24). Nový fúzní partner pro MAML2 gen z rodiny CRTC byl popsán později (24). CRTC3 je lokalizovaný na chromozomu 15q26.1 a jeho fúze s genem MAML2 se vyskytuje velmi vzácně u mladých lidí a dětí. Podobně jako CRTC1-MAML2 je také fúze CRTC3-MAML2 spojená s excelentní prognózou (24,26).
Obr. 7. Sekvenogram fúzního transkriptu <i>CRTC1-MAML2</i>. Šipky vyznačují místo fúze. 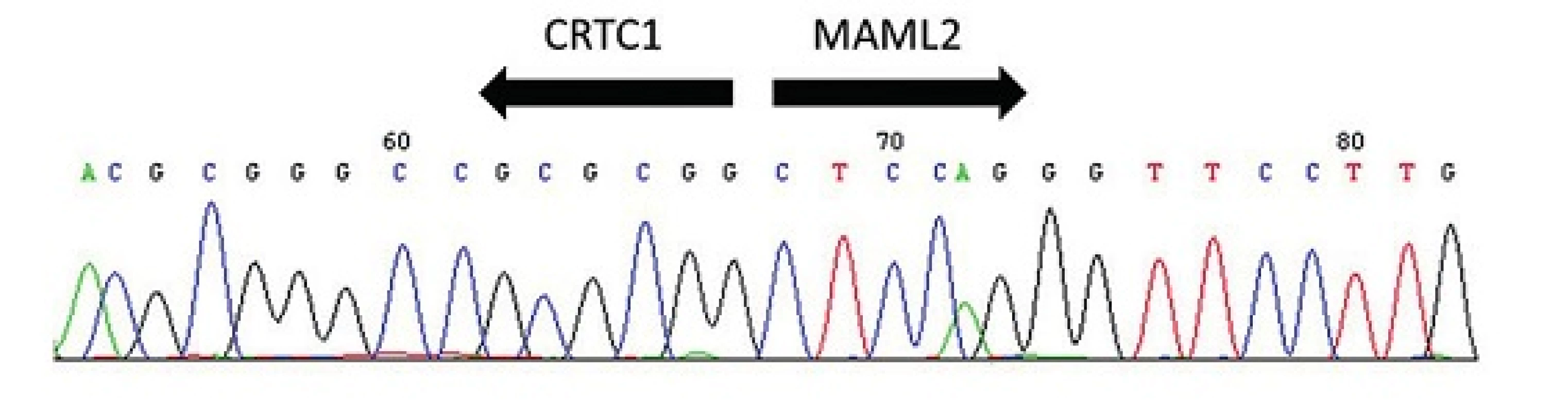
Při zmíněné translokaci je u fúzního proteinu CRTC1-MAML2 nahrazena N-terminální bazická doména genu MAML2 CREB-binding (cAMP response element-binding) doménou genu CRTC1. Molekulární konsekvence této záměny nejsou dosud zcela objasněné, ale z dosavadních zjištění vyplývá, že fúzní protein nezávisle na vstupních signálech aktivuje jak CREB závislé geny, tak i Notch signální dráhu. Aktivace dvou nezávislých drah, zejména však CREB, pak významně přispívá k vlastnímu neoplastickému procesu (2). Obdobný mechanismus se pak zřejmě uplatňuje i u sesterského fúzního genu CRTC3-MAML2.
V literatuře přetrvávají určité kontroverze ohledně translokace CRTC1-MAML2 ve Warthinovu tumoru (27-28), velmi pravděpodobně je však detekovaná translokace i v těchto vzácných případech specifická pro MEC vznikající ve Warthinově tumoru (mínění autorů textu) (29). Nepochybně mají obě translokace CRTC1-MAML2 a CRTC3-MAML2 pozitivní prognostický význam, translokované MEC se chovají příznivě. Translokaci nebo přestavbu genu MAML2 lze také využít v diagnosticky obtížných případech, jako jsou onkocytární a světlobuněčná varianta MEC (30) nebo v neobvyklých lokalizacích, např. intraoseální (centrální) MEC (31).
MYB-NFIB fúzní gen v adenoidně cystickém karcinomu
Adenoidně cystický karcinom (AdCC) je low-grade bazaloidní nádor sestávající z epiteliálních a myoepiteliálních buněk ve variabilních morfologických strukturách (32). Jedná se o nejčastější karcinom hlavy a krku infiltrující nervy, s peri - a intraneurálním šířením ve 20 - 80 % případů (33). AdCC je většinou ohraničený, ale neopouzdřený nádor, hluboce infiltrující okolní tkáně především progresí kolem nervů. Je tvořen dvěma hlavními typy buněk, a to duktálními a modifikovanými myoepiteliálními. Jádra jsou hranatá a hyperchromní a cytoplazma často vodojasná. V AdCC se rozlišují se tři růstové struktury: tubulární, kribriformní a solidní (32) (obr. 8). Nejčastější kribriformní struktura je charakterizována hnízdy buněk s pseudocystickými prostory, které jsou vyplněny hyalinní nebo bazofilní mukoidní extracelulární matrix. Tubulární struktura je tvořena dobře formovanými vývody a tubuly s centrálními luminy, které jsou lemovány uvnitř epiteliálními a zevně myoepiteliálními buňkami. Solidní (bazaloidní) struktura je formována uniformními malými bazaloidními buňkami s minimální cytoplazmou, které netvoří ani tubulární ani mikrocystické struktury (32). V kribriformní a solidní variantě nádoru se vyskytují i malé pravé vývody, které nemusejí být ihned patrné. Každá ze tří výše popsaných struktur může být v nádoru výrazně dominantní nebo častěji je jen jednou z komponent kompozitního tumoru. Nádorové stroma je obvykle hyalinizované (někdy i poměrně extenzivně s útlumem epiteliální komponenty) a může vykazovat i mucinózní nebo myxoidní rysy. Častým nálezem je perineurální a intraneurální invaze, která může dosahovat do značné vzdálenosti od klinických ale i radiologických hranic karcinomu.
Obr. 8. Adenoidně cystický karcinom s typickou kribriformní strukturou a invazivním růstem (hematoxylin-eozin). 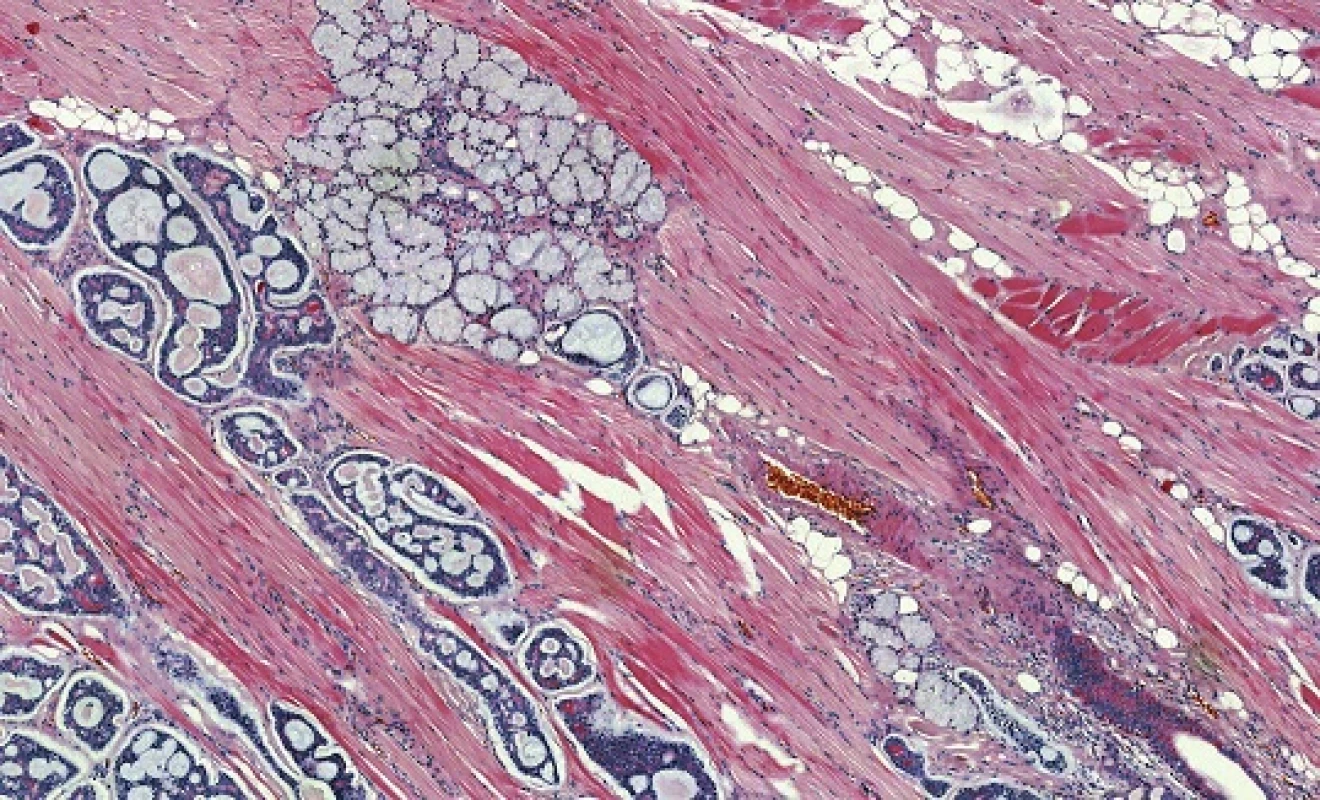
Pro AdCC slinných žláz je typická chromozomální translokace t(6;9)(q22-23;p23-24), která generuje fúzní transkript MYB-NFIB (obr. 9) (34-36). MYB–NFIB fúzní onkogen byl poprvé popsán u AdCC Martou Perssonovou et al. v roce 2009 (37). Gen MYB, lokalizovaný v oblasti 6q22-23, kóduje transkripční faktor který hraje zásadní roli v regulaci buněčné proliferace, diferenciace a apoptózy, a tím pravděpodobně i v tumorogenezi. MYB je vysoce exprimován v nezralých a proliferujících epiteliálních, endoteliálních a hematopoetických buňkách a naopak down-regulován v době, kdy se tyto buňky stanou diferencovanými (34,36). Gen NFIB (Nuclear Factor I/B), lokalizovaný v oblasti 9p23-24, patří do rodiny dimerních DNA-vazebných proteinů fungujících jako buněčný transkripční faktor. Vznik fúzního onkogenu MYB-NFIB vede ke ztrátě 3´ konce MYB genu (exonu 15), místa, kde dochází k negativní regulaci MYB exprese (34,36). Následná zvýšená exprese fúzního transkriptu a proteinu pak aktivuje transkripci MYB cílových genů, které mají zasadní roli v onkogenní transformaci. MYB-NFIB fúze nebo přestavba MYB genu, které vedou k jeho aktivaci, a tím ke zvýšené expresi MYB–NFIB fúzního proteinu nebo MYB onkoproteinu, byly dosud ze salivárních karcinomů i jiných karcinomů hlavy a krku prokázány pouze u AdCC, a to ve více jak v 80 % případů (34,38). Jedná se tak o charakteristický znak těchto maligních sialomů, který se dá využít jako diagnostický marker, s výhodou především u vzdálených metastáz.
Obr. 9. Sekvenogram fúzního transkriptu <i>MYB-NFIB</i>. Šipky vyznačují místo fúze. 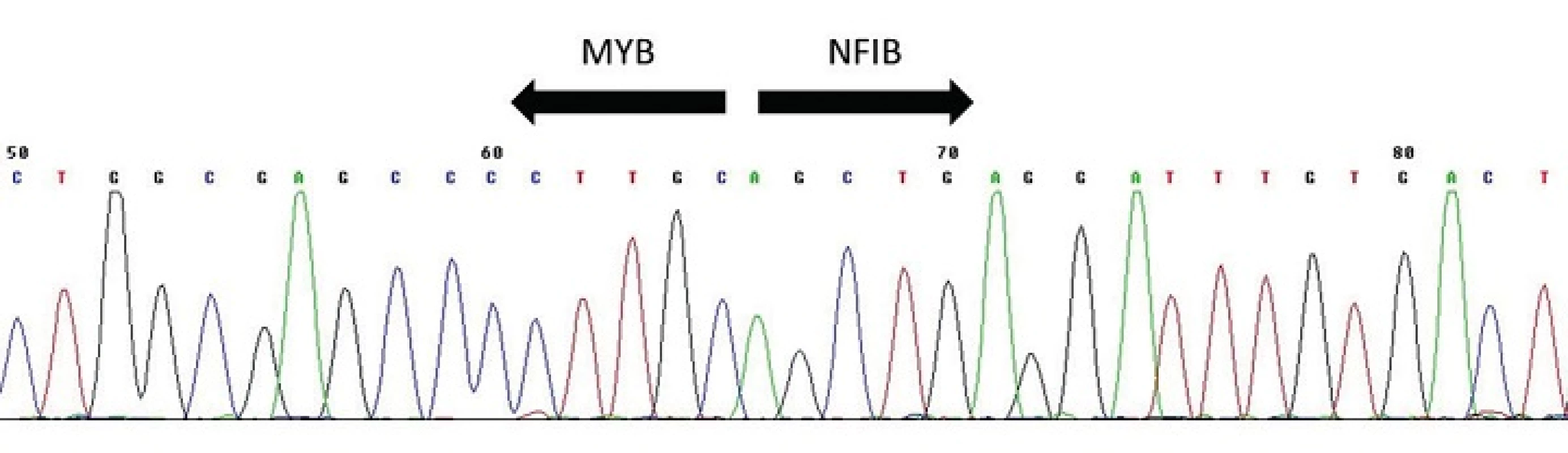
ETV6-NTRK3 fúzní gen v sekrečním karcinomu mammárního typu / Mammary analogue secretory carcinoma
Sekreční karcinom mamárního typu (MASC) je nově popsaný nádor slinných žláz, který vykazuje histologickou a imunohistochemickou podobnost se sekrečním karcinomem prsu (9). Podobně jako prsní sekreční karcinom, exprimuje MASC difúzně cytokeratiny, S-100 protein a mammaglobin, a je charakterizován translokací t(12;15) (p13;q25), která generuje fúzní transkript ETV6-NTRK3 (9,16). Histologicky, jak sekreční karcinom salivární tak mamární, jsou většinou low-grade malignity, a jsou dobře ohraničené ale neopouzdřené s ložiskovým invazivním růstem. Nádorové buňky MASC jsou většinou uniformní, blandního vzhledu, s pravidelnými vesikulárními jádry, jedním centrálně lokalizovaným zřetelným jadérkem a eosinofilní vakuolizovanou nebo vodojasnou cytoplasmou (obr. 10A). Mikrocystická struktura je pro MASC typická, ale nádor je strukturálně variabilní, takže tubulární, solidní, makrocystická a kribriformní ložiska v různých proporcích nejsou výjimkou (obr. 10B). Velmi důležitým diferenciálně diagnostickým znakem je absence sekrečních zymogenních granul v cytoplasmě nádorových buněk, která MASC odlišuje od strukturálně podobného acinického karcinomu (9). MASC je karcinom, který typicky obsahuje tubulární a mikrocystické struktury s hojným homogenním nebo vakuolizovaným sekretem v lumen. Sekreční materiál je pozitivní při barvení mucikarminem a PAS před i po natrávení diastázou. Imunoprofil MASC je charakterizován ko-expresí cytokeratinů (CK7, CK8, CK18), S-100 proteinu, SOX10, mammaglobinu a GATA3 (9). MASC nevykazuje na rozdíl od acinického karcinomu expresi markeru DOG1, který byl původně použit v diagnostice gastrointestinálního stromálního tumoru, ale v diagnostice karcinomů slinných žláz se využívá jeho exprese v normálních i nádorových buňkách s acinární diferenciací (39). Průkaz GCDFP 15 (gross cystic disease fluid protein) a EMA (epiteliální membránový protein) jsou velmi často v MASC pozitivní, zatímco p63 protein je zpravidla v nádorových buňkách negativní (9). Ložiskově a jen v některých případech, může jaderná exprese p63 dekorovat vrstvu bazálních buněk, a svědčí tak pro in situ lézi nebo fokální intraduktální komponentu MASC (40).
Obr. 10. Sekreční karcinom mamárního typu (MASC): typická mikrocystická struktura s uniformními nádorovými buňkami, blandního vzhledu, s pravidelnými vesikulárními jádry, jedním centrálně lokalizovaným zřetelným jadérkem a eosinofilní vakuolizovanou nebo vodojasnou cytoplasmou (A). MASC je nádor strukturálně variabilní, takže tubulární, solidní, makrocystická a kribriformní ložiska v různých proporcích nejsou výjimkou (B) (hematoxylin-eozin). 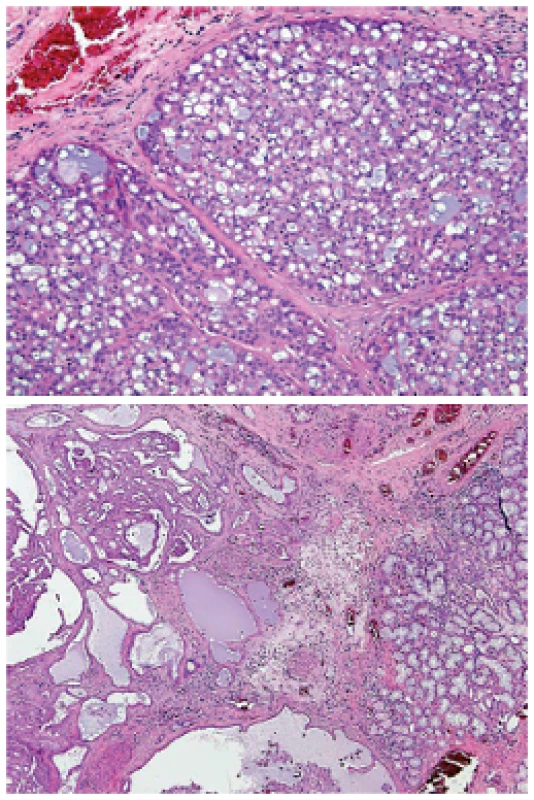
Pro MASC je typická rekurentní chromosomální translokace t(12;15)(p13;q28) generující fúzní transkript ETV6-NTRK3 (9). Tato translokace byla popsána v řadě mezenchymálních nádorů (10-14), v různých hematologických malignitách (15) a dokonce nedávno v podskupině radiací indukovaných papilokarcinomů štítné žlázy (17), ale nevyskytuje se v žádném jiném nádoru slinných žláz než v MASC. Skutečně raritním je pozorování primárního sekrečního karcinomu mamárního typu (MASC) ve štítné žláze (41,42) napodobující papilokarcinom. To je skutečná diagnostická “past”, protože léčba papilokarcinomu štítné žlázy je diametrálně odlišná od léčby MASC (42). Fúzní gen ETV6-NTRK3 kóduje chimerický onkoprotein tyrosin kinázu, která aktivuje Ras-MAP kinázovou dráhu startující onkogenní transformaci (16, 43). Větší klinicko-patologické studie jsou dosud vzácné, ale ukazují, že MASC je u většiny pacientů low-grade malignita s relativně příznivou prognózou (44-45). U části pacientů může být však chování karcinomu velmi agresivní, včetně lokálních recidiv, vzdálených metastáz, případně s fatálním klinickým průběhem (46). Příkladem může být MASC s high-grade transformací (46) nebo MASC označovaný ETV6-X, u nichž FISH prokazuje zlom v ETV6 genu nikoliv však genu NTRK3 a ani žádného dalšího genu z NTRK rodiny, konkrétně NTRK1 a NTRK2 (47). MASC s high grade transformací jsou velmi agresivní karcinomy, které rychle generalizují a klinický průběh je často smrtelný, proto se u pacientů s takto agresivními formami MASC a s prokázanou translokací ETV6-NTRK3 nabízí možnost cílené léčby inhibitory onkogenní tyrosin kinázy (46-48).
EWSR1-ATF1 fúzní gen v hyalinizujícím světlobuněčném karcinomu malých slinných žláz
Hyalinizující světlobuněčný karcinom malých slinných žláz (HCCC) byl prvně rozpoznán v roce 1994 Milchgrubovou et al. (49) jako samostatná nádorová jednotka odlišná od monomorfní světlobuněčné varianty myoepiteliálního karcinomu (50,51), epiteliálního-myoepiteliálního karcinomu a od světlobuněčných variant acinického a mukoepidermoidního karcinomu (20). Dle dosud platné WHO klasifikace nádorů hlavy a krku z roku 2005 (52) je sice HCCC klasifikován jako světlobuněčný adenokarcinom NOS (not otherwise specified), ale to je jistě chybná koncepce zvláště ve světle nových molekulárně genetických nálezů, které ukazují že HCCC je samostatná nádorová jednotka definovaná specifickou translokací t(12;22)(q13;q12) zahrnující geny EWSR1 a ATF1 (obr. 11) (53). Při této translokaci dochází k fúzi N-koncové transaktivační části genu EWSR1 s DNA vazebnou doménou transkripčního faktoru ATF1, což vede k aktivaci exprese downstream cílových genů, které se účastní buněčného růstu (53). HCCC je low-grade karcinom s dobrou prognózou u většiny pacientů, ale vzácně s rizikem recidivy a regionálních uzlinových metastáz.
Obr. 11. Sekvenogram fúzního transkriptu <i>EWSR1-ATF1</i>. Šipky vyznačují místo fúze. 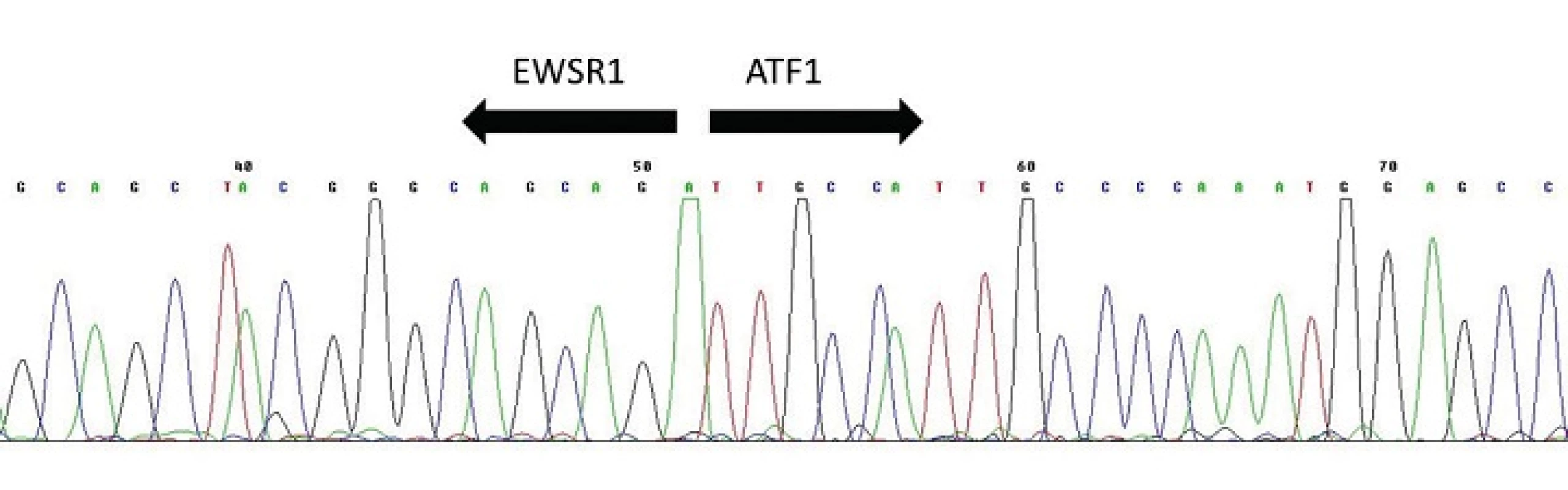
Histologicky je HCCC monofázický karcinom sestávající z uniformních buněk s eosinofilní nebo vodojasnou cytoplasmou typicky uspořádaných do malých hnízd, pruhů a trabekulárních struktur, oddělených od sebe hyalinizovanými vazivovými septy (obr. 12). Fokálně může být přítomna hlenotvorba a odlišení od světlobuněčné varianty mukoepidermoidního karcinomu je tedy obtížné. Na základě absence S-100 proteinu a hladkosvalového aktinu byl HCCC již v původní práci definován jako karcinom, který postrádá myoepiteliální diferenciaci (49). Původní článek (49) a mnoho následujících studií však prokázaly, že HCCC vykazuje squamocelulární diferenciaci s difusní expresí vysokomolekulárních cytokeratinů a markeru p63 (54-56). Nicméně diferenciální diagnostika světlobuněčných lézí, především karcinomů, v dutině ústní byla vždy velmi problematická a zmatečná. Jednotlivé nádorové jednotky mohou mít podobné nebo shodné morfologické znaky, může se prolínat imunoprofil, kriteria pro odlišení nebyla svorně přijímána, a navíc pro diagnostiku lézí dutiny ústní je často k dispozici pouze malé množství tkáně v probatorní excizi. Proto byl nález specifické a rekurentní translokace t(12;22)(q13;q12), která generuje fúzní onkogen EWSR1-ATF1 přijat s velkou nadějí, že bude spolehlivým diferenciálně diagnostickým markerem HCCC. Tato naděje se splnila pouze částečně, protože průkaz EWSR1-ATF1 sice slouží k odlišení většiny ostatních světlobuněčných nádorů v ústní dutině, které HCCC napodobují (53,57), ale světlobuněčný odontogenní karcinom vykazuje identickou translokaci EWSR1-ATF1 jako HCCC (58, 59), což svědčí pro biologickou příbuznost obou nádorů. My jsme nedávno dokonce identifikovali zlom v EWSR1 genu u světlobuněčné varianty myoepiteliálního karcinomu (51). EWSR1-ATF1 fúzní onkogen není specifický, již dříve byla identická translokace popsána u řady morfologicky velmi odlišných nádorů, jako jsou světlobuněčný sarkom, angiomatoidní fibrozní histiocytom, maligní gastrointestinální neuroektodermální tumor (60). Nedávno byl dokonce publikován případ angiosarkomu parotis s EWSR1-ATF1 fúzí (61). Vzato celkově, průkaz přestavby genu EWSR1 musí být interpretován vždy ve shodě s histomorfologií a imunoprofilem nádoru (62).
Obr. 12. Hyalinizující světlobuněčný karcinom malých slinných žláz sestává z uniformních buněk s eosinofilní nebo vodojasnou cytoplasmou typicky uspořádaných do malých hnízd, pruhů a trabekulárních struktur, oddělených od sebe hyalinizovanými vazivovými septy. (hematoxylin-eozin). 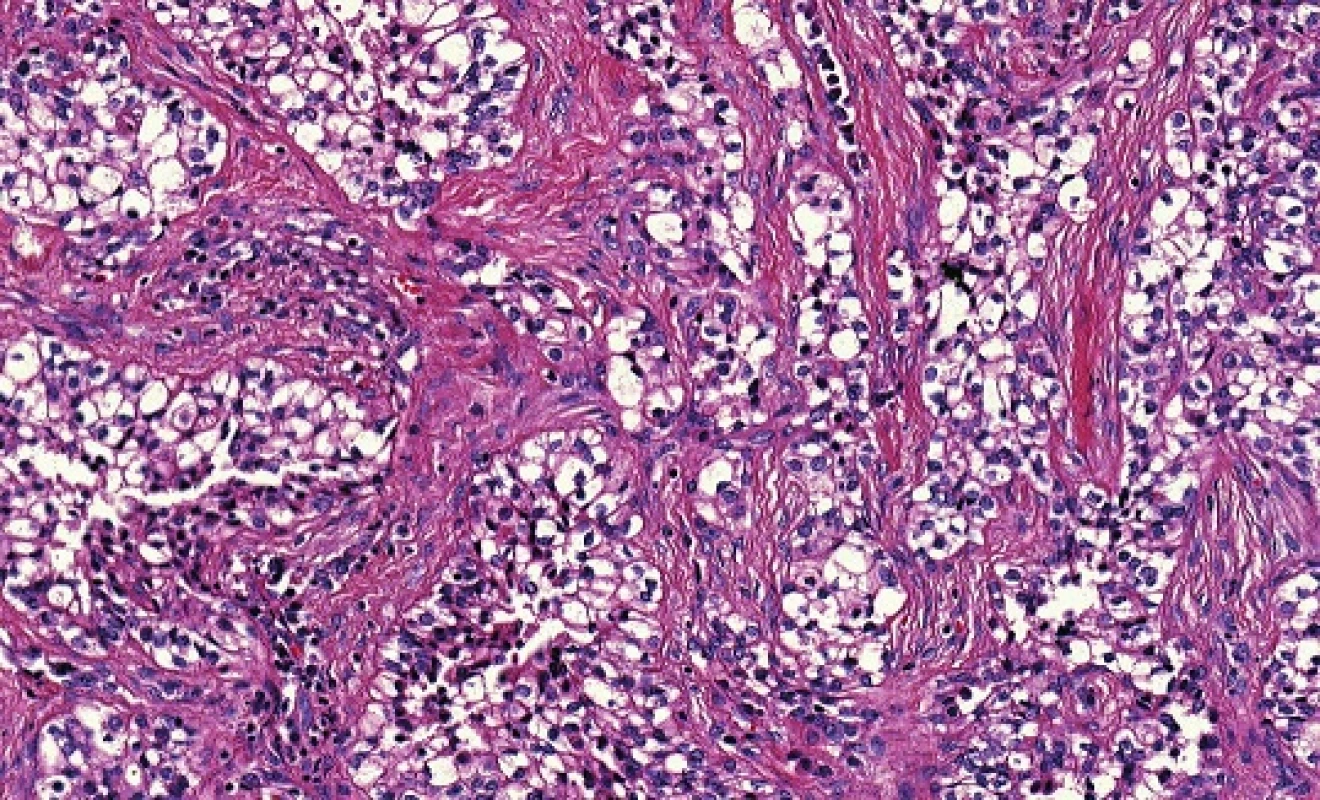
Závěry
Nedávné objevy specifických translokací a fúzních onkogenů u několika salivárních karcinomů výrazně ovlivnily diagnostické a interpretační postupy v klasifikaci salivárních karcinomů (63). Metody molekulární diagnostiky mají v onkopatologii slinných žláz v současné době především diferenciálně diagnostický význam, protože mnohé translokace jsou specifické pro určitou nádorovou jednotku. Nově popsaný sekreční karcinom slinných žláz mamárního typu (MASC) je chakterizován translokací t(12;15) a genovou fúzi ETV6-NTRK3, která je v onkologii slinných žláz specifická pro MASC a nebyla nalezena v žádné jiné nádorové jednotce slinných žláz. Podobně průkaz translokace t(12;22) s fúzním onkogenem EWSR1-ATF1 je v kontextu příslušné histomorfologie diagnostický pro hyalinizující světlobuněčný karcinom malých slinných žláz a fúzní transkript MYB-NFIB pro adenoidně cystický karcinom. Průkaz fúzního transkriptu u mukoepidermoidního karcinomu má nejen diagnostický význam, ale může být využit i v prognóze. Přítomnost fúzního onkogenu t(11;19) CRTC1-MAML2 a t(11;15) CRTC3-MAML2 je spojena jednoznačně s příznivou prognozou. S rozvojem technik molekulární biologie bude nepochybně v salivární patologii v dalších letech přibývat objevů translokací a dalších aberací. V neposlední řadě, je naděje, že tyto nálezy bude možné v blízké budoucnosti využít k cílené biologické léčbě pacientů s karcinomy slinných žláz.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
Prof. MUDr. Alena Skálová, CSc.
Šiklův ústav patologie LF UK v Plzni
Fakultní nemocnice Bory
Ed. Beneše 13, 305 99 Plzeň, Česká republika
tel.: +420 377 402 545
e-mail: skalova@fnplzen.cz
Zdroje
1. Mitelman F, Johansson B, Mertens F. The impact of translocations and gene fusions on cancer causation. Nat Rev Cancer 2007; 7(4): 233-245.
2. Stenman G. Fusion oncogenes and tumor type specificity – insight from salivary gland tumors. Semin Cancer Biol 2005; 15(3): 224-235.
3. Aman P. Fusion oncogenes in tumor development. Semin Cancer Biol 2005; 15(3): 236-243.
4. Mitelman F, Johansson B, Mertens F, eds. Mitelman database of chromosome aberrations and gene fusions in cancer: http://cgap.nci.nih.gov/Chromosomes/Mitelman, 2013.
5. Asp J, Persson F, Kost-Alimova M, Stenman G. CHCHD7-PLAG1 and TCEA1-PLAG1 gene fusions resulting from cryptic, intrachromosomal 8q rearrangements in pleomorphic salivary gland adenomas. Genes Chromosomes Cancer 2006; 45(9): 820-828.
6. Persson F, Winnes M, Andrén Y, et al. High-resolution array CGH analysis of salivary gland tumors reveals fusion and amplification of the FGFR1 and PLAG1 genes in ring chromosomes. Oncogene 2008; 27(21): 3072-3080.
7. Persson F, Andrén Y,Winnes M, et al. High-resolution genomic profiling of adenomas and carcinomas of the salivary glands reveals amplification, rearrangement, and fusion of HMGA2. Genes Chromosomes Cancer 2009; 48(1): 69-82.
8. Stenman G, Andersson MK, Andrén Y. New tricks from an old oncogene: gene fusions and copy number alterations of MYB in human cancer. Cell Cycle 2010; 9(15): 2986-2995.
9. Skalova A, Vaněček T, Šíma R, et al. Mammary analogue secretory carcinoma of salivary glands, containing the ETV6-NTRK3 fusion gene: a hitherto undescribed salivary gland tumor entity. Am J Surg Pathol 2010; 34(5): 599–608.
10. Knezevich SR, McFadden DE, Tao W, Lim JF, Sorensen PH. A novel ETV6-NTRK3 gene fusion in congenital fibrosarcoma. Nat Genet 1998; 18(2): 184–187.
11. Knezevich SR, Garnett MJ, Pysher TJ, Beckwith JB, Grundy PE, Sorensen PH. ETV6-NTRK3 gene fusions and trisomy 11 establish a histogenetic link between mesoblastic nephroma and congenital fibrosarcoma. Cancer Res 1998; 58(22): 5046–5048.
12. Bourgeois JM, Knezevich SR, Mathers JA, Sorensen PH. Molecular detection of the ETV6-NTRK3 gene fusion differentiates congenital fibrosarcoma from other childhood spindle cell tumors. Am J Surg Pathol 2000; 24(7): 937–946.
13. Rubin BP, Chen CJ, Morgan TW, et al. Congenital mesoblastic nephroma t(12;15) is associated with ETV6-NTRK3 gene fusion: cytogenetic and molecular relationship to congenital (infantile) fibrosarcoma. Am J Pathol 1998; 153(5): 1451–1458.
14. Alassiri A, Lum A, Goytain A, et al. ETV6-NTRK3 is expressed in a subset of ALK-negative inflammatory myofibroblastic tumors: case series of 20 patients. Mod Pathol 2015; 28(Supplement 2s): 13A.
15. Kralik JM, Kranewitter W, Boesmueller H, et al. Characterization of a newly identified ETV6 NTRK3 fusion transcript in acute myeloid leukemia. Diagn Pathol 2011; 6 : 19.
16. Tognon CE, Knezevich SR, Huntsman D, et al. Expression of the ETV6-NTRK3 gene fusion as a primary event in human secretory breast carcinoma. Cancer Cell 2002; 2(5): 367–376.
17. Leeman-Neill RJ, Kelly LM, Liu P, et al. ETV6-NTRK3 is a common chromosomal rearrangement in radiation-associated thyroid cancer. Cancer 2014; 120(6): 799–807.
18. Behboudi A, Enlund F, Winnes M, et al. Molecular classification of mucoepidermoid carcinoma – prognostic significance of the MECT1-MAML2 fusion oncogene. Genes Chromosomes Cancer 2006; 45(5): 470-481.
19. Goode RK, El-Naggar AK. Mucoepidermoid carcinoma. In: Barnes L, Eveson J, Reichart P, Sidransky D, eds. Pathology and genetics of head and neck tumours. World Health Organization classification of tumours. Lyon: IARC Press; 2005 : 219-220.
20. Hellquist H, Skalova A. Histopathology of the salivary glands. Berlin, Heidelberg: Springer Verlag; 2014.
21. Tonon G, Modi S, Wu L, et al. t(11;19)(q21;p13) translocation in mucoepidermoid carcinoma creates a novel fusion product that disrupts a Notch signaling pathway. Nat Genet 2003; 33(2): 208-213.
22. Okabe M, Miyabe S, Nagatsuka H, et al. MECT1-MAML2 fusion transcript defines a favorable subset of mucoepidermoid carcinoma. Clin Cancer Res 2006; 12(13): 3902-3907.
23. Seethala RR, Dacic S, Cieply K, Kelly LM, Nikiforova MN. A reappraisal of the MECT1/MAML2 translocation in salivary mucoepidermoid carcinomas. Am J Surg Pathol 2010; 34(8): 1106-1121.
24. Okumura Y, Miyabe S, Nakayama T, Fujiyoshi Y, Hattori H, Shimozato K, Inagaki H. Impact of CRTC1 ⁄ 3–MAML2 fusions on histological classification and prognosis of mucoepidermoid carcinoma. Histopathology 2011; 59(1): 90–97.
25. Fehr A, Röser K, Heidorn K, Hallas C, Löning T, Bullerdiek J. A new type of MAML2 fusion in mucoepidermoid carcinoma. Genes Chromosomes Cancer 2008; 47(3): 203-206.
26. Nakayama T, Miyabe S, Okabe M, et al. Clinicopathological significance of the CRTC3-MAML2 fusion transcript in mucoepidermoid carcinoma. Mod Pathol 2009; 22(12): 1575-1581.
27. Bell D, Luna MA, Weber RS, Kaye FJ, El-Naggar AK. CRTC1/MAML2 fusion transcript in Warthin’s tumor and mucoepidermoid carcinoma: evidence for a common genetic association. Genes Chromosomes Cancer 2008; 47(4): 309–314.
28. Fehr A, Roser K, Belge G, Löning T, Bullerdiek J. A closer look at Warthin tumors and the t(11;19). Cancer Genet Cytogenet 2008; 180(2): 135–139.
29. Skálová A, Vaněček T, Hauer L, et al. CRTC1-MAML2 and CRTC3-MAML2 fusions were not detected in metaplastic Warthin´s tumor and metaplastic pleomorphic adenoma of salivary glands. Am J Surg Pathol 2013; 37(11): 1743-1750.
30. García JJ, Hunt JL, Weinreb I, et al. Fluorescence in situ hybridization for detection of MAML2 rearrangements in oncocytic mucoepidermoid carcinomas: utility as a diagnostic test. Hum Pathol 2011; 42(12): 2001–2009.
31. Bell D, Holsinger CF, El-Naggar AK. CRTC1/MAML2 fusion transcript in central mucoepidermoid carcinoma of mandible—diagnostic and histogenetic implications. Ann Diagn Pathol 2010; 14(6): 396–401.
32. Barnes L, Eveson JW, Reichart P, Sidransky D, eds. World Health Organization Classification of Tumours: Pathology and Genetics of Head and Neck Tumours. Lyon: IARC Press; 2005 : 209–281.
33. Amit M, Binenbaum Y, Trejo-Leider L, et al. International collaborative validation of intraneural invasion as a prognostic marker in adenoid cystic carcinoma of the head and neck. Head Neck 2015; 37(7): 1038-1045.
34. Stenman G. Fusion oncogenes in salivary gland tumors: molecular and clinical consequences. Head Neck Pathol 2013; 7 Suppl 1: S12-S19.
35. Stenman G, Persson F, Andersson MK. Diagnostic and therapeutic implications of new molecular biomarkers in salivary gland cancers. Oral Oncol 2014; 50(8): 683-690.
36. Bell D, Hanna EY. Salivary gland cancers: biology and molecular targets for therapy. Curr Oncol Rep 2012; 14(2): 166-174.
37. Persson M, Andrén Y, Mark J, Horlings HM, Persson F, Stenman G. Recurrent fusion of MYB and NFIB transcription factor genes in carcinomas of the breast and head and neck. Proc Natl Acad Sci U S A 2009; 106(44): 18740-18744.
38. Simpson RH, Skálová A, Di Palma S, Leivo I. Recent advances in the diagnostic pathology of salivary carcinomas. Virchows Arch 2014; 465(4): 371-384.
39. Chenevert J, Duvvuri U, Chiosea S, et al. DOG1: a novel marker of salivary acinar and intercalated duct differentiation. Mod Pathol 2012; 25(7): 919–929.
40. Laco J, Svajdler M, Jr, Andrejs J, et al. Mammary analogue secretory carcinoma of salivary glands: a report of 2 cases with expression of basal/ myoepithelial markers (calponin, CD10 and p63 protein). Pathol Res Pract 2013; 209(3): 167-172.
41. Stevens TM, Kovalovsky AO, Velosa C, et al. Mammary analog secretory carcinoma, - low-grade salivary duct carcinoma, and mimickers: a comparative study. Mod Pathol 2015; 28(8): 1084-1100.
42. Reynolds S, Shaheen M, Olson G, Barry M, Wu J, Bocklage T. A case of primary mammary analog secretory carcinoma (MASC) of the thyroid masquerading as papillary thyroid carcinoma: potentially more than a one off. Head Neck Pathol. In press 2016.
43. Lannon CL, Martin MJ, Tognon CE, Jin W, Kim SJ, Sorensen PH. A highly conserved NTRK3 C-terminal sequence in the ETV6-NTRK3 oncoprotein binds the phosphotyrosine binding domain of insulin receptor substrate-1: an essential interaction for transformation. J Biol Chem 2004; 279(8): 6225-6234.
44. Chiosea SI, Griffith C, Assaad A, Seethala RR. Clinicopathological characterization of mammary analogue secretory carcinoma of salivary glands. Histopathology 2012; 61(3) :387–394.
45. Majewska H, Skalova A, Stodulski D, et al. Mammary analogue secretory carcinoma of salivary glands: a new entity associated with ETV6 gene rearrangement. Virchows Arch 2015; 466 (3): 245-254.
46. Skálová A, Vanecek T, Majewska H, et al. Mammary analogue secretory carcinoma of salivary glands with high-grade transformation: report of 3 cases with the ETV6-NTRK3 gene fusion and analysis of TP53, beta-catenin, EGFR, and CCND1 genes. Am J Surg Pathol 2014; 38(1): 23–33.
47. Skálová A, Vaněček T, Simpson RHW, et al. Mammary analogue secretory carcinoma of salivary glands: molecular analysis of 25 ETV6 gene rearranged tumors with lack of detection of classical ETV6-NTRK3 fusion transcript by standard RT-PCR: report of four cases harboring ETV6-X gene fusion. Am J Surg Pathol 2016; 40(1): 3-13.
48. Drilon A, Li G, Dogan S, et al. What hinds behind the MASC: Clinical response and acquired resistance to entrectinib after ETV6-NTRK3 identification in a mammary analogue secretory carcinoma (MASC). Annals Oncol Advance. In press 2016.
49. Milchgrub S, Gnepp DR, Vuitch F, Delgado R, Albores-Saavedra J. Hyalinizing clear cell carcinoma of salivary gland. Am J Surg Pathol 1994; 18(1): 74–82.
50. Michal M, Skálová A, Simpson RH, Rychterová V, Leivo I. Clear cell malignant myoepithelioma of the salivary glands. Histopathology 1996; 28(4): 309–315.
51. Skálová A, Weinreb I, Hyrcza M, et al. Clear cell myoepithelial carcinoma of salivary glands showing EWSR1 rearrangement. Molecular analysis of 94 salivary gland carcinomas with prominent clear cell component. Am J Surg Pathol 2015; 39(3): 338–348
52. Barnes L, Eveson JW, Reichart P, Sidransky D, eds. World Health Organization Classification of Tumours: Pathology and Genetics of Head and Neck Tumours. Lyon: IARC Press; 2005.
53. Antonescu CR, Katabi N, Zhang L, et al. EWSR1-ATF1 fusion is a novel and consistent finding in hyalinizing clear-cell carcinoma of salivary gland. Genes Chromosomes Cancer 2011; 50(7): 559–570.
54. Weinreb I. Translocation-associated salivary gland tumors: a review and update. Adv Anat Pathol 2013; 20(6): 367-377.
55. Bilodeau EA, Hoschar AP, Barnes EL, Hunt JL, Seethala RR. Clear cell carcinoma and clear cell odontogenic carcinoma: a comparative clinicopathologic and immunohistochemical study. Head Neck Pathol 2011; 5(2): 101-107.
56. Dardick I, Leong I. Clear cell carcinoma: review of its histomorphogenesis and classification as a squamous cell lesion. Oral Surg Oral Pathol Oral Radiol Endod 2009; 108(3): 399-405.
57. Shah AA, LeGallo RD, van Zante A, et al. EWSR1 genetic rearrangements in salivary gland tumors: a specific and very common feature of hyalinizing clear cell carcinoma. Am J Surg Pathol 2013; 37(4): 571–578.
58. Bilodeau EA, Weinreb I, Antonescu CR, et al. Clear cell odontogenic carcinomas show EWSR1 rearrangements: a novel finding & biologic link to salivary clear cell carcinomas. Mod Pathol 2012; 25 (Supplement 2s): 101 : 305A.
59. Bilodeau EA, Bilodeau EA, Weinreb I, et al. Clear cell odontogenic carcinomas show EWSR1 rearrangements: a novel finding and biological link to salivary clear cell carcinomas. Am J Surg Pathol 2013; 37(7): 1001-1005.
60. Stockman DL, Miettinen M, Suster S, et al. Malignant gastrointestinal neuroectodermal tumor: clinicopathologic, immunohistochemical, ultrastructural, and molecular analysis of 16 cases with a reappraisal of clear cell sarcoma-like tumors of the gastrointestinal tract. Am J Surg Pathol 2012; 36(6): 857–868.
61. Gru AA, Becker N, Pfeifer JD. Angiosarcoma of the parotid gland with a t(12;22) translocation creating a EWSR1-ATF1 fusion: a diagnostic dilemma. J Clin Pathol 2013; 66(5): 452–454.
62. Tanguay J, Weinreb I. What the EWSR1-ATF1 Fusion has taught us about hyalinizing clear cell carcinoma. Head and Neck Pathol 2013; 7(1): 28–34.
63. Simpson RWH, Skálová A, Di Palma S, Leivo I. Recent advances in the diagnostic pathology of salivary carcinomas. Virchows Arch 2014; 465(4): 371-384.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článok vyšiel v časopiseČesko-slovenská patologie

2016 Číslo 3-
Všetky články tohto čísla
- Novinky v patológii hlavy a krku
- S laureátkou Hlavovej ceny za rok 2016
- MONITOR aneb nemělo by vám uniknout, že...
- HPV-asociované karcinómy hlavy a krku: Aktualizácia poznatkov a odporúčania pre prax
- Novinky v molekulární diagnostice karcinomů slinných žláz: „translokační karcinomy“
- Poorly differentiated sinonasal tract malignancies: A review focusing on recently described entities
- Rozlišování různých typů dysplazie v Barrettově jícnu - první krok k harmonizaci gradingu
- Submukózny kalcifikujúci fibrózny tumor žalúdka – kazuistika
- Kazuistika: Diagnóza až pod mikroskopem - diseminovaná echinokokóza multilokulárního vzhledu s protoskolexy
- K životnému jubileu prof. MUDr. Štefana Kopeckého, PhD.
- Jaká je Vaše diagnóza?
- „Hassalloidné“ telieska v pľúcach u dieťaťa s epidermolysis bullosa junctionalis a s Bartovým syndrómom
- Jaká je Vaše diagnóza? Odpověď
- Dr. h. c. prof. MUDr. Štefan Galbavý, DrSc. 70-ročný
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Dr. h. c. prof. MUDr. Štefan Galbavý, DrSc. 70-ročný
- HPV-asociované karcinómy hlavy a krku: Aktualizácia poznatkov a odporúčania pre prax
- Poorly differentiated sinonasal tract malignancies: A review focusing on recently described entities
- Kazuistika: Diagnóza až pod mikroskopem - diseminovaná echinokokóza multilokulárního vzhledu s protoskolexy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



