-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Difúzní obrovskobuněčný tumor šlachových pochev krční páteře s destrukcí obratle C6 - kazuistika
Diffuse tenosynovial giant cell tumor of the cervical spine destroying vertebra C6 - a case report
Presented is a case of 59-year-old woman with longstanding neck pain who has been promptly operated for spinal cord compression. Imaging studies disclosed ill-defined cervical paravertebral soft tissue mass at the level of vertebra C5/6 abutting left-sided intervertebral joint and destroying neighboring both vertebral arch and processus spinosus. Submitted specimen was interpreted as a possible metastatic skeletal process by clinicians and referring pathologist favored diagnosis of giant cell tumor/osteoclastoma of the bone. Microscopic features were consistent with giant cell lesion where uniform mononuclear mosaic stromal component dominated the unevenly distributed loose clusters of osteoclast-like giant cells frequently imparting appearance of peculiar pseudoalveolar spaces. Additionally, alternating geographic xanthomatous and densely hyalinized/ osteoid-like zones with speckled, coarsely granular haemosiderin pigment completed the variegated structural composition. The tumor infiltrated adjacent striated muscles; either original bone structures and/or extracellular matrix deposits were not identified. Immunohistochemical stains with p63, SATB2, desmin, EMA, clusterin and S100protein turned out to be completely negative. FISH analysis revealed no rearrangement of CSF1 gene. The diagnosis of the diffuse tenosynovial giant cell tumor was rendered.
Keywords:
bone – diffuse tenosynovial giant cell tumor – cervical spine – tendon sheath – intervertebral joint
Autoři: Zdeněk Kinkor 1; Tomáš Svoboda 2; Petr Grossman 1; David Bludovský 3; Filip Heidenreich 4; Andrej Švec 5; Iveta Mečiarová 6
Působiště autorů: Bioptická laboratoř s. r. o., Šiklův ústav patologie, LF UK, Plzeň 1; Onkologická klinika, FN a LF UK, Plzeň 2; Neurochirurgická klinika, FN a LF UK, Plzeň 3; Klinika zobrazovacích metod, FN a LF UK, Plzeň 4; Ortopedická klinika, Univerzitná nemocnica Akademika Dérera, Bratislava 5; Alfa Medical Patológia, FN Ružinov, Bratislava 6
Vyšlo v časopise: Čes.-slov. Patol., 52, 2016, No. 4, p. 218-221
Kategorie: Původní práce
Souhrn
Popisován je případ padesátidevítileté ženy s tumorózní expanzí převážně v měkkých tkáních oblasti C5/6 krční páteře s destrukcí obratlového oblouku C6 a útlakem durálního vaku. Konzultující patolog favorizoval diagnózu primárního kostního tumoru typu obrovskobuněčného kostního nádoru. Mikroskopický obraz odpovídal obrovskobuněčné lézi s převažující pravidelnou mononukleární stromální složkou, nerovnoměrně rozloženými vícejadernými elementy napodobujícími osteoklasty a mapovitými xantogranulomatózními infiltráty, včetně všudypřítomného drobně hrudkovitého hemosiderinového pigmentu. Nečekané pak byly doprovodné oblasti pokročilé hyalinní fibrózy společně s nezvyklými a matoucími pseudoalveolárními formacemi, které zastíraly původní charakteristický projev. Nádor se šířil neohraničeně do okolní příčně pruhované svaloviny, známky produkce extracelulární matrix či struktury původního skeletu nebyly nalezeny. Imunohistochemické vyšetření s markery p63, SATB2, desmin, EMA, clusterin a S100 protein bylo kompletně negativní; metodou FISH nebyl prokázán zlom genu CSF1. Proces byl definitivně hodnocen jako difúzní obrovskobuněčný tumor šlachové pochvy.
Klíčová slova:
krční páteř – obratel – difúzní obrovskobuněčný tumor šlachových pochev – obrovskobuněčný kostní tumor
Obrovskobuněčný tumor šlach a aponeuróz/tenosynoviální obrovskobuněčný tumor (TOT) je relativně častá, histogeneticky nejasná léze, mající dva hlavní klinicko-patologické projevy. První a nejběžnější je nález ohraničeného tumoru v okolí interfalangeálních kloubů rukou či nohou bez anatomické souvislosti se synoviální výstelkou. Druhou, vzácnější formou je čistě nitrokloubní proces, který většinou difúzně a rozsáhle prostupuje synovii a mnohdy vede k úplné obliteraci kloubní štěrbiny s omezením pohybu a deformací původního anatomického postavení kloubu. I přes odlišnou makroskopickou manifestaci jsou oba procesy a priori benigní a vznik malignity na pozadí, vesměs difúzního TOT, je vzácností; raritou pak je metastázování histologicky benigního TOT (1-6). Rearanže genu CSF1 - t(1;2)(COL6A3-CSF1), společná oběma klinickým podobám léze, ukazuje, že se jedná o totožný nádorový proces zahrnující i dříve nepřesně vykládanou tzv. pigmentovou vilonodulární synovitidu (PVS) (7-9). Až na výjimky (absence obrovských vícejaderných buněk, pseudoangiomatózní uspořádání mononukleární stromální složky atd.) konzistentní histologický obraz a charakteristická topografie tumoru nečiní patologům větší diagnostické problémy. Předkládáme ojedinělý případ difúzního, agresivně rostoucího TOT krční páteře s destrukcí obratle, který byl zpočátku mylně pokládán za primární obrovskobuněčný tumor kosti (OBN).
MATERIÁL A METODIKA
Materiál byl fixován v 10% formolu a zalit do parafínu (FFPE); pro barvení hematoxylinem eozinem a molekulární analýzu byly krájeny řezy silné 2 mm, pro imunohistochemické vyšetření (IHC) řezy silné 4 mm. IHC vyšetření bylo prováděno elektronicky nastaveným protokolem v automatu BenchMark ULTRA, VENTANA/Roche. K vizualizaci reakce byl použit diaminobenzidin tetrahydrochlorid, k dobarvení jader metylénová modř.
Použity byly protilátky S100protein (Dako, polyklonální, předředěno), SATB2 (Sigma-Aldrich, polyklonální, ředění 1 : 100), p63 (Ventana, 4A3, předředěno), EMA (Dako, E29, ředění 1 : 400), desmin (Dako, D33, předředěno) a clusterin (Biocare Medical, 41D, ředění 1 : 100).
Analýza zlomu genu CSF1 v oblasti 1p13.3 fluorescenční in situ hybridizací (FISH) byla provedena standardním postupem na FFPE řezu s fluorescenčně značenou oligo „break apart“ sondou (SureFISH, DAKO/Agilent Technologies, Santa Clara, USA) vyrobené podle vlastního návrhu. Hranice pozitivity (cut-off) 10 % byla stanovena na vlastní kontrolní skupině.
VLASTNÍ POZOROVÁNÍ
Padesátidevítiletá žena s několikaměsíční anamnézou bolestí krční páteře byla operována pro náhle vzniklou míšní kompresi v oblasti C5/6. CT vyšetření ukázalo tumorózní expanzi v úrovni C5/6, vycházející z levé části oblouku C6; vyšetření MRI popisuje měkkotkáňovou solidní infiltraci postihující levostranný oblouk a pedikl obratlů C5/6 s propagací do processus spinosus a transversus (obr. 1, 2). Postižen je i levý intervertebrální kloub C5/6 s celkovou velikostí nádorové expanze cca 30 x 28 x 16 mm. Léze se propaguje mediálně do páteřního kanálu, který příčně zužuje na 12,5 mm a dochází k posunutí durálního vaku do pravé poloviny kanálu.
Obr. 1. Neostře ohraničená, měkkotkáňová tumorózní expanze v úrovni C5/6, rozrušující levostranný meziobratlový kloub, obratlový oblouk a processus spinosus obratle C6 (CT). 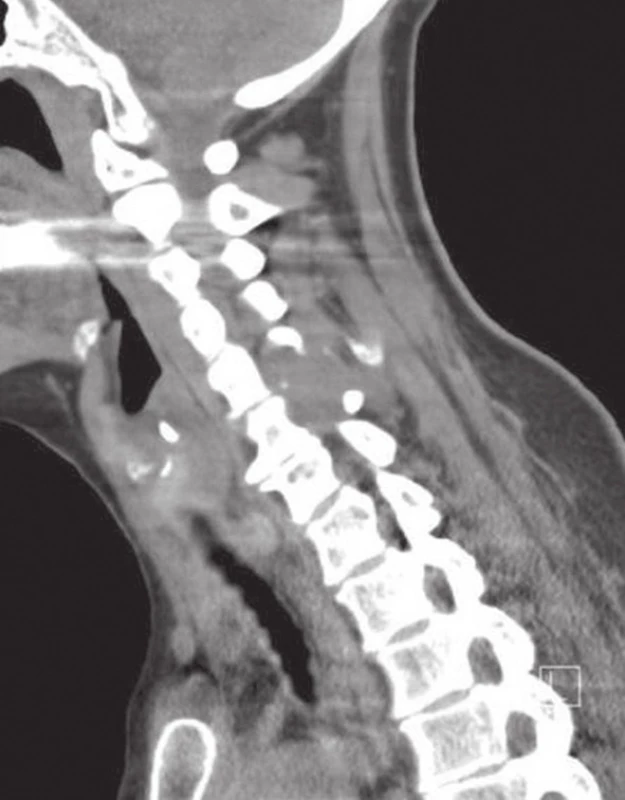
Obr. 2. Agresívně rostoucí tumor s pokročilou destrukcí levostranného oblouku obratle C6 a expanzí do extradurálního prostoru páteřního kanálu (MRI). 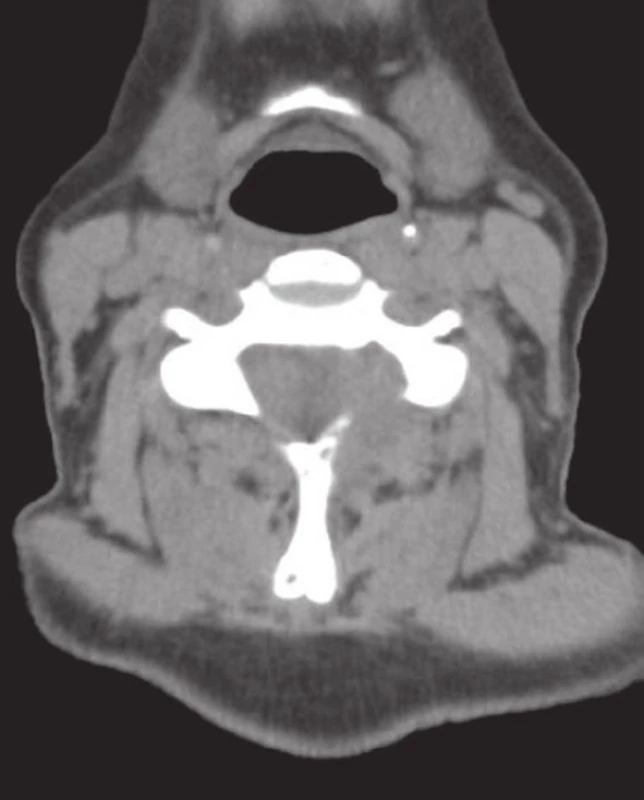
Žádanka na histologické vyšetření byla zaslána s diagnózou v.s. metastatická infiltrace obratlů C5/6. Materiál objemu cca 3 cm3 tvořilo makroskopicky několik nepřehledných tkáňových fragmentů šedobéžové až narezlé barvy, které byly zpracovány celé ve třech blocích. Při krájení nůž „neskřípal“ a tkáň nebyla odvápňována. Konzultující patolog uvádí diagnózu OBN obratle.
V mikroskopickém obraze převládaly partie difúzně mozaikovitě uspořádaných, blandně vyhlížejících, uniformních oválných stromálních elementů, které pouze místy doprovázely nerovnoměrně rozptýlené obrovské vícejaderné buňky typu osteoklastů, nacházejících se izolovaně či v drobných skupinkách (obr. 3, 4). Buněčné atypie ani nekróza se nevyskytovaly, mitotická aktivita byla ojedinělá a pravidelná. Některé oblasti provázela rozsáhlá intenzívní fibróza/hyalinóza (obr. 5), jinde se naopak kompaktní buněčná populace rozvolňovala, což nezřídka vedlo ke tvorbě pseudoalveolárních resp. primitivních pseudoangiomatózních prostor (obr. 6). Disperzně byla patrna drobně hrudkovitá depozita hemosiderinového pigmentu. Celkovou kompozici léze doplňovaly náhodně rozložené, rozlehlé pasáže xantogranulomatózního infiltrátu s pravidelnou lymfocytární příměsí (obr. 7). Výjimečným nálezem byly dvě izolované, opticky prázdné štěrbiny přesvědčivě lemované plochými až kubickými pigmentovanými buňkami, které intenzívně připomínaly rezidua původní kloubní synoviální výstelky (obr. 8). Původní skelet či novotvořená kostní/chrupavčitá matrix nebyly zastiženy, na periferii procesu pak bylo zjevné šíření do přilehlé příčně pruhované svaloviny. Typické rysy OBN nebyly přítomné.
Obr. 3. Převládající difúzní mozaikovitá, uniformní mononukleární stromální složka s roztroušeným hrudkovitým hemosiderinovým pigmentem (HE, 200x). 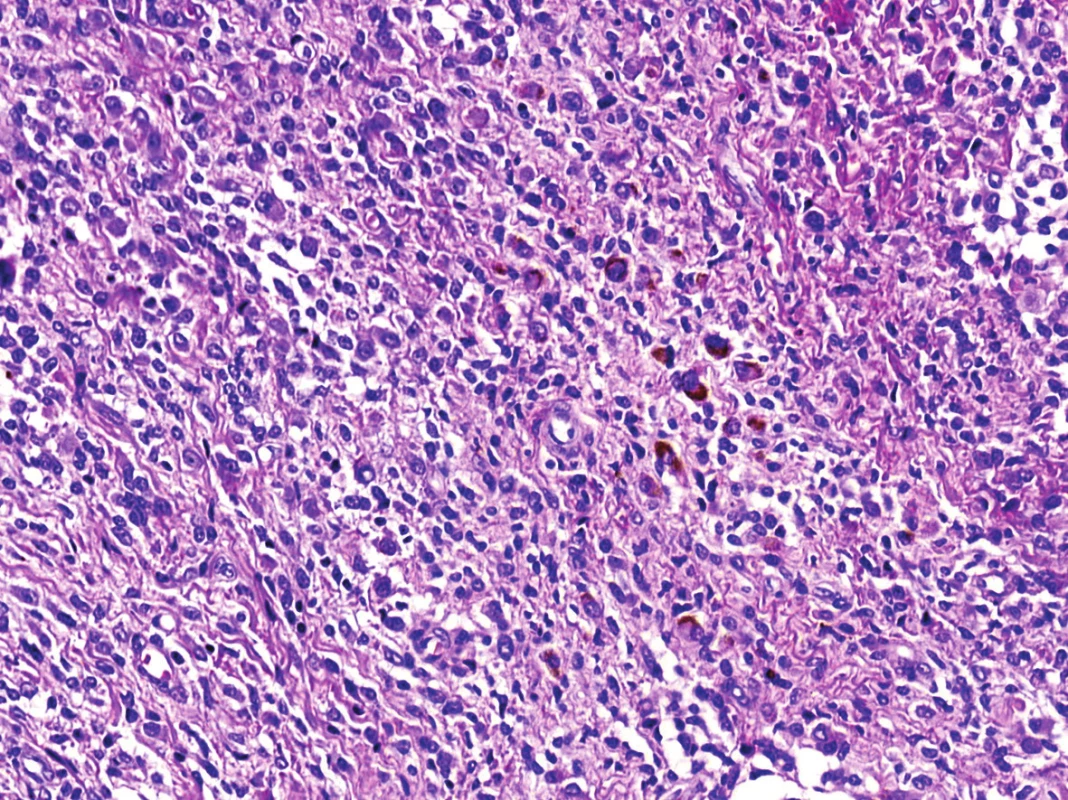
Obr. 4. Nerovnoměrně rozptýlené, osteoklastům podobné, vícejaderné elementy se nacházely samostatně či v drobných rozvolněných skupinkách (HE, 200x). 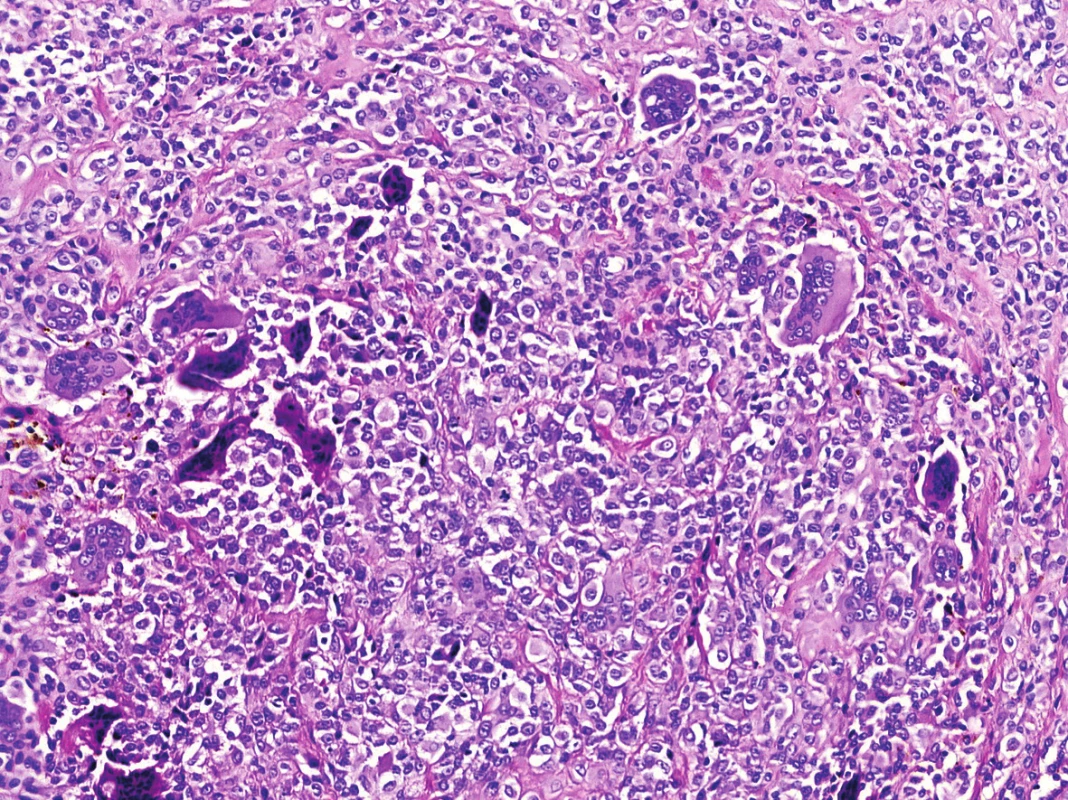
Obr. 5. Oblasti pokročilé fibrózní hyalinizace s úbytkem nádorové populace zastírající původní vzhled nádoru (HE, 200x). 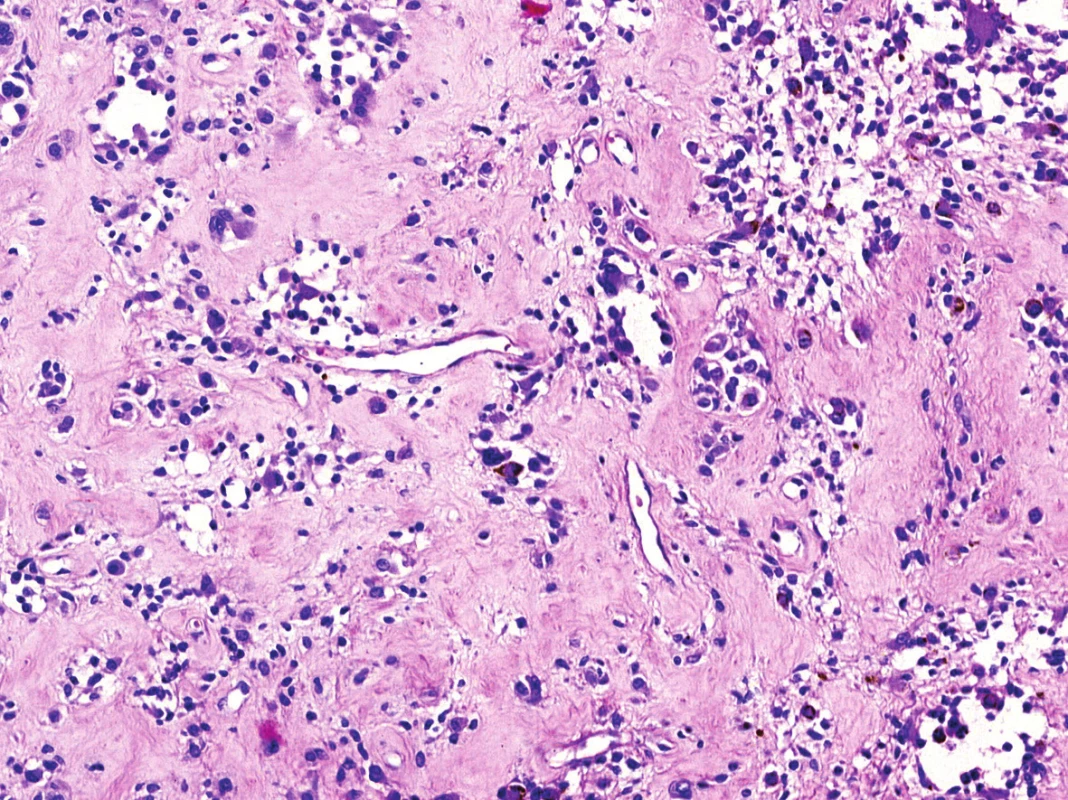
Obr. 6. Nezvyklé rozvolnění původní kompaktní buněčné skladby s tvorbou nápadných pseudoalveolárních/pseudoangiomatózních formací (HE, 200x). 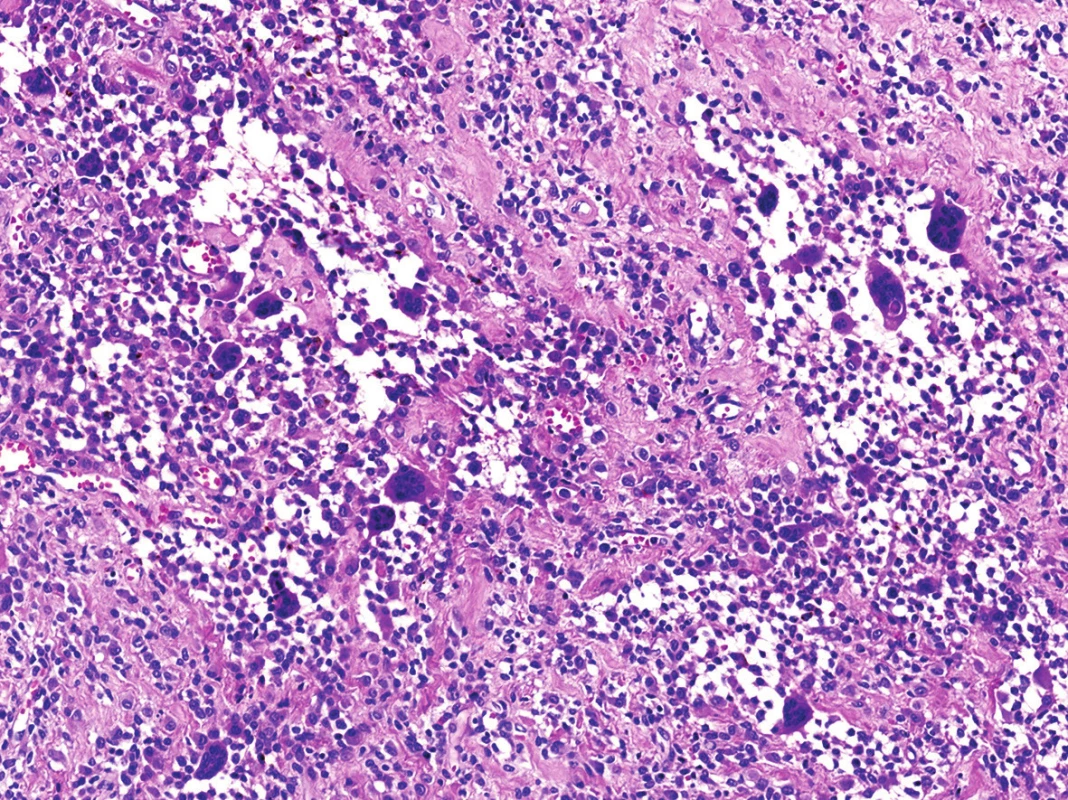
Obr. 7. Mapovité xantogranulomatózní pasáže dotvářely celkovou kompozici léze (HE, 200x). 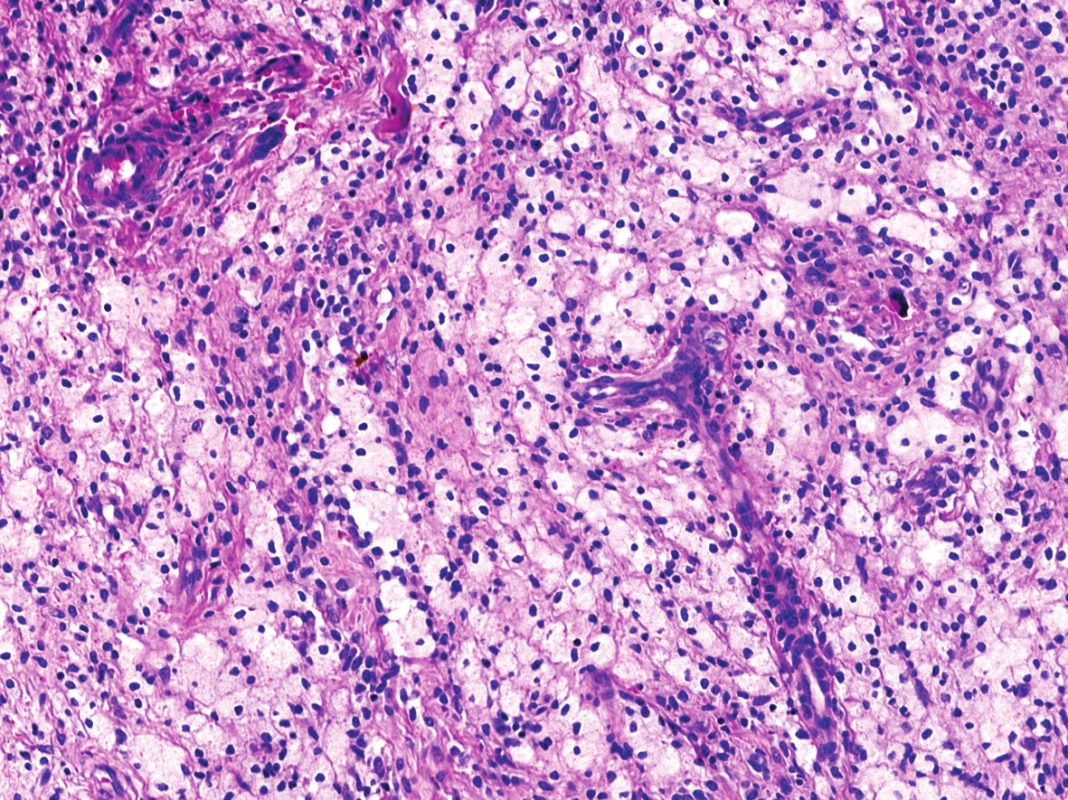
Obr. 8. Náhodně zastižené, dva osamocené štěrbinovité prostory s plochou pigmentovanou výstelkou připomínající původní kloubní synovii (HE, 200x). 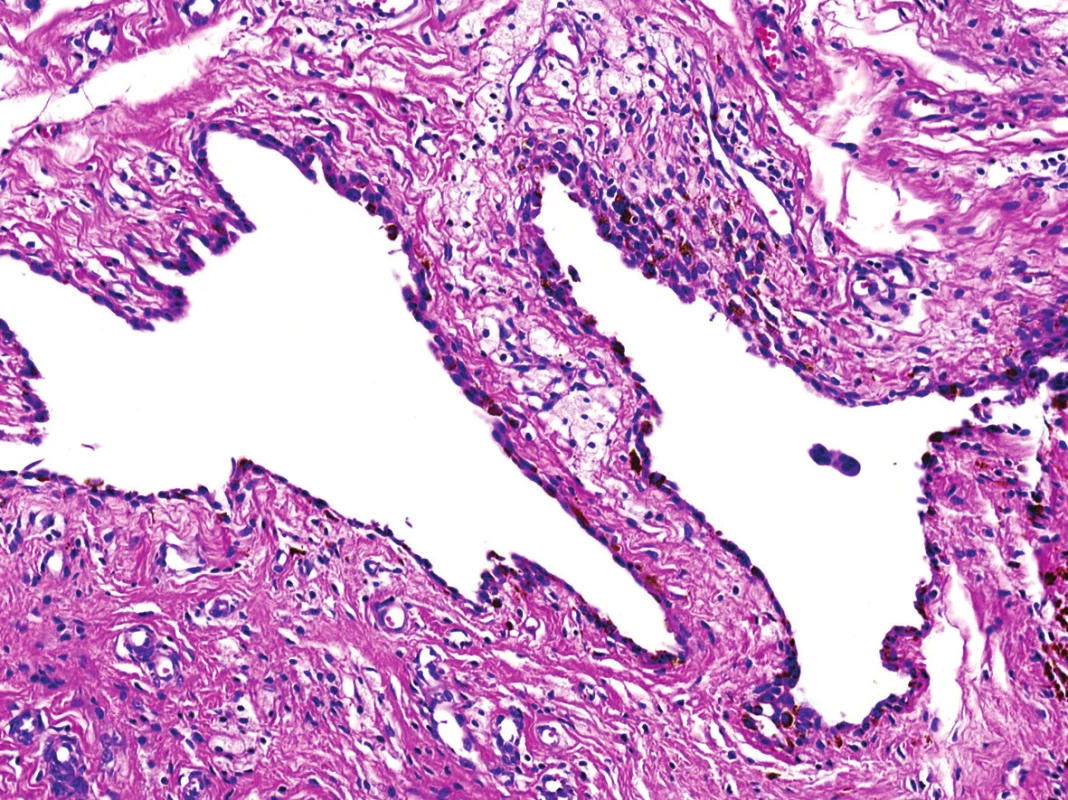
IHC vyšetření s markery p63, SATB2, desmin, EMA, S100 protein, clusterin bylo kompletně negativní, FISH analýza neprokázala zlom genu CSF1.
Nález byl nakonec uzavřen jako difúzní, agresivně rostoucí tenosynoviální obrovskobuněčný tumor bez zřejmých cytomorfologických rysů malignity; původ v intervertebrálním kloubu je možný.
DISKUZE
Diagnostika TOT v ortotopické lokalizaci okolí malých kloubů ruky/nohy nebo synoviální výstelce velkých nosných kloubů apendikulárního skeletu je snadná. Výjimkou jsou situace, kdy charakteristická skladba a rozložení obrovskobuněčné a stromální komponenty schází - např. úplné vymizení vícejaderných buněk či nezvyklé a zavádějící pseudovaskulární uspořádání mononukleární stromální složky (viděli jsme difúzní TOT v oblasti Achillovy šlachy původně diagnostikovaný jako angiosarkom!?). V těchto případech se vyplatí pátrat po menšinových archetypálních oblastech a důležitou roli určitě hraje i míra zkušenosti a představivosti. Přestože existují zprávy o užitečnosti „specifického imunofenotypu“ při odpovídajícím morfologickém kontextu (například exprese desminu či clusterinu), naše vlastní zkušenost to bohužel nepotvrzuje (10). Opravdovým úskalím je pak sporadický výskyt TOT v nečekaných místech, kde k nejčastěji zmiňovaným se řadí páteř a temporomandibulární kloub (11-17). Zde je pravidelně (často difúzní) TOT mylně vnímán jako primárně kostní proces a nesprávně interpretován škálou obrovskobuněčných lézí - např. OBN, aneuryzmatická kostní cysta (AKC) či osteoblastom. Paradoxem však je, že diagnostické pochybení zde a priori nemusí být vždy klinicky/biologicky relevantní. TOT v těchto místech roste převážně neohraničeně a intimní anatomické souvislosti často neumožní úplné odstranění tumoru; topografie recidiv je pak spojena s nepříjemnou morbiditou (kosmetická mutilace či neurologické výpadky).
Diferenciální diagnostika nejčastějších obrovskobuněčných lézí obratlů se soustředí zejména na OBN a AKC. Přestože OBN typicky postihuje obratlové tělo a AKC obratlový oblouk, u větších a pokročilejších procesů ani pečlivá radiologická korelace nemusí s jistotou rozlišit přesně místo vzniku; též značná expanze do okolních měkkých tkání není výjimkou u žádné z nich. Klíčové morfologické rysy OBN - např. rovnoměrné rozložení početných vícejaderných buněk, absence extracelulární matrix či mozaikový vzhled monotypických oválných stromálních elementů nemají absolutní platnost a solidní partie AKC mohou vypadat obdobně. Naopak obrovské buňky vzhledu osteoklastů jsou v TOT menšinovou součástí, většinou nerovnoměrně/nahodile rozptýlené a mnohdy doprovázené zvláštním místním rozvolněním stromální komponenty lakunární či pseudovaskulární podoby. Prakticky všudypřítomné jsou zde mapovitě včleněné xantogranulomatózní infiltráty a roztroušený příznačný, hrubě korpuskulární, hemosiderinový pigment. V probatorních limitovaných biopsiích zdánlivě patognomonické obrazy však ztrácejí absolutní platnost a může pomoci molekulární analýza. Např. OBN či chondroblastom jsou definovány mutací H3F3A resp. H3F3B a pro AKC je určující rearanže t(16;17) (CDH11-USP6); limitující stránkou však zůstává poškození DNA nestandardním/nešetrným odvápněním tkáně (18,19). Je příznačné, že v obou jmenovaných procesech je genetická aberace omezena pouze na stromální součást a účast osteoklastů je pokládána za nenádorovou reaktivní příměs. Totožný patogenetický scénář platí pro TOT, kde u více než poloviny případů byla zjištěna translokace t(1;2) (COL6A3-CSF1) (7-9). Zde dokonce k přeskupení genu CSF1 dochází pouze u menšiny stromálních buněk a veškerá zbývající „nádorová“ populace je považována jen za reaktivní součást (7). To vysvětluje i fakt IHC detekce CSF1 proteinu pouze v elementech s uvedeným molekulárním defektem; všechna další buněčná skladba naopak exprimuje pouze receptor CSF1 (CSF1-R) (9). Existence významné menšiny translokačně negativních/IHC CSF1-pozitivních případů (cca 40 %) poukazuje i na možné alternativní patogenetické mechanizmy aktivace CSF1. Je již zjevné, že způsob růstu TOT (lokalizovaný vs. difúzní) ani možné agresívní chování se u CSF1 wt lézí neliší (8). Nadějné jsou pak první zprávy o biologické terapii TOT zacílené na interakci CSF1/CSF1-R buď formou malých molekul (imatinib mesylát) či protilátek (emactuzumab), kdy došlo k výrazné regresi či stabilizaci tumoru (včetně raritních metastáz) bez ohledu na zjištěný molekulární profil (20-23).
Diagnostika TOT v neočekávaných lokalizacích není jednoduchá, především pro matoucí morfologickou podobnost s běžnějšími obrovskobuněčnými procesy; velká opatrnost je na místě zejména v případech intimní souvislosti se skeletem. Přesné zhodnocení histologických detailů, expertní zkušenost a kompetentní klinicko-radiologickou korelaci může nově doplnit IHC či molekulární analýza na úrovni CSF1/CSF1-R, resp. CSF1. Správná diagnóza agresívních případů TOT v anatomicky komplikovaných a chirurgicky obtížně přístupných místech má potenciál efektivní biologické léčby.
PODĚKOVÁNÍ
Autoři děkují prim. MUDr. Petrovi Mukenšnáblovi, Ph.D. za zhotovení mikrofotografií a Mgr. Vratislavu Šedivcovi za laboratorně technologickou asistenci.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
Doc. MUDr. Zdeněk Kinkor, Ph.D.
Bioptická laboratoř s.r.o.,
Mikulášské nám. 4
326 00 Plzeň
tel.: +420 737 220 449
e-mail: kinkor@medima.cz
Zdroje
1. Bertoni F, Unni, Beabout JW, Sim FH. Malignant giant cell tumor of the tendon sheath and joint (malignant pigmented villonodular synovitis). Am J Surg Pathol 1997; 21 : 153-163.
2. Bhadra AK, Pollock R, Tirabosco RP, Skinner JA et al. Primary tumors of the synovium. A report of four cases of malignant tumor. J Bone Joint Surg Br 2007; 89 : 1504-1508.
3. Li CF, Wang JW, Huang WW, Hou CC et al. Malignant diffuse-type tenosynovial giant cell tumors: a series of 7 cases comparing with 24 benign lesions with review of the literature. Am J Surg Pathol 2008; 32 : 587-599.
4. Imakiire N, Fujimo T, Morii T, Honya K et al. Malignant pigmented villonodular synovitis in the knee - report of a case with rapid clinical progression. Open Orthop J 2011; 7 : 13-16.
5. Asano N, Yoshida A, Kobayashi E, Yamaguchi T et al. Multiple metastases from histologically benign intraarticular diffuse-type tenosynovial giant cell tumor: a case report. Hum Pathol 2014; 45 : 2355-2358.
6. Righi A, Gambarotti M, Sbaraglia M, Frisoni T et al. Metastasizing tenosynovial giant cell tumor, diffuse-type/pigmented villonodular synovitis. Clin Sarcoma Res 2015; 5 : 15.
7. West RB, Rubin BP, Miller MA, Subramanian S et al. A landscape effect in tenosynovial giant cell tumor from activation of CSF1 expression by translocation in a minority of tumor cells. PNAS 2006; 103 : 600-605.
8. Cupp JS, Miller MA, Montgomery KD, Nielsen TO et al. Translocation and expression of CSF1 in pigmented villonodular synovitis, tenosynovial giant cell tumor, rheumatoid arthritis and other reactive synovitides. Am J Surg Pathol 2007; 31 : 970-976.
9. Moller E, Mandahl N. Mertens F, Panagopoulos I. Molecular identification of COL6A3-CSF1 fusion transcripts in tenosynovial giant cell tumors. Genes Chromosomes Cancer 2008; 47 : 21-25.
10. Boland JM, Folpe AL, Hornick JL, Grogg KL. Clusterin is expressed in normal synoviocytes and in tenosynovial giant cell tumors of localized and diffuse types: diagnostic and histogenetic implications. Am J Surg Pathol 2009; 33 : 1225-1229.
11. Dingle SR, Flynn JC, Stewart G. Giant cell tumor of the tendon sheath involving the cervical spine. A case report. J Bone Joint Surg Am 2002; 84A: 1664-1667.
12. Furlong MA, Motamedi K, Laskin WB, Vinh TN et al. Synovial-type giant cell tumors of the vertebral column: a clinicopathologic study of 15 cases with a review of the literature and discussion of the differential diagnosis. Hum Pathol 2003; 34 : 670-679.
13. Teixeira WG, Lara NA Jr., Narazaki DK, de Oliveira et al. Giant-cell tumor of the tendon sheath in the upper cervical spine. J Clin Oncol 2012; 30: e250-253.
14. Wang K, Zhu B, Yang S, Liu Z et al. Primary diffuse-type tenosynovial giant cell tumor of the spine: a report of 3 cases ad systemic review of the literature. Turk Neurosurg 2014; 24 : 804-814.
15. Wong JJ, Phal PM, Wiesenfeld D. Pigmented villonodular synovitis of the temporomandibular joint: a radiologic diagnosis and case report. J Oral Maxillofac Surg 2012; 70 : 126-134.
16. Bredell M, Schucknecht B, Bode-Lesniewska B. Tenosynovial, diffuse type giant cell tumor of the temporomandibular joint, diagnosis and management of a rare tumor. J Clin Med Res 2015; 7 : 262-266.
17. Qin JR, Jin L, Li KL, Zhang SS et al. Diffuse-type giant cell tumor of the tendon sheath in the temporal region incidentally diagnosed due to a temporal tumor: A report of two cases and review of the literature. Oncol Lett 2015; 10 : 1179-1183.
18. Cleven AH, Hocker S, Briaire-de Bruijn I, Szuhai K et al. Mutation analysis of H3F3A and H3F3B as a diagnostic tool for giant cell tumor of bone and chondroblastoma. Am J Surg Pathol 2015; 39 : 1576-1583.
19. Oliveira AM, Chou MM. USP6-induced neoplasms: the biologic spectrum of aneurysmal bone cyst and nodular fasciitis. Hum Pathol 2014; 45 : 1-11.
20. Blay JY, EL Sayadi H, Thiesse P, Garret J et al. Complete response to imatinib in relapsing pigmented villonodular synovitis/tenosynovial giant cell tumor. Ann Oncol 2008; 19 : 821-822.
21. Ravi V, Wang WL, Lewis VO. Treatment of tenosynovial giant cell tumor and pigmented villonodular synovitis. Curr Opin Oncol 2011; 23 : 361-366.
22. Cassier PA, Gelderblom H, Stacchiotti S, Thomas D et al. Efficacy of imatinib mesylate for the treatment of locally advanced and/or metastatic tenosynovial giant cell tumor/pigmented villonodular synovitis. Cancer 2015; 118 : 1649-1655.
23. Cassier PA, Italiano A, Gomez-Roca CA, Le Tourneau C et al. CSF1R inhibition with emactuzumab in locally advanced diffuse-type tenosynovial giant cell tumor of the soft tissue: a dose-escalation and dose-expansion phase 1 study. Lancet Oncol 2015; 16 : 949-956.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článok vyšiel v časopiseČesko-slovenská patologie

2016 Číslo 4-
Všetky články tohto čísla
- Mutace genů BRCA ... i co dalšího život patologům dal a vzal
- Nikdo by neměl podléhat iluzi, že to bez něj dál nepůjde
- MONITOR - aneb nemělo by vám uniknout že ...
- BRCA1 a BRCA2 – patologův startovní balíček
- Problematika mutací BRCA z klinického pohledu
- Onkopatologické aspekty inaktivace genů BRCA1 a BRCA2 v nádorech ovaria, děložní tuby a pánevního peritonea
- Karcinomy prsu u nosiček mutací BRCA 1/2
- Vyšetření mutací genů BRCA1 a BRCA2 v nádorových tkáních – možnosti a limitace
- Prof. MUDr. Blahoslav Bednář, DrSc. – 100 let od narození
- Světlobuněčný sarkom vulvy. Kazuistika
- MONITOR - aneb nemělo by vám uniknout že ...
- Difúzní obrovskobuněčný tumor šlachových pochev krční páteře s destrukcí obratle C6 - kazuistika
- Bazocelulárny karcinóm kože so zmiešaným histomorfologickým obrazom: porovnávacia štúdia
- Zemřel neurohistolog a neuropatolog prof. MUDr. Stanislav Němeček, DrSc. (4. 11. 1931 – 17. 8. 2016)
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Vyšetření mutací genů BRCA1 a BRCA2 v nádorových tkáních – možnosti a limitace
- Difúzní obrovskobuněčný tumor šlachových pochev krční páteře s destrukcí obratle C6 - kazuistika
- BRCA1 a BRCA2 – patologův startovní balíček
- Karcinomy prsu u nosiček mutací BRCA 1/2
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



