-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Jaká je Vaše diagnóza?
Odpověď
Vyšlo v časopise: Čes.-slov. Patol., 53, 2017, No. 2, p. 102-103
Kategória: Jaká je vaše diagnóza?
VRETENOBUNKOVÝ RABDOMYOSARKÓM
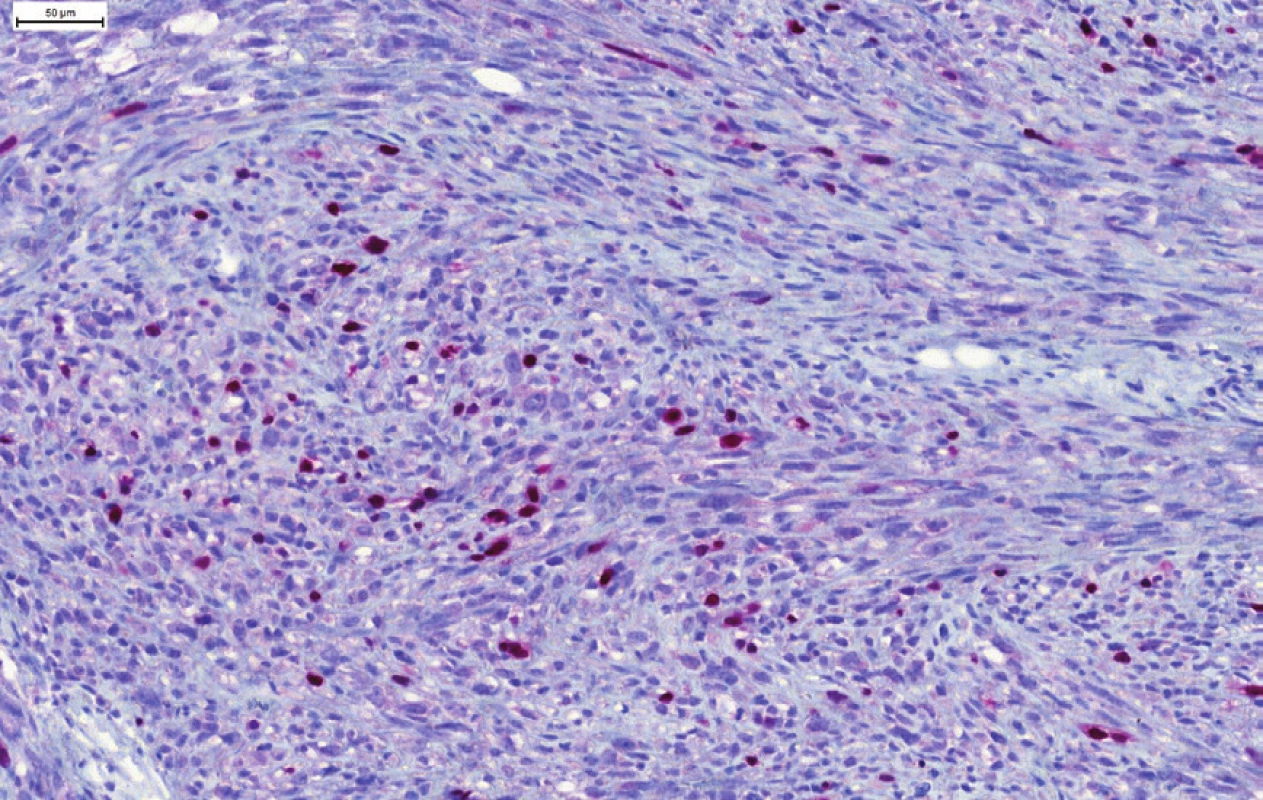
Vzhľadom na ložiskovú pozitívnu expresiu hladkosvalového aktínu a dezmínu bola na prvom mieste zvažovaná diagnóza leiomyosarkómu (LMS) s aberantnou, ale v LMS bežne popisovanou pozitivitou cytokeratínov (1,2). Diagnózu LMS však nepodporovala negativita h-caldesmonu, ktorý je považovaný za najšpecifickejší marker hladkosvalovej diferenciácie (3-6). Preto bolo doplnené vyšetrenie markerov rabdomyoblastickej diferenciácie myogenínu a MyoD1. V oboch prípadoch sme v nádorových bunkách dokázali pozitívnu expresiu (MyoD1 > myogenin, obr. 4 a 5) a nádor bol klasifikovaný ako vretenobunkový rabdomyosarkóm (RMS).
Vretenobunkový RMS (SC-RMS) bol prvý krát popísaný v roku 1992 (7). Spolu s jeho variantom, sklerozujúcim RMS (SCL-RMS), popísaným v roku 2000 (8), je v poslednej WHO klasifikácii nádorov mäkkých tkanív vyčlenený ako samostatný podtyp RMS (spindle cell/sclerosing rhabdomyosarcoma) (9). Ide o vzácny tumor, ktorý tvorí iba približne 5-10 % všetkých prípadov RMS (9). Postavenie tejto skupiny nádorov vzhľadom k ostatným podtypom RMS bolo až donedávna nejednoznačné. Fúzie génov PAX3 - a PAX7-FOXO1, typické pre alveolárny RMS sa v SC-RMS nevyskytujú (10,11) a aj preto bol spočiatku SC-RMS považovaný skôr za podtyp embryonálneho RMS. V SC/SCL-RMS však boli dokázané mutácie v géne MYOD1 (často s koexistujúcou mutáciou PIK3CA), ktoré v embryonálnom ani alveolárnom RMS dokázané neboli. To svedčí pre spoločnú patogenézu SC/SCL-RMS a podporuje klasifikáciu v rámci samostatnej podskupiny RMS (11-14). Geneticky sa však nejedná o homogénnu jednotku, keďže väčšina kongenitálnych / infantilných SC-RMS je (na rozdiel od prípadov u starších detí a dospelých) charakterizovaná fúziami zahŕňajúcimi gény VGLL2 alebo NCOA2 (15,16).
Diagnóza SC-RMS môže byť ťažká, pretože môže výrazne pripomínať iné vretenobunkové lézie, napr. LMS, malígny „peripheral nerve sheath tumor“ (MPNST), vretenobunkový melanóm, alebo „fibrosarkóm“. Sklerozujúca varianta má navyše výrazne hyalinizovanú strómu a pseudovaskulárny spôsob rastu, čím môže pripomínať osteosarkóm, chondrosarkóm, alebo angiosarkóm (17). Imunohistochemicky je SC-RMS okrem dezmínu často pozitívny aj pri dôkaze hladkosvalového aktínu, čo môže viesť k nesprávnej diagnóze LMS (18,19). Vďaka možnej pozitívnej expresii keratínov, EMA, CD117 alebo TLE-1 môže byť SC-RMS zamenený aj za vretenobunkový karcinóm, gastrointestinálny stromálny tumor, alebo synoviálny sarkóm (12,18,20). V ojedinelých prípadoch môže byť v SC-RMS prítomná aberantná imunoexpresia WT-1 a CD99 (10,19). Expresia S100 proteínu, GFAP a h-caldesmonu sú v SC-RMS konzistentne negatívne (12,18,19,21).
Kľúčom k správnej diagnóze môže byť prítomnosť ojedinelých, alebo difúzne roztrúsených rabdomyoblastov a ojedinele aj buniek s priečnym pruhovaním, ktoré však v nádore nemusia byť vôbec prítomné (v našom prípade sme rabdomyoblastickú diferenciáciu nenašli) (18,13,22). Nenahraditeľnú úlohu preto zohráva imunohistochemické vyšetrenie a dôkaz nukleárnych myogénnych transkripčných faktorov myogenínu (myf-4) (často iba fokálna pozitivita) a MyoD1 (vo väčšine prípadov difúzna pozitivita) (22).
Prognóza SC/SCL-RMS je závislá od veku pacienta, lokalizácie a prítomnej genetickej aberácie. V detskom veku sa často jedná o paratestikulárne lokalizované nádory, s prezentáciou v skoršom štádiu a veľmi dobrou prognózou (7,23). U dospelých ide o nádory s variabilnou lokalizáciou, najčastejšie v oblasti hlavy a krku a s výrazne horšou prognózou (18). Podľa nedávnej analýzy deviatich po sebe následujúcich štúdií Children’s Oncology Group nemali vretenobunkové RMS výrazne lepšiu prognózu ako embryonálne RMS (24). Táto analýza však nezohľadňovala genetické pozadie SC/SCL-RMS. Podľa najnovších prác majú nádory s fúziami zahŕňajúcimi gény VGLL2 alebo NCOA2 excelentnú prognózu, zatiaľ čo nádory s mutáciou MYOD1 sú asociované so skorým metastázovaním a úmrtím väčšiny pacientov (11,14).
Zdroje
1. Miettinen M. Immunoreactivity for cytokeratin and epithelial membrane antigen in leiomyosarcoma. Arch Pathol Lab Med 1998; 112(6): 637–640.
2. Iwata J, Fletcher CD. Immunohistochemical detection of cytokeratin and epithelial membrane antigen in leiomyosarcoma: a systematic study of 100 cases. Pathol Int 2000; 50(1): 7–14.
3. Watanabe K, Kusakabe T, Hoshi N, Saito A, Suzuki T. h-Caldesmon in leiomyosarcoma and tumors with smooth muscle-like differentiation: Its specifc expression in the smooth muscle cell tumors. Hum Pathol 1999; 30(4): 392–396.
4. Miettinen MM, Sarlomo-Rikala M, Kovatich AJ, Lasota J. Calponin and h-caldesmon in soft tissue tumors: consistent h-caldesmon immunoreactivity in gastrointestinal stromal tumors indicates traits of smooth muscle differentiation. Mod Pathol 1999; 12(8): 756–762.
5. Hisaoka M, Wei-Qi S, Jian W, Morio T, Hashimoto H. Specifc but variable expression of h-caldesmon in leiomyosarcomas: an immunohistochemical reassessment of a novel myogenic marker. Appl Immunohistochem Mol Morphol 2001; 9(4): 302–308.
6. Ceballos KM, Nielsen GP, Selig MK, O’Connell JX. Is anti-h-caldesmon useful for distinguishing smooth muscle and myofbroblastic tumors? An immunohistochemical study. Am J Clin Pathol 2000; 114(5): 746–753.
7. Cavazzana AO, Schmidt D, Ninfo V, et al. Spindle cell rhabdomyosarcoma. A prognostically favorable variant of rhabdomyosarcoma. Am J Surg Pathol 1992; 16(3): 229–235.
8. Mentzel T, Katenkamp D. Sclerosing, pseudovascular rhabdomyosarcoma in adults. Clinicopathological and immunohistochemical analysis of three cases. Virchows Arch 2000; 436(4): 305–311.
9. Fletcher CDM, Bridge JA, Hogendoorn PCW, Mertens F, eds. WHO classification of tumours of soft tissue and bone. Lyon: IARC Press; 2013 : 134–135.
10. Rekhi B, Singhvi T. Histopathological, immunohistochemical and molecular cytogenetic analysis of 21 spindle cell/sclerosing rhabdomyosarcomas. APMIS 2014; 122(11): 1144-1152.
11. Owosho AA, Chen S, Kashikar S, et al. Clinical and molecular heterogeneity of head and neck spindle cell and sclerosing rhabdomyosarcoma. Oral Oncol 2016; 58:e6-e11.
12. Szuhai K, de Jong D, Leung WY, Fletcher CD, Hogendoorn PC. Transactivating mutation of the MYOD1 gene is a frequent event in adult spindle cell rhabdomyosarcoma. J Pathol 2014; 232(3): 300-307.
13. Agaram NP, Chen CL, Zhang L, LaQuaglia MP, Wexler L, Antonescu CR. Recurrent MYOD1 mutations in pediatric and adult sclerosing and spindle cell rhabdomyosarcomas: evidence for a common pathogenesis. Genes Chromosomes Cancer 2014; 53(9): 779-787.
14. Rekhi B, Upadhyay P, Ramteke MP, Dutt A. MYOD1 (L122R) mutations are associated with spindle cell and sclerosing rhabdomyosarcomas with aggressive clinical outcomes. Mod Pathol 2016; 29(12): 1532-1540.
15. Mosquera JM, Sboner A, Zhang L, et al. Recurrent NCOA2gene rearrangements in congenital/infantile spindle cell rhabdomyosarcoma. Genes Chromosom Cancer 2013; 52(6): 538–550.
16. Alaggio R, Zhang L, Sung YS, et al. A molecular study of pediatric spindle and sclerosing rhabdomyosarcoma: identification of novel and recurrent VGLL2-related fusions in infantile cases. Am J Surg Pathol 2016; 40(2): 224–235.
17. Folpe AL, McKenney JK, Bridge JA, Weiss SW. Sclerosing rhabdomyosarcoma in adults: report of four cases of a hyalinizing, matrix-rich variant of rhabdomyosarcoma that may be confused with osteosarcoma, chondrosarcoma, or angiosarcoma. Am J Surg Pathol 2002; 26(9): 1175–1183.
18. Nascimento AF, Fletcher CD. Spindle cell rhabdomyosarcoma in adults. Am J Surg Pathol 2005; 29(8): 1106–1113.
19. Mentzel T, Kuhnen C. Spindle cell rhabdomyosarcoma in adults: clinicopathological and immunohistochemical analysis of seven new cases. Virchows Arch 2006; 449(5): 554-560.
20. Diniz G, Aktas S, Ortac R, Tunakan M, Unlu I, Vergin C. Kit expression in spindle cell rhabdomyosarcoma can possibly create a different approach for its tumorigenesis and therapy. Pathol Res Pract 2006; 202(9): 671-677.
21. Zhao Z, Yin Y, Zhang J, et al. Spindle cell/sclerosing rhabdomyosarcoma: case series from a single institution emphasizing morphology, immunohistochemistry and follow-up. Int J Clin Exp Pathol 2015; 8(11): 13814-13820.
22. Carroll SJ, Nodit L. Spindle cell rhabdomyosarcoma: a brief diagnostic review and differential diagnosis. Arch Pathol Lab Med 2013; 137(8): 1155-1158.
23. Leuschner I, Newton WA, Schmidt D, et al. Spindle cell variants of embryonal rhabdomyosarcoma in the paratesticular region: a report of the Intergroup Rhabdomyosarcoma Study. Am J Surg Pathol 1993; 17(3): 221–230.
24. Rudzinski ER, Anderson JR, Hawkins DS, Skapek SX, Parham DM, Teot LA. The World Health Organization Classification of Skeletal Muscle Tumors in Pediatric Rhabdomyosarcoma: A Report From the Children‘s Oncology Group. Arch Pathol Lab Med 2015; 139(10): 1281-1287.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článok vyšiel v časopiseČesko-slovenská patologie

2017 Číslo 2-
Všetky články tohto čísla
- Jaká je Vaše diagnóza?
-
Mikrofotografie mobilem z volné ruky?
... To nemyslíte vážně! -
Jaká je Vaše diagnóza?
Odpověď - Patológia mäkkých tkanív a kostí
- Nádory měkkých tkání a kostí mě začaly velmi lákat zejména proto, že se zdály tak komplikované…
- MONITOR aneb nemělo by Vám uniknout, že...
- Obrovskobuněčné léze kostí a jejich diferenciální diagnostika
- Myxoidní nádory měkkých tkání
-
Hybridní nádory z obalů periferních nervů:
přehledový článek - Stanovení optimálního vyšetřovacího algoritmu pro efektivní vyhledávání nemalobuněčných karcinomů plic s přestavbou genu ALK – zavedení metodiky a praktické zkušenosti z rutinního vyšetřování
- Zralý teratom těla děložního: kazuistika
- Osobní zprávy
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Myxoidní nádory měkkých tkání
- Obrovskobuněčné léze kostí a jejich diferenciální diagnostika
-
Hybridní nádory z obalů periferních nervů:
přehledový článek - Zralý teratom těla děložního: kazuistika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy