-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Peroperační biopsie oblasti hlavy a krku, štítné žlázy a příštitných tělísek, měkkých tkání a kostí a urogenitálního traktu
Intraoperative diagnosis of the head and neck lesions, thyroid and parathyroid gland, bone and soft tissue, and genitourinary tract
In this article, indications and pitfalls in frozen section diagnosis in selected organs and systems are discussed. The main indications for frozen section examination of head and neck and genitourinary system lesions are to evaluate the resection margin and the metastatic involvement of lymph nodes. Recently, intraoperative consultation has been introduced for identification of patients who might benefit from testis-sparing surgery. Preoperative fine-needle aspiration has greatly diminished the need for frozen section evaluation of thyroid lesions. The only reasonable indication for intraoperative examination of the thyroid is a lesion suspected of malignancy for which preoperative cytology is not aviable for various reasons. In contrast, frozen section is still routinely requested at many institutions to confirm the presence of parathyroid lesions, although precise differentiation between parathyroid hyperplasia, adenoma, and carcinoma is not possible in most cases by histological assesment alone. Tumors of bone and soft tissue are relatively rare, and most pathologists are unfamiliar with intraoperative consultation of these lesions. However, in many cases, limb-sparing management of bone and soft tissue sarcomas is dependent on intraoperative histological diagnosis. Accurate diagnosis is possible in most instances by correlating the histology with clinical and radiological data. In selected cases, histochemistry and/or intraoperative immunohistochemistry may be helpful in diagnosis of bone lesions.
Keywords:
frozen section – head and neck – thyroid gland – parathyroid gland – soft tissue – urogenital tract
Autoři: Jan Laco 1*; Ondřej Daum 2,3*
; Iva Zambo 4*; Ondrej Ondič 2,3*
; Marián Švajdler 2,3
Působiště autorů: Fingerlandův ústav patologie, Univerzita Karlova v Praze, Lékařská fakulta a Fakultní nemocnice Hradec Králové 1; Šiklův ústav patologie, Univerzita Karlova v Praze, Lékařská fakulta v Plzni a Fakultní nemocnice Plzeň, Česká republika 2; Bioptická laboratoř, s. r. o., Plzeň 3; I. patologicko-anatomický ústav FN u sv. Anny a LF MU 4
Vyšlo v časopise: Čes.-slov. Patol., 54, 2018, No. 2, p. 72-80
Kategorie: Přehledový článek
Souhrn
Tato práce představuje a shrnuje indikace a úskalí peroperačního vyšetřování biopsií z vybraných lokalizací. Hlavní indikací pro peroperační vyšetření při chirurgických výkonech prováděných v oblasti hlavy a krku a v oblasti urogenitální traktu je obyčejně potřeba zhodnotit status resekčních okrajů a posoudit eventuální metastatické postižení lymfatických uzlin, ovšem peroperační biopsie v současnosti začíná nabývat na významu např. i při identifikaci pacientů vhodných pro tzv. „testis-sparing surgery“. Časté užití aspirační jehlové biopsie během předoperačního vyšetřování lézí štítné žlázy celkově vedlo k poklesu potřeby peroperačního vyšetřování. Jedinou smysluplnou indikací tak zůstává peroperační vyšetření štítné žlázy v případech, kdy i přes suspekci na maligní proces není z různých důvodů předoperační cytologie provedena. Na stranu druhou, peroperační biopsie jsou na některých pracovištích i nadále rutinně vyžadovány za účelem peroperačního zhodnocení parathyroidálních lézí a to i přes známý fakt, že rozlišení hyperplázie, adenomu a karcinomu příštítného tělíska je často pouze za použití histologie samotné nemožné. Měkotkáňové nádory a nádory kostí jsou relativně vzácné, tedy s peroperační diagnostikou těchto lézí se většina patologů příliš nesetkává. Avšak rozhodnutí chirurga o provedení končetinu šetřícího chirurgického výkonu při malignitách kostí a měkkých tkání je v některých případech zcela závislé na peroperační histologické diagnostice. Přesná diagnóza je ve většině případů možná po korelaci histologie, klinických a radiologických údajů, u vybraných kostních lézí pak může být při diagnostice velmi nápomocné i užití histochemie a/nebo peroperační imunohistochemie.
Klíčová slova:
peroperační biopsie – hlava a krk – štítná žláza – přištítná tělíska – měkké tkáně – urogenitální trakt
PEROPERAČNÍ BIOPSIE V OBLASTI HLAVY A KRKU
Peroperační biopsie v oblasti hlavy a krku patří mezi relativně často indikovaná vyšetření; její diagnostická přesnost je vysoká a dosahuje 95–99 % (1,2). V tomto textu bude diskutována především problematika vyšetření slizničních lézí horního aerodigestivního traktu, zejména karcinomů. Většina informací je převzata z monografie Wenig BM. Atlas of Head and Neck Pathology (3), kde může čtenář najít podrobnější pojednání o této problematice, včetně bohaté obrazové dokumentace.
Mezi nejčastější indikace peroperační biopsie v oblasti hlavy a krku patří zejména stanovení diagnózy, posouzení resekčních okrajů a upřesnění rozsahu chirurgického výkonu.
- Stanovení diagnózy. U většiny afekcí v oblasti hlavy a krku je diagnóza před plánovanou operací stanovena z probatorní biopsie, ať už formou klíšťkových biopsií např. z nosohltanu, patrové mandle, kořene jazyka nebo hrtanu, nebo formou malých excizí např. z dutiny ústní. V některých případech, např. při tzv. metastáze karcinomu z neznámého primárního zdroje, se však předoperačně primární ložisko karcinomu pomocí probatorních biopsií nemusí podařit zjistit, a pak je k peroperačnímu vyšetření zaslána celá stejnostranná patrová mandle (obr. 1A a 1B).
V případě krční lymfadenopatie nejasného původu bývá zvětšená uzlina rovněž zasílána k peroperačnímu vyšetření, zejména pokud je předchozí tenkojehlová aspirační cytologie nediagnostická. - Posouzení resekčních okrajů. Posouzení resekčních okrajů patří mezi nejčastější indikace peroperační biopsie v oblasti hlavy a krku a jeho smyslem je posoudit kompletnost resekce chorobného ložiska. K vyšetření může být zaslán celý resekovaný tumor nebo samostatné vzorky okrajů, často v několika částech, které může chirurg topograficky rozlišit. S druhým postupem se v naší praxi setkáváme častěji. Jeho nevýhodou je však nemožnost posoudit vzdálenost případného nádoru od resekčních okrajů a výsledek je sdělen pouze ve formě nádor přítomen nebo nepřítomen. Peroperační vyšetření celého resekátu je na druhou stranu často obtížné z důvodu nesnadné topografické orientace a přesného určení resekčních okrajů. Definice tzv. „pozitivního okraje“ u karcinomů oblasti hlavy a krku není bohužel v odborné literatuře konzistentní. Většinou se za „pozitivní okraj“ pokládá a) přítomnost invazivního karcinomu přímo v okraji a/nebo ve vzdálenosti menší než 0,5 mm od okraje a také b) přítomnost high-grade dysplázie dlaždicobuněčného epitelu přímo v okraji. Za optimální vzdálenost od okraje je obecně považováno 5–10 mm pro karcinomy dutiny ústní a hltanu a 5 mm (dle některých autorů pouze 1-2 mm) pro karcinomy hrtanu. Je důležité si uvědomit, že stav resekčních okrajů je významný prognostický faktor lokální recidivy a je zohledňován spolu s dalšími parametry (např. perineurálním šířením, infiltrací kosti apod.) při výběru adjuvantní léčby. Diskrepance mezi peroperačně zjištěnou a následně mikroskopicky určenou vzdáleností karcinomu od resekčního okraje bývá nejčastěji způsobena podrůstáním karcinomu pod intaktní sliznicí (např. u karcinomu jazyka) a/nebo variabilním zmenšením tkáně o 20–40 %, ke kterému pravidelně dochází jednak ihned po vyříznutí vzorku ztrátou tkáňového napětí, a jednak v důsledku fixace (dalších 10 %). Pokud tedy chce chirurg dosáhnout 5mm vzdálenosti nádoru od resekčního okraje podle hodnocení patologa, musí být tato vzdálenost peroperačně nejméně 8–10 mm.
- Upřesnění rozsahu chirurgického výkonu. V této indikaci se většinou jedná o vyšetření suspektního ložiska, které nebylo zjištěno nebo jasně interpretováno při předoperačním vyšetření zobrazovacími metodami a nález může modifikovat rozsah operace. Do této skupiny rovněž patří peroperační vyšetření lymfatických uzlin, jehož výsledek ovlivňuje rozsah krční disekce (jednostranná vs. oboustranná apod.).
Tab. 1. A) Invazivní nerohovějící spinocelulární karcinom patrové mandle v peroperační biopsii zhotovené zmrazovací technikou. V rámci pátrání po primárním nádorovém ložisku u nemocného s metastázami v krčních lymfatických uzlinách byla provedena stejnostranná tonzilektomie a celá mandle byla zaslána k peroperačnímu vyšetření (HE, 200x). (B) Tentýž invazivní nerohovějící spinocelulární karcinom patrové mandle v definitivním preparátu (HE, 200x) 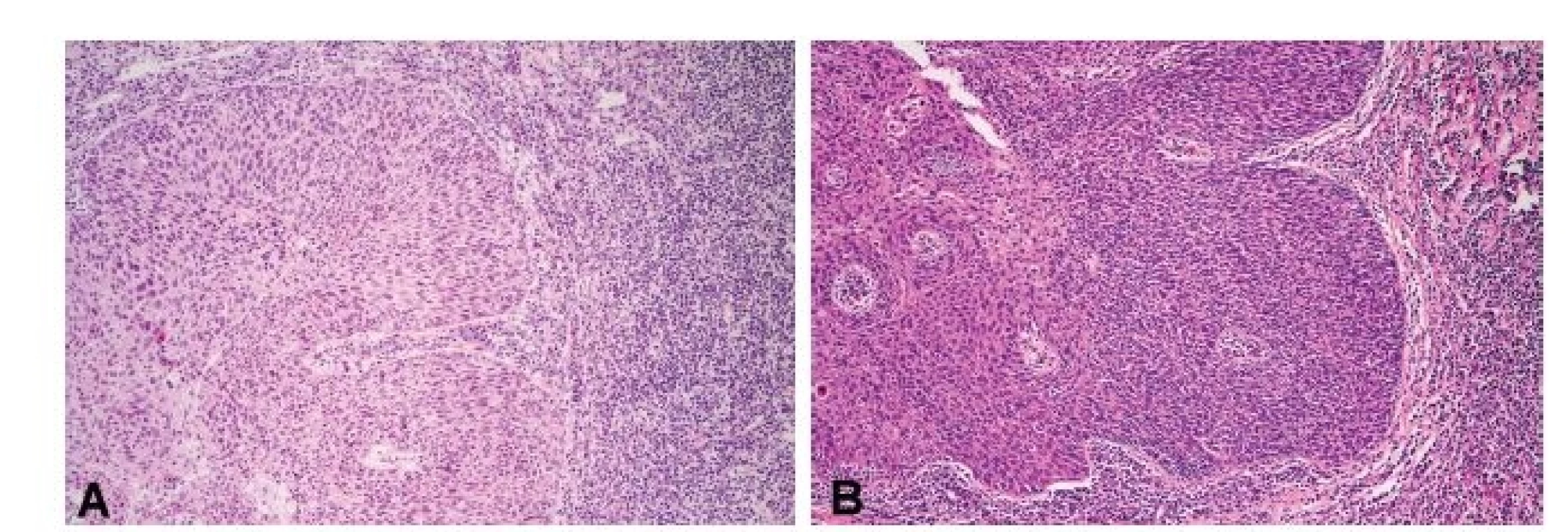
Zpracování, resp. přikrojení materiálu zaslaného k peroperačnímu vyšetření se v zásadě neliší od přikrojení fixovaného materiálu, rozdíl však bývá v rozsahu vyšetření daného personální a přístrojovou kapacitou laboratoře, zejména pokud je vzorek většího rozměru nebo je vzorků větší množství.
Pokud jsou zaslány malé vzorky, pak je lze vyšetřit většinou kompletně ve 2–3 preparátech. V případě zaslání celé patrové mandle bývá situace obtížnější, protože často není nádor makroskopicky zřejmý, ať už z důvodu malé velikosti (často pouze několik milimetrů), nebo splýváním jeho bělavé barvy s barvou lymfatické tkáně mandle. V těchto případech je nejlépe „naslepo“ vyšetřit 1–2 prostřední lamely ve 3–4 preparátech a při negativním výsledku po domluvě s operujícím lékařem případně vyšetřit další lamely. Resekát je vhodné předem otušovat, aby bylo možné následně posoudit vztah k okrajům. Rovněž je vhodné zhotovit schematický nákres vyšetřených lamel pro následnou mikroskopickou rekonstrukci alespoň největšího rozměru karcinomu, který je zásadní pro stanovení pT parametru. Velmi malý nádor lokalizovaný v oblasti pólu může být nalezen až při definitivním zpracování a na tuto možnost je nutné chirurga upozornit.
Nativně zaslanou zvětšenou lymfatickou uzlinu je vhodné vyšetřit 1–3 preparáty podle konkrétního nálezu. Rovněž je s výhodou zhotovit otiskové preparáty, které lze následně využít zejména v diagnostice hematologických onemocnění. Konečně lze část nativní uzliny krátkodobě uschovat při nízké teplotě pro další vyšetření, např. mikrobiologické v případě podezření na infekční onemocnění (např. tuberkulóza) nebo molekulárně genetické v případě hematologické choroby.
Posouzení resekčních okrajů
V ideálním případě je nutné vyšetřit všechny zaslané vzorky z resekčních okrajů, protože makroskopický nález je velmi často negativní. Problémem může být situace, kdy je v rámci kompletního posouzení všech resekčních okrajů k vyšetření zasláno velké množství větších tkáňových fragmentů. Kompletní zpracování materiálu zde naráží nejen na personální a přístrojové limity laboratoře, ale také na limit od pojišťovny na počet peroperačních vzorků od jednoho pacienta na určité období. Tuto situaci je nutné předem řešit v rámci mezioborové spolupráce a financování vyšetření realizovat např. z rozvojového projektu apod. Vždy je třeba upozornit na skutečnost, že v rámci definitivního zpracování může při prokrajování materiálu dojít k nálezu struktur karcinomu.
Upřesnění rozsahu chirurgického výkonu
V tomto případě se nejčastěji jedná o vyšetření krční lymfatické uzliny, jehož výsledek následně modifikuje rozsah krční disekce. Při makroskopicky negativním nálezu uzlinu vyšetřujeme většinou 1–3 řezy. Při mikroskopicky negativním nálezu je nutné opět upozornit na možnost nálezu mikrometastáz nebo izolovaných nádorových buněk při definitivním zpracování materiálu.
Mikroskopické vyšetření a diferenciální diagnóza
Diagnóza invazivního karcinomu, resp. dlaždicobuněčného karcinomu nebývá většinou obtížná, ať už v primárním ložisku nebo v podobě metastázy v lymfatické uzlině. Pro potřeby peroperačního vyšetření není nutné a většinou ani spolehlivě možné posuzovat grading nebo typ růstu (expanzivní vs. různé druhy infiltrativního). Hodnocení dysplastických změn dlaždicobuněčného epitelu už bývá obtížnější.
Diferenciální diagnostika invazivního karcinomu, resp. dysplastických změn dlaždicobuněčného epitelu při peroperačním vyšetření zahrnuje zejména reaktivní změny dlaždicobuněčného epitelu, postradiační změny a juxtaorální Chievitzův orgán.
Reaktivní změny dlaždicobuněčného epitelu vznikající z nejrůznějších, např. zánětlivých příčin mohou být výrazně vystupňované a mohou nabývat až charakteru pseudoepiteliomatózní hyperplázie. Obdobné změny epitelu mohou být přítomny také nad ložiskem nádoru z granulárních buněk, v oblasti hlavy a krku nejčastěji lokalizovaným v jazyku nebo v hrtanu. Od dysplastických změn pseudoepiteliomatózní hyperplázii odlišuje absence výraznějších cytologických atypií a od invazivního karcinomu chybění desmoplastického vazivového stromatu a příp. výraznější zánětlivé reakce v okolí. Je však nutné přiznat, že odlišení reaktivních změn zejména od low-grade dysplázie je velmi obtížné. Pro posuzování stavu resekčních okrajů je naštěstí relevantní pouze nález high-grade dysplázie, jejíž odlišení od reaktivních změn bývá snadnější.
Postradiační změny mohou velmi snadno vést k falešně pozitivní diagnóze invazivního dlaždicobuněčného karcinomu. Klíčem k úspěchu v této situaci je znalost spektra mikroskopických změn, které mohou v důsledku radioterapie vznikat, a samozřejmě pak údaj o této léčbě u vyšetřovaného nemocného, který však nemusí být operujícím lékařem sdělen.
Postradiační změny zahrnují zejména a) atrofii a ulceraci dlaždicobuněčného epitelu, který navíc může vykazovat reaktivní změny až charakteru pseudoepiteliomatózní hyperplázie (viz výše), b) atrofii a dlaždicobuněčnou metaplázii malých slinných žlázek až vzhledu nekrotizující sialometaplázie, c) submukózní fibrózu s atypickými fibroblasty a d) bizarní degenerované a/nebo regenerující buňky příčně pruhované svaloviny. Konečně k vaskulárním změnám patří dilatované kapiláry vystlané dužnatými endoteliemi, přítomnost pěnitých histiocytů v intimě, myointimální proliferace a trombóza.
Pro odlišení nekrotizující sialometaplázie od invazivního dlaždicobuněčného karcinomu je zcela zásadní prohlížet ložisko malým zvětšením a všimnout si zachovalé lobulární architektoniky u nekrotizující sialometaplázie. Naopak, vyšetřování léze hned při velkém zvětšení vede snadno k chybné diagnóze invazivního karcinomu, protože u nekrotizující sialometaplázie buňky také často jeví určitý stupeň cytologických atypií, které mohou být zaměněny za změny dysplastické, resp. nádorové. Na rozdíl od (většinou) kohezivních čepů invazivního dlaždicobuněčného karcinomu jsou atypické fibroblasty v jizevnaté vazivové tkáni disperzně rozptýleny jako jednotlivé buňky.
Juxtaorální Chievitzův orgán je normální mikroskopická struktura nejasné funkce, která je lokalizována bilaterálně v retromolárním trigonu dutiny ústní v blízkosti bukotemporální fascie při úhlu mandibuly. Jedná se o skupinky nerohovějících dlaždicových buněk spojených intercelulárními můstky, které jsou v intimním vztahu s větvemi bukálního nervu. Buňky na obvodu klastru mohou jevit periferní palisádování. Cytologické atypie ani mitotická aktivita nejsou přítomny a desmoplastická reakce v okolí rovněž chybí. Diferenciálně diagnosticky je nutné odlišit invazivní dlaždicobuněčný karcinom s perineurálním šířením nádorových buněk (4).
PEROPERAČNÍ VYŠETŘENÍ ŠTÍTNÉ ŽLÁZY
Během 21. století došlo k výrazné redukci počtu peroperačních vyšetření štítné žlázy, což bylo zapříčiněno hlavně dvěma faktory. Jednak šlo o důsledek výrazného pokroku předoperační diagnostiky představované zejména sonografickým vyšetřením a navazující tenkojehlovou aspirační cytologií (fine needle aspiration cytology, FNAC), který umožnil s vysokou mírou jistoty diagnostikovat papilární karcinom, medulární karcinom, anaplastický karcinom a high-grade lymfom, a tak určit terapeutický postup bez nutnosti peroperačního vyšetření kryostatových řezů (5). Na druhou stranu k uvedenému poklesu přispělo i zkvalitnění spolupráce mezi operatéry a patology, díky kterému do klinického povědomí pronikly poznatky o nízké validitě peroperační diferenciální diagnostiky folikulárních lézí. S vědomím těchto limitací peroperačního vyšetření štítné žlázy a s ohledem na charakter informace určující případnou modifikaci léčebného postupu lze stanovit několik možností racionální indikace peroperačního vyšetření:
- Uzly a nádorové infiltráty štítné žlázy s definitivní diagnózou maligního nádoru na základě předoperační FNAC (kategorie VI. Maligní podle Bethesda klasifikace). Za zbytečné lze považovat zejména peroperační vyšetření kryostatových řezů uzlů na podkladě FNAC diagnostikovaných jako papilární karcinom (6), protože sama tato cytologická diagnóza je indikací k totální thyroidektomii. Obdobný význam má i předoperační diagnóza medulárního karcinomu, zejména je-li podpořena biochemickým průkazem elevace sérové hladiny kalcitoninu. V případě anaplastického karcinomu a high-grade lymfomu bývá cytologický obraz natolik dramatický, že většinou nevzbuzuje pochyby o nutnosti radikálního výkonu. Za výjimky z uvedeného pravidla lze považovat jednak snahu o peroperační zhodnocení kompletnosti výkonu (tedy intaktnosti resekční linie), které může být klinikem vyžadováno zejména u anaplastického karcinomu nebo high-grade lymfomu, případně u povrchově lokalizovaného papilárního karcinomu nebo medulárního karcinomu; jednak vyšetření extrathyroideálních nodulů zastižených při chirurgickém výkonu, jejichž povaha by mohla rozhodnout o případné „extrathyroideální extenzi“ výkonu (diferenciální diagnostika mezi lymfatickou metastázou, benigní lymfadenopatií, lézí příštitného tělíska, ektopickým nodulem štítné žlázy, případně jiným nenádorovým procesem).
- Uzly s předoperační cytologickou diagnózou kategorie IV. Folikulární neoplázie/Suspekce z folikulární neoplázie/Neoplázie z Hűrthleho buněk/Suspekce z neoplázie z Hűrthleho buněk. Také u této skupiny pacientů nelze očekávat od peroperačního vyšetření kryostatových řezů rozhodující informaci (6,7). A to z toho důvodu, že do této cytologické diagnostické kategorie může spadat spektrum folikulárních proliferací od hyperplastického (adenomatoidního) uzlu až po široce invazivní folikulární karcinom. Rozlišení mezi jednotlivými jednotkami tohoto spektra je přitom buď zbytečné, nebo v kontextu peroperačního histologického vyšetření téměř nemožné. V praxi připadají v úvahu zejména tyto možnosti (přičemž pro nádory z Hűrthleho buněk platí stejná pravidla jako pro folikulární neoplázie): Hyperplastický uzel vs. folikulární adenom - odlišují se na podkladě přítomnosti vazivového pouzdra adenomu. K průkazu jeho přítomnosti je postačující makroskopická inspekce léze, bez nutnosti zhotovení kryostatových řezů. Rozlišení mezi těmito dvěma jednotkami nemá však žádný dopad na další terapeutický postup. Folikulární adenom vs. folikulární karcinom - vzhledem k tomu, že jde téměř vždy o diferenciální diagnostiku mezi folikulárním adenomem a minimálně invazivním karcinomem (tedy s kapsuloinvazí bez angioinvaze) nebo opouzdřeným karcinomem s angioinvazí, je v tomto případě rozhodujícím kritériem histologický průkaz (ložiskového) invazivního růstu. Jeho vyloučení logicky vyžaduje kompletní zpracování periferie nádoru, což je v podmínkách peroperační biopsie u větších tumorů nemožné (8). Navíc, vzhledem k tomu, že i v kvalitních parafínových řezech může být průkaz invaze značně svízelný, nelze od kryostatových řezů očekávat vysokou míru jistoty v hodnocení tohoto parametru. Za relativně užitečnou formu peroperačního vyšetření lze pokládat makroskopické zhodnocení pouzdra, které u adenomů bývá tenké, zatímco u karcinomu tlusté a nepravidelné. Nicméně ani tento znak není dostatečně specifický na to, aby jeho peroperační analýza vyvážila možnost znehodnocení tkáně pro definitivní vyšetření parafínových řezů kvůli artefaktům vzniklým rozrušením kontinuity pouzdra nefixovaného uzlu. V některých studiích se úspěšnost peroperační diagnostiky folikulárního karcinomu blíží rozhodování na základě házení mincí (9). Proto, ačkoli průkaz invaze rozhoduje o případném rozšíření lobektomie na thyroidektomii, pro dobro pacienta je vhodnější případnou kompletizaci výkonu provést s odstupem v druhé době, po provedení standardního histologického vyšetření z parafínových řezů.
- Uzly s předoperační cytologickou diagnózou kategorie III. Atypie nejasného významu (AUS)/Folikulární léze nejasného významu (FLUS) a kategorie V. Podezření z malignity, případně i kategorie I. Nediagnostický vzorek. Tyto dvě kategorie představují hlavní skupinu lézí, u nichž má peroperační vyšetření vlastní léze opodstatnění. Nejčastěji se jedná o vyloučení možnosti papilárního karcinomu, které není obtížné v typických případech makroskopicky se prezentujících jako hůře ohraničený šedý tuhý uzel, u kterých lze také očekávat charakteristickou histomorfologii (pravděpodobnou příčinou nejistoty při cytologické diagnóze z FNAC je v těchto případech nejspíše nízká celularita nebo přítomnost artefaktů snižujících hodnotitelnost vzorku). Ne tak jednoznačnou morfologii mají varianty papilárního karcinomu s méně vyjádřenými tzv. „papilárními atypiemi“ jader, z nichž nejčastější patří do skupiny folikulární varianty papilárního karcinomu, a to včetně „neinvazivního folikulárního thyroidního nádoru s papilárními jadernými znaky“ (NIFTP). Makroskopicky mívají tyto varianty obdobný vzhled jako folikulární neoplázie, s nimiž tedy vstupují do diferenciální diagnostiky, která se však na základě současných poznatků nejeví jako kruciální, neboť v případě opouzdřených nádorů z thyreocytů je biologické chování dáno nikoli jadernými znaky, ale přítomností invaze (10). Problematika diagnózy invazivní opouzdřené folikulární varianty papilárního karcinomu se pak překrývá s problematikou diagnostiky folikulárního karcinomu. Je-li však přesto vyžadováno rozlišení mezi papilárním karcinomem a folikulární neoplázií, je nutno mít na paměti, že v kryostatových řezech mohou být jaderné znaky papilárního karcinomu velmi málo vyjádřené, až nepřítomné (optická „prázdnost“ jader, jaderné pseudoinkluze a zářezy), a naopak ve folikulárních neopláziích může docházet k arteficiálním deformacím jader a tvorbě intranukleárních vakuol simulujících „papilární jaderné“ atypie. Proto je vhodnější v těchto případech provést peroperační cytologické vyšetření, a to buď otiskovou, nebo seškrabem (scrape cytology, vhodná zejména v lézích bohatých na koloid) (11,12) (obr. 2A-C).
- Léze s předoperační cytologickou diagnózou kategorie II. Benigní, případně léze bez předchozí cytologické diagnózy. V obou skupinách je peroperační kryostatové vyšetření v drtivé většině případů zbytečné, protože jde převážně o nodózní strumy různé etiologie odstraňované kvůli útlaku trachey, případně z estetických důvodů. Ačkoli ani v takovém terénu není náhodný nález nádoru vyloučen, je přínosnější vyčkat definitivního výsledku z parafínových řezů. Nepříliš častou výjimkou může být rychle rostoucí struma na podkladě high-grade lymfomu nebo anaplastického karcinomu, kdy se na podkladě klinického obrazu může klinik rozhodnout pro urgentní chirurgické řešení bez předoperačního cytologického ověření. V tom případě by bylo možné provést peroperační vyšetření, podobně jako je uvedeno u těchto jednotek předoperačně diagnostikovaných jako kategorie VI. Maligní.
Obr. 1. Porovnání peroperační „scrape“ cytologie a kryostatového histologického řezu. (A) Ačkoli v některých případech mohou být jaderné znaky papilárního karcinomu přítomny i v kryostatových řezech (HE, 200x), (B, C) v peroperačních cytologických preparátech získaných seškrabem tkáně z řezu nádorem jsou obvykle výrazněji vyjádřena opticky prázdná jádra, jaderné pseudoinkluze i jaderné zářezy (B, HE, 200x; C, HE, 400x). 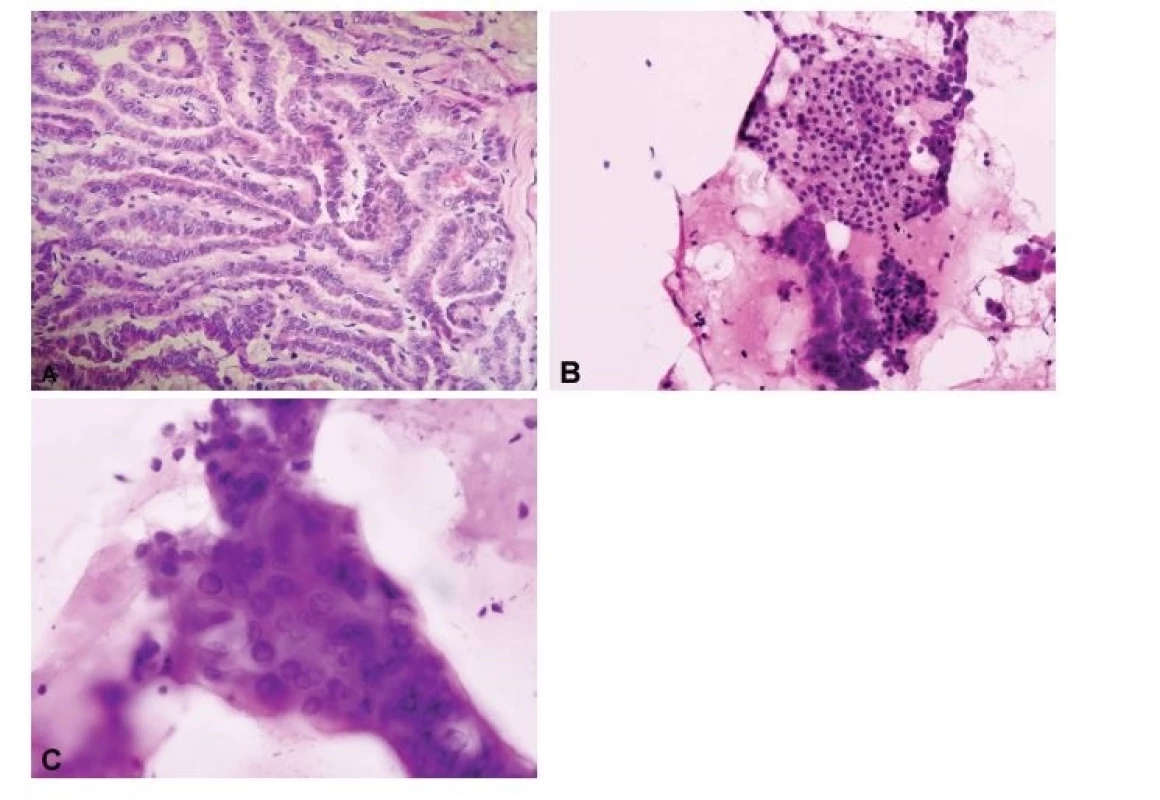
PEROPERAČNÍ VYŠETŘENÍ PŘIŠTÍTNÝCH TĚLÍSEK
Na rozdíl od štítné žlázy není peroperační vyšetření příštítných tělísek na ústupu, a to i přes výrazný pokrok předoperační diagnostiky, zejména scintigrafické detekci. Zvýšení senzitivity zobrazovacích metod s sebou totiž přináší zvýšený záchyt menších (časnějších) lézí příštítného tělíska, které je makroskopicky obtížnější odlišit od nodulárních útvarů jiného původu. Peroperační vyšetření kryostatových řezů tak má stále významnou roli, i když některá pracoviště preferují k ověření topiky parathyroidektomie rychlou intraoperační analýzu sérové hladiny parthormonu (13). Navíc také dochází ke zvýšení incidence sekundární hyperplázie příštítných tělísek při chronické renální insuficienci (12). Peroperační vyšetření může být vyžadováno z těchto důvodů:
- Potvrzení parathyroideální proliferace. V prvé řadě je nutné potvrdit, že odebraný útvar představuje příštítné tělísko. Nejčastěji jej může mimikovat ektopický nodulus štítné žlázy, který je sice většinou tvořený folikly obsahujícími koloid, někdy však je tkáň štítné žlázy v kryostatovém řezu k nerozeznání od příštítného tělíska (hyperplastický uzel štítné žlázy nemusí obsahovat koloid, příštítné tělísko zase může být tvořeno mikrofolikulárními útvary obsahujícími pseudokoloid). Dále může chirurg odebrat pouze lalůček tukové tkáně, který však nečiní diferenciálně diagnostické obtíže. Lymfatická uzlina sice může mikroskopicky připomínat adenom příštítného tělíska, makroskopicky však bývá světle šedé barvy, zatímco adenom příštítného tělíska mívá barvu hnědou. Histologicky pak většinou lze i v kryostatových řezech rozlišit mezi okrouhlými lymfocyty a polyedrickými endokrinními buňkami příštítného tělíska s vyšší mírou kohezivity. Ektopická tkáň thymu je charakteristická především přítomností Hassalových tělísek. Obrazem proliferace příštítného tělíska se rozumí zvýšená celularita jeho endokrinní komponenty s vymizením nebo výraznou redukcí shluků adipocytů, které normálně tvoří 25-40 % jeho objemu, v proliferativních lézích se vyskytují jen nečetné izolované adipocyty (11). Vzácně může proliferace postihovat obě komponenty (lipoadenom, případně lipohyperplázie příštítného tělíska), v těchto případech však rozměry léze vylučují možnost normální parathyroidey (14).
- Adenom vs. hyperplázie příštítného tělíska. Ačkoli se uvádí, že adenom je charakterizován přítomností periferního lemu reziduální normální tkáně příštítného tělíska, ve skutečnosti nemá tento morfologický znak velký význam. Jednak je tento lem inkompletní a nemusí tedy být v kryostatovém řezu zastižen, jednak chirurg ani od peroperačního vyšetření tuto diferenciální diagnostiku neočekává, protože spoléhá na operační nález (zvětšení jednoho příštítného tělíska při adenomu vs. všech tělísek při hyperplázii) a na pooperační monitorování hladiny parathormonu (která signifikantně poklesne po odstranění adenomu). Proto je diagnóza „proliferace příštítného tělíska“ nebo „hypercelulární tkáň příštítného tělíska zcela dostačující“ (11).
- Adenom vs. karcinom příštítného tělíska. Mezi spolehlivé znaky karcinomu příštítného tělíska patří kromě metastáz infiltrativní růst a angioinvaze. Takto jednoznačné nálezy jsou však vzácné. Méně specifickými znaky jsou přítomnost silných vazivových pruhů, vzácněji nekróza, případně mitotická aktivita (mitózy se ale bohužel v kryostatových řezech obtížně odlišují od pyknotických jader). Naopak jaderná pleomorfie nemá kvůli častému výskytu tzv. benigních endokrinních atypií diagnostický význam. Hlavní význam má stanovení podezření na možnost karcinomu příštítného tělíska tehdy, jestliže se jedná o příštítné tělísko, které má být použito k autotransplantaci, aby byla zajištěna produkce parathormonu po totální parathyroidektomii (15).
PEROPERAČNÍ BIOPSIE KOSTÍ A MĚKKÝCH TKÁNÍ
Stanovení správné diagnózy u řady muskuloskeletálních lézí je velmi komplikované a prakticky nemožné bez znalosti potřebných klinických údajů a výsledků zobrazovacích vyšetření. Peroperační diagnostika patologických procesů v měkkých tkáních a kostech je v mnoha ohledech specifická. Výtěžnost peroperačního vyšetření je limitována charakterem materiálu, tedy velmi obtížným až nemožným zpracováním mineralizované kostní tkáně standardní technikou (16). Tuková tkáň a kosterní sval jsou při zpracování v zmražených řezech výrazně poškozeny vznikem artefaktů: tkáň je potrhaná a morfologicky znehodnocená početnými opticky prázdnými lakunami (17). Primární sarkomy měkkých tkání a kostí jsou vzácné, mnohdy se navíc jedná o histologicky značně heterogenní léze. Z výše uvedených limitací vyplývá, že určení přesné diagnózy mezenchymálních tumorů z kryostatových preparátů není vždy možné.
V praxi se setkáváme s několika typy klinických požadavků.
- Stejně jako u jiných orgánových systémů, i v případě tumorů měkkých tkání a kostí operatéra zajímá stav resekčních okrajů nebo histologická verifikace reziduálního nádoru či recidivy u makroskopicky nejednoznačného nálezu.
- Důvodem peroperačního vyšetření může být i dotaz na diagnostickou výtěžnost biopsie, a to zejména u lézí obtížně přístupných (16-18). Ve všech těchto případech názor patologa přímo ovlivňuje bezprostřední operační strategii. Standardní zpracování mezenchymální tkáně v kryostatu však klade vyšší nároky na zkušenosti a zručnost laborantek, překonání očekávaných technických komplikací je nezřídka časově náročnější, proto odezva od příjmu materiálu po telefonické hlášení výsledku často překračuje obvyklých 20 minut.
- Peroperační vyšetření lze využít také v případech, kdy se pokoušíme co nejpřesněji stanovit primární diagnózu léze a stav pacienta nedovoluje vyčkat na zkompletování mikroskopického nálezu z formol-parafínových preparátů a výsledků speciálního barvení, imunohistochemických a molekulárně genetických vyšetření. Klinik nečeká odpověď v řádech minut – zvolení optimálního léčebného postupu je odloženo na následující den. Jedná se zejména o pacienty, u kterých naléhavě hrozí patologická fraktura kosti postižené nejasným ložiskovým procesem. Pokud je příčinou osteolytické léze metastáza (obr. 3A), primární benigní tumor nebo některý z chemorezistentních sarkomů, je v první linii indikováno operační řešení, většinou s implantací tumorózní endoprotézy. U pacientů s konvenčním osteosarkomem (obr. 3B) či Ewingovým sarkomem resekčnímu výkonu přechází neoadjuvantní terapie, u hnisavé osteomyelitidy je logicky metodou volby terapie antibiotiky. S obdobnou situací se setkáváme v případech obrovských měkkotkáňových tumorů, které hrozí akutními klinickými komplikacemi, a v rámci diferenciálně diagnostické rozvahy by se mohlo jednat o synoviální sarkom či Ewingův sarkom. Pokud je tedy po patologovi žádána co nejpřesněji specifikovaná diagnóza v rámci peroperačního vyšetření, je nezbytné kromě standardního přehledného barvení využít i další pomocné metody. Speciální barvení pomáhá vizualizovat síť retikulinových vláken či prokázat hlenové substance, výsledek je k dispozici za cca 25-30 min, což pomáhá zejména v diagnostice kulatobuněčného sarkomu (obr. 3C, 3D a 3E) či metastazujících adenokarcinomů. Z reprezentativního bločku lze peroperačně nádorovou tkáň vyšetřit imunohistochemicky. Dle histologického obrazu lze zvolit základní panel protilátek, většinou stačí kombinace tří až čtyř antigenů. U ortopedických pacientů je vyšetřujemet desmin (obr. 3F a 3G), hladkosvalový aktin, CD34, S-100, CD99, LCA, Fli-1, EMA a AE1/AE3. Z nativních cytologických preparátů, nejlépe otiskových, lze navíc stanovit přítomnost rearanže sledovaného genu, nejčastěji EWSR1 nebo SS18. Výsledek kryostatového imunohistochemického vyšetření je k dispozici za cca 2 hodiny, výsledek molekulárně-genetického vyšetření následující den. Z ekonomických důvodů velmi doporučujeme indikovat doplňující laboratorní vyšetření na vitální nádorovou tkáň, tedy až po mikroskopickém zhodnocení kryostatových řezů a cytologických nátěrů či otiskových preparátů. Pro komplexní zhodnocení nálezu jsou nezbytné validní klinické informace. Výhodou je osobní přítomnost patologa na sále během odběru peroperační biopsie, zejména u měkkotkáňových tumorů. Dialog s operatérem, imprese z makroskopického vzhledu léze, její velikosti, topografického uložení a posouzení vztahu k okolním strukturám napomáhá přesnější specifikaci peroperační diagnózy a znamená menší časovou zátěž v porovnání s podrobným studiem klinické dokumentace a výsledků zobrazovacích vyšetření.
- Peroperační vyšetření patří do diagnostického algoritmu u některých typů mezenchymálních lézí. V příznivě krátkém časovém intervalu poskytne informace o radikalitě operačního zákroku a většinou postačuje k zařazení tumoru do kategorie: low-grade sarkom, high-grade sarkom, kulatobuněčný tumor, non-hodgkinův lymfom či metastáza karcinomu. Pomocí doplňujících vyšetření lze ve většině případů lézi blíže specifikovat a mnohdy i stanovit přesnou diagnózu. Úzká spolupráce s klinickým lékařem je nezbytná.
Obr. 2. (A) Metastáza dlaždicobuněčného karcinomu do proximálního femuru, primární lokalizace: děložní čípek (HE, 200x). (B) Konvenční high-grade osteosarkom, osteoblastická varianta v proximální tibii u 57letého muže (HE, 200x). (C) Ewingův sarkom malé pánve u 21letého muže, v době diagnózy 24 cm v největším rozměru (HE, 200x). (D) Ewingův sarkom, barvení na retikulin dle Gömöriho (200x). (E) Ewingův sarkom, cytologický preparát – otisk (HE, 200x). (F) Leiomyosarkom grade 2 na ventrální straně bérce u 48leté ženy (HE, 200x). (G) Leiomyosarkom, desmin, (200x). 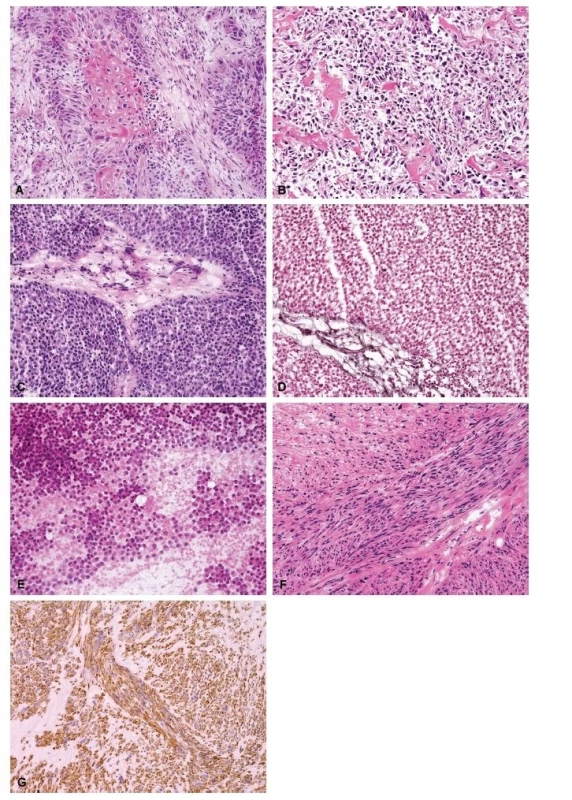
PEROPERAČNÍ VYŠETŘENÍ LEDVINY
U většiny renálních tumorů je vhledem k dobře známé četnosti výskytu jednotlivých podtypů renálních karcinomů často již předoperačně klinicky předpokládáno, že se jedná o světlobuněčný renální karcinom a řeší se radikální nefrektomií či parciální resekcí bez potřeby peroperační diagnostiky. Ve speciálních případech však může mít peroperační konzultace svá opodstatnění. Přesné indikace k peroperačnímu vyšetření tkáně ledviny nejsou jednoznačně definované a i na renomovaných pracovištích jsou značně ovlivněné subjektivními faktory jako osobní preference operatéra, tradice a typ nemocnice.
- Makroskopické peroperační zhodnocení resekátu může mít význam při určení origa nádoru. Někdy může být předoperačně obtížné odlišit, zda nádor vychází z renálního parenchymu či přechodného epitelu dutého systému ledviny. Pouhé správné podélné rozpolcení ledviny umožňující makroskopicky zhodnotit dutý systém je pak často rozhodující. Pokud však makroskopická diagnóza pro nepřehledný terén není možná a je přistoupeno k provedení peroperační biopsie s hodnocením tkáně mikroskopicky, je vhodné peroperačně zpracovat vitální nádorovou tkáň nacházející se v dutém systému ledviny, kde uroteliání karcinom obvykle prezentuje typické morfologické rysy (na rozdíl od komponenty infiltrující renální parenchym, která často imituje renální karcinom). Diagnóza uroteliálního karcinomu je pro urologa indikací k provedení ureterektomie společně s nefrektomií jako prevence rekurence nádoru.
- Peroperační biopsie bylo též až do nedávné minulosti využíváno v některých případech parciálních nefrektomií k vyšetření resekčního okraje. Tento postup v současnosti není doporučován, neboť byla prokázána (19,20) omezená spolehlivost hodnocení zmražených řezů, kdy nenádorový renální parenchym může ve zmražených řezech imitovat struktury nádoru. Na některých pracovištích je však tento postup i nadále uplatňován jako standardní vyšetření (21). Pro šířku bezpečného okraje (bezpečnostního lemu) nejsou stanoveny přesné limity, tento údaj navíc nekoreluje s rizikem rekurence či metastázy a ani s délkou přežívání pacientů (22). Pokud chirurg označí tuší resekční linii, v definitivní biopsii je okraj dobře hodnotitelný.
Peroperační diagnostika zejména onkocytárních tumorů a nádorů s granulární cytoplasmou je obtížná a přesná diagnóza je možná jen v definitivní biopsii z klasických parafínových bloků. Dalším praktickým postřehem je, že u chromofobního renálního karcinomu ve zmražených řezech nedochází ke vzniku rozinkových jader, které jsou artefaktem zpracování tkáně do parafínového bloku.
Peroperační hodnocení klinovité excize z dárcovské ledviny v čase odběru (tzv. time-zero biopsy) je kapitola sama o sobě a téma přesahuje formát tohoto článku (navíc, v současnosti některá významná pracoviště na hodnocení ledviny od tzv. marginálních dárců používají tkáň fixovanou formalínem a zalitou v parafínu pomocí rychlého protokolu) (23). U dárcovských biopsií však nezřídka vyvstává i požadavek na peroperační zhodnocení dignity malého nádoru dárcovské ledviny. Pokud je nádor benigní, může být po jeho resekci ledvina použita k transplantaci. Na významu pak např. nabývá i otázka rozpoznání angiomyolipomu (obr. 4A, 4B a 4C) a obzvlášť jeho epiteloidní varianty.
PEROPERAČNÍ VYŠETŘENÍ MOČOVÉHO MĚCHÝŘE
Dobrá dostupnost endoskopických metod umožňuje diagnostikovat většinu uroteliálních lézí močového měchýře již předoperačně. Nejčastějším peroperačním požadavkem urologa je proto:
- Zhodnocení resekčních okrajů močovodů (především na přítomnost uroteliálního karcinomu in situ), a to i přes současné poznatky, kdy je klinický význam tohoto vyšetření mnohými zpochybňován (24,25).
- Zřídka se lze setkat i s žádostí o vyšetření tkáně krčku močového měchýře při prostatektomii pro karcinom (možnost infiltrace krčku močového měchýře adenokarcinomem prostaty).
- Dalším eventuálním peroperačním požadavkem může být zhodnocení metastatického postižení lymfatických uzlin pro určení rozsahu lymfadenektomie při karcinomu močového měchýře, či za účelem rozhodnutí o ukončení operace (26).
PEROPERAČNÍ VYŠETŘENÍ PROSTATY
Urology dříve často požadované peroperační hodnocení resekčních okrajů při radikální prostatektomii nebylo v celé patologické obci jednoznačně akceptováno. Ani v současnosti pak neexistuje v této otázce jednotný konsenzus. I když je stanovení přítomnosti karcinomu v resekčním okraji radikální prostatektomie relativně přesným vyšetřením (senzitivita až cca 85%, specificita a pozitivní prediktivní hodnota v některých studiích až 100%), celková přesnost předpovědi statusu resekčního okraje se pohybuje jen okolo cca 80% a peroperační vyšetření tedy pravděpodobně nemá větší význam, zejména pak nejedná-li se o „nerve-sparing“ prostatektomii (27). Dnes tato otázka ztrácí na významu kvůli výraznému zlepšení klinických možností předoperační stratifikace pacientů vhodných k tomuto výkonu (PSA nomogramy, Gleason skóre v punkční biopsii, klinický staging atd.). Ze stejného důvodu a pro častější záchyt pacientů v časných stádiích nádorového onemocnění se též prakticky upouští od peroperačního hodnocení metastatického postižení lymfatických uzlin při radikální prostatektomii, ačkoliv identifikace postižení lymfatických uzlin může mít význam v případě high-risk karcinomů (neprovedení radikální prostatektomie v případě metastázy v lymfatických uzlinách)(28,29).
Vyšetření prostaty u potenciálního dárce orgánů připadá v úvahu jen při podezření na prostatický karcinom při vysoké hladině PSA. Tehdy je doporučováno přikrojit prostatickou tkáň po lamelách tloušťky 3 mm ve snaze najít suspektní ložisko. Pokud toto není přítomné, mělo by být pokračováno extenzivním vyšetřením periferie orgánu metodou zmražených řezů. Pokud karcinom není detekován ani tímto vyšetřením, lze říci, že donor nemá karcinom prostaty (30).
PEROPERAČNÍ VYŠETŘENÍ PENISU
Peroperační diagnostika karcinomu penisu se dnes nedoporučuje (31). I v této otázce je však relevantním požadavek operatéra na peroperační zhodnocení resekční linie, případně regionálních lymfatických uzlin (sentinelové uzliny a nebo tzv. limitované disekce inguinálních lymfatických uzlin) (32,33). Doporučovaná minimální makroskopická šířka volného chirurgického resekčního okraje je alespoň 1,5 cm. Patolog by se měl vyjádřit samostatně k resekční linii na úrovni: a) kůže, b) corpora cavernosa a corpus spongiosum s přilehlou mezenchymální tkání a c) uretry.
Pokud nádor těsně naléhá k resekční linii, doporučuje se obarvit resekční okraj tuší a následně přikrojit podélné excize kolmé na resekční linii jak pro peroperační tak i definitivní zhodnocení resekátu.
PEROPERAČNÍ VYŠETŘENÍ VARLAT
Nádory varlat by měly být indikovány k peroperačnímu vyšetření jen za zvláštních klinických okolností a to u pacientů, kteří by mohli profitovat z tzv. „testis-sparing surgery“ (34,35). Zejména se jedná o:
- Nádor u prepubertálního pacienta, kde je silný předpoklad, že se může jednat o nádor benigního spektra (34-37).
- Náhodně na USG vyšetření zastižený nehmatatelný nádor (38).
- Léze, u nichž předoperačním vyšetřením nebylo možné jednoznačně vyloučit pouze zánětlivou etiologii, vaskulární lézi, jinou benigní lézi, která maligní nádor jen napodobňuje - například tumor z Leydigových buněk, či adenomatoidní tumor (obr. 4D).
- Léze v solitárním varleti, synchronní bilaterální tumory či metachronní kontralaterální tumory (34,35).
Histologicky nejčastěji diagnostikovaným nádorem varlete je seminom. V peroperační biopsii je zásadní identifikace vlastních velkých neoplastických buněk seminomu, případně nález intratubulární neoplázie zárodečných buněk v přilehlých tubulech (v nové WHO klasifikaci 2016 označované „germ cell neoplasia in situ“ (39)). Peroperačně však může způsobit nemalé obtíže jeho komponenta lymfocytárního/zánětlivého infiltrátu, obzvláště je-li výrazně vyjádřena. Zásadní je pak odlišení od zánětlivých pseudotumorů.
Jinou problematikou může být odlišení epidermální cysty od teratomové komponenty germinálního nádoru. Tady je na prvním místě nejdůležitější dostatečný sampling materiálu. Mikroskopický nález struktur kožních adnex a intratubulární neoplázie zárodečných buněk v okolí tumoru pak svědčí pro diagnózu germinálního nádoru s teratomovou komponentou.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
MUDr. Marián Švajdler, Ph.D.
Bioptická laboratoř, s.r.o.
Mikulášske nám. 4
326 00 Plzeň, Česká republika
tel.: +420 737220036
e-mail: svajdler@yahoo.com
Zdroje
1. Sharma SM, Prasad BR, Pushparaj S, Poojary D. Accuracy of intraoperative frozensection in assessing margins in oral cancer resection. J Maxillofac Oral Surg 2009; 8(4): 357-361.
2. Chiosea SI. Intraoperative margin assessment in early oral squamous cell carcinoma. Surg Pathol Clin 2017; 10(1): 1-14.
3. Wenig BM. Atlas of Head and Neck Pathology (2nd edn). Saunders Elsevier; 2008 : 390-403, 533-534.
4. Michal M, Kacerovská D, Kazakov DV, Skálová A. Pseudotumory a imitátory malignity v patologii hlavy a krku. Cesk Patol 2012; 48(4): 190-197.
5. Hamburger JI, Hamburger SW. Declining role of frozen section in surgical planning for thyroid nodules. Surgery 1985; 98(2): 307-312.
6. LiVolsi VA, Baloch ZW. Use and abuse of frozen section in the diagnosis of follicular thyroid lesions. Endocr Pathol 2005; 16(4): 285-293.
7. Miller MC, Rubin CJ, Cunnane M, et al. Intraoperative pathologic examination: cost effectiveness and clinical value in patients with cytologic diagnosis of cellular follicular thyroid lesion. Thyroid 2007; 17(6): 557-565.
8. Antic T, Taxy JB. Thyroid frozen section: supplementary or unnecessary? Am J Surg Pathol 2013; 37(2): 282-286.
9. Neale ML, Delbridge L, Reeve TS, Poole AG. The value of frozen section examination in planning surgery for follicular thyroid neoplasms. Aust N Z J Surg 1993; 63(8): 610-613.
10. Ganly I, Wang L, Tuttle RM, et al. Invasion rather than nuclear features correlates with outcome in encapsulated follicular tumors: further evidence for the reclassification of the encapsulated papillary thyroid carcinoma follicular variant. Hum Pathol 2015; 46(5): 657-664.
11. Anton RC, Wheeler TM. Frozen section of thyroid and parathyroid specimens. Arch Pathol Lab Med 2005; 129(12): 1575-1584.
12. Osamura RY, Hunt JL. Current practices in performing frozen sections for thyroid and parathyroid pathology. Virchows Arch 2008; 453(5): 433-440.
13. Iacobone M, Scarpa M, Lumachi F, Favia G. Are frozen sections useful and cost-effective in the era of intraoperative qPTH assays? Surgery 2005; 138(6): 1159-1164.
14. Seethala RR, Ogilvie JB, Carty SE, Barnes EL, Yim JH. Parathyroid lipoadenomas and lipohyperplasias: clinicopathologic correlations. Am J Surg Pathol 2008; 32(12): 1854-1867.
15. Rosen IB, Young JE, Archibald SD, Walfish PG, Vale J. Parathyroid cancer: clinical variations and relationship to autotransplantation. Can J Surg 1994; 37(6): 465-469.
16. Bhaker P, Mohan H, Handa U and Kumar S. Role of intraoperative pathology consultation in skeletal tumors and tumor-like lesions. Sarcoma 2014; 2014 : 902104.
17. Bui MM, Smith P, Agresta SV, Cheong D and Letson GD. Practical issues of intraoperative frozen section diagnosis of bone and soft tissue lesions. Cancer Control 2008; 15(1): 7-12.
18. Ashford RU, McCarthy SW, Scolyer RA, Bonar SF, Karim RZ, Stalley PD. Surgical biopsy with intra-operative frozen section. An accurate and cost-effective method for diagnosis of musculoskeletal sarcomas. J Bone Joint Surg Br 2006; 88(9): 1207-1211.
19. Yossepowitch O, Thompson RH, Leibovich BC, at al. Positive surgical margins at partial nephrectomy: predictors and oncological outcomes. J Urol 2008; 179(6): 2158-2163.
20. Lam JS1, Bergman J, Breda A, Schulam PG. Importance of surgical margins in the management of renal cell carcinoma. Nat Clin Pract Urol 2008; 5(6): 308-317.
21. 3. Sidana A, Donovan JF, Gaitonde K. Surgeons‘ preferences and practice patterns regarding intraoperative frozen section during partial nephrectomy. Urol Oncol 2014; 32(6): 864-868.
22. Gordetsky J, Gorin MA, Canner J, et al. Frozen section during partial nephrectomy: Does it predict positive margins? BJU Int 2015; 116(6): 868-872.
23. Liapis H, Gaut JP, Klein C, et al. Banff Working Group. Banff histopathological consensus criteria for preimplantation kidney biopsies. Am J Transplant 2017; 17(1): 140-150.
24. Loeser A, Katzenberger T, Vergho DC, Kocot A, Burger M, Riedmiller H. Frozen section analysis of ureteral margins in patients undergoing radical cystectomy for bladder cancer: differential impact of carcinoma in situ in the bladder on reliability and impact on tumour recurrence in the upper urinary tract. Urol Int 2014; 92(1): 50-54.
25. Satkunasivam R, Hu B, Metcalfe C, et al. Utility and significance of ureteric frozen section analysis during radical cystectomy. BJU Int 2016; 117(3): 463-468.
26. Baltaci S, Adsan O, Ugurlu O, et al. Reliability of frozen section examination of obturator lymph nodes and impact on lymph node dissection borders during radical cystectomy: results of a prospective multicentre study by the Turkish Society of Urooncology. BJU Int 2011; 107(4): 547-553.
27. Nunez AL, Giannico GA, Mukhtar F, Dailey V, El-Galley R, Hameed O. Frozen section evaluation of margins in radical prostatectomy specimens: a contemporary study and literature review. Ann Diagn Pathol 2016; 24 : 11-18.
28. Song J, Li M, Zagaja GP, Taxy JB, Shalhav AL, Al-Ahmadie HA. Intraoperative frozen section assessment of pelvic lymph nodesduring radical prostatectomy is of limited value. BJU Int 2010; 106(10): 1463-1467.
29. Conti A, Santoni M, Burattini L, et al. Update on histopathological evaluation of lymphadenectomy specimens from prostate cancer patients. World J Urol 2017; 35(4): 517-526.
30. Mikuz G, Montironi R, Lopez-Beltran A, Bussolati G. The dilemma of multiorgan donors with high serum PSA--a pathologist‘s proposal. Virchows Arch 2006; 449(2): 273-276.
31. Shen SS, Truong LD, Ro JY. Penis. In: Truong LD, Shen SS, Ro JY, eds. Frozen Setion Library: Genitourinary Tract. New York: Springer Science-Business Media, LLC; 2009 : 95-135.
32. Chipollini J, Tang DH, Manimala N, et at. Evaluating the accuracy of intraoperative frozen section during inguinal lymph node dissection in penile cancer. Urol Oncol 2018; 36(1): 14e1-14e5.
33. Heyns CF, Fleshner N, Sangar V, Schlenker B, Yuvaraja TB, van Poppel H. Management of the lymph nodes in penile cancer. Urology 2010; 76(2 Suppl 1): S43-57.
34. Matei DV, Vartolomei MD, Renne G, et al. Reliability of frozen section examination in a large cohort of testicular masses: what did we learn? Clin Genitourin Cancer 2017; 15(4): e689-e696.
35. Djaladat H. Organ-sparing surgery for testicular tumours. Curr Opin Urol 2015; 25(2): 116-120.
36. Dodat H, Chavrier Y, Dyon JF, et al. Primary testicular tumors in children. Apropos of 23 cases. Chir Pediatr 1986; 27(1): 1-13.
37. Lin JN, Wang KL, Chuang JH. Primary testicular tumors in children. Int Surg 1988; 73(3): 190-192.
38. Sheynkin YR, Sukkarieh T, Lipke M, Cohen HL, Schulsinger DA. Management of nonpalpable testicular tumors. Urology 2004; 63(6): 1163-1167.
39. Moch H, Humphrey PA, Ulbright TM, Reuter VE, eds. WHO classification of tumours of the urinary system and male genital organs (4th ed). Lyon: IARC; 2016.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článek Peroperační biopsie (1. díl)Článek Lidí málo, práce hodně
Článok vyšiel v časopiseČesko-slovenská patologie

2018 Číslo 2-
Všetky články tohto čísla
- Peroperační biopsie (1. díl)
- Lidí málo, práce hodně
- Monitor aneb nemělo by vám uniknout, že...
- Peroperačná biopsia: história, indikácie, kontraindikácie a kontrola kvality
- Peroperačné vyšetrenie pankreasu, žlčníka, extrahepatálnych žlčových ciest, pečene a gastrointestinálneho traktu
- Vzpomínka na MUDr. Šimona Vagundu
- Peroperační biopsie oblasti hlavy a krku, štítné žlázy a příštitných tělísek, měkkých tkání a kostí a urogenitálního traktu
- Dysplazie a adenokarcinom jícnu: studie dvojité exprese intestinálních a gastrických markerů
- Výsledky morfologické depistáže Lynchova syndromu v období 2013-2016
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Peroperačná biopsia: história, indikácie, kontraindikácie a kontrola kvality
- Peroperačné vyšetrenie pankreasu, žlčníka, extrahepatálnych žlčových ciest, pečene a gastrointestinálneho traktu
- Peroperační biopsie oblasti hlavy a krku, štítné žlázy a příštitných tělísek, měkkých tkání a kostí a urogenitálního traktu
- Peroperační biopsie (1. díl)
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



