Metody detekce molekulárních prognostických a prediktivních markerů v diagnostice adenoidně cystického karcinomu slinných žláz
Molecular methods for detection of prognostic and predictive markers in diagnosis of adenoid cystic carcinoma of the salivary gland origin
Adenoid cystic carcinoma of salivary gland origin (AdCC) is second most common salivary carcinoma characterized by frequent recurrences, perineural invasion and high long-term mortality rate. The surgical resection of the tumor in combination with adjuvant radiotherapy is the only method of choice. AdCC has been studied, altogether with immunohistochemistry, by numerous molecular-genetic techniques. Some of them, e.g. reverse-transcription PCR or fluorescent in situ hybridization contributed to the identification of translocation t(6;9)(q22-23;p23-24), which results in fusion of two transcription factors MYB-NFIB. For AdCC is this fusion unique among salivary gland carcinomas and serves as a diagnostical tool in differential diagnosis of histopathologically difficult cases. More complex methods, such as next-generation sequencing helped to detect other molecular level changes; and hence improved understanding of a development, behavior and pathogenesis of this possibly fatal malignancy.
This review summarizes basic knowledge of AdCC on the genome, transcriptome and epigenetic level, which were achieved using molecular-genetic and immunohistochemical methods.
Keywords:
adenoid cystic carcinoma – salivary carcinoma – MYB-NFIB – FISH – aCGH – NGS
Autoři:
Petr Šteiner 1,2; Jaroslav Pavelka 3; Tomáš Vaneček 1,2; Markéta Miesbauerová 1,2; Alena Skálová 1,2
Působiště autorů:
Šiklův ústav patologie, Univerzita Karlova v Praze, Lékařská fakulta v Plzni, Plzeň
1; Bioptická laboratoř, s. r. o., Plzeň
2; Západočeská Univerzita v Plzni, Pedagogická fakulta, Plzeň
3
Vyšlo v časopise:
Čes.-slov. Patol., 54, 2018, No. 3, p. 132-136
Kategorie:
Původní práce
Souhrn
Adenoidně cystický karcinom slinných žláz (AdCC) je druhým nejčastějším salivárním karcinomem charakteristickým častými recidivami, perineurálním šířením a vysokou mortalitou v dlouhodobém horizontu. V léčbě AdCC je metodou volby chirurgická resekce s adjuvantní radioterapií, ale léčba velkých, invadujících a recidivujících karcinomů je zpravidla paliativní. AdCC charakterizuje vysoká incidence nádorově specifického onkogenu MYB-NFIB, který je v současné době diagnostickým markerem, ale mohl by v budoucnu sloužit jako cíl pro biologickou léčbu.
Ve studiu a diagnostice AdCC je využívána imunohistochemie a mnoho molekulárně-genetických metod. Některé metody, jako např. reverzně-transkripční PCR či fluorescenční in-situ hybridizace významnou měrou přispěly k identifikaci translokace t(6;9)(q22-23;p23-24) resultující ve fúzi transkripčních faktorů MYB a NFIB, která je pro AdCC mezi salivárními karcinomy unikátní a slouží při diagnostice histopatologicky obtížných případů. Komplexnější metody jako např. masivně paralelní sekvenování pak detekovaly další změny na molekulární úrovni a tím umožnily lepšímu pochopení vzniku a patogeneze tohoto v dlouhodobém horizontu často fatálně končícího onemocnění.
Tento přehledový článek shrnuje základní poznatky o tomto onemocnění, kterých bylo dosaženo použitím právě imunohistochemických a molekulárně-genetických metod, to je na úrovni genomu, transkriptomu či epigenomu.
Klíčová slova:
adenoidně cystický karcinom – salivární karcinom – MYB-NFIB – FISH – aCGH – NGS
Nádory slinných žláz jsou vzácné, představují jen asi 1 % všech lidských neoplázií. Jsou velmi variabilní, jak v mikroskopickém obraze a imunoprofilu, tak klinickým chováním. Adenoidně cystický karcinom (AdCC) je druhým nejčastějším maligním nádorem malých i velkých slinných žláz a představuje asi 10 % všech salivárních karcinomů. Jedná se o nejčastější karcinom hlavy a krku infiltrující nervy, s peri- a intraneurálním šířením až v 80 % případů (1). AdCC slinných žláz je charakteristický svým pomalým růstem, a přestože se histologicky jedná u většiny pacientů o dobře diferencovaný low-grade karcinom, jeho typickým projevem je prolongovaný klinický průběh trvající zpravidla roky, opakované recidivy, a variabilní riziko vzniku pozdních vzdálených metastáz. Klinický průběh onemocnění u pacientů postižených AdCC slinných žláz se často zdánlivě jeví indolentní, ale z dlouhodobého hlediska se jedná o jeden z nejagresivnějších a nejméně předvídatelných nádorů hlavy a krku. AdCC je také spojen s vysokou mortalitou (2). V individuálním případě je však velmi obtížné až nemožné predikovat klinický průběh nádorového onemocnění jen na základě histomorfologických nálezů.
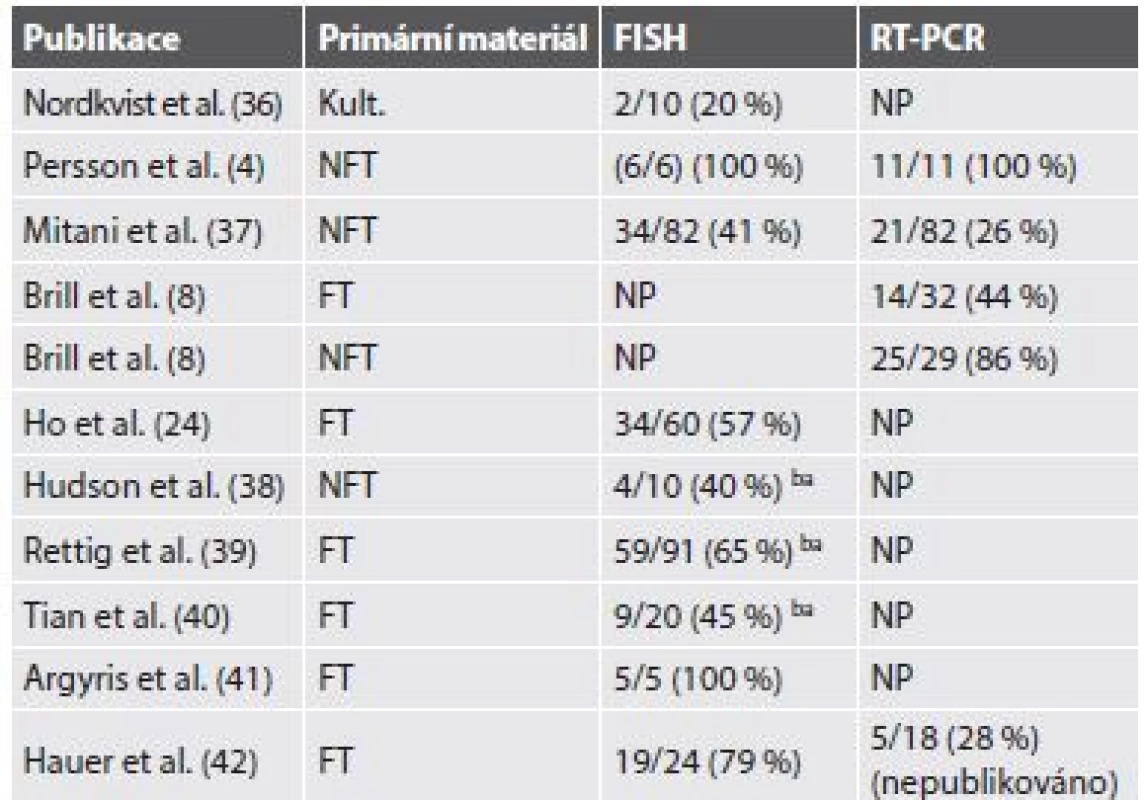
Pro AdCC slinných žláz je typická chromozomální translokace t(6;9)(q22-23;p23-24), která generuje fúzní transkript MYB-NFIB (3). MYB–NFIB fúzní onkogen byl poprvé popsán u AdCC Martou Persson a kol. v roce 2009 (4). Gen MYB, lokalizovaný v oblasti 6q22-23, kóduje transkripční faktor, který hraje zásadní roli v regulaci buněčné proliferace, diferenciace a apoptózy, a tím pravděpodobně i v tumorigenezi AdCC. MYB je vysoce exprimován v nezralých a proliferujících epiteliálních, endoteliálních a hematopoetických buňkách a naopak down-regulován v době, kdy se tyto buňky stanou diferencovanými (3,5). Gen NFIB (Nuclear Factor I/B), lokalizovaný v oblasti 9p23-24, patří do rodiny dimerních DNA-vazebných proteinů fungujících jako buněčný transkripční faktor. Vznik fúzního onkogenu MYB-NFIB vede ke ztrátě 3´ konce MYB genu (od exonu 15 dále), místa, kde dochází k negativní regulaci MYB exprese (4). Následná zvýšená exprese fúzního transkriptu a tím proteinu pak aktivuje transkripci MYB cílových genů, které mají zásadní roli v onkogenní transformaci. MYB-NFIB fúze nebo přestavba MYB genu, které vedou k jeho aktivaci, a tím ke zvýšené expresi MYB–NFIB fúzního proteinu nebo MYB onkoproteinu, byly dosud ze salivárních karcinomů i jiných karcinomů hlavy a krku prokázány pouze u AdCC (3,6). Jedná se tudíž o charakteristický znak těchto maligních sialomů, který se dá využít jako diagnostický marker, s výhodou především u vzdálených metastáz. Zjištěné četnosti fúze MYB-NFIB u AdCC se však v různých studiích liší a závisí především na použité metodice (tab. 1).
V diagnostice AdCC se využívají imunohistochemické a molekulárně-genetické metody od relativně jednoduchých, jako jsou karyotypování, reverzně-transkripční PCR (RT-PCR), reverzně-transkripční PCR v reálném čase (Real-Time RT-PCR), fluorescenční in-situ hybridizace (FISH) až po ty komplexní, mezi které se řadí například komparativní genomová hybridizace na čipu (array comparative genomic hybridization - aCGH), či masivně paralelní sekvenování (Next Generation Sequencing - NGS).
IMUNOHISTOCHEMIE
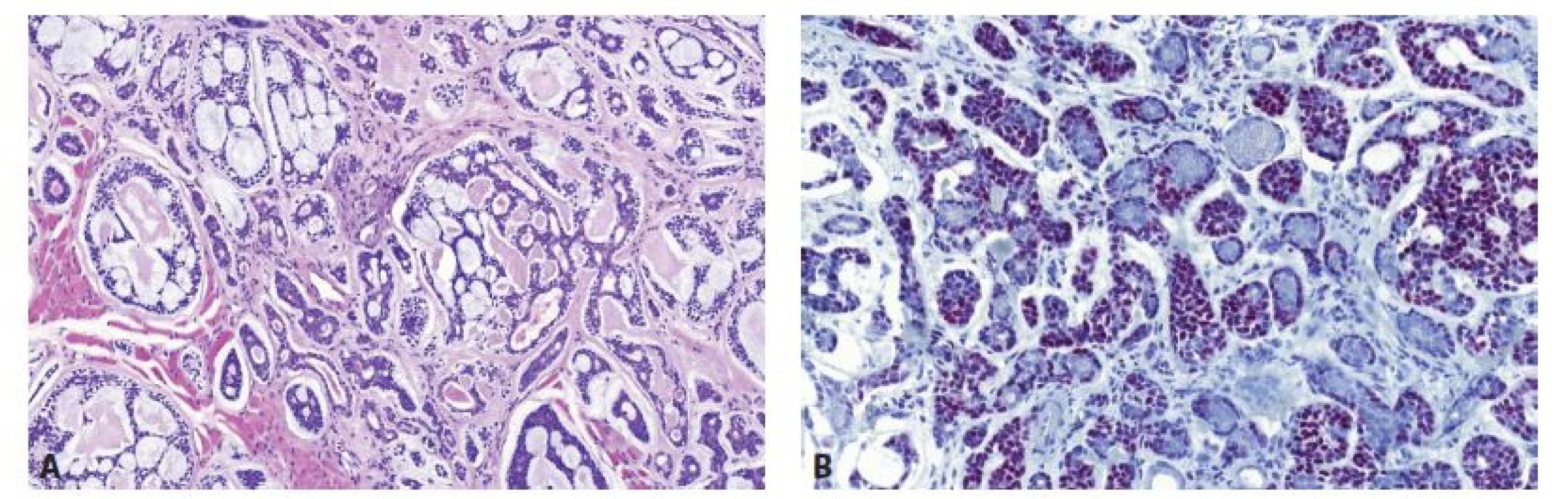
V diagnostice AdCC lze využít jako nespecifickou skríningovou metodu detekci MYB proteinu (protilátka firmy AbCam v ředění 1:100), (obr. 1). Imunopozitivita na průkaz MYB proteinu se však vyskytuje i u některých AdCC případů, u kterých nebyl detekován zlom MYB genu, což naznačuje i jiné mechanismy aktivace MYB signální dráhy. Slabá až střední pozitivita barvení je také detekována až u 14 % jiných typů salivárních nádorů, což, na rozdíl od molekulárně-genetických technik, snižuje specifitu metody (7-9).
REVERZNĚ-TRANSKRIPČNÍ PCR
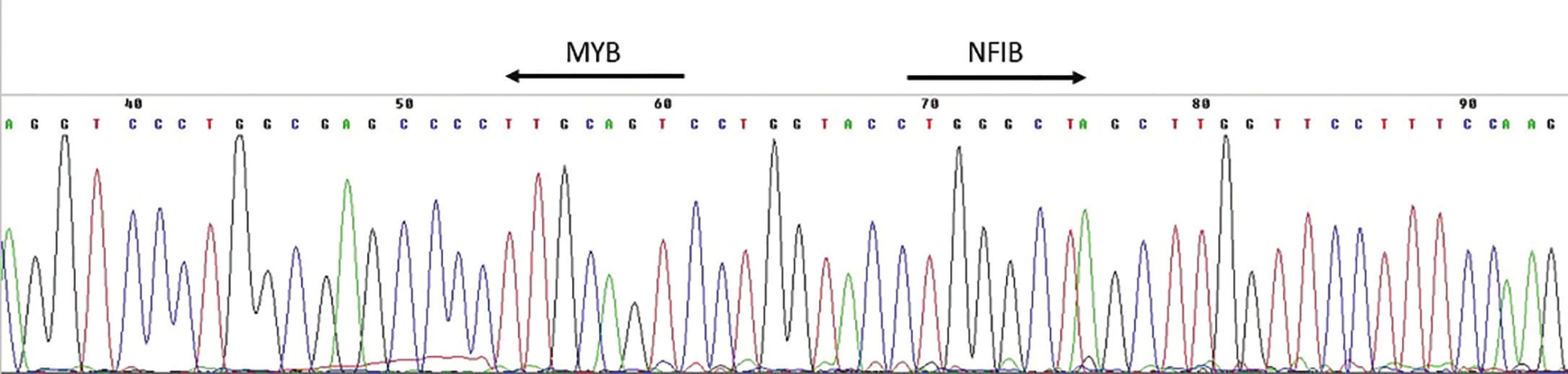
K detekci přítomnosti fúzního transkriptu v cDNA (reverzně přepsaná RNA) je využívána RT-PCR. Jedná se o metodu, kdy pomocí PCR za použití kombinace primerů nasedajících k jednomu i druhému fúznímu partnerovi dochází v přítomnosti fúzního transkriptu k jeho amplifikaci a tím možnosti jeho vizualizace, tj. detekce pomocí elektroforézy (obr. 2)(4). Vzhledem k variabilitě zlomových míst genů MYB a NFIB a faktu, že většina identifikovaných AdCC je dostupná ve formě parafinových bloků obsahujících více či méně degradovanou nukleovou kyselinu, je tato metoda zatížena rizikem falešně negativních výsledků. Studie provedená za použití této techniky detekovala přítomnostMYB-NFIB fúzního transkriptu v cca 30 % AdCC (10), což je výrazně méně než v případě detekce pomocí FISH metody (tab. 1).
Variantu RT-PCR, tzv. Real Time RT-PCR lze využít k relativní kvantifikaci exprese mRNA genu MYB. Pomocí této metody bylo zjištěno, že overexprese MYB mRNA byla detekována u většiny případů AdCC (89 %) s tím, že u případů pozitivních na fúziMYB-NFIB je tato overexprese signifikantně vyšší, než u případů bez této translokace (8,10).
FLUORESCENČNÍ IN-SITU HYBRIDIZACE
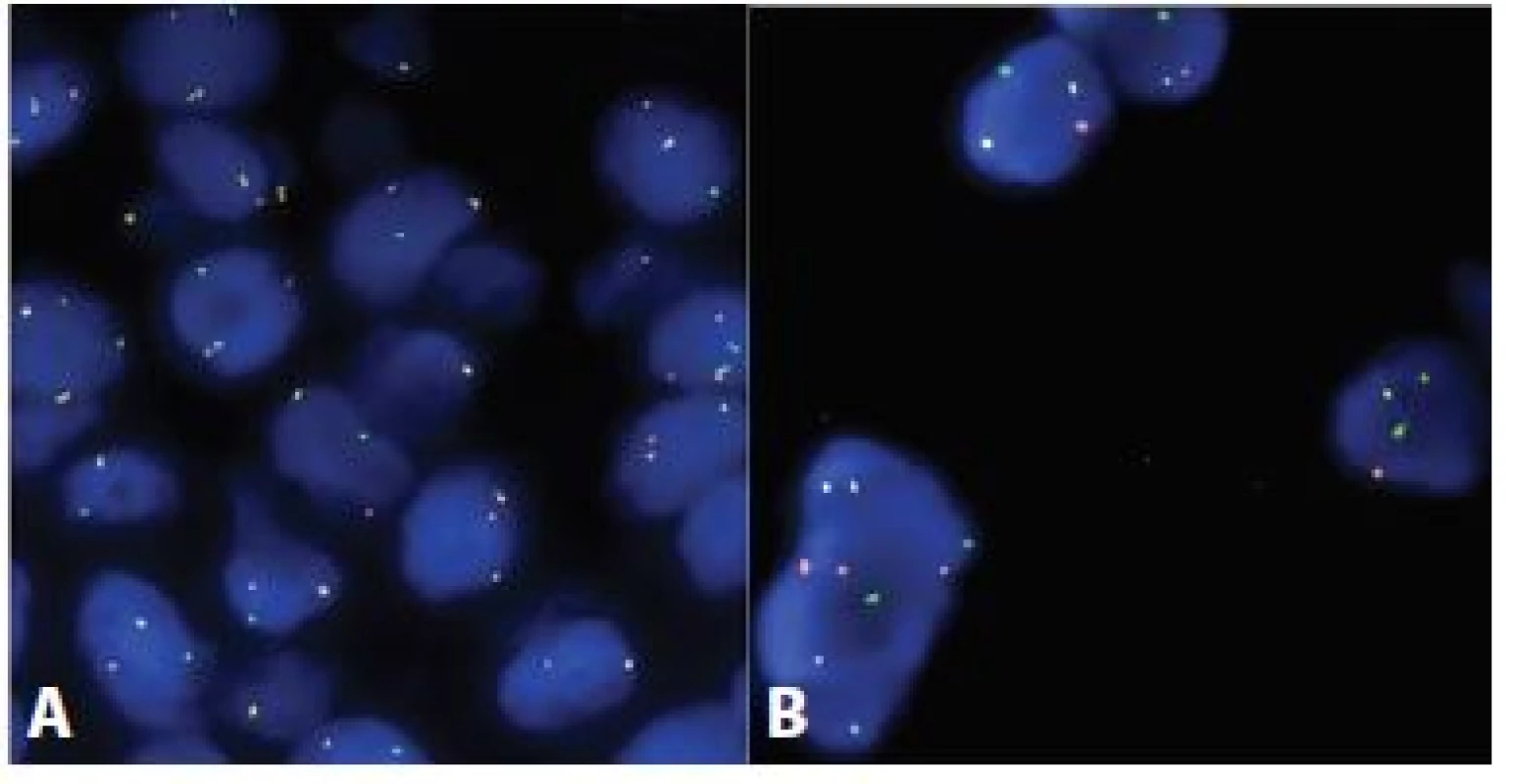
V současnosti nejčastěji využívanou metodou v diagnostice AdCC je FISH analýza cílená na translokaci t(6;9)(q22-23;p23-24). Oproti konvenčním RT-PCR metodám není třeba znát přesnou nukleotidovou pozici zlomových míst, neboť FISH próba, zahrnující kompletní sekvenci studovaných genů a přilehlých oblastí, obsáhne celé široké spektrum možných aberací. Jako sondy se dříve hojně využívaly bakteriální arteficiální chromosomy (BAC). Jejich nevýhodou byly velmi často slabé signály na hůře fixovaném materiálu. V současnosti je dosahováno lepších výsledků s použitím polynukleotidových sond certifikovaných pro in-vitro diagnostiku či oligonukleotidových necertifikovaných sond. Přítomnost fúzního genu pak lze prokazovat přímo - použitím kombinované fúzní sondy (jedna část sondy je cílena na MYB gen a druhá na gen NFIB) či nepřímo - detekcí zlomů jednotlivých zúčastněných genů s použitím tzv. break-apart sond (obr. 3).
Vedle analýzy translokace MYB-NFIB lze FISH použít i ke studiu dalších změn nalezených v AdCC, jako jsou např. numerické aberace genů. Takto byly popsány například relativně raritní amplifikace genu KIT (9) a genu CCND1 (12).
Výše zmíněné metody jsou většinou cílené na jednu konkrétní oblast (například na fúzi MYB-NFIB). K detailnějšímu studiu nádorů je nutné využití komplexnějších analýz.
ARRAY-KOMPARATIVNÍ GENOMOVÁ HYBRIDIZACE
V případě studia početních chromosomálních změn je metodou volby komparativní genomová hybridizace na čipu založená na kompetitivní hybridizaci různě fluorescenčně značené (např. Cy3 a Cy5) nádorové a nenádorové DNA jednoho vzorku na čipu, který obsahuje obvykle 25-70 nt dlouhé oligonukleotidy (sondy) se známou přesnou genomickou lokalizací. Po hybridizaci je čip skenován pro zjištění intensit fluorescencí, kdy z případné převahy intenzity konkrétní barvy lze usuzovat na zisk nebo ztráty jednotlivých regionů korespondujících k daným sondám (13).
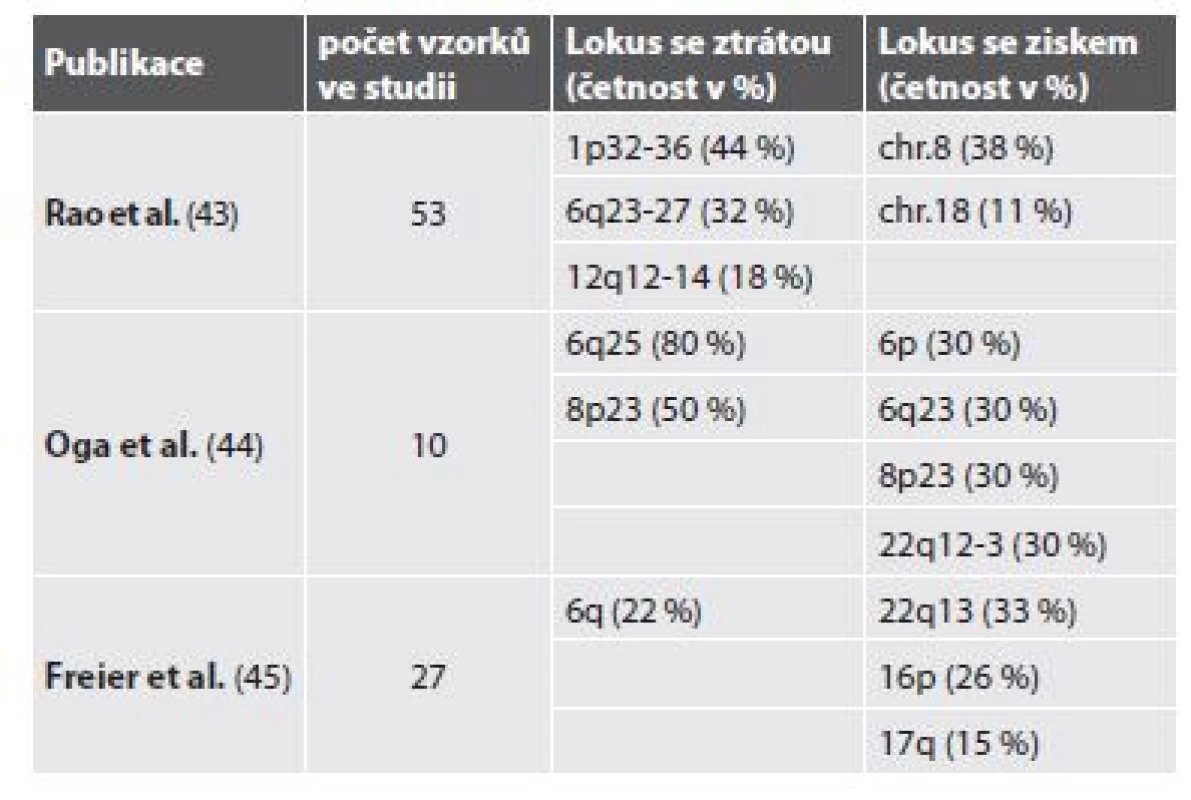
V práci Bernheima a kol. (14) byly pomocí aCGH detekovány rekurentní numerické aberace u bronchiálních a salivárních AdCC. Šlo o parciální ztráty v oblastech 1p35, 6q22-25, 8q12-13, 9p21, 12q12-13, 17p11-13 a zisky (gain) v oblastech 7p15.2, 17q21-25, 22q11-13. Do minimálních oblastí vykazujících deleci se řadily oblasti obsahující tumor-supresorové geny CDKN2A/CDKN2B, TP53 a LIMA1. Minimální oblast s amplifikací byla oblast HOXA genového clusteru (14). V jiných studiích však byla nalezena řada dalších změn v genomu (tab. 2).
EXPRESNÍ ANALÝZA
Komplexnější alternativou k měření exprese pomocí Real-Time RT-PCR je cDNA expresní čip schopný analýzy míry exprese mRNA až celého transkriptomu. Jde o variantu aCGH, kdy jsou na čip, obsahující oligonukleotidy z kódujících oblastí genomu, nahybridizovány fluorescenčně značené cDNA tumoru a zdravé tkáně k detekci rozdílů exprese (15). Touto metodou byla u AdCC například potvrzena zvýšená exprese genu SOX10 (16,17) a obecně upregulace genů ze SOX, NOTCH a WNT genových rodin (18).
MASIVNĚ PARALELNÍ SEKVENOVÁNÍ
V současnosti zřejmě nejkomplexnější metodou s nejvyšší informační výtěžností je masivně paralelní sekvenování nebo také sekvenování nové generace (anglicky next-generation sequencing – NGS).
NGS je schopna nejen prosté analýzy sekvencí nukleotidů v kompletním genomu či jeho vybrané části, ale může detekovat i případné strukturální varianty. Tímto v sobě zahrnuje mimo jiné i jistou náhradu aCGH, Real-Time RT-PCR či expresních arrayí. V případě celogenomového či RNA (transkriptomového) sekvenování je izolována DNA či RNA, která se přepíše do cDNA. Takto připravená DNA je pak různými metodami fragmentována na kratší úseky vhodné pro další zpracování. U cíleného sekvenování vybraných částí genomu či transkriptomu se po izolaci DNA či RNA (přepsané do cDNA) nejprve vychytávají hybridizací či obohacují amplifikací konkrétní oblasti zájmů. Pak již, pro oba přístupy společně, následuje ligace adapterů a amplifikace produktu s použitím primerů nasedajících ke komplementárním sekvencím na adapterech. Po přečištění amplifikátu je vzniklý produkt – knihovna připraven k vlastnímu sekvenování a následně k analýze dat. V současné době jsou nejrozšířenějšími postupy „Sequence-by-synthesis“ metody využívající fluorescenční značení a metody využívající analýzu změny pH (19,20).
NGS metody se také významně zapsaly do molekulární charakterizace AdCC. V roce 2016 byl celogenomovým sekvenováním odhalen gen MYBL1 jako alternativní fúzní partner NFIB u 5 z 12 MYB-NFIB negativních případů (21). Přibližně ve stejné době pak Brayer a kol. získali obdobnou informaci pomocí RNA sekvenování (22). Mimo to bylo těmito skupinami identifikováno několik nových vzácně se vyskytujících fúzí – genů YTHDF3 a RAD51B s MYBL1 genem, dále genů XRCC4, NKAIN2, PTPRD a AIG1 genů s genem NFIB.
Tyto studie, stejně jako některé další, také potvrdily nízkou frekvenci genových mutací (substitucí, krátkých delecí, inzercí apod.) u AdCC. Pokud již byly mutace nalezeny, jako ve studii Stephens a kol. (23), zasahovaly především geny z NOTCH signální dráhy. Příkladem je gen SPEN mutovaný u 20,8 % pacientů. Gen SPEN je lokalizovaný na lokusu 1p36. Kóduje represor transkripce s RNA SPOC (Spen paralog and ortholog C-terminal) vazebnými doménami, regulující především NOTCH signální dráhu. Všechny nalezené mutace vyústily ve zkrácený protein s chybějící regulační SPOC doménou. Ve stejné studii byla v 8,3 % případů také identifikována aktivující mutace FGFR2 analogická k mutacím nalezeným u ovariálních a endometriálních nádorů, poukazující na možnosti léčebného využití u této podskupiny pacientů (23). Ve studii Ho a kol. (24) byly použitím kombinace celogenomového a exomového sekvenování na kohortě 60 případů detekovány mutace zasahující chromatin remodelující geny, dále i geny z FGF/IGF/PI3K, PKA a NOTCH signálních drah. V malém procentu případů negativních na MYB-NFIB fúzi pak byly pozorovány pravděpodobně aktivující mutace genu MYB (24).
Expresní studie využívající jak čipovou, tak NGS technologii přinesly další vhled do karcinogeneze AdCC. Prokázaly například, že u tumorů s fúzemi MYB-NFIB a MYBL1-NFIB nejsou signifikantní rozdíly v expresích analyzovaných genů. Naproti tomu, klastrová analýza expresních profilů odlišila vzorky s translokacemi zasahujícími exon 11 nebo vyšší v MYB, popř. MYBL1 genu od vzorků s translokacemi zasahujícími exony 8 nebo 9 těchto genů (21). Bell a kol. (25) pak zkoumali transkriptom AdCC se zaměřením na rozdíly mezi epiteliálně (E-AdCC) a myoepiteliálně (M-AdCC) dominantními AdCC. Nalezli 430 transkriptů specifických pro E-AdCC, 392 pro M-AdCC a 424 transkriptů, které byly společné pro oba typy. Jejich detailní analýza pak ukázala na možné použití DLX-6 genu jako biomarkeru pro E-AdCC a KRT16, SOX11 a MYB genů pro M-AdCC (25).
METODY PRO DETEKCI METYLACÍ PROMOTORŮ GENŮ
Výše zmíněné studie se zabývaly strukturou vlastní nukleové kyseliny, popř. mírou její exprese. Významnou funkci v karcinogenezi má však též epigenetika, tj. ovlivnění exprese genů beze změny nukleotidové sekvence. Toto se na úrovni DNA děje nejčastěji prostřednictvím metylací promotorových oblastí genů vyúsťujících v potlačení exprese daných genů a je tedy logicky dalším předmětem zájmu při charakterizaci nádorových onemocnění.
Metylační status promotorů genů lze zjišťovat řadou odlišných způsobů. Nejčastěji používaným způsobem je metylačně sensitivní PCR (MSP), při které se metylované cytosiny v DNA nejprve konvertují bisulfidovou reakcí na uracil a takto konvertovaný templát je pak amplifikován pomocí PCR za použití primerů specifických jak k metylované tak nemetylované sekvenci. V pozitivním případě vzniká v reakci obsahující primery pro metylovaný promotor elektroforeticky či fluorescenčně detekovatelný produkt amplifikace.
Maruya a kol. (26) pomocí MSP detekovali metylaci promotoru E-cadherinu (CDH1) u 70 % případů AdCC. V obdobné studii Zhang a kol. (27) identifikovali metylovaný promotor CDH1 u 57 % pacientů, zde však, na rozdíl od výše zmíněné studie, metylační status promotoru CDH1 koreloval s pokročilejším stádiem tumoru a také perineurálním šířením AdCC. V dalších studiích využívajících MSP pak byla zjištěna zvýšená metylace promotorů genů p16 u 49,1 % (28) a 46,7 % (29) pacientů, dále genů RASSF1A celkem u 33,8 % pacientů, DAPK u 20,9 %, MGMT u 5,8 % (29,30), RARβ2 u 3,8 % (30) a genu RUNX3 u 75 % pacientů, jehož nízká exprese korelovala s vyšší agresivitou AdCC (31). Ve studii Shao a kol. (32) byla studována metylace genu MYB s negativním výsledkem u všech 18-ti analyzovaných případů AdCC. V práci Tan a kol. (33) pak byla detekována hypometylace Aquaporinu-1 u 75,3 % AdCC pacientů, avšak nekorelující s klinickými parametry.
Další metodou, použitou ke studiu metylačního profilu AdCC byla Metylated CpG Island Amplification (MCIA), která je založena na štěpení DNA 2 různými metylačně sensitivními restrikčními enzymy s následnou amplifikací PCR. Nádorová a kontrolní DNA jsou poté označeny Cy3 a Cy5 a hybridizovány na čipu. Porovnáním intensity výsledných barev (princip aCGH) lze zjistit míru metylace daných promotorů.
Ve studiích jež používali MCIA metody pak bylo identifikováno 32 hypermetylovaných genů, mezi nimi např. EN1, FOXE1, GBX2, FOXL1 a 7 hypometylovaných genů, jako např. FBXO17, PHKG1, LOXL1, DOCK1 a PARVG. Nejvýznamnějším z těchto výsledků byla hypermetylace EN1 – genu ovlivňujícím vývoj CNS, která koreluje se stádiem, lokalizací a klinickým chováním nádoru (34,35).
ZÁVĚR
Na základě našich zkušeností s detekcí translokací MYB-NFIB,popř. MYBL1-NFIB lze říci, že především FISH analýza za použití break-apart a fúzních sond představuje spolehlivý diagnostický nástroj u jinak obtížně diagnostikovatelných AdCC různých tkání. Oproti tomu RT-PCR dává často falešně negativní výsledky kvůli využívání parafinových bločků a tím degradované RNA, či pro možný výskyt alternativních zlomových míst. Jako slibný prognostický marker AdCC se dle našich závěrů jeví delece lokusu 1p36, která výrazně koreluje s nižším přežíváním pacientů.
Adenoidně cystický karcinom je druhým nejčastějším maligním nádorem slinných žláz, je diagnosticky obtížný, neúprosně progredující a v mnoha případech fatálně končící nádor. Metody molekulární biologie, vedle histopatologie a imunoprofilu, významně pomáhají lepšímu pochopení vzniku, chování a vývoji tohoto onemocnění, což v budoucnu může vyústit v objev nové, účinnější léčby.
PODĚKOVÁNÍ
Tato práce byla z části podpořena grantem SVV-2017-260 391.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmu a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toho prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
Mgr. Petr Šteiner
Bioptická laboratoř s.r.o.
Mikulášské náměstí 4, 326 00, Plzeň
tel: +420 732 961 886
e-mail.: steiner@biopticka.cz
Zdroje
1. Amit M, Binenbaum Y, Trejo-Leider L, et al. International collaborative validation of intraneural invasion as a prognostic marker in adenoid cystic carcinoma of the head and neck. Head Neck 2015; 37(7): 1038-1045.
2. Stenam G, Licitra L, Said-Al-Naief N, van Zante A, Yarbrough WG. Adenoid Cystic Carcinoma. In: El-Naggar AK, Chan JKC, Grandis JR, Takata T, Slootweg PJ, eds. World Health Organization (WHO) Classification of Head and Neck Tumours. (4th ed). Lyon, France: IARC Press; 2017: 164-165.
3. Stenman G. Fusion oncogenes in salivary gland tumors: molecular and clinical consequences. Head Neck Pathol 2013; 7 Suppl 1: S12-19.
4. Persson M, Andrén Y, Mark J, Horlings HM, Persson F, Stenman G. Recurrent fusion of MYB and NFIB transcription factor genes in carcinomas of the breast and head and neck. Proc Natl Acad Sci U S A 2009; 106(44): 18740-18744.
5. Stenman G, Persson F, Andersson MK. Diagnostic and therapeutic implications of new molecular biomarkers in salivary gland cancers. Oral Oncol 2014; 50(8): 683-690.
6. Simpson RH, Skálová A, Di Palma S, Leivo I. Recent advances in the diagnostic pathology of salivary carcinomas. Virchows Arch 2014; 465(4): 371-384.
7. West RB, Kong C, Clarke N, et al. MYB expression and translocation in adenoid cystic carcinomas and other salivary gland tumors with clinicopathologic correlation. Am J Surg Pathol 2011; 35(1): 92-99.
8. Brill LB, Kanner WA, Fehr A, et al. Analysis of MYB expression and MYB-NFIB gene fusions in adenoid cystic carcinoma and other salivary neoplasms. Mod Pathol 2011; 24(9): 1169-1176.
9. Rooney SL, Robinson RA. Immunohistochemical expression of MYB in salivary gland basal cell adenocarcinoma and basal cell adenoma. J Oral Pathol Med. In press 2017.
10. Mitani Y, Li J, Rao PH, et al. Comprehensive analysis of the MYB-NFIB gene fusion in salivary adenoid cystic carcinoma: Incidence, variability, and clinicopathologic significance. Clin Cancer Res 2010; 16(19): 4722-4731.
11. Freier K, Flechtenmacher C, Walch A, et al. Differential KIT expression in histological subtypes of adenoid cystic carcinoma (ACC) of the salivary gland. Oral Oncol 2005; 41(9): 934-939.
12. Greer RO, Said S, Shroyer KR, Marileila VG, Weed SA. Overexpression of cyclin D1 and cortactin is primarily independent of gene amplification in salivary gland adenoid cystic carcinoma. Oral Oncol 2007; 43(8): 735-741.
13. Szuhai K, Vermeer M. Microarray Techniques to Analyze Copy-Number Alterations in Genomic DNA: Array Comparative Genomic Hybridization and Single-Nucleotide Polymorphism Array. J Invest Dermatol 2015; 135(10): e37.doi:10.1038/jid.2015.308
14. Bernheim A, Toujani S, Saulnier P, et al. High-resolution array comparative genomic hybridization analysis of human bronchial and salivary adenoid cystic carcinoma. Lab Invest 2008; 88(5): 464-473.
15. Ylstra B, van den Ijssel P, Carvalho B, Brakenhoff RH, Meijer GA. BAC to the future! or oligonucleotides: a perspective for micro array comparative genomic hybridization (array CGH). Nucleic Acids Res 2006; 34(2): 445-450.
16. Ohtomo R, Mori T, Shibata S, et al. SOX10 is a novel marker of acinus and intercalated duct differentiation in salivary gland tumors: a clue to the histogenesis for tumor diagnosis. Mod Pathol 2013; 26(8): 1041-1050.
17. Ivanov SV, Panaccione A, Nonaka D, et al. Diagnostic SOX10 gene signatures in salivary adenoid cystic and breast basal-like carcinomas. Br J Cancer 2013; 109(2): 444-451.
18. Chen W, Zhang HL, Shao XJ, et al. Gene expression profile of salivary adenoid cystic carcinoma associated with perineural invasion. Tohoku J Exp Med 2007; 212(3): 319-334.
19. Ambardar S, Gupta R, Trakroo D, Lal R, Vakhlu J. High Throughput Sequencing: An Overview of Sequencing Chemistry. Indian J Microbiol 2016; 56(4): 394-404.
20. Apaga DL, Dennis SE, Salvador JM, Calacal GC, De Ungria MC. Comparison of Two Massively Parallel Sequencing Platforms using 83 Single Nucleotide Polymorphisms for Human Identification. Sci Rep 2017; 7(1): 398.
21. Mitani Y, Liu B, Rao PH, et al. Novel MYBL1 Gene Rearrangements with Recurrent MYBL1-NFIB Fusions in Salivary Adenoid Cystic Carcinomas Lacking t(6;9) Translocations. Clin Cancer Res 2016; 22(3): 725-733.
22. Brayer KJ, Frerich CA, Kang H, Ness SA. Recurrent Fusions in MYB and MYBL1 Define a Common, Transcription Factor-Driven Oncogenic Pathway in Salivary Gland Adenoid Cystic Carcinoma. Cancer Discov 2016; 6(2): 176-187.
23. Stephens PJ, Davies HR, Mitani Y, et al. Whole exome sequencing of adenoid cystic carcinoma. J Clin Invest 2013; 123(7): 2965-2968.
24. Ho AS, Kannan K, Roy DM, et al. The mutational landscape of adenoid cystic carcinoma. Nat Genet 2013; 45(7): 791-798.
25. Bell D, Bell AH, Bondaruk J, Hanna EY, Weber RS. In-depth characterization of the salivary adenoid cystic carcinoma transcriptome with emphasis on dominant cell type. Cancer 2016; 122(10): 1513-1522.
26. Maruya S, Kurotaki H, Wada R, Saku T, Shinkawa H, Yagihashi S. Promoter methylation and protein expression of the E-cadherin gene in the clinicopathologic assessment of adenoid cystic carcinoma. Mod Pathol 2004; 17(6): 637-645.
27. Zhang CY, Mao L, Li L, et al. Promoter methylation as a common mechanism for inactivating E-cadherin in human salivary gland adenoid cystic carcinoma. Cancer 2007; 110(1): 87-95.
28. Guo XL, Sun SZ, Wei FC. [Mechanisms of p16 gene inactivation salivary adenoid cystic carcinoma]. Hua Xi Kou Qiang Yi Xue Za Zhi 2005; 23(5): 418-420.
29. Li J, El-Naggar A, Mao L. Promoter methylation of p16INK4a, RASSF1A, and DAPK is frequent in salivary adenoid cystic carcinoma. Cancer 2005; 104(4): 771-776.
30. Williams MD, Chakravarti N, Kies MS, et al. Implications of methylation patterns of cancer genes in salivary gland tumors. Clin Cancer Res 2006; 12(24): 7353-7358.
31. Sasahira T, Kurihara M, Yamamoto K, Bhawal UK, Kirita T, Kuniyasu H. Downregulation of runt-related transcription factor 3 associated with poor prognosis of adenoid cystic and mucoepidermoid carcinomas of the salivary gland. Cancer Sci 2011; 102(2): 492-497.
32. Shao C, Bai W, Junn JC, et al. Evaluation of MYB promoter methylation in salivary adenoid cystic carcinoma. Oral Oncol 2011; 47(4): 251-255.
33. Tan M, Shao C, Bishop JA, et al. Aquaporin-1 promoter hypermethylation is associated with improved prognosis in salivary gland adenoid cystic carcinoma. Otolaryngol Head Neck Surg 2014; 150(5): 801-807.
34. Bell A, Bell D, Weber RS, El-Naggar AK. CpG island methylation profiling in human salivary gland adenoid cystic carcinoma. Cancer 2011; 117(13): 2898-2909.
35. Bell D, Bell A, Roberts D, Weber RS, El-Naggar AK. Developmental transcription factor EN1--a novel biomarker in human salivary gland adenoid cystic carcinoma. Cancer 2012; 118(5): 1288-1292.
36. Nordkvist A, Mark J, Gustafsson H, Bang G, Stenman G. Non-random chromosome rearrangements in adenoid cystic carcinoma of the salivary glands. Genes Chromosomes Cancer 1994; 10(2): 115-121.
37. Mitani Y, Rao PH, Futreal PA, et al. Novel chromosomal rearrangements and break points at the t(6;9) in salivary adenoid cystic carcinoma: association with MYB-NFIB chimeric fusion, MYB expression, and clinical outcome. Clin Cancer Res 2011; 17(22): 7003-7014.
38. Hudson JB, Collins BT. MYB gene abnormalities t(6;9) in adenoid cystic carcinoma fine-needle aspiration biopsy using fluorescence in situ hybridization. Arch Pathol Lab Med 2014; 138(3): 403-409.
39. Rettig EM, Tan M, Ling S, et al. MYB rearrangement and clinicopathologic characteristics in head and neck adenoid cystic carcinoma. Laryngoscope 2015; 125(9): E292-299.
40. Tian Z, Li L, Zhang CY, Gu T, Li J. Differences in MYB expression and gene abnormalities further confirm that salivary cribriform basal cell tumors and adenoid cystic carcinoma are two distinct tumor entities. J Oral Pathol Med 2016; 45(9): 698-703.
41. Argyris PP, Wetzel SL, Greipp P, et al. Clinical utility of myb rearrangement detection and p63/p40 immunophenotyping in the diagnosis of adenoid cystic carcinoma of minor salivary glands: a pilot study. Oral Surg Oral Med Oral Pathol Oral Radiol 2016; 121(3): 282-289.
42. Hauer L, Skálová A, Šteiner P, et al. Adenoidně cystický karcinom slinných žláz. Soubor 27 pacientů. Česká Stomatologie 2016; 116(3): 57-65.
43. Rao PH, Roberts D, Zhao YJ, et al. Deletion of 1p32-p36 is the most frequent genetic change and poor prognostic marker in adenoid cystic carcinoma of the salivary glands. Clin Cancer Res 2008; 14(16): 5181-5187.
44. Oga A, Uchida K, Nakao M, et al. Loss of 6q or 8p23 is associated with the total number of DNA copy number aberrations in adenoid cystic carcinoma. Oncol Rep 2011; 26(6): 1393-1398.
45. Freier K, Flechtenmacher C, Walch A, et al. Copy number gains on 22q13 in adenoid cystic carcinoma of the salivary gland revealed by comparative genomic hybridization and tissue microarray analysis. Cancer Genet Cytogenet 2005; 159(1): 89-95.
Štítky
Patológia Súdne lekárstvo ToxikológiaČlánok vyšiel v časopise
Česko-slovenská patologie

2018 Číslo 3
Najčítanejšie v tomto čísle
- Peroperačná diagnostika nádorov centrálneho nervového systému
- Peroperační biopsie v gynekopatologii
- Aberantní axilární tkáň mléčné žlázy s pseudoangiomatózní stromální hyperplázií u muže
- Metody detekce molekulárních prognostických a prediktivních markerů v diagnostice adenoidně cystického karcinomu slinných žláz
