-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Morfologické nálezy v placentě asociované s infekcí SARS-CoV-2
Morphologic findings in placenta associated with SARS-CoV-2 infection
SARS-CoV-2 infection in pregnancy can cause a number of serious complications, including fetal growth restriction or intrauterine fetal death. It appears that transplacental transmission of infection is rare and the arising complications are due to damage of placental parenchyma. The aim of this article is to summarize the results of recent publications dealing with placental changes in COVID-19 disease, with special consideration to the morphology of the newly defined SARS-CoV-2 placentitis.
Keywords:
Placenta – SARS-CoV-2 – COVID-19 – morphology – placentitis
Autori: Magdaléna Daumová 1,2; Šárka Hadravská 1,2; Andrea Straková Peteříková 1
Pôsobisko autorov: Šiklův ústav patologie LFP UK a FN Plzeň 1; Bioptická laboratoř s. r. o., Plzeň 2
Vyšlo v časopise: Čes.-slov. Patol., 57, 2021, No. 4, p. 199-202
Kategória: Přehledový článek
Súhrn
Infekce virem SARS-CoV-2 v graviditě může být příčinou řady závažných komplikací včetně růstové restrikce plodu či jeho nitroděložního odumření. Zdá se, že obávaný transplacentární přenos infekce je vzácný a že vzniklé komplikace vyplývají z poškození placentárního parenchymu. Cílem tohoto článku je sumarizace výsledků současných publikací zabývajících se změnami v placentách při onemocnění COVID-19 se zvláštním přihlédnutím k morfologii nově definované SARS-CoV-2 placentitidy.
Klíčová slova:
placenta – SARS-CoV-2 – COVID-19 – morfologie – placentitida
Po propuknutí těžké pneumonie neznámé etiologie u obyvatel čínského Wu-chanu koncem roku 2019 byl záhy identifikován původce tohoto onemocnění, beta-koronavirus (1), který byl později na základě fylogenetické analýzy Mezinárodního výboru pro taxonomii virů oficiálně označen jako virus těžkého akutního respiračního syndromu 2 (SARS-CoV-2) (2). V krátkém časovém horizontu došlo k rozšíření nákazy na další kontinenty a v březnu roku 2020 prohlásila Světová zdravotnická organizace (WHO) šíření SARS-CoV-2 za pandemii.
Manifestace onemocnění je značně variabilní, od inaparentní nákazy až po velmi závažné stavy komplikované postižením mnoha orgánových systémů, které často končí fatálně (3-5). Řada současných prací uvádí, že tato infekce může negativním způsobem ovlivnit průběh gravidity a přibývá důkazů, že virus SARS-CoV-2 vyvolává v placentě specifické histopatologické změny, které mohou být příčinou fetálních a neonatálních komplikací.
Pro vstup SARS-CoV-2 do hostitelské buňky je klíčová vazba virového S-proteinu na angiotenzin-konvertující enzym 2 (ACE2) (6), který je přítomen na povrchu buněk řady orgánů včetně placenty. (7). Již delší dobu je známo, že exprese ACE2 v placentě se během gravidity mění. Zatímco v časných stádiích těhotenství je patrná zejména v oblasti deciduy (8), s přibývající délkou gravidity byla vyšší exprese ACE2 zaznamenána v syncytiotrofoblastu, v endotelu cév choriových klků a v cytotrofoblastu (8-10). Tyto změny v distribuci ACE2 naznačují, že by se vnímavost placety k infekci SARS-CoV-2, ale i její projevy v placentě mohly v různých stádiích gravidity lišit. Je důležité si uvědomit, že přítomnost infekčního agens v placentě nemusí nutně vést k přenosu na plod (11). Ačkoli je popisována možná souvislost maternální infekce SARS-CoV-2 se spontánními aborty či porody mrtvého plodu (12-14), z výsledků současných publikací vyplývá, že transplacentární přenos onemocnění je spíše vzácností (15-17). Na rozdíl od jiných virových infekcí nebyl u kongenitální infekce SARS-CoV-2 dosud pozorován teratogenní účinek.
Souhrn současných poznatků o morfologii placenty při infekci SARS-CoV-2
Výsledky prvotních studií poukazovaly zejména na možnou souvislost mezi maternální infekcí SARS-CoV-2 a přítomností placentárních změn charakteristických pro maternální a fetální vaskulární malperfúzi (10,12,18-27). Maternální vaskulární malperfúze (MVM) je souhrnný termín pro skupinu patologických změn vznikajících v důsledku alterace uteroplacentárního krevního oběhu. Mezi tyto změny patří hypoplázie placenty, retroplacentární hematom, vilózní infarkty, distální vilózní hypoplázie, akcelerovaná maturace choriových klků či deciduální arteriopatie (28,29). Fetální vaskulární malperfúze (FVM) je naproti tomu zastřešující termín pro soubor patologických změn vznikajících v důsledku alterace fetoplacentárního krevního oběhu. Trombózy, resp. vazivová obliterace lumin fetálních cév, avaskulární choriové klky, vilózní stromovaskulární karyorrhexe, intramurální fibrinová depozita (ve stěnách fetálních cév) a vaskulární ektázie (dilatace fetálních cév) patří mezi projevy FVM (28,30).
Předpokládá se, že v patogenezi MVM by mohla hrát roli hypoxie, vznikající v důsledku těžkého onemocnění u matky. Hypoxie může vést k hypoperfúzi orgánů a následnému hypoxicko - ischemickému poškození placenty (31,32). V případě FVM je situace nejasná, nelze vyloučit přímé působení viru na stěnu fetálních cév, ani možnost sekundárního poškození endotelu při aktivaci fetálního imunitního systému (18,31,33,34).
K výsledkům těchto studií je však prozatím třeba přistupovat poněkud rezervovaně. Do primárních souborů byly totiž často zařazeny všechny placenty od pozitivně testovaných matek bez ohledu na průkaz přítomnosti viru v placentární tkáni. Dalším limitujícím faktorem je v některých případech i absence vhodné kontrolní skupiny. Je třeba zdůraznit, že žádná z primárních studií neprokázala signifikantně vyšší frekvenci některé z morfologických změn typických pro MVM, resp. FVM. Vzhledem k tomu, že tyto změny se objevují v asociaci s mnoha dalšími patologickými stavy komplikujícími graviditu (v případě MVM jde zejména o hypertenzní choroby či maternální diabetes, u FVM se často jedná o mechanické vlivy ovlivňující průtok krve umbilikálními cévami) (29,30,35), je nutné je považovat za nespecifické a interpretovat je vždy v kontextu s celkovými klinickými údaji.
Vzhledem k virové povaze onemocnění byla od počátku pandemie diskutována možnost zánětlivého poškození placenty. Do současné doby byla dokumentována řada případů akutních i chronických zánětlivých placentárních lézí asociovaných s touto infekcí včetně akutní chorioamionitidy (13,18,36-38), lymfohistiocytární vilitidy (10,26,27,39), chronické deciduitidy (26) a chronické histiocytární intervilositidy (13,24,40-42). Zejména poslední zmiňovaná jednotka, chronická histiocytární intervilositida, dosahuje podle současných dat statistické významnosti. Kromě tohoto chronického zánětu se v různě velkých souborech placent s konfirmovanou SARS-CoV-2 infekcí podařilo opakovaně prokázat zvýšenou tendenci k ukládání perivilózního fibrinoidu (41,43-46) a nekrózy vilózního trofoblastu (23,27,41,43,44,47). Na základě těchto opakovaných pozorování byla v recentní práci uznávaných autorů pod vedením D. J. Roberts definována triáda histopatologických změn charakterizujících SARS-CoV-2 placentitidu. Tato triáda zahrnuje přítomnost chronické histiocytární intervilositidy, depozit perivilózního fibrinoidu a nekróz vilózního trofoblastu. Autoři však zároveň doporučují ověření přítomnosti placentární infekce za pomoci imunohistochemie či molekulárně biologických metod i v morfologicky typických případech (11). Důvodem je zejména podobnost s jinými záněty infekční i neinfekční etiologie.
DISKUZE
Ačkoli je infekce placenty virem SARS-CoV-2 poměrně vzácná, lze předpokládat, že se s ní budeme setkávat i v budoucnu a nelze vyloučit, že nové virulentnější varianty viru by mohly vést k nárůstu nových případů i možných perinatálních komplikací.
Obávanou komplikací placentární infekce SARS-CoV-2 je zejména vertikální intrauterinní přenos na plod. Výsledky současných studií však naznačují, že k této formě přenosu dochází jen velmi vzácně (15,48,49). Přesto je třeba mít na paměti, že kongenitální infekce SARS-CoV-2 může být u novorozence příčinou velmi těžkého stavu vyžadujícího intenzivní péči (45). Komplikace v podobě intrauterinní růstové restrikce, předčasného porodu, spontánního abortu či porodu mrtvého plodu jsou spíše důsledkem placentárního poškození (11,50).
Počáteční retrospektivní analýzy poukazovaly zejména na možnou souvislost mezi infekcí SARS-CoV-2 a placentární malperfúzí. Přesto, že ve prospěch těchto nálezů hovoří řada logických argumentů, není jejich patogeneze plně objasněna a bude tedy pravděpodobně předmětem dalších výzkumů.
Ve světle současných poznatků můžeme konstatovat, že specifickým morfologickým obrazem infekce placenty virem SARS-CoV-2 je chronická histiocytární intervilositida, doprovázená nekrózami vilózního trofoblastu a zvýšeným ukládáním perivilózního fibrinoidu. V zánětlivém infiltrátu lze kromě histiocytů najít i různě intenzivní příměs neutrofilních granulocytů (Obr. 1A-1C). Tento znak ji do jisté míry odlišuje od chronické histiocytární intervilositidy neinfekčního původu, která představuje hlavní diferenciální diagnózu. Rovněž nekrózy vilózního trofoblastu nebývají konstantním nálezem u chronické neinfekční intervilositidy. Depozita perivilózního fibrinoidu mohou být objemná a v některých případech patrná již při makroskopickém vyšetření. Přítomnost viru SARS-CoV-2 v placentě lze prokázat molekulárně genetickým (in situ hybridizace, popř. PCR) či imunohistochemickým vyšetřením (Obr.1D). Exprese virových proteinů byla zaznamenána především v buňkách vilózního trofoblastu (syncytiotrofoblastu) (10,22,24,41,42).
Obr. 1. A: SARS-CoV-2 placentitida: Chronická histiocytární intervilositida s depozity perivilózního fibrinoidu a nekrózou vilózního trofoblastu (HE, 200x).
B: Chronická zánětlivá celulizace s příměsí neutrofilních granulocytů v intervilózních prostorách, destrukce vilózního trofoblastu (HE, 400x).
C: Imunohistochemický průkaz histiocytů v intervilózních prostorách (CD68, 200x).
D: Imunohistochemický průkaz virového nukleokapsidového proteinu v cytoplazmě vilózního trofoblastu (SARS-CoV-2 BioSB, 200x).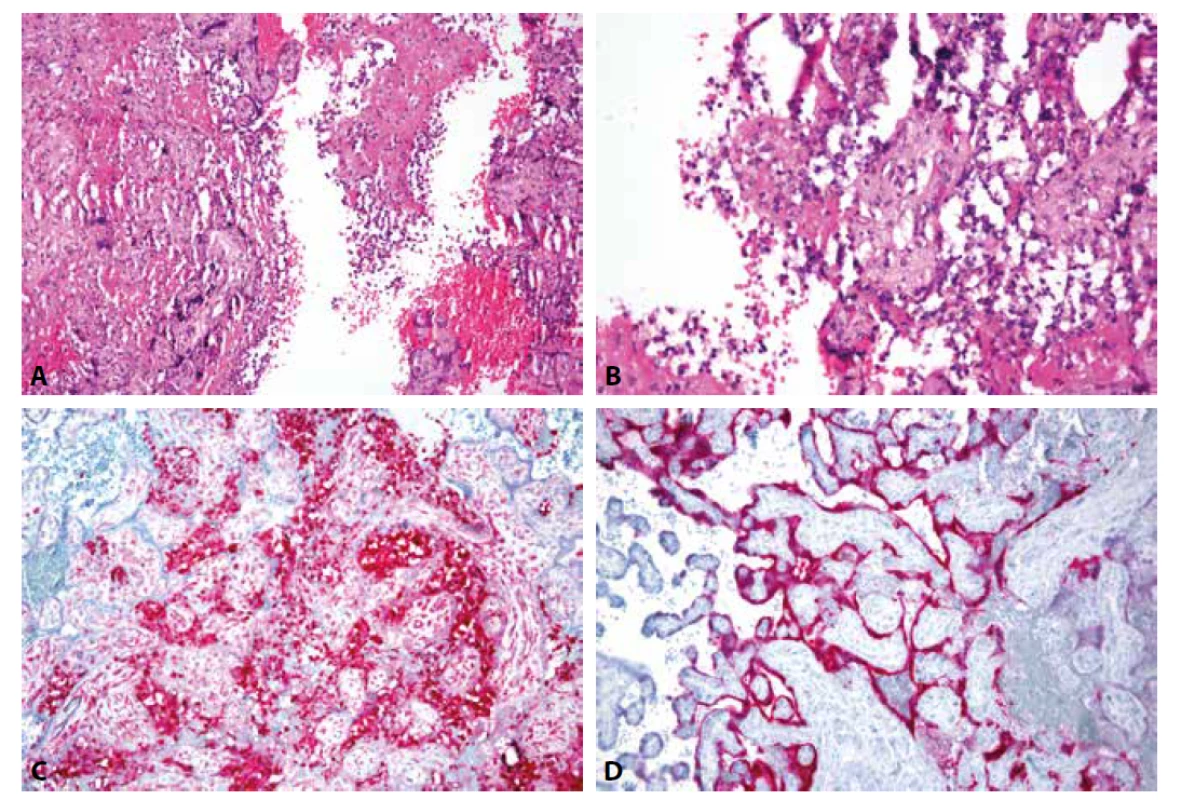
Patogeneze SARS-CoV-2 placentitidy je předmětem zkoumání. Předpokládá se, že alespoň částečnou úlohu by mohl sehrávat komplement (51). Nové publikace tuto hypotézu dokládají průkazem zvýšené akumulace C4d na povrchu vilózního trofoblastu. Je možné, že vazba virových proteinů na povrch vilózního trofoblastu by mohla vést k aktivaci komplementu a tím přispívat k jeho destrukci. Silný chemotaktický účinek komplementu by pak mohl vysvětlovat přítomnost histiocytů v intervilózních prostorách a lokální působení prozánětlivých cytokinů by mohlo mít vliv na zvýšené ukládání perivilózního fibrinoidu (11,52).
Přesto, že některé publikace dospěly k závěru, že chronická intervilositida společně s nekrózami vilózního trofoblastu představují zvýšené riziko přenosu infekce z matky na plod (15), dosud nebylo toto tvrzení dalšími studiemi jednoznačně potvrzeno. Mechanismus transplacentárního přenosu infekce zůstává prozatím neobjasněn.
Otázkou rovněž zůstává, jaký bude mít kongenitální infekce, ale i SASR-CoV-2 placentitida vliv na postnatální vývoj a klinický stav novorozence. Při znalosti možných následků zánětlivých lézí doprovázených zvýšeným ukládáním perivilózního fibrinoidu lze vyslovit podezření, že i v tomto případě by mohlo docházet k poruchám neurologického vývoje.
ZÁVĚR
Maternální infekce SARS-CoV-2 může být příčinou závažných fetálních a neonatálních komplikací, které vyplývají zejména z poškození placentárního parenchymu. Nově byla definována tzv. SARS-CoV-2 placentitida, která je charakterizována triádou histopatologických změn – chronickou histiocytární intervilositidou, nekrózou vilózního trofoblastu a nadměrným ukládáním perivilózního fibrinoidu. Diferenciálně diagnosticky je nutné odlišit SARS-CoV-2 placentitidu od chronické histiocytární intervilositidy neinfekční etiologie, zejména proto, že u druhé jmenované jednotky hrozí riziko rekurence. Přítomnost viru v placentární tkáni je možné potvrdit imunohistochemicky či molekulárně geneticky. Je třeba zdůraznit, že infekce placenty není synonymem pro infekci plodu a že obávaný intrauterinní přenos infekce z matky na plod je spíše vzácností.
Budoucí studie jistě přinesou řadu dalších zajímavých informací, které doplní celkový pohled na problematiku infekce SARS-CoV-2 v graviditě.
PODĚKOVÁNÍ
Práce byla podpořena grantem MŠMT SVV-2021-22 639.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
MUDr. Magdaléna Daumová, Ph.D.
Šiklův ústav patologie LFP UK a FN Plzeň
Edvarda Beneše 1128/13, 305 99 Plzeň
tel.: 377 402 089
e-mail: daumovam@fnplzen.cz
Zdroje
1. Zhu N, Zhang D, Wang W, et al. A Novel Coronavirus from Patients with Pneumonia in China, 2019. N Engl J Med 2020; 382(8): 727 - 733.
2. Coronaviridae Study Group of the International Committee on Taxonomy of V. The species Severe acute respiratory syndrome - related coronavirus: classifying 2019 - nCoV and naming it SARS-CoV-2. Nat Microbiol 2020; 5(4): 536-544.
3. Harrison AG, Lin T, Wang P. Mechanisms of SARS-CoV-2 Transmission and Pathogenesis. Trends Immunol 2020; 41(12): 1100-1115.
4. Zaim S, Chong JH, Sankaranarayanan V, Harky A. COVID-19 and Multiorgan Response. Curr Probl Cardiol 2020; 45(8): 100618.
5. Gupta A, Madhavan MV, Sehgal K, et al. Extrapulmonary manifestations of COVID-19. Nat Med 2020; 26(7): 1017-1032.
6. Liu Z, Xiao X, Wei X, et al. Composition and divergence of coronavirus spike proteins and host ACE2 receptors predict potential intermediate hosts of SARS-CoV-2. J Med Virol 2020; 92(6): 595-601.
7. Li M, Chen L, Zhang J, Xiong C, Li X. The SARS-CoV-2 receptor ACE2 expression of maternal - fetal interface and fetal organs by single - cell transcriptome study. PloS one 2020; 15(4): e0230295.
8. Valdes G, Neves LA, Anton L, et al. Distribution of angiotensin-(1-7) and ACE2 in human placentas of normal and pathological pregnancies. Placenta 2006; 27(2-3): 200-207.
9. Pringle KG, Tadros MA, Callister RJ, Lumbers ER. The expression and localization of the human placental prorenin/renin-angiotensin system throughout pregnancy: roles in trophoblast invasion and angiogenesis? Placenta 2011; 32(12): 956-962.
10. Taglauer E, Benarroch Y, Rop K, et al. Consistent localization of SARS-CoV-2 spike glycoprotein and ACE2 over TMPRSS2 predominance in placental villi of 15 COVID-19 positive maternal - fetal dyads. Placenta 2020; 100): 69-74.
11. Watkins JC, Torous VF, Roberts DJ. Defining Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) Placentitis: A Report of 7 Cases with Confirmatory In Situ Hybridization, Distinct Histomorphologic Features, and Evidence of Complement Deposition. Arch Pathol Lab Med 2021. ahead of print
12. Hosier H, Farhadian SF, Morotti RA, et al. SARS-CoV-2 infection of the placenta. J Clin Invest 2020; 130(9): 4947-4953.
13. Richtmann R, Torloni MR, Oyamada Otani AR, et al. Fetal deaths in pregnancies with SARS-CoV-2 infection in Brazil: A case series. Case Rep. Women’s Health 2020; 27: e00243.
14. Juan J, Gil MM, Rong Z, Zhang Y, Yang H, Poon LC. Effect of coronavirus disease 2019 (COVID-19) on maternal, perinatal and neonatal outcome: systematic review. Ultrasound Obstet Gynecol 2020; 56(1): 15-27.
15. Schwartz DA, Baldewijns M, Benachi A, et al. Chronic Histiocytic Intervillositis With Trophoblast Necrosis Is a Risk Factor Associated With Placental Infection From Coronavirus Disease 2019 (COVID-19) and Intrauterine Maternal-Fetal Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) Transmission in Live-Born and Stillborn Infants. Arch Pathol Lab Med 2021; 145(5): 517-528.
16. Shende P, Gaikwad P, Gandhewar M, et al. Persistence of SARS-CoV-2 in the first trimester placenta leading to transplacental transmission and fetal demise from an asymptomatic mother. Hum Reprod 2021; 36(4): 899-906.
17. Valdespino-Vazquez MY, Helguera-Repetto CA, Leon-Juarez M, et al. Fetal and placental infection with SARS-CoV-2 in early pregnancy. J Med Virol 2021; 93(7): 4480-4487.
18. Baergen RN, Heller DS. Placental Pathology in Covid-19 Positive Mothers: Preliminary Findings. Pediatr Dev Pathol 2020; 23(3): 177 - 180.
19. Shanes ED, Mithal LB, Otero S, Azad HA, Miller ES, Goldstein JA. Placental Pathology in COVID-19. Am J Clin Pathol 2020; 154(1): 23 - 32.
20. Smithgall MC, Liu-Jarin X, Hamele-Bena D, et al. Third-trimester placentas of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2)-positive women: histomorphology, including viral immunohistochemistry and in-situ hybridization. Histopathology 2020; 77(6): 994-999.
21. Kuhrt K, McMicking J, Nanda S, Nelson - Piercy C, Shennan A. Placental abruption in a twin pregnancy at 32 weeks’ gestation complicated by coronavirus disease 2019 without vertical transmission to the babies. Am J Obstet Gynecol MFM 2020; 2(3): 100135.
22. Hecht JL, Quade B, Deshpande V, et al. SARS-CoV-2 can infect the placenta and is not associated with specific placental histopathology: a series of 19 placentas from COVID-19-positive mothers. Mod Pathol 2020; 33(11): 2092-2103.
23. Zhang P, Salafia C, Heyman T, Salafia C, Lederman S, Dygulska B. Detection of severe acute respiratory syndrome coronavirus 2 in placentas with pathology and vertical transmission. Am J Obstet Gynecol MFM 2020; 2(4): 100197.
24. Facchetti F, Bugatti M, Drera E, et al. SARSCoV2 vertical transmission with adverse effects on the newborn revealed through integrated immunohistochemical, electron microscopy and molecular analyses of Placenta. EBioMedicine 2020; 59 : 102951.
25. Ferraiolo A, Barra F, Kratochwila C, et al. Report of Positive Placental Swabs for SARSCoV - 2 in an Asymptomatic Pregnant Woman with COVID-19. Medicina (Kaunas) 2020; 56(6).
26. Menter T, Mertz KD, Jiang S, et al. Placental Pathology Findings during and after SARSCoV - 2 Infection: Features of Villitis and Malperfusion. Pathobiology 2021; 88(1): 69-77.
27. Sisman J, Jaleel MA, Moreno W, et al. Intrauterine Transmission of SARS-COV-2 Infection in a Preterm Infant. Pediatr Infect Dis J 2020; 39(9): e265-e267.
28. Khong TY, Mooney EE, Ariel I, et al. Sampling and Definitions of Placental Lesions: Amsterdam Placental Workshop Group Consensus Statement. Arch Pathol Lab Med 2016; 140(7): 698-713.
29. Ernst LM. Maternal vascular malperfusion of the placental bed. APMIS 2018; 126(7): 551 - 560.
30. Redline RW, Ravishankar S. Fetal vascular malperfusion, an update. APMIS 2018; 126(7): 561-569.
31. Wong YP, Khong TY, Tan GC. The Effects of COVID-19 on Placenta and Pregnancy: What Do We Know So Far? Diagnostics 2021; 11(1).
32. Sharps MC, Hayes DJL, Lee S, et al. A structured review of placental morphology and histopathological lesions associated with SARS - -CoV-2 infection. Placenta 2020; 101 : 13-29.
33. Connors JM, Levy JH. COVID-19 and its implications for thrombosis and anticoagulation. Blood 2020; 135(23): 2033-2040.
34. Ashary N, Bhide A, Chakraborty P, et al. Single - Cell RNA-seq Identifies Cell Subsets in Human Placenta That Highly Expresses Factors Driving Pathogenesis of SARS-CoV-2. Front Cell Dev Biol 2020; 8 : 783.
35. Scifres CM, Parks WT, Feghali M, Caritis SN, Catov JM. Placental maternal vascular malperfusion and adverse pregnancy outcomes in gestational diabetes mellitus. Placenta 2017; 49 : 10-15.
36. Algeri P, Stagnati V, Spazzini MD, et al. Considerations on COVID-19 pregnancy: a cases series during outbreak in Bergamo Province, North Italy. J Maternal Fetal Neonatal Med 2020 : 1-4.
37. Lokken EM, Walker CL, Delaney S, et al. Clinical characteristics of 46 pregnant women with a severe acute respiratory syndrome coronavirus 2 infection in Washington State. Am J Obstet Gynecol 2020; 223(6): 911 e911 - 911 e914.
38. Prabhu M, Cagino K, Matthews KC, et al. Pregnancy and postpartum outcomes in a universally tested population for SARSCoV - 2 in New York City: a prospective cohort study. BJOG 2020; 127(12): 1548-1556.
39. Hsu AL, Guan M, Johannesen E, et al. Placental SARS-CoV-2 in a pregnant woman with mild COVID-19 disease. J Med Virol 2021; 93(2): 1038-1044.
40. Kirtsman M, Diambomba Y, Poutanen SM, et al. Probable congenital SARS-CoV-2 infection in a neonate born to a woman with active SARS-CoV-2 infection. CMAJ 2020; 192(24): E647-E650.
41. Mongula JE, Frenken MWE, van Lijnschoten G, et al. COVID-19 during pregnancy: non-reassuring fetal heart rate, placental pathology and coagulopathy. Ultrasound Obstet Gynecol 2020; 56(5): 773-776.
42. Patane L, Morotti D, Giunta MR, et al. Vertical transmission of coronavirus disease 2019: severe acute respiratory syndrome coronavirus 2 RNA on the fetal side of the placenta in pregnancies with coronavirus disease 2019-positive mothers and neonates at birth. Am J Obstet Gynecol MFM 2020; 2(3): 100145.
43. Pulinx B, Kieffer D, Michiels I, et al. Vertical transmission of SARS-CoV-2 infection and preterm birth. Eur J Clin Microbiol Infect Dis 2020; 39(12): 2441-2445.
44. Debelenko L, Katsyv I, Chong AM, Peruyero L, Szabolcs M, Uhlemann AC. Trophoblast damage with acute and chronic intervillositis: disruption of the placental barrier by severe acute respiratory syndrome coronavirus 2. Hum Pathol 2021; 109 : 69-79.
45. Vivanti AJ, Vauloup-Fellous C, Prevot S, et al. Transplacental transmission of SARSCoV - 2 infection. Nat Commun 2020; 11(1): 3572.
46. Gao L, Ren J, Xu L, et al. Placental pathology of the third trimester pregnant women from COVID-19. Diagn Pathol 2021; 16(1): 8.
47. Linehan L, O’Donoghue K, Dineen S, White J, Higgins JR, Fitzgerald B. SARS-CoV-2 placentitis: An uncommon complication of maternal COVID-19. Placenta 2021; 104 : 261 - 266.
48. Schwartz DA, Dhaliwal A. Infections in pregnancy with COVID-19 and other respiratory RNA virus diseases are rarely, if ever, transmitted to the fetus: Experiences with coronaviruses, HPIV, hMPV RSV, and influenza. Arch Pathol Lab Med 2020. ahead of print
49. Raschetti R, Vivanti AJ, Vauloup-Fellous C, Loi B, Benachi A, De Luca D. Synthesis and systematic review of reported neonatal SARSCoV - 2 infections. Nat Commun 2020; 11(1): 5164.
50. Wastnedge EAN, Reynolds RM, van Boeckel SR, et al. Pregnancy and COVID-19. Physiol Rev 2021; 101(1): 303-318.
51. Bendon RW, Coventry S, Thompson M, Rudzinski ER, Williams EM, Oron AP. Significance of C4d Immunostaining in Placental Chronic Intervillositis. Pediatr Dev Pathol 2015; 18(5): 362-368.
52. Libbrecht S, Van Cleemput J, Vandekerckhove L, et al. A rare but devastating cause of twin loss in a near-term pregnancy highlighting the features of severe SARS-CoV-2 placentitis. Histopathology 2021. Ahead of print
Štítky
Patológia Súdne lekárstvo Toxikológia
Článek 'NEUROPATOLOGIEČlánek 'HEPATOPATOLOGIEČlánek 'PULMOPATOLOGIEČlánek 'ORTOPEDICKÁ PATOLOGIEČlánek 'PATOLOGIE GITČlánek 'PATOLOGIE ORL OBLASTIČlánek 'GYNEKOPATOLOGIEČlánek 'UROPATOLOGIEČlánek 'KARDIOPATOLOGIEČlánek 'CYTODIAGNOSTIKAČlánek 'HEMATOPATOLOGIEČlánek Pathologia mutansČlánek Jaká je vaše diagnóza?
Článok vyšiel v časopiseČesko-slovenská patologie

2021 Číslo 4-
Všetky články tohto čísla
- Patologie placenty – nové a méně známé jednotky
- Placenta je tichým svědkem gravidity, jen je potřeba ho donutit mluvit
- 'NEUROPATOLOGIE
- 'HEPATOPATOLOGIE
- 'PULMOPATOLOGIE
- 'ORTOPEDICKÁ PATOLOGIE
- 'PATOLOGIE GIT
- 'PATOLOGIE ORL OBLASTI
- 'GYNEKOPATOLOGIE
- 'UROPATOLOGIE
- 'KARDIOPATOLOGIE
- 'CYTODIAGNOSTIKA
- Morfologické nálezy v placentě asociované s infekcí SARS-CoV-2
- Placentární mezenchymální dysplázie – morfologie a diferenciální diagnostika
- Chronické záněty placenty neinfekční etiologie
- Non-immune hydrops fetalis associated with two umbilical cord hemangiomas and vascular malformation of the transverse mesocolon. Case report
- 'HEMATOPATOLOGIE
- Subcutaneous symplastic haemangioma after radiotherapy: A case report
- Pathologia mutans
- Jaká je vaše diagnóza?
- Profesor Jaroslav Hlava a jeho následníci – vzpomínka u příležitosti 100. výročí otevření Hlavova ústavu
- Hlavův ústav slaví stoleté výročí založení
- Jaká je vaše diagnóza? Odpověď: Karcinom prsu metastazující do placenty
- Prof. MUDr. František Fakan, CSc. in memoriam
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Chronické záněty placenty neinfekční etiologie
- Morfologické nálezy v placentě asociované s infekcí SARS-CoV-2
- Patologie placenty – nové a méně známé jednotky
- Placentární mezenchymální dysplázie – morfologie a diferenciální diagnostika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



